У пациентов с наличием пародонтальных патологий величина альвеолярного гребня в дистальных участках может быть критически минимальной, что ограничивает возможности для установки дентальных имплантатов по причине близости дна гайморовой пазухи. И хотя процедуры аугментации с формированием субантрального или латерального окна обеспечивают достаточный уровень эффективности, но параллельно они чреваты своими потенциальными осложнениями. Наиболее распространённым из таких является перфорация Шнайдеровой мембраны, которая случается в 14-52% операций. Курение и сложное строение синуса являются факторами риска повреждения слизистой оболочки дна пазухи. Лечение подобного осложнения проводится с использованием резорбируемых мембран, а профилактика – посредством применения возможностей пьезохирургии и предварительного планирования всех этапов хирургической манипуляции.
Клинический случай
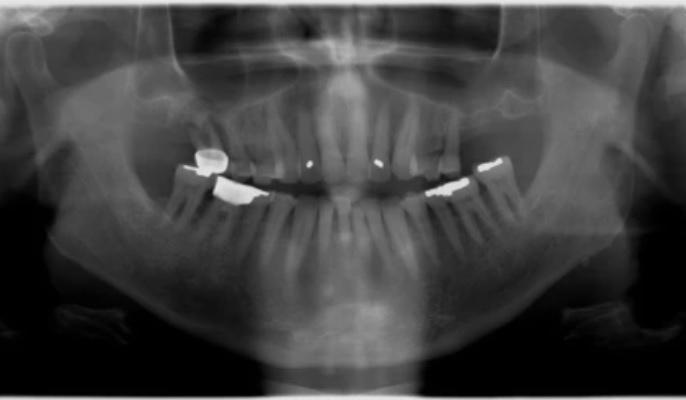
65-летний мужчина, который находился на пенсии, обратился за помощью в стоматологический центр Western University of Health Sciences после консультации у частнопрактикующего пародонтолога с целью установки дентальных имплантатов. Соматический анамнез пациента не был отягощен, аллергий в истории болезни не наблюдалось. Однако пациент постоянно выкуривал приблизительно 40 упаковок сигарет за год. В ходе клинического осмотра не было обнаружено ни признаков кариеса, ни симптомов воспаления слизистой, кроме пародонтально-эндодонтической патологии в области 3 зуба и локализированного пародонтита тяжелой формы в области 30-31 зубов, поражающего даже область фуркации. 18 зуб выступал за границу окклюзионной плоскости, а на нижних резцах были отмечены области абфракции с вестибулярной стороны (фото 1).
Фото 1. Панорамная рентгенограмма, выполненная при первичном осмотре: значительная потеря костной ткани, суперпрорезывание моляров и поражение области фуркации.
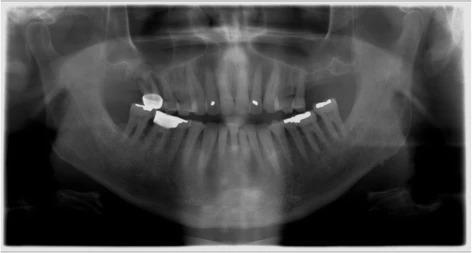
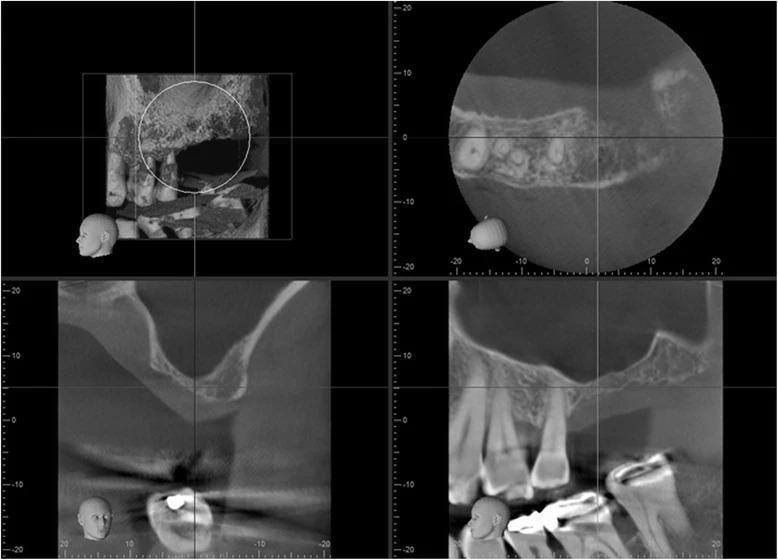
В качестве первичного лечения провели экстракции 3, 30 и 31 зубов, а лунку в области 30 зуба аугментировали посредством кортикального гранулированного трансплантата. В ходе заживления удалось сохранить кость в области 30 зуба, но над областью 3 зуба наблюдался острый костный дефицит (фото 2). С левой стороны аналогичный дефицит костной ткани наблюдался в области 14 зуба (фото 3). Учитывая хорошее общее состояние здоровья пациента, продолжение воздержания от курения, адекватные параметры слизистой после первичного лечения и несложную анатомическую структуру гайморовых пазух, было принято решение провести аугментацию через латеральное окно. После полной консультации с объяснением всех рисков и преимуществ подобного подхода пациент согласился на проведение данной манипуляции.
Фото 2. Правый синус перед началом аугментации: дефицит высоты резидуального гребня в области 3 зуба.
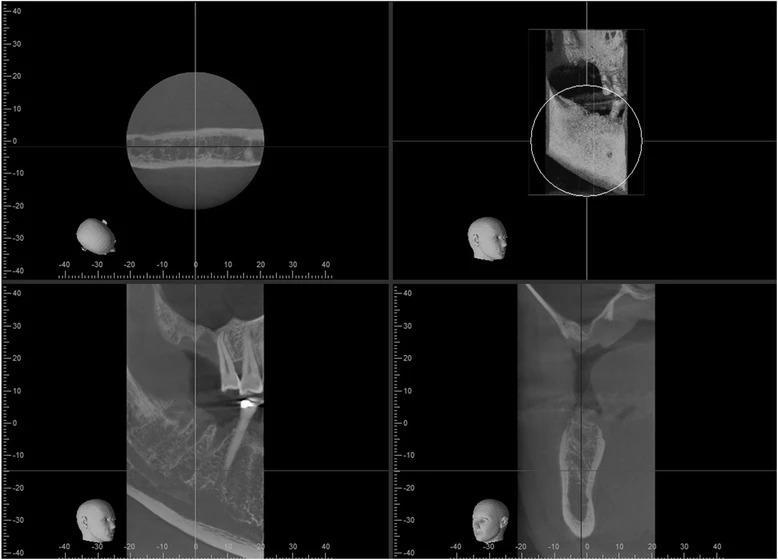
Фото 3. Левый синус перед началом аугментации: дефицит высоты резидуального гребня в области 14 зуба.
Все последующие хирургические вмешательства проводились под местной анестезией. Пациент принимал одну таблетку триазолана (0,25 мг) вечером и днем перед операцией, а также ибупрофен 600 мг и амоксициллин 250 мг каждые 6 ч. в течение 1 недели, начиная курс за день до вмешательства. Начиная со второго дня после операции, пациенту было назначено полоскание полости рта дважды в день 0,5 унцией хлоргексидина глюконата в течение 30 с после гигиены. Через 7 дней после каждого оперативного вмешательства пациента осматривали повторно. Аугментации в области дна пазух проводились через латеральное окно с каждой стороны с перерывом в 3 месяца между таковыми по методу Tatum (1974). Сначала проводили срединный разрез по резидуальному гребню с формированием послабляющих надрезов со щечной стороны, после чего обнажали Шнайдеровую мембрану через остеотомичный канал, сформированный пьезотомом на 15 мм в диаметре (Piezotome 2, Acteon North America и Mount Laurel, NJ, США). После этого аккуратно сепарировали слизистую пазухи от костного дна с использованием грибовидной насадки (набор для вмешательств в области пазухи Acteon North America, Mount Laurel, NJ, США) и специальной кюретки Sinus (набор для вмешательств в области пазухи ACE Surgical Supply, Brockton, MA, USA) до тех пор, пока не визуализировали нижние 15 мм медиальной стенки синуса. Во время выполнения обеих операций нами были замечены небольшие разрывы слизистой дна пазухи, не превышающие 5 мм, в средней части мобилизованной Шнайдеровой мембраны. Восстановление таковых проводили посредством двойного слоя коллагеновой ленты размером 2 см × 2 см × 1,5 мм (RCT, контурированный по форме, ACE Surgical Supply, Brockton, MA, USA). После установки мембран между ними и костным дном пазухи засыпали смесь кортикального и губчатого аллотрансплантата (AlloOss, ACE Surgical Supply, Brockton, MA, USA) и ксенотрансплантата крупного рогатого скота (NuOss, ACE Surgical Supply, Brockton, MA, США) в пропорции 1:1. После этого сформированные окна доступа дополнительно закрывали резорбируемой коллагеновой мембраной (ConFORM, ACE Surgical, Brockton, MA, США), как ранее было предложено Wallace and Froum, а область вмешательства ушивали непрерывными швами (PTFE 3-0, Cytoplast, Osteogenics, Lubbock, TX, США). Никаких осложнений пациентами не отмечалось, а смесь костного заменителя оставили для ремоделирования костной ткани на период 10-12 месяцев. Год спустя провели КЛКТ-сканирование обоих участков аугментации: с правой стороны формирование костной ткани наблюдалось дистальнее желаемого участка имплантации (фото 4), а на месте перспективной установки титановых опор наблюдалось овальное расширение пазухи; с левой стороны было отмечено пальцевидное расширение синуса между аугментированным участком кости и медиальной стенкой пазухи (фото 5). После консультации пациента относительно полученных результатов было принято решение провести дополнительную процедуру аугментации
Фото 4. КЛКТ-срезы правой пазухи через 12 месяцев после первой аугментации: дефицит кости в области предполагаемой имплантации, формирование костной ткани дистальнее интересующего участка. Для лучшей визуализации в структуру трансплантата в ходе аугментации были добавлены рентгеноконтрастные частицы гидроксиапатита.
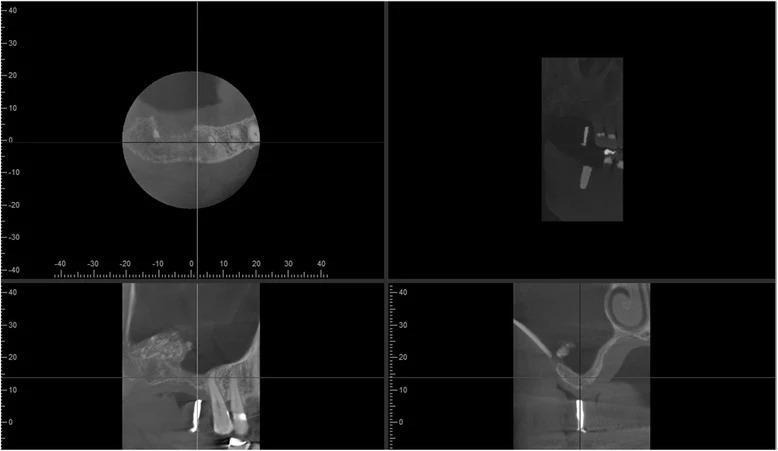
Фото 5. КЛКТ-срезы левой пазухи через 12 месяцев после первой аугментации: изменение анатомии синуса после аугментации, пальцевидное расширение синуса в области аугментации, визуализация аугментированных участков вокруг расширения пазухи.
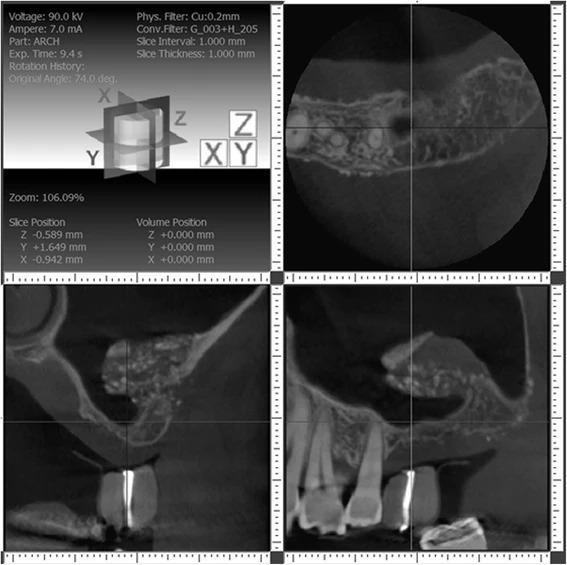
С правой стороны было решено провести аугментации, используя баллонирующую технику через субантральный доступ, поскольку область дефицита кости имела почти сферическую форму и находилась приблизительно по центру участка 3 зуба. Одновременно планировалось провести имплантацию, поскольку наличие 5 мм кости в данном участке позволило бы обеспечить надлежащую первичную стабильность инфраконструкции. Кроме того, подобный подход был ранее рекомендован Pjetursson и Lang. Доступ был создан по методике Tatum, которую позже более детально описал Misch, а сама аугментация проводилась по баллонирующему алгоритму, предложенному Muronoi и коллегами (фото 6 – процедура, фото 7 – схематическое изображение).
Фото 6. Процедура баллонирующей дилатации в области правого синуса:
а) вид после выполнения инфильтрационной анестезии;
b) полнотканный разрез посредине костного гребня;
c) остеотомия;
d,e) дилататор, который наполняется физиологическим раствором;
f) введение дилататора;
g) наполнение баллона дилататора;
h) подготовка аллотрансплантата и коллагеновой ленты;
i) визуализация коллагеновой ленты на дне области остеотомии после наполнения участка костным заменителем;
j) установка имплантата;
k) ушивание раны;
i) рентгенограмма после вмешательства.
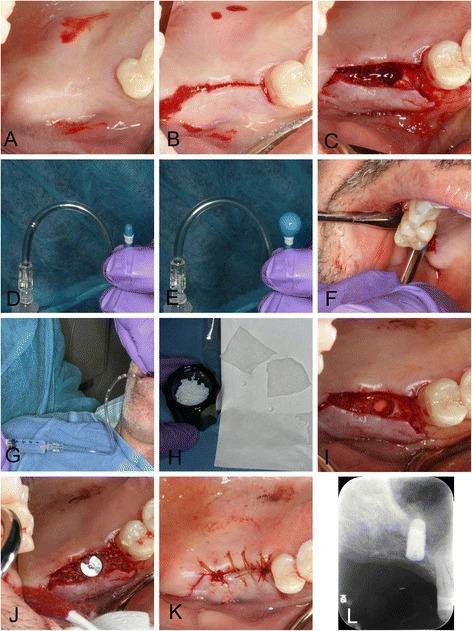
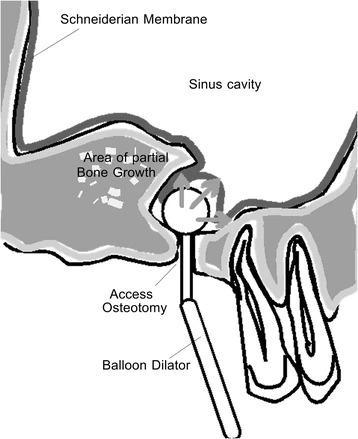
Фото 7. Схематическое изображение процедуры баллонирующей дилатации.
В ходе вмешательства был сформирован слизисто-периостальный лоскут с дополнительными щечными послабляющими разрезами (фото 6а, b), после чего остеотомию проводили с использованием специальных сверл (фото 6c; имплантологический набор Zimmer implant surgical kit, Zimmer, Carlsbad, CA, USA). Поскольку ширина гребня была достаточной, а кость – плотной, было решено не применять технику Summer, а вместо этого проводить остеотомию до конечной ширины, немного уменьшая ее размер для имплантатов 4,7 мм в диаметре. Такой подход помогает без проблем ввести баллонирующий элемент для поднятия слизистой дна пазухи (Osseous Technologies of America, Hamburg, NY, США). Препарирование кости завершили за 1 мм до дна синуса, а перед баллонизацией мембраны провели ее легкую сепарацию используя остеотомы с плоской рабочей поверхностью (ACE Surgical Supply, Brockton, MA, США). Поднятие дна пазухи с помощью остетомов проводилось последовательно для аккуратного передвижения слизистой миллиметр за миллиметром. Целостность мембраны Шнайдера проверяли при помощи зонда ВОЗ, после чего вводили дилататор (фото 6d-g). Последний наполняли физиологическим раствором, затем устанавливали два слоя резорбируемой коллагеновой ленты, аллотрансплантат, и в конце – дентальный имплантат размером 4,7 × 10 мм (фото. 6h-j, Tapered Screw-Vent TSVWB10, Zimmer, Carlsbad, CA, США). Первичная стабильность титановой опоры превышала 30 Нсм. После установки заглушки адаптировали лоскут и область вмешательства ушили посредством непрерывных хромированных кетгутовых швов 4-0 (фото 6k). На послеоперационной рентгенограмме было подтверждено адекватное позиционирование имплантата, и наличие костного трансплантата вокруг инфраконструкции (фото 6I). На протяжении нескольких последующих дней наблюдались незначительные болевые ощущения, однако после этого заживление проходило без осложнений. Через 12 месяцев имплантат демонстрировал полную успешность.
С левой стороны планировалось обеспечить доступ через латеральное окно, поскольку область дефицита костной ткани была не только больше, но и сложнее по форме. Данное окно было сформировано в области неба, поскольку дефект был наиболее явным именно на данном участке. Кроме того, в ходе первой операции мы уже смогли оценить состояние нижней медиальной стенки синуса, а КЛКТ-срезы только подтвердили отсутствие каких-либо магистральных сосудов в данной области. Учитывая данную специфику и результаты прежних исследований, посвященных данному вопросу (фото 8, работы Bailey и коллег), мы пришли к выводу, что данный алгоритм не несет никаких дополнительных рисков и является наиболее адаптированным для данной ситуации.
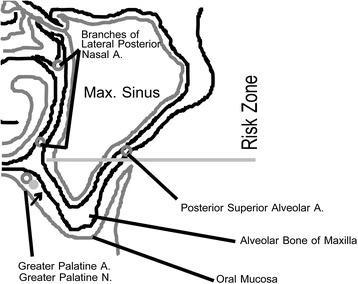
Фото 8. Кровоснабжение синуса. Область перехода твердого нёба в альвеолярный гребень в задней части верхней челюсти является локализацией большого палатинального нейроваскулярного пучка (данный участок можно пропальпировать, а также визуализировать на КЛКТ-срезах).
Операция проходила по классическому алгоритму лишь с учетом хода магистрального палатинального сосудисто-нервного пучка (фото 9). После сепарации лоскута (фото 10а, b), с помощью пьезотома (Piezotome 2, Acteon North America, Mount Laurel, NJ, USA) сформировали прямоугольное окно над областью костного дефекта (фото 10c). Используя пьезохирургические насадки и гидравлическое давление (IntraLift Kit, Acteon North America, Mount Laurel, NJ, USA) удалось аккуратно отсепарировать Шнайдеровую мембрану (фото 10d-f). В данной части гребня устанавливали аналогичный имплантат размером 4,7 мм × 10 мм (фото 10f, Tapered Screw Vent TSWB10, Zimmer, Carlsbad, CA, США), достигая величины торка более 30 Нсм. Над обнаженной слизистой пазухи помещали резорбируемую коллагеновую ленту, а также аллотрансплантат из кортикальных частиц (LifeNet Health, Virginia Beach, WA, США), который также покрывали коллагеновой мембраной (ConFORM, ACE Surgical Supply, Brockton, MA , США) над небным окном доступа (фото 10g-i). Имплантат и трансплантат перекрывали палатинальным лоскутом и ушивали непрерывными и горизонтальными матрацными PTFE-швами 3-0 (Cytoplast, Osteogenics Biomedical, Lubbock, TX, USA). На рентгенограмме удалось подтвердить адекватное позиционирование трансплантата (фото 10k).
Фото 9. Схематическое изображение палатинального доступа. Латеральное окно огибает область прежней аугментации, а также места прохождения большого палатинального нейрососудистого пучка.
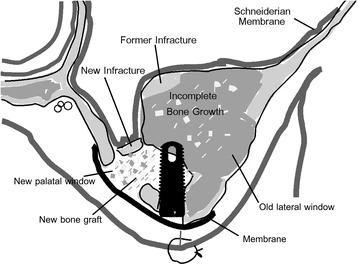
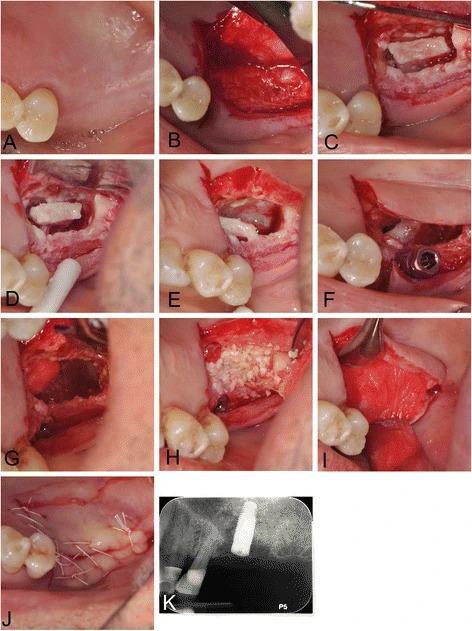
Фото 10. Аугментация в области синуса:
a) вид перед проведением инфильтрационной анестезии;
b) проведение полнотканного разреза по середине костного гребня с формированием послабляющего разреза на небной стороне и сепарацией лоскута;
c) формирование окна при помощи пьезотома;
d-e) мобилизация мембраны посредством гидравлического давления; низлежащая костная ткань служит ложем для заполнения полости трансплантатом;
f) установка имплантата;
g) перекрытие обнаженных участков слизистой посредством коллагеновой ленты;
h) установка гранулированного минерализованного аллотрансплантата;
i) установка резорбируемой коллагеновой мембраны в области окна доступа;
j) ушитые области вмешательства;
k) рентгенограмма после вмешательства.
Важно ограничить вмешательство в данной области, поскольку ветви боковых задних носовых артерий могут доходить до данного участка. Травмирование этих кровеносных сосудов может привести к значительному синусовому кровотечению, которое трудно остановить без проведения тампонады пазухи. Часто на КЛКТ-срезах можно увидеть небольшой кровеносный канал посредине латеральной стенки пазухи, в котором, скорее всего, проходит задняя верхняя альвеолярная вена и артерия. На КЛКТ мы видим небольшой канал кровеносного сосуда в середине боковой стенки синуса, который, вероятно, является задней верхней альвеолярной артерией и веной. Данная зона тоже является зоной риска: можно проводить аугментацию выше данной области, но не рисковать опускаться ниже таковой.
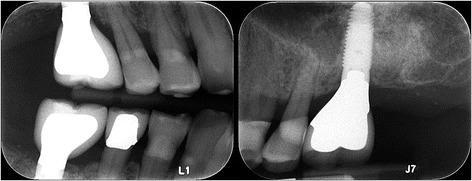
Пациент отмечал незначительный дискомфорт на протяжении первой недели после вмешательства, но кроме этого больше никаких осложнений не наблюдалось. Через 12 месяцев после открытия области операции было подтверждено успешную интеграцию имплантата. Третий имплантат был установлен на месте 30 зуба, а 18 зуб, который характеризовался чрезмерным прорезыванием, удалили. Фаза протезирования также прошла без каких-либо осложнений (фото 11). Поскольку пациенту постоянно проводилась поддерживающая пародонтальная терапия, через 3 года после установки интраосслаьных опор патологической потери костной ткани в их области не наблюдалось (фото 12). Глубина зондирования вокруг имплантатов не превышала 2-4 мм без признаков кровотечения.
Фото 11. Рентгенограмма с супраконструкциями на имплантатах.
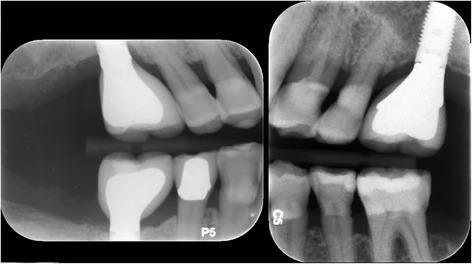
Фото 12. Рентгенографический контроль уровень кости через три года после установки имплантатов.
Выводы
Можно сделать вывод, что проблема неадекватного формирования костной ткани после аугментации в области синуса, может быть решена за счет повторного вмешательства, обходя прежние участки операционного доступа. Подобный подход обеспечивает долгосрочную успешность имплантатов, установленных в области реконструкции резидуального гребня верхней челюсти.
Автор: Tobias K. Boehm
Производители:
У пациентов с наличием пародонтальных патологий величина альвеолярного гребня в дистальных участках может быть критически минимальной, что ограничивает возможности для установки дентальных имплантатов по причине близости дна гайморовой пазухи. И хотя процедуры аугментации с формированием субантрального или латерального окна обеспечивают достаточный уровень эффективности, но параллельно они чреваты своими потенциальными осложнениями. Наиболее распространённым из таких является перфорация Шнайдеровой мембраны, которая случается в 14-52% операций. Курение и сложное строение синуса являются факторами риска повреждения слизистой оболочки дна пазухи. Лечение подобного осложнения проводится с использованием резорбируемых мембран, а профилактика – посредством применения возможностей пьезохирургии и предварительного планирования всех этапов хирургической манипуляции.

Клинический случай
65-летний мужчина, который находился на пенсии, обратился за помощью в стоматологический центр Western University of Health Sciences после консультации у частнопрактикующего пародонтолога с целью установки дентальных имплантатов. Соматический анамнез пациента не был отягощен, аллергий в истории болезни не наблюдалось. Однако пациент постоянно выкуривал приблизительно 40 упаковок сигарет за год. В ходе клинического осмотра не было обнаружено ни признаков кариеса, ни симптомов воспаления слизистой, кроме пародонтально-эндодонтической патологии в области 3 зуба и локализированного пародонтита тяжелой формы в области 30-31 зубов, поражающего даже область фуркации. 18 зуб выступал за границу окклюзионной плоскости, а на нижних резцах были отмечены области абфракции с вестибулярной стороны (фото 1).
Фото 1. Панорамная рентгенограмма, выполненная при первичном осмотре: значительная потеря костной ткани, суперпрорезывание моляров и поражение области фуркации.

В качестве первичного лечения провели экстракции 3, 30 и 31 зубов, а лунку в области 30 зуба аугментировали посредством кортикального гранулированного трансплантата. В ходе заживления удалось сохранить кость в области 30 зуба, но над областью 3 зуба наблюдался острый костный дефицит (фото 2). С левой стороны аналогичный дефицит костной ткани наблюдался в области 14 зуба (фото 3). Учитывая хорошее общее состояние здоровья пациента, продолжение воздержания от курения, адекватные параметры слизистой после первичного лечения и несложную анатомическую структуру гайморовых пазух, было принято решение провести аугментацию через латеральное окно. После полной консультации с объяснением всех рисков и преимуществ подобного подхода пациент согласился на проведение данной манипуляции.
Фото 2. Правый синус перед началом аугментации: дефицит высоты резидуального гребня в области 3 зуба.

Фото 3. Левый синус перед началом аугментации: дефицит высоты резидуального гребня в области 14 зуба.

Все последующие хирургические вмешательства проводились под местной анестезией. Пациент принимал одну таблетку триазолана (0,25 мг) вечером и днем перед операцией, а также ибупрофен 600 мг и амоксициллин 250 мг каждые 6 ч. в течение 1 недели, начиная курс за день до вмешательства. Начиная со второго дня после операции, пациенту было назначено полоскание полости рта дважды в день 0,5 унцией хлоргексидина глюконата в течение 30 с после гигиены. Через 7 дней после каждого оперативного вмешательства пациента осматривали повторно. Аугментации в области дна пазух проводились через латеральное окно с каждой стороны с перерывом в 3 месяца между таковыми по методу Tatum (1974). Сначала проводили срединный разрез по резидуальному гребню с формированием послабляющих надрезов со щечной стороны, после чего обнажали Шнайдеровую мембрану через остеотомичный канал, сформированный пьезотомом на 15 мм в диаметре (Piezotome 2, Acteon North America и Mount Laurel, NJ, США). После этого аккуратно сепарировали слизистую пазухи от костного дна с использованием грибовидной насадки (набор для вмешательств в области пазухи Acteon North America, Mount Laurel, NJ, США) и специальной кюретки Sinus (набор для вмешательств в области пазухи ACE Surgical Supply, Brockton, MA, USA) до тех пор, пока не визуализировали нижние 15 мм медиальной стенки синуса. Во время выполнения обеих операций нами были замечены небольшие разрывы слизистой дна пазухи, не превышающие 5 мм, в средней части мобилизованной Шнайдеровой мембраны. Восстановление таковых проводили посредством двойного слоя коллагеновой ленты размером 2 см × 2 см × 1,5 мм (RCT, контурированный по форме, ACE Surgical Supply, Brockton, MA, USA). После установки мембран между ними и костным дном пазухи засыпали смесь кортикального и губчатого аллотрансплантата (AlloOss, ACE Surgical Supply, Brockton, MA, USA) и ксенотрансплантата крупного рогатого скота (NuOss, ACE Surgical Supply, Brockton, MA, США) в пропорции 1:1. После этого сформированные окна доступа дополнительно закрывали резорбируемой коллагеновой мембраной (ConFORM, ACE Surgical, Brockton, MA, США), как ранее было предложено Wallace and Froum, а область вмешательства ушивали непрерывными швами (PTFE 3-0, Cytoplast, Osteogenics, Lubbock, TX, США). Никаких осложнений пациентами не отмечалось, а смесь костного заменителя оставили для ремоделирования костной ткани на период 10-12 месяцев. Год спустя провели КЛКТ-сканирование обоих участков аугментации: с правой стороны формирование костной ткани наблюдалось дистальнее желаемого участка имплантации (фото 4), а на месте перспективной установки титановых опор наблюдалось овальное расширение пазухи; с левой стороны было отмечено пальцевидное расширение синуса между аугментированным участком кости и медиальной стенкой пазухи (фото 5). После консультации пациента относительно полученных результатов было принято решение провести дополнительную процедуру аугментации
Фото 4. КЛКТ-срезы правой пазухи через 12 месяцев после первой аугментации: дефицит кости в области предполагаемой имплантации, формирование костной ткани дистальнее интересующего участка. Для лучшей визуализации в структуру трансплантата в ходе аугментации были добавлены рентгеноконтрастные частицы гидроксиапатита.

Фото 5. КЛКТ-срезы левой пазухи через 12 месяцев после первой аугментации: изменение анатомии синуса после аугментации, пальцевидное расширение синуса в области аугментации, визуализация аугментированных участков вокруг расширения пазухи.

С правой стороны было решено провести аугментации, используя баллонирующую технику через субантральный доступ, поскольку область дефицита кости имела почти сферическую форму и находилась приблизительно по центру участка 3 зуба. Одновременно планировалось провести имплантацию, поскольку наличие 5 мм кости в данном участке позволило бы обеспечить надлежащую первичную стабильность инфраконструкции. Кроме того, подобный подход был ранее рекомендован Pjetursson и Lang. Доступ был создан по методике Tatum, которую позже более детально описал Misch, а сама аугментация проводилась по баллонирующему алгоритму, предложенному Muronoi и коллегами (фото 6 – процедура, фото 7 – схематическое изображение).
Фото 6. Процедура баллонирующей дилатации в области правого синуса:
а) вид после выполнения инфильтрационной анестезии;
b) полнотканный разрез посредине костного гребня;
c) остеотомия;
d,e) дилататор, который наполняется физиологическим раствором;
f) введение дилататора;
g) наполнение баллона дилататора;
h) подготовка аллотрансплантата и коллагеновой ленты;
i) визуализация коллагеновой ленты на дне области остеотомии после наполнения участка костным заменителем;
j) установка имплантата;
k) ушивание раны;
i) рентгенограмма после вмешательства.

Фото 7. Схематическое изображение процедуры баллонирующей дилатации.

В ходе вмешательства был сформирован слизисто-периостальный лоскут с дополнительными щечными послабляющими разрезами (фото 6а, b), после чего остеотомию проводили с использованием специальных сверл (фото 6c; имплантологический набор Zimmer implant surgical kit, Zimmer, Carlsbad, CA, USA). Поскольку ширина гребня была достаточной, а кость – плотной, было решено не применять технику Summer, а вместо этого проводить остеотомию до конечной ширины, немного уменьшая ее размер для имплантатов 4,7 мм в диаметре. Такой подход помогает без проблем ввести баллонирующий элемент для поднятия слизистой дна пазухи (Osseous Technologies of America, Hamburg, NY, США). Препарирование кости завершили за 1 мм до дна синуса, а перед баллонизацией мембраны провели ее легкую сепарацию используя остеотомы с плоской рабочей поверхностью (ACE Surgical Supply, Brockton, MA, США). Поднятие дна пазухи с помощью остетомов проводилось последовательно для аккуратного передвижения слизистой миллиметр за миллиметром. Целостность мембраны Шнайдера проверяли при помощи зонда ВОЗ, после чего вводили дилататор (фото 6d-g). Последний наполняли физиологическим раствором, затем устанавливали два слоя резорбируемой коллагеновой ленты, аллотрансплантат, и в конце – дентальный имплантат размером 4,7 × 10 мм (фото. 6h-j, Tapered Screw-Vent TSVWB10, Zimmer, Carlsbad, CA, США). Первичная стабильность титановой опоры превышала 30 Нсм. После установки заглушки адаптировали лоскут и область вмешательства ушили посредством непрерывных хромированных кетгутовых швов 4-0 (фото 6k). На послеоперационной рентгенограмме было подтверждено адекватное позиционирование имплантата, и наличие костного трансплантата вокруг инфраконструкции (фото 6I). На протяжении нескольких последующих дней наблюдались незначительные болевые ощущения, однако после этого заживление проходило без осложнений. Через 12 месяцев имплантат демонстрировал полную успешность.
С левой стороны планировалось обеспечить доступ через латеральное окно, поскольку область дефицита костной ткани была не только больше, но и сложнее по форме. Данное окно было сформировано в области неба, поскольку дефект был наиболее явным именно на данном участке. Кроме того, в ходе первой операции мы уже смогли оценить состояние нижней медиальной стенки синуса, а КЛКТ-срезы только подтвердили отсутствие каких-либо магистральных сосудов в данной области. Учитывая данную специфику и результаты прежних исследований, посвященных данному вопросу (фото 8, работы Bailey и коллег), мы пришли к выводу, что данный алгоритм не несет никаких дополнительных рисков и является наиболее адаптированным для данной ситуации.
Фото 8. Кровоснабжение синуса. Область перехода твердого нёба в альвеолярный гребень в задней части верхней челюсти является локализацией большого палатинального нейроваскулярного пучка (данный участок можно пропальпировать, а также визуализировать на КЛКТ-срезах).

Операция проходила по классическому алгоритму лишь с учетом хода магистрального палатинального сосудисто-нервного пучка (фото 9). После сепарации лоскута (фото 10а, b), с помощью пьезотома (Piezotome 2, Acteon North America, Mount Laurel, NJ, USA) сформировали прямоугольное окно над областью костного дефекта (фото 10c). Используя пьезохирургические насадки и гидравлическое давление (IntraLift Kit, Acteon North America, Mount Laurel, NJ, USA) удалось аккуратно отсепарировать Шнайдеровую мембрану (фото 10d-f). В данной части гребня устанавливали аналогичный имплантат размером 4,7 мм × 10 мм (фото 10f, Tapered Screw Vent TSWB10, Zimmer, Carlsbad, CA, США), достигая величины торка более 30 Нсм. Над обнаженной слизистой пазухи помещали резорбируемую коллагеновую ленту, а также аллотрансплантат из кортикальных частиц (LifeNet Health, Virginia Beach, WA, США), который также покрывали коллагеновой мембраной (ConFORM, ACE Surgical Supply, Brockton, MA , США) над небным окном доступа (фото 10g-i). Имплантат и трансплантат перекрывали палатинальным лоскутом и ушивали непрерывными и горизонтальными матрацными PTFE-швами 3-0 (Cytoplast, Osteogenics Biomedical, Lubbock, TX, USA). На рентгенограмме удалось подтвердить адекватное позиционирование трансплантата (фото 10k).
Фото 9. Схематическое изображение палатинального доступа. Латеральное окно огибает область прежней аугментации, а также места прохождения большого палатинального нейрососудистого пучка.

Фото 10. Аугментация в области синуса:
a) вид перед проведением инфильтрационной анестезии;
b) проведение полнотканного разреза по середине костного гребня с формированием послабляющего разреза на небной стороне и сепарацией лоскута;
c) формирование окна при помощи пьезотома;
d-e) мобилизация мембраны посредством гидравлического давления; низлежащая костная ткань служит ложем для заполнения полости трансплантатом;
f) установка имплантата;
g) перекрытие обнаженных участков слизистой посредством коллагеновой ленты;
h) установка гранулированного минерализованного аллотрансплантата;
i) установка резорбируемой коллагеновой мембраны в области окна доступа;
j) ушитые области вмешательства;
k) рентгенограмма после вмешательства.

Важно ограничить вмешательство в данной области, поскольку ветви боковых задних носовых артерий могут доходить до данного участка. Травмирование этих кровеносных сосудов может привести к значительному синусовому кровотечению, которое трудно остановить без проведения тампонады пазухи. Часто на КЛКТ-срезах можно увидеть небольшой кровеносный канал посредине латеральной стенки пазухи, в котором, скорее всего, проходит задняя верхняя альвеолярная вена и артерия. На КЛКТ мы видим небольшой канал кровеносного сосуда в середине боковой стенки синуса, который, вероятно, является задней верхней альвеолярной артерией и веной. Данная зона тоже является зоной риска: можно проводить аугментацию выше данной области, но не рисковать опускаться ниже таковой.
Пациент отмечал незначительный дискомфорт на протяжении первой недели после вмешательства, но кроме этого больше никаких осложнений не наблюдалось. Через 12 месяцев после открытия области операции было подтверждено успешную интеграцию имплантата. Третий имплантат был установлен на месте 30 зуба, а 18 зуб, который характеризовался чрезмерным прорезыванием, удалили. Фаза протезирования также прошла без каких-либо осложнений (фото 11). Поскольку пациенту постоянно проводилась поддерживающая пародонтальная терапия, через 3 года после установки интраосслаьных опор патологической потери костной ткани в их области не наблюдалось (фото 12). Глубина зондирования вокруг имплантатов не превышала 2-4 мм без признаков кровотечения.
Фото 11. Рентгенограмма с супраконструкциями на имплантатах.

Фото 12. Рентгенографический контроль уровень кости через три года после установки имплантатов.

Выводы
Можно сделать вывод, что проблема неадекватного формирования костной ткани после аугментации в области синуса, может быть решена за счет повторного вмешательства, обходя прежние участки операционного доступа. Подобный подход обеспечивает долгосрочную успешность имплантатов, установленных в области реконструкции резидуального гребня верхней челюсти.
Автор: Tobias K. Boehm


























































































































































0 комментариев