В настоящее время в литературе предлагаются различные подходы к установке имплантатов в атрофированном боковом отделе верхней челюсти. Такие стратегии варьируются от использования блочного костного трансплантата, коротких, наклонных и скуловых имплантатов до синус-лифтинга (СЛ). СЛ зарекомендовал себя как предсказуемая хирургическая процедура для увеличения высоты кости в боковом отделе верхней челюсти. В данной статье представлен обзор методов СЛ, включая модифицированную технику локального управления дном пазухи в свежих гнездах после удаления моляров.
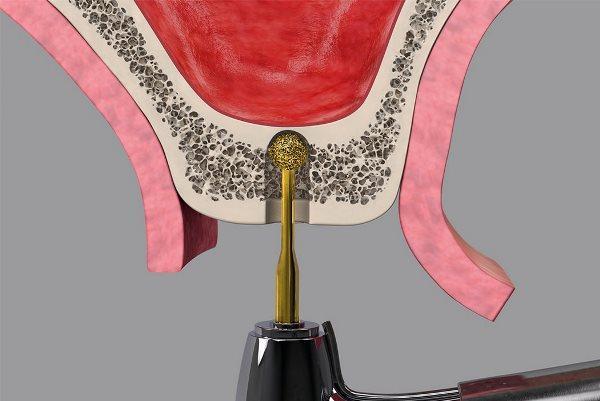
С клинической точки зрения пневматизация пазух вместе с резорбцией гребня могут уменьшить доступную высоту кости для будущей установки имплантатов. Кроме того, в боковом отделе верхней челюсти часто наблюдается более низкое качество кости, что может затруднить установку имплантатов. В настоящее время предлагается несколько стратегий установки имплантатов в атрофический боковой отдел верхней челюсти, включая блочную костную пластику, использование коротких, наклонных или скуловых имплантатов, а также синус-лифтинг (СЛ). Среди них СФ продемонстрировал предсказуемость хирургического вмешательства для увеличения высоты кости в боковом отделе верхней челюсти.
Обзор литературы по этой теме приводит к обилию информации, расхождениям во мнениях и даже отсутствию консенсуса. Хотя настоящий обзор не содержит новых данных по этому распространенному клиническому сценарию, его цель - оценить текущую опубликованную информацию, чтобы дать представление о принятии решений относительно методов СЛ и соответствующих трансплантационных материалов и биопрепаратов.
Методы синус-лифтинга
Наиболее распространенными методами СЛ являются метод латерального окна (МЛА) и транскрестальный метод (ТКМ). Оба подхода предполагают установку костных трансплантатов в пространство, образовавшееся в результате поднятия дна пазухи. Сообщалось, что результаты успешности процедуры и выживаемости имплантатов были значительно выше.
Метод латерального окна
При использовании подхода МЛА, впервые примененного доктором Hilt Tatum, Jr. в 1970-х годах и впервые опубликованного Boyne и James в 1980 году, полнослойный лоскут приподнимают, чтобы обнажить боковую стенку верхнечелюстной пазухи. Доступ к верхнечелюстной пазухе достигается путем создания окна в латеральной стенке пазухи с сохранением целостности мембраны пазухи. Техника «неполного перелома» предполагает отделение костного островка, чтобы переместить его в качестве крыши, чего невозможно добиться в узких пазухах. Техника «wall-off» позволяет полностью удалить костный островок, в результате чего обеспечивается лучший доступ к пазухе.
Было показано, что пьезоэлектрическая хирургия для подготовки латерального окна и разъединения мембраны снижает количество интраоперационных осложнений по сравнению с ротационными инструментами. Основными преимуществами пьезоэлектрического устройства являются избирательное режущее действие на минерализованную ткань и то, что достигаемая им точная остеотомия улучшает хирургический контроль. После обнажения мембрану пазухи отделяют от костных стенок с помощью элеваторов и/или тупых пьезоэлектрических наконечников, стараясь не допустить перфораций и чрезмерного растяжения за пределы области, запланированной для костной аугментации. Это позволяет установить трансплантационный материал во вновь созданный участок. В местах с достаточной высотой альвеолярной кости, обычно от 3 мм до 5 мм, возможна одновременная установка имплантатов (т.е. «одноэтапная» техника). После поднятия мембраны пазухи во вновь созданный участок помещают выбранный костный трансплантат, а затем, при наличии показаний, устанавливают имплантат. Перед ушиванием лоскута на костное окно можно наложить коллагеновую мембрану, особенно если окно относительно большое. Альтернативой является поэтапная процедура, когда кость наращивают во время первого хирургического вмешательства, а затем устанавливают дентальные имплантаты после создания соответствующего объема кости (т.е. «двухэтапная» техника).
Выбор материала для костного трансплантата при аугментации дна гайморовой пазухи обычно обусловлен техническими предпочтениями и анатомическими факторами. Аугментация дна верхнечелюстной пазухи без трансплантата считается приемлемой альтернативой с удовлетворительными результатами. Этот подход требует одновременной установки имплантатов, выступающих в полость пазухи, чтобы накрыть шнейдеровскую мембрану и тем самым создать достаточное пространство для образования кровяного сгустка.
Предполагается, что мембрана пазухи обладает остеогенным потенциалом, вызывая образование новой кости вокруг установленных имплантатов. Самопроизвольное образование костной ткани до 2-3 мм в пазухе после синус-лифтинга было подтверждено в исследованиях на животных. Однако количество новой костной ткани уменьшается по мере увеличения длины выступа имплантата при СЛ без трансплантационного материала. Чтобы справиться с этим ограничением, при СЛ обычно показано использование костных трансплантатов для обеспечения достаточного пространства между мембраной пазухи и дном полости пазухи. Считается, что материал трансплантата улучшает первичную стабильность, обеспечивая больше субстрата для фиксации имплантата.
Было показано, что при использовании метода МЛА высота кости увеличивается на 8-10 мм. Однако такой подход часто связан со значительной заболеваемостью пациентов. Он требует использования широкого мукопериостального лоскута с как минимум одним вертикальным разрезом для создания костного окна в латеральной стенке, что может привести к повышенному риску послеоперационной боли, отека лица, задержки заживления, кровотечения и послеоперационной инфекции.
Метод транскрестального окна
Подход ТКМ был представлен Tatum в 1976 году и модифицирован Summers в 1994 году. В отличие от МЛА, где необходимо проводить остеотомию буккальной костной пластинки, ТКМ предполагает гребневой подход к мембране пазухи через просверленное ложе имплантата. При этом дно пазухи подвергается дроблению с помощью набора остеотомов все большего диаметра, что позволяет приподнять дно пазухи и увеличить плотность окружающей верхнечелюстной кости, что приводит к лучшей первичной стабильности имплантатов, чем при МЛА.
После обнажения области остеотомии путем поднятия гребневого лоскута или использования беслоскутной техники, 2-миллиметровым спиральным сверлом создают пилотное отверстие на расстоянии 1 мм от дна пазухи. Остеотомию расширяют на 0,5-1,2 мм меньше размера планируемого имплантата с помощью остеотома или серии остеотомических сверл. Затем частицы трансплантата вводят в область остеотомии и продвигают к пазухе с помощью легкого сверления. Перелом дна пазухи можно определить по изменению сопротивления между остеотомом и костью или по изменению звука сверления. Остеотом не следует продвигать в пазуху, так как это повышает риск перфорации мембраны. Объем достижимого синус-лифтинга во многом зависит от опыта хирурга из-за закрытого подхода и ограниченности обзора. Важным недостатком трансальвеолярного подхода является возможность непреднамеренной перфорации мембраны пазухи. Это может быть чревато серьезными осложнениями, если частицы трансплантата попадут в антральную полость и вызовут закупорку устья, что может привести к хроническому риносинуситу.
Однако исследование с использованием интрасинусальной эндоскопии показало, что при тщательном выполнении ТКМ дно пазухи можно приподнять на 5 мм без перфорации мембраны. Поскольку эта техника в основном выполняется без визуализации, возможности для обнаружения перфораций ограничены. В таких случаях высота подъема не должна превышать в среднем 3 мм. В случае, если в результате неожиданной перфорации мембраны синуса при крестальном подходе требуется лучшая визуализация, лечащие врачи должны уметь выполнять оба протокола (крестальный и латеральный).
ТКМ – менее инвазивный метод лечения, чем МЛА, с более коротким периодом проведения операции и меньшим послеоперационным дискомфортом. Кроме того, большинство процедур ТКМ проводят одновременно с установкой имплантатов, что сокращает общее время лечения. По результатам сетевого мета-анализа было показано, что ТКМ превосходит МЛА в местах с остаточной высотой кости (ОВК) от 4 мм до 8 мм. Результаты исследования показали, что МЛА не подходит для пациентов с промежуточной ОВК из-за неоправданного увеличения числа осложнений и финансовых затрат.
Показания к применению техники синус-лифтинга
В ретроспективном исследовании, длившемся от 6 до 20 лет, было показано, что имплантаты с менее чем 3 мм предоперационной ОВК до СЛ имели более низкую выживаемость, чем имплантаты с 3 мм и более предоперационной ОВК. Если ОВК превышает 6 мм, наиболее показано проведение ТКМ. Если ОВК составляет от 4 до 6 мм, то при относительно здоровом состоянии пазухи рекомендуется использовать ТКМ, в то время как латеральный подход предпочтительнее, если целостность пазухи и мембраны нарушены (например, при незначительном, около 2 мм, утолщении мембраны пазухи, кистах). Если ОВК составляет от 2 до 4 мм, латеральный подход будет более удобной альтернативой. Кроме того, латеральный подход рекомендуется при широких (или слишком резких) контурах верхнечелюстной кости и наличии перегородки в области подъема, так как потенциал растяжения мембраны пазухи будет относительно неблагоприятным, а хирургические трудности и риски относительно высокими.
Техники ТКМ
Обычные методы создания доступа к пазухам включают использование остеотомов, ротационных инструментов, комбинации остеотомов и трепанационных боров, а также пьезоэлектрических инструментов. Механическое (гидравлическое) давление для отсоединения мембраны пазухи от дна пазухи может быть создано различными средствами, включая остеотомы, комбинацию остеотомов и биоматериалов для трансплантации, трепанированный костный стержень плюс биоматериалы для трансплантации, пьезоэлектрические вставки с внутренней ирригацией, введение жидкости через канал внутри корпуса имплантата, а также надувные приспособления.
С 2003 года модификации оригинальной техники ТКМ позволяют отказаться от использования ручного молотка и направлены на повышение удобства для пациента и снижение риска осложнений. При установке верхнечелюстных зубных имплантатов с помощью остеотома травма, вызванная перкуссией, а также гиперэкстензия шеи во время операции могут смещать отолиты, как сообщалось в некоторых исследованиях, и провоцировать доброкачественное пароксизмальное позиционное головокружение, которое может стать причиной утраты трудоспособности и вызвать значительный стресс у пациента.
ТКМ обычно связывают с низкой интра- и послеоперационной заболеваемостью, а использование сверл может привести к значительно меньшему дискомфорту пациента во время операции и значительно большему доверию пациента по сравнению с остеотомами. Более того, замена ручных инструментов, таких как остеотомы и ручной молоток, на инструменты с электроприводом, такие как пьезоэлектрические насадки и электромагнитный молоток, может еще больше снизить заболеваемость при неизменных реконструктивных возможностях последних.
Техника поднятия мембраны пазухи с помощью баллона
Техника поднятия антральной мембраны с помощью баллона позволяет поднять мембрану пазухи с минимальной травмой и особенно удобна в труднодоступных местах. Такой подход эффективен, когда зубы соседствуют с беззубым участком, требующим аугментации. Первоначальная последовательность сверления такая же, как и при подготовке ложа имплантации в обычном гребне кости, не требующем аугментации синуса, а при доступе к мембране синуса через место остеотомии вводят гидравлический подъемник с легким давлением. Обычно используют трубку, соединенную с воздушным баллоном с помощью шприца, наполненного стерильным физиологическим раствором, и при нажатии на плунжер баллон раздувается и, соответственно, приподнимает мембрану. Поскольку физраствор не наносит вреда при введении в пазуху, при использовании этой методики баллон необязателен. Преимуществами протокола с антральным баллоном являются низкая частота инфекций и кровотечений, а также низкий риск перфорации мембраны синуса.
Опосредованная ротационным инструментом оссеоденсификация при ТКМ
Остеоденсификация (ОД) – это новая хирургическая техника подготовки места установки имплантата, которая позволяет сохранить кость с помощью специально разработанных боров. Боры используют со стандартным хирургическим мотором, и они способны уплотнять кость, вращаясь в нережущем направлении (против часовой стрелки со скоростью 800-1200 оборотов в минуту) или сверлить кость, вращаясь в режущем направлении (по часовой стрелке со скоростью 800-1200 оборотов в минуту) с обильной ирригацией.
В отличие от традиционных методов сверления, эта новая методика предлагает инновационный подход к уплотнению кости за счет контролируемой деформации путем контакта внутренней поверхности ложа для установки имплантата с вращающимися поверхностями бора для денсификации. Деформация костей происходит по вязкоупругим и пластическим механизмам. Обильное количество ирригационной жидкости во время процедуры обеспечивает смазывание поверхности бора и кости во избежание перегрева.
ОД зарекомендовала себя с точки зрения значительно более высоких показателей момента установки имплантата и первичной стабильности по сравнению со стандартным субтрактивным сверлением. В недавнем систематическом обзоре сообщалось, что ОД обеспечивает неизменно более высокий коэффициент стабильности имплантата на исходном уровне и через 4-6 месяцев после установки имплантата по сравнению с традиционным сверлением. При подготовке места установки с помощью ОД ложе для имплантации постепенно расширяется как в латеральном, так и в верхушечном направлении, что позволяет использовать его не только для расширения гребня, но и для ТКМ безопасным, предсказуемым способом с пониженной заболеваемостью.
После проникновения в дно пазухи в процессе сверления без уплотнения кости и введения ирригационного раствора и аутогенной костной стружки/трансплантата производят гидравлическую отслойку мембраны пазухи и последующее поднятие. Несмотря на то, что ОД показала хорошие результаты при синус-лифтинге в случаях со сниженной ОВК, в литературе до сих пор не установлена минимальная высота кости для безопасного использования этой техники.
Данный подход менее травматичен, чем обычное сверление, что приводит к увеличению плотности костной ткани вокруг имплантатов и сокращению времени заживления. Клиническое исследование показало, что ОД и МЛА одинаково эффективны при СЛ с одновременной установкой имплантатов, когда ОВК составляет 4 мм или менее. Однако ОД значительно превосходила МЛА по уровню болевых ощущений, влиянию на воспринимаемое качество жизни, продолжительности операции, послеоперационному отеку и уровню приема анальгетиков.
Гидродинамический пьезоэлектрический синус-лифтинг
При пьезоэлектрическом синус-лифтинге используется пьезоэлектрическая ультразвуковая вибрация (25-30 кГц); пьезохирургический прибор прецизионно рассекает только минерализованные структуры (кость), не рассекая мягкие ткани (мембрану), которые не повреждаются при случайном контакте. СЛ выполняют с помощью инструмента с круглой головкой, что позволяет избежать перфораций. На круглой вставке с 2-миллиметровыми интервалами нанесены линии, указывающие глубину, для точного измерения остаточной высоты кости от альвеолярного гребня до дна пазухи. Кроме того, пьезоэлектрический наконечник имеет набор стопорных манжет с 2-миллиметровыми интервалами для предотвращения случайной перфорации мембраны при приближении к дну пазухи.
После введения в дно пазухи наконечник удерживается в ложе для имплантации, оказывая гидравлическое давление на мембрану пазухи в течение дополнительных 10-20 секунд. В большинстве случаев с помощью этой процедуры мембрану пазухи легко удается приподнять. Затем цилиндрический наконечник шириной 2,8 мм используют для латерального расширения ложа для имплантации, а приподнятие слизистой оболочки пазухи обеспечивают с помощью гидравлического давления. После извлечения наконечника из ложа для имплантации хирург может наблюдать за движением мембраны пазухи вверх-вниз во время дыхания. Цилиндрический наконечник - это окончательный наконечник для формирования ложа, в который помещают конический имплантат шириной от 3,7 до 4,2 мм для обеспечения хорошей первичной стабильности.
Пьезохирургический прибор обеспечивает чистое операционное поле и отсутствие крови во время подготовки места операции; это происходит благодаря эффекту воздушно-водяной кавитации ультразвукового инструмента. Было показано, что пьезоэлектрический СЛ снижает частоту перфорации мембраны.
Магнитодинамическая технология
В 2012 году компания Crespi представила электромагнитный молоток для проведения хирургических операций в полости рта (Фото 1). Магнитный молоток — один из нескольких инструментов, используемых для подготовки остеотомии имплантатов и синус-лифтинга. Это новое хирургическое изделие, предназначенное для нанесения контролируемого высокоинтенсивного удара за очень короткий промежуток времени. Магнитодинамическая технология использует физические принципы электромагнетизма для приложения контролируемых сил к поверхности при минимизации времени удара. Считается, что такое максимальное усилие, достигаемое за короткое время удара, сводит к минимуму образование ударной волны. Удар, наносимый магнитным молотком, настолько быстр, что при трении выделяется лишь небольшое количество тепла, что исключает необходимость ирригации зоны воздействия. Это улучшает видимость, помогает избежать потери биологических веществ из-за ирригации, тем самым повышая стабильность имплантата за счет уплотнения кости вокруг ложа для имплантации.
Фото 1. Электромагнитный молоток.
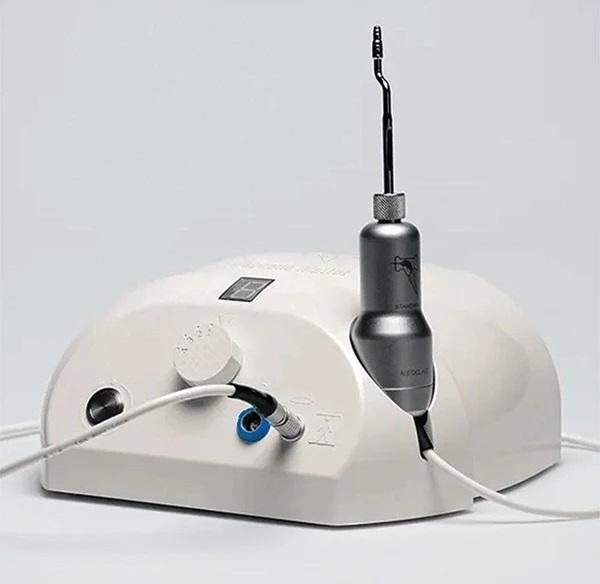
Магнитный молоток включает в себя наконечник, питающийся от изделия с регулируемой мощностью, передающий усилие в зависимости от времени приложения, что снижает выделение тепла и благоприятно воспринимается костью. К наконечнику могут быть прикреплены различные насадки, подающие ударную волну на его кончик. Доступны четыре режима силы: 75, 90, 130 и 260 даН (деканьютонов). Время удара составляет 80 микросекунд. Магнитный импульс, создаваемый в наконечнике, приводит инструмент в действие с силой, в 10 раз превышающей силу, создаваемую ручными изделиями, при этом время воздействия практически сводится к нулю. Контроль и стабильность прилагаемых усилий повышают безопасность для пациентов и хирургов.
Гидравлический синус-лифтинг
Для снижения частоты перфорации мембраны было предложено использовать контролируемое гидравлическое давление для отслоения шнейдеровской мембраны от костных стенок пазух. Этот метод можно применять как при открытом, так и при закрытом синус-лифтинге. Он предполагает получение доступа к шнейдеровской мембране посредством крестальной или латеральной остеотомии и применение гидравлического давления с помощью прямого потока воды из наконечника, при этом рентгеноконтрастное вещество, такое как физраствор или вода, вводят под мембрану с помощью специально разработанных инжекторов или насосов. Как только мембрана будет отслоена от стенок пазухи, через остеотомию аккуратно вводят трансплантат и уплотняют его, чтобы увеличить объем гребня.
Гидравлический метод синус-лифтинга можно безопасно использовать для приподнятия большего участка шнейдеровской мембраны, что приводит к снижению частоты перфорации мембраны по сравнению с традиционным интракрестальным СЛ. Это также позволяет пересадить большой объем трансплантата, что может привести к улучшению стабильности имплантата. Этот метод требует навыков высокого уровня, поэтому его клиническое применение по-прежнему ограничено. Данные, подтверждающие эффективность и успешность этой методики, в основном основаны на сериях случаев, и рандомизированных клинических исследований, сравнивающих процедуру гидравлического синус-лифтинга с традиционными открытыми или закрытыми методами синус-лифтинга, не проводилось.
Другие ТКМ, опосредованные ротационным инструментом
Преимущество ротационного инструментального ТКМ, также известного как крестальный подход, перед остеотомией заключается в возможности проникновения в полость пазухи, что снижает риск перфорации мембраны и минимизирует дискомфорт для пациента. Хотя все методы крестального доступа рекомендуется использовать в сочетании с немедленной установкой имплантатов после синус-лифтинга при остаточной высоте кости от 5 мм до 6 мм, случаи использования крестального подхода при остаточной высоте кости меньше этого показателя также успешно поддаются лечению.
В 1994 году Cosci начал 6-летнее ретроспективное исследование своей методики на 265 имплантатах с использованием первых описанных ротационных инструментов, специально разработанных для СЛ с крестальным доступом. Процедура выполняется с помощью боров для синус-лифтинга с плоским концом длиной от 1 мм до 8 мм в сочетании с крестальными ограничителями. На сегодняшний день на рынке доступны различные наборы для транскрестального синус-лифтинга по методике Cosci. Они предназначены для использования с наконечником для имплантатов и включают в себя боры без режущих поверхностей.
При этом методе дно пазухи достигают с помощью трепана трефином, как показано на конусно-лучевой компьютерной томографии (КЛКТ), и перфорируют с помощью бора для синус-лифтинга на 1 мм больше, чем глубина, достигнутая основным бором. После формирования ложа для имплантации инструмент с тупым наконечником используют для тщательного зондирования и определения соотношения мембраны пазухи и дна пазухи. Если определяется наличие кости, используют атравматическое сверло для синус-лифтинга на 1 мм длиннее, и так далее, пока не будет достигнута выстилка пазухи. Убедившись, что дно удалено, выполняют маневр Вальсальвы, чтобы убедиться в целостности мембраны. Это делается с помощью стоматологического зеркала, позволяющего наблюдать за потоком воздуха или пузырьками из ложа для имплантации, указывающими на перфорацию.
Целостность мембраны можно оценить визуально с помощью зеркала, если толщина кости составляет всего несколько миллиметров, а пазуха расположена ближе к гребню. Если перфорация не выявлена, врач может приступить к поднятию мембраны и размещению трансплантата. Самым простым способом поднятия мембраны является введение самого костного трансплантата. Трансплантационный материал осторожно помещают в небольшом количестве в ложе для имплантации с помощью остеотомов, аккуратно постукивая молотком, и продвигают на глубину дна пазухи, но не глубже. Объем необходимого костного трансплантата определяется величиной необходимого поднятия. Рентгенографическая проверка на этом этапе может помочь в определении объема подъема кости. Установка имплантата придаст дополнительный объем, так как он сдвинет трансплантат в направлении верхушки.
Модифицированный метод использования трепана/остеотома
Модифицированный подход с использованием трепана/остеотома облегчает СЛ с использованием остеотома для поднятия основной части остаточного цилиндра альвеолярной кости, полученной с помощью трепана, проводимого на расстоянии 1-2 мм от дна пазухи, вместо сверла, в качестве первого этапа. Трепан используют с пониженной скоростью вращения для подготовки участка в пределах от 1 мм до 2 мм от мембраны пазухи. Затем с помощью калиброванного остеотома, соответствующего диаметру трепанационного сверла, под мягким надавливанием трепанационную костную массу поднимают на глубину, примерно на 1 мм меньшую, чем отпрепрарироанный участок. Самый широкий остеотом должен быть на один размер меньше диаметра планируемого имплантата. Установка имплантата вызывает латеральное перемещение приподнятой массы альвеолярной кости с мягким и контролируемым смещением.
Методика местного управления дном пазухи
Когда рассматривается возможность немедленной установки имплантатов для зубов, расположенных в непосредственной близости от дна пазухи, обычно применяют двухэтапный подход. Во многих случаях первым этапом является удаление зуба с последующим сохранением гребня с использованием биоматериалов или без них. К установке имплантата обычно приступают после соответствующего периода заживления.
Установка имплантатов в свежих лунках после удаления зуба и одновременное поднятие дна верхнечелюстной пазухи значительно сокращает общее время лечения и позволяет установить имплантаты, превышающие предоперационные размеры кости по длине и ширине, что можно считать достаточным для замещения многокорневых моляров верхней челюсти.
Методика местного управления дном пазухи (МУДП) – это использование принципов техники наращивания беззубого гребня. В одной операции сочетаются поднятие дна верхнечелюстной пазухи, буккальное расширение остаточной альвеолярной кости и установка имплантатов. Как и в методики наращивания беззубого гребня, регенерация кости и остеоинтеграция имплантата происходят одновременно. Концепция МУДП может быть реализована в лунках свежеудаленных моляров, что позволяет устанавливать имплантаты с широким телом непосредственно в лунку моляра верхней челюсти для получения первичной стабильности в межкорневой перегородке. Это хирургическое вмешательство обеспечивает горизонтальное расширение пустых корневых пространств и вертикальное расширение межкорневой перегородки, которая обычно присутствует в небной кости, покрывающей небный корень и выстилающей дно пазухи.
Межкорневая костная перегородка представляет собой идеальное место для немедленной установки имплантатов в задней части верхней челюсти; в некоторых случаях недостаточные размеры межкорневой костной перегородки могут поставить под угрозу проведение процедуры МУДП. Морфологическое исследование анатомических структур, КЛКТ и соответствующее программное обеспечение являются ключевыми инструментами для планирования точного положения имплантата и проведения хирургической навигационной операции имплантации зубов.
Рекомендуемая методика в этом контексте – ОД с использованием хирургических боров с применением насосных движений с обильной ирригацией для устранения перегрева. Нагнетание жидкости в сочетании с высокоскоростным вращением против часовой стрелки вызывает гидродинамическую волну, называемую волной сжатия, перед точкой контакта. Это повышает первичную стабильность, минеральную плотность кости и процентное содержание костной ткани на поверхности имплантата по сравнению со стандартным и экстракционным сверлением.
Модифицированная техника местного управления дном пазухи в лунках свежеудаленных моляров
После удаления зуба, щечного расширения остаточной кости перегородки, поднятия дна гайморовой пазухи и установки имплантата, модифицированная методика МУДП в лунках свежеудаленных моляров предусматривает дополнительную процедуру, которая выполняется после установки имплантата. При этой процедуре костный трансплантат и имплантат слегка приподнимают в пазухе с помощью электромагнитного молотка, чтобы достичь дополнительного СЛ до 5 мм без перфорации мембраны.
После атравматичного удаления моляра выполняют сверление с помощью цифрового хирургического шаблона. Затем проводят формирование ложа для имплантации на 2 мм меньше желаемой ширины имплантата, но на 1 мм ниже дна пазухи (Фото 2). В этом случае рекомендуется использовать остеоденсифицирующие боры для формирования ложа (Фото 3). Затем исползуют трепан со сниженной скоростью вращения, чтобы подготовить основу вокруг ложа, но на 1 мм ниже дна пазухи (Фото 4). Затем магнитный молоток аккуратно, с контролируемым усилием, обрушивает дно пазухи в полость пазухи, поднимая мембрану пазухи на 2-3 мм вместе с костным фрагментом и материалом костного трансплантата, помещенным в место остеотомии (Фото 5). Минимально инвазивный и удобный в использовании магнитный молоток обеспечивает заданное усилие за оптимальное время.
Фото 2. Пилотное сверло вводится на 1 мм ниже дна верхнечелюстной пазухи у перегородки моляра.
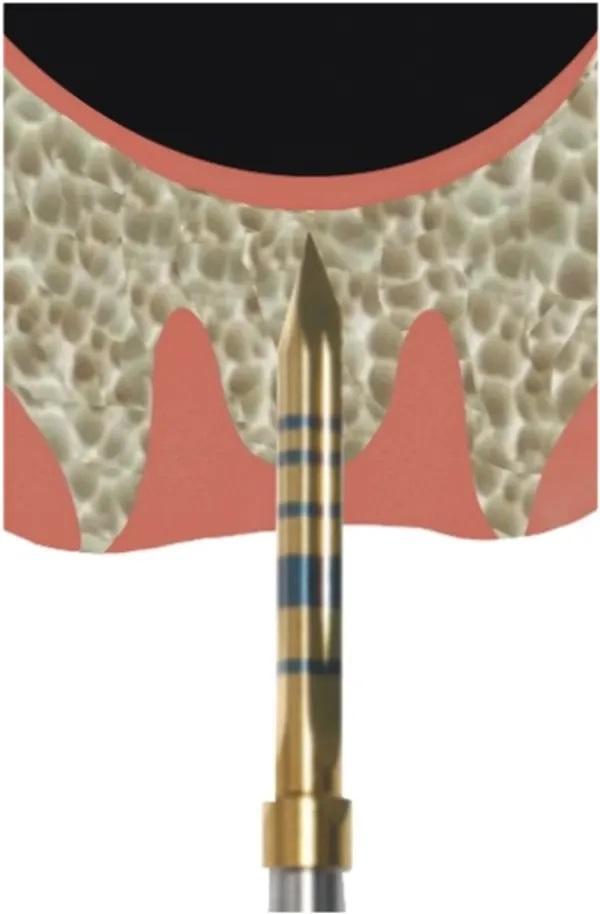
Фото 3. Оссеоденсифицирующие боры используют по часовой стрелке со скоростью 800-1200 оборотов в минуту, чтобы достичь глубины 1 мм под дном пазухи.
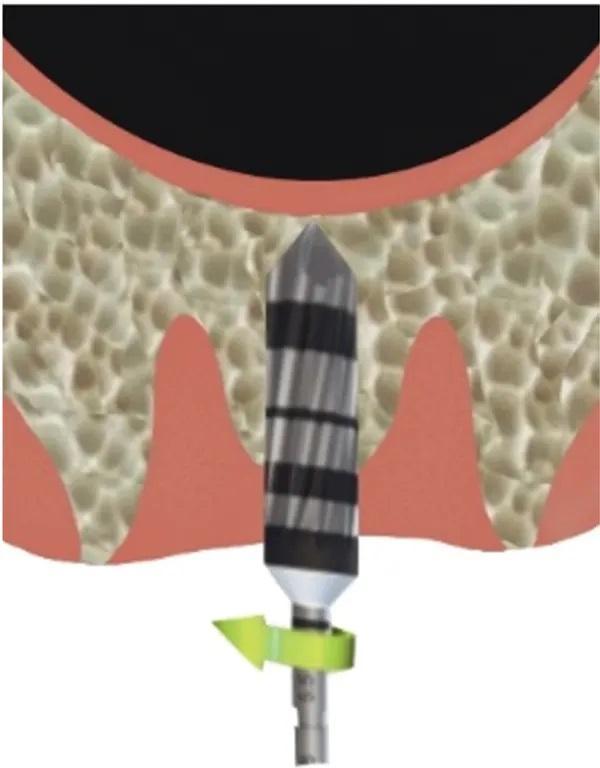
Фото 4. Трепан используют на 1 мм ниже дна пазухи.
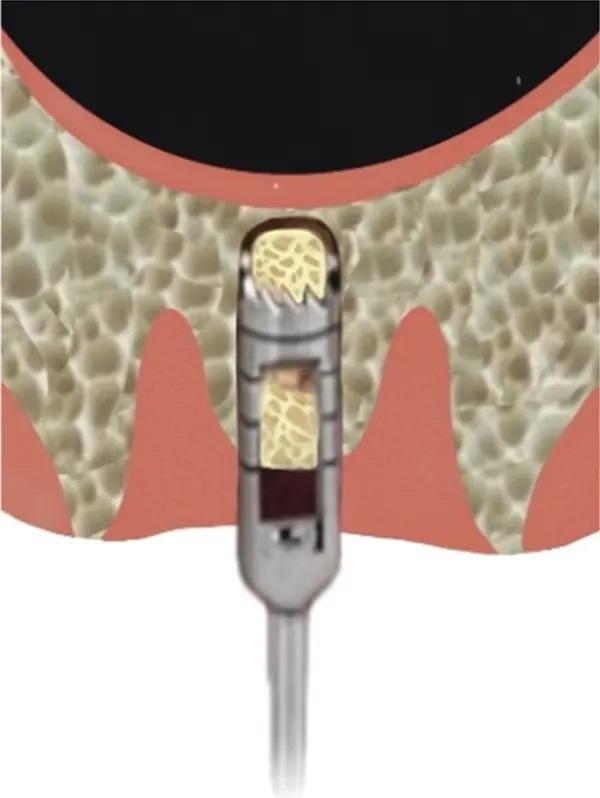
Фото 5. Затем для проведения СЛ используют магнитный молоток.
Устанавливают имплантат определенного размера, первичная стабильность оценивают с помощью динамометрического ключа (Фото 6). Для предотвращения случайного смещения имплантата в пазуху во время начального периода остеоинтеграции на имплантат устанавливают формирователь десны с широким профилем. Постукивание по верхушке формирователя десны в вертикальном направлении с помощью магнитного молоточка в режиме наименьшей силы позволяет провести СЛ на дополнительные 3-5 мм (Фото 7).
Фото 6. Устанавливают имплантат, еще больше приподнимая дно пазухи.
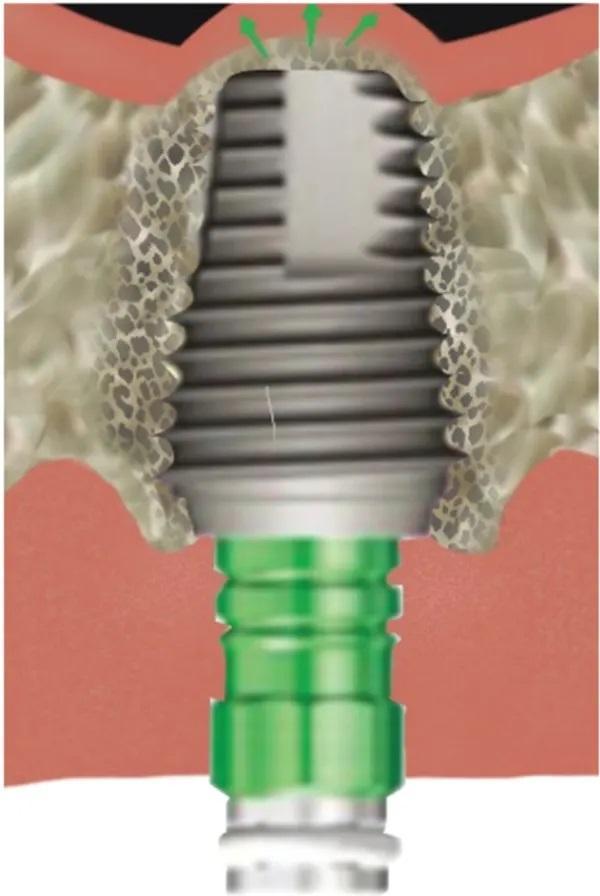
Фото 7. Вживление костной ткани в имплантат.
Пример клинического случая
Пациент, 68 лет, обратился с жалобами на чувствительность эндодонтически пролеченного зуба (1.6) в правом боковом отделе верхней челюсти. Он искал долгосрочное решение для облегчения боли и чувствительности. Пациент сообщил, что боль носила периодический характер с момента эндодонтического лечения зуба. Для оценки ситуации была выполнена периапикальная рентгенограмма (Фото 8). Между зубами 1.7 и 1.6 была отмечена потеря костной ткани. Была отмечена значительная глубина зондирования между двумя молярами, и пациент был проинформирован о возможном вертикальном переломе корня зуба 1.6.
Фото 8. Зубы 1.7 и 1.6 были безнадежны из-за потери костной ткани пародонта между ними.
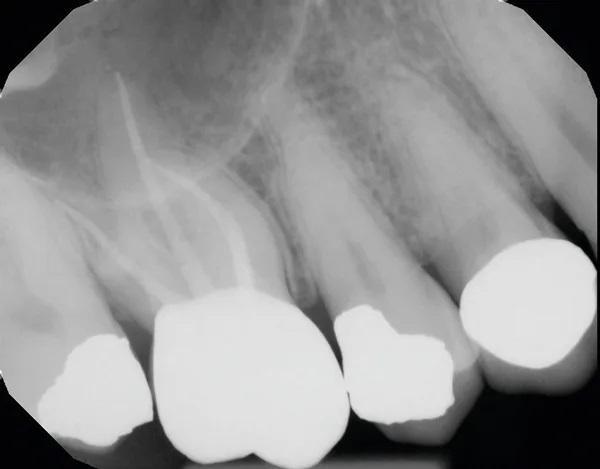
Были обсуждены варианты лечения, и пациент заявил, что из-за сохраняющейся чувствительности при жевании он хотел бы удалить зуб 1.6. Поскольку зуб 1.7 имел значительную потерю костной ткани с мезиальной стороны, было решено удалить оба зуба 1.7 и 1.6 и установить имплантат только на место зуба 1.6. Пациента проинформировали о том, что для обеспечения достаточного количества костной ткани для опоры имплантата потребуется крестальная аугментация пазухи, которая будет проведена одновременно с установкой имплантата. Пациенту было проведено сканирование с помощью внутриротового сканера и КЛКТ для изготовления хирургического шаблона.
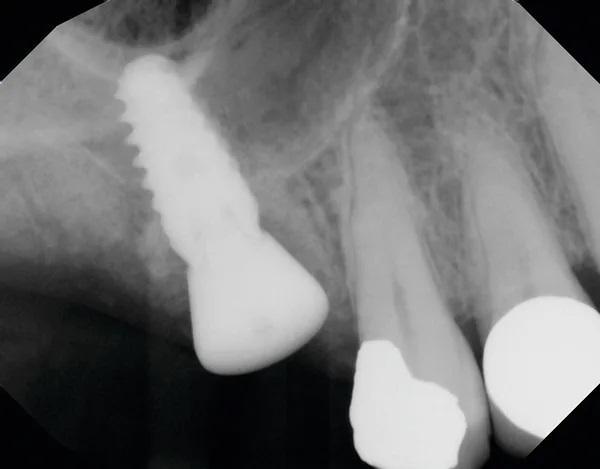
Пациент явилась на прием к хирургу, и после ознакомления и подписания форм согласия была введена местная анестезия. Лезвием скальпеля №15 была отсечена маргинальная десна, и был поднят полнослойный слизисто-надкостничный лоскут. Зуб 1.6 был рассечен на две части с помощью хирургического бора 557 с обильным орошением стерильным физраствором. Зуб удалили двумя частями с помощью элеватора и щипцов, также был удален зуб 1.7. Лунки были орошены стерильным физиологическим раствором, а для синус-лифтинга в области зуба 1.6 был использован интракрестальный подход с помощью системы постукивания молотком. Материал костного трансплантата (аллотрансплантат AlloOss [смесь 50/50], Ace Southern) был смешан с материалом аллотрансплантата (DirectGen Mineralized Cortical/Cancellous Particulate, 250-1000 мкм 1,0 куб. см, Implant Direct), который был смешан с кровью, а затем размещен для проведения синус-лифтинга. В подготовленное ложе был установлен имплантат (ULT, 5 мм x 10 мм, Ditron Dental). Дополнительный трансплантационный материал был помещен для заполнения всех пустот вокруг имплантата, а также в лунку после удаления зуба 1.7. Был установлен формирователь десны шириной 3 мм, мягкие ткани были ушиты хромированным кетгутом 4-0. Затем была выполнена периапикальная рентгенограмма (Фото 9).
Фото 9. Модифицированная техника местного управления дном пазухи в лунке свежеудаленного первого моляра и сохранение лунки второго моляра.
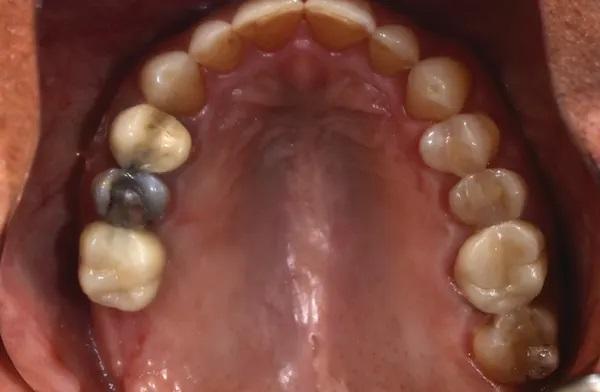
Через 5 месяцев после непосредственной установки имплантата были получены окончательные оттиски, в зуботехнической лаборатории была изготовлена реставрация с винтовой фиксацией, которая была возвращена для установки. Пациент вернулся, формирователь десны был удален, а окончательная реставрация установлена и закручена в соответствии с рекомендациями производителя. Были выполнены рентгенограмма и клинические снимки (Фото 10 и Фото 11).
Фото 10. Завершенная реставрация на имплантате, установленном с помощью крестального синус-лифтинга, через 5 месяцев после установки имплантата.
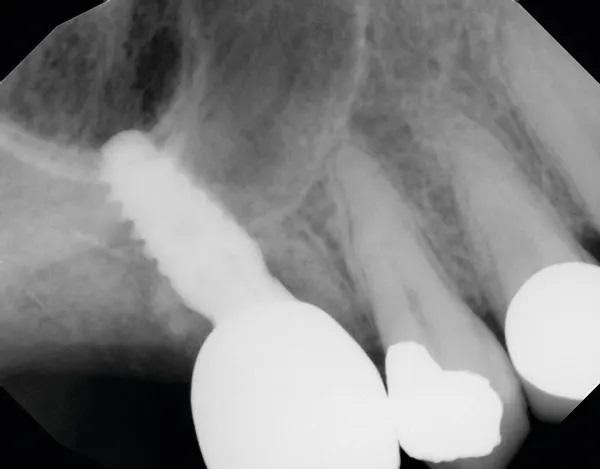
Фото 11. Клинический окклюзионный вид имплантата с реставрацией в области первого моляра с проведением крестального синус-лифтинга при установке имплантата, через 5 месяцев после установки имплантата.
Трансплантационные материалы
Физиологические свойства костных трансплантатов и заменителей костной ткани часто определяют как остеоиндуктивные, остеокондуктивные и остеогенные. Остеоиндуктивность – это способность трансплантата активно способствовать формированию костной ткани. Остеокондуктивность – это характеристика каркаса, которая облегчает колонизацию и врастание костных клеток и васкуляризацию благодаря своей трехмерной структуре. Остеокондукция – это пассивный процесс, который определяется в первую очередь пористостью трансплантационного каркаса и в меньшей степени его химическими и физическими свойствами, стимулирующими адгезию и рост клеток организма-хозяина. Остеогенность означает наличие костеобразующих клеток в костном трансплантате. Ниже описаны различные материалы для костной пластики.
Аутотрансплантаты
Первым трансплантационным материалом для аугментации дна верхнечелюстной пазухи была аутогенная кость, полученная от пациента, которому проводилось лечение. Изначально предпочтение отдавалось аутогенным трансплантатам из-за меньшего риска отторжения организмом-хозяином, а также их остеоиндуктивных, остеокондуктивных и остеогенных свойств. Аутологичные трансплантаты – единственные трансплантаты с остеогенным потенциалом, поскольку они содержат остеогенные клетки внутри костного трансплантата. Среди трансплантационных материалов аутологичная кость по-прежнему считается золотым стандартом.
Хотя аутогенная кость обычно дает благоприятные результаты, ее использование в СЛ имеет два основных недостатка. Во-первых, необходимо забирать различное количество кости, обычно от 0,5 до 5 куб. см, из другого операционного участка. Это увеличивает время хирургического вмешательства и риск интраоперационных осложнений и послеоперационной заболеваемости. Во-вторых, высокая степень биодеградации (до 40%), связанная с частицами аутогенной кости, может превысить скорость образования новой кости в фазе консолидации и привести к неоптимальному результату увеличения объема костной ткани. Для преодоления этих недостатков различные биоматериалы использовались как отдельно, так и в сочетании с аутотрансплантатами в процедурах СЛ, чтобы задействовать свойства, присущие аутогенной кости, и одновременно с этим воспользоваться низкой скоростью резорбции некоторых костных заменителей для повышения объемной стабильности трансплантата. Хотя такой подход имеет биологический смысл, с клинической точки зрения ни один конкретный материал для костного трансплантата или их комбинация не показали явного превосходства при аугментации дна верхнечелюстной пазухи.
Заменяющие материалы
Среди остеокондуктивных материалов в стоматологической литературе описаны аллотрансплантаты (свежезамороженная кость, сублимированная кость, деминерализованная сублимированная кость), ксенотрансплантаты (бычьего, лошадиного или свиного происхождения) и аллопластические материалы (различные комбинации кальций-фосфата, биоактивных стекол или полимеров), способные усиливать остеогенез. Кроме того, в ряде исследований было показано, что эти биоматериалы могут не оказывать отрицательного влияния на клинические результаты и выживаемость имплантатов по сравнению с аутогенной костью. Таким образом, выбор материала является важным фактором, который следует учитывать.
Аллотрансплантаты-Аллотрансплантаты – часто используемая альтернатива аутогенной костной пластике и подходящий материал для стоматологических регенеративных процедур. К ним относятся СЛ, направленная костная регенерация (НКР), сохранение альвеолярного гребня для установки имплантатов и другие вспомогательные процедуры трансплантации в имплантологии. Основное преимущество аллотрансплантатов перед другими коммерчески доступными костнозамещающими материалами заключается во включении в них остеоиндуктивных факторов роста. В исследованиях доказана их эффективность в развитии новой костной ткани. Хотя аллотрансплантаты для замещения костной ткани популярны в США, во многих странах их использование в лечении пациентов строго регламентировано или запрещено. Сохраняются ограничения, связанные с риском передачи инфекционных заболеваний, таких как вирус иммунодефицита человека (ВИЧ) и гепатиты В и С. Эти опасения, как правило, можно устранить путем обработки тканей, например, стерилизации, механической очистки, ультразвуковой промывки и гамма-облучения трансплантационного материала в процессе обработки производителем.
Аллотрансплантаты успешно используются в сочетании с ксенотрансплантатами для процедур СЛ. В клинической практике наблюдается тенденция к использованию минерализованных костных аллотрансплантатов, которые обладают рентгеноконтрастностью и обеспечивают улучшенную остеокондуктивную основу для врастания и поддержки костной ткани. Минерализованные частицы могут быть получены их кортикальной, губчатой кости или представлять собой смесь этих двух форм. Они обладают более быстрым обменом и более физиологичным профилем резорбции, чем медленно рассасывающийся бычий костный минерал (ксенотрансплантат).
Ксенотрансплантаты. Ксенотрансплантаты считаются жизнеспособной альтернативой аутогенной кости благодаря их высоким остеокондуктивным свойствам и медленной скорости резорбции. В настоящее время на рынке костных заменителей доминирует множество ксенотрансплантатов бычьего происхождения. Различные способы манипуляций и очистки трансплантатов бычьего происхождения были представлены в коммерческих продуктах с различными характеристиками и биологическим поведением. Эти материалы хорошо сохраняются в пространстве и обладают высокой рентгеноконтрастностью, что помогает врачам определить материал в пазухе при установке.
В более ранних исследованиях ксенотрансплантатов была показана их клиническая стабильность и превосходная остеокондуктивность, а также возможность их использования в хирургических процедурах в полости рта, таких как СЛ. Ксенотрансплантаты служат матрицей и каркасом, способствующим миграции остеогенных клеток из окружающей кости верхнечелюстной пазухи в место трансплантации, что повышает способность к формированию новой кости. Перспективным материалом для ксенотрансплантации, изучаемым в настоящее время, является хитозан – полимер природного происхождения, получаемый из экзоскелетов моллюсков и состоящий из глюкозамина и N-ацетилглюкозамина.
Шелк – еще один новый материал для ксенотрансплантации, изучаемый в настоящее время. Шелк, натуральный биополимер, получаемый из шелкопряда Bombyx mori, состоит преимущественно из белков, фиброина и серицина. После удаления серицина путем дегумирования фиброин шелка широко используют в качестве костного каркаса в виде губки, волокон, пленки и гидрогеля. Фиброин шелка демонстрирует отличную биосовместимость, деградируемость, интеграцию в ткани, а также кислородную и водную проницаемость.
Несмотря на многообещающие перспективы, некоторые ограничения, связанные с использованием ксенотрансплантатов в качестве заменителей костной ткани, все еще сохраняются. К ним относятся различная скорость резорбции, отсутствие жизнеспособных клеток и биологических компонентов, а также необходимость обработки тканей, которая могла бы обеспечить сохранение остеоиндуктивных клеток.
Аллопласты. Для преодоления потенциальной иммуногенности и болезненности донорских участков изготавливаются искусственные синтетические костные заменители, в точности имитирующие биологические свойства натуральной кости. Эти материалы получают синтетическим путем или из натуральных материалов и перерабатывают. Тем не менее, имеющиеся в настоящее время синтетические материалы обладают лишь остеокондуктивными свойствами, обеспечивая основу для врастания и/или замещения новой кости. Для наращивания костной ткани пазух успешно используются различные виды аллопластических материалов, включая гидроксиапатит, сульфат кальция, фосфат кальция, биоактивные стекла, титановые гранулы и полимеры. Трикальцийфосфат был первым костным заменителем, использованным для костной пластики пазух. В будущем эти материалы могут быть адаптированы для создания клеточных конструкций и доставки факторов роста.
Биопрепараты
Биологические препараты определяются как естественные медиаторы восстановления тканей, которые регулируют клеточные явления в процессе заживления ран с помощью установленных механизмов действия. К ним относятся анаболическое костеобразование, ангиогенез, цементогенез, дифференцировка остеобластов, матричный митоз, хемотаксис и другие процессы, улучшающие среду заживления твердых и мягких тканей. Производное эмалевой матрицы, тромбоцитарный фактор роста (ТФР), костный морфогенетический белок (КМБ), богатая тромбоцитами плазма (БТП), богатый тромбоцитами фибрин (БТФ), фактор роста фибробластов (ФРФ), трансформирующий фактор роста (ТФР)-β1, эпидермальный фактор роста, фактор роста эндотелия сосудов (ФРЭС), инсулиноподобный фактор роста-I (ИПФ-I) и фактор роста гепатоцитов – наиболее распространенные биологические препараты, которые, как было показано in vitro и/или in vivo, способствуют формированию костной ткани для имплантации.
В 2022 году Американская академия пародонтологии в своем консенсусном заявлении о наилучших доказательствах пришла к выводу, что использование биологических препаратов при создании места для имплантата, включая горизонтальное/вертикальное наращивание альвеолярного гребня и СЛ с одновременной или отсроченной установкой имплантата, имеет ограниченные доказательства в пользу утверждения, что использование вышеуказанных биологических препаратов, как в качестве монотерапии, так и в сочетании с костно-пластическими материалами, дает лучшие клинические и рентгенографические результаты по сравнению с традиционными вмешательствами. Однако дополнительное использование этих биопрепаратов, по-видимому, приводит к благоприятным гистоморфометрическим результатам (т.е. образованию минерализованной ткани, наблюдаемому в биоптатах костной ткани).
Тромбоцитарные концентраты в регенеративной стоматологии
В стоматологической регенеративной терапии использование богатых тромбоцитами продуктов (например, БТП, БТФ и концентрированного фактора роста [КФР]), полученных из собственной крови пациента, в настоящее время представляется предпочтительным вариантом терапии. При активации тромбоциты образуют сеть в фибриновом матриксе и выделяют факторы роста, которые запускают процесс заживления ран через усиление клеточной адгезии, пролиферации и хемотаксиса. Первоначальная концепция, которая привела к созданию концентратов тромбоцитов, была представлена в конце 1990-х годов и заключалась в том, что концентрированные тромбоциты и аутологичные факторы роста могут быть объединены в растворы плазмы, которые затем могут быть использованы в месте хирургического вмешательства для содействия местному заживлению. Несмотря на противоречивые мнения, в целом считается, что высвобождаемые тромбоцитами факторы роста уменьшают воспаление, снижают риск осложнений и способствуют васкуляризации кости, что может быть особенно полезно в ситуациях, когда ожидаются плохие или ухудшенные результаты заживления (например, у пациентов с диабетом и остеопорозом). Кроме того, как сообщается, продукты, полученные из тромбоцитов, могут действовать как антибактериальные средства против Staphylococcus aureus и Escherichia coli. Еще одно преимущество некоторых биопрепаратов, в частности аутологичных продуктов, полученных из крови, таких как БТФ, заключается в том, что они улучшают манипуляционные свойства частиц костного трансплантата. Основными поколениями аутологичных тромбоцитарных концентратов являются БТП, БТФ и КФР.
БТП, первое поколение концентратов тромбоцитов, представляет собой плазму с высоким содержанием тромбоцитов, которая может быть получена путем центрифугирования венозной крови пациента и последующего использования ее в качестве материала для костного трансплантата. Из-за ограничений, связанных с антикоагулянтным составом БТП, дополнительные исследования Choukroun et al. в начале 2000-х годов были направлены на создание тромбоцитарного концентрата второго поколения, не содержащего антикоагулянтных факторов. Второе поколение концентратов тромбоцитов, БТФ, обладает теми же свойствами, что и БТП, но с дополнительным преимуществом – остеогенностью. Добавки в БТФ не требуются благодаря наличию фибриногена, который превращается в фибрин под действием физиологически доступного тромбина; это минимизирует риск послеоперационных осложнений. В то время как результаты применения БТФ для заживления мягких тканей, покрытия рецессии десны и регенерации пародонта хорошо описаны в литературе, использование БТФ при НКР и СЛ и его влияние на формирование кости вокруг имплантатов менее изучено. Тромбоциты являются естественным источником факторов роста, включая ТФР, ТФР-β1 и ТФР-β2, ФРФ, ФРЭС и ИПФ-I, которые стимулируют пролиферацию клеток, ремоделирование матрикса и ангиогенез.
Разработанный в 2011 году, КФР получают путем центрифугирования образцов крови с чередующимися и регулируемыми скоростями в специально разработанной центрифуге. Таким образом, тромбоциты концентрируются в гелевом слое, состоящем из фибринового матрикса, богатого факторами роста и лейкоцитами. КФР действует путем дегрануляции альфа-гранул тромбоцитов, которые играют жизненно важную роль в раннем заживлении ран. КФР содержит больше факторов роста, чем другие препараты на основе тромбоцитов, такие как БТФ и БТП, и, в отличие от БТП, КФР не рассасывается так быстро после наложения.
В то время как два основных фактора роста, одобренных Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США, ТФР и КМБ, полученные из рекомбинантных источников и созданные в бактериях или клетках млекопитающих, продаются за сотни долларов, факторы роста, полученные исключительно из аутологичного БТФ, доступны с помощью недорогих методов. Поэтому представляет интерес определить преимущество использования высоких супрафизиологических концентраций факторов роста в рекомбинантной форме (ТФР и КМБ) по сравнению с более низкими концентрациями в аутологичной форме (БТФ).
Хотя рекомбинантные белки обладают регенеративным потенциалом, который хорошо документирован в литературе, многие биологические ограничения для их использования (например, набухание, отек) в сочетании с их низкой стабильностью in vivo остаются сдерживающим фактором. Поэтому будущие исследования должны быть направлены на сравнение периода полураспада и биоактивности факторов роста, содержащихся в БТФ, с доступными в продаже рекомбинантными факторами роста.
Относительно новая концепция создания обогащенного факторами роста матрикса костного трансплантата с использованием аутологичного фибринового адгезива была описана Sohn et al. в 2015 году. «Липкая кость» представляет собой биологически затвердевший костный трансплантат, состоящий из смешанного гранулометрического состава (трифосфат кальция, ксенотрансплантаты и аллотрансплантаты дентина, полученные из удаленных зубов), окруженного фибриновой сетью.
Вывод
При выборе оптимального трансплантата для СЛ врачи должны оценить такие факторы, как болезненность донорского участка, объемная стабильность трансплантата, протокол нагрузки на имплантат, стоимость и пожелания пациента. «Избыточная аугментация» пазухи может быть клинически выгодна для компенсации уменьшения объема в процессе заживления независимо от выбора биоматериала, особенно при использовании двухэтапной процедуры. Однако положение и проходимость устья должны быть оценены до операции, чтобы избежать его ятрогенной закупорки в результате «переполнения» костным трансплантатом при аугментации пазухи. Это должно быть сделано с помощью КЛКТ-сканирования, чтобы выявить любые аномалии положения.
Количество доказательств для разработки надежных клинических рекомендаций по использованию средств и процедур для синус-лифтинга в повседневной практике все еще ограничено. Необходимы целенаправленные, хорошо спланированные долгосрочные исследования, оценивающие эффективность различных материалов для костного трансплантата и стратегий тканевой инженерии при аугментации верхнечелюстной пазухи, чтобы получить дополнительные знания, которые помогут врачам определить, какой хирургический протокол может дать наиболее благоприятные и предсказуемые результаты в конкретных клинических сценариях.
Авторы:
Gregori M. Kurtzman, DDS
Ole T. Jensen, DDS
В настоящее время в литературе предлагаются различные подходы к установке имплантатов в атрофированном боковом отделе верхней челюсти. Такие стратегии варьируются от использования блочного костного трансплантата, коротких, наклонных и скуловых имплантатов до синус-лифтинга (СЛ). СЛ зарекомендовал себя как предсказуемая хирургическая процедура для увеличения высоты кости в боковом отделе верхней челюсти. В данной статье представлен обзор методов СЛ, включая модифицированную технику локального управления дном пазухи в свежих гнездах после удаления моляров.

С клинической точки зрения пневматизация пазух вместе с резорбцией гребня могут уменьшить доступную высоту кости для будущей установки имплантатов. Кроме того, в боковом отделе верхней челюсти часто наблюдается более низкое качество кости, что может затруднить установку имплантатов. В настоящее время предлагается несколько стратегий установки имплантатов в атрофический боковой отдел верхней челюсти, включая блочную костную пластику, использование коротких, наклонных или скуловых имплантатов, а также синус-лифтинг (СЛ). Среди них СФ продемонстрировал предсказуемость хирургического вмешательства для увеличения высоты кости в боковом отделе верхней челюсти.
Обзор литературы по этой теме приводит к обилию информации, расхождениям во мнениях и даже отсутствию консенсуса. Хотя настоящий обзор не содержит новых данных по этому распространенному клиническому сценарию, его цель - оценить текущую опубликованную информацию, чтобы дать представление о принятии решений относительно методов СЛ и соответствующих трансплантационных материалов и биопрепаратов.
Методы синус-лифтинга
Наиболее распространенными методами СЛ являются метод латерального окна (МЛА) и транскрестальный метод (ТКМ). Оба подхода предполагают установку костных трансплантатов в пространство, образовавшееся в результате поднятия дна пазухи. Сообщалось, что результаты успешности процедуры и выживаемости имплантатов были значительно выше.
Метод латерального окна
При использовании подхода МЛА, впервые примененного доктором Hilt Tatum, Jr. в 1970-х годах и впервые опубликованного Boyne и James в 1980 году, полнослойный лоскут приподнимают, чтобы обнажить боковую стенку верхнечелюстной пазухи. Доступ к верхнечелюстной пазухе достигается путем создания окна в латеральной стенке пазухи с сохранением целостности мембраны пазухи. Техника «неполного перелома» предполагает отделение костного островка, чтобы переместить его в качестве крыши, чего невозможно добиться в узких пазухах. Техника «wall-off» позволяет полностью удалить костный островок, в результате чего обеспечивается лучший доступ к пазухе.
Было показано, что пьезоэлектрическая хирургия для подготовки латерального окна и разъединения мембраны снижает количество интраоперационных осложнений по сравнению с ротационными инструментами. Основными преимуществами пьезоэлектрического устройства являются избирательное режущее действие на минерализованную ткань и то, что достигаемая им точная остеотомия улучшает хирургический контроль. После обнажения мембрану пазухи отделяют от костных стенок с помощью элеваторов и/или тупых пьезоэлектрических наконечников, стараясь не допустить перфораций и чрезмерного растяжения за пределы области, запланированной для костной аугментации. Это позволяет установить трансплантационный материал во вновь созданный участок. В местах с достаточной высотой альвеолярной кости, обычно от 3 мм до 5 мм, возможна одновременная установка имплантатов (т.е. «одноэтапная» техника). После поднятия мембраны пазухи во вновь созданный участок помещают выбранный костный трансплантат, а затем, при наличии показаний, устанавливают имплантат. Перед ушиванием лоскута на костное окно можно наложить коллагеновую мембрану, особенно если окно относительно большое. Альтернативой является поэтапная процедура, когда кость наращивают во время первого хирургического вмешательства, а затем устанавливают дентальные имплантаты после создания соответствующего объема кости (т.е. «двухэтапная» техника).
Выбор материала для костного трансплантата при аугментации дна гайморовой пазухи обычно обусловлен техническими предпочтениями и анатомическими факторами. Аугментация дна верхнечелюстной пазухи без трансплантата считается приемлемой альтернативой с удовлетворительными результатами. Этот подход требует одновременной установки имплантатов, выступающих в полость пазухи, чтобы накрыть шнейдеровскую мембрану и тем самым создать достаточное пространство для образования кровяного сгустка.
Предполагается, что мембрана пазухи обладает остеогенным потенциалом, вызывая образование новой кости вокруг установленных имплантатов. Самопроизвольное образование костной ткани до 2-3 мм в пазухе после синус-лифтинга было подтверждено в исследованиях на животных. Однако количество новой костной ткани уменьшается по мере увеличения длины выступа имплантата при СЛ без трансплантационного материала. Чтобы справиться с этим ограничением, при СЛ обычно показано использование костных трансплантатов для обеспечения достаточного пространства между мембраной пазухи и дном полости пазухи. Считается, что материал трансплантата улучшает первичную стабильность, обеспечивая больше субстрата для фиксации имплантата.
Было показано, что при использовании метода МЛА высота кости увеличивается на 8-10 мм. Однако такой подход часто связан со значительной заболеваемостью пациентов. Он требует использования широкого мукопериостального лоскута с как минимум одним вертикальным разрезом для создания костного окна в латеральной стенке, что может привести к повышенному риску послеоперационной боли, отека лица, задержки заживления, кровотечения и послеоперационной инфекции.
Метод транскрестального окна
Подход ТКМ был представлен Tatum в 1976 году и модифицирован Summers в 1994 году. В отличие от МЛА, где необходимо проводить остеотомию буккальной костной пластинки, ТКМ предполагает гребневой подход к мембране пазухи через просверленное ложе имплантата. При этом дно пазухи подвергается дроблению с помощью набора остеотомов все большего диаметра, что позволяет приподнять дно пазухи и увеличить плотность окружающей верхнечелюстной кости, что приводит к лучшей первичной стабильности имплантатов, чем при МЛА.
После обнажения области остеотомии путем поднятия гребневого лоскута или использования беслоскутной техники, 2-миллиметровым спиральным сверлом создают пилотное отверстие на расстоянии 1 мм от дна пазухи. Остеотомию расширяют на 0,5-1,2 мм меньше размера планируемого имплантата с помощью остеотома или серии остеотомических сверл. Затем частицы трансплантата вводят в область остеотомии и продвигают к пазухе с помощью легкого сверления. Перелом дна пазухи можно определить по изменению сопротивления между остеотомом и костью или по изменению звука сверления. Остеотом не следует продвигать в пазуху, так как это повышает риск перфорации мембраны. Объем достижимого синус-лифтинга во многом зависит от опыта хирурга из-за закрытого подхода и ограниченности обзора. Важным недостатком трансальвеолярного подхода является возможность непреднамеренной перфорации мембраны пазухи. Это может быть чревато серьезными осложнениями, если частицы трансплантата попадут в антральную полость и вызовут закупорку устья, что может привести к хроническому риносинуситу.
Однако исследование с использованием интрасинусальной эндоскопии показало, что при тщательном выполнении ТКМ дно пазухи можно приподнять на 5 мм без перфорации мембраны. Поскольку эта техника в основном выполняется без визуализации, возможности для обнаружения перфораций ограничены. В таких случаях высота подъема не должна превышать в среднем 3 мм. В случае, если в результате неожиданной перфорации мембраны синуса при крестальном подходе требуется лучшая визуализация, лечащие врачи должны уметь выполнять оба протокола (крестальный и латеральный).
ТКМ – менее инвазивный метод лечения, чем МЛА, с более коротким периодом проведения операции и меньшим послеоперационным дискомфортом. Кроме того, большинство процедур ТКМ проводят одновременно с установкой имплантатов, что сокращает общее время лечения. По результатам сетевого мета-анализа было показано, что ТКМ превосходит МЛА в местах с остаточной высотой кости (ОВК) от 4 мм до 8 мм. Результаты исследования показали, что МЛА не подходит для пациентов с промежуточной ОВК из-за неоправданного увеличения числа осложнений и финансовых затрат.
Показания к применению техники синус-лифтинга
В ретроспективном исследовании, длившемся от 6 до 20 лет, было показано, что имплантаты с менее чем 3 мм предоперационной ОВК до СЛ имели более низкую выживаемость, чем имплантаты с 3 мм и более предоперационной ОВК. Если ОВК превышает 6 мм, наиболее показано проведение ТКМ. Если ОВК составляет от 4 до 6 мм, то при относительно здоровом состоянии пазухи рекомендуется использовать ТКМ, в то время как латеральный подход предпочтительнее, если целостность пазухи и мембраны нарушены (например, при незначительном, около 2 мм, утолщении мембраны пазухи, кистах). Если ОВК составляет от 2 до 4 мм, латеральный подход будет более удобной альтернативой. Кроме того, латеральный подход рекомендуется при широких (или слишком резких) контурах верхнечелюстной кости и наличии перегородки в области подъема, так как потенциал растяжения мембраны пазухи будет относительно неблагоприятным, а хирургические трудности и риски относительно высокими.
Техники ТКМ
Обычные методы создания доступа к пазухам включают использование остеотомов, ротационных инструментов, комбинации остеотомов и трепанационных боров, а также пьезоэлектрических инструментов. Механическое (гидравлическое) давление для отсоединения мембраны пазухи от дна пазухи может быть создано различными средствами, включая остеотомы, комбинацию остеотомов и биоматериалов для трансплантации, трепанированный костный стержень плюс биоматериалы для трансплантации, пьезоэлектрические вставки с внутренней ирригацией, введение жидкости через канал внутри корпуса имплантата, а также надувные приспособления.
С 2003 года модификации оригинальной техники ТКМ позволяют отказаться от использования ручного молотка и направлены на повышение удобства для пациента и снижение риска осложнений. При установке верхнечелюстных зубных имплантатов с помощью остеотома травма, вызванная перкуссией, а также гиперэкстензия шеи во время операции могут смещать отолиты, как сообщалось в некоторых исследованиях, и провоцировать доброкачественное пароксизмальное позиционное головокружение, которое может стать причиной утраты трудоспособности и вызвать значительный стресс у пациента.
ТКМ обычно связывают с низкой интра- и послеоперационной заболеваемостью, а использование сверл может привести к значительно меньшему дискомфорту пациента во время операции и значительно большему доверию пациента по сравнению с остеотомами. Более того, замена ручных инструментов, таких как остеотомы и ручной молоток, на инструменты с электроприводом, такие как пьезоэлектрические насадки и электромагнитный молоток, может еще больше снизить заболеваемость при неизменных реконструктивных возможностях последних.
Техника поднятия мембраны пазухи с помощью баллона
Техника поднятия антральной мембраны с помощью баллона позволяет поднять мембрану пазухи с минимальной травмой и особенно удобна в труднодоступных местах. Такой подход эффективен, когда зубы соседствуют с беззубым участком, требующим аугментации. Первоначальная последовательность сверления такая же, как и при подготовке ложа имплантации в обычном гребне кости, не требующем аугментации синуса, а при доступе к мембране синуса через место остеотомии вводят гидравлический подъемник с легким давлением. Обычно используют трубку, соединенную с воздушным баллоном с помощью шприца, наполненного стерильным физиологическим раствором, и при нажатии на плунжер баллон раздувается и, соответственно, приподнимает мембрану. Поскольку физраствор не наносит вреда при введении в пазуху, при использовании этой методики баллон необязателен. Преимуществами протокола с антральным баллоном являются низкая частота инфекций и кровотечений, а также низкий риск перфорации мембраны синуса.
Опосредованная ротационным инструментом оссеоденсификация при ТКМ
Остеоденсификация (ОД) – это новая хирургическая техника подготовки места установки имплантата, которая позволяет сохранить кость с помощью специально разработанных боров. Боры используют со стандартным хирургическим мотором, и они способны уплотнять кость, вращаясь в нережущем направлении (против часовой стрелки со скоростью 800-1200 оборотов в минуту) или сверлить кость, вращаясь в режущем направлении (по часовой стрелке со скоростью 800-1200 оборотов в минуту) с обильной ирригацией.
В отличие от традиционных методов сверления, эта новая методика предлагает инновационный подход к уплотнению кости за счет контролируемой деформации путем контакта внутренней поверхности ложа для установки имплантата с вращающимися поверхностями бора для денсификации. Деформация костей происходит по вязкоупругим и пластическим механизмам. Обильное количество ирригационной жидкости во время процедуры обеспечивает смазывание поверхности бора и кости во избежание перегрева.
ОД зарекомендовала себя с точки зрения значительно более высоких показателей момента установки имплантата и первичной стабильности по сравнению со стандартным субтрактивным сверлением. В недавнем систематическом обзоре сообщалось, что ОД обеспечивает неизменно более высокий коэффициент стабильности имплантата на исходном уровне и через 4-6 месяцев после установки имплантата по сравнению с традиционным сверлением. При подготовке места установки с помощью ОД ложе для имплантации постепенно расширяется как в латеральном, так и в верхушечном направлении, что позволяет использовать его не только для расширения гребня, но и для ТКМ безопасным, предсказуемым способом с пониженной заболеваемостью.
После проникновения в дно пазухи в процессе сверления без уплотнения кости и введения ирригационного раствора и аутогенной костной стружки/трансплантата производят гидравлическую отслойку мембраны пазухи и последующее поднятие. Несмотря на то, что ОД показала хорошие результаты при синус-лифтинге в случаях со сниженной ОВК, в литературе до сих пор не установлена минимальная высота кости для безопасного использования этой техники.
Данный подход менее травматичен, чем обычное сверление, что приводит к увеличению плотности костной ткани вокруг имплантатов и сокращению времени заживления. Клиническое исследование показало, что ОД и МЛА одинаково эффективны при СЛ с одновременной установкой имплантатов, когда ОВК составляет 4 мм или менее. Однако ОД значительно превосходила МЛА по уровню болевых ощущений, влиянию на воспринимаемое качество жизни, продолжительности операции, послеоперационному отеку и уровню приема анальгетиков.
Гидродинамический пьезоэлектрический синус-лифтинг
При пьезоэлектрическом синус-лифтинге используется пьезоэлектрическая ультразвуковая вибрация (25-30 кГц); пьезохирургический прибор прецизионно рассекает только минерализованные структуры (кость), не рассекая мягкие ткани (мембрану), которые не повреждаются при случайном контакте. СЛ выполняют с помощью инструмента с круглой головкой, что позволяет избежать перфораций. На круглой вставке с 2-миллиметровыми интервалами нанесены линии, указывающие глубину, для точного измерения остаточной высоты кости от альвеолярного гребня до дна пазухи. Кроме того, пьезоэлектрический наконечник имеет набор стопорных манжет с 2-миллиметровыми интервалами для предотвращения случайной перфорации мембраны при приближении к дну пазухи.
После введения в дно пазухи наконечник удерживается в ложе для имплантации, оказывая гидравлическое давление на мембрану пазухи в течение дополнительных 10-20 секунд. В большинстве случаев с помощью этой процедуры мембрану пазухи легко удается приподнять. Затем цилиндрический наконечник шириной 2,8 мм используют для латерального расширения ложа для имплантации, а приподнятие слизистой оболочки пазухи обеспечивают с помощью гидравлического давления. После извлечения наконечника из ложа для имплантации хирург может наблюдать за движением мембраны пазухи вверх-вниз во время дыхания. Цилиндрический наконечник - это окончательный наконечник для формирования ложа, в который помещают конический имплантат шириной от 3,7 до 4,2 мм для обеспечения хорошей первичной стабильности.
Пьезохирургический прибор обеспечивает чистое операционное поле и отсутствие крови во время подготовки места операции; это происходит благодаря эффекту воздушно-водяной кавитации ультразвукового инструмента. Было показано, что пьезоэлектрический СЛ снижает частоту перфорации мембраны.
Магнитодинамическая технология
В 2012 году компания Crespi представила электромагнитный молоток для проведения хирургических операций в полости рта (Фото 1). Магнитный молоток — один из нескольких инструментов, используемых для подготовки остеотомии имплантатов и синус-лифтинга. Это новое хирургическое изделие, предназначенное для нанесения контролируемого высокоинтенсивного удара за очень короткий промежуток времени. Магнитодинамическая технология использует физические принципы электромагнетизма для приложения контролируемых сил к поверхности при минимизации времени удара. Считается, что такое максимальное усилие, достигаемое за короткое время удара, сводит к минимуму образование ударной волны. Удар, наносимый магнитным молотком, настолько быстр, что при трении выделяется лишь небольшое количество тепла, что исключает необходимость ирригации зоны воздействия. Это улучшает видимость, помогает избежать потери биологических веществ из-за ирригации, тем самым повышая стабильность имплантата за счет уплотнения кости вокруг ложа для имплантации.
Фото 1. Электромагнитный молоток.

Магнитный молоток включает в себя наконечник, питающийся от изделия с регулируемой мощностью, передающий усилие в зависимости от времени приложения, что снижает выделение тепла и благоприятно воспринимается костью. К наконечнику могут быть прикреплены различные насадки, подающие ударную волну на его кончик. Доступны четыре режима силы: 75, 90, 130 и 260 даН (деканьютонов). Время удара составляет 80 микросекунд. Магнитный импульс, создаваемый в наконечнике, приводит инструмент в действие с силой, в 10 раз превышающей силу, создаваемую ручными изделиями, при этом время воздействия практически сводится к нулю. Контроль и стабильность прилагаемых усилий повышают безопасность для пациентов и хирургов.
Гидравлический синус-лифтинг
Для снижения частоты перфорации мембраны было предложено использовать контролируемое гидравлическое давление для отслоения шнейдеровской мембраны от костных стенок пазух. Этот метод можно применять как при открытом, так и при закрытом синус-лифтинге. Он предполагает получение доступа к шнейдеровской мембране посредством крестальной или латеральной остеотомии и применение гидравлического давления с помощью прямого потока воды из наконечника, при этом рентгеноконтрастное вещество, такое как физраствор или вода, вводят под мембрану с помощью специально разработанных инжекторов или насосов. Как только мембрана будет отслоена от стенок пазухи, через остеотомию аккуратно вводят трансплантат и уплотняют его, чтобы увеличить объем гребня.
Гидравлический метод синус-лифтинга можно безопасно использовать для приподнятия большего участка шнейдеровской мембраны, что приводит к снижению частоты перфорации мембраны по сравнению с традиционным интракрестальным СЛ. Это также позволяет пересадить большой объем трансплантата, что может привести к улучшению стабильности имплантата. Этот метод требует навыков высокого уровня, поэтому его клиническое применение по-прежнему ограничено. Данные, подтверждающие эффективность и успешность этой методики, в основном основаны на сериях случаев, и рандомизированных клинических исследований, сравнивающих процедуру гидравлического синус-лифтинга с традиционными открытыми или закрытыми методами синус-лифтинга, не проводилось.
Другие ТКМ, опосредованные ротационным инструментом
Преимущество ротационного инструментального ТКМ, также известного как крестальный подход, перед остеотомией заключается в возможности проникновения в полость пазухи, что снижает риск перфорации мембраны и минимизирует дискомфорт для пациента. Хотя все методы крестального доступа рекомендуется использовать в сочетании с немедленной установкой имплантатов после синус-лифтинга при остаточной высоте кости от 5 мм до 6 мм, случаи использования крестального подхода при остаточной высоте кости меньше этого показателя также успешно поддаются лечению.
В 1994 году Cosci начал 6-летнее ретроспективное исследование своей методики на 265 имплантатах с использованием первых описанных ротационных инструментов, специально разработанных для СЛ с крестальным доступом. Процедура выполняется с помощью боров для синус-лифтинга с плоским концом длиной от 1 мм до 8 мм в сочетании с крестальными ограничителями. На сегодняшний день на рынке доступны различные наборы для транскрестального синус-лифтинга по методике Cosci. Они предназначены для использования с наконечником для имплантатов и включают в себя боры без режущих поверхностей.
При этом методе дно пазухи достигают с помощью трепана трефином, как показано на конусно-лучевой компьютерной томографии (КЛКТ), и перфорируют с помощью бора для синус-лифтинга на 1 мм больше, чем глубина, достигнутая основным бором. После формирования ложа для имплантации инструмент с тупым наконечником используют для тщательного зондирования и определения соотношения мембраны пазухи и дна пазухи. Если определяется наличие кости, используют атравматическое сверло для синус-лифтинга на 1 мм длиннее, и так далее, пока не будет достигнута выстилка пазухи. Убедившись, что дно удалено, выполняют маневр Вальсальвы, чтобы убедиться в целостности мембраны. Это делается с помощью стоматологического зеркала, позволяющего наблюдать за потоком воздуха или пузырьками из ложа для имплантации, указывающими на перфорацию.
Целостность мембраны можно оценить визуально с помощью зеркала, если толщина кости составляет всего несколько миллиметров, а пазуха расположена ближе к гребню. Если перфорация не выявлена, врач может приступить к поднятию мембраны и размещению трансплантата. Самым простым способом поднятия мембраны является введение самого костного трансплантата. Трансплантационный материал осторожно помещают в небольшом количестве в ложе для имплантации с помощью остеотомов, аккуратно постукивая молотком, и продвигают на глубину дна пазухи, но не глубже. Объем необходимого костного трансплантата определяется величиной необходимого поднятия. Рентгенографическая проверка на этом этапе может помочь в определении объема подъема кости. Установка имплантата придаст дополнительный объем, так как он сдвинет трансплантат в направлении верхушки.
Модифицированный метод использования трепана/остеотома
Модифицированный подход с использованием трепана/остеотома облегчает СЛ с использованием остеотома для поднятия основной части остаточного цилиндра альвеолярной кости, полученной с помощью трепана, проводимого на расстоянии 1-2 мм от дна пазухи, вместо сверла, в качестве первого этапа. Трепан используют с пониженной скоростью вращения для подготовки участка в пределах от 1 мм до 2 мм от мембраны пазухи. Затем с помощью калиброванного остеотома, соответствующего диаметру трепанационного сверла, под мягким надавливанием трепанационную костную массу поднимают на глубину, примерно на 1 мм меньшую, чем отпрепрарироанный участок. Самый широкий остеотом должен быть на один размер меньше диаметра планируемого имплантата. Установка имплантата вызывает латеральное перемещение приподнятой массы альвеолярной кости с мягким и контролируемым смещением.
Методика местного управления дном пазухи
Когда рассматривается возможность немедленной установки имплантатов для зубов, расположенных в непосредственной близости от дна пазухи, обычно применяют двухэтапный подход. Во многих случаях первым этапом является удаление зуба с последующим сохранением гребня с использованием биоматериалов или без них. К установке имплантата обычно приступают после соответствующего периода заживления.
Установка имплантатов в свежих лунках после удаления зуба и одновременное поднятие дна верхнечелюстной пазухи значительно сокращает общее время лечения и позволяет установить имплантаты, превышающие предоперационные размеры кости по длине и ширине, что можно считать достаточным для замещения многокорневых моляров верхней челюсти.
Методика местного управления дном пазухи (МУДП) – это использование принципов техники наращивания беззубого гребня. В одной операции сочетаются поднятие дна верхнечелюстной пазухи, буккальное расширение остаточной альвеолярной кости и установка имплантатов. Как и в методики наращивания беззубого гребня, регенерация кости и остеоинтеграция имплантата происходят одновременно. Концепция МУДП может быть реализована в лунках свежеудаленных моляров, что позволяет устанавливать имплантаты с широким телом непосредственно в лунку моляра верхней челюсти для получения первичной стабильности в межкорневой перегородке. Это хирургическое вмешательство обеспечивает горизонтальное расширение пустых корневых пространств и вертикальное расширение межкорневой перегородки, которая обычно присутствует в небной кости, покрывающей небный корень и выстилающей дно пазухи.
Межкорневая костная перегородка представляет собой идеальное место для немедленной установки имплантатов в задней части верхней челюсти; в некоторых случаях недостаточные размеры межкорневой костной перегородки могут поставить под угрозу проведение процедуры МУДП. Морфологическое исследование анатомических структур, КЛКТ и соответствующее программное обеспечение являются ключевыми инструментами для планирования точного положения имплантата и проведения хирургической навигационной операции имплантации зубов.
Рекомендуемая методика в этом контексте – ОД с использованием хирургических боров с применением насосных движений с обильной ирригацией для устранения перегрева. Нагнетание жидкости в сочетании с высокоскоростным вращением против часовой стрелки вызывает гидродинамическую волну, называемую волной сжатия, перед точкой контакта. Это повышает первичную стабильность, минеральную плотность кости и процентное содержание костной ткани на поверхности имплантата по сравнению со стандартным и экстракционным сверлением.
Модифицированная техника местного управления дном пазухи в лунках свежеудаленных моляров
После удаления зуба, щечного расширения остаточной кости перегородки, поднятия дна гайморовой пазухи и установки имплантата, модифицированная методика МУДП в лунках свежеудаленных моляров предусматривает дополнительную процедуру, которая выполняется после установки имплантата. При этой процедуре костный трансплантат и имплантат слегка приподнимают в пазухе с помощью электромагнитного молотка, чтобы достичь дополнительного СЛ до 5 мм без перфорации мембраны.
После атравматичного удаления моляра выполняют сверление с помощью цифрового хирургического шаблона. Затем проводят формирование ложа для имплантации на 2 мм меньше желаемой ширины имплантата, но на 1 мм ниже дна пазухи (Фото 2). В этом случае рекомендуется использовать остеоденсифицирующие боры для формирования ложа (Фото 3). Затем исползуют трепан со сниженной скоростью вращения, чтобы подготовить основу вокруг ложа, но на 1 мм ниже дна пазухи (Фото 4). Затем магнитный молоток аккуратно, с контролируемым усилием, обрушивает дно пазухи в полость пазухи, поднимая мембрану пазухи на 2-3 мм вместе с костным фрагментом и материалом костного трансплантата, помещенным в место остеотомии (Фото 5). Минимально инвазивный и удобный в использовании магнитный молоток обеспечивает заданное усилие за оптимальное время.
Фото 2. Пилотное сверло вводится на 1 мм ниже дна верхнечелюстной пазухи у перегородки моляра.

Фото 3. Оссеоденсифицирующие боры используют по часовой стрелке со скоростью 800-1200 оборотов в минуту, чтобы достичь глубины 1 мм под дном пазухи.

Фото 4. Трепан используют на 1 мм ниже дна пазухи.

Фото 5. Затем для проведения СЛ используют магнитный молоток.

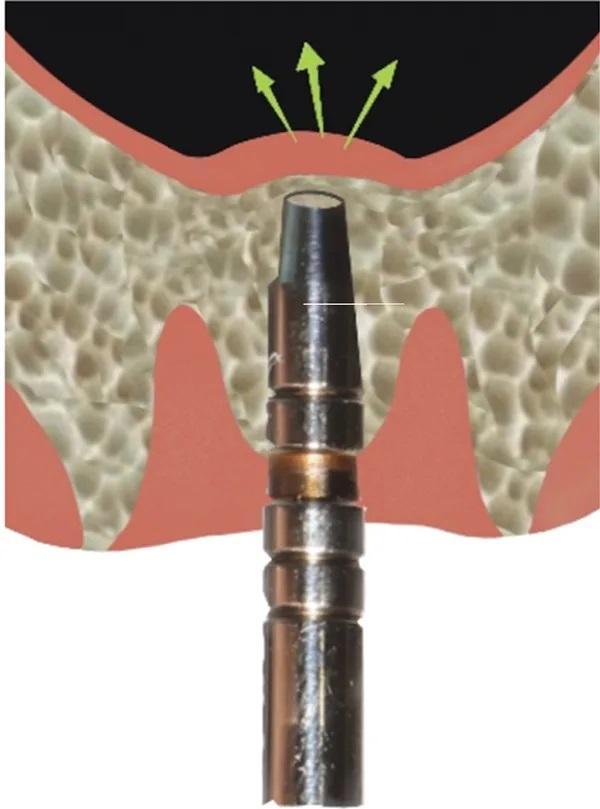
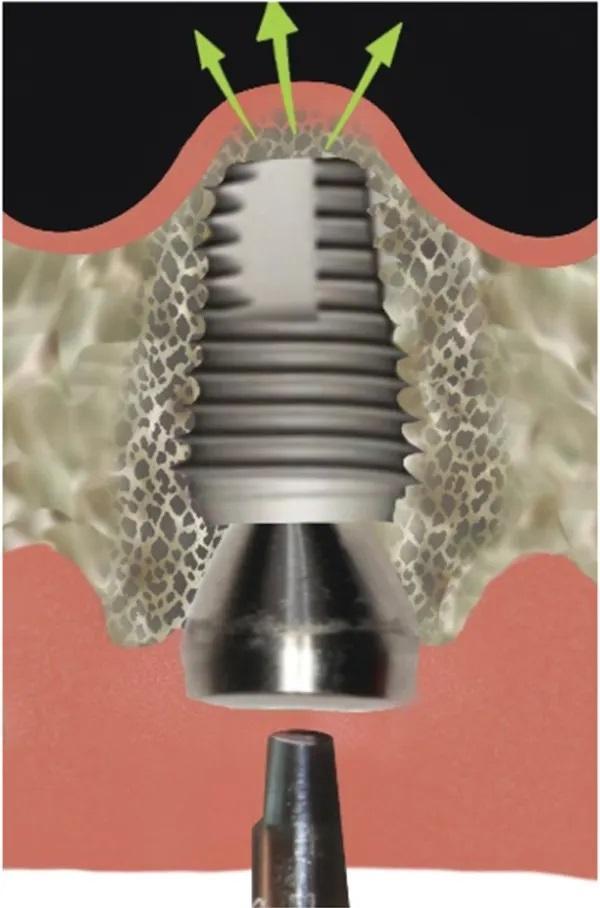
Устанавливают имплантат определенного размера, первичная стабильность оценивают с помощью динамометрического ключа (Фото 6). Для предотвращения случайного смещения имплантата в пазуху во время начального периода остеоинтеграции на имплантат устанавливают формирователь десны с широким профилем. Постукивание по верхушке формирователя десны в вертикальном направлении с помощью магнитного молоточка в режиме наименьшей силы позволяет провести СЛ на дополнительные 3-5 мм (Фото 7).
Фото 6. Устанавливают имплантат, еще больше приподнимая дно пазухи.

Фото 7. Вживление костной ткани в имплантат.

Пример клинического случая
Пациент, 68 лет, обратился с жалобами на чувствительность эндодонтически пролеченного зуба (1.6) в правом боковом отделе верхней челюсти. Он искал долгосрочное решение для облегчения боли и чувствительности. Пациент сообщил, что боль носила периодический характер с момента эндодонтического лечения зуба. Для оценки ситуации была выполнена периапикальная рентгенограмма (Фото 8). Между зубами 1.7 и 1.6 была отмечена потеря костной ткани. Была отмечена значительная глубина зондирования между двумя молярами, и пациент был проинформирован о возможном вертикальном переломе корня зуба 1.6.
Фото 8. Зубы 1.7 и 1.6 были безнадежны из-за потери костной ткани пародонта между ними.

Были обсуждены варианты лечения, и пациент заявил, что из-за сохраняющейся чувствительности при жевании он хотел бы удалить зуб 1.6. Поскольку зуб 1.7 имел значительную потерю костной ткани с мезиальной стороны, было решено удалить оба зуба 1.7 и 1.6 и установить имплантат только на место зуба 1.6. Пациента проинформировали о том, что для обеспечения достаточного количества костной ткани для опоры имплантата потребуется крестальная аугментация пазухи, которая будет проведена одновременно с установкой имплантата. Пациенту было проведено сканирование с помощью внутриротового сканера и КЛКТ для изготовления хирургического шаблона.
Пациент явилась на прием к хирургу, и после ознакомления и подписания форм согласия была введена местная анестезия. Лезвием скальпеля №15 была отсечена маргинальная десна, и был поднят полнослойный слизисто-надкостничный лоскут. Зуб 1.6 был рассечен на две части с помощью хирургического бора 557 с обильным орошением стерильным физраствором. Зуб удалили двумя частями с помощью элеватора и щипцов, также был удален зуб 1.7. Лунки были орошены стерильным физиологическим раствором, а для синус-лифтинга в области зуба 1.6 был использован интракрестальный подход с помощью системы постукивания молотком. Материал костного трансплантата (аллотрансплантат AlloOss [смесь 50/50], Ace Southern) был смешан с материалом аллотрансплантата (DirectGen Mineralized Cortical/Cancellous Particulate, 250-1000 мкм 1,0 куб. см, Implant Direct), который был смешан с кровью, а затем размещен для проведения синус-лифтинга. В подготовленное ложе был установлен имплантат (ULT, 5 мм x 10 мм, Ditron Dental). Дополнительный трансплантационный материал был помещен для заполнения всех пустот вокруг имплантата, а также в лунку после удаления зуба 1.7. Был установлен формирователь десны шириной 3 мм, мягкие ткани были ушиты хромированным кетгутом 4-0. Затем была выполнена периапикальная рентгенограмма (Фото 9).
Фото 9. Модифицированная техника местного управления дном пазухи в лунке свежеудаленного первого моляра и сохранение лунки второго моляра.

Через 5 месяцев после непосредственной установки имплантата были получены окончательные оттиски, в зуботехнической лаборатории была изготовлена реставрация с винтовой фиксацией, которая была возвращена для установки. Пациент вернулся, формирователь десны был удален, а окончательная реставрация установлена и закручена в соответствии с рекомендациями производителя. Были выполнены рентгенограмма и клинические снимки (Фото 10 и Фото 11).
Фото 10. Завершенная реставрация на имплантате, установленном с помощью крестального синус-лифтинга, через 5 месяцев после установки имплантата.

Фото 11. Клинический окклюзионный вид имплантата с реставрацией в области первого моляра с проведением крестального синус-лифтинга при установке имплантата, через 5 месяцев после установки имплантата.

Трансплантационные материалы
Физиологические свойства костных трансплантатов и заменителей костной ткани часто определяют как остеоиндуктивные, остеокондуктивные и остеогенные. Остеоиндуктивность – это способность трансплантата активно способствовать формированию костной ткани. Остеокондуктивность – это характеристика каркаса, которая облегчает колонизацию и врастание костных клеток и васкуляризацию благодаря своей трехмерной структуре. Остеокондукция – это пассивный процесс, который определяется в первую очередь пористостью трансплантационного каркаса и в меньшей степени его химическими и физическими свойствами, стимулирующими адгезию и рост клеток организма-хозяина. Остеогенность означает наличие костеобразующих клеток в костном трансплантате. Ниже описаны различные материалы для костной пластики.
Аутотрансплантаты
Первым трансплантационным материалом для аугментации дна верхнечелюстной пазухи была аутогенная кость, полученная от пациента, которому проводилось лечение. Изначально предпочтение отдавалось аутогенным трансплантатам из-за меньшего риска отторжения организмом-хозяином, а также их остеоиндуктивных, остеокондуктивных и остеогенных свойств. Аутологичные трансплантаты – единственные трансплантаты с остеогенным потенциалом, поскольку они содержат остеогенные клетки внутри костного трансплантата. Среди трансплантационных материалов аутологичная кость по-прежнему считается золотым стандартом.
Хотя аутогенная кость обычно дает благоприятные результаты, ее использование в СЛ имеет два основных недостатка. Во-первых, необходимо забирать различное количество кости, обычно от 0,5 до 5 куб. см, из другого операционного участка. Это увеличивает время хирургического вмешательства и риск интраоперационных осложнений и послеоперационной заболеваемости. Во-вторых, высокая степень биодеградации (до 40%), связанная с частицами аутогенной кости, может превысить скорость образования новой кости в фазе консолидации и привести к неоптимальному результату увеличения объема костной ткани. Для преодоления этих недостатков различные биоматериалы использовались как отдельно, так и в сочетании с аутотрансплантатами в процедурах СЛ, чтобы задействовать свойства, присущие аутогенной кости, и одновременно с этим воспользоваться низкой скоростью резорбции некоторых костных заменителей для повышения объемной стабильности трансплантата. Хотя такой подход имеет биологический смысл, с клинической точки зрения ни один конкретный материал для костного трансплантата или их комбинация не показали явного превосходства при аугментации дна верхнечелюстной пазухи.
Заменяющие материалы
Среди остеокондуктивных материалов в стоматологической литературе описаны аллотрансплантаты (свежезамороженная кость, сублимированная кость, деминерализованная сублимированная кость), ксенотрансплантаты (бычьего, лошадиного или свиного происхождения) и аллопластические материалы (различные комбинации кальций-фосфата, биоактивных стекол или полимеров), способные усиливать остеогенез. Кроме того, в ряде исследований было показано, что эти биоматериалы могут не оказывать отрицательного влияния на клинические результаты и выживаемость имплантатов по сравнению с аутогенной костью. Таким образом, выбор материала является важным фактором, который следует учитывать.
Аллотрансплантаты-Аллотрансплантаты – часто используемая альтернатива аутогенной костной пластике и подходящий материал для стоматологических регенеративных процедур. К ним относятся СЛ, направленная костная регенерация (НКР), сохранение альвеолярного гребня для установки имплантатов и другие вспомогательные процедуры трансплантации в имплантологии. Основное преимущество аллотрансплантатов перед другими коммерчески доступными костнозамещающими материалами заключается во включении в них остеоиндуктивных факторов роста. В исследованиях доказана их эффективность в развитии новой костной ткани. Хотя аллотрансплантаты для замещения костной ткани популярны в США, во многих странах их использование в лечении пациентов строго регламентировано или запрещено. Сохраняются ограничения, связанные с риском передачи инфекционных заболеваний, таких как вирус иммунодефицита человека (ВИЧ) и гепатиты В и С. Эти опасения, как правило, можно устранить путем обработки тканей, например, стерилизации, механической очистки, ультразвуковой промывки и гамма-облучения трансплантационного материала в процессе обработки производителем.
Аллотрансплантаты успешно используются в сочетании с ксенотрансплантатами для процедур СЛ. В клинической практике наблюдается тенденция к использованию минерализованных костных аллотрансплантатов, которые обладают рентгеноконтрастностью и обеспечивают улучшенную остеокондуктивную основу для врастания и поддержки костной ткани. Минерализованные частицы могут быть получены их кортикальной, губчатой кости или представлять собой смесь этих двух форм. Они обладают более быстрым обменом и более физиологичным профилем резорбции, чем медленно рассасывающийся бычий костный минерал (ксенотрансплантат).
Ксенотрансплантаты. Ксенотрансплантаты считаются жизнеспособной альтернативой аутогенной кости благодаря их высоким остеокондуктивным свойствам и медленной скорости резорбции. В настоящее время на рынке костных заменителей доминирует множество ксенотрансплантатов бычьего происхождения. Различные способы манипуляций и очистки трансплантатов бычьего происхождения были представлены в коммерческих продуктах с различными характеристиками и биологическим поведением. Эти материалы хорошо сохраняются в пространстве и обладают высокой рентгеноконтрастностью, что помогает врачам определить материал в пазухе при установке.
В более ранних исследованиях ксенотрансплантатов была показана их клиническая стабильность и превосходная остеокондуктивность, а также возможность их использования в хирургических процедурах в полости рта, таких как СЛ. Ксенотрансплантаты служат матрицей и каркасом, способствующим миграции остеогенных клеток из окружающей кости верхнечелюстной пазухи в место трансплантации, что повышает способность к формированию новой кости. Перспективным материалом для ксенотрансплантации, изучаемым в настоящее время, является хитозан – полимер природного происхождения, получаемый из экзоскелетов моллюсков и состоящий из глюкозамина и N-ацетилглюкозамина.
Шелк – еще один новый материал для ксенотрансплантации, изучаемый в настоящее время. Шелк, натуральный биополимер, получаемый из шелкопряда Bombyx mori, состоит преимущественно из белков, фиброина и серицина. После удаления серицина путем дегумирования фиброин шелка широко используют в качестве костного каркаса в виде губки, волокон, пленки и гидрогеля. Фиброин шелка демонстрирует отличную биосовместимость, деградируемость, интеграцию в ткани, а также кислородную и водную проницаемость.
Несмотря на многообещающие перспективы, некоторые ограничения, связанные с использованием ксенотрансплантатов в качестве заменителей костной ткани, все еще сохраняются. К ним относятся различная скорость резорбции, отсутствие жизнеспособных клеток и биологических компонентов, а также необходимость обработки тканей, которая могла бы обеспечить сохранение остеоиндуктивных клеток.
Аллопласты. Для преодоления потенциальной иммуногенности и болезненности донорских участков изготавливаются искусственные синтетические костные заменители, в точности имитирующие биологические свойства натуральной кости. Эти материалы получают синтетическим путем или из натуральных материалов и перерабатывают. Тем не менее, имеющиеся в настоящее время синтетические материалы обладают лишь остеокондуктивными свойствами, обеспечивая основу для врастания и/или замещения новой кости. Для наращивания костной ткани пазух успешно используются различные виды аллопластических материалов, включая гидроксиапатит, сульфат кальция, фосфат кальция, биоактивные стекла, титановые гранулы и полимеры. Трикальцийфосфат был первым костным заменителем, использованным для костной пластики пазух. В будущем эти материалы могут быть адаптированы для создания клеточных конструкций и доставки факторов роста.
Биопрепараты
Биологические препараты определяются как естественные медиаторы восстановления тканей, которые регулируют клеточные явления в процессе заживления ран с помощью установленных механизмов действия. К ним относятся анаболическое костеобразование, ангиогенез, цементогенез, дифференцировка остеобластов, матричный митоз, хемотаксис и другие процессы, улучшающие среду заживления твердых и мягких тканей. Производное эмалевой матрицы, тромбоцитарный фактор роста (ТФР), костный морфогенетический белок (КМБ), богатая тромбоцитами плазма (БТП), богатый тромбоцитами фибрин (БТФ), фактор роста фибробластов (ФРФ), трансформирующий фактор роста (ТФР)-β1, эпидермальный фактор роста, фактор роста эндотелия сосудов (ФРЭС), инсулиноподобный фактор роста-I (ИПФ-I) и фактор роста гепатоцитов – наиболее распространенные биологические препараты, которые, как было показано in vitro и/или in vivo, способствуют формированию костной ткани для имплантации.
В 2022 году Американская академия пародонтологии в своем консенсусном заявлении о наилучших доказательствах пришла к выводу, что использование биологических препаратов при создании места для имплантата, включая горизонтальное/вертикальное наращивание альвеолярного гребня и СЛ с одновременной или отсроченной установкой имплантата, имеет ограниченные доказательства в пользу утверждения, что использование вышеуказанных биологических препаратов, как в качестве монотерапии, так и в сочетании с костно-пластическими материалами, дает лучшие клинические и рентгенографические результаты по сравнению с традиционными вмешательствами. Однако дополнительное использование этих биопрепаратов, по-видимому, приводит к благоприятным гистоморфометрическим результатам (т.е. образованию минерализованной ткани, наблюдаемому в биоптатах костной ткани).
Тромбоцитарные концентраты в регенеративной стоматологии
В стоматологической регенеративной терапии использование богатых тромбоцитами продуктов (например, БТП, БТФ и концентрированного фактора роста [КФР]), полученных из собственной крови пациента, в настоящее время представляется предпочтительным вариантом терапии. При активации тромбоциты образуют сеть в фибриновом матриксе и выделяют факторы роста, которые запускают процесс заживления ран через усиление клеточной адгезии, пролиферации и хемотаксиса. Первоначальная концепция, которая привела к созданию концентратов тромбоцитов, была представлена в конце 1990-х годов и заключалась в том, что концентрированные тромбоциты и аутологичные факторы роста могут быть объединены в растворы плазмы, которые затем могут быть использованы в месте хирургического вмешательства для содействия местному заживлению. Несмотря на противоречивые мнения, в целом считается, что высвобождаемые тромбоцитами факторы роста уменьшают воспаление, снижают риск осложнений и способствуют васкуляризации кости, что может быть особенно полезно в ситуациях, когда ожидаются плохие или ухудшенные результаты заживления (например, у пациентов с диабетом и остеопорозом). Кроме того, как сообщается, продукты, полученные из тромбоцитов, могут действовать как антибактериальные средства против Staphylococcus aureus и Escherichia coli. Еще одно преимущество некоторых биопрепаратов, в частности аутологичных продуктов, полученных из крови, таких как БТФ, заключается в том, что они улучшают манипуляционные свойства частиц костного трансплантата. Основными поколениями аутологичных тромбоцитарных концентратов являются БТП, БТФ и КФР.
БТП, первое поколение концентратов тромбоцитов, представляет собой плазму с высоким содержанием тромбоцитов, которая может быть получена путем центрифугирования венозной крови пациента и последующего использования ее в качестве материала для костного трансплантата. Из-за ограничений, связанных с антикоагулянтным составом БТП, дополнительные исследования Choukroun et al. в начале 2000-х годов были направлены на создание тромбоцитарного концентрата второго поколения, не содержащего антикоагулянтных факторов. Второе поколение концентратов тромбоцитов, БТФ, обладает теми же свойствами, что и БТП, но с дополнительным преимуществом – остеогенностью. Добавки в БТФ не требуются благодаря наличию фибриногена, который превращается в фибрин под действием физиологически доступного тромбина; это минимизирует риск послеоперационных осложнений. В то время как результаты применения БТФ для заживления мягких тканей, покрытия рецессии десны и регенерации пародонта хорошо описаны в литературе, использование БТФ при НКР и СЛ и его влияние на формирование кости вокруг имплантатов менее изучено. Тромбоциты являются естественным источником факторов роста, включая ТФР, ТФР-β1 и ТФР-β2, ФРФ, ФРЭС и ИПФ-I, которые стимулируют пролиферацию клеток, ремоделирование матрикса и ангиогенез.
Разработанный в 2011 году, КФР получают путем центрифугирования образцов крови с чередующимися и регулируемыми скоростями в специально разработанной центрифуге. Таким образом, тромбоциты концентрируются в гелевом слое, состоящем из фибринового матрикса, богатого факторами роста и лейкоцитами. КФР действует путем дегрануляции альфа-гранул тромбоцитов, которые играют жизненно важную роль в раннем заживлении ран. КФР содержит больше факторов роста, чем другие препараты на основе тромбоцитов, такие как БТФ и БТП, и, в отличие от БТП, КФР не рассасывается так быстро после наложения.
В то время как два основных фактора роста, одобренных Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США, ТФР и КМБ, полученные из рекомбинантных источников и созданные в бактериях или клетках млекопитающих, продаются за сотни долларов, факторы роста, полученные исключительно из аутологичного БТФ, доступны с помощью недорогих методов. Поэтому представляет интерес определить преимущество использования высоких супрафизиологических концентраций факторов роста в рекомбинантной форме (ТФР и КМБ) по сравнению с более низкими концентрациями в аутологичной форме (БТФ).
Хотя рекомбинантные белки обладают регенеративным потенциалом, который хорошо документирован в литературе, многие биологические ограничения для их использования (например, набухание, отек) в сочетании с их низкой стабильностью in vivo остаются сдерживающим фактором. Поэтому будущие исследования должны быть направлены на сравнение периода полураспада и биоактивности факторов роста, содержащихся в БТФ, с доступными в продаже рекомбинантными факторами роста.
Относительно новая концепция создания обогащенного факторами роста матрикса костного трансплантата с использованием аутологичного фибринового адгезива была описана Sohn et al. в 2015 году. «Липкая кость» представляет собой биологически затвердевший костный трансплантат, состоящий из смешанного гранулометрического состава (трифосфат кальция, ксенотрансплантаты и аллотрансплантаты дентина, полученные из удаленных зубов), окруженного фибриновой сетью.
Вывод
При выборе оптимального трансплантата для СЛ врачи должны оценить такие факторы, как болезненность донорского участка, объемная стабильность трансплантата, протокол нагрузки на имплантат, стоимость и пожелания пациента. «Избыточная аугментация» пазухи может быть клинически выгодна для компенсации уменьшения объема в процессе заживления независимо от выбора биоматериала, особенно при использовании двухэтапной процедуры. Однако положение и проходимость устья должны быть оценены до операции, чтобы избежать его ятрогенной закупорки в результате «переполнения» костным трансплантатом при аугментации пазухи. Это должно быть сделано с помощью КЛКТ-сканирования, чтобы выявить любые аномалии положения.
Количество доказательств для разработки надежных клинических рекомендаций по использованию средств и процедур для синус-лифтинга в повседневной практике все еще ограничено. Необходимы целенаправленные, хорошо спланированные долгосрочные исследования, оценивающие эффективность различных материалов для костного трансплантата и стратегий тканевой инженерии при аугментации верхнечелюстной пазухи, чтобы получить дополнительные знания, которые помогут врачам определить, какой хирургический протокол может дать наиболее благоприятные и предсказуемые результаты в конкретных клинических сценариях.
Авторы:
Gregori M. Kurtzman, DDS
Ole T. Jensen, DDS





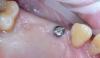
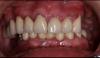

























































































































































0 комментариев