Цели проведения мягкотканной аугментации (пародонтальной пластической хирургии) в пародонтологии являются крайне разнообразными. Данная процедура используется для возобновления мягкотканного покрытия корня до уровня цементно-эмалевой границы в эстетических целях, для снижения температурной чувствительности, для защиты тканей от чрезмерной редукции путем истирания, для формирования надлежащего визуального профиля составляющих элементов улыбки. Кроме того, пародонтальная пластическая хирургия позволят сформировать достаточный объем кератинизированных десен, минимизировать натяжения со стороны уздечки и тяжей слизистой, минимизировать уровень пародонтального зондирования, скорректировать симптомы кровотечения и уменьшить ощущения дискомфорта. По отношению к процедуре возобновления покрытия корней существуют специфические ограничения, которые аргументированы морфологией мягких тканей – так, например, внешний профиль слизистой всегда будет ниже уровня межзубных сосочков, а при изменении уровня самих сосочков довольно сложно спрогнозировать все последствия ятрогенных вмешательств. Поэтому в случаях развития интерпроксимальных рецессий добиться полного восстановления мягкотканого покрытия корня попросту невозможно. Наиболее прогнозированными являются такие ятрогенные вмешательства, которые выполняются при наличии как минимум 3 мм мезио-дистальной ширины сосочка между двумя смежными корнями.
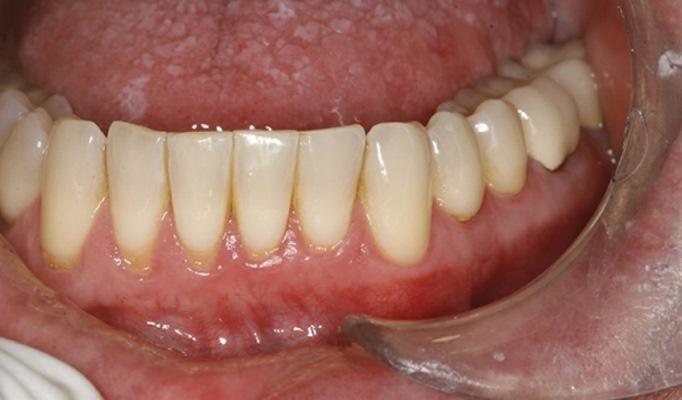
Тем не менее, в другом исследовании полученные результаты были полностью противоположными. Такое несоответствие может быть спровоцировано различиями в применении разных пародонтологических протоколов вмешательства. Описанная в данной статье модифицированная техника аугментации десен с формированием бороздкового доступа отличается от всех вышеупомянутых за счет дополнительного использования фибрина, обогащенного тромбоцитами (PRF). Опыт авторов относительно применения соединительнотканного трансплантата был аналогичен результатам, описанным в исследовании Chao. В то же время техника формирования точечного доступа, также описанная в публикации Chambrone, продемонстрировала достаточно перспективные результаты в отношении восстановления множественных рецессий. В обеих исследованиях результаты, полученные на верхней челюсти, были несколько выше таковых на нижней. При этом методы обработки самой поверхности корня (посредством дериватов эмалевой матрицы, лазеров или тетрациклина) в общем не обеспечивают никакого дополнительного клинического результата по отношению к восстановлению мягкотканного покрытия посредством соединительнотканного трансплантата. Несмотря на это, эффект методов обработки поверхности корня может иметь влияние на уровень развития постоперационного дискомфорта, а также на изменения в области мягких тканей на гистологическом уровне. Применение PRF демонстрирует позитивные результаты в отношении уменьшения времени заживления и снижения уровня постоперационного дискомфорта. При этом долгосрочный эффект использования PRF целенаправленно на восстановление мягкотканного покрытия корня остается недостаточно изученным.
В данной статье мы детально опишем технику аугментации десен SMILE (Sulcular Modified Internal Labial Enhancement), которая предусматривает применение туннельного доступа, ксенографта и PRF, и при этом требует гораздо меньшего инструментального обеспечения по сравнению с другими методами пародонтологических вмешательств.
Протокол вмешательства
Как и в случаях других методов восстановления мягкотканного покрытия корней, первый этап вмешательства состоит, конечно же, в тщательной очистке поверхности корня. Данную очистку можно провести посредством ручных инструментов или их ультразвуковых аналогов. Все ошурки с поверхности корня, полученные в ходе обработки, должны быть тщательно удалены, а конечная форма поверхности должна быть гладкой и чистой. Кроме того, должен присутствовать плавный переход с поверхности корня на поверхности вестибулярной эмали. При наличии предварительно выполненных композитных реставраций в проекции области вмешательства их следует удалить. Процедуру очистки лучше всего проводить перед этапом формирования туннельного доступа, поскольку в таких условиях операционное поле является более сухим, а следовательно – менее контаминированным. В случаях же обнажения слишком огромной площади поверхности корня или же при чрезмерно огромных размерах рецессии в мезио-дистальном направлении, иногда сначала требуется сформировать туннельный доступ, который и позволит обеспечить надлежащую полную очистку проблемной области корня. После этого проводят послабление мягких тканей с внешней стороны зубов. Данную манипуляцию начинают выполнять в области зубодесневой бороздки посредством бороздково-сосочкового элеватора, разработанного доктором Ансоном (H&H Company, hhcompany.store) (фото 1). Острый инструмент вставляют в область межзубных мягких тканей и проводят аккуратную сепарацию полнотканного лоскута, двигаясь к медиальному и дистальному сосочкам так, чтобы инструмент мог войти в области одного зуба и выйти в области другого (фото 1). После этого долотом Fedi продолжают сепарацию тканей в области бороздки, стараясь при этом никоем образом не разорвать ткани сосочка (фото 2).
Фото 1. Сепарация тканей при помощи бороздково-сосочкового элеватора.
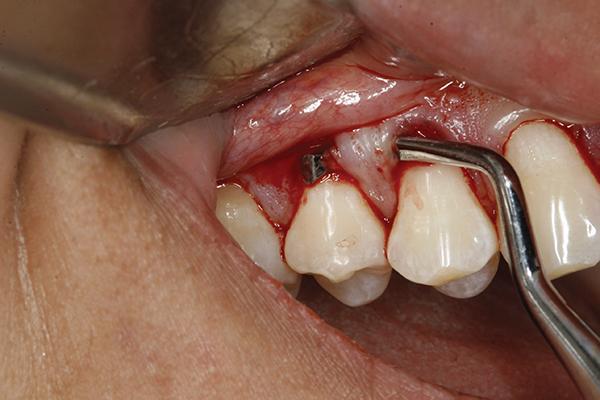
Фото 2. Более глубокая сепарация тканей при помощи долота Fedi.
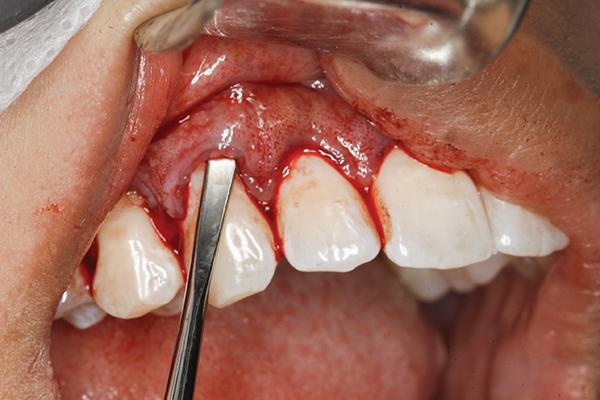
По сути, проводиться полнотканная сепарация лоскута, однако, когда долото достигает области переходной слизистой, происходит трансформация манипуляции в сепарацию неполного лоскута. После послабления тканей формируют небольшой разрез приблизительно на 5-6 мм длины в проекции преддверия полости рта над областью клыка (фото 3). При проведении вмешательства в области передних зубов обычно еще проводят один дополнительный разрез в области уздечки, дабы послабить ее натяжение. Затем при помощи долота Fedi проводят сепарацию тканей в зоне разреза, формируя неполный лоскут. Инструмент вставляют в разрез и аккуратно продвигают его во всех направлениях до достижения надлежащей сепарации тканей (фото 4). При невозможности сепарации тканей в проекции маргинальных десен через бороздковый доступ можно попробовать сепарировать их посредством долота Fedi через сформированный апикальный разрез. Послабление тканей проводиться до тех пор, пока их нельзя будет сместить коронально до уровня цементно-эмалевой границы, при этом не нарушив целостности сосочка (фото 4).
Фото 3. Формирование апикального разреза.
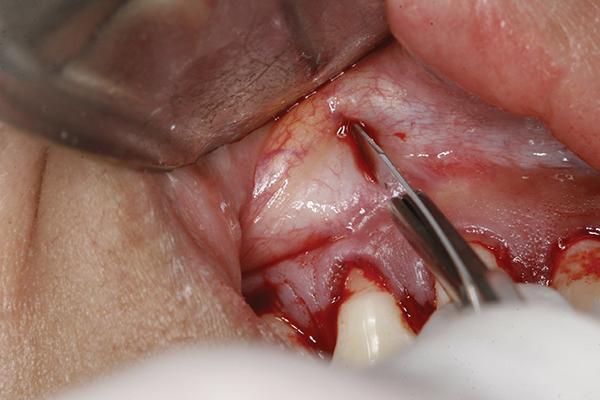
Фото 4. Сепарация тканей через апикальный разрез посредством долота Fedi.
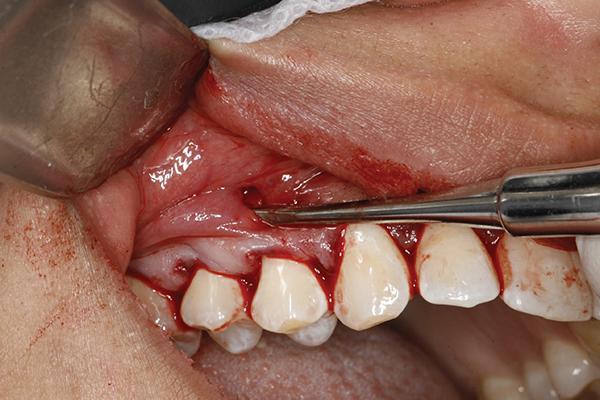
Долото Fedi также используется и для сепарации тканей в проекции сосочка, при этом ни в коем случае не разрывая его. В области нижней челюсти особую осторожность следует соблюдать в зоне выхода подбородочного нерва, дабы не повредить его в ходе выполнения манипуляции.
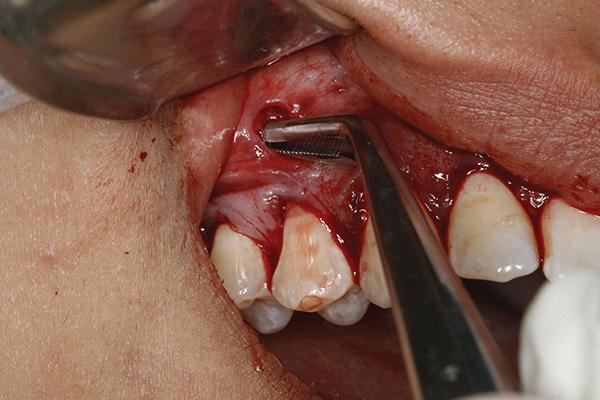
Следующий этап вмешательства предполагает установку ксенотрансплантата и PRF. Авторы в качестве трансплантата использовали коллагеновый материал из брюшины свиньи (Straumann Membrane Flex, Straumann), который, по данным производителя, рассасывается через 12-16 недель. Ксенографт разрезают на полоски размером 4 мм х 10 мм. Обычно на секстант требуется кусок мембраны размером 30 х 40 мм. Затем полоски коллагена замачивают в растворе с низким содержанием тромбоцитов, полученном в ходе приготовления PRF, и после этого они упаковываются через апикальные разрезы. Коллагеновые полоски устанавливаются в проекции зоны под сосочками, и затем их позиционируют при помощи ватных валиков (фото 5).
Фото 5. Установка коллагеновых полосок через апикальный разрез.
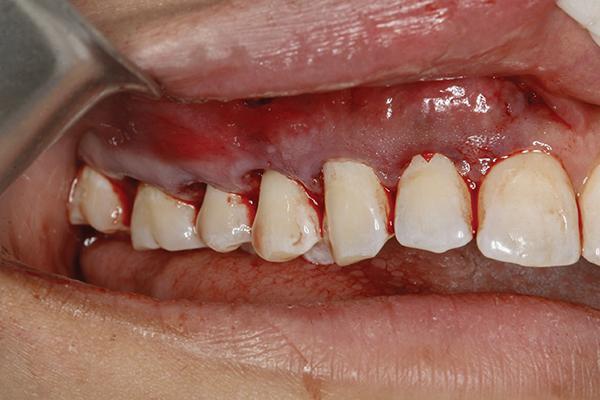
Мембраны PRF приготавливают согласно алгоритму Dohan и Choukroun. После того, как сгустки фибрина удаляют из пробирок, их упаковывают и компрессируют в металлических перфорированных коробках. Полученную жидкость используют для смачивания коллагеновых мембран. Установку последних не следует проводить через зону бороздки, поскольку в таком случае можно спровоцировать разрыв сосочка. С помощью долота Fedi коллагеновые мембраны можно упаковывать в более задней позиции и коронально для поддержки сосочков посредством сформированного незначительного давления. Дополнительные порции коллагеновых полосок применяют для пассивного позиционирования тканей в более корональном направлении. Некоторые коллагеновые полоски можно даже оставить несколько обнаженными в области зубодесневой бороздки. После этого PRF-мембрану также разрезают на кусочки (фото 6) и упаковывают в область вмешательства. Ушивание проводить не рекомендовано, поскольку используемый трансплантат под давлением может сместиться более апикально. После завершения хирургического вмешательства поверх области операции на 3-5 минут устанавливают влажную марлю, которая обеспечивает гемостаз и стабильность лоскута (фото 7).
Фото 6. Вид PRF после приготовления.

Фото 7. Вид после завершения операции в области правого квадранта верхней челюсти без ушивания.
После операции пациенту запрещается проводить чистку зубов на протяжении 3-4 дней, а после необходимо проводить данную манипуляцию сухой ультрамягкой зубной щеткой (PHB Toothbrushes) в апикально-корональном направлении два раза в день. Дополнительно очистку ротовой полости обеспечивают за счет антисептических полосканий. Не рекомендуется использование зубной нити на протяжении как минимум 6 недель. Обычно для полосканий используют хлоргексидин или эфирные масла, однако пока что не установлено может ли повлиять их применение на функцию фибробластов и риск развития дисколораций мягких тканей. В послеоперационный период также используют нестероидные противовоспалительные средства и антибиотики (например, 1 г амоксициллина перорально до операции, затем одна капсула три раза в день в течение 7 дней; если у пациента аллергия на амоксициллин, можно назначить клиндамицин 150 мг, две капсулы до операции, затем одна капсула четыре раза в день или две капсулы два раза в день в течение 7 дней, либо азитромицин в соответствии с указаниями).
Клинические случаи
Клинический случай 1
48-летний пациент обратился за помощью по поводу имеющейся чувствительности на температурные раздражители, прогрессирующей рецессии, имеющихся очагов пришеечной абразии и абфракции, а также несоответствующего уровня гигиены полости рта (фото 8). Общесоматический анамнез не был отягощен. Пациенту было проведено вмешательство по протоколу SMILE. Область вмешательства проецировалась на участки 2-8 зубов, и была расширена на область двух сосочков кпереди от проблемных зубов. После операции пациенту был предписан прием амоксициллина по 500 мг, № 22, две капсулы в первый день, а затем по одной капсуле три раза в день на протяжении недели. На фото 9-11 изображены результаты, полученные сразу же после операции, через 1 неделю и через 5 месяцев.
Фото 8. Клинический случай 1. Вид до лечения: рецессии, изменения в области слизисто-десневой границы, очаги пришеечной абразии корня.
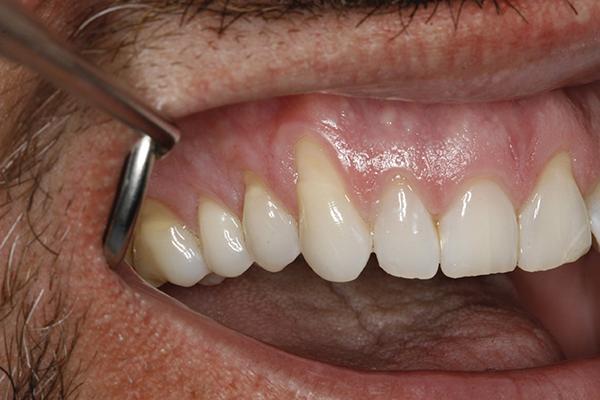
Фото 9. Клинический случай 1. Вид сразу после выполнения операции.
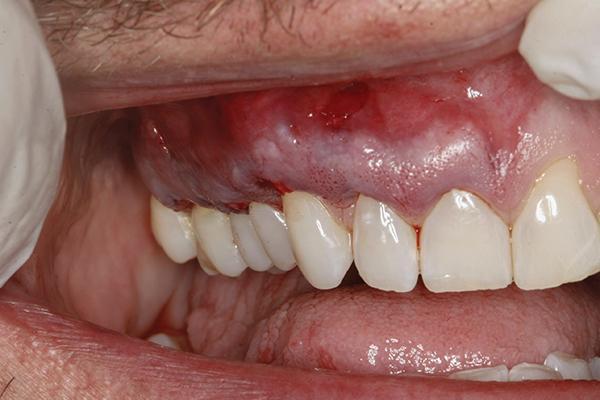
Фото 10. Клинический случай 1. Вид через 1 неделю после выполнения операции.
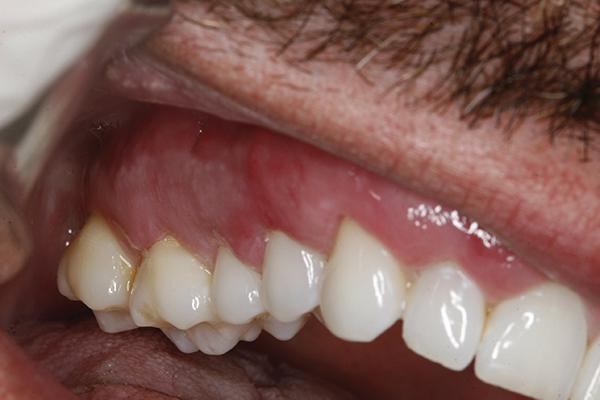
Фото 11. Клинический случай 1. Вид через 5 месяцев после выполнения операции.
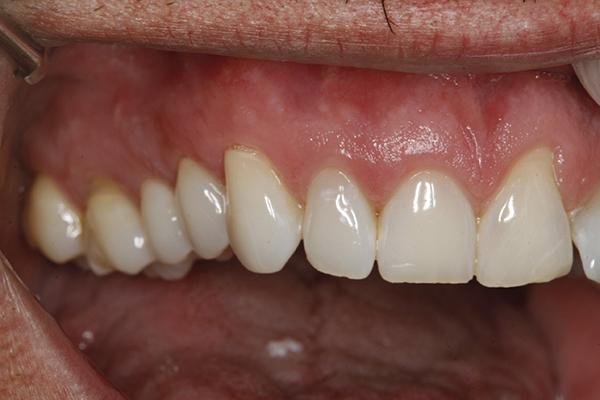
Клинический случай 2
53-летний мужчина обратился за помощью по поводу очагов абразии нижних зубов и излишним натяжением уздечки в области 22 зуба (фото 12). У пациента отмечались симптомы кленчинга, бруксизма, проблемы с гигиеной полости рта. Он отметил, что у его жены имелся негативный опыт использования техники коррекции состояния десен посредством аутологического трансплантата. Вмешательство проводили по протоколу, описанному выше (фото 13). Заживление тканей проходило без каких-либо осложнений. Область вмешательства включала участок дистальнее 18 зуба и до участка мезиальнее 25 зуба. Лечение в области правого квадранта нижней челюсти планировалось провести позже. На фото 14 изображен результат, полученный через 1 неделю после операции, а на фото 15 – через 5 месяцев.
Фото 12. Клинический случай 2. Вид до лечения: участки пришеечной абразии, изменения в области слизисто-десневой границы, натяжение слизистой в области уздечки.
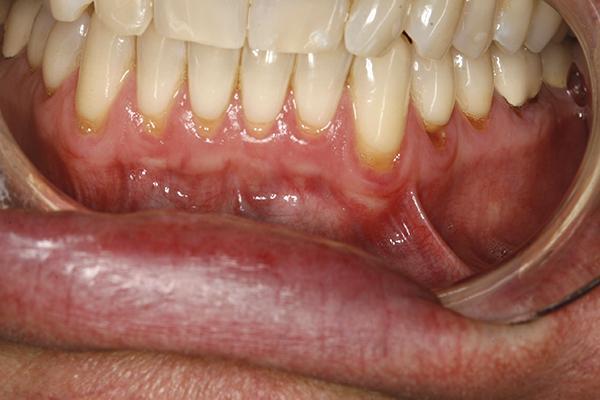
Фото 13. Клинический случай 2. Выполнение вертикального разреза.
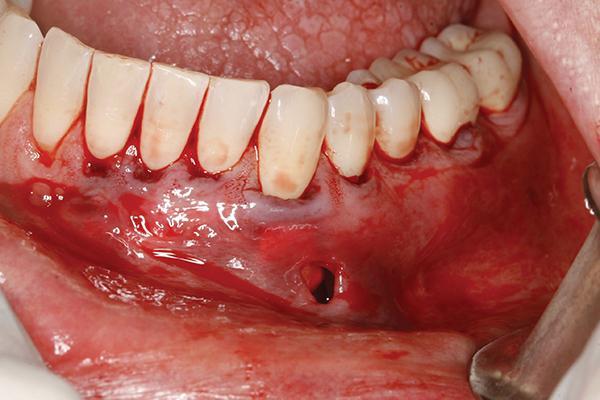
Фото 14. Клинический случай 2. Вид через 1 неделю после выполнения операции.
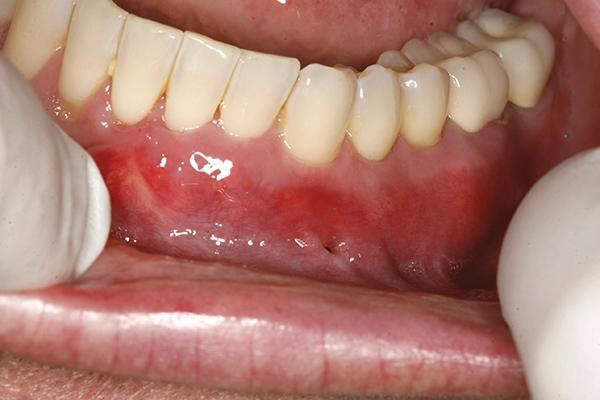
Фото 15. Клинический случай 2. Вид через 5 месяцев после выполнения операции.
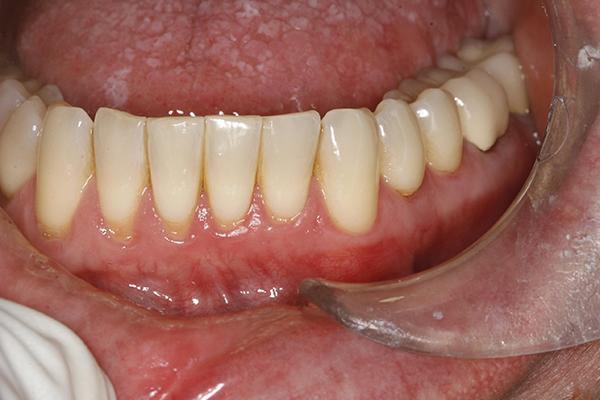
Клинический случай 3
59-летний мужчина обратился за помощью с жалобой на наличие рецессий в области передних зубов нижней челюсти, которые, по его собственному мнению, прогрессировали (фото 16). Кроме рецессий в области передних 22, 23 и 25 зубов отмечалось наличие композитных реставрацией. Пациент сообщил об использовании ночной каппы по причине бруксизма. Композитные реставрации в области 22, 23 и 25 зубов были удалены, после чего провели тщательную очистку поверхности корня. Кислотной обработки поверхности корней не проводилось. Было сформировано три апикальных разреза, по одному дистальнее линии клыков, и один в области 25-26 зуба. Процедура проводилась согласно вышеописанному протоколу. Ушивание раны не проводили (фото 17). Для обеспечения гемостаза использовали смоченный марлевый тампон. Через 5 месяцев после вмешательства было отмечено повышение уровня прикрепленной кератинизированной слизистой (фото 18).
Фото 16. Клинический случай 3. Вид до лечения: наличие пришеечных реставраций в области 22, 23 и 25 зубов.
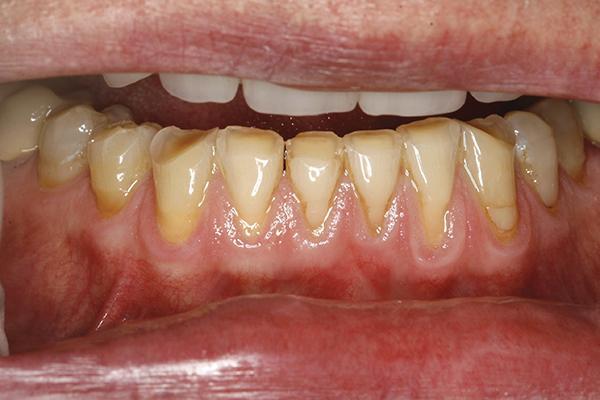
Фото 17. Клинический случай 3. Вид сразу же после выполнения операции.
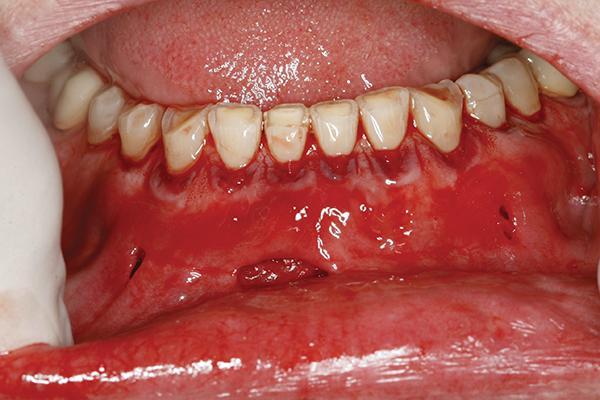
Фото 18. Клинический случай 3. Вид через 5 месяцев после выполнения операции.
Обсуждение
Получение аутогенного трансплантата характеризуется развитием послеоперационного дискомфорта, онемения, и ограничено имеющимися параметрами мягких тканей. Поэтому применение аллогенных или ксеногенных трансплантатов является довольно эффективной альтернативой. Для оптимизации протекания биологических механизмов в процессе восстановления мягкотканного покрытия поверхности обнаженных корней, исследователи предлагают использовать обогащенную тромбоцитами плазму, в которой проводят гидратацию трансплантатов. Shepherd и коллеги описали метод применения бесклеточного дермального матрикса, смоченного в PRP, который в дальнейшем упаковывали в туннельно-сформированный доступ. Результаты продемонстрировали, что при смачивании трансплантата в физиологических растворе удавалось добиться восстановления в среднем 70% мягкотканного покрытия корня, а при смачивании в PRP - 90% мягкотканого покрытия. В представленной статье мы описали новый протокол минимально инвазивного восстановления мягкотканного покрытия корня посредством использования аллогенного трансплантата и возможностей PRF. В жидкости PRF, применяемой для гидратации графта, были обнаружены фактор роста тромбоцитов-BB (PDGF-BB)), инсулиноподобный фактор роста-1 (IGF-1) и трансформирующий фактор роста бета-1 (TGF-β1). Кроме этого, мы предложили использовать и сами PRF-мембраны для аугментации. Данные производные плазмы приготавливаются несколько по-иному протоколу, нежели PRP. В ходе приготовления PRP развивается быстрая полимеризация, вызванная действием тромбина, что приводит к быстрому освобождению факторов роста в структуре мембраны. Из-за того, что PRF полимеризируется значительно медленнее, релизинг факторов роста обеспечивается на протяжении гораздо большего периода времени. Мы считаем, что именно применение PRF способствовало достижению настолько успешных результатов лечения, описанных в продемонстрированных клинических случаях.
Другие исследователи включали PRF в структуру более традиционных хирургических подходов закрытия участков рецессий. Horowitz использовал PRF либо отдельно, либо с целью гидратации коллагеновых трансплантатов, что позволяло демонстрировать отличные результаты лечения даже через 5 лет после вмешательства. Öncü продемонстрировал, что PRF мембраны обеспечивают сравнительно лучший результат по сравнению с субэпителиальными соединительнотканевыми трансплантатами при корональном смещении лоскутов. Участки корней, в области которых использовали PRF, характеризовались более высоким показателем восстановления мягкотканного покрытия, и при этом характеризовались гораздо меньшим уровнем послеоперационного дискомфорта. Moraschini и соавторы провели мета-анализ результатов применения PRF при лечении рецессии десен, и не обнаружили никаких существенных улучшений в отношении увеличения ширины кератинизированных тканей, уровня восстановления мягкотканного покрытия и клинического прикрепления.
Ксенотрансплантантные мембраны представляют собой резорбируемые биомеханические улучшенные коллагеновые материалы, которые изготавливаются из очищенной брюшины свиньи. Очистка тканей брюшины обеспечивается за счет запатентованной серии процедур, направленных на удаление неколлагеновых компонентов. После очистки мембрану стабилизируют путем кросс-соединений. Агент, обеспечивающий формирование данных соединений, в дальнейшем удаляют с целью повышения биосовместимости мембраны. Конечный продукт поддается сегментированию и стерилизации посредством гамма-излучения. Сама мембрана является в значительной мере пористой, что можно увидеть на изображении поперечного сечения, полученного в ходе сканирующей электронной микроскопии (СЭМ) высокого разрешения (фото 19). Такая пористая структура позволяет абсорбировать жидкость, отжатую из PRF в перфорированной металлической коробке. Значительная площадь поверхности мембраны также способствует адсорбции белков и факторов роста на самой коллагеновой структуре.
Фото 19. СЭМ-фотография коллагеновой ксеногенной мембраны (100-кратное увеличение области поперечного сечения с визуализацией пористой структуры).

В описанных выше клинических случаях PRF использовался в двух формах. Во-первых, коллагеновые мембраны гидратировали в жидкости, выделяемой из сжатых PRF-мембран, или сгустков после их приготовления. Такой подход обеспечивает адсорбцию факторов роста и более длительное их высвобождение структурой смоченного коллагена. Чтобы гарантировать точное позиционирование коллагеновой мембраны при ее введении через вертикальный разрез, ее удерживают на месте с помощью небольшого инструмента (Micro Pliers Straight, Paradise Dental Technologies) (фото 20), который также позволяет вводить PRF-мембраны как небольшими сегментами, так и полноценными длинными полосками (фото 21) непосредственно под коллагеновую мембрану. Благодаря специфике приготовления PRF, данный тип мембран обеспечивает релизинг факторов роста в течение до 4 недель, что в значительной мере может способствовать успешному заживлению области вмешательства.
Фото 20. Установка гидратированной коллагеновой мембраны через туннельный доступ.
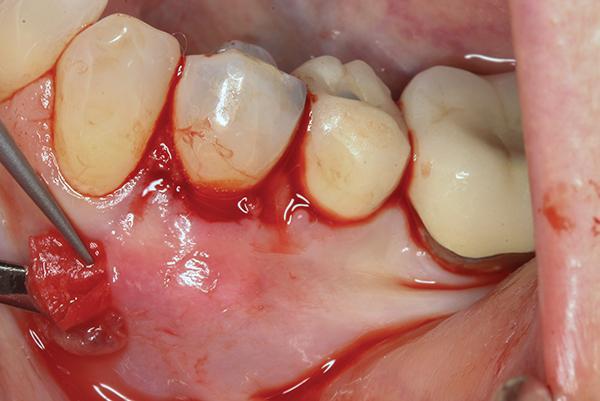
Фото 21. Полноценная PRF-мембрана устанавливается между коллагеновой мембранной и костной тканью.
В ходе дальнейших исследований необходимо обратить внимание на несколько следующих аспектов. Например, обработка поверхности корня этилендиаминтетрауксусной кислотой (ЭДТА) может улучшить характеристики поверхности дентина и оптимизировать условия для истинной регенерации пародонта. Точно так же добавление производного эмалевого матрикса может способствовать восстановлению как мягкотканного покрытия корня, так и тканей пародонта в целом. Долгосрочные исследования позволят определить степень ретенции полученных результатов на протяжении долгосрочных периодов мониторинга. Наконец, технология цифрового сканирования может позволить исследователям получить более точные данные относительно восстановления вертикальных и горизонтальных параметров мягкотканного покрытия корня, а также может способствовать оценке толщины сформированных тканей. Улучшение самого биотипа слизистой имеет огромное значение в ходе комплексного лечения пациентов с использованием дентальных имплантатов или в случаях коррекции эстетических параметров улыбки.
Выводы
Представленная в данной статье методика является модификацией современных методов восстановления мягкотканного покрытия поверхности корня. Для ее реализации требуется лишь бороздково-сосочковый элеватор и несколько других распространенных в использовании хирургических инструментов. Формирование доступа происходит как через зубодесневую бороздку, так и через апикальный разрез, а в качестве материала используют коллагеновый ксенотранслпантат и PRF-мембраны. Особенностью данной техники является отсутствие в потребности наложения швов и проведения дополнительного хирургического вмешательства с целю забора трансплантата. Уровень постоперационного дискомфорта при реализации описанной техники сравним с таковым при проведении классических туннельных вмешательств. Врач может проводить лечение одновременно в нескольких квадрантах челюстей, поскольку количество используемого трансплантата является неограниченным. Даже если PRF в значительной мере не влияет на оптимизацию результатов лечения в форме восстановления мягкотканного покрытия, производные плазмы способствуют более быстрому заживлению области вмешательства и снижению уровня послеоперационного дискомфорта. Перспектива дальнейших исследований состоит в сравнении эффективности данной методики с аналогичными хирургическими подходами.
Авторы:
David Anson, DDS
Robert A. Horowitz, DDS
Цели проведения мягкотканной аугментации (пародонтальной пластической хирургии) в пародонтологии являются крайне разнообразными. Данная процедура используется для возобновления мягкотканного покрытия корня до уровня цементно-эмалевой границы в эстетических целях, для снижения температурной чувствительности, для защиты тканей от чрезмерной редукции путем истирания, для формирования надлежащего визуального профиля составляющих элементов улыбки. Кроме того, пародонтальная пластическая хирургия позволят сформировать достаточный объем кератинизированных десен, минимизировать натяжения со стороны уздечки и тяжей слизистой, минимизировать уровень пародонтального зондирования, скорректировать симптомы кровотечения и уменьшить ощущения дискомфорта. По отношению к процедуре возобновления покрытия корней существуют специфические ограничения, которые аргументированы морфологией мягких тканей – так, например, внешний профиль слизистой всегда будет ниже уровня межзубных сосочков, а при изменении уровня самих сосочков довольно сложно спрогнозировать все последствия ятрогенных вмешательств. Поэтому в случаях развития интерпроксимальных рецессий добиться полного восстановления мягкотканого покрытия корня попросту невозможно. Наиболее прогнозированными являются такие ятрогенные вмешательства, которые выполняются при наличии как минимум 3 мм мезио-дистальной ширины сосочка между двумя смежными корнями.

Тем не менее, в другом исследовании полученные результаты были полностью противоположными. Такое несоответствие может быть спровоцировано различиями в применении разных пародонтологических протоколов вмешательства. Описанная в данной статье модифицированная техника аугментации десен с формированием бороздкового доступа отличается от всех вышеупомянутых за счет дополнительного использования фибрина, обогащенного тромбоцитами (PRF). Опыт авторов относительно применения соединительнотканного трансплантата был аналогичен результатам, описанным в исследовании Chao. В то же время техника формирования точечного доступа, также описанная в публикации Chambrone, продемонстрировала достаточно перспективные результаты в отношении восстановления множественных рецессий. В обеих исследованиях результаты, полученные на верхней челюсти, были несколько выше таковых на нижней. При этом методы обработки самой поверхности корня (посредством дериватов эмалевой матрицы, лазеров или тетрациклина) в общем не обеспечивают никакого дополнительного клинического результата по отношению к восстановлению мягкотканного покрытия посредством соединительнотканного трансплантата. Несмотря на это, эффект методов обработки поверхности корня может иметь влияние на уровень развития постоперационного дискомфорта, а также на изменения в области мягких тканей на гистологическом уровне. Применение PRF демонстрирует позитивные результаты в отношении уменьшения времени заживления и снижения уровня постоперационного дискомфорта. При этом долгосрочный эффект использования PRF целенаправленно на восстановление мягкотканного покрытия корня остается недостаточно изученным.
В данной статье мы детально опишем технику аугментации десен SMILE (Sulcular Modified Internal Labial Enhancement), которая предусматривает применение туннельного доступа, ксенографта и PRF, и при этом требует гораздо меньшего инструментального обеспечения по сравнению с другими методами пародонтологических вмешательств.
Протокол вмешательства
Как и в случаях других методов восстановления мягкотканного покрытия корней, первый этап вмешательства состоит, конечно же, в тщательной очистке поверхности корня. Данную очистку можно провести посредством ручных инструментов или их ультразвуковых аналогов. Все ошурки с поверхности корня, полученные в ходе обработки, должны быть тщательно удалены, а конечная форма поверхности должна быть гладкой и чистой. Кроме того, должен присутствовать плавный переход с поверхности корня на поверхности вестибулярной эмали. При наличии предварительно выполненных композитных реставраций в проекции области вмешательства их следует удалить. Процедуру очистки лучше всего проводить перед этапом формирования туннельного доступа, поскольку в таких условиях операционное поле является более сухим, а следовательно – менее контаминированным. В случаях же обнажения слишком огромной площади поверхности корня или же при чрезмерно огромных размерах рецессии в мезио-дистальном направлении, иногда сначала требуется сформировать туннельный доступ, который и позволит обеспечить надлежащую полную очистку проблемной области корня. После этого проводят послабление мягких тканей с внешней стороны зубов. Данную манипуляцию начинают выполнять в области зубодесневой бороздки посредством бороздково-сосочкового элеватора, разработанного доктором Ансоном (H&H Company, hhcompany.store) (фото 1). Острый инструмент вставляют в область межзубных мягких тканей и проводят аккуратную сепарацию полнотканного лоскута, двигаясь к медиальному и дистальному сосочкам так, чтобы инструмент мог войти в области одного зуба и выйти в области другого (фото 1). После этого долотом Fedi продолжают сепарацию тканей в области бороздки, стараясь при этом никоем образом не разорвать ткани сосочка (фото 2).
Фото 1. Сепарация тканей при помощи бороздково-сосочкового элеватора.

Фото 2. Более глубокая сепарация тканей при помощи долота Fedi.

По сути, проводиться полнотканная сепарация лоскута, однако, когда долото достигает области переходной слизистой, происходит трансформация манипуляции в сепарацию неполного лоскута. После послабления тканей формируют небольшой разрез приблизительно на 5-6 мм длины в проекции преддверия полости рта над областью клыка (фото 3). При проведении вмешательства в области передних зубов обычно еще проводят один дополнительный разрез в области уздечки, дабы послабить ее натяжение. Затем при помощи долота Fedi проводят сепарацию тканей в зоне разреза, формируя неполный лоскут. Инструмент вставляют в разрез и аккуратно продвигают его во всех направлениях до достижения надлежащей сепарации тканей (фото 4). При невозможности сепарации тканей в проекции маргинальных десен через бороздковый доступ можно попробовать сепарировать их посредством долота Fedi через сформированный апикальный разрез. Послабление тканей проводиться до тех пор, пока их нельзя будет сместить коронально до уровня цементно-эмалевой границы, при этом не нарушив целостности сосочка (фото 4).
Фото 3. Формирование апикального разреза.

Фото 4. Сепарация тканей через апикальный разрез посредством долота Fedi.

Долото Fedi также используется и для сепарации тканей в проекции сосочка, при этом ни в коем случае не разрывая его. В области нижней челюсти особую осторожность следует соблюдать в зоне выхода подбородочного нерва, дабы не повредить его в ходе выполнения манипуляции.
Следующий этап вмешательства предполагает установку ксенотрансплантата и PRF. Авторы в качестве трансплантата использовали коллагеновый материал из брюшины свиньи (Straumann Membrane Flex, Straumann), который, по данным производителя, рассасывается через 12-16 недель. Ксенографт разрезают на полоски размером 4 мм х 10 мм. Обычно на секстант требуется кусок мембраны размером 30 х 40 мм. Затем полоски коллагена замачивают в растворе с низким содержанием тромбоцитов, полученном в ходе приготовления PRF, и после этого они упаковываются через апикальные разрезы. Коллагеновые полоски устанавливаются в проекции зоны под сосочками, и затем их позиционируют при помощи ватных валиков (фото 5).
Фото 5. Установка коллагеновых полосок через апикальный разрез.

Мембраны PRF приготавливают согласно алгоритму Dohan и Choukroun. После того, как сгустки фибрина удаляют из пробирок, их упаковывают и компрессируют в металлических перфорированных коробках. Полученную жидкость используют для смачивания коллагеновых мембран. Установку последних не следует проводить через зону бороздки, поскольку в таком случае можно спровоцировать разрыв сосочка. С помощью долота Fedi коллагеновые мембраны можно упаковывать в более задней позиции и коронально для поддержки сосочков посредством сформированного незначительного давления. Дополнительные порции коллагеновых полосок применяют для пассивного позиционирования тканей в более корональном направлении. Некоторые коллагеновые полоски можно даже оставить несколько обнаженными в области зубодесневой бороздки. После этого PRF-мембрану также разрезают на кусочки (фото 6) и упаковывают в область вмешательства. Ушивание проводить не рекомендовано, поскольку используемый трансплантат под давлением может сместиться более апикально. После завершения хирургического вмешательства поверх области операции на 3-5 минут устанавливают влажную марлю, которая обеспечивает гемостаз и стабильность лоскута (фото 7).
Фото 6. Вид PRF после приготовления.

Фото 7. Вид после завершения операции в области правого квадранта верхней челюсти без ушивания.

После операции пациенту запрещается проводить чистку зубов на протяжении 3-4 дней, а после необходимо проводить данную манипуляцию сухой ультрамягкой зубной щеткой (PHB Toothbrushes) в апикально-корональном направлении два раза в день. Дополнительно очистку ротовой полости обеспечивают за счет антисептических полосканий. Не рекомендуется использование зубной нити на протяжении как минимум 6 недель. Обычно для полосканий используют хлоргексидин или эфирные масла, однако пока что не установлено может ли повлиять их применение на функцию фибробластов и риск развития дисколораций мягких тканей. В послеоперационный период также используют нестероидные противовоспалительные средства и антибиотики (например, 1 г амоксициллина перорально до операции, затем одна капсула три раза в день в течение 7 дней; если у пациента аллергия на амоксициллин, можно назначить клиндамицин 150 мг, две капсулы до операции, затем одна капсула четыре раза в день или две капсулы два раза в день в течение 7 дней, либо азитромицин в соответствии с указаниями).
Клинические случаи
Клинический случай 1
48-летний пациент обратился за помощью по поводу имеющейся чувствительности на температурные раздражители, прогрессирующей рецессии, имеющихся очагов пришеечной абразии и абфракции, а также несоответствующего уровня гигиены полости рта (фото 8). Общесоматический анамнез не был отягощен. Пациенту было проведено вмешательство по протоколу SMILE. Область вмешательства проецировалась на участки 2-8 зубов, и была расширена на область двух сосочков кпереди от проблемных зубов. После операции пациенту был предписан прием амоксициллина по 500 мг, № 22, две капсулы в первый день, а затем по одной капсуле три раза в день на протяжении недели. На фото 9-11 изображены результаты, полученные сразу же после операции, через 1 неделю и через 5 месяцев.
Фото 8. Клинический случай 1. Вид до лечения: рецессии, изменения в области слизисто-десневой границы, очаги пришеечной абразии корня.

Фото 9. Клинический случай 1. Вид сразу после выполнения операции.

Фото 10. Клинический случай 1. Вид через 1 неделю после выполнения операции.

Фото 11. Клинический случай 1. Вид через 5 месяцев после выполнения операции.

Клинический случай 2
53-летний мужчина обратился за помощью по поводу очагов абразии нижних зубов и излишним натяжением уздечки в области 22 зуба (фото 12). У пациента отмечались симптомы кленчинга, бруксизма, проблемы с гигиеной полости рта. Он отметил, что у его жены имелся негативный опыт использования техники коррекции состояния десен посредством аутологического трансплантата. Вмешательство проводили по протоколу, описанному выше (фото 13). Заживление тканей проходило без каких-либо осложнений. Область вмешательства включала участок дистальнее 18 зуба и до участка мезиальнее 25 зуба. Лечение в области правого квадранта нижней челюсти планировалось провести позже. На фото 14 изображен результат, полученный через 1 неделю после операции, а на фото 15 – через 5 месяцев.
Фото 12. Клинический случай 2. Вид до лечения: участки пришеечной абразии, изменения в области слизисто-десневой границы, натяжение слизистой в области уздечки.

Фото 13. Клинический случай 2. Выполнение вертикального разреза.

Фото 14. Клинический случай 2. Вид через 1 неделю после выполнения операции.

Фото 15. Клинический случай 2. Вид через 5 месяцев после выполнения операции.

Клинический случай 3
59-летний мужчина обратился за помощью с жалобой на наличие рецессий в области передних зубов нижней челюсти, которые, по его собственному мнению, прогрессировали (фото 16). Кроме рецессий в области передних 22, 23 и 25 зубов отмечалось наличие композитных реставрацией. Пациент сообщил об использовании ночной каппы по причине бруксизма. Композитные реставрации в области 22, 23 и 25 зубов были удалены, после чего провели тщательную очистку поверхности корня. Кислотной обработки поверхности корней не проводилось. Было сформировано три апикальных разреза, по одному дистальнее линии клыков, и один в области 25-26 зуба. Процедура проводилась согласно вышеописанному протоколу. Ушивание раны не проводили (фото 17). Для обеспечения гемостаза использовали смоченный марлевый тампон. Через 5 месяцев после вмешательства было отмечено повышение уровня прикрепленной кератинизированной слизистой (фото 18).
Фото 16. Клинический случай 3. Вид до лечения: наличие пришеечных реставраций в области 22, 23 и 25 зубов.

Фото 17. Клинический случай 3. Вид сразу же после выполнения операции.

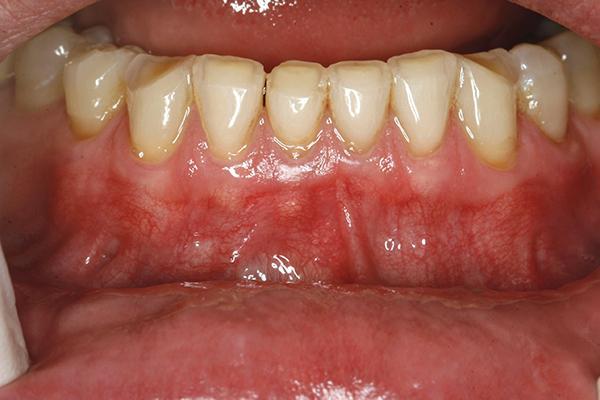
Фото 18. Клинический случай 3. Вид через 5 месяцев после выполнения операции.

Обсуждение
Получение аутогенного трансплантата характеризуется развитием послеоперационного дискомфорта, онемения, и ограничено имеющимися параметрами мягких тканей. Поэтому применение аллогенных или ксеногенных трансплантатов является довольно эффективной альтернативой. Для оптимизации протекания биологических механизмов в процессе восстановления мягкотканного покрытия поверхности обнаженных корней, исследователи предлагают использовать обогащенную тромбоцитами плазму, в которой проводят гидратацию трансплантатов. Shepherd и коллеги описали метод применения бесклеточного дермального матрикса, смоченного в PRP, который в дальнейшем упаковывали в туннельно-сформированный доступ. Результаты продемонстрировали, что при смачивании трансплантата в физиологических растворе удавалось добиться восстановления в среднем 70% мягкотканного покрытия корня, а при смачивании в PRP - 90% мягкотканого покрытия. В представленной статье мы описали новый протокол минимально инвазивного восстановления мягкотканного покрытия корня посредством использования аллогенного трансплантата и возможностей PRF. В жидкости PRF, применяемой для гидратации графта, были обнаружены фактор роста тромбоцитов-BB (PDGF-BB)), инсулиноподобный фактор роста-1 (IGF-1) и трансформирующий фактор роста бета-1 (TGF-β1). Кроме этого, мы предложили использовать и сами PRF-мембраны для аугментации. Данные производные плазмы приготавливаются несколько по-иному протоколу, нежели PRP. В ходе приготовления PRP развивается быстрая полимеризация, вызванная действием тромбина, что приводит к быстрому освобождению факторов роста в структуре мембраны. Из-за того, что PRF полимеризируется значительно медленнее, релизинг факторов роста обеспечивается на протяжении гораздо большего периода времени. Мы считаем, что именно применение PRF способствовало достижению настолько успешных результатов лечения, описанных в продемонстрированных клинических случаях.
Другие исследователи включали PRF в структуру более традиционных хирургических подходов закрытия участков рецессий. Horowitz использовал PRF либо отдельно, либо с целью гидратации коллагеновых трансплантатов, что позволяло демонстрировать отличные результаты лечения даже через 5 лет после вмешательства. Öncü продемонстрировал, что PRF мембраны обеспечивают сравнительно лучший результат по сравнению с субэпителиальными соединительнотканевыми трансплантатами при корональном смещении лоскутов. Участки корней, в области которых использовали PRF, характеризовались более высоким показателем восстановления мягкотканного покрытия, и при этом характеризовались гораздо меньшим уровнем послеоперационного дискомфорта. Moraschini и соавторы провели мета-анализ результатов применения PRF при лечении рецессии десен, и не обнаружили никаких существенных улучшений в отношении увеличения ширины кератинизированных тканей, уровня восстановления мягкотканного покрытия и клинического прикрепления.
Ксенотрансплантантные мембраны представляют собой резорбируемые биомеханические улучшенные коллагеновые материалы, которые изготавливаются из очищенной брюшины свиньи. Очистка тканей брюшины обеспечивается за счет запатентованной серии процедур, направленных на удаление неколлагеновых компонентов. После очистки мембрану стабилизируют путем кросс-соединений. Агент, обеспечивающий формирование данных соединений, в дальнейшем удаляют с целью повышения биосовместимости мембраны. Конечный продукт поддается сегментированию и стерилизации посредством гамма-излучения. Сама мембрана является в значительной мере пористой, что можно увидеть на изображении поперечного сечения, полученного в ходе сканирующей электронной микроскопии (СЭМ) высокого разрешения (фото 19). Такая пористая структура позволяет абсорбировать жидкость, отжатую из PRF в перфорированной металлической коробке. Значительная площадь поверхности мембраны также способствует адсорбции белков и факторов роста на самой коллагеновой структуре.
Фото 19. СЭМ-фотография коллагеновой ксеногенной мембраны (100-кратное увеличение области поперечного сечения с визуализацией пористой структуры).

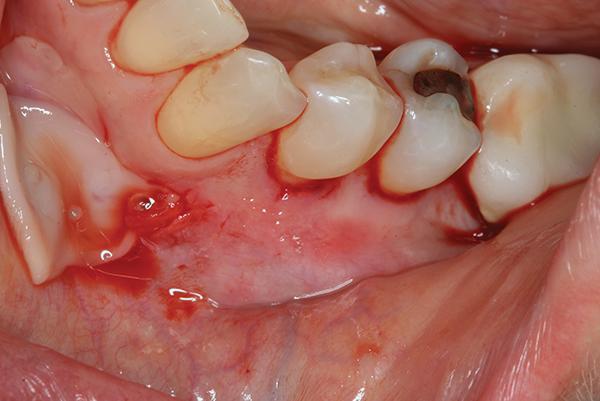
В описанных выше клинических случаях PRF использовался в двух формах. Во-первых, коллагеновые мембраны гидратировали в жидкости, выделяемой из сжатых PRF-мембран, или сгустков после их приготовления. Такой подход обеспечивает адсорбцию факторов роста и более длительное их высвобождение структурой смоченного коллагена. Чтобы гарантировать точное позиционирование коллагеновой мембраны при ее введении через вертикальный разрез, ее удерживают на месте с помощью небольшого инструмента (Micro Pliers Straight, Paradise Dental Technologies) (фото 20), который также позволяет вводить PRF-мембраны как небольшими сегментами, так и полноценными длинными полосками (фото 21) непосредственно под коллагеновую мембрану. Благодаря специфике приготовления PRF, данный тип мембран обеспечивает релизинг факторов роста в течение до 4 недель, что в значительной мере может способствовать успешному заживлению области вмешательства.
Фото 20. Установка гидратированной коллагеновой мембраны через туннельный доступ.

Фото 21. Полноценная PRF-мембрана устанавливается между коллагеновой мембранной и костной тканью.

В ходе дальнейших исследований необходимо обратить внимание на несколько следующих аспектов. Например, обработка поверхности корня этилендиаминтетрауксусной кислотой (ЭДТА) может улучшить характеристики поверхности дентина и оптимизировать условия для истинной регенерации пародонта. Точно так же добавление производного эмалевого матрикса может способствовать восстановлению как мягкотканного покрытия корня, так и тканей пародонта в целом. Долгосрочные исследования позволят определить степень ретенции полученных результатов на протяжении долгосрочных периодов мониторинга. Наконец, технология цифрового сканирования может позволить исследователям получить более точные данные относительно восстановления вертикальных и горизонтальных параметров мягкотканного покрытия корня, а также может способствовать оценке толщины сформированных тканей. Улучшение самого биотипа слизистой имеет огромное значение в ходе комплексного лечения пациентов с использованием дентальных имплантатов или в случаях коррекции эстетических параметров улыбки.
Выводы
Представленная в данной статье методика является модификацией современных методов восстановления мягкотканного покрытия поверхности корня. Для ее реализации требуется лишь бороздково-сосочковый элеватор и несколько других распространенных в использовании хирургических инструментов. Формирование доступа происходит как через зубодесневую бороздку, так и через апикальный разрез, а в качестве материала используют коллагеновый ксенотранслпантат и PRF-мембраны. Особенностью данной техники является отсутствие в потребности наложения швов и проведения дополнительного хирургического вмешательства с целю забора трансплантата. Уровень постоперационного дискомфорта при реализации описанной техники сравним с таковым при проведении классических туннельных вмешательств. Врач может проводить лечение одновременно в нескольких квадрантах челюстей, поскольку количество используемого трансплантата является неограниченным. Даже если PRF в значительной мере не влияет на оптимизацию результатов лечения в форме восстановления мягкотканного покрытия, производные плазмы способствуют более быстрому заживлению области вмешательства и снижению уровня послеоперационного дискомфорта. Перспектива дальнейших исследований состоит в сравнении эффективности данной методики с аналогичными хирургическими подходами.
Авторы:
David Anson, DDS
Robert A. Horowitz, DDS



























































































































































0 комментариев