В результате травматической окклюзии (фактор короткого времени действия) или ортодонтического лечения (фактор долгого времени действия) в области пародонтальной связки и в смежных с ней участках начинает развиваться механическое напряжение, которое само по себе запускает биохимическую реакцию со стороны структур зубочелюстного аппарата. Такая реакция состоит из целого каскада биологических и химических этапов, совокупность которых определяет комплексный характер адаптивных свойств организма.
Если подобные механизмы имеют возможность развиваться на протяжении нескольких часов, начинают прогрессировать уже и метаболические нарушения, которые связаны с высвобождением вторичных маркеров воспаления по типу циклического аденозин-монофосфата и фактора некроза опухолей альфа (TNF), последний при этом включает активатор рецептора ядерного транскрипционного фактора [NF-κB] (RANK) / рецептора лиганда NF-κB (RANKL) и молекулы остеопротегерина (OPG). Данные факторы стимулируют процесс ремоделирования и резорбции костной ткани.
В конечном счете все эти биохимические реакции непосредственно влияют на работу стоматологов-хирургов. В ходе воспалительной реакции, ассоциированной с действием травматической окклюзии, в области критического действия на пародонтальную связку наблюдается миграция лейкоцитов (нейтрофилов и макрофагов). А если учесть, что такая ситуация может наблюдаться и после выполнения определенных пародонтологических вмешательств, то следует клинически полностью минимизировать риск развития окклюзионной травмы среди пародонтологических пациентов с целью исключения возможности развития вторичных ятрогенных осложнений. В данной статье будут рассмотрены аспекты влияния окклюзионных сил разной интенсивности на структуру тканей пародонта и проанализировано их потенциальное влияние на заживления ран после выполнения определенных пародонтолологических манипуляций.
Побочные эффекты травматической окклюзии на клинические результаты лечения
По причине вышеописанных биологических механизмов развития воспаления окклюзионная травма может негативно влиять на процесс заживления пародонтологической раны после выполнения ятрогенных вмешательств в структуре тканей пародонта. Именно поэтому признаки подвижности зубов и травматической окклюзиии должны быть продиагностированы и откорректированы еще на этапах планирования будущего лечения, а не в ходе постоперационного мониторинга.
Reinhardt и коллеги использовали метод конечных элементов для того, чтобы определить, в какой зоне, в зависимости от точки приложения силы на пародонтальную связку, воспалительное поражение начнется раньше всего. Для этой цели авторы тщательно изучали специфику функционирования центральных резцов верхней челюсти. Интересным оказалось то, что в ходе исследования удалось установить, что уровень редукции альвеолярной кости оказался мало зависимым от значения напряжения в области пародонтальной связки до момента, когда убыль кости уже достигла 6 мм. Также было отмечено, что значение напряжения на пародонтальную связку при той же прилагаемой силе в условиях потери 4-6 мм удерживающей костной ткани практически удваивается, таким образом, эффект окклюзионной травмы, по сути, начинает прогрессировать. Данный факт является крайне важным для учета при проведении манипуляций направленной регенерации тканей, ведь если концентрация действующих сил будет прилагаться на область вмешательства, то риск потери используемого трансплантата и мембраны повышается практически сразу в несколько раз. Harrel и Nunn более детально обсуждали эффект выполняемых окклюзионных коррекций на ткани пародонта. В их исследовании принимало участие 89 человек с патологиями пародонта и зарегистрированными окклюзионными параметрами. 30 пациентам не было предоставлено никакого лечения, 18 была проведена процедура очистки и полировки поверхностей корня, а 41 – хирургическое лечения имеющейся патологии. Ученым удалось установить, что пациенты со смежно существующими окклюзионными проблемами и глубокими пародонтальными карманами характеризуются худшим прогнозом лечения и повышением уровня подвижности отдельных зубов при сравнении этих же параметров с группой пациентов, у которых не отмечалось никаких смежных окклюзионных нарушений. Таким образом, авторам удалось установить, что наличие неконтролируемых окклюзионных изменений само по себе является фактором риска для потенциального развития заболеваний пародонтального комплекса. Также исследователями было установлено, что зубы, которым проводилась окклюзионная коррекция, или которые не характеризовались наличием каких-либо первичных окклюзионных нарушений, демонстрировали более низкие показатели риска ухудшения их начального состояния по сравнению с теми зубами, в области которых не было проведено надлежащей окклюзионной адаптации.
Авторам удалось установить, чтобы зубы с окклюзионными отклонениями, лечение которых не проводилось в ходе комплексной реабилитации, характеризовались более прогрессивным увеличением глубины пародонтальных карманов с каждым годом наблюдения. Таким образом, окклюзионная травма доказательно влияет не только на параметр подвижности зубов, но и на глубину пародонтальных карманов, компрометируя общий пародонтологический статус пациента.
Palcanis также подтвердил факт наличия изменений в области пародонтальной связки под действием окклюзионной травмы на животной модели собак. После резекции корональной части зубов автор вводил в область пародонтальной связки специальную канюлю через пространство пульповой камеры. Таким образом удавалось изолировано повысить давление в пародонтальной связке, не прибегая к более сложным вариантам имитации чрезмерной компрессии на ткани пародонта. Кроме того, такой подход позволял автору точно измерять давление, которое действовало на пародонтальную связку. Biancu, Ericsson и Lindhe проводили исследования с целью определения механизмов влияния травмы на существующую деструкцию в области пародонта, определяя, как давление может спровоцировать прогрессирующую потерю пародонтального прикрепления. Исследования проводилось на годовалых собаках породы бигль. У восьми псов был установлен ортодонтический эластик, который провоцировал расшатывание коронки зуба. Положение эластика для формирования расшатывающего движения меняли с язычной на вестибулярную сторону и наоборот дважды в неделю на протяжении 3 месяцев. В конце исследования проводили также контроль за уровнем накопления зубного налета. Результаты гистологических исследований продемонстрировали, что наиболее корональная часть пародонтальной связки демонстрирует признаки чрезмерной подвижности, снижения количества коллагена в пространстве связки и увеличения количества сосудов и клеток воспалительного инфильтрата (лейкоцитов). Интересно, что в области прилегающей кости также отмечалось увеличение количества остеокластов, а количество коллагеновых волокон, которые соединяли структуры цемента зуба с альвеолярной лункой, наоборот, было уменьшено.
Таким образом, можно предположить, что качественные изменения в структуре пародонта ассоциированы с действием чрезмерных сил, превышающих все биологические и физиологические нормы и которые провоцируют развитие подвижности зубов.
Элиминация подобного эффекта позволит снизить риск развития поражения окружающих тканей и будет способствовать нормальному заживлению терапевтической раны в структуре пародонта. Бразильские ученые изучали эффект окклюзионный травмы на пародонтальную связку, преднамеренно завышая прикус у мышей путем наложения чрезмерно высоких пломб из амальгамы или композита. Результаты гистологического анализа продемонстрировали признаки травматического поражения связки (дезорганизация структуры, иррегулярность рисунка альвеолярной кости), причем выраженность таковых была больше в области зубов, восстановленных посредством амальгамы, нежели в области зубов, восстановленных при использовании композитных материалов.
Признаки травмы пародонта в результате окклюзионного взаимодействия
Травма в результате окклюзионного взаимодействия (TFO) представляет собой патологические нарушения в структуре тканей пародонта, вызванные действием жевательных мышц. Подобные нарушения наблюдаются в случаях парафункциональной активности, в результате проведения ятрогенных вмешательств, при разных формах нарушения прикуса, а также при миграции зубов. Stillman определил травму пародонта в результате окклюзионного взаимодействия как «состояние, при котором поражение тканей, которые обеспечивают поддержку зуба, развивается в результате тесного контакта между зубами-антагонистами». Причинами оклюзионно-ассоциированной травмы могут быть преждевременные контакты, парафункции (по типу бруксизма), а также изменения положения зубов с течением времени. Кроме того, Глоссарий терминов Американской академии пародонтологии выделяет два отдельных понятия – первичная и вторична окклюзионная травма. При первичной окклюзионной травме происходит поражение зубов со здоровым состоянием окружающих пародонтальных тканей в результате действия чрезмерно высоких окклюзионных сил. При вторичной окклюзионной травме зубы подвергаются действию нормальных окклюзионных сил, однако состояние их пародонта уже является компрометированным, из-за чего действие даже физиологически допустимых окклюзионных напряжений провоцирует прогрессирующее поражение пародонта.
Комбинированная окклюзионная травма представляет собой патологию, при которой чрезмерные окклюзионные нагрузки действуют на зуб, состояние пародонта которого и без того является проблематичным. Исходя их этого, травматическая окклюзия может быть определена как окклюзия, которая провоцирует поражение связочного аппарата зуба.
Клинические признаки пародонтального поражения, вызванного действием окклюзионных нагрузок у разных индивидов, проявляются по-разному. Jin и Cao проводили исследование, в котором авторы пытались связать влияние травматической окклюзии со степенью сложности патологии пародонтита. Для этой цели исследователи проводили анализ среди 32 пациентов со средней и тяжелой формами пародонтального поражения на базе Пекинского медицинского университета. Все зубы, в области которых отмечалось увеличение глубины пародонтального зондирования и потеря поддерживающей костной ткани, были изучены изолировано от зубов, которые, несмотря на присущие окклюзионные изменения, демонстрировали функциональную стабильность.
В результате исследования авторами было предложено использовать два показателя – индекс окклюзионно-ассоциированой травмы и индекс адаптивности. Высокие показатели индекса окклюзионно-ассоциированой травмы характеризовали расширение области пародонтальной связки, повышение функциональной подвижности зубов, а также более высокий риск прогрессирования пародонтальных карманов и потери пародонтального прикрепления. При высоких показателях индекса адаптивности зубы характеризовались наличием фасеток истирания и сравнительно меньшим уровнем потери окружающей костной ткани, а также очень медленным снижением показателей уровня пародонтального прикрепления.
Отсутствие окклюзии
Как уже было описано выше, механическая нагрузка непосредственно инициирует прогрессирование процесса костного ремоделирования, однако окклюзионная гипофункция с другой стороны (например, из-за потери зубов-антагонистов) провоцирует развитие начальных признаков остеопороза. Сами же механизмы, которые реализуют процесс потери костной массы, до сих пор до конца не изучены.
В недавнем исследовании Xu и коллег было установлено, что отсутствие окклюзионного взаимодействия приводит не только к потере костной массы, но также к изменению архитектуры в структуре самой кости. Кроме того, оказалось, что данные процессы коррелируют с активностью склеростина – молекулы, которая секретируется остеоцитами, и которая по своему действию является анатагонистом сигнального пути Wnt/ß-катенина. Присоединяясь к LRP5 / 6 рецептору склеростин ингибирует формирование костной ткани клетками-остеобластами. В дальнейшем эта же молекула индуцирует промоцию процесса остеокластогенеза и экспрессии RANKL, которые принимают участие в резорбции костной ткани. Для более обширного понимания механизмов потери костной ткани в состоянии гипо-окклюзии необходимо обеспечить проведение дальнейших исследований, которые будут концентрироваться на биологических и механических аспектах костного ремоделирования.
Фазы заживления пародонтальной раны
Заживление пародонтальной раны является неотъемлемым этапом в процессе реабилитации пациентов после выполнения ятрогенных вмешательств в структуре пародонта. Однако, и данный процесс предусматривает реализацию ряда определенных этапов, описание которых будет приведено ниже.
Фаза гемостаза и воспаления
Цель реализации организмом фазы гемостаза и воспаления в области пародонтальной раны заключается в том, чтобы элиминировать из области вмешательства все возможные бактерии и антигены, и добиться первичной коагуляции в зоне интереса. Во время гемостаза фибриноген в структуре экссудата запускает механизм свертывания крови и формирует фибриновую сетку. Именно благодаря последней кровотечение останавливается. На протяжении всех 24 часов после вмешательства активно реализуется весь механизм воспалительной реакции, который включает как клеточные, так и сосудистые составляющие. Высвобождение гистамина и серотонина в области вмешательства вызывает вазодилатацию и позволяет фагоцитам свободно мигрировать в участок раны.
Направленная миграция нейтрофилов происходит за счет хемокинов, каскада факторов комплимента и тех пептидов, которые высвобождаются во время свертывания крови. После попадания в рану нейтрофилы высвобождают реактивные фракции оксигена, за счет которых и происходит очищение раны. Кроме того, нейтрофилы обеспечивают выпуск протеаз, которые лизируют бактериальные клетки, удаление же другого налета происходит за счет фагоцитов. Также нейтрофилы формируют так называемые нейтрофильные внеклеточные ловушки, которые впоследствии проходят через процессы ядерной и мембранной дезинтеграции, деконденсации хроматина, растворения цитоплазмы и диффузии с цитоплазматическими протеинами. В ходе реализации данного феномена также возникают разрывы плазменной мембраны и высвобождение волокон хроматина (которые сформированы из ДНК), гистонов, и еще 20 разных белков, включая эластазу, миелопероксидазу, катепсин G, протеиназу 3, высокоподвижную группу протеинов В1, и LL37.18. Формирование внеклеточной нейтрофильной сетки приводит и к активации иммунных клеток, которые укрепляют биологический барьер в области раны и обеспечивают защиту от возможного проникновения микробных антигенов. В конечном счете достигается фаза деградации провоспалительных медиаторов, что позволяет уменьшить общий объем воспаления, и также обеспечивает профилактику развития хронической его формы.
Если же процесс формирования и развития внеклеточной нейтрофильной сетки каким-то образом развивается не так, как было описано выше, это может привести к хроническому воспалению пародонтальной раны, и ее длительному незаживлению. Повышенный риск изменений в структуре механизма воспаления отмечается при разных хронических и аутоиммунных заболеваниях по типу ревматоидного артрита, системной волчанки и хронических диабетических язв. Макрофаги также являются критически важным иммунологическим регулятором, участвующим в очистке области раны и развитии процесса воспаления. Макрофаги M1 разных подтипов обеспечивают реализацию этапа непосредственного воспаления, в то время как макрофаги фенотипа М2 классифицируются как противоспалительный фенотип клеток, который принимает участие в разрешении воспаления и заживлении пародонтальной раны. Классически на микробный стимул (липополисахариды) или цитокины (TNF и гранулоцитарный макрофагальный колониестимулирующий фактор [GM-CSF]) реагируют макрофаги фенотипа M1, в то время как другие цитокины (т.е. интерлейкин [IL] -4, IL-13, IL-33) связаны с поляризацией и дифференциаций альвеолярных макрофагов в клетки фенотипа M2.
Миграционная фаза
Миграционная фаза предусматривает движение эпителиальных клеток и фибробластов из краев раны на встречу друг другу, что в результате приводит к закрытию поверхности раны. Миграция клеток является основной составляющей в процессе замещения утраченных тканей и контролируется за счет междуклеточных взаимодействий и локальных факторов.
Пролиферативная фаза
Пролиферативная фаза реализуется вместе с и после миграционной фазы (с 3 дня). На данном этапе формируется грануляционная ткань, которая состоит из капиллярных и лимфатических сосудов, проросших в область раны. Коллаген синтезируется фибробластами, что укрепляет область заживления на протяжении 14 дней. В конце этого периода плотность сосудистой составляющей снижается, а признаки отека практически исчезают.
Фаза ремоделирования
Эта фаза характеризуется созреванием клеточной соединительной ткани и утолщением эпителиальной прослойки, что приводит к образованию шрама. При этом клеточная грануляционная ткань изменяется и становиться бесклеточной массой на протяжении от нескольких месяцев до 2 лет.
Влияние окклюзии на заживление пародонтальной раны
Процесс заживления раны предусматривает реализацию ряда этапов, включая воспалительную реакцию, ее разрешение и структурное ремоделирование с созреванием тканей пародонта в пораженной области. Лечение ран должно учитывать несколько этапов, включая воспалительный ответ и разрешение, а также ремоделирование и созревание окончательной структуры. При заживлении раны в области пародонтальной связки нужно учитывать факт влияния окклюзионной травмы как с биологической, так и с физиологической перспектив, поскольку фактор травматической окклюзии может спровоцировать не только развитие нежелательных изменений, но и ингибирование процесса прогрессирующего роста костной ткани. Окклюзионная травма также может вызвать дезориентацию волокон в структуре пародонтальной связки, снижение количества таковых, повышение объема клеточного инфильтрата, сдвиг костного ремоделирования в сторону остеокластогенеза, тромбоз вен, и даже некроз пародонтальной связки, что ранее уже было описано в литературе. Дальнейшее прогрессирование фактора травматической окклюзии негативно влияет на репарацию пародонтальной связки и ее адекватное кровоснабжение. Все вышеперечисленные негативные эффекты приобретают все большее значение в случаях заживления пародонта после дентальной имплантации в рамках направленной регенерации ткани, или даже при травмах зубов. Так, компрессия пародонтальной связки провоцирует ее воспалительное расширение, а, следовательно, и уменьшение количества удерживающих коллагеновых волокон. На фото 1 проиллюстрировано влияние окклюзии на параметры заживления раны.
Фото 1. Каскад реакций в ходе заживления раны. Негативный эффект окклюзионный травмы на пародонт включает компрессию пародонтальной связки, тромбоз, формирование воспалительного инфильтрата, остеокластогенез и возможную потерю трансплантата, посредством которого проводилась аугментация. Также может отмечаться лимфоцитарная инфильтрация, резорбция костной ткани, требующие проведения более инвазивных вмешательств на пародонте.
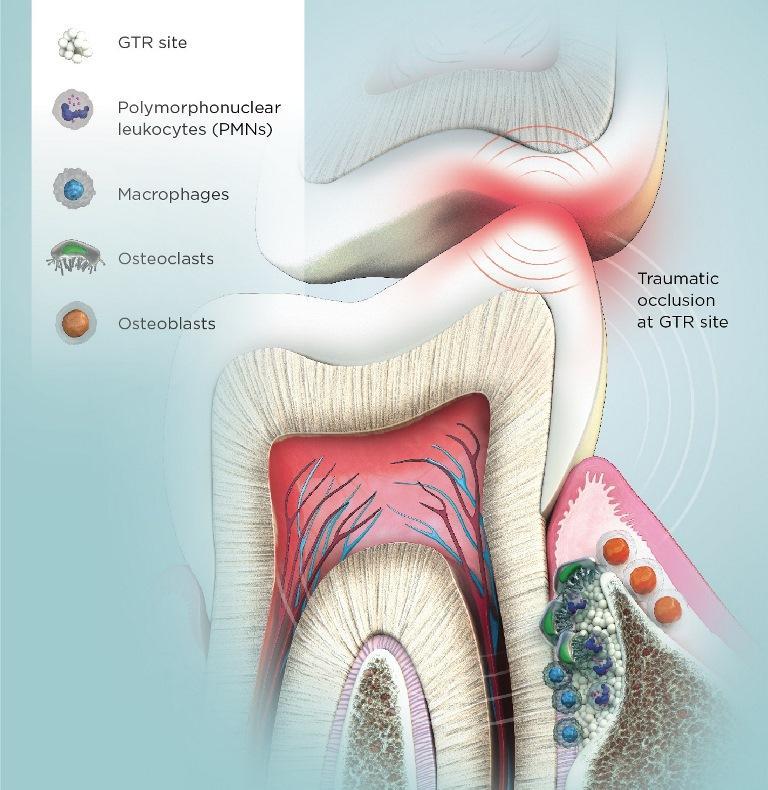
Компрессия же костной ткани приводит к повышению уровня функциональной подвижности зубов с окружающим формированием воспалительного инфильтрата. Окклюзия просвета кровеносных сосудов непосредственно приводит к потере пародонтального прикрепления и уровня окружающей костной ткани, начинает развиваться сдвиг системы в сторону остеокластогенеза. Асептическое воспаление тканей пародонта проявляется формированием фасеток истирания зубов, и поступательным некрозом пародонтальной связки под значительной продолжительной окклюзионной нагрузкой. Ремоделирование костной ткани под действием неконтролированных окклюзионных сил хоть и характеризуется адаптивным утолщением твердой костной пластинки, но также чревато и тромбозом вен в структуре кости.
Таким образом, для того, чтобы предотвратить все потенциальные негативные последствия, пародонтологические пациенты должны быть тщательно продиагностированы на предмет окллюзионных соотношений после выполнения любых хирургических и регенераторных манипуляций на тканях пародонта. Потеря костной ткани, вызванная фактором травматической окклюзии при отсутствии бактериально-индуцированного воспаления, является обратимой. Аналогичная ситуация и с травматическим поражением пародонтальной связки в результате неадекватной окклюзионной нагрузки – при исключении провоцирующего фактора связка самостоятельно восстанавливается.
Таким образом, стоматологии должны уделять должное внимание факту диагностики травматической окклюзии у всех стоматологических пациентов, и особенно у тех, которым была выполнена процедура направленной регенерации тканей. Ведь гармоническое состояние окклюзионного соотношения также является фактором успешного достижения регенерации тканей вокруг предварительно пораженных зубов, или же в области установленных имплантатов.
Клинические применения и выводы
Исходя из имеющихся данных, авторы могут резюмировать, что травматическая окклюзия может провоцировать развитие пагубного воспалительного эффекта, подобного хроническим ранам, что может в итоге негативно повлиять на регенерацию тканей пародонта. Кроме того, хронические воспаления раны, вызванные окклюзионной нагрузкой, могут усугубляться в контексте других аутоиммунных нарушений или хронических воспалительных состояний (например, при диабете). В подобных случаях необходимо предпринимать все доступные меры, чтобы нивелировать подобные негативные последствия. Также необходимо помнить, что процесс заживления раны состоит из четырех фаз – гемостаза, миграции клеток, пролиферации и ремоделирования, которые должны быть сбалансированы между собой и обеспечивать естественный механизм очистки и восстановления пораженных тканей пародонта.
С целью обеспечения регенерации тканей пародонта в условиях травматической окклюзии необходимо исключить влияние всех идентифицированных окклюзионных несоответствий (как осевых, так и неосевых), которые провоцируют повышение уровня биологической подвижности зубов в структуре пародонта. Все рабочие и нерабочие окклюзионные контакты должны быть проверены и скорректированы перед проведением анестезии, дабы врач был уверен, что окклюзионная коррекция была проведена в условиях нормальной проприоцептивной чувствительности пациента. Кроме того, важно обеспечить детализированную пародонтальную диагностику в области потенциально проблемных зубов, а также мониторинг за изменениями окклюзионных направляющих в долгосрочной перспективе после окончания непосредственной реабилитации стоматологического пациента.
Авторы:
Ann M. Decker, DMD
Hom-Lay Wang, DDS, MSD, PhD
В результате травматической окклюзии (фактор короткого времени действия) или ортодонтического лечения (фактор долгого времени действия) в области пародонтальной связки и в смежных с ней участках начинает развиваться механическое напряжение, которое само по себе запускает биохимическую реакцию со стороны структур зубочелюстного аппарата. Такая реакция состоит из целого каскада биологических и химических этапов, совокупность которых определяет комплексный характер адаптивных свойств организма.

Если подобные механизмы имеют возможность развиваться на протяжении нескольких часов, начинают прогрессировать уже и метаболические нарушения, которые связаны с высвобождением вторичных маркеров воспаления по типу циклического аденозин-монофосфата и фактора некроза опухолей альфа (TNF), последний при этом включает активатор рецептора ядерного транскрипционного фактора [NF-κB] (RANK) / рецептора лиганда NF-κB (RANKL) и молекулы остеопротегерина (OPG). Данные факторы стимулируют процесс ремоделирования и резорбции костной ткани.
В конечном счете все эти биохимические реакции непосредственно влияют на работу стоматологов-хирургов. В ходе воспалительной реакции, ассоциированной с действием травматической окклюзии, в области критического действия на пародонтальную связку наблюдается миграция лейкоцитов (нейтрофилов и макрофагов). А если учесть, что такая ситуация может наблюдаться и после выполнения определенных пародонтологических вмешательств, то следует клинически полностью минимизировать риск развития окклюзионной травмы среди пародонтологических пациентов с целью исключения возможности развития вторичных ятрогенных осложнений. В данной статье будут рассмотрены аспекты влияния окклюзионных сил разной интенсивности на структуру тканей пародонта и проанализировано их потенциальное влияние на заживления ран после выполнения определенных пародонтолологических манипуляций.
Побочные эффекты травматической окклюзии на клинические результаты лечения
По причине вышеописанных биологических механизмов развития воспаления окклюзионная травма может негативно влиять на процесс заживления пародонтологической раны после выполнения ятрогенных вмешательств в структуре тканей пародонта. Именно поэтому признаки подвижности зубов и травматической окклюзиии должны быть продиагностированы и откорректированы еще на этапах планирования будущего лечения, а не в ходе постоперационного мониторинга.
Reinhardt и коллеги использовали метод конечных элементов для того, чтобы определить, в какой зоне, в зависимости от точки приложения силы на пародонтальную связку, воспалительное поражение начнется раньше всего. Для этой цели авторы тщательно изучали специфику функционирования центральных резцов верхней челюсти. Интересным оказалось то, что в ходе исследования удалось установить, что уровень редукции альвеолярной кости оказался мало зависимым от значения напряжения в области пародонтальной связки до момента, когда убыль кости уже достигла 6 мм. Также было отмечено, что значение напряжения на пародонтальную связку при той же прилагаемой силе в условиях потери 4-6 мм удерживающей костной ткани практически удваивается, таким образом, эффект окклюзионной травмы, по сути, начинает прогрессировать. Данный факт является крайне важным для учета при проведении манипуляций направленной регенерации тканей, ведь если концентрация действующих сил будет прилагаться на область вмешательства, то риск потери используемого трансплантата и мембраны повышается практически сразу в несколько раз. Harrel и Nunn более детально обсуждали эффект выполняемых окклюзионных коррекций на ткани пародонта. В их исследовании принимало участие 89 человек с патологиями пародонта и зарегистрированными окклюзионными параметрами. 30 пациентам не было предоставлено никакого лечения, 18 была проведена процедура очистки и полировки поверхностей корня, а 41 – хирургическое лечения имеющейся патологии. Ученым удалось установить, что пациенты со смежно существующими окклюзионными проблемами и глубокими пародонтальными карманами характеризуются худшим прогнозом лечения и повышением уровня подвижности отдельных зубов при сравнении этих же параметров с группой пациентов, у которых не отмечалось никаких смежных окклюзионных нарушений. Таким образом, авторам удалось установить, что наличие неконтролируемых окклюзионных изменений само по себе является фактором риска для потенциального развития заболеваний пародонтального комплекса. Также исследователями было установлено, что зубы, которым проводилась окклюзионная коррекция, или которые не характеризовались наличием каких-либо первичных окклюзионных нарушений, демонстрировали более низкие показатели риска ухудшения их начального состояния по сравнению с теми зубами, в области которых не было проведено надлежащей окклюзионной адаптации.
Авторам удалось установить, чтобы зубы с окклюзионными отклонениями, лечение которых не проводилось в ходе комплексной реабилитации, характеризовались более прогрессивным увеличением глубины пародонтальных карманов с каждым годом наблюдения. Таким образом, окклюзионная травма доказательно влияет не только на параметр подвижности зубов, но и на глубину пародонтальных карманов, компрометируя общий пародонтологический статус пациента.
Palcanis также подтвердил факт наличия изменений в области пародонтальной связки под действием окклюзионной травмы на животной модели собак. После резекции корональной части зубов автор вводил в область пародонтальной связки специальную канюлю через пространство пульповой камеры. Таким образом удавалось изолировано повысить давление в пародонтальной связке, не прибегая к более сложным вариантам имитации чрезмерной компрессии на ткани пародонта. Кроме того, такой подход позволял автору точно измерять давление, которое действовало на пародонтальную связку. Biancu, Ericsson и Lindhe проводили исследования с целью определения механизмов влияния травмы на существующую деструкцию в области пародонта, определяя, как давление может спровоцировать прогрессирующую потерю пародонтального прикрепления. Исследования проводилось на годовалых собаках породы бигль. У восьми псов был установлен ортодонтический эластик, который провоцировал расшатывание коронки зуба. Положение эластика для формирования расшатывающего движения меняли с язычной на вестибулярную сторону и наоборот дважды в неделю на протяжении 3 месяцев. В конце исследования проводили также контроль за уровнем накопления зубного налета. Результаты гистологических исследований продемонстрировали, что наиболее корональная часть пародонтальной связки демонстрирует признаки чрезмерной подвижности, снижения количества коллагена в пространстве связки и увеличения количества сосудов и клеток воспалительного инфильтрата (лейкоцитов). Интересно, что в области прилегающей кости также отмечалось увеличение количества остеокластов, а количество коллагеновых волокон, которые соединяли структуры цемента зуба с альвеолярной лункой, наоборот, было уменьшено.
Таким образом, можно предположить, что качественные изменения в структуре пародонта ассоциированы с действием чрезмерных сил, превышающих все биологические и физиологические нормы и которые провоцируют развитие подвижности зубов.
Элиминация подобного эффекта позволит снизить риск развития поражения окружающих тканей и будет способствовать нормальному заживлению терапевтической раны в структуре пародонта. Бразильские ученые изучали эффект окклюзионный травмы на пародонтальную связку, преднамеренно завышая прикус у мышей путем наложения чрезмерно высоких пломб из амальгамы или композита. Результаты гистологического анализа продемонстрировали признаки травматического поражения связки (дезорганизация структуры, иррегулярность рисунка альвеолярной кости), причем выраженность таковых была больше в области зубов, восстановленных посредством амальгамы, нежели в области зубов, восстановленных при использовании композитных материалов.
Признаки травмы пародонта в результате окклюзионного взаимодействия
Травма в результате окклюзионного взаимодействия (TFO) представляет собой патологические нарушения в структуре тканей пародонта, вызванные действием жевательных мышц. Подобные нарушения наблюдаются в случаях парафункциональной активности, в результате проведения ятрогенных вмешательств, при разных формах нарушения прикуса, а также при миграции зубов. Stillman определил травму пародонта в результате окклюзионного взаимодействия как «состояние, при котором поражение тканей, которые обеспечивают поддержку зуба, развивается в результате тесного контакта между зубами-антагонистами». Причинами оклюзионно-ассоциированной травмы могут быть преждевременные контакты, парафункции (по типу бруксизма), а также изменения положения зубов с течением времени. Кроме того, Глоссарий терминов Американской академии пародонтологии выделяет два отдельных понятия – первичная и вторична окклюзионная травма. При первичной окклюзионной травме происходит поражение зубов со здоровым состоянием окружающих пародонтальных тканей в результате действия чрезмерно высоких окклюзионных сил. При вторичной окклюзионной травме зубы подвергаются действию нормальных окклюзионных сил, однако состояние их пародонта уже является компрометированным, из-за чего действие даже физиологически допустимых окклюзионных напряжений провоцирует прогрессирующее поражение пародонта.
Комбинированная окклюзионная травма представляет собой патологию, при которой чрезмерные окклюзионные нагрузки действуют на зуб, состояние пародонта которого и без того является проблематичным. Исходя их этого, травматическая окклюзия может быть определена как окклюзия, которая провоцирует поражение связочного аппарата зуба.
Клинические признаки пародонтального поражения, вызванного действием окклюзионных нагрузок у разных индивидов, проявляются по-разному. Jin и Cao проводили исследование, в котором авторы пытались связать влияние травматической окклюзии со степенью сложности патологии пародонтита. Для этой цели исследователи проводили анализ среди 32 пациентов со средней и тяжелой формами пародонтального поражения на базе Пекинского медицинского университета. Все зубы, в области которых отмечалось увеличение глубины пародонтального зондирования и потеря поддерживающей костной ткани, были изучены изолировано от зубов, которые, несмотря на присущие окклюзионные изменения, демонстрировали функциональную стабильность.
В результате исследования авторами было предложено использовать два показателя – индекс окклюзионно-ассоциированой травмы и индекс адаптивности. Высокие показатели индекса окклюзионно-ассоциированой травмы характеризовали расширение области пародонтальной связки, повышение функциональной подвижности зубов, а также более высокий риск прогрессирования пародонтальных карманов и потери пародонтального прикрепления. При высоких показателях индекса адаптивности зубы характеризовались наличием фасеток истирания и сравнительно меньшим уровнем потери окружающей костной ткани, а также очень медленным снижением показателей уровня пародонтального прикрепления.
Отсутствие окклюзии
Как уже было описано выше, механическая нагрузка непосредственно инициирует прогрессирование процесса костного ремоделирования, однако окклюзионная гипофункция с другой стороны (например, из-за потери зубов-антагонистов) провоцирует развитие начальных признаков остеопороза. Сами же механизмы, которые реализуют процесс потери костной массы, до сих пор до конца не изучены.
В недавнем исследовании Xu и коллег было установлено, что отсутствие окклюзионного взаимодействия приводит не только к потере костной массы, но также к изменению архитектуры в структуре самой кости. Кроме того, оказалось, что данные процессы коррелируют с активностью склеростина – молекулы, которая секретируется остеоцитами, и которая по своему действию является анатагонистом сигнального пути Wnt/ß-катенина. Присоединяясь к LRP5 / 6 рецептору склеростин ингибирует формирование костной ткани клетками-остеобластами. В дальнейшем эта же молекула индуцирует промоцию процесса остеокластогенеза и экспрессии RANKL, которые принимают участие в резорбции костной ткани. Для более обширного понимания механизмов потери костной ткани в состоянии гипо-окклюзии необходимо обеспечить проведение дальнейших исследований, которые будут концентрироваться на биологических и механических аспектах костного ремоделирования.
Фазы заживления пародонтальной раны
Заживление пародонтальной раны является неотъемлемым этапом в процессе реабилитации пациентов после выполнения ятрогенных вмешательств в структуре пародонта. Однако, и данный процесс предусматривает реализацию ряда определенных этапов, описание которых будет приведено ниже.
Фаза гемостаза и воспаления
Цель реализации организмом фазы гемостаза и воспаления в области пародонтальной раны заключается в том, чтобы элиминировать из области вмешательства все возможные бактерии и антигены, и добиться первичной коагуляции в зоне интереса. Во время гемостаза фибриноген в структуре экссудата запускает механизм свертывания крови и формирует фибриновую сетку. Именно благодаря последней кровотечение останавливается. На протяжении всех 24 часов после вмешательства активно реализуется весь механизм воспалительной реакции, который включает как клеточные, так и сосудистые составляющие. Высвобождение гистамина и серотонина в области вмешательства вызывает вазодилатацию и позволяет фагоцитам свободно мигрировать в участок раны.
Направленная миграция нейтрофилов происходит за счет хемокинов, каскада факторов комплимента и тех пептидов, которые высвобождаются во время свертывания крови. После попадания в рану нейтрофилы высвобождают реактивные фракции оксигена, за счет которых и происходит очищение раны. Кроме того, нейтрофилы обеспечивают выпуск протеаз, которые лизируют бактериальные клетки, удаление же другого налета происходит за счет фагоцитов. Также нейтрофилы формируют так называемые нейтрофильные внеклеточные ловушки, которые впоследствии проходят через процессы ядерной и мембранной дезинтеграции, деконденсации хроматина, растворения цитоплазмы и диффузии с цитоплазматическими протеинами. В ходе реализации данного феномена также возникают разрывы плазменной мембраны и высвобождение волокон хроматина (которые сформированы из ДНК), гистонов, и еще 20 разных белков, включая эластазу, миелопероксидазу, катепсин G, протеиназу 3, высокоподвижную группу протеинов В1, и LL37.18. Формирование внеклеточной нейтрофильной сетки приводит и к активации иммунных клеток, которые укрепляют биологический барьер в области раны и обеспечивают защиту от возможного проникновения микробных антигенов. В конечном счете достигается фаза деградации провоспалительных медиаторов, что позволяет уменьшить общий объем воспаления, и также обеспечивает профилактику развития хронической его формы.
Если же процесс формирования и развития внеклеточной нейтрофильной сетки каким-то образом развивается не так, как было описано выше, это может привести к хроническому воспалению пародонтальной раны, и ее длительному незаживлению. Повышенный риск изменений в структуре механизма воспаления отмечается при разных хронических и аутоиммунных заболеваниях по типу ревматоидного артрита, системной волчанки и хронических диабетических язв. Макрофаги также являются критически важным иммунологическим регулятором, участвующим в очистке области раны и развитии процесса воспаления. Макрофаги M1 разных подтипов обеспечивают реализацию этапа непосредственного воспаления, в то время как макрофаги фенотипа М2 классифицируются как противоспалительный фенотип клеток, который принимает участие в разрешении воспаления и заживлении пародонтальной раны. Классически на микробный стимул (липополисахариды) или цитокины (TNF и гранулоцитарный макрофагальный колониестимулирующий фактор [GM-CSF]) реагируют макрофаги фенотипа M1, в то время как другие цитокины (т.е. интерлейкин [IL] -4, IL-13, IL-33) связаны с поляризацией и дифференциаций альвеолярных макрофагов в клетки фенотипа M2.
Миграционная фаза
Миграционная фаза предусматривает движение эпителиальных клеток и фибробластов из краев раны на встречу друг другу, что в результате приводит к закрытию поверхности раны. Миграция клеток является основной составляющей в процессе замещения утраченных тканей и контролируется за счет междуклеточных взаимодействий и локальных факторов.
Пролиферативная фаза
Пролиферативная фаза реализуется вместе с и после миграционной фазы (с 3 дня). На данном этапе формируется грануляционная ткань, которая состоит из капиллярных и лимфатических сосудов, проросших в область раны. Коллаген синтезируется фибробластами, что укрепляет область заживления на протяжении 14 дней. В конце этого периода плотность сосудистой составляющей снижается, а признаки отека практически исчезают.
Фаза ремоделирования
Эта фаза характеризуется созреванием клеточной соединительной ткани и утолщением эпителиальной прослойки, что приводит к образованию шрама. При этом клеточная грануляционная ткань изменяется и становиться бесклеточной массой на протяжении от нескольких месяцев до 2 лет.
Влияние окклюзии на заживление пародонтальной раны
Процесс заживления раны предусматривает реализацию ряда этапов, включая воспалительную реакцию, ее разрешение и структурное ремоделирование с созреванием тканей пародонта в пораженной области. Лечение ран должно учитывать несколько этапов, включая воспалительный ответ и разрешение, а также ремоделирование и созревание окончательной структуры. При заживлении раны в области пародонтальной связки нужно учитывать факт влияния окклюзионной травмы как с биологической, так и с физиологической перспектив, поскольку фактор травматической окклюзии может спровоцировать не только развитие нежелательных изменений, но и ингибирование процесса прогрессирующего роста костной ткани. Окклюзионная травма также может вызвать дезориентацию волокон в структуре пародонтальной связки, снижение количества таковых, повышение объема клеточного инфильтрата, сдвиг костного ремоделирования в сторону остеокластогенеза, тромбоз вен, и даже некроз пародонтальной связки, что ранее уже было описано в литературе. Дальнейшее прогрессирование фактора травматической окклюзии негативно влияет на репарацию пародонтальной связки и ее адекватное кровоснабжение. Все вышеперечисленные негативные эффекты приобретают все большее значение в случаях заживления пародонта после дентальной имплантации в рамках направленной регенерации ткани, или даже при травмах зубов. Так, компрессия пародонтальной связки провоцирует ее воспалительное расширение, а, следовательно, и уменьшение количества удерживающих коллагеновых волокон. На фото 1 проиллюстрировано влияние окклюзии на параметры заживления раны.
Фото 1. Каскад реакций в ходе заживления раны. Негативный эффект окклюзионный травмы на пародонт включает компрессию пародонтальной связки, тромбоз, формирование воспалительного инфильтрата, остеокластогенез и возможную потерю трансплантата, посредством которого проводилась аугментация. Также может отмечаться лимфоцитарная инфильтрация, резорбция костной ткани, требующие проведения более инвазивных вмешательств на пародонте.

Компрессия же костной ткани приводит к повышению уровня функциональной подвижности зубов с окружающим формированием воспалительного инфильтрата. Окклюзия просвета кровеносных сосудов непосредственно приводит к потере пародонтального прикрепления и уровня окружающей костной ткани, начинает развиваться сдвиг системы в сторону остеокластогенеза. Асептическое воспаление тканей пародонта проявляется формированием фасеток истирания зубов, и поступательным некрозом пародонтальной связки под значительной продолжительной окклюзионной нагрузкой. Ремоделирование костной ткани под действием неконтролированных окклюзионных сил хоть и характеризуется адаптивным утолщением твердой костной пластинки, но также чревато и тромбозом вен в структуре кости.
Таким образом, для того, чтобы предотвратить все потенциальные негативные последствия, пародонтологические пациенты должны быть тщательно продиагностированы на предмет окллюзионных соотношений после выполнения любых хирургических и регенераторных манипуляций на тканях пародонта. Потеря костной ткани, вызванная фактором травматической окклюзии при отсутствии бактериально-индуцированного воспаления, является обратимой. Аналогичная ситуация и с травматическим поражением пародонтальной связки в результате неадекватной окклюзионной нагрузки – при исключении провоцирующего фактора связка самостоятельно восстанавливается.
Таким образом, стоматологии должны уделять должное внимание факту диагностики травматической окклюзии у всех стоматологических пациентов, и особенно у тех, которым была выполнена процедура направленной регенерации тканей. Ведь гармоническое состояние окклюзионного соотношения также является фактором успешного достижения регенерации тканей вокруг предварительно пораженных зубов, или же в области установленных имплантатов.
Клинические применения и выводы
Исходя из имеющихся данных, авторы могут резюмировать, что травматическая окклюзия может провоцировать развитие пагубного воспалительного эффекта, подобного хроническим ранам, что может в итоге негативно повлиять на регенерацию тканей пародонта. Кроме того, хронические воспаления раны, вызванные окклюзионной нагрузкой, могут усугубляться в контексте других аутоиммунных нарушений или хронических воспалительных состояний (например, при диабете). В подобных случаях необходимо предпринимать все доступные меры, чтобы нивелировать подобные негативные последствия. Также необходимо помнить, что процесс заживления раны состоит из четырех фаз – гемостаза, миграции клеток, пролиферации и ремоделирования, которые должны быть сбалансированы между собой и обеспечивать естественный механизм очистки и восстановления пораженных тканей пародонта.
С целью обеспечения регенерации тканей пародонта в условиях травматической окклюзии необходимо исключить влияние всех идентифицированных окклюзионных несоответствий (как осевых, так и неосевых), которые провоцируют повышение уровня биологической подвижности зубов в структуре пародонта. Все рабочие и нерабочие окклюзионные контакты должны быть проверены и скорректированы перед проведением анестезии, дабы врач был уверен, что окклюзионная коррекция была проведена в условиях нормальной проприоцептивной чувствительности пациента. Кроме того, важно обеспечить детализированную пародонтальную диагностику в области потенциально проблемных зубов, а также мониторинг за изменениями окклюзионных направляющих в долгосрочной перспективе после окончания непосредственной реабилитации стоматологического пациента.
Авторы:
Ann M. Decker, DMD
Hom-Lay Wang, DDS, MSD, PhD






























































































































































0 комментариев