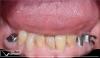
Одной из главных целей реконструкции нижней челюсти является восстановление ее непрерывности как целостной анатомической структуры и особенностей морфологии, чтобы в дальнейшем сформировать условия для проведения комплекса реабилитационных мероприятий, в том числе и дентальной имплантации. Возможности реализации данной цели могут быть ограничены агрессивным характером поражений и размером дефектов, сформировавшихся в результате их действия. С целью реконструкции в данное время доступен целый спектр трансплантационных материалов, но аутологичный трансплантат остается золотым стандартом для подобных ситуаций. И хотя применение свободного лоскута позволяет проводить процедуру непосредственной реконструкции, но использование гранулированного кортико-губчатого (ГКГ) трансплантата обеспечивает гораздо более точный подход для функциональной и эстетической реабилитации нижней челюсти. При этом стоимость использования данного материала является приемлемой, а послеоперационный дискомфорт сведен к минимуму.
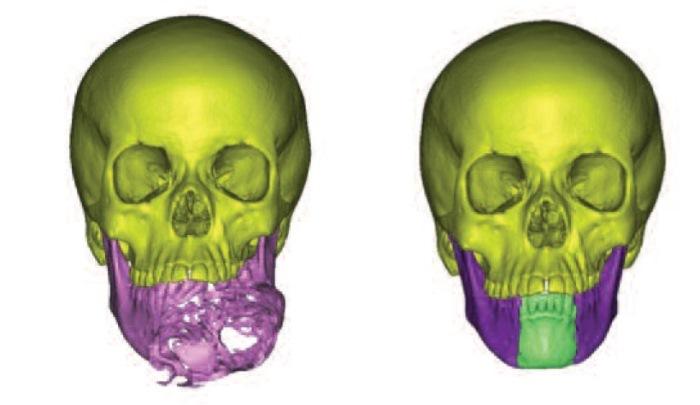
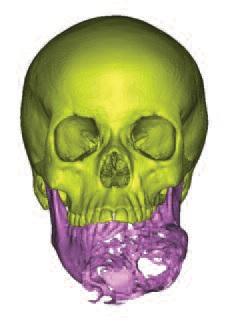
После клинического обследования, планирования резективной манипуляции и промежуточных этапов лечения, обязательным является проведение компьютерно-томографических (КТ) исследований. Файл сканирования сохраняется в формате Digital Imaging in Medicine (DICOM) и импортируется в программное обеспечение Mimics Softwate (Materialise, Левен, Бельгия). После этого КТ-снимок становиться доступным для детализированного анализа с возможностью имитации на нем процедуры графической резекции и последующей реконструкции с учетом степени и границы имеющегося поражения (фото 1).
Фото 1. Реформатированный КЛКТ-скан опухоли нижней челюсти.
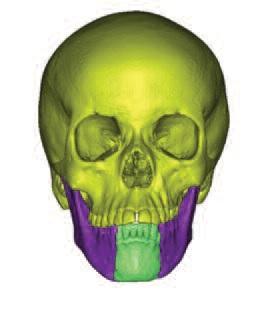
Трехмерные изображения также импортируются в 3-Matic (Materialise, Бельгия) для более точного воссоздания параметров нижней челюсти и прогнозирования будущей реконструкции с минимальными графическими искажениями (фото 2).
Фото 2. Идеально реконструированная нижняя челюсть.
Модель идеальной нижней челюсти изготавливается из порошка диоксида кремния ZP 131 и клеящего композита на 3D принтере Z Corp 510 3d (Z-Corp, Берлингтон, штат Массачусетс) (фото 3). После этого к полученной модели адаптируют 2.4 мм титановую пластину (фото 4).
Фото 3. Напечатанная 3D модель.
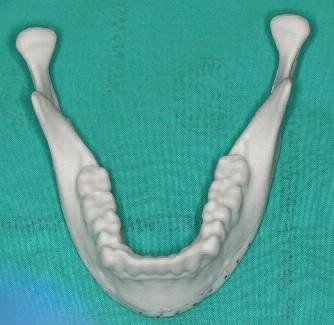
Фото 4. Титановая пластина с прокладкой для формирования пространства под ветви челюсти.
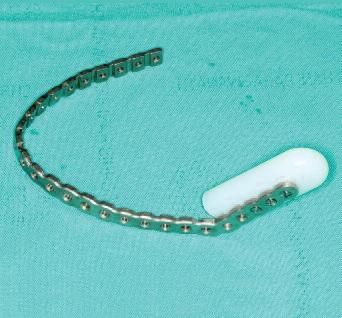
Опухоль в ходе хирургического вмешательства иссекается строго по ориентирам и границам, определенным в ходе графического планирования манипуляции (фото 5), а титановая пластина фиксируется на сохраненной части челюсти. После фиксации пластины к ее основе прикрепляют силиконовую прокладку. Прокладка играет роль наполнителя для формирования и сохранения места под костный трансплантат, которым заместят область дефекта через 8 месяцев после резекции (фото 6а и 6б).
Фото 5. Резецированная часть челюсти.
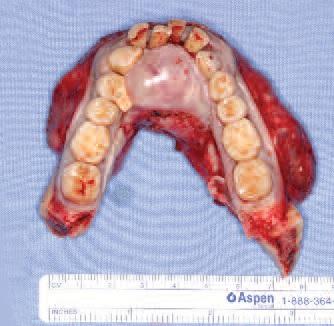
Фото 6. А – фиксация прокладки в полости рта; Б – фиксация прокладки к титановой пластине.
После фиксации прокладки для коррекции эстетического профиля пластины послабляют межчелюстную фиксацию. Затем послойно ушивают мягкие ткани, восстанавливая прикрепления надподъязычых и надгортанных мышц. После ушивания раны у пациента остается межчелюстная фиксация конструкции на период последующих 6 недель, а первые 24 часа после операции он находится под присмотром в отделении интенсивной терапии. Все лекарства вводятся внутривенно, а питание проходит через назогастральный зонд в течение первых 7 дней после операции.
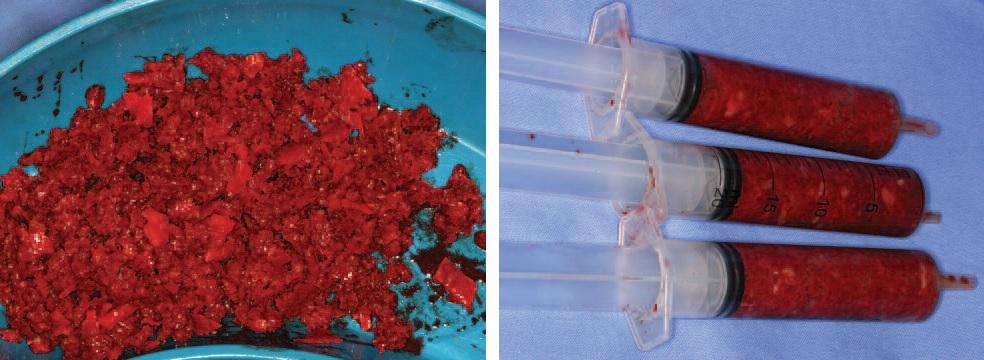
Через восемь недель проводят забор трансплантата с задней поверхности гребня подвздошной кости, объем которого зависит от размера дефекта (фото 7а). Полученную кость измельчают и упаковывают в шприцы емкостью 20 мл, максимально компрессируя ее для получения компактного костного трансплантата (фото 7б).
Фото 7. А – гранулированный кортикогубчатый аутографт; Б – аутографт в шприцах.
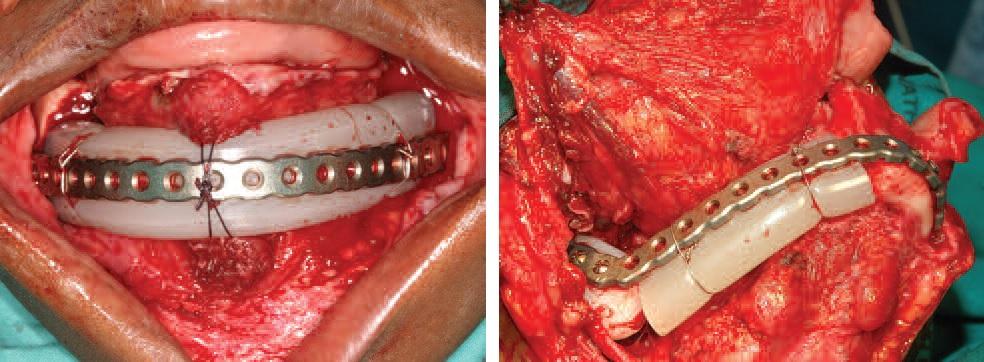
Зафиксированную прокладку обнажают через внеротовой доступ, и, если заживление раны проходило без осложнений, то врач получает гладкую реципиентную область (фото 8), полностью адаптированную и подходящую для установки костного трансплантата (фото 9).
Фото 8. Вид реципиентной области после удаления прокладки.
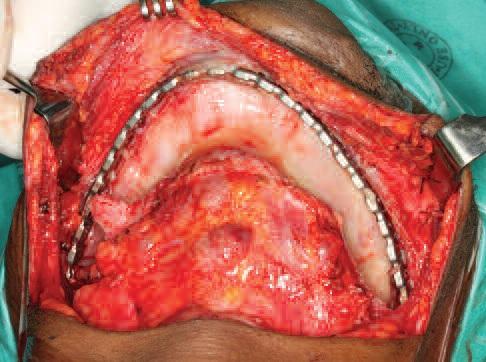
Фото 9. Установка аутографта в реципиентную область.
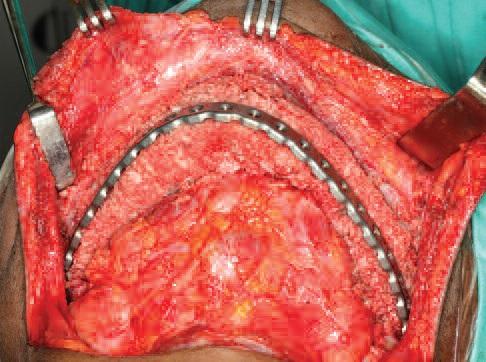
Податливая консистенция ГКГ трансплантата и уже сформированная форма реципиентного ложа помогают практически добиться дублирования формы челюсти, полученной в процессе планирования и трехмерного принтинга (фото 10). После внесения материала, ушивание мягких тканей над его поверхностью и титановой пластиной проводят без излишнего натяжения, но обеспечивая фиксацию тканей. После этого пациенту снова восстанавливают межчелюстную фиксацию для обеспечения стабильности трансплантата и оптимального процесса заживления мягких тканей.
Фото 10. Указатели для установки имплантатов на восковой репродукции, визуализированные на рентгенограмме.
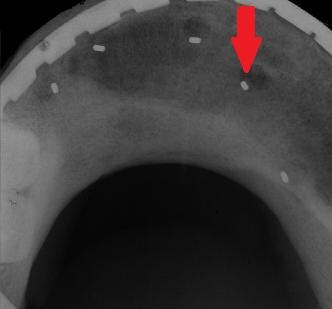
Послеоперационный уход аналогичен таковому после первого резективного вмешательства: первые 24 часа пациент находится в отделении интенсивной терапии, после чего еще 6 дней он находится в больнице для контроля за процессом заживления раны. Повторные осмотры проводятся каждую неделю на протяжении полутора месяца.
Через полгода проверяют состояние трансплантированной кости посредством рентгенологических исследований. При отсутствии четкой границы в области трансплантат-челюсть и при формировании адекватного рисунка трабекулярной кости (фото 10 - 11) приступают к следующему этапу лечения.
Фото 11. Панорамная рентгенограмма через 6 месяцев после реконструкции челюсти: граница между естественной костью и областью аугментации почти незаметна.
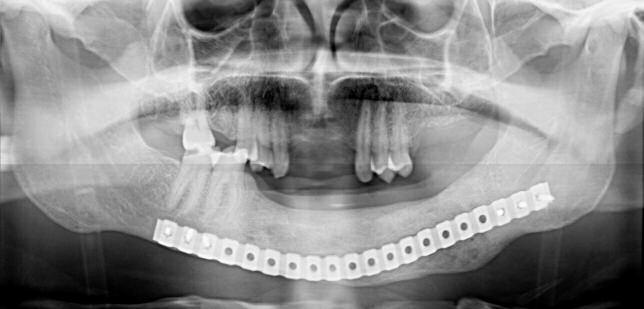
Планирование процедуры имплантации проводят по стандартному протоколу. Диагностическую восковую репродукцию используют для изготовления шаблона: пациенту проводится КТ-сканирование с установленным сымитированным протезом для будущего проектирования позиции имплантатов. С этой целью можно использовать разные варианты программного обеспечения (фото 12). На следующем этапе изготавливают направляющий хирургический шаблон (фото 13а), который в дальнейшем используется для корректной установки имплантатов (фото 13б).
Фото 12. Виртуальное планирование этапа имплантации.
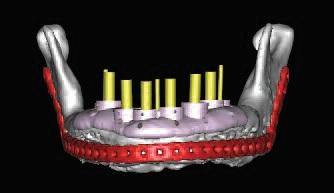
Фото 13. А – установка хирургического шаблона; Б – установка имплантатов в реконструированную часть нижней челюсти.
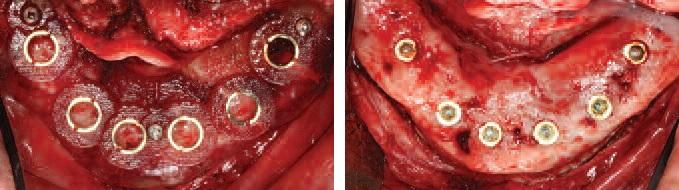
Оттиски снимают с целью изготовления бороздкового конформера. После установки формирователей десны, мягкие ткани ушивают. Через три месяца производят пластику мягких тканей, исходя из позиции конформера зафиксированного на имплантатах (фото 14а и б). После завершения мукосализации приступают к изготовлению окончательного протеза (фото 15а, б и фото 16).
Фото 14. Бороздковый конформер для пластики мягких тканей.
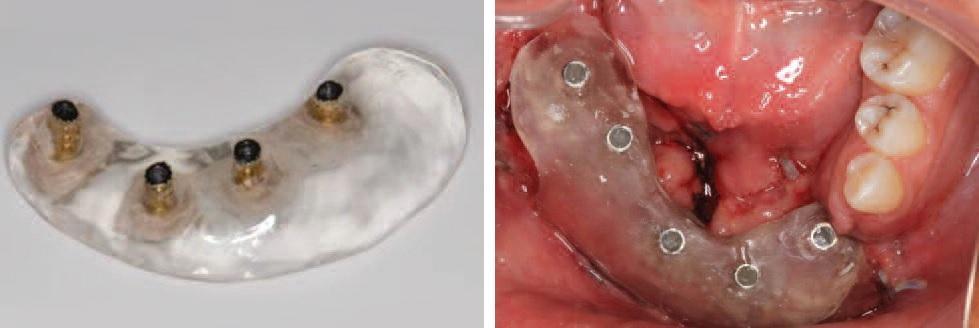
Фото 15. Фронтальный (А) и окклюзионный (Б) вид зафиксированного протеза на имплантатах.
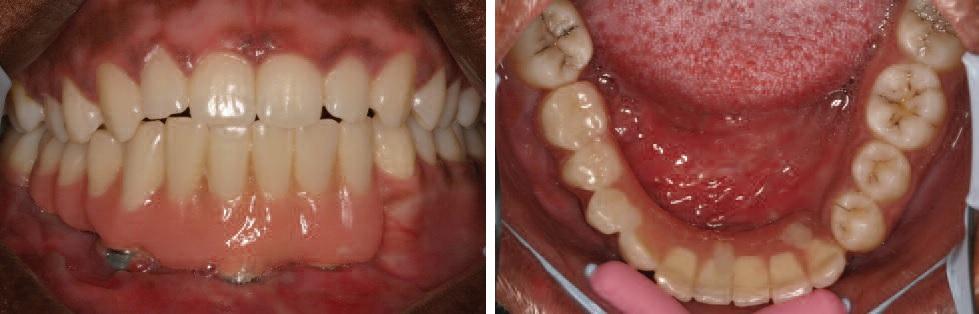
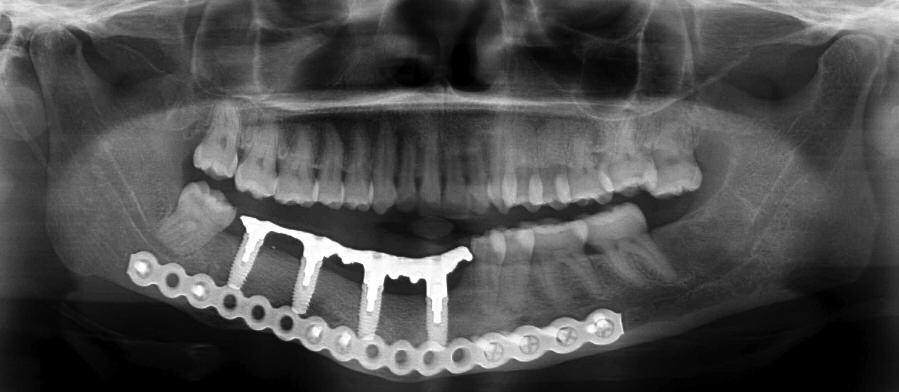
Фото 16. Панорамная рентгенограмма с установленным протезом.
Потеря части нижней челюсти значительно влияет на качество жизни пациентов. Восстановление целостности и непрерывности нижней челюсти помогает провести на только функциональную, но эстетическую и социальную реабилитацию пациента в обществе. Протокол реконструктивного подхода, описанный в данной статье, был проверен на более чем 60 пациентах и максимально усовершенствован с годами. Использование цифровых технологий в комбинации с адекватным пониманием биологии костной ткани во время реституции обеспечивает возможности для точного прогнозирования результатов ятрогенных вмешательств с достижением наиболее успешных клинических результатов реконструкции.
Авторы: Nika Vafaei, Carlo Ferretti (Йоханнесбург, ЮАР)
Одной из главных целей реконструкции нижней челюсти является восстановление ее непрерывности как целостной анатомической структуры и особенностей морфологии, чтобы в дальнейшем сформировать условия для проведения комплекса реабилитационных мероприятий, в том числе и дентальной имплантации. Возможности реализации данной цели могут быть ограничены агрессивным характером поражений и размером дефектов, сформировавшихся в результате их действия. С целью реконструкции в данное время доступен целый спектр трансплантационных материалов, но аутологичный трансплантат остается золотым стандартом для подобных ситуаций. И хотя применение свободного лоскута позволяет проводить процедуру непосредственной реконструкции, но использование гранулированного кортико-губчатого (ГКГ) трансплантата обеспечивает гораздо более точный подход для функциональной и эстетической реабилитации нижней челюсти. При этом стоимость использования данного материала является приемлемой, а послеоперационный дискомфорт сведен к минимуму.

После клинического обследования, планирования резективной манипуляции и промежуточных этапов лечения, обязательным является проведение компьютерно-томографических (КТ) исследований. Файл сканирования сохраняется в формате Digital Imaging in Medicine (DICOM) и импортируется в программное обеспечение Mimics Softwate (Materialise, Левен, Бельгия). После этого КТ-снимок становиться доступным для детализированного анализа с возможностью имитации на нем процедуры графической резекции и последующей реконструкции с учетом степени и границы имеющегося поражения (фото 1).
Фото 1. Реформатированный КЛКТ-скан опухоли нижней челюсти.

Трехмерные изображения также импортируются в 3-Matic (Materialise, Бельгия) для более точного воссоздания параметров нижней челюсти и прогнозирования будущей реконструкции с минимальными графическими искажениями (фото 2).
Фото 2. Идеально реконструированная нижняя челюсть.

Модель идеальной нижней челюсти изготавливается из порошка диоксида кремния ZP 131 и клеящего композита на 3D принтере Z Corp 510 3d (Z-Corp, Берлингтон, штат Массачусетс) (фото 3). После этого к полученной модели адаптируют 2.4 мм титановую пластину (фото 4).
Фото 3. Напечатанная 3D модель.

Фото 4. Титановая пластина с прокладкой для формирования пространства под ветви челюсти.

Опухоль в ходе хирургического вмешательства иссекается строго по ориентирам и границам, определенным в ходе графического планирования манипуляции (фото 5), а титановая пластина фиксируется на сохраненной части челюсти. После фиксации пластины к ее основе прикрепляют силиконовую прокладку. Прокладка играет роль наполнителя для формирования и сохранения места под костный трансплантат, которым заместят область дефекта через 8 месяцев после резекции (фото 6а и 6б).
Фото 5. Резецированная часть челюсти.

Фото 6. А – фиксация прокладки в полости рта; Б – фиксация прокладки к титановой пластине.

После фиксации прокладки для коррекции эстетического профиля пластины послабляют межчелюстную фиксацию. Затем послойно ушивают мягкие ткани, восстанавливая прикрепления надподъязычых и надгортанных мышц. После ушивания раны у пациента остается межчелюстная фиксация конструкции на период последующих 6 недель, а первые 24 часа после операции он находится под присмотром в отделении интенсивной терапии. Все лекарства вводятся внутривенно, а питание проходит через назогастральный зонд в течение первых 7 дней после операции.
Через восемь недель проводят забор трансплантата с задней поверхности гребня подвздошной кости, объем которого зависит от размера дефекта (фото 7а). Полученную кость измельчают и упаковывают в шприцы емкостью 20 мл, максимально компрессируя ее для получения компактного костного трансплантата (фото 7б).
Фото 7. А – гранулированный кортикогубчатый аутографт; Б – аутографт в шприцах.

Зафиксированную прокладку обнажают через внеротовой доступ, и, если заживление раны проходило без осложнений, то врач получает гладкую реципиентную область (фото 8), полностью адаптированную и подходящую для установки костного трансплантата (фото 9).
Фото 8. Вид реципиентной области после удаления прокладки.

Фото 9. Установка аутографта в реципиентную область.

Податливая консистенция ГКГ трансплантата и уже сформированная форма реципиентного ложа помогают практически добиться дублирования формы челюсти, полученной в процессе планирования и трехмерного принтинга (фото 10). После внесения материала, ушивание мягких тканей над его поверхностью и титановой пластиной проводят без излишнего натяжения, но обеспечивая фиксацию тканей. После этого пациенту снова восстанавливают межчелюстную фиксацию для обеспечения стабильности трансплантата и оптимального процесса заживления мягких тканей.
Фото 10. Указатели для установки имплантатов на восковой репродукции, визуализированные на рентгенограмме.

Послеоперационный уход аналогичен таковому после первого резективного вмешательства: первые 24 часа пациент находится в отделении интенсивной терапии, после чего еще 6 дней он находится в больнице для контроля за процессом заживления раны. Повторные осмотры проводятся каждую неделю на протяжении полутора месяца.
Через полгода проверяют состояние трансплантированной кости посредством рентгенологических исследований. При отсутствии четкой границы в области трансплантат-челюсть и при формировании адекватного рисунка трабекулярной кости (фото 10 - 11) приступают к следующему этапу лечения.
Фото 11. Панорамная рентгенограмма через 6 месяцев после реконструкции челюсти: граница между естественной костью и областью аугментации почти незаметна.

Планирование процедуры имплантации проводят по стандартному протоколу. Диагностическую восковую репродукцию используют для изготовления шаблона: пациенту проводится КТ-сканирование с установленным сымитированным протезом для будущего проектирования позиции имплантатов. С этой целью можно использовать разные варианты программного обеспечения (фото 12). На следующем этапе изготавливают направляющий хирургический шаблон (фото 13а), который в дальнейшем используется для корректной установки имплантатов (фото 13б).
Фото 12. Виртуальное планирование этапа имплантации.

Фото 13. А – установка хирургического шаблона; Б – установка имплантатов в реконструированную часть нижней челюсти.

Оттиски снимают с целью изготовления бороздкового конформера. После установки формирователей десны, мягкие ткани ушивают. Через три месяца производят пластику мягких тканей, исходя из позиции конформера зафиксированного на имплантатах (фото 14а и б). После завершения мукосализации приступают к изготовлению окончательного протеза (фото 15а, б и фото 16).
Фото 14. Бороздковый конформер для пластики мягких тканей.

Фото 15. Фронтальный (А) и окклюзионный (Б) вид зафиксированного протеза на имплантатах.

Фото 16. Панорамная рентгенограмма с установленным протезом.

Потеря части нижней челюсти значительно влияет на качество жизни пациентов. Восстановление целостности и непрерывности нижней челюсти помогает провести на только функциональную, но эстетическую и социальную реабилитацию пациента в обществе. Протокол реконструктивного подхода, описанный в данной статье, был проверен на более чем 60 пациентах и максимально усовершенствован с годами. Использование цифровых технологий в комбинации с адекватным пониманием биологии костной ткани во время реституции обеспечивает возможности для точного прогнозирования результатов ятрогенных вмешательств с достижением наиболее успешных клинических результатов реконструкции.
Авторы: Nika Vafaei, Carlo Ferretti (Йоханнесбург, ЮАР)





























































































































































0 комментариев