Потеря альвеолярной кости угрожает стабильности зубов и может привести к утрате функции. Когда это происходит в эстетической зоне, это может иметь серьезные социальные последствия, снижая качество жизни пациента. В представленном случае 65-летняя некурящая пациентка с пародонтитом обратилась с пародонтальным дефектом в переднем отделе, потребовавшим костной регенерации. Лечение включало применение депротеинизированного минерала бычьей кости, покрытого октакальцийфосфатом и состоящего на 100% из губчатой костной ткани, вместе с адъювантными факторами, такими как концентраты тромбоцитов и богатый тромбоцитами фибрин, для восстановления атрофированного альвеолярного гребня. У пациентки отмечалось гладкое заживление без зафиксированных осложнений. Долгосрочное наблюдение в течение 6,3 лет выявило успешную регенерацию кости и стабильность результата. Данное описание клинического случая демонстрирует долгосрочную безопасность и надежность ксеногенного материала для поддержки регенерации кости у пациента, проходившего лечение по поводу потери альвеолярной кости вследствие пародонтита.
Костная пластика обычно используется для восстановления альвеолярных гребней. Однако недостатки современных методов — такие как низкая механическая прочность некоторых биоматериалов, которая может быть недостаточной в областях, на которые оказывается нагрузка, выделение кислоты некоторыми синтетическими полимерами в процессе их деградации, что потенциально может оказывать неблагоприятное воздействие на кость, и потенциальные иммунологические реакции на кость, полученную от трупов — стимулировали разработку и усовершенствование материалов для трансплантации и протоколов с целью улучшения результатов. Многие клиницисты отдают предпочтение использованию ксеногенных материалов, поскольку они обеспечивают медленную скорость резорбции, биосовместимость, отличную остеокондуктивность, гладкое заживление и стабильность по конкурентоспособной цене.
Подходы к костной аугментации с использованием депротеинизированного минерала бычьей кости (ДМБК) эффективно сохраняют объем. Однако относительно медленная резорбция этого материала коррелирует с более низкой скоростью образования кости по сравнению с естественным заживлением. Включение в трансплантационный материал биодеградируемых материалов, таких как биоактивная керамика, может устранить это ограничение. Наноразмерные особенности, присутствующие в дизайне оптимального каркаса, в последнее время стали ключевым фактором в достижении желаемых характеристик регенерированных тканей. Например, молекулы октакальцийфосфата (ОКФ), которые являются предшественниками кристаллов биологического апатита, превращаются в гидроксиапатит при физиологическом pH, демонстрируя высокую растворимость и биодеградируемость. Это происходит по мере того, как остеобластические клетки выстраиваются на поверхности ОКФ, что сопровождается потреблением ионов кальция и высвобождением ионов неорганического фосфата, способствуя остеокондуктивности, дифференцировке остеобластов и, как следствие, образованию новой кости. Клиницисты также могут комбинировать материалы для костной пластики с богатой тромбоцитами плазмой (БоТП) и богатым тромбоцитами фибрином (БоТФ), чтобы обеспечить факторы роста, лейкоциты и циркулирующие стволовые клетки, которые иначе могут быть недоступны для костного трансплантата.
Систематический обзор показал, что использование БоТП вместе с биоматериалами для трансплантации было связано с меньшим процентом остаточного костного заместителя и несколько более высокой скоростью образования новой кости по сравнению с использованием только трансплантационных материалов. Однако метаанализ, проведенный другой группой исследователей, не обнаружил статистически значимых различий в показателях выживаемости имплантатов, образовании новой кости или других аспектах между группами без БоТФ и с БоТФ.Тем не менее, рандомизированное клиническое исследование и проспективное исследование, в которых комбинировались ДМБК и БоТФ — аналогично подходу, использованному в данном описании случая, — показали, что использование фибрина способствовало адекватному костному приросту и было более эффективным при лечении внутрикостных пародонтальных дефектов, чем использование ДМБК без БоТФ.
Данное описание клинического случая описывает результаты подхода к костной аугментации с использованием ДМБК, покрытого ОКФ, состоящего исключительно из губчатой кости, смешанного с аутогенной костью и адъювантными материалами для сохранения зуба с костным дефектом, вызванным пародонтитом.
Описание случая
65-летняя некурящая пациентка с пародонтитом обратилась с костным дефектом на мезиальной поверхности верхнего левого центрального резца (зуб № 2.1) (Фото 1 и Фото 2). Зарегистрированный индекс подвижности (по Грейсу и Смейлсу) составил 2 степень, т.е. движение в вестибуло-лингвальном направлении на 1–2 мм. Во время процедуры пластики был отслоен слизисто-надкостничный лоскут, обнажен глубокий пародонтальный дефект (Фото 3 и Фото 4). Аутогенная кость была взята из ветви нижней челюсти и смешана в соотношении 1:2 с ДМБК (покрытый ОКФ, 100% губчатая кость) (Ti-oss, Chiyewon Co. Ltd.; распространяется как creos xenoform, Nobel Biocare). Полученный материал был смешан с высококонцентрированными тромбоцитами, полученными путем дополнительного центрифугирования БоТП (упоминается как концентраты тромбоцитов в протоколе, адаптированном автором), к которым были добавлены тромбин и кальций для образования коагулированной массы (Фото 5), использованной для заполнения дефекта (Фото 6). Показано, что тромбин и кальций in vitro и in vivo активируют тромбоциты для высвобождения факторов роста, тем самым стимулируя остеобласты, усиливая ангиогенез и способствуя миграции клеток.
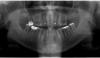
Фото 1. Предоперационный рентгеновский снимок. Стрелка указывает на пародонтальный дефект у зуба № 2.1.
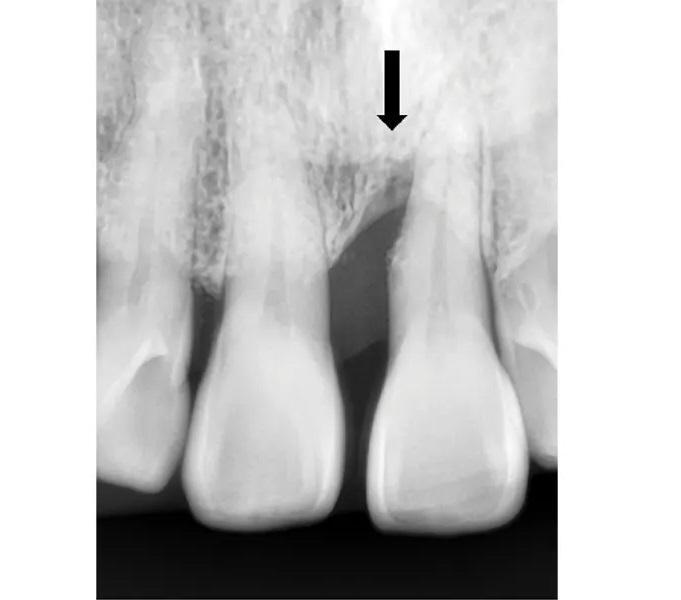
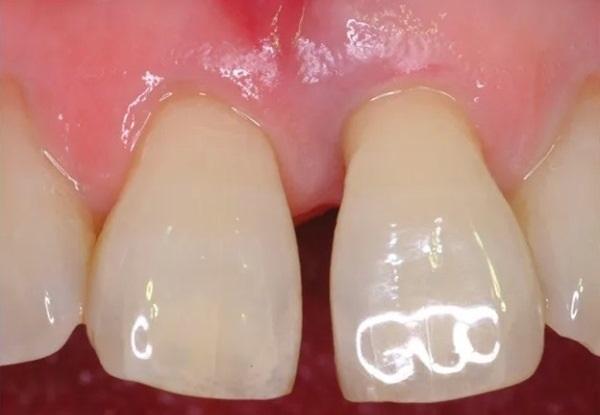
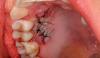
Фото 2. Предоперационное клиническое изображение с пародонтальным дефектом у зуба № 2.1.
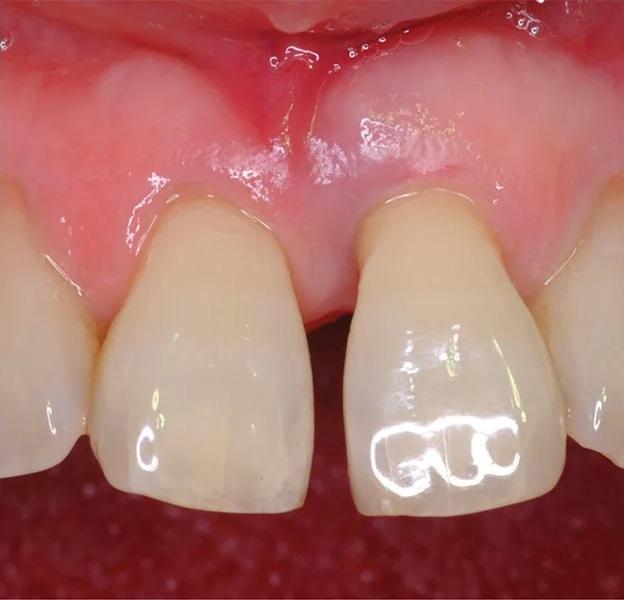
Фото 3. Интраоперационное клиническое изображение, показывающее пародонтальный дефект.
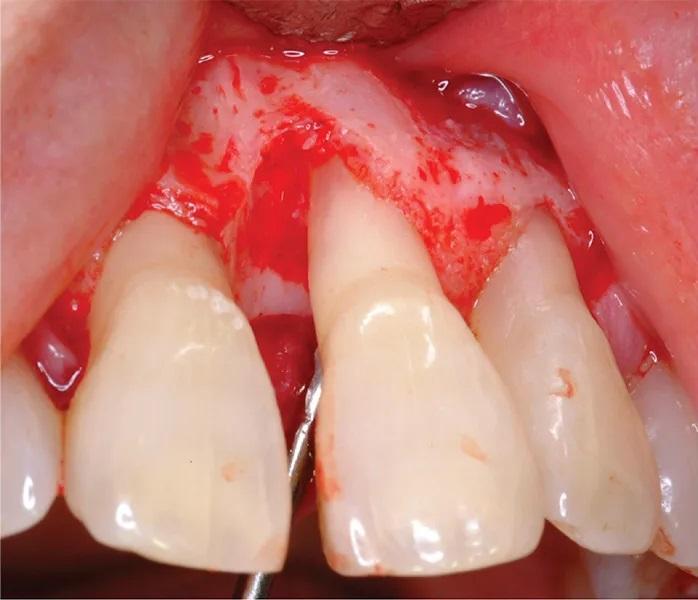
Фото 4. Интраоперационное клиническое изображение с зондом, показывающим глубину дефекта.
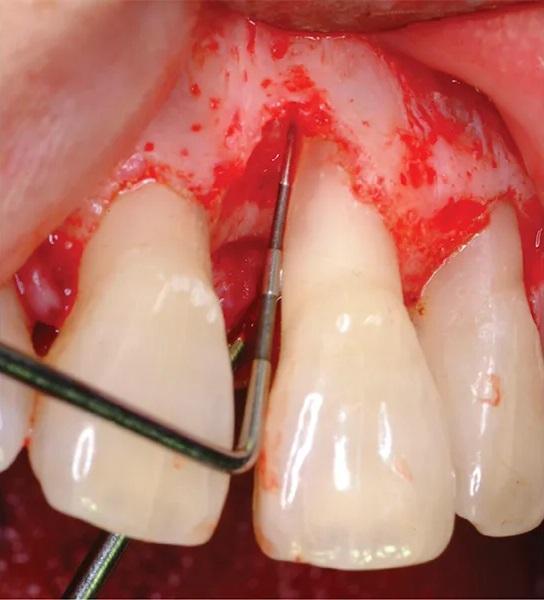
Фото 5. Трансплантационный материал был приготовлен путем комбинирования ДМБК, концентратов тромбоцитов и аутогенных костных стружек с кальцием и тромбином для индукции коагуляции.
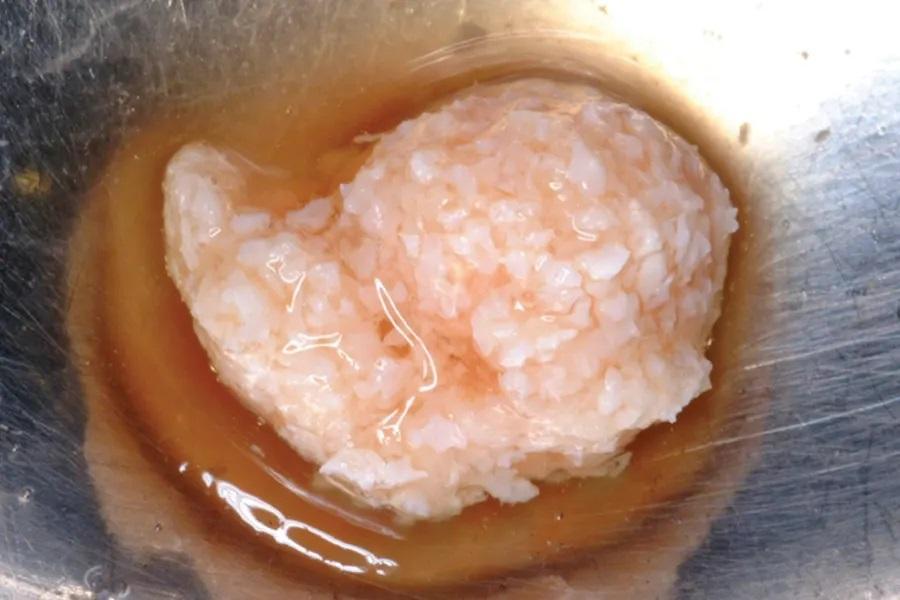
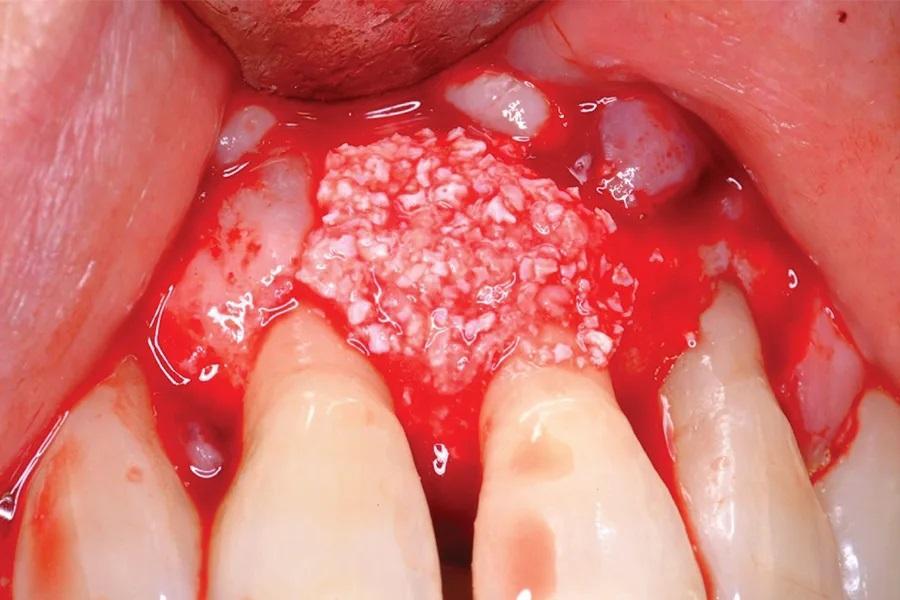
Фото 6. Слизисто-надкостничный лоскут был отслоен для наложения приготовленной костно-пластической смеси, заполняющей дефект.
Затем участок был покрыт БоТФ (Фото 7), чья консистенция, подобная десне, предотвращала рассеивание костного трансплантата по линии разреза лоскута. Это было особенно важно, поскольку защитная (коллагеновая) мембрана не применялась. Впоследствии мягкие ткани были ушиты (Фото 8).
Фото 7. Затем трансплантат был покрыт коагулятом БоТФ.
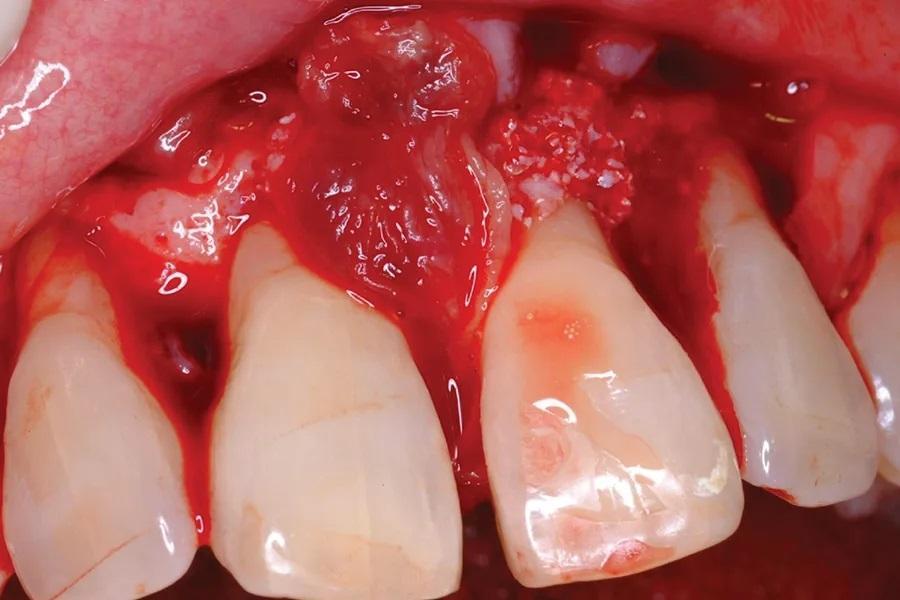
Фото 8. Слизисто-надкостничный лоскут был ушит.
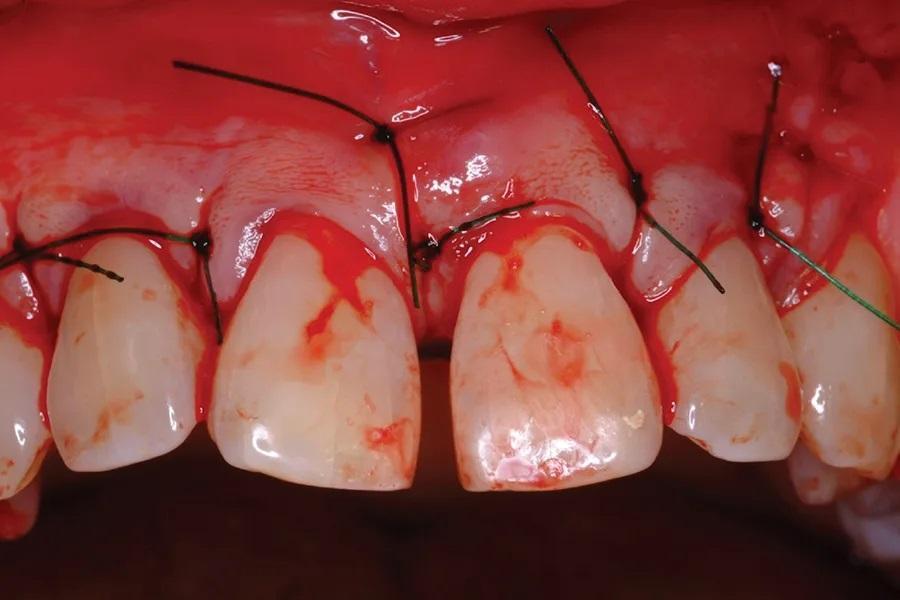
В тот же день была выполнена установка композитных виниров для маскировки диастемы по средней линии и улучшения эстетики. Заживление проходило без осложнений. Долгосрочные контрольные изображения через 5,6 лет (Фото 9) показали длительное сохранение регенерированной кости, удержание зуба и адекватный эстетический вид с практически оптимальным сосочком.
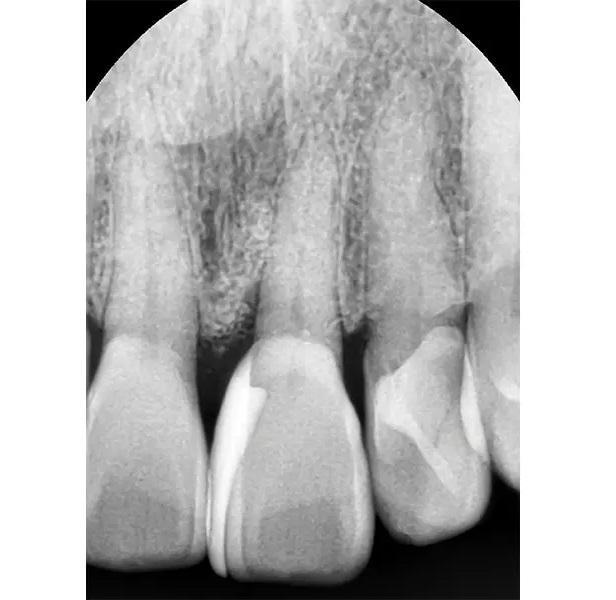
Фото 9. Рентгеновский снимок через 5,6 лет после лечения, подтверждающий регенерацию пародонтального дефекта.
Обсуждение
Данное описание клинического случая описывает пациентку с пародонтитом, которую лечили с помощью ДМБК, покрытого ОКФ и состоящего исключительно из губчатой кости, и адъювантных факторов, в результате чего была получена коагулированная масса, которая была наложена на дефект, покрыта БоТФ и ушита. Этот подход успешно стабилизировал и сохранил зуб, вовлеченный в пародонтологический процесс.
Стабильность объема альвеолярного гребня была сохранена, так как трансплантационный материал был уложен с умеренной компрессией для обеспечения надлежащей васкуляризации. Это было дополнительно усилено многопористой природой губчатой кости, характеризующейся относительно большим размером пор (300–400 мкм), что способствовало миграции, пролиферации и, в конечном итоге, дифференцировке клеток, облегчая остеоинтеграцию.
Хотя недавнее исследование показало, что покрытие поверхности ДМБК ОКФ, которое постепенно превращается в гидроксиапатит, дает уровни вновь образованной кости, сопоставимые с материалами без ОКФ, оно обеспечивало большую биодеградируемость, оставляя меньшее количество остаточного трансплантата по сравнению с контролем. Однако предыдущие отчеты не обнаружили статистически значимой разницы.
В рамках ограничений представленного случая описанный метод с использованием 100% ксеногенной губчатой кости продемонстрировал общий успех в регенерации кости для лечения пародонтального дефекта. ДМБК с адъювантными материалами обеспечил гладкое заживление и успешные результаты, такие как долгосрочная стабильность костной и мягких тканей с удовлетворительной эстетикой. Для дальнейшего подтверждения полезности этого подхода необходимо более масштабное исследование.
Заключение
Данное описание клинического случая подчеркивает многообещающую регенеративную стратегию для пародонтальных костных дефектов, использующую покрытый ОКФ, 100% губчатый ДМБК в сочетании с аутогенной костью и концентратами тромбоцитов. Этот подход привел к эффективной регенерации кости, стабильному объему альвеолярного гребня и устойчивым клиническим и эстетическим результатам в течение длительного периода наблюдения. Использование БоТФ оказалось полезным для поддержания стабильности трансплантата и стимулирования заживления. Хотя результаты обнадеживают, для подтверждения эффективности и воспроизводимости этой методики в более широких клинических условиях необходимы дальнейшие исследования с участием более крупных когорт пациентов и контролируемые сравнения.
Автор: Myung Ho Lee, DDS
Потеря альвеолярной кости угрожает стабильности зубов и может привести к утрате функции. Когда это происходит в эстетической зоне, это может иметь серьезные социальные последствия, снижая качество жизни пациента. В представленном случае 65-летняя некурящая пациентка с пародонтитом обратилась с пародонтальным дефектом в переднем отделе, потребовавшим костной регенерации. Лечение включало применение депротеинизированного минерала бычьей кости, покрытого октакальцийфосфатом и состоящего на 100% из губчатой костной ткани, вместе с адъювантными факторами, такими как концентраты тромбоцитов и богатый тромбоцитами фибрин, для восстановления атрофированного альвеолярного гребня. У пациентки отмечалось гладкое заживление без зафиксированных осложнений. Долгосрочное наблюдение в течение 6,3 лет выявило успешную регенерацию кости и стабильность результата. Данное описание клинического случая демонстрирует долгосрочную безопасность и надежность ксеногенного материала для поддержки регенерации кости у пациента, проходившего лечение по поводу потери альвеолярной кости вследствие пародонтита.

Костная пластика обычно используется для восстановления альвеолярных гребней. Однако недостатки современных методов — такие как низкая механическая прочность некоторых биоматериалов, которая может быть недостаточной в областях, на которые оказывается нагрузка, выделение кислоты некоторыми синтетическими полимерами в процессе их деградации, что потенциально может оказывать неблагоприятное воздействие на кость, и потенциальные иммунологические реакции на кость, полученную от трупов — стимулировали разработку и усовершенствование материалов для трансплантации и протоколов с целью улучшения результатов. Многие клиницисты отдают предпочтение использованию ксеногенных материалов, поскольку они обеспечивают медленную скорость резорбции, биосовместимость, отличную остеокондуктивность, гладкое заживление и стабильность по конкурентоспособной цене.
Подходы к костной аугментации с использованием депротеинизированного минерала бычьей кости (ДМБК) эффективно сохраняют объем. Однако относительно медленная резорбция этого материала коррелирует с более низкой скоростью образования кости по сравнению с естественным заживлением. Включение в трансплантационный материал биодеградируемых материалов, таких как биоактивная керамика, может устранить это ограничение. Наноразмерные особенности, присутствующие в дизайне оптимального каркаса, в последнее время стали ключевым фактором в достижении желаемых характеристик регенерированных тканей. Например, молекулы октакальцийфосфата (ОКФ), которые являются предшественниками кристаллов биологического апатита, превращаются в гидроксиапатит при физиологическом pH, демонстрируя высокую растворимость и биодеградируемость. Это происходит по мере того, как остеобластические клетки выстраиваются на поверхности ОКФ, что сопровождается потреблением ионов кальция и высвобождением ионов неорганического фосфата, способствуя остеокондуктивности, дифференцировке остеобластов и, как следствие, образованию новой кости. Клиницисты также могут комбинировать материалы для костной пластики с богатой тромбоцитами плазмой (БоТП) и богатым тромбоцитами фибрином (БоТФ), чтобы обеспечить факторы роста, лейкоциты и циркулирующие стволовые клетки, которые иначе могут быть недоступны для костного трансплантата.
Систематический обзор показал, что использование БоТП вместе с биоматериалами для трансплантации было связано с меньшим процентом остаточного костного заместителя и несколько более высокой скоростью образования новой кости по сравнению с использованием только трансплантационных материалов. Однако метаанализ, проведенный другой группой исследователей, не обнаружил статистически значимых различий в показателях выживаемости имплантатов, образовании новой кости или других аспектах между группами без БоТФ и с БоТФ.Тем не менее, рандомизированное клиническое исследование и проспективное исследование, в которых комбинировались ДМБК и БоТФ — аналогично подходу, использованному в данном описании случая, — показали, что использование фибрина способствовало адекватному костному приросту и было более эффективным при лечении внутрикостных пародонтальных дефектов, чем использование ДМБК без БоТФ.
Данное описание клинического случая описывает результаты подхода к костной аугментации с использованием ДМБК, покрытого ОКФ, состоящего исключительно из губчатой кости, смешанного с аутогенной костью и адъювантными материалами для сохранения зуба с костным дефектом, вызванным пародонтитом.
Описание случая
65-летняя некурящая пациентка с пародонтитом обратилась с костным дефектом на мезиальной поверхности верхнего левого центрального резца (зуб № 2.1) (Фото 1 и Фото 2). Зарегистрированный индекс подвижности (по Грейсу и Смейлсу) составил 2 степень, т.е. движение в вестибуло-лингвальном направлении на 1–2 мм. Во время процедуры пластики был отслоен слизисто-надкостничный лоскут, обнажен глубокий пародонтальный дефект (Фото 3 и Фото 4). Аутогенная кость была взята из ветви нижней челюсти и смешана в соотношении 1:2 с ДМБК (покрытый ОКФ, 100% губчатая кость) (Ti-oss, Chiyewon Co. Ltd.; распространяется как creos xenoform, Nobel Biocare). Полученный материал был смешан с высококонцентрированными тромбоцитами, полученными путем дополнительного центрифугирования БоТП (упоминается как концентраты тромбоцитов в протоколе, адаптированном автором), к которым были добавлены тромбин и кальций для образования коагулированной массы (Фото 5), использованной для заполнения дефекта (Фото 6). Показано, что тромбин и кальций in vitro и in vivo активируют тромбоциты для высвобождения факторов роста, тем самым стимулируя остеобласты, усиливая ангиогенез и способствуя миграции клеток.
Фото 1. Предоперационный рентгеновский снимок. Стрелка указывает на пародонтальный дефект у зуба № 2.1.

Фото 2. Предоперационное клиническое изображение с пародонтальным дефектом у зуба № 2.1.

Фото 3. Интраоперационное клиническое изображение, показывающее пародонтальный дефект.

Фото 4. Интраоперационное клиническое изображение с зондом, показывающим глубину дефекта.

Фото 5. Трансплантационный материал был приготовлен путем комбинирования ДМБК, концентратов тромбоцитов и аутогенных костных стружек с кальцием и тромбином для индукции коагуляции.

Фото 6. Слизисто-надкостничный лоскут был отслоен для наложения приготовленной костно-пластической смеси, заполняющей дефект.

Затем участок был покрыт БоТФ (Фото 7), чья консистенция, подобная десне, предотвращала рассеивание костного трансплантата по линии разреза лоскута. Это было особенно важно, поскольку защитная (коллагеновая) мембрана не применялась. Впоследствии мягкие ткани были ушиты (Фото 8).
Фото 7. Затем трансплантат был покрыт коагулятом БоТФ.

Фото 8. Слизисто-надкостничный лоскут был ушит.

В тот же день была выполнена установка композитных виниров для маскировки диастемы по средней линии и улучшения эстетики. Заживление проходило без осложнений. Долгосрочные контрольные изображения через 5,6 лет (Фото 9) показали длительное сохранение регенерированной кости, удержание зуба и адекватный эстетический вид с практически оптимальным сосочком.
Фото 9. Рентгеновский снимок через 5,6 лет после лечения, подтверждающий регенерацию пародонтального дефекта.

Обсуждение
Данное описание клинического случая описывает пациентку с пародонтитом, которую лечили с помощью ДМБК, покрытого ОКФ и состоящего исключительно из губчатой кости, и адъювантных факторов, в результате чего была получена коагулированная масса, которая была наложена на дефект, покрыта БоТФ и ушита. Этот подход успешно стабилизировал и сохранил зуб, вовлеченный в пародонтологический процесс.
Стабильность объема альвеолярного гребня была сохранена, так как трансплантационный материал был уложен с умеренной компрессией для обеспечения надлежащей васкуляризации. Это было дополнительно усилено многопористой природой губчатой кости, характеризующейся относительно большим размером пор (300–400 мкм), что способствовало миграции, пролиферации и, в конечном итоге, дифференцировке клеток, облегчая остеоинтеграцию.
Хотя недавнее исследование показало, что покрытие поверхности ДМБК ОКФ, которое постепенно превращается в гидроксиапатит, дает уровни вновь образованной кости, сопоставимые с материалами без ОКФ, оно обеспечивало большую биодеградируемость, оставляя меньшее количество остаточного трансплантата по сравнению с контролем. Однако предыдущие отчеты не обнаружили статистически значимой разницы.
В рамках ограничений представленного случая описанный метод с использованием 100% ксеногенной губчатой кости продемонстрировал общий успех в регенерации кости для лечения пародонтального дефекта. ДМБК с адъювантными материалами обеспечил гладкое заживление и успешные результаты, такие как долгосрочная стабильность костной и мягких тканей с удовлетворительной эстетикой. Для дальнейшего подтверждения полезности этого подхода необходимо более масштабное исследование.
Заключение
Данное описание клинического случая подчеркивает многообещающую регенеративную стратегию для пародонтальных костных дефектов, использующую покрытый ОКФ, 100% губчатый ДМБК в сочетании с аутогенной костью и концентратами тромбоцитов. Этот подход привел к эффективной регенерации кости, стабильному объему альвеолярного гребня и устойчивым клиническим и эстетическим результатам в течение длительного периода наблюдения. Использование БоТФ оказалось полезным для поддержания стабильности трансплантата и стимулирования заживления. Хотя результаты обнадеживают, для подтверждения эффективности и воспроизводимости этой методики в более широких клинических условиях необходимы дальнейшие исследования с участием более крупных когорт пациентов и контролируемые сравнения.
Автор: Myung Ho Lee, DDS





























































































































































0 комментариев