Методы направленной костной регенерации (НКР) обеспечивают высокую эффективность восстановления дефицита альвеолярной кости для последующей процедуры дентальной имплантации. Во время реконструктивной хирургии установка имплантатов может проводиться непосредственно или отстрочено, в зависимости от возможности обеспечения первичной стабильности. Но даже несмотря на успех НКР в имплантологии, вертикальный дефицит кости и ножевидная форма альвеолярного гребня остаются двумя основными преградами для установки дентальных имплантатов, поскольку в подобных условиях спрогнозировать результат будущего лечения представляется невозможным.
Метод и материалы
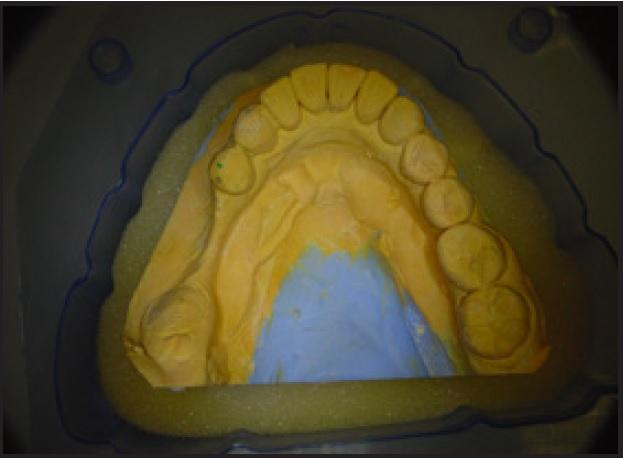
Пять соматически здоровых пациентов (двое мужчин и трое женщины) возрастом от 38 до 62 лет с недостаточной шириной альвеолярного гребня и потребностью в проведении дентальной имплантации в задней области нижней челюсти были отобраны для описания серии клинических случаев (фото 1). До этого все пациенты были проинформированы о характере исследования и процедурах, связанных с ним, а также о возможности потенциальных рисков, поэтому все они подписали формы о добровольном согласии относительно участия в данном исследовании. В ходе анализа были изучены истории болезней, выполнены внутриротовые осмотры мягких и твердых тканей, и при наличии показаний пациенты направлялись на дополнительное пародонтальное лечение. Для всех пациентов выполняли предоперационные рентгенограммы, в том числе панорамные и периапикальные снимки; компьютерную томографию (КТ) проводили лишь троим пациентам из презентационной выборки.
Фото 1. Гипсовая модель нижней челюсти пациента с областью резорбции костной ткани в задней области со щечной и лингвальной сторон.
За два часа до операции пациенты принимали по 2 грамма амоксициллина, а непосредственно перед вмешательством они самостоятельно проводили ирригацию ротовой полости 0,12% раствором хлоргексидина глюконата на протяжении 1 минуты. Для купирования болевых ощущений проводили местную анестезию. Костный заменитель (Tutodent, Tutogen или Bio Oss, Geistlich) использовали для восстановления ширины альвеолярного отростка как минимум до 6 мм, такие параметры обеспечили бы требуемые условия для проведения имплантации. Во всех случаях материал костного заменителя покрывали коллагеновыми мембранами (в трех случаях перикардиальными Tutogen, и в двух Ossix, Biomet 3) для защиты трансплантата от контакта со слизистой оболочкой и профилактики интерпозиции мягких тканей в область аугментации. Перед установкой мембраны были подрезаны до нужной формы для адаптации к месту аугментации. Пациентам не было проведено никаких процедур по увеличению вертикальной составляющей альвеолярного гребня. Повторные осмотры проводились через 3, 7, 14 и 30 дней. После операции пациентам также были даны инструкции относительно гигиенического ухода за раной и ротовой полостью в целом. Швы были удалены через 15 дней после операции.
Хирургическая процедура формирования периостального карманного лоскута
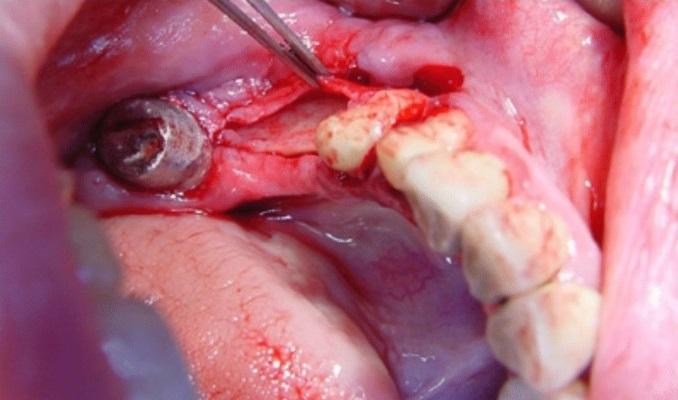
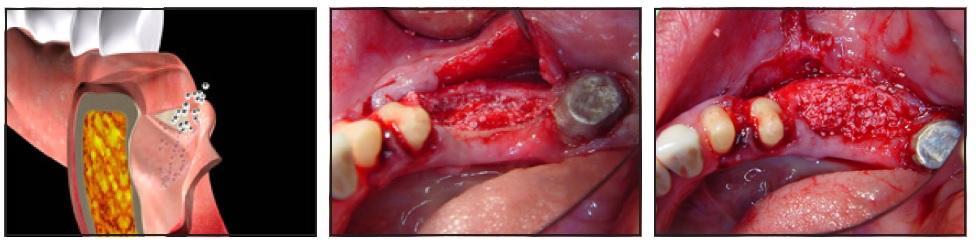
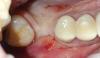
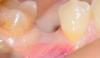
Полный разрез был сделан под углом 45° паракрестально к щечной стенке в толще тканей ороговевшей десны на самой коронарной части альвеолярного гребня (фото 2а и 2б). Слизисто-надкостичный лоскут отсепарировали лингвально, а щечную его часть расщепили, отделив периост от слизистой апикально на 10-13 мм (в соответствии с длиной используемого имплантата). В ходе выполнения данной процедуры не было выполнено никаких послабляющих разрезов. Но после расщепления лоскута послабляющие вертикальные разрезы сформировали изнутри слизистой оболочки наружу с обеих сторон, переходя за муко-гингивальную границу (мезиально и дистально). Были приняты меры для сохранения надкостницы в области кости. Расщепление слизистой позволяет добиться большей эластичности лоскута. Начиная с крестального разреза, надкостницу отделили от кости с помощью периостальногго элеватора, расширяя при этом область сепарации апикально от 8 до 12 мм, и тем самым формируя карман между пластинкой щечной кости и отсепарированной надкостницей. Вертикальная глубина аугментации была определена формой кости и длиной будущего имплантата (фото 3а и 3б).
Фото 2а-2б. Паракрестальный разрез, сделанный в области верхушки альвеолярного гребня под углом 45° к щечной стенке в толще кератинизированной десны.
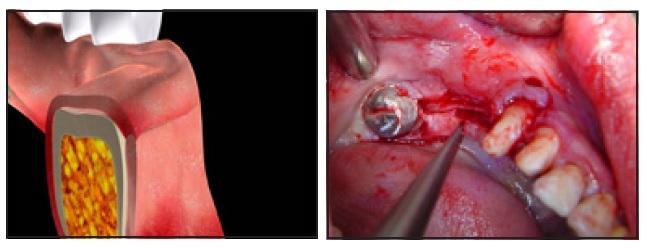
Фото 3а-3б. Надкостницу отсепарировали от кости с помощью периостального элеватора с формированием периостального кармана соответственной высоты.
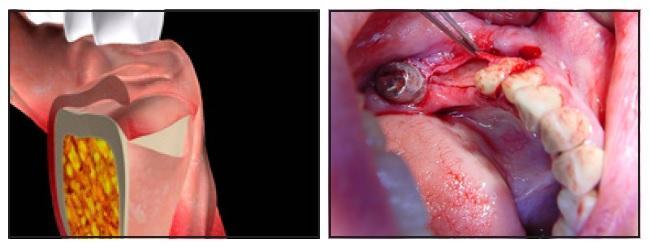
Периостальный карман заполнили медленно резорбирующимся трансплантатным материалом после пенетрации костного мозга для стимуляции ангиогенеза (фото 4а-4с). Рассасывающейся коллагеновой мембраной прикрыли участок трансплантационного материала в области верхушки гребня, поскольку прикрыть материал в данном месте с помощью периоста было физически невозможно.
Фото 4а и 4б. Увеличение эластичности лоскута путем сепарации слизистой от надкостницы и заполнение периостального кармана материалом трансплантата.
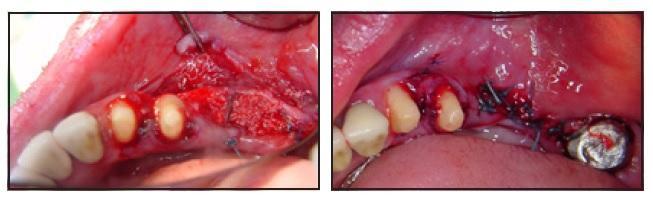
Наложение швов было выполнено в два этапа. Швы начинали через язычный полный лоскут, затем проходили через щечную часть надкостницы, потом опять возвращались к язычному лоскуту через щечную часть надкостницы, то есть выполняли матрацный шов. Узлы формировали с лингвальной стороны (фото 5а). Вторым матрацным швом слизистую фиксировали щечно к лингвальному мукопериостальному лоскуту. Узлы в таком случае формировали со щечной стороны (фото 5б).
Фото 5а (слева) и 5б (справа). Фиксация периоста с помощью матрацных швов (пришит только периост). Второй слой матрацных швов обеспечил фиксацию слизистой к лингвальному мукопериостальному лоскуту.
Процедура имплантации
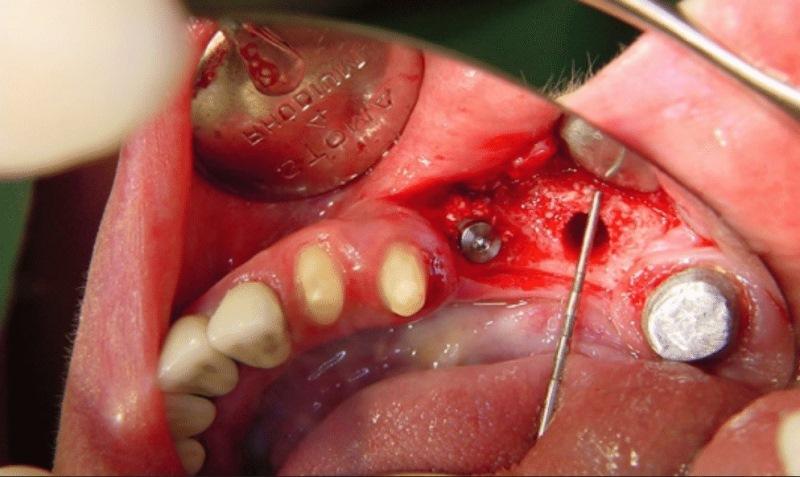
Перед имплантацией КТ-сканирование проводили трем пациентам. Результаты процедуры подтвердили эффективность аугментации (фото 6а-6с). Имплантаты устанавливали через 24 недели после реконструкции альвеолярного гребня (фото 7а и 7б), средние показатели высоты и ширины которого были изменены посредством ятрогенного вмешательства. Все имплантаты Tapered Screw Vent были установлены по закрытому типу (погружены в кость альвеолярного гребня). После их установки лоскут ушили с помощью узловых швов. Постоперационные рекомендации были даны пациентам в устной форме, а также в письменном виде. Через 12 недель установили формирователи десен, а еще через 3-4 недели установили окончательные конструкции протезов. Каждого пациента тщательно осматривали в ходе повторных визитов каждые 3 месяца, а через год каждому из них была выполнена периапикальная рентегнография.
Фото 6
а. КТ-снимки через 24 месяца.
б. Увеличенный вид аугментированной области. Ширина гребня на вершине составляет 2 мм, у основы – 7,8 мм.
с. 3D реконструкция аугментированной области.
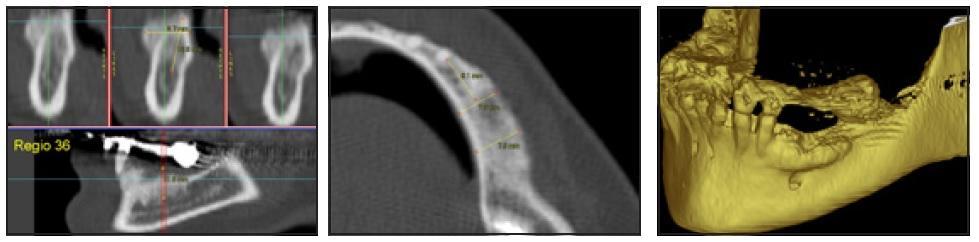
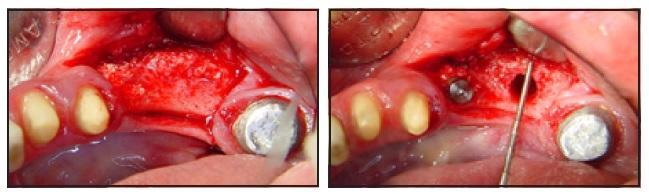
Фото 7а и 7б. Вид до и после установки первого имплантата.
Клинические измерения
После сепарации лоскута с помощью пародонтального зонда (Stoma Dental System) проводили маркировку середины ширины альвеолярного гребня для планируемой установки имплантатов. Зонд размещали в самой коронарной точке гребня перпендикулярно к апикокоронарной оси. По одному измерению проводили каждому пациенту в месте установки каждого из имплантатов. Аналогичные измерения проводили и непосредственно при процедуре имплантации. Разницу между этими двумя измерениями (то есть до и после аугментации) записывали в форме таблицы. Ширина альвеолярного гребня до аугментации у 5 пациентов группы выборки колебалась от 0,5 до 4,3 мм (среднее значение 2, 38±1,11 мм). Через 6 месяцев после аугментации ширина гребня у пяти пациентов достигла следующих значений: 7,6; 7,8; 6,2; 6,0; 6,6 мм, но если говорить в абсолютных числах, то увеличение ширины альвеолярного гребня составляло 7,1; 5,8; 2,7; 3,0 и 2,3 мм соответственно (в среднем 4, 33±1,92 мм). Таким образом, прирост костной ткани колебался от 1420% до 53%, со средним арифметическим показателем равным 389±301%.
Результаты
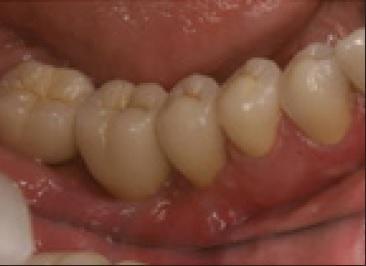
Все области аугментации зажили без сопутствующих осложнений и без обнажения покрывающих мембран. Симптомов инфицирования или боли не наблюдалось, что может служить признаком того, что альвеолярный нерв не был поврежден во время проведения операций. Ширина альвеолярного гребня в среднем увеличилась на 4,3 ± 1,9 мм (в диапазоне от 1,6 до 7,1 мм), что соответствует приросту кости в 389% ± 301% (от 50% до 1420%). У одного пациента после установки имплантата наблюдалась дигисценция, проблему с которой решили с помощью повторного графтинга. Первичная стабильность имплантата при этом ни в одном из случаев не была спровоцирована и через 2 года все конструкции демонстрировали отличные показатели функциональности с потерей костной ткани не более чем в 1 мм, что было подтверждено результатами периапикальной рентгенографии. Процесс заживления проходил без осложнений (фото 8).
Фото 8. Клинический вид через 2 года после фиксации финальных реставраций.
Обсуждение
Целью исследования серии клинических случаев были презентация и оценка модифицированной техники формирования периостального карманного лоскута для аугментации ножевидных альвеолярных гребней. Подобный подход являлся подготовительным для последующей имплантации. Чтобы проверить эффективность данной техники ширину альвеолярного гребня измеряли до операции и в постоперационный период. Процедура оказалось очень эффективной при горизонтальной аугментации. Для достижения предсказуемых результатов НКР пользуются принципом ПАФС: первичное закрытие раны, ангиогенез, формирование места для установки имплантата, стабильность результатов реконструкции твердых тканей альвеолярного гребня. Первичное закрытие раны путем ушивания без какого-либо натяжения способствует нормальному заживлению раны и ее защите от негативного влияния бактериальных и механических факторов, что повышает регенераторный потенциал области хирургического вмешательства. Ангиогенез, который представляет собой процесс образования новых кровеносных сосудов, усиливает рост и регенерацию раны. Декортикация и пенетрация внутрикостного пространства формируют связные каналы для проникновения и миграции остеогенных и плюрипотентных мезенхимальных клеток из области костного мозга в структуру костного трансплантата. Это не только увеличивает площадь контакта между костным трансплантатом и реципиентной тканью, но также обеспечивает механическую ретенцию между этими структурами, тем самым улучшая процесс заживления. Кроме того, активизируется феномен региональной акселерации, в результате чего процесс костного ремоделирования проходит быстрее благодаря формированию сразу нескольких очагов минерализации. Пространство в области вмешательства необходимо для проникновения остеогенных клеток, которые дифференцируются в остеобласты и образуют костную ткань. Тем не менее, остеобласты мигрируют более медленно, чем эпителиальные клетки, и именно для профилактики этого используют барьерные мембраны. Стабильность области аугментации определяет успех заживления раны, поскольку именно первично образовавшийся сгусток является большим резервуаром факторов роста и дифференциации, а также клеток-предвестников формирования грануляционной ткани, в результате организации и ремоделирования которой образуется новая кость.
Карман, формируемый в результате периостального расщепления, помогает увеличить стабильность трансплантата, даже в случаях тяжелого дефицита костной ткани. Исследования, направленные на изучение подвижности зубов, определили, что одной из причин патологии является редукция области прикрепления. Таким образом, подвижность зубов влияет на стабильность области хирургического вмешательства, препятствуя нормальной регенерации. Если говорить о стабильности при НКР, то данный фактор обеспечивает активацию этапа заживления, стимулируя депонирование факторов роста в области раны, что, в свою очередь, является частью процесса НКР. Второе преимущество метода ПКЛ состоит в том, что он позволяет ушить область вмешательства без натяжения мягких тканей даже в случаях проведения сложной горизонтальной аугментации. То есть даже при большом дефиците горизонтальной ширины кости данный подход обеспечивает возможность первичного закрытия мягких тканей без какого-либо натяжения, так как именно первичное закрытие является необходимым критерием гарантии костной регенерации под изолирующей мембраной. Техника ПКЛ обеспечивает не только первичное закрытие раны, но также сводит к минимуму риск микродвижения трансплантата и операционной области в целом: то есть происходит реализация сразу двух важных критериев успешности НКР. Исследователи, уделявшие внимание НКР в случаях горизонтального дефицита кости альвеолярных гребней, не только доказали успешность процедуры, но и описали ряд возможных осложнений. Zitzmann и коллеги сообщили, что примерно в 26% случаев формируются дигисценции мягких тканей, которые провоцируют обнажение изолирующих мембран. Распространённость таких осложнений выше при использовании нерезоорбирующихся мембран (42%), чем в случаях с коллагеновыми аналогами (10%). Следует также учитывать, что дигисценции в случаях использования коллагенновых мембран особо не угрожают общему клиническому исходу лечения. Friedmann и коллеги использовали сшитые коллагеновые мембраны у 16 пациентов с дефицитом альвеолярного гребня. У десяти из этих пациентов (62,5%) образовались дигисценции, обнажающее мембрану, и, как следствие, произошло инициирование ее ранней биодеградации. Norton, который использовал бычий костный материал и коллагеновые мембраны при процедурах синус-лифтинга и НКР в случаях горизонтальной аугментации, установил, что в 26% обнажение мембран было спровоцировано расхождением мягких тканей, а при гистологическом исследовании было обнаружено слабые следы костной регенерации. Из этого следует главный вывод: дигисценции мягких тканей компрометируют процесс направленной костной регенерации. Кроме того, Moses подтвердил возможность возникновения до 35% случаев дигисценций именно при проведении горизонтальной аугментации с помощью НКР.
Значительное снижение костной регенерации было отмечено в случаях, когда не удавалось обеспечить первичного закрытия раны в период заживления, что приводило к бактериальной контаминации области вмешательства. Это наблюдение подтверждено исследованиями Hiatt и Schallhorn, которые доказали, что степень регенерации увеличивается прямо пропорционально адекватности закрытия мягких тканей в месте аугментации. Дигисценции являются обычным осложнением при горизонтальной реконструкции гребня, которое может спровоцировать весь результат лечения. Поскольку техника ПКЛ улучшает подвижность мягких тканей и позволяет достичь первичного закрытия без натяжения, риск возникновения дигисценций сводится к минимуму.
Выводы
Расщепление слизисто-периостального лоскута по своей сути предусматривает повышение мобильности и эластичности мягких тканей, тем самым обеспечивая закрытие даже обширных областей горизонтальной аугментации. Разделение лоскута с вершины помогает сформировать периостальный карман для лучшей поддержки костного трансплантата, однако для аргументированного подтверждения эффективности результатов требуется проведение большего количества клинических исследований по поводу перспективы использования периостального щечного лоскута.
Авторы:
Marius Steigmann, DDS
Maurice Salama, DDS, MS
Hom-Lay Wang, DDS, MSD, PhD
Методы направленной костной регенерации (НКР) обеспечивают высокую эффективность восстановления дефицита альвеолярной кости для последующей процедуры дентальной имплантации. Во время реконструктивной хирургии установка имплантатов может проводиться непосредственно или отстрочено, в зависимости от возможности обеспечения первичной стабильности. Но даже несмотря на успех НКР в имплантологии, вертикальный дефицит кости и ножевидная форма альвеолярного гребня остаются двумя основными преградами для установки дентальных имплантатов, поскольку в подобных условиях спрогнозировать результат будущего лечения представляется невозможным.

Метод и материалы
Пять соматически здоровых пациентов (двое мужчин и трое женщины) возрастом от 38 до 62 лет с недостаточной шириной альвеолярного гребня и потребностью в проведении дентальной имплантации в задней области нижней челюсти были отобраны для описания серии клинических случаев (фото 1). До этого все пациенты были проинформированы о характере исследования и процедурах, связанных с ним, а также о возможности потенциальных рисков, поэтому все они подписали формы о добровольном согласии относительно участия в данном исследовании. В ходе анализа были изучены истории болезней, выполнены внутриротовые осмотры мягких и твердых тканей, и при наличии показаний пациенты направлялись на дополнительное пародонтальное лечение. Для всех пациентов выполняли предоперационные рентгенограммы, в том числе панорамные и периапикальные снимки; компьютерную томографию (КТ) проводили лишь троим пациентам из презентационной выборки.
Фото 1. Гипсовая модель нижней челюсти пациента с областью резорбции костной ткани в задней области со щечной и лингвальной сторон.

За два часа до операции пациенты принимали по 2 грамма амоксициллина, а непосредственно перед вмешательством они самостоятельно проводили ирригацию ротовой полости 0,12% раствором хлоргексидина глюконата на протяжении 1 минуты. Для купирования болевых ощущений проводили местную анестезию. Костный заменитель (Tutodent, Tutogen или Bio Oss, Geistlich) использовали для восстановления ширины альвеолярного отростка как минимум до 6 мм, такие параметры обеспечили бы требуемые условия для проведения имплантации. Во всех случаях материал костного заменителя покрывали коллагеновыми мембранами (в трех случаях перикардиальными Tutogen, и в двух Ossix, Biomet 3) для защиты трансплантата от контакта со слизистой оболочкой и профилактики интерпозиции мягких тканей в область аугментации. Перед установкой мембраны были подрезаны до нужной формы для адаптации к месту аугментации. Пациентам не было проведено никаких процедур по увеличению вертикальной составляющей альвеолярного гребня. Повторные осмотры проводились через 3, 7, 14 и 30 дней. После операции пациентам также были даны инструкции относительно гигиенического ухода за раной и ротовой полостью в целом. Швы были удалены через 15 дней после операции.
Хирургическая процедура формирования периостального карманного лоскута
Полный разрез был сделан под углом 45° паракрестально к щечной стенке в толще тканей ороговевшей десны на самой коронарной части альвеолярного гребня (фото 2а и 2б). Слизисто-надкостичный лоскут отсепарировали лингвально, а щечную его часть расщепили, отделив периост от слизистой апикально на 10-13 мм (в соответствии с длиной используемого имплантата). В ходе выполнения данной процедуры не было выполнено никаких послабляющих разрезов. Но после расщепления лоскута послабляющие вертикальные разрезы сформировали изнутри слизистой оболочки наружу с обеих сторон, переходя за муко-гингивальную границу (мезиально и дистально). Были приняты меры для сохранения надкостницы в области кости. Расщепление слизистой позволяет добиться большей эластичности лоскута. Начиная с крестального разреза, надкостницу отделили от кости с помощью периостальногго элеватора, расширяя при этом область сепарации апикально от 8 до 12 мм, и тем самым формируя карман между пластинкой щечной кости и отсепарированной надкостницей. Вертикальная глубина аугментации была определена формой кости и длиной будущего имплантата (фото 3а и 3б).
Фото 2а-2б. Паракрестальный разрез, сделанный в области верхушки альвеолярного гребня под углом 45° к щечной стенке в толще кератинизированной десны.

Фото 3а-3б. Надкостницу отсепарировали от кости с помощью периостального элеватора с формированием периостального кармана соответственной высоты.

Периостальный карман заполнили медленно резорбирующимся трансплантатным материалом после пенетрации костного мозга для стимуляции ангиогенеза (фото 4а-4с). Рассасывающейся коллагеновой мембраной прикрыли участок трансплантационного материала в области верхушки гребня, поскольку прикрыть материал в данном месте с помощью периоста было физически невозможно.
Фото 4а и 4б. Увеличение эластичности лоскута путем сепарации слизистой от надкостницы и заполнение периостального кармана материалом трансплантата.

Наложение швов было выполнено в два этапа. Швы начинали через язычный полный лоскут, затем проходили через щечную часть надкостницы, потом опять возвращались к язычному лоскуту через щечную часть надкостницы, то есть выполняли матрацный шов. Узлы формировали с лингвальной стороны (фото 5а). Вторым матрацным швом слизистую фиксировали щечно к лингвальному мукопериостальному лоскуту. Узлы в таком случае формировали со щечной стороны (фото 5б).
Фото 5а (слева) и 5б (справа). Фиксация периоста с помощью матрацных швов (пришит только периост). Второй слой матрацных швов обеспечил фиксацию слизистой к лингвальному мукопериостальному лоскуту.

Процедура имплантации
Перед имплантацией КТ-сканирование проводили трем пациентам. Результаты процедуры подтвердили эффективность аугментации (фото 6а-6с). Имплантаты устанавливали через 24 недели после реконструкции альвеолярного гребня (фото 7а и 7б), средние показатели высоты и ширины которого были изменены посредством ятрогенного вмешательства. Все имплантаты Tapered Screw Vent были установлены по закрытому типу (погружены в кость альвеолярного гребня). После их установки лоскут ушили с помощью узловых швов. Постоперационные рекомендации были даны пациентам в устной форме, а также в письменном виде. Через 12 недель установили формирователи десен, а еще через 3-4 недели установили окончательные конструкции протезов. Каждого пациента тщательно осматривали в ходе повторных визитов каждые 3 месяца, а через год каждому из них была выполнена периапикальная рентегнография.
Фото 6
а. КТ-снимки через 24 месяца.
б. Увеличенный вид аугментированной области. Ширина гребня на вершине составляет 2 мм, у основы – 7,8 мм.
с. 3D реконструкция аугментированной области.

Фото 7а и 7б. Вид до и после установки первого имплантата.


Клинические измерения
После сепарации лоскута с помощью пародонтального зонда (Stoma Dental System) проводили маркировку середины ширины альвеолярного гребня для планируемой установки имплантатов. Зонд размещали в самой коронарной точке гребня перпендикулярно к апикокоронарной оси. По одному измерению проводили каждому пациенту в месте установки каждого из имплантатов. Аналогичные измерения проводили и непосредственно при процедуре имплантации. Разницу между этими двумя измерениями (то есть до и после аугментации) записывали в форме таблицы. Ширина альвеолярного гребня до аугментации у 5 пациентов группы выборки колебалась от 0,5 до 4,3 мм (среднее значение 2, 38±1,11 мм). Через 6 месяцев после аугментации ширина гребня у пяти пациентов достигла следующих значений: 7,6; 7,8; 6,2; 6,0; 6,6 мм, но если говорить в абсолютных числах, то увеличение ширины альвеолярного гребня составляло 7,1; 5,8; 2,7; 3,0 и 2,3 мм соответственно (в среднем 4, 33±1,92 мм). Таким образом, прирост костной ткани колебался от 1420% до 53%, со средним арифметическим показателем равным 389±301%.
Результаты
Все области аугментации зажили без сопутствующих осложнений и без обнажения покрывающих мембран. Симптомов инфицирования или боли не наблюдалось, что может служить признаком того, что альвеолярный нерв не был поврежден во время проведения операций. Ширина альвеолярного гребня в среднем увеличилась на 4,3 ± 1,9 мм (в диапазоне от 1,6 до 7,1 мм), что соответствует приросту кости в 389% ± 301% (от 50% до 1420%). У одного пациента после установки имплантата наблюдалась дигисценция, проблему с которой решили с помощью повторного графтинга. Первичная стабильность имплантата при этом ни в одном из случаев не была спровоцирована и через 2 года все конструкции демонстрировали отличные показатели функциональности с потерей костной ткани не более чем в 1 мм, что было подтверждено результатами периапикальной рентгенографии. Процесс заживления проходил без осложнений (фото 8).
Фото 8. Клинический вид через 2 года после фиксации финальных реставраций.

Обсуждение
Целью исследования серии клинических случаев были презентация и оценка модифицированной техники формирования периостального карманного лоскута для аугментации ножевидных альвеолярных гребней. Подобный подход являлся подготовительным для последующей имплантации. Чтобы проверить эффективность данной техники ширину альвеолярного гребня измеряли до операции и в постоперационный период. Процедура оказалось очень эффективной при горизонтальной аугментации. Для достижения предсказуемых результатов НКР пользуются принципом ПАФС: первичное закрытие раны, ангиогенез, формирование места для установки имплантата, стабильность результатов реконструкции твердых тканей альвеолярного гребня. Первичное закрытие раны путем ушивания без какого-либо натяжения способствует нормальному заживлению раны и ее защите от негативного влияния бактериальных и механических факторов, что повышает регенераторный потенциал области хирургического вмешательства. Ангиогенез, который представляет собой процесс образования новых кровеносных сосудов, усиливает рост и регенерацию раны. Декортикация и пенетрация внутрикостного пространства формируют связные каналы для проникновения и миграции остеогенных и плюрипотентных мезенхимальных клеток из области костного мозга в структуру костного трансплантата. Это не только увеличивает площадь контакта между костным трансплантатом и реципиентной тканью, но также обеспечивает механическую ретенцию между этими структурами, тем самым улучшая процесс заживления. Кроме того, активизируется феномен региональной акселерации, в результате чего процесс костного ремоделирования проходит быстрее благодаря формированию сразу нескольких очагов минерализации. Пространство в области вмешательства необходимо для проникновения остеогенных клеток, которые дифференцируются в остеобласты и образуют костную ткань. Тем не менее, остеобласты мигрируют более медленно, чем эпителиальные клетки, и именно для профилактики этого используют барьерные мембраны. Стабильность области аугментации определяет успех заживления раны, поскольку именно первично образовавшийся сгусток является большим резервуаром факторов роста и дифференциации, а также клеток-предвестников формирования грануляционной ткани, в результате организации и ремоделирования которой образуется новая кость.
Карман, формируемый в результате периостального расщепления, помогает увеличить стабильность трансплантата, даже в случаях тяжелого дефицита костной ткани. Исследования, направленные на изучение подвижности зубов, определили, что одной из причин патологии является редукция области прикрепления. Таким образом, подвижность зубов влияет на стабильность области хирургического вмешательства, препятствуя нормальной регенерации. Если говорить о стабильности при НКР, то данный фактор обеспечивает активацию этапа заживления, стимулируя депонирование факторов роста в области раны, что, в свою очередь, является частью процесса НКР. Второе преимущество метода ПКЛ состоит в том, что он позволяет ушить область вмешательства без натяжения мягких тканей даже в случаях проведения сложной горизонтальной аугментации. То есть даже при большом дефиците горизонтальной ширины кости данный подход обеспечивает возможность первичного закрытия мягких тканей без какого-либо натяжения, так как именно первичное закрытие является необходимым критерием гарантии костной регенерации под изолирующей мембраной. Техника ПКЛ обеспечивает не только первичное закрытие раны, но также сводит к минимуму риск микродвижения трансплантата и операционной области в целом: то есть происходит реализация сразу двух важных критериев успешности НКР. Исследователи, уделявшие внимание НКР в случаях горизонтального дефицита кости альвеолярных гребней, не только доказали успешность процедуры, но и описали ряд возможных осложнений. Zitzmann и коллеги сообщили, что примерно в 26% случаев формируются дигисценции мягких тканей, которые провоцируют обнажение изолирующих мембран. Распространённость таких осложнений выше при использовании нерезоорбирующихся мембран (42%), чем в случаях с коллагеновыми аналогами (10%). Следует также учитывать, что дигисценции в случаях использования коллагенновых мембран особо не угрожают общему клиническому исходу лечения. Friedmann и коллеги использовали сшитые коллагеновые мембраны у 16 пациентов с дефицитом альвеолярного гребня. У десяти из этих пациентов (62,5%) образовались дигисценции, обнажающее мембрану, и, как следствие, произошло инициирование ее ранней биодеградации. Norton, который использовал бычий костный материал и коллагеновые мембраны при процедурах синус-лифтинга и НКР в случаях горизонтальной аугментации, установил, что в 26% обнажение мембран было спровоцировано расхождением мягких тканей, а при гистологическом исследовании было обнаружено слабые следы костной регенерации. Из этого следует главный вывод: дигисценции мягких тканей компрометируют процесс направленной костной регенерации. Кроме того, Moses подтвердил возможность возникновения до 35% случаев дигисценций именно при проведении горизонтальной аугментации с помощью НКР.
Значительное снижение костной регенерации было отмечено в случаях, когда не удавалось обеспечить первичного закрытия раны в период заживления, что приводило к бактериальной контаминации области вмешательства. Это наблюдение подтверждено исследованиями Hiatt и Schallhorn, которые доказали, что степень регенерации увеличивается прямо пропорционально адекватности закрытия мягких тканей в месте аугментации. Дигисценции являются обычным осложнением при горизонтальной реконструкции гребня, которое может спровоцировать весь результат лечения. Поскольку техника ПКЛ улучшает подвижность мягких тканей и позволяет достичь первичного закрытия без натяжения, риск возникновения дигисценций сводится к минимуму.
Выводы
Расщепление слизисто-периостального лоскута по своей сути предусматривает повышение мобильности и эластичности мягких тканей, тем самым обеспечивая закрытие даже обширных областей горизонтальной аугментации. Разделение лоскута с вершины помогает сформировать периостальный карман для лучшей поддержки костного трансплантата, однако для аргументированного подтверждения эффективности результатов требуется проведение большего количества клинических исследований по поводу перспективы использования периостального щечного лоскута.
Авторы:
Marius Steigmann, DDS
Maurice Salama, DDS, MS
Hom-Lay Wang, DDS, MSD, PhD





























































































































































0 комментариев