Дентальная имплантация на данный момент является одним из наиболее устоявшихся в стоматологической практике методов восстановления беззубых участков челюстей при помощи титановых внутрикостных опор. Однако, в ряде исследований было установлено, что титан со временем может вызывать развитие воспаления в окружающих тканях, что приводит к дальнейшей экспрессии определенных медиаторов, что обуславливает персистенцию состояния хронического воспаления за счет постоянной стимуляции иммунной системы. Данные триггеры приводят к активации тех сигнальных путей, который повышают предрасположенность к развитию рака и аутоиммунных заболеваний. Сигнальные клетки по типу цитокинов являются, по сути, «инструкторами» и влияют на деятельность других клеток, которые характеризируются наличием специфических рецепторов, позволяющих распознать эти самые цитокины. В более ранних публикациях подобный процесс хронического воспаления был верифицирован как жировой дегенеративный остеонекроз в пространстве костного мозга челюстей (ЖДОПКМЧ). Исходя из этого было начато исследование, направленное на изучение процесса от перехода стадии острой травмы челюсти при имплантации до стадии развития хронического воспаления в костной ткани.
Клинические особенности ЖДОПКМЧ: определение и диагностические критерии
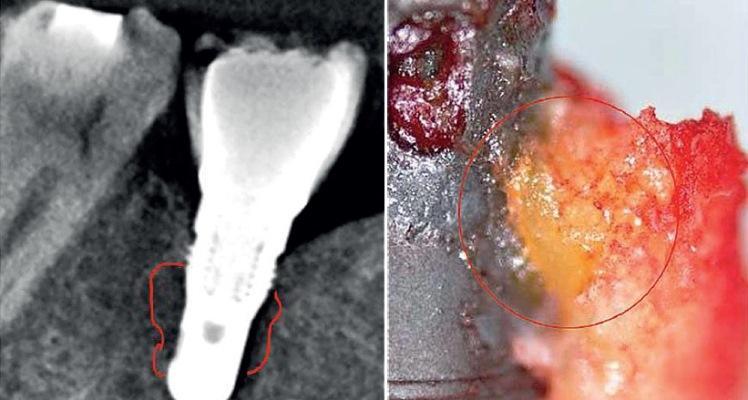
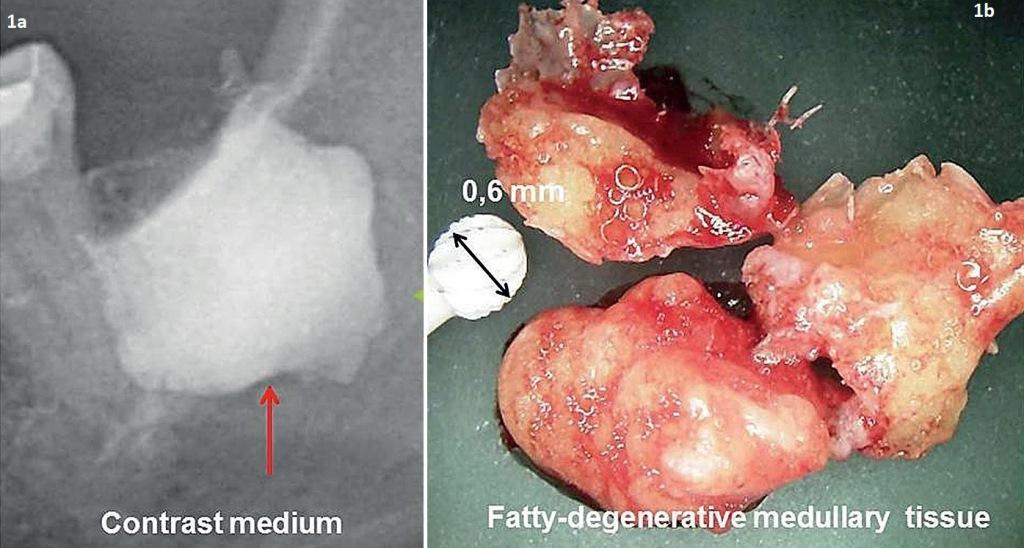
ЖДОПКМЧ представляет собой поражение, сходное с поражением длинных костей, определяемое как «отек костного мозга» и «хронический негнойный остеомиелит». Размягчение костного мозга при ЖДОПКМЧ является крайне выраженным, поскольку при удалении кортикальной пластинки содержание костного мозга можно просто изъять аспиратором или выскоблить кюреткой посредством нескольких движений. Имеющиеся пустотелые пространства именуются кавитациями, которые выполнены адипоцитами, подвергшимися жировой дегенерации, а также демиелинизированными костными оболочками нижнего альвеолярного нерва. На фото 1 изображен образец костной ткани с признаками выраженной жировой трансформации. Распространенность ЖДОПКМЧ можно проанализировать на имеющейся рентгенограмме по имеющейся разнице в показателях контраста между здоровой и патологической тканью.
Фото 1. Область контрастирования (заполненная контрастным агентом) соответствует области поражения после выполнения процедуры кюретажа (а); образец костной ткани с признаками жировой дегенерации костного мозга (b).
Растворение титановых частиц в костной ткани челюстей
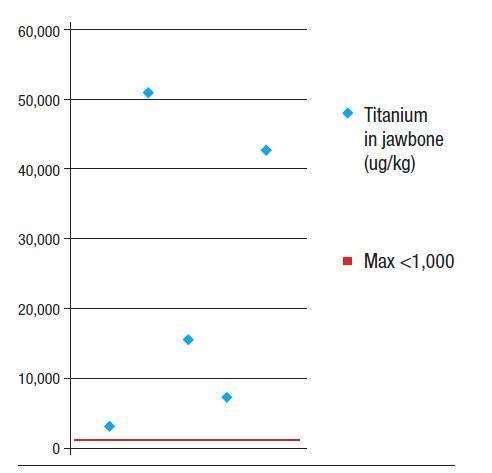
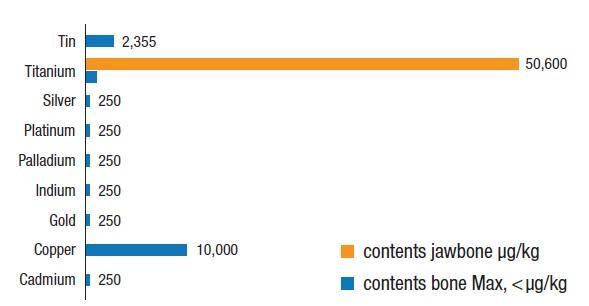
После сообщений в литературе, касающихся растворения титановых частиц в костной ткани челюстей, мы провели анализ 5 образцов костной ткани из 14 полученных от пациентов с ЖДОПКМЧ на предмет фактического уровня концентрации титана. Количество растворенного Ti в данных образцах варьировало от 3200 до 50 600 мкг/кг со средним значением на уровне 24 200 мкг/кг (± 20 029 СО; фото 3). Поскольку сведения о среднем максимальном содержании растворенного Ti, которое могло бы считаться биосовместимым и приемлемым, в литературе отсутствуют, мы определили таковое на уровне 1000 мкг/кг массы тела, что в четыре раза выше, чем приемлемый уровень всех других тяжелых металлов в организме человека согласно имеющимся научным данным (<250 мкг/кг). Частицы Ti могут растворяться и вызывать развитие иммунологических реакций в организме человека, провоцируя при этом релизинг системных сигнальных клеток. Исследование, представленное Nakashima и коллегами, позволило установить механизм активации макрофагов частицами Ti из поверхности имплантатов, а также определить структуру цепочки цитокиновой связи, которая также активируется за счет высвобождения частиц металла из поверхности внутрикостных опор. В проведенном исследовании макрофаги пациентов подвергались воздействию частиц сплавов Ti, взятых из соединительной ткани, окружающей имплантаты бедра. Воздействие макрофагов на частицы сплава Ti в лабораторных условиях в течение 48 часов привело к 40-кратному увеличению высвобождения фактора некроза опухоли альфа (TNF-альфа) и семикратному увеличению уровня релизинга интерлейкина-6 (IL-6).
Анализ экспрессии цитокинов в образцах ЖДОПКМЧ
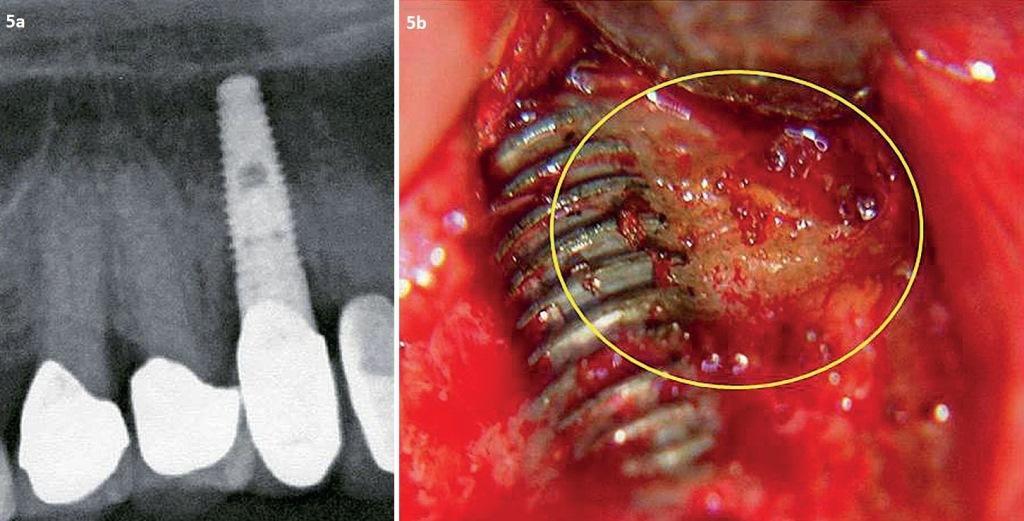
Чтобы различить паттерны цитокиновых связей, которые идентифицируются в костной ткани челюстей, 14 пациентам с признаками ЖДОПКМЧ было проведено оперативное вмешательство, предусматривающее удаление установленных имплантатов с окружающим объемом кости. У всех пациентов были обнаружены участки развития ЖДОПКМЧ в костной ткани, окружающей имплантат, которые по своему строению были аналогичны ранее описанным в литературе. В изъятых объемах костной ткани проводили исследование цитокиновых профилей. На КЛКТ-срезе, изображенном на фото 2, выраженность патологических изменений является минимальной, в отличие от того, что удалось верифицировать на гистологических препаратах. В ходе макроскопического анализа вокруг имплантатов была верифицирована желтая размягченная губчатая костная ткань, которая прикреплялась к их титановой поверхности. Непосредственное изучение цитокиновых профилей в структуре данных образцов кости проводилось в Институте медицинской диагностики IMD. Аналогично результатам, представленным в предыдущих публикациях, было установлено, что определяющей характеристикой ЖДОПКМЧ является сверхэкспрессия провоспалительных сигнальных клеток типа RANTES (regulated upon activation, normal T-cell expressed and secreted – регулируются при активации нормальной экспрессии и секреции Т-клеток), также известных как хемокин C-ассоциированный лиганд 5 (CCL5). Средние значения уровней семи цитокинов в образцах костной ткани здоровых пациентов и пациентов с ЖДОПКМЧ изображены на фото 4. На фото 5 изображен один из образцов костной ткани, изъятый из периимплантатной области с признаками поражения ЖДОПКМЧ на предмет изучения цитокинового паттерна. ЖДОПКМЧ аналогичен процессу «молчащего» или субклинического воспаления без типичных признаков, характерных для острого воспаления. При хроническом воспалении отмечается локальная продукция воспалительных цитокинов по типу TNF-α и IL-1/6, превалирование регуляторных и компенсирующих механизмов взаимодействия, которые способствуют развитию ЖДОПКМЧ в костном мозге. Этот феномен наличия внутрикостного источника избыточной экспрессии RANTES/CCL5 (R/C), очевидно, является довольно распространенным, несмотря на игнорирование данного предположения большинством врачей-стоматологов. Хирургическое вмешательство в области ЖДОПКМЧ может остановить индукцию сигнальных путей типа R/C и, таким образом, способствовать ингибированию развития ЖДОПКМЧ-ассоциированных признаков поражения.
Фото 2. Титановый имплантат в области 46 зуба: визуализация на КЛКТ-скане (а); жировая ткань, прикрепленная к поверхности имплантата (b).
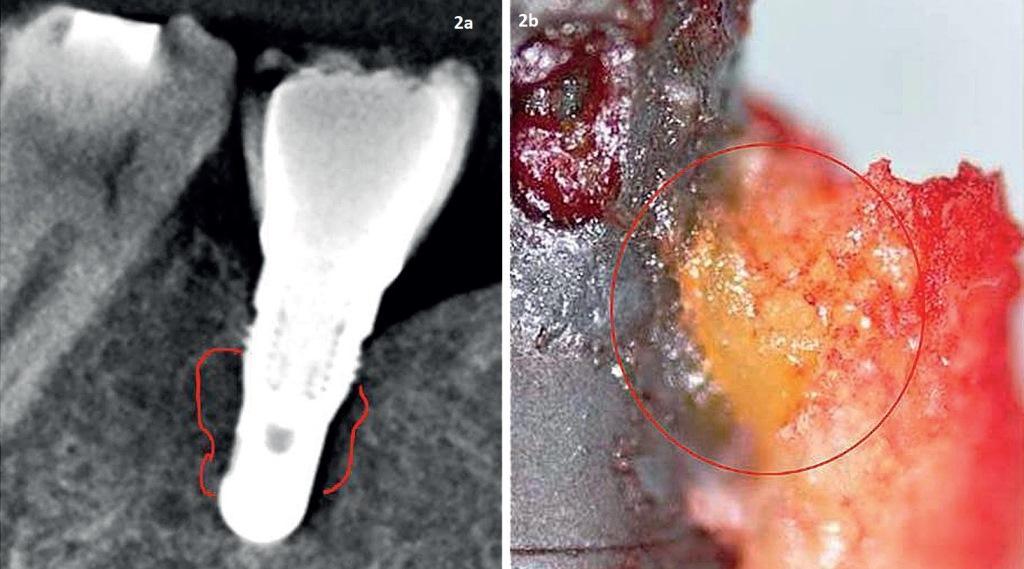
Фото 3. Распределение уровня концентрации частиц титана в костной ткани челюсти в 5 случаях регистрации жирового дегенеративного остеонекроза.
Почему ЖДОПКМЧ - загадка в стоматологии?
В предыдущих исследованиях мы продемонстрировали факт отсутствия явных рентгенологических признаков ЖДОПКМЧ, что значительно осложняет процесс точной диагностики данного поражения по данным обычных рентгенограмм. Именно поэтому большинство случаев ЖДОПКМЧ попросту игнорируется врачами-стоматологами. Несмотря на то, что классические рентгенологические подходы идентификации ЖДОПКМЧ являются весьма ограниченными, для диагностики данного поражения можно использовать ряд других диагностических методик. Одной из таких является компьютеризированная трансальвеолярная ультразвуковая методика (ТУМ), которая позволяет верифицировать факт размягчения костной ткани. ТАУ является куда более диагностически чувствительным подходом по сравнению с рентгенографией для подтверждения имеющихся микроскопических патологических изменений. Несмотря на это, патология ЖДОПКМЧ все равно остается недодиагностированной. При этом, даже несмотря на отсутствие рентгенологических признаков поражения ЖДОПКМЧ, врач должен понимать, что провоспалительные механизмы в это время уже набирают оборотов в структуре костной ткани, как это изображено на фото 4. Именно развитие данного феномена является ключевым для дальнейшей персистенции хронического воспаления.
Фото 4. Сравнение уровней семи цитокинов: случаи ЖДОПКМЧ – красные колонки, случаи имплантатов без признаков поражения – синие колонки.
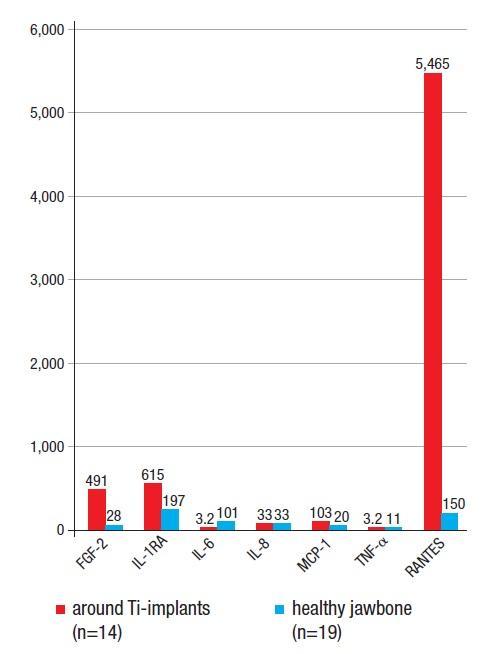
Фото 5. Отсутствие признаков поражения имплантата на рентгенограмме (а); случай жировой дегенерации кости в области того же имплантата (b).
Исследование высокого растворения титана в костной ткани челюстей
В данном тематическом исследовании подчеркивается проблема ложной гипотезы о том, что рентгенограммы могут помочь идентифицировать факт релизинга титановых частиц из поверхности имплантата в периимплантатную область. На рентгенограмме области имплантата, установленного на месте 15 зуба, не было выявлено наличия каких-либо патологических изменений, при этом рентгенологически опора выглядела механически успешной. Но уже на фото 6, полученном после эксплантации, можно увидеть металлический преципитат черного цвета вдоль костных канавок, сформированных резьбой имплантата. В ходе спектрального анализа данного преципитата на предмет тяжелых металлов (фото 6-7), количество обнаруженного титана было увеличено в 50 раз по сравнению с установленным биоприемлемым уровнем в <1000 мкг/кг массы тела.
Фото 6. Рентгенограмма имплантата в области 15 зуба до его удаления (а); вид альвеолярной кости после удаления имплантата: визуализация участков преципитации титана (b).
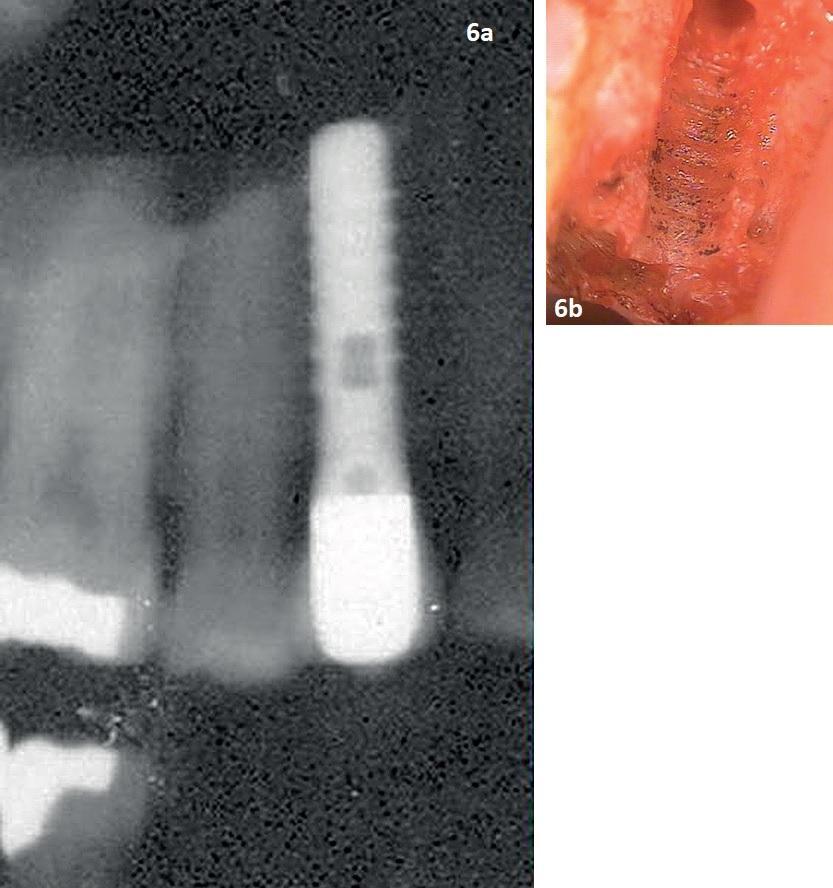
Фото 7. Содержание титана в костной ткани в области 15 зуба, определенное при помощи спектрального анализа.
Сенсибилизация иммунной системы титановыми имплантатами
TNF-альфа является провоспалительным цитокином, который высвобождается на начальной стадии почти любой иммунной реакции. Также данный цитокин играет ключевую роль в процессе потери титановых имплантатов из-за генетической неприемлемости титана. Кроме фактического высвобождения частиц титана из поверхности внутрикостной конструкции, сенсибилизация иммунной системы также развивается за счет повышенной провоспалительной активности неспецифических иммунных клеток (тканевых макрофагов и моноцитов). Данный паттерн активности у некоторых пациентов развивается сразу же после контакта костной ткани с частицами металла, в нашем случае – с титановыми. Релизинг таковых диаметром 1-10 мкм в периимплантатную область происходит за счет механической абразии, химической, бактериальной и гальванической коррозии, что в конце концов приводит к формированию гипервоспалительного состояния. Sterner и коллеги изучали эффект влияния частиц алюминия, керамики, циркония и титана разного размера и их концентрации на релизинг фактора TNF и его взаимодействие с клетками макрофагов. Было установлено, что по сравнению с частицами алюминия частицы титана того же размера и в такой же концентрации стимулируют куда большую секрецию TNF. При этом частицы циркония вовсе не влияли на паттерн секреции TNF. Ранее мы уже описывали эффект растворения титановых частиц в костной ткани челюстей: при контакте с таковыми тканевые макрофаги высвобождают провоспалительные цитокины, которые являются составляющими местной воспалительной реакции. Объем релизинга провоспалительных цитокинов определяется полиморфизмом генов, ассоциированных с данными клетками, и поэтому может варьировать у разных индивидов.
Jacobi-Gresser и соавторы обнаружили, что у пациентов с потерей имплантатов или периимплантитом отмечалась значительно более выраженная генетическая предрасположенность к воспалению, а также более высокие уровни положительного результата иммунологического теста с избыточной активацией TNF-α и IL-1. Таким образом, два цитокина TNF-α и IL-1 являются ключевыми медиаторами местного и системного воспалительного ответа. Степень релизинга и активации данных цитокинов после контакта с частицами титана варьирует у разных индивидов в зависимости от выраженности полиморфизма генов, ассоциированных с данными клетками, и противовоспалительного действия антагонистов рецепторов IL-1.
Вторичная экспрессия RANTES / CCL5, управляемая TNF-α при развитии ЖДОПКМЧ
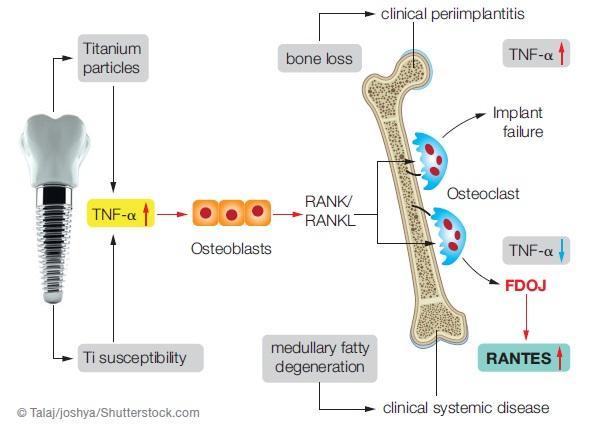
Учитывая все вышеизложенные факты, возникает вопрос о том, существует ли индуцированное или синергическое взаимодействие между воспалительными медиаторами TNF-α, секретируемыми вокруг титановых имплантатов, и высокими уровнями экспрессии механизма R/C. Секреция воспалительных цитокинов опосредует развитие системных эффектов воспаления жировой ткани. Экспрессия механизма R/C резко повышается в областях уже имеющегося воспаления. Результаты проведенных исследований указывают на то, что титановые частицы способны провоцировать повышение релизинга провоспалительных и остеолитических медиаторов в культуре костного мозга человека. Данные медиаторы в конце концов являются ответственными за асептическое поражение имплантатов. Кроме собственно действия TNF-α, развивается и R/C -ассоциированный каскад реакций: снижается объем кровоснабжения, плотность капиллярной сетки, после чего в пространстве костного мозга отмечаются ишемические и гипоксические изменения. Адипоциты и некротические частицы жировых клеток считаются иммунологические активными. Таким образом, на ранней острой фазе воспаления превалируют провоспалительные цитокины TNF-α и IL-6, в то время как на поздней стадии поражения – хемокины по типу R/C. По сути, происходит трансформация острого воспалительного поражения в хроническое. Кроме поражения тканей или инфицирования, ишемия еще и сама по себе индуцирует экспрессию хемокинов и повышение уровня воспалительных цитокинов. В большинстве полученных адипоцитов отмечалась спонтанная и продолжительная экспрессия R/C, при этом до 36% повышения уровня R/C было непосредственно спровоцировано ишемией и гипоксией. Адипоциты в таком случае следует рассматривать как источник экспрессии R/C. Полный механизм взаимодействия между TNF-α и R/C остается не до конца изученным (фото 8).
Фото 8. Побочные эффекты имплантации предполагают возможное развитие потери костной ткани и интраоссальной опоры, или же развитие жирового дегенеративного остеонекроза.
Почему избыточная экспрессия RANTES/CCL5, возможно, связана с системными заболеваниями?
Провоспалительные сигнальные медиаторы по типу R/C могут иметь системное влияние на организм человека, провоцируя не только развитие хронического воспаления, но и дальнейшие патофизиологические изменения. Общепринятым является факт дисбаланса между цитокинами и их специфическими ингибиторами в случаях развития хронического воспаления. ЖДОПКМЧ, по сути, является одним из феноменов воспалительного клеточного ответа, при котором цитокины не активируются посредством вирусов или бактерий. Данная гипотеза поддерживается тем фактом, что уровни типичных провоспалительных цитокинов по типу TNF-α и IL-6 заметно не повышаются при ЖДОПКМЧ, или вообще отсутствуют в образцах, полученных из области развития ЖДОПКМЧ. С другой стороны, повышается уровень R/C, что более характерно для хронического воспаления. Отсутствие острого воспаления при ЖДОПКМЧ только свидетельствует о субклинической и скрытой пролиферации хронического воспалительного процесса, контролируемого R/C. Высокие уровни R/C воспалительного цитокина были также обнаружены в среде стареющих стволовых клеток. В случае рака молочной железы имеются свидетельства о синергетической остеоиммунологической реакции на титановые имплантаты, поскольку TNF является активатором R/C промоции в мезенхимальных стволовых клетках в опухолевой среде рака молочной железы. Стимуляция мезенхимальных стволовых клеток посредством TNF провоцирует развитие зависящего от дозы повышения экспрессии R/C в структуре опухоли. Исследование R/C при ревматоидном артрите установило наличие аналогичного механизма взаимодействия: хотя в не стимулированных синовиальных фибробластах экспрессия мРНК не была связана с R/C, но при этом нарушение функции хондроцитов и деградация хрящевой ткани демонстрировала R/C-ассоциированной паттерн. IL-1 и TNF также индуцируют выработку R/C, сверхэкспрессия которого отмечалась в суставах, пораженных артритом. Цепочка стимуляции от действия TNF и IL-1 до повышения уровня R/C также может являться значимой патогенетической составляющей при прогрессировании сердечно-сосудистых заболеваний.
Имплантация и возможные цитокиновые каскады
Perala установил факт индукции TNF после совместной инкубации материала нативной ткани с установленным имплантатом в лабораторных условиях. Такое открытие может свидетельствовать о высвобождении иммуногенных частиц из поверхности внутрикостной опоры в окружающую ткань. Что же касается экспрессии цитокинов в контексте имплантата и связанных с ним фаз заживления костной ткани, то проведенный анализ позволил выделить несколько новых фаз активации сигнальных путей на разных этапах интеграции, который индуцируются цитокинами:
- Фаза клинически успешного бессимптомного титанового имплантата с окружающей его областью субклинического ЖДОПКМЧ, рентгенологическая идентификация которого осложнена из-за отсутствия альтернативных методов измерения плотности костной ткани.
- Фаза острой травмы после установки имплантата, которая ассоциирована с релизингом цитокинов и развитием воспалительных каскадов через TNF, IL-6 и IL-1.
- Провокация экспрессии TNF титановыми частицами на более поздних стадиях.
- Повышение секреции R/C за счет длительного действия TNF.
Развитие подобного поражения ассоциировано со следующими клиническими проблемами:
- Нарушение стабильности титанового имплантата в условиях отсутствия признаков воспаления;
- Клиническая и рентгенологическая незаметность прогрессирования поражения;
- Как правило, появившиеся симптомы системного поражения, не ассоциируют с действием титановых имплантатов, поскольку таковые развиваются через довольно длительное время после установки внутрикостных опор.
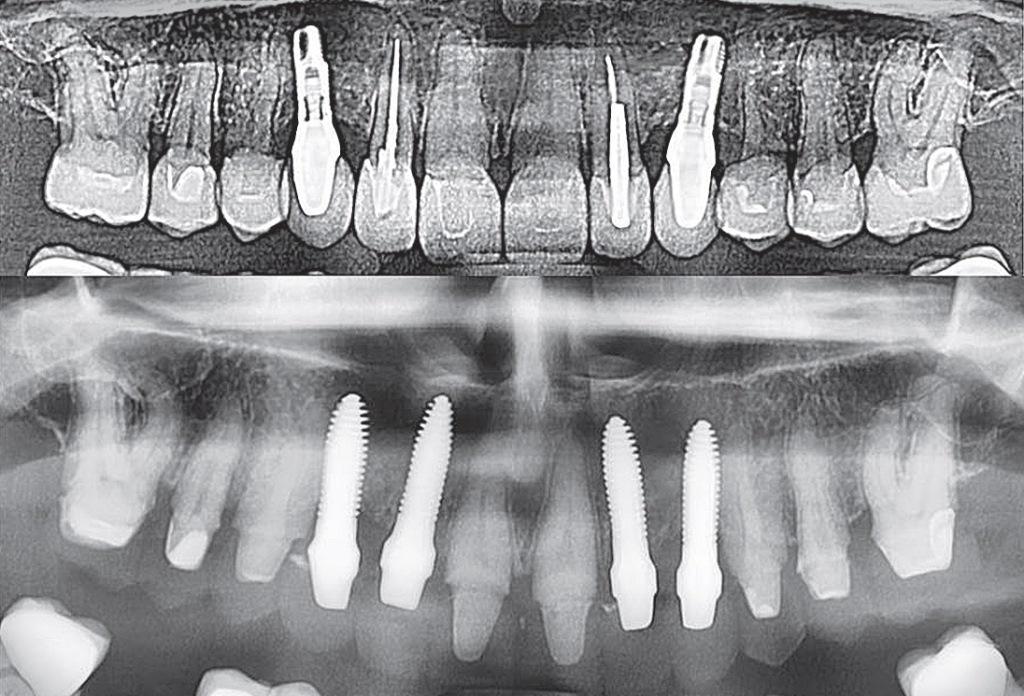
Сценарий остеоиммунологического механизма развития поражения после проведения имплантации изображен на фото 8. Немедленная замена титанового имплантата посредством керамического может позволить избежать хронических патологических нарушений, характерных для ЖДОПКМЧ (фото 9).
Фото 9. Замена титановых имплантатов на керамические: сравнение ортопантомограмм до и после.
Заключение
Полученные данные свидетельствуют о наличии иммунологической связи между фактом установки титановых имплантатов и развитием ЖДОПКМЧ. Только клиническая оценка имплантатов является недостаточной для диагностики патологии подобного типа. Данные рентгенографии также достаточно ограничены с точки зрения верификации уровня экспрессии цитокинов и интерлейкинов, спровоцированного титановыми частицами. Поэтому потребность в установке титановых внутрикостных опор следует рассматривать с системной перспективы. Системные и локальные критерии здоровья пациента являются некими ориентирами для прогнозирования возможного развития ЖДОПКМЧ. При этом нужно понимать, что стабильное состояние имплантата не равняется отсутствию ЖДОПКМЧ. Приведенное выше исследование является первым в своем роде, которое описывает наличие потенциальной связи между фактом установки титанового имплантата и ЖДОПКМЧ, как векторного причинно-следственного взаимодействия. Изъятие установленной титановой опоры может позволить нивелировать R/C-ассоциированные сигнальные пути, таким образом, минимизируя риск развития хронического воспаления.
Автор:
Drs Johann Lechner (Германия)
Sammy Noumbissi (США)
Дентальная имплантация на данный момент является одним из наиболее устоявшихся в стоматологической практике методов восстановления беззубых участков челюстей при помощи титановых внутрикостных опор. Однако, в ряде исследований было установлено, что титан со временем может вызывать развитие воспаления в окружающих тканях, что приводит к дальнейшей экспрессии определенных медиаторов, что обуславливает персистенцию состояния хронического воспаления за счет постоянной стимуляции иммунной системы. Данные триггеры приводят к активации тех сигнальных путей, который повышают предрасположенность к развитию рака и аутоиммунных заболеваний. Сигнальные клетки по типу цитокинов являются, по сути, «инструкторами» и влияют на деятельность других клеток, которые характеризируются наличием специфических рецепторов, позволяющих распознать эти самые цитокины. В более ранних публикациях подобный процесс хронического воспаления был верифицирован как жировой дегенеративный остеонекроз в пространстве костного мозга челюстей (ЖДОПКМЧ). Исходя из этого было начато исследование, направленное на изучение процесса от перехода стадии острой травмы челюсти при имплантации до стадии развития хронического воспаления в костной ткани.

Клинические особенности ЖДОПКМЧ: определение и диагностические критерии
ЖДОПКМЧ представляет собой поражение, сходное с поражением длинных костей, определяемое как «отек костного мозга» и «хронический негнойный остеомиелит». Размягчение костного мозга при ЖДОПКМЧ является крайне выраженным, поскольку при удалении кортикальной пластинки содержание костного мозга можно просто изъять аспиратором или выскоблить кюреткой посредством нескольких движений. Имеющиеся пустотелые пространства именуются кавитациями, которые выполнены адипоцитами, подвергшимися жировой дегенерации, а также демиелинизированными костными оболочками нижнего альвеолярного нерва. На фото 1 изображен образец костной ткани с признаками выраженной жировой трансформации. Распространенность ЖДОПКМЧ можно проанализировать на имеющейся рентгенограмме по имеющейся разнице в показателях контраста между здоровой и патологической тканью.
Фото 1. Область контрастирования (заполненная контрастным агентом) соответствует области поражения после выполнения процедуры кюретажа (а); образец костной ткани с признаками жировой дегенерации костного мозга (b).

Растворение титановых частиц в костной ткани челюстей
После сообщений в литературе, касающихся растворения титановых частиц в костной ткани челюстей, мы провели анализ 5 образцов костной ткани из 14 полученных от пациентов с ЖДОПКМЧ на предмет фактического уровня концентрации титана. Количество растворенного Ti в данных образцах варьировало от 3200 до 50 600 мкг/кг со средним значением на уровне 24 200 мкг/кг (± 20 029 СО; фото 3). Поскольку сведения о среднем максимальном содержании растворенного Ti, которое могло бы считаться биосовместимым и приемлемым, в литературе отсутствуют, мы определили таковое на уровне 1000 мкг/кг массы тела, что в четыре раза выше, чем приемлемый уровень всех других тяжелых металлов в организме человека согласно имеющимся научным данным (<250 мкг/кг). Частицы Ti могут растворяться и вызывать развитие иммунологических реакций в организме человека, провоцируя при этом релизинг системных сигнальных клеток. Исследование, представленное Nakashima и коллегами, позволило установить механизм активации макрофагов частицами Ti из поверхности имплантатов, а также определить структуру цепочки цитокиновой связи, которая также активируется за счет высвобождения частиц металла из поверхности внутрикостных опор. В проведенном исследовании макрофаги пациентов подвергались воздействию частиц сплавов Ti, взятых из соединительной ткани, окружающей имплантаты бедра. Воздействие макрофагов на частицы сплава Ti в лабораторных условиях в течение 48 часов привело к 40-кратному увеличению высвобождения фактора некроза опухоли альфа (TNF-альфа) и семикратному увеличению уровня релизинга интерлейкина-6 (IL-6).
Анализ экспрессии цитокинов в образцах ЖДОПКМЧ
Чтобы различить паттерны цитокиновых связей, которые идентифицируются в костной ткани челюстей, 14 пациентам с признаками ЖДОПКМЧ было проведено оперативное вмешательство, предусматривающее удаление установленных имплантатов с окружающим объемом кости. У всех пациентов были обнаружены участки развития ЖДОПКМЧ в костной ткани, окружающей имплантат, которые по своему строению были аналогичны ранее описанным в литературе. В изъятых объемах костной ткани проводили исследование цитокиновых профилей. На КЛКТ-срезе, изображенном на фото 2, выраженность патологических изменений является минимальной, в отличие от того, что удалось верифицировать на гистологических препаратах. В ходе макроскопического анализа вокруг имплантатов была верифицирована желтая размягченная губчатая костная ткань, которая прикреплялась к их титановой поверхности. Непосредственное изучение цитокиновых профилей в структуре данных образцов кости проводилось в Институте медицинской диагностики IMD. Аналогично результатам, представленным в предыдущих публикациях, было установлено, что определяющей характеристикой ЖДОПКМЧ является сверхэкспрессия провоспалительных сигнальных клеток типа RANTES (regulated upon activation, normal T-cell expressed and secreted – регулируются при активации нормальной экспрессии и секреции Т-клеток), также известных как хемокин C-ассоциированный лиганд 5 (CCL5). Средние значения уровней семи цитокинов в образцах костной ткани здоровых пациентов и пациентов с ЖДОПКМЧ изображены на фото 4. На фото 5 изображен один из образцов костной ткани, изъятый из периимплантатной области с признаками поражения ЖДОПКМЧ на предмет изучения цитокинового паттерна. ЖДОПКМЧ аналогичен процессу «молчащего» или субклинического воспаления без типичных признаков, характерных для острого воспаления. При хроническом воспалении отмечается локальная продукция воспалительных цитокинов по типу TNF-α и IL-1/6, превалирование регуляторных и компенсирующих механизмов взаимодействия, которые способствуют развитию ЖДОПКМЧ в костном мозге. Этот феномен наличия внутрикостного источника избыточной экспрессии RANTES/CCL5 (R/C), очевидно, является довольно распространенным, несмотря на игнорирование данного предположения большинством врачей-стоматологов. Хирургическое вмешательство в области ЖДОПКМЧ может остановить индукцию сигнальных путей типа R/C и, таким образом, способствовать ингибированию развития ЖДОПКМЧ-ассоциированных признаков поражения.
Фото 2. Титановый имплантат в области 46 зуба: визуализация на КЛКТ-скане (а); жировая ткань, прикрепленная к поверхности имплантата (b).

Фото 3. Распределение уровня концентрации частиц титана в костной ткани челюсти в 5 случаях регистрации жирового дегенеративного остеонекроза.

Почему ЖДОПКМЧ - загадка в стоматологии?
В предыдущих исследованиях мы продемонстрировали факт отсутствия явных рентгенологических признаков ЖДОПКМЧ, что значительно осложняет процесс точной диагностики данного поражения по данным обычных рентгенограмм. Именно поэтому большинство случаев ЖДОПКМЧ попросту игнорируется врачами-стоматологами. Несмотря на то, что классические рентгенологические подходы идентификации ЖДОПКМЧ являются весьма ограниченными, для диагностики данного поражения можно использовать ряд других диагностических методик. Одной из таких является компьютеризированная трансальвеолярная ультразвуковая методика (ТУМ), которая позволяет верифицировать факт размягчения костной ткани. ТАУ является куда более диагностически чувствительным подходом по сравнению с рентгенографией для подтверждения имеющихся микроскопических патологических изменений. Несмотря на это, патология ЖДОПКМЧ все равно остается недодиагностированной. При этом, даже несмотря на отсутствие рентгенологических признаков поражения ЖДОПКМЧ, врач должен понимать, что провоспалительные механизмы в это время уже набирают оборотов в структуре костной ткани, как это изображено на фото 4. Именно развитие данного феномена является ключевым для дальнейшей персистенции хронического воспаления.
Фото 4. Сравнение уровней семи цитокинов: случаи ЖДОПКМЧ – красные колонки, случаи имплантатов без признаков поражения – синие колонки.

Фото 5. Отсутствие признаков поражения имплантата на рентгенограмме (а); случай жировой дегенерации кости в области того же имплантата (b).

Исследование высокого растворения титана в костной ткани челюстей
В данном тематическом исследовании подчеркивается проблема ложной гипотезы о том, что рентгенограммы могут помочь идентифицировать факт релизинга титановых частиц из поверхности имплантата в периимплантатную область. На рентгенограмме области имплантата, установленного на месте 15 зуба, не было выявлено наличия каких-либо патологических изменений, при этом рентгенологически опора выглядела механически успешной. Но уже на фото 6, полученном после эксплантации, можно увидеть металлический преципитат черного цвета вдоль костных канавок, сформированных резьбой имплантата. В ходе спектрального анализа данного преципитата на предмет тяжелых металлов (фото 6-7), количество обнаруженного титана было увеличено в 50 раз по сравнению с установленным биоприемлемым уровнем в <1000 мкг/кг массы тела.
Фото 6. Рентгенограмма имплантата в области 15 зуба до его удаления (а); вид альвеолярной кости после удаления имплантата: визуализация участков преципитации титана (b).

Фото 7. Содержание титана в костной ткани в области 15 зуба, определенное при помощи спектрального анализа.

Сенсибилизация иммунной системы титановыми имплантатами
TNF-альфа является провоспалительным цитокином, который высвобождается на начальной стадии почти любой иммунной реакции. Также данный цитокин играет ключевую роль в процессе потери титановых имплантатов из-за генетической неприемлемости титана. Кроме фактического высвобождения частиц титана из поверхности внутрикостной конструкции, сенсибилизация иммунной системы также развивается за счет повышенной провоспалительной активности неспецифических иммунных клеток (тканевых макрофагов и моноцитов). Данный паттерн активности у некоторых пациентов развивается сразу же после контакта костной ткани с частицами металла, в нашем случае – с титановыми. Релизинг таковых диаметром 1-10 мкм в периимплантатную область происходит за счет механической абразии, химической, бактериальной и гальванической коррозии, что в конце концов приводит к формированию гипервоспалительного состояния. Sterner и коллеги изучали эффект влияния частиц алюминия, керамики, циркония и титана разного размера и их концентрации на релизинг фактора TNF и его взаимодействие с клетками макрофагов. Было установлено, что по сравнению с частицами алюминия частицы титана того же размера и в такой же концентрации стимулируют куда большую секрецию TNF. При этом частицы циркония вовсе не влияли на паттерн секреции TNF. Ранее мы уже описывали эффект растворения титановых частиц в костной ткани челюстей: при контакте с таковыми тканевые макрофаги высвобождают провоспалительные цитокины, которые являются составляющими местной воспалительной реакции. Объем релизинга провоспалительных цитокинов определяется полиморфизмом генов, ассоциированных с данными клетками, и поэтому может варьировать у разных индивидов.
Jacobi-Gresser и соавторы обнаружили, что у пациентов с потерей имплантатов или периимплантитом отмечалась значительно более выраженная генетическая предрасположенность к воспалению, а также более высокие уровни положительного результата иммунологического теста с избыточной активацией TNF-α и IL-1. Таким образом, два цитокина TNF-α и IL-1 являются ключевыми медиаторами местного и системного воспалительного ответа. Степень релизинга и активации данных цитокинов после контакта с частицами титана варьирует у разных индивидов в зависимости от выраженности полиморфизма генов, ассоциированных с данными клетками, и противовоспалительного действия антагонистов рецепторов IL-1.
Вторичная экспрессия RANTES / CCL5, управляемая TNF-α при развитии ЖДОПКМЧ
Учитывая все вышеизложенные факты, возникает вопрос о том, существует ли индуцированное или синергическое взаимодействие между воспалительными медиаторами TNF-α, секретируемыми вокруг титановых имплантатов, и высокими уровнями экспрессии механизма R/C. Секреция воспалительных цитокинов опосредует развитие системных эффектов воспаления жировой ткани. Экспрессия механизма R/C резко повышается в областях уже имеющегося воспаления. Результаты проведенных исследований указывают на то, что титановые частицы способны провоцировать повышение релизинга провоспалительных и остеолитических медиаторов в культуре костного мозга человека. Данные медиаторы в конце концов являются ответственными за асептическое поражение имплантатов. Кроме собственно действия TNF-α, развивается и R/C -ассоциированный каскад реакций: снижается объем кровоснабжения, плотность капиллярной сетки, после чего в пространстве костного мозга отмечаются ишемические и гипоксические изменения. Адипоциты и некротические частицы жировых клеток считаются иммунологические активными. Таким образом, на ранней острой фазе воспаления превалируют провоспалительные цитокины TNF-α и IL-6, в то время как на поздней стадии поражения – хемокины по типу R/C. По сути, происходит трансформация острого воспалительного поражения в хроническое. Кроме поражения тканей или инфицирования, ишемия еще и сама по себе индуцирует экспрессию хемокинов и повышение уровня воспалительных цитокинов. В большинстве полученных адипоцитов отмечалась спонтанная и продолжительная экспрессия R/C, при этом до 36% повышения уровня R/C было непосредственно спровоцировано ишемией и гипоксией. Адипоциты в таком случае следует рассматривать как источник экспрессии R/C. Полный механизм взаимодействия между TNF-α и R/C остается не до конца изученным (фото 8).
Фото 8. Побочные эффекты имплантации предполагают возможное развитие потери костной ткани и интраоссальной опоры, или же развитие жирового дегенеративного остеонекроза.

Почему избыточная экспрессия RANTES/CCL5, возможно, связана с системными заболеваниями?
Провоспалительные сигнальные медиаторы по типу R/C могут иметь системное влияние на организм человека, провоцируя не только развитие хронического воспаления, но и дальнейшие патофизиологические изменения. Общепринятым является факт дисбаланса между цитокинами и их специфическими ингибиторами в случаях развития хронического воспаления. ЖДОПКМЧ, по сути, является одним из феноменов воспалительного клеточного ответа, при котором цитокины не активируются посредством вирусов или бактерий. Данная гипотеза поддерживается тем фактом, что уровни типичных провоспалительных цитокинов по типу TNF-α и IL-6 заметно не повышаются при ЖДОПКМЧ, или вообще отсутствуют в образцах, полученных из области развития ЖДОПКМЧ. С другой стороны, повышается уровень R/C, что более характерно для хронического воспаления. Отсутствие острого воспаления при ЖДОПКМЧ только свидетельствует о субклинической и скрытой пролиферации хронического воспалительного процесса, контролируемого R/C. Высокие уровни R/C воспалительного цитокина были также обнаружены в среде стареющих стволовых клеток. В случае рака молочной железы имеются свидетельства о синергетической остеоиммунологической реакции на титановые имплантаты, поскольку TNF является активатором R/C промоции в мезенхимальных стволовых клетках в опухолевой среде рака молочной железы. Стимуляция мезенхимальных стволовых клеток посредством TNF провоцирует развитие зависящего от дозы повышения экспрессии R/C в структуре опухоли. Исследование R/C при ревматоидном артрите установило наличие аналогичного механизма взаимодействия: хотя в не стимулированных синовиальных фибробластах экспрессия мРНК не была связана с R/C, но при этом нарушение функции хондроцитов и деградация хрящевой ткани демонстрировала R/C-ассоциированной паттерн. IL-1 и TNF также индуцируют выработку R/C, сверхэкспрессия которого отмечалась в суставах, пораженных артритом. Цепочка стимуляции от действия TNF и IL-1 до повышения уровня R/C также может являться значимой патогенетической составляющей при прогрессировании сердечно-сосудистых заболеваний.
Имплантация и возможные цитокиновые каскады
Perala установил факт индукции TNF после совместной инкубации материала нативной ткани с установленным имплантатом в лабораторных условиях. Такое открытие может свидетельствовать о высвобождении иммуногенных частиц из поверхности внутрикостной опоры в окружающую ткань. Что же касается экспрессии цитокинов в контексте имплантата и связанных с ним фаз заживления костной ткани, то проведенный анализ позволил выделить несколько новых фаз активации сигнальных путей на разных этапах интеграции, который индуцируются цитокинами:
- Фаза клинически успешного бессимптомного титанового имплантата с окружающей его областью субклинического ЖДОПКМЧ, рентгенологическая идентификация которого осложнена из-за отсутствия альтернативных методов измерения плотности костной ткани.
- Фаза острой травмы после установки имплантата, которая ассоциирована с релизингом цитокинов и развитием воспалительных каскадов через TNF, IL-6 и IL-1.
- Провокация экспрессии TNF титановыми частицами на более поздних стадиях.
- Повышение секреции R/C за счет длительного действия TNF.
Развитие подобного поражения ассоциировано со следующими клиническими проблемами:
- Нарушение стабильности титанового имплантата в условиях отсутствия признаков воспаления;
- Клиническая и рентгенологическая незаметность прогрессирования поражения;
- Как правило, появившиеся симптомы системного поражения, не ассоциируют с действием титановых имплантатов, поскольку таковые развиваются через довольно длительное время после установки внутрикостных опор.
Сценарий остеоиммунологического механизма развития поражения после проведения имплантации изображен на фото 8. Немедленная замена титанового имплантата посредством керамического может позволить избежать хронических патологических нарушений, характерных для ЖДОПКМЧ (фото 9).
Фото 9. Замена титановых имплантатов на керамические: сравнение ортопантомограмм до и после.

Заключение
Полученные данные свидетельствуют о наличии иммунологической связи между фактом установки титановых имплантатов и развитием ЖДОПКМЧ. Только клиническая оценка имплантатов является недостаточной для диагностики патологии подобного типа. Данные рентгенографии также достаточно ограничены с точки зрения верификации уровня экспрессии цитокинов и интерлейкинов, спровоцированного титановыми частицами. Поэтому потребность в установке титановых внутрикостных опор следует рассматривать с системной перспективы. Системные и локальные критерии здоровья пациента являются некими ориентирами для прогнозирования возможного развития ЖДОПКМЧ. При этом нужно понимать, что стабильное состояние имплантата не равняется отсутствию ЖДОПКМЧ. Приведенное выше исследование является первым в своем роде, которое описывает наличие потенциальной связи между фактом установки титанового имплантата и ЖДОПКМЧ, как векторного причинно-следственного взаимодействия. Изъятие установленной титановой опоры может позволить нивелировать R/C-ассоциированные сигнальные пути, таким образом, минимизируя риск развития хронического воспаления.
Автор:
Drs Johann Lechner (Германия)
Sammy Noumbissi (США)

































































































































































10 комментариев
как модераторы пропускают такие статьи? Бред полнейший. Реклама циркониевых говноимплантов? Они не интегрируются если что
Armen_doc, говно имеет право на всплеск!?
Либо ломаются. Потерь таких имплантатов более чем за 10 лет наблюдения >70 процентов
Armen_doc, что за система у Вас в руке?
Титановые имплантаты дентальные все покрыты плёнкой оксида титана, в некоторых поверхностях могут быть дополнительные ионы в этом соединение - например кальция или циркония, но основа - ТiO2, что делает поверхность титановых имплантатов инертной для реакций организма по типу токсико-аллергических реакций. И именно эта плёнка, а она есть всегда - препятствует выделению свободных ионов титана и других металлов в костную среду и соответственно организм. окисная плёнка по сути создаёт поверхность из керамики на поверхности титанового имплантата. Статься бредовая! )))
Статья полностью соответствует действительности. Доктора надо подтянуть биохимию и физиологию. Титан покрыт оксидной пленкой только в кислородной среде, а в организме человека в тканях больше ионов хлора. Я думаю надо предельно внимательно подбирать керамические системы и конечно же не стоит одинаково относиться к процедуре установки титана и керамики. Учение свет, нужно изучать материал прежде чем кого-то критиковать.
Vitadent421, у меня похоже произошло то, что описано в статье. Что делать? Где и как это лечить? Импл удалили, но без окружающей кости. К тому же выпиливали их и бором попадали по резьбе. Метал пыль там где то в кости осела. Симптомы интоксикации алюминием и титаном.
Прошу обратить внимание на состояние костной ткани на прицельных снимках. Ни каких костно-пластических материалов не применялось. Просто керамический имплантат.
Vitadent421, это циркониевый имплантат разрушился