Ткани полости рта постоянно подвергаются различным видам повреждений — механическим (при приёме пищи), микробиологическим (при проникновении патогенных бактерий, грибов, вирусов). В здоровых тканях полости рта существует баланс между симбиотическими бактериями и клетками врождённого иммунитета, в первую очередь нейтрофилами. Когда этот баланс нарушается, развивается воспалительный процесс.
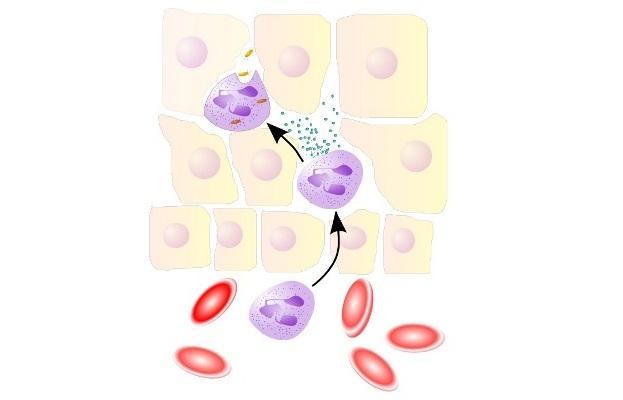
В ходе развития данного патологического процесса, циркулирующие нейтрофилы быстро мобилизуются в очаг инфекции или воспаления путём трансмиграции.
Этот процесс начинается с экспрессии рецепторов адгезии (E- и P-селектины) эндотелиальными клетками. Затем нейтрофилы должны проактивироваться хемокинами, что позволяет усилить их сродство к интегринам и обеспечить прочную адгезию полиморфноядерных лейкоцитов с эндотелиоцитами, служащую необходимым условием для трансмиграции. Этот процесс в основном регулируется гетеродимерными рецепторами, образованными или субъединицей α (CD11), или общей субъединицей β (CD18). Данные рецепторы взаимодействуют с лигандами адгезии, такими как молекула межклеточной адгезии-1 и -2 на эндотелиальных клетках.
Нейтрофилы оснащены различными антимикробными механизмами, которые помогают им бороться с широким спектром микроорганизмов. Эти реакции включают фагоцитоз, активацию окислительного стресса, дегрануляцию и формирование нейтрофильных внеклеточных ловушек.
Показано, что количество полиморфноядерных лейкоцитов возрастает в ротовой жидкости при развитии заболевания. Однако их роль в патогенезе хронического пародонтита до конца не ясна, что и определяет актуальность данной проблемы.
Показателем активности клеток служит количество микровезикул, необходимых для обеспечения информационных потоков в тканях. Общее число микровезикул у больных с хроническим пародонтитом возрастало более чем в 11 раз (табл. 2; 0,000001), причём в большей степени за счёт микровезикул лейкоцитарного происхождения. Так, у здоровых микровезикулы, образованные всеми лейкоцитами, составляли 29,5%, при воспалении пародонта — 41,15%, при этом более трети из них были образованы нейтрофилами. Около 56% нейтрофильных микровезикул имели маркёр CD11b, что свидетельствовало о формировании прочной адгезии нейтрофилов к эндотелию сосудов и их активной миграции в повреждённые ткани.
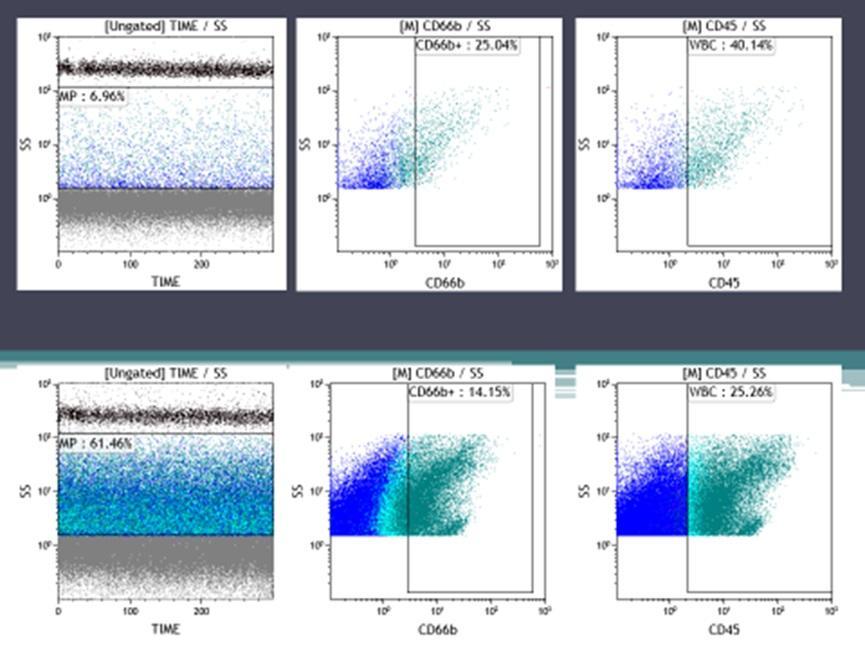
При изучении уровня факторов агрессии нейтрофилов выявлен их рост у больных пародонтитом. Минимальное увеличение показателя было зафиксировано у миелопероксидазы — её концентрация в ротовой жидкости у больных пародонтитом возрастала в 2,1 раза, а максимальное — у металлопротеиназы-2: её уровень повышался в 24,8 раза (0,0001)
Таблица. Факторы агрессии нейтрофилов в ротовой жидкости больных хроническим пародонтитом
|
Показатели |
Группа контроля, n=20 |
Больные пародонтитом, n=30 |
р |
|
Кальпротектин MRPg8/14, пг/мл |
15,89 (8,90; 19,05) |
62,37 (47,98; 104,56) |
0,00002 |
|
Липокаин 2 NGAL, пг/мл |
1,90 (1,40; 2,40) |
7,90 (7,30; 8,40) |
0,0001 |
|
Матриксная металлопротеиназа-2, пг/мл |
0,17 (0,10; 0,22) |
4,21 (3,41; 4,72) |
0,0001 |
|
Матриксная металлопротеиназа-9, пг/мл |
11,02 (5,03; 14,99) |
58,05 (54,87; 61,24) |
0,00004 |
|
Миелопероксидаза, нг/мг белка |
28,45 (17,86; 33,61) |
58,21 (57,04; 60,98) |
0,0001 |
Объективные показатели состояния полости рта исследуемой группы имели также сильную положительную связь с факторами агрессии полиморфноядерных лейкоцитов. Так, например, содержание металлопротеиназы-2 соотносилось с глубиной пародонтального кармана (r=0,754), индексом кровоточивости (r=0,811), PMA (r=0,675); показатель миелопероксидазы — с теми же параметрами (r=0,721, r=0,689 и r=0,799 соответственно), как и концентрация кальпротектина (r=0,654, r=0,743 и r=0,901 соответственно).
Основным причинным фактором пародонтита считают колонизацию биоплёнки ротовой полости условно-патогенными бактериями. Предполагают, что P. gingivalis — основной возбудитель пародонтита. Показано, что для развития пародонтита одних оральных бактерий недостаточно. Клиническая картина пародонтита — результат преувеличенной воспалительной реакции организма в ответ на бактериальную нагрузку, которая и приводит к повреждению пародонта.
Нейтрофилы бывают наиболее распространёнными лейкоцитами в пародонтальных карманах, десневой щели и воспалённых тканях пародонта. В здоровых тканях пародонта нейтрофилы в основном находятся в соединительном эпителии и десневой жидкости, они необходимы для поддержания симбиоза между бактериальным сообществом и макроорганизмом.
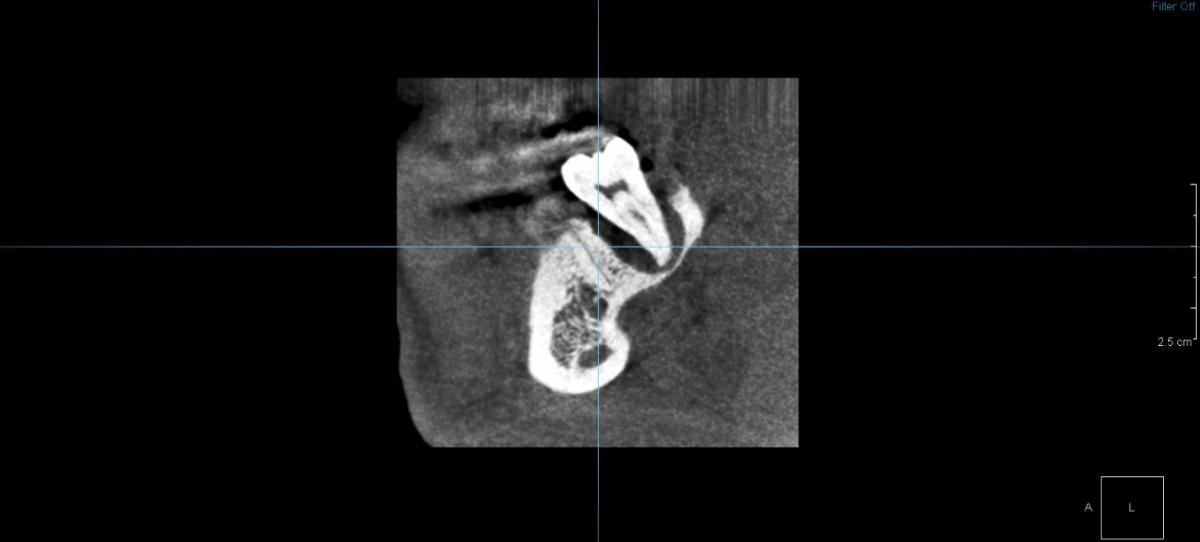
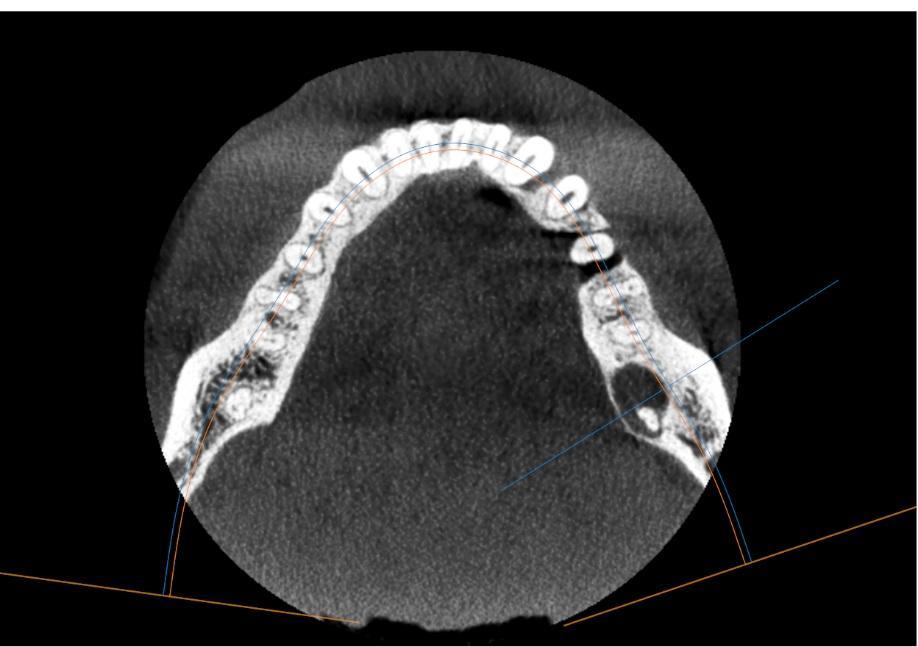
Инициация и прогрессирование пародонтита зависят от дисбиотических изменений в микробиоме в ответ на появление питательных веществ из продуктов воспаления дёсен и распада тканей, а также антибактериальных механизмов, с помощью которых организм пытается снизить микробную нагрузку в области десневой борозды после начала воспаления. Реакцией организма на повреждение станговится активация врождённого звена иммунной системы, где одним из основных защитников служит нейтрофил.
В ходе развития воспалительного процесса происходит увеличение количества нейтрофилов и интенсивности их миграции в десневую щель. Высвобождение ими протеолитических и коллагенолитических ферментов, а также активных форм кислорода в тканях пародонта приводит к потере волокон маргинальной периодонтальной связки, апикальной миграции соединительного эпителия, что способствует апикальному распространению бактериальной биоплёнки вдоль поверхности корня и ещё большему воспалению.
Полиморфноядерные лейкоциты посредством образования микровезикул, несущих, с одной стороны, факторы агрессии, направленные на элиминацию патогена, а с другой — хемокины, индуцирующие рекрутирование клеток и врождённого и адаптивного звеньев иммунитета, вызывают увеличение вторичной альтерации и пролонгацию воспаления.
Интенсивная борьба нейтрофилов с патогенной микрофлорой приводит к появлению неоантигенов в очаге повреждения и запуску аутоиммунного компонента воспалительного процесса. Кроме этого, активированные нейтрофилы могут индуцировать остеокластическую резорбцию кости путём экспрессии ключевого остеокластогенного цитокина — связанного с мембраной рецепторного активатора лиганда ядерного фактора-κВ. В итоге формируется самоподдерживающийся воспалительный процесс, развивается хроническое воспаление, приводящее к разрушению тканей пародонта.
Нейтрофилы усиливают патогенез хронического пародонтита за счёт секреции факторов агрессии: металлопротеиназ, миелопероксидазы, кальпротектина, липокаина 2 и микровезикул.
Авторы:

Фефелов Александр Александрович
Веду прием: Краевая стоматологическая поликлиника (Чита)
Врач-стоматолог хирург, пародонтолог.
Ткани полости рта постоянно подвергаются различным видам повреждений — механическим (при приёме пищи), микробиологическим (при проникновении патогенных бактерий, грибов, вирусов). В здоровых тканях полости рта существует баланс между симбиотическими бактериями и клетками врождённого иммунитета, в первую очередь нейтрофилами. Когда этот баланс нарушается, развивается воспалительный процесс.

В ходе развития данного патологического процесса, циркулирующие нейтрофилы быстро мобилизуются в очаг инфекции или воспаления путём трансмиграции.
Этот процесс начинается с экспрессии рецепторов адгезии (E- и P-селектины) эндотелиальными клетками. Затем нейтрофилы должны проактивироваться хемокинами, что позволяет усилить их сродство к интегринам и обеспечить прочную адгезию полиморфноядерных лейкоцитов с эндотелиоцитами, служащую необходимым условием для трансмиграции. Этот процесс в основном регулируется гетеродимерными рецепторами, образованными или субъединицей α (CD11), или общей субъединицей β (CD18). Данные рецепторы взаимодействуют с лигандами адгезии, такими как молекула межклеточной адгезии-1 и -2 на эндотелиальных клетках.
Нейтрофилы оснащены различными антимикробными механизмами, которые помогают им бороться с широким спектром микроорганизмов. Эти реакции включают фагоцитоз, активацию окислительного стресса, дегрануляцию и формирование нейтрофильных внеклеточных ловушек.
Показано, что количество полиморфноядерных лейкоцитов возрастает в ротовой жидкости при развитии заболевания. Однако их роль в патогенезе хронического пародонтита до конца не ясна, что и определяет актуальность данной проблемы.
Показателем активности клеток служит количество микровезикул, необходимых для обеспечения информационных потоков в тканях. Общее число микровезикул у больных с хроническим пародонтитом возрастало более чем в 11 раз (табл. 2; 0,000001), причём в большей степени за счёт микровезикул лейкоцитарного происхождения. Так, у здоровых микровезикулы, образованные всеми лейкоцитами, составляли 29,5%, при воспалении пародонта — 41,15%, при этом более трети из них были образованы нейтрофилами. Около 56% нейтрофильных микровезикул имели маркёр CD11b, что свидетельствовало о формировании прочной адгезии нейтрофилов к эндотелию сосудов и их активной миграции в повреждённые ткани.

При изучении уровня факторов агрессии нейтрофилов выявлен их рост у больных пародонтитом. Минимальное увеличение показателя было зафиксировано у миелопероксидазы — её концентрация в ротовой жидкости у больных пародонтитом возрастала в 2,1 раза, а максимальное — у металлопротеиназы-2: её уровень повышался в 24,8 раза (0,0001)
Таблица. Факторы агрессии нейтрофилов в ротовой жидкости больных хроническим пародонтитом
|
Показатели |
Группа контроля, n=20 |
Больные пародонтитом, n=30 |
р |
|
Кальпротектин MRPg8/14, пг/мл |
15,89 (8,90; 19,05) |
62,37 (47,98; 104,56) |
0,00002 |
|
Липокаин 2 NGAL, пг/мл |
1,90 (1,40; 2,40) |
7,90 (7,30; 8,40) |
0,0001 |
|
Матриксная металлопротеиназа-2, пг/мл |
0,17 (0,10; 0,22) |
4,21 (3,41; 4,72) |
0,0001 |
|
Матриксная металлопротеиназа-9, пг/мл |
11,02 (5,03; 14,99) |
58,05 (54,87; 61,24) |
0,00004 |
|
Миелопероксидаза, нг/мг белка |
28,45 (17,86; 33,61) |
58,21 (57,04; 60,98) |
0,0001 |
Объективные показатели состояния полости рта исследуемой группы имели также сильную положительную связь с факторами агрессии полиморфноядерных лейкоцитов. Так, например, содержание металлопротеиназы-2 соотносилось с глубиной пародонтального кармана (r=0,754), индексом кровоточивости (r=0,811), PMA (r=0,675); показатель миелопероксидазы — с теми же параметрами (r=0,721, r=0,689 и r=0,799 соответственно), как и концентрация кальпротектина (r=0,654, r=0,743 и r=0,901 соответственно).

Основным причинным фактором пародонтита считают колонизацию биоплёнки ротовой полости условно-патогенными бактериями. Предполагают, что P. gingivalis — основной возбудитель пародонтита. Показано, что для развития пародонтита одних оральных бактерий недостаточно. Клиническая картина пародонтита — результат преувеличенной воспалительной реакции организма в ответ на бактериальную нагрузку, которая и приводит к повреждению пародонта.
Нейтрофилы бывают наиболее распространёнными лейкоцитами в пародонтальных карманах, десневой щели и воспалённых тканях пародонта. В здоровых тканях пародонта нейтрофилы в основном находятся в соединительном эпителии и десневой жидкости, они необходимы для поддержания симбиоза между бактериальным сообществом и макроорганизмом.



Инициация и прогрессирование пародонтита зависят от дисбиотических изменений в микробиоме в ответ на появление питательных веществ из продуктов воспаления дёсен и распада тканей, а также антибактериальных механизмов, с помощью которых организм пытается снизить микробную нагрузку в области десневой борозды после начала воспаления. Реакцией организма на повреждение станговится активация врождённого звена иммунной системы, где одним из основных защитников служит нейтрофил.
В ходе развития воспалительного процесса происходит увеличение количества нейтрофилов и интенсивности их миграции в десневую щель. Высвобождение ими протеолитических и коллагенолитических ферментов, а также активных форм кислорода в тканях пародонта приводит к потере волокон маргинальной периодонтальной связки, апикальной миграции соединительного эпителия, что способствует апикальному распространению бактериальной биоплёнки вдоль поверхности корня и ещё большему воспалению.
Полиморфноядерные лейкоциты посредством образования микровезикул, несущих, с одной стороны, факторы агрессии, направленные на элиминацию патогена, а с другой — хемокины, индуцирующие рекрутирование клеток и врождённого и адаптивного звеньев иммунитета, вызывают увеличение вторичной альтерации и пролонгацию воспаления.
Интенсивная борьба нейтрофилов с патогенной микрофлорой приводит к появлению неоантигенов в очаге повреждения и запуску аутоиммунного компонента воспалительного процесса. Кроме этого, активированные нейтрофилы могут индуцировать остеокластическую резорбцию кости путём экспрессии ключевого остеокластогенного цитокина — связанного с мембраной рецепторного активатора лиганда ядерного фактора-κВ. В итоге формируется самоподдерживающийся воспалительный процесс, развивается хроническое воспаление, приводящее к разрушению тканей пародонта.
Нейтрофилы усиливают патогенез хронического пародонтита за счёт секреции факторов агрессии: металлопротеиназ, миелопероксидазы, кальпротектина, липокаина 2 и микровезикул.
































































































































































0 комментариев