Цель данного исследования заключается в сравнении эффективности двух неорганических костных материалов (НКМ) бычьего происхождения, полученных по технологии низкотемпературного спекания: Bio-Oss (Geistlich, Вольхузен, Швейцария) и A-Oss (Osstem, Сеул, Корея), – при направленной костной регенерации (НКР) для устранения щелевидных дефектов в области имплантатов.
Введение
Сегодня все больше внимания уделяется изучению инновационных устройств и технологий, которые позволят свести к минимуму травму тканей, продолжительность хирургического вмешательства и тяжесть послеоперационных осложнений при имплантологическом лечениии [1]. Направленная костная регенерация (НКР) — это хирургическое вмешательство, нацеленное на увеличение объема костной ткани в области дентальных имплантатов с использованием различных костных материалов и барьерных мембран [2]. Неорганические костные материалы (НКМ) бычьего происхождения широко используются при синус-лифтинге, сохранении объема гребня, немедленной имплантации и НКР [3–7]. НКМ отличаются способностью сохранять объем регенерации и медленнее замещаются новой костной тканью, по сравнению с аутогенной и аллогенной костью.
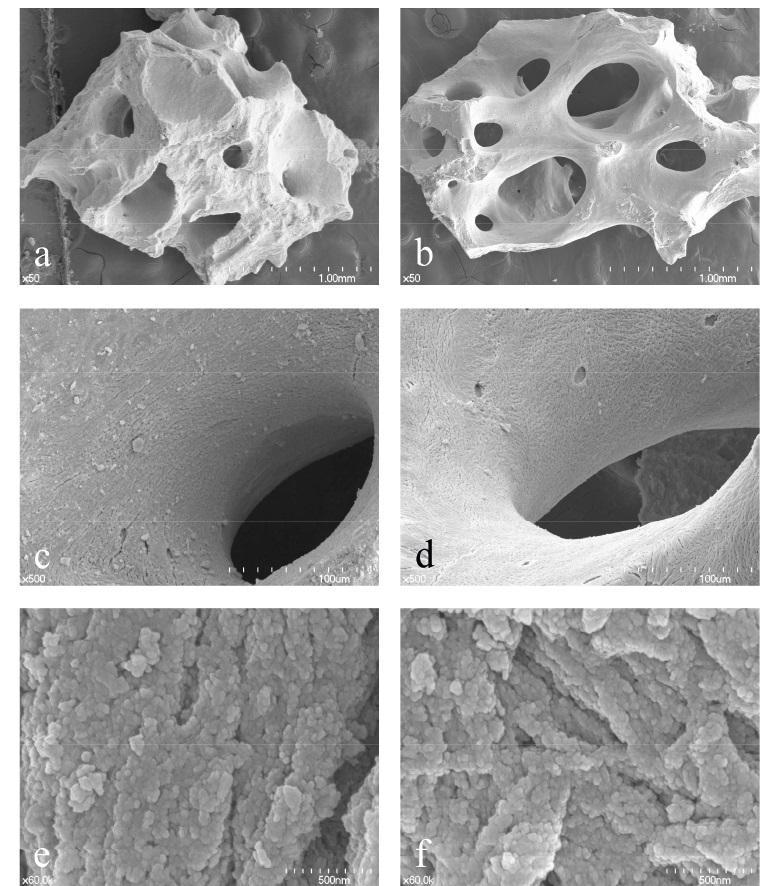
На стоматологическом рынке представлены разные типы НКМ, которые спекаются при высокой температуре [8] или изготовлены из свиного или лошадиного материала [9]. Однако, по некоторым данным, преобладают именно НКМ бычьего происхождения, полученные по технологии низкотемпературного спекания [10]. Долгое время золотым стандартом среди таких материалов считался именно Bio-Oss (Geistlich, Вольхузен, Швейцария), в первую очередь, благодаря убедительной научно-доказательной базе. Материал A-Oss (Osstem, Сеул, Корея) получают путем химической обработки ароматическим сильнощелочным растворителем с последующим обжигом при температуре ниже 400◦С с крайне низкой скоростью нагрева (<0,3◦С в минуту) [11]. Физико-химические характеристики A-Oss по сути сопоставимы с Bio-Oss с учетом более высокой пористости и более низкой степени кристалличности. В отличие от других ксеногенных костных материалов, у A-Oss ниже степень резорбции и ремоделирования (рис. 1) [11,12].
Рис. 1. Сравнительная сканирующая электронная микроскопия материалов Bio-Oss и A-Oss. Частицы Bio-Oss при увеличении ×50 (а), ×500 (с) и ×60 000 (е); частицы A-Oss при увеличении ×50 (b), ×500 (d) и ×60 000 (f)
В стоматологической и челюстно-лицевой хирургии титановые сетки применяются для устранения крупных костных дефектов; такие сетки отличаются биосовместимостью и высокой жесткостью [13–15]. Все большей популярностью пользуются предварительно сформированные ультратонкие титановые 3D-мембраны с фиксацией непосредственно к имплантату [16,17]. Они сохраняют стабильность на протяжении всего периода заживления, а наличие большого числа отверстий разного размера позволяет добиться оптимальных результатов НКР [18].
Цель данного рандомизированного контролируемого клинического исследования (РКИ) заключается в сравнении двух НКМ, спеченных при низкой температуре (Bio-Oss и A-Oss), в комбинации с ультратонкой титановой 3D-мембраной при устранении щелевидных костных дефектов в области одиночного имплантата. По имеющейся у авторов информации, это первое исследование, в котором измеряют и сравнивают изменения объема НКМ во всех трех плоскостях для количественной оценки результатов НКР. Нулевая гипотеза предполагала отсутствие между группами разницы в изменениях объема регенерации (количество), плотности костной ткани (качество), а также частоты послеоперационных осложнений.
Материалы и методы
Рандомизированное контролируемое исследование с параллельными группами проводилось в отделении стоматологической и челюстно-лицевой хирургии больницы университета Ханьян в период с июня 2018 г. по июль 2019 г. Исследование одобрено Институциональным наблюдательным советом больницы университета Ханьян (IRB №2018-03-006) и зарегистрировано на международной платформе регистрации клинических испытаний ВОЗ (KCT0004906). Исследование проведено в соответствии с Хельсинкской декларацией и международными принципами проведения РКИ, в том числе со стандартом CONSORT (версия от 2 марта 2018 г.). Все хирургические вмешательства и протезирование выполнены одним специалистом (Ч.Д.П.).
Выборка пациентов
В исследование включили здоровых пациентов в возрасте от 18 лет, которым по результатам клинического обследования и рентгенологического исследования, в том числе с помощью конусно-лучевой компьютерной томографии (КЛКТ), показана установка одиночного имплантата в заживший альвеолярный гребень одновременно с НКР для устранения щелевидного костного дефекта, возникшего при имплантации в ортопедически правильном положении (OneGuide, Osstem, Сеул, Корея). При этом костные дефекты ограничивались только щечной и/или проксимальной поверхностью без вовлечения соседних зубов и не распространялись на язычную поверхность. Критериями исключения были необходимость установить рядом более двух имплантатов и наличие системных или местных противопоказаний для имплантации, включая некомпенсированные метаболические нарушения в анамнезе, курение, бруксизм, нелеченный пародонтит. Пациентов проинформировали об особенностях хирургического вмешательства, используемых материалах, преимуществах, потенциальных рисках и возможных осложнениях. Все пациенты предоставили подписанное информированное согласие на участие в исследовании.
Хирургический этап
Все вмешательства выполняли в условиях местной анестезии и внутривенной седации среднего уровня. Сформировали и отслоили полнослойный лоскут, иссекли грануляционные ткани. Остеотомическое отверстие наметили в кортикальной кости с помощью направляющего сверла.
Ложе имплантата сформировали коническими сверлами в соответствующей последовательности (набор OneGuide или 122 Taper, Osstem), уделяя особое внимание правильному трехмерному позиционированию. Имплантат (TS III SOI, Osstem или T01 SA, Toplan, Сеул, Корея) установили на 1 мм апикальнее края альвеолярного гребня с язычной/небной стороны. Образование щелевидного дефекта сопровождалось обнажением резьбы на щечной и/или проксимальной поверхности имплантата.
Измерили расстояние от платформы имплантата до участка первого контакта имплантата с костью (высота дефекта; рис. 2a) и расстояние от мезиального до дистального костного края на уровне платформы имплантата (ширина дефекта; рис. 2b); таким образом определили размер дефекта. С учетом этих параметров подобрали наиболее подходящую титановую 3D-мембрану (OssBuilder, Osstem): в области щечных щелевидных дефектов – тип I, в области комбинированных щечно-проксимальных дефектов – тип II (рис. 3). При необходимости мембрану немного обрезали так, чтобы обеспечить большую стабильность костного материала. Многократно перфорировали кортикальную кость для создания доступа к костному мозгу и стимулирования остеогенных клеткок с целью ускорения регенерации костной ткани.
Рис. 2. Измерение высоты (а) и ширины дефекта (b) для определения его размера, а также оценка плотности регенерированной кости путем измерения глубины зондирования (с)
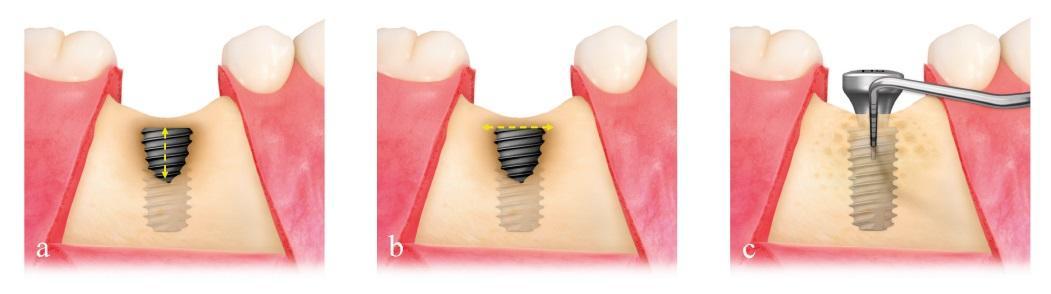
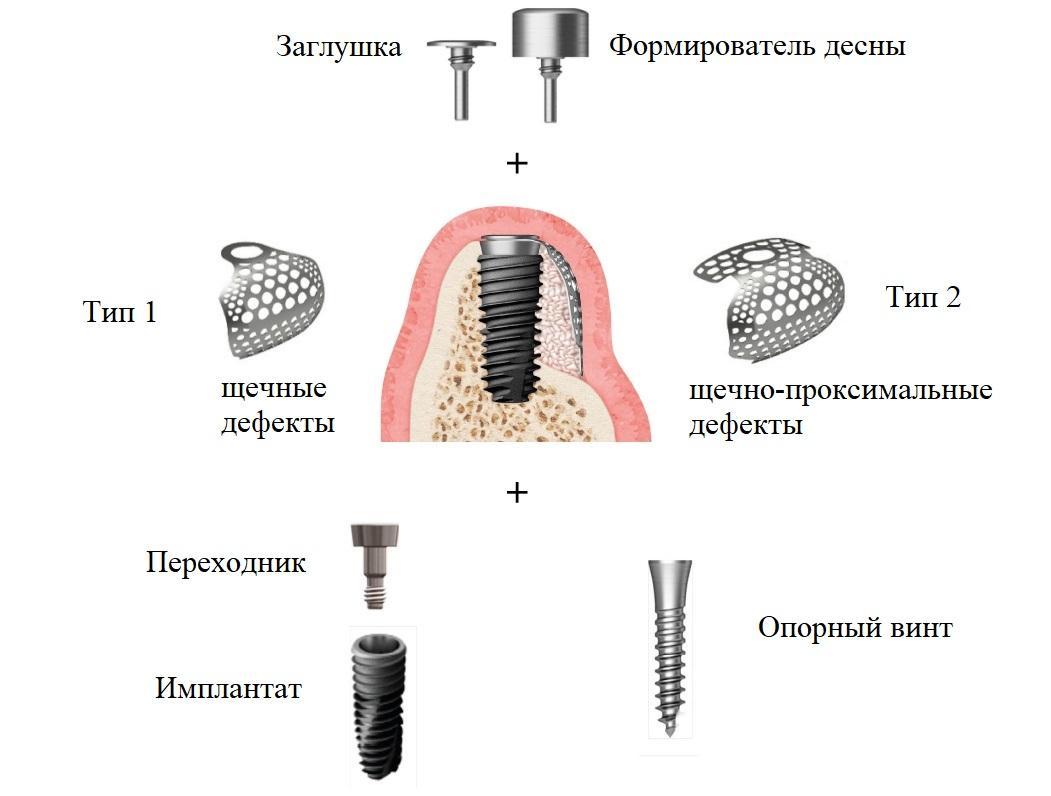
Рис. 3. Компоненты титановой 3D-мембраны, использованной в рамках этого исследования для устранения щелевидных костных дефектов в области имплантатов
Пациентов случайным образом распределили в одну из двух групп: Bio-Oss или A-Oss. Непосредственно на обнаженную поверхность имплантата нанесли лиофилизированную аллогенную кость (SureOss, HansBiomed, Сеул, Корея), которую затем покрыли соответствующим НКМ (Bio-Oss или A-Oss) в том же объеме для восстановления альвеолярного контура. Переходник – промежуточный компонент для установки титановой мембраны на имплантат – фиксировали вручную, а к нему прикрепили выбранную титановая мембрану (рис. 3). На имплантаты, установленные с крутящим моментом ≤30 Нсм или с коэффициентом стабильности ISQ≤70, фиксировали заглушку из комплекта, а мягкие ткани плотно ушивали. Во всех других случаях сразу устанавливали специальный формирователь десны. Кроме того, поверх титановой мембраны дополнительно накладывали резорбируемую коллагеновую мембрану (OssGuide, SK Bioland, Чхонан, Корея или OssMem hard, Osstem), чтобы свести к минимуму риск обнажения титановой сетки на ранних этапах заживления. Предварительное рассечение надкостницы в основании полнослойного лоскута позволяет ушить рану без натяжения. В послеоперационном периоде пациентам назначили анальгетики для купирования боли и антибиотики в течение 10 дней для профилактики инфицирования тканей. Также рекомендовали дважды в день полоскать рот раствором хлоргексидина. Швы сняли через 10 дней после операции.
Через 8 месяцев под местной анестезией сформировали лоскут аналогичного дизайна и раскрыли имплантаты. Удалили титановую мембрану и определили плотность кости щечно, примерно по центру области регенерации при помощи зондирования с усилием 0,25 Н (рис. 2c). Специальную заглушку или формирователь десны заменили на стандартный формирователь десны, вокруг которого ушили мягкие ткани. Швы сняли через 10 дней. Дожидались полного заживления мягких тканей и только после этого получили оттиск. Временную реставрацию фиксировали на индивидуальный титановый абатмент и прогрессивно нагружали; окончательное протезирование провели через 12 месяцев после имплантации. Все послеоперационные осложнения НКР регистрировались в соответствии с ранее предложенной классификацией осложнений НКР [19], лечение выполнял тот же специалист (Ч.Д.П.).
Оценка объема регенерации
Изменения объема регенерации оценивали по изображениям КЛКТ до операции (T0), сразу после имплантации и НКР (T1), после раскрытия имплантатов (T2) и на этапе окончательного протезирования (T3). Параметры КЛКТ задали с учетом принципов минимальной эффективной дозы излучения (ALARA): FOV 35×50 мм; размер вокселя 0,2 мм; время 10,8 с; кВ 75; мА 10; произведение дозы на площадь 240 мГр·см2. В программном обеспечении Aquarium iNtuition (TeraRecon, Дарем, Северная Каролина, США) реконструировали трехмерное изображение участка вмешательства и сегментировали его по прилежащим анатомическим образованиям (соседние зубы, дно верхнечелюстной пазухи, нижнечелюстной канал). Однородные по плотности и размеру структуры (например, имплантат и формирователь десны) вычли из снимка, после чего независимый эксперт без доступа к клинической информации (К.Г.Х.) рассчитал остаточный объем (см3) на разных этапах наблюдения (рис. 4). Это программное обеспечение широко используется в медицине, например, для точного определения степени кальцификации крупных сосудов [20] и измерения объема органа перед трансплантацией [21]; в данном исследовании его использовали совместно с КТ для измерения объема области регенерации.
Статистический анализ
Размер выборки определили так, чтобы статистическая мощность теста составила 90% при уровне α = 0,05 в соответствии с предположением о равенстве дисперсий, основанном на средних значениях внутригрупповых и междиндивидуальных различий из предыдущего РКИ, в котором Bio-Oss сравнивали с НКМ с покрытием из фосфата кальция при выполнении синус-лифтинга [22]. На основании этих результатов минимальный размер выборки оценили в 9 человек в каждой группе, учитывая возможный уровень отсева в 10% по ходу исследования.
Разницу в изменениях объема регенерации в группах Bio-Oss и A-Oss изучали с помощью смешанной модели с поправкой на ковариаты при измерениях в трех последовательных временных периодах, а также на исходном уровне (T0). Значимость ковариатных эффектов и прогнозируемых изменений объема проверяли при α = 0,05. Описательная статистика проводилась с указанием средних значений (СЗ)±стандартное отклонение (СО) для количественных переменных и с указанием процентов для качественных переменных.
Для статистического анализа использовалась программа SAS, версия 9.4 (SAS Inc., Кэри, Северная Каролина, США). Значение Р < 0,05 считали статистически значимым.
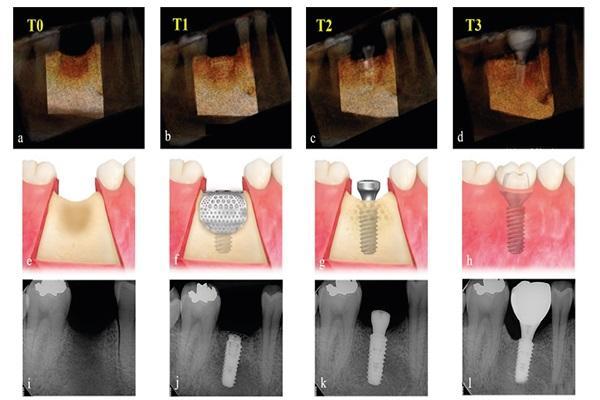
Рис. 4. Снимки КЛКТ, схематические изображения и прицельные рентгенограммы на разных этапах наблюдения. Объем регенерации рассчитали по 3D-реконструкции изображений КЛКТ с помощью ПО Aquarium iNtuition, версия 4.4.12 (TeraRecon, Дарем, Северная Каролина, США). T0 – до вмешательства (а, е, i), T1 – cразу после имплантации и НКР (b, f, j), T2 – после раскрытия имплантатов (с, g, k), T3 – на этапе окончательного протезирования (d, h, l)
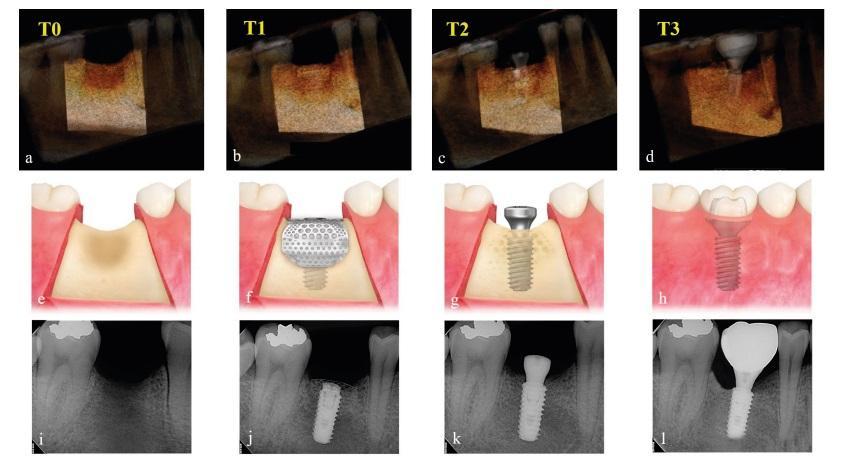
Результаты
Всего в исследование последовательно включили 18 пациентов, в процессе наблюдения два пациента (по одному в каждой группе) выбыли из исследования. В табл. 1 объединены данные 16 пациентов (7 мужчин и 9 женщин) в возрасте от 28 до 72 лет (в среднем 54,3±11,7 лет). Межгрупповое сравнение демографических параметров представлено в табл. 2. Статистически значимая разница между группами Bio-Oss и A-Oss наблюдалась только по переменной «длина имплантата» (Р < 0,01).
Таблица 1. Характеристики пациентов
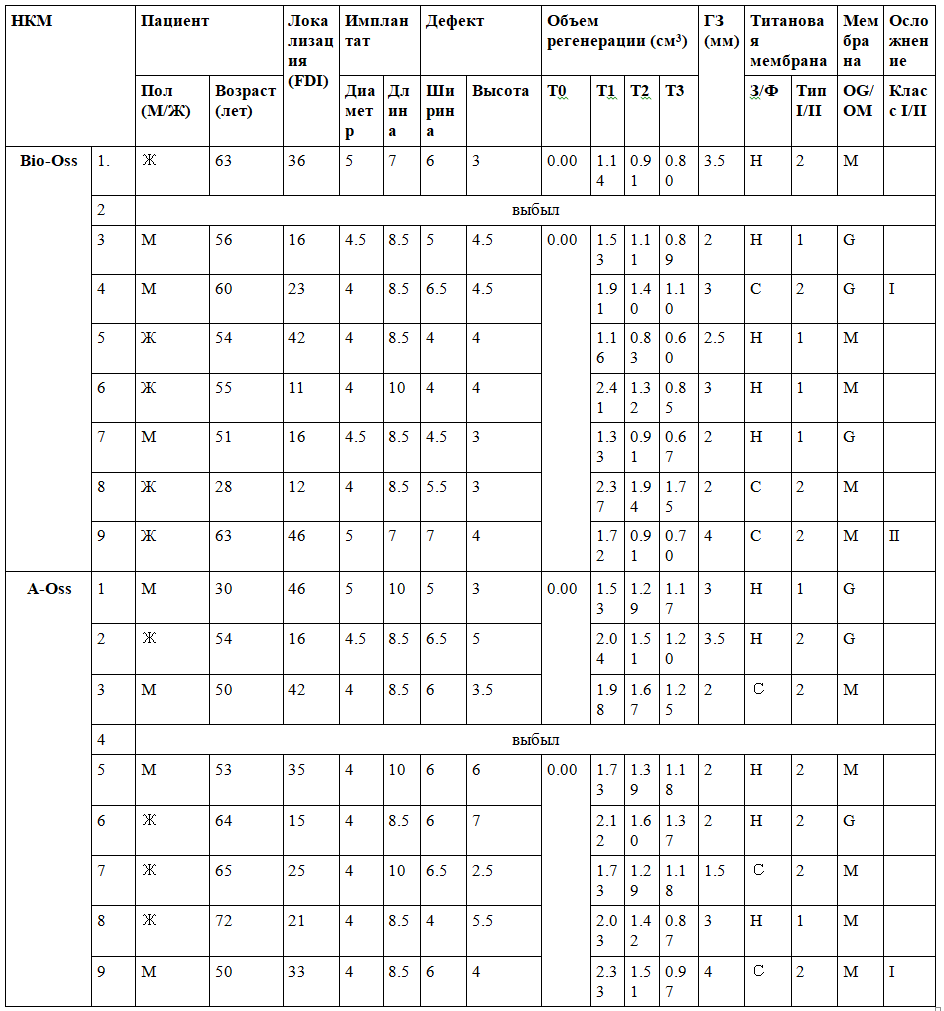
НКМ – неорганический костный материал бычьего происхождения, ГЗ – глубина зондирования, З – заглушка, Ф – формирователь десны, OG – OssGuide, OM – OssMem hard. Тип I – титановая 3D-мембрана для устранения щечного щелевидного дефекта; тип II – титановая 3D-мембрана для для устранения комбинированного щечно-проксимального щелевидного дефекта. Класс I – небольшое обнажение мембраны (≤3 мм) без экссудации; класс II – значительное обнажение мембраны (>3 мм) без экссудации. T0 – до вмешательства, T1 – сразу после имплантации и НКР, T2 – после раскрытия имплантатов, T3 – на этапе окончательного протезирования.
Таблица 2. Демографическое сравнение пациентов в группах Bio-Oss и A-Oss
|
Переменная |
Bio-Oss |
A-Oss |
Значение P |
|
|
Пол |
Мужчины |
3 (37.5) |
4 (50.0) |
0.6143 |
|
Женщины |
5 (62.5) |
4 (50.0) |
||
|
Возраст |
Лет |
53.8 ± 10.8 |
54.8 ± 12.2 |
0.9258 |
|
Локализация |
Верхняя челюсть |
5 (62.5) |
4 (50.0) |
0.6143 |
|
Нижняя челюсть |
3 (37.5) |
4 (50.0) |
||
|
Передний отдел |
4 (50.0) |
3 (37.5) |
0.6143 |
|
|
Дистальный отдел |
4 (50.0) |
5 (62.5) |
||
|
Дефект |
Ширина |
5.3 ± 1.1 |
5.8 ± 0.8 |
0.1542 |
|
Высота |
3.8 ± 0.6 |
4.6 ± 1.5 |
0.0892 |
|
|
Имплантат |
Диаметр (мм) |
4.4 ± 0.4 |
4.2 ± 0.4 |
0.0850 |
|
Длина (мм) |
8.3 ± 0.9 |
9.1 ± 0.7 |
0.0050* |
|
|
Глубина зондирования |
(мм) |
2.8 ± 0.7 |
2.6 ± 0.8 |
0.5001 |
|
Титановая мембрана |
Заглушка |
3 (37.5) |
4 (50.0) |
0.6143 |
|
Формирователь |
5 (62.5) |
4 (50.0) |
||
|
Тип I (щечный) |
4 (50.0) |
2 (25.0) |
0.2369 |
|
|
Тип II (щечно-проксимальный) |
4 (50.0) |
6 (75.0) |
||
|
Осложение |
(Да) |
2 (25.0) |
1 (12.5) |
0.4103 |
* Число случаев (%) суммировалось для качественных переменных и сравнивалось с помощью точного теста Фишера. СЗ±СО суммировались для количественных переменных и *Р<0,01 по тесту Вилкоксона.
В обеих группах максимальный объем регенерации наблюдался на этапе T1 и достигал 1,70±0,50 см3 в группе Bio-Oss и 1,94±0,26 см3 в группе A-Oss, после чего постепенно сокращался до этапа T3 включительно. На этапе T2 объем регенерации уменьшился до 1,17±0,38 см3 в группе Bio-Oss и 1,46±0,14 см3 в группе A-Oss, на этапе T3 – до 0,92± 0,37 см3 и 1,15±0,16 см3 соответственно. Разница в объеме регенерации на разных временных этапах была статистически значимой (Р<0,001; табл. 3). При этом существенной разницы между двумя группами на протяжении всего наблюдения не отмечалось (Р>0,05; рис. 5). Кроме того, на этапе T3 между группами не выявлено значимой разницы в плотности регенерировавшей кости (Р>0,05).
Таблица 3. Сравнение объема регенерации на разных этапах наблюдения
|
Прогноз |
Значение Т |
Значение Р |
|
|
Т2 – Т3 |
-0.2244 |
-5.02 |
0.0007* |
|
Т2 – Т1 |
-2.3194 |
-15.62 |
<0.0001* |
|
Т3 – Т1 |
-2.0950 |
-16.87 |
<0.0001* |
*Р<0,001 при сравнении СЗ, полученных методом наименьших квадратов в смешанной модели при α = 0,05. T1 – сразу после имплантации и НКР, T2 – после раскрытия имплантатов, T3 – на этапе окончательного протезирования.
Анализ по смешанной модели выявил, что значительное уменьшение объема регенерации происходило на этапах T2 и T3 (Р<0,001), у пациентов старшей возрастной группы (Р<0,01), а также при наличии осложнений (Р<0,05). Напротив, более широкий дефект (Р<0,01) и его локализация на верхней челюсти (Р<0,05) ассоциировались с менее выраженной потерей объема регенерации (табл. 4). Послеоперационные осложнения отмечались у трех пациентов: два (обнажение титановой мембраны классов I и II по линии ушивания) в группе Bio-Oss и один (обнажение титановой мембраны класса I в проекции ее мезиально-щечного края) в группе A-Oss. Во всех трех случаях мембрана была фиксирована заглушками; статистически значимая разница между двумя группами отсутствовала. Пациентам рекомендовали дважды в день тщательно и осторожно очищать область дефекта мягкой зубной щеткой, смоченной хлоргексидинсодержащим (1%) гелем. Титановые мембраны не требовалось удалять раньше времени, даже несмотря на отсутствие реэпителизации в области дефекта. Обнажение витков резьбы имплантата, а также выраженная утрата костного материала с экссудацией в ходе заживления не наблюдались. На этапе T2 дополнительное внесение костного материала не потребовалось.
Рис. 5. Сравнение объемов регенерации между группами Bio-Oss и A-Oss в разные временные промежутки после корректировки уровня α с помощью поправки Бонферрони. СЗ±СО (мм) с доверительным интервалом (ДИ) 95%. T0 – до вмешательства, T1 – сразу после имплантации и НКР, T2 – после раскрытия имплантатов, T3 – на этапе окончательного протезирования
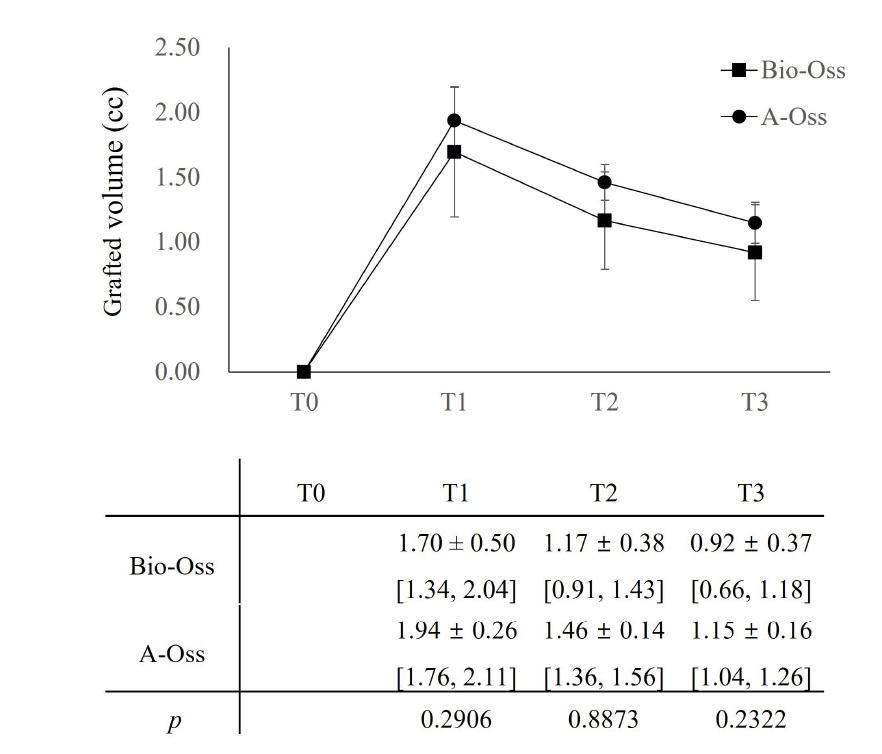
Таблица 4. Прогностические коэффициенты для изменения объема регенерации по смешанной модели
Эффекты |
| Прогноз | Значение Т | Значение Р |
Группа | -0.2112 | -1.12 | 0.2906 | |
Время | T2 | -2.4125 | -11.49 | <0.0001*** |
T3 | -2.2475 | -12.80 | <0.0001*** | |
Группа×Время † | (T2) | 0.1863 | 0.63 | 0.5460 |
(T3) | 0.3050 | 1.23 | 0.2505 | |
Возраст | -0.0045 | -4.17 | 0.0024** | |
Осложнения | (Да) | -0.1184 | -2.79 | 0.0210* |
Дефект | (Ширина) | 0.0796 | 4.58 | 0.0013** |
Локализация | (Дистальный) | -0.0624 | -2.17 | 0.0583 |
(Верхняя челюсть) | 0.0684 | 2.77 | 0.0218* |
* * *Р<0,001; **Р<0,01; *Р<0,05 по смешанной модели при α = 0,05.
† Анализ эффекта взаимодействия группы и времени с учетом предположения, что изменения объема регенерации в двух группах могут зависеть от временной точки наблюдения. T2 – объем на этапе раскрытия имплантатов, T3 – объем на этапе окончательного протезирования. Пол пациента (мужской), фиксация титановой мембраны (заглушка), тип титановой мембраны (щечная) и глубина зондирования не были статистически значимыми факторами, значения P составили 0,8457, 0,0638, 0,2369 и 0,4256 соответственно. Имплантат (диаметр), имплантат (длина) и дефект (высота) также не были статистически значимыми факторами, значения P составили 0,4215, 0,0604 и 0,0969 соответственно.
Обсуждение
Методика представленного РКИ разработана для оценки эффективности материала A-Oss при НКР по сравнению с другим НКМ, полученным по технологии низкотемпературного спекания (Bio-Oss). Нулевая гипотеза предполагала отсутствие различий между A-Oss и Bio-Oss. НКМ отличаются более длительным сохранением объема, однако в процессе замещения новообразованной костью объем Bio-Oss и A-Oss уменьшился на 46% (0,78±0,37 см3) и 40,8% (0,79±0,33 см3) соответственно. Эти значения превысили ожидаемые, что можно объяснить разницей рентгенологической картины: на этапе T1 костный материал был четко очерчен тонкой рентгеноконтрастной титановой сеткой, в то время как на этапах T2 и T3 эта рентгенологическая граница между костью и мягкими тканями размывалась, что и привело к недооценке объема регенерации после извлечения мембраны. По разным данным, на протяжении 6 месяцев после синус-лифтинга объем внесенного костного материала постепенно уменьшается на 17,3~23,9% [22,23]. Считается, что при НКР этот показатель может быть еще больше из-за давления со стороны надлежащих мягких тканей. В представленном исследовании в области НКР выполнялись только линейные измерения по изображениям КЛКТ с ограниченным полем обзора. Полученные результаты выглядят закономерными, учитывая, что в других работах с применением Bio-Oss уменьшение линейного размера в области платформы имплантата варьировалось от 20,2% до 42,8% [24,25]. Однако также следует признать, что при наличии в поле обзора КЛКТ металлических объектов (например, имплантата и титановой мембраны) существует риск ошибки измерения из-за артефактов изображения.
Выяснили, что объем регенерации зависит от развития послеоперационных осложнений и от локализации хирургического поля (Р < 0,05). Наличие послеоперационных дефектов или вмешательство в дистальном отделе (а не в переднем, Р = 0,0583) и на нижней челюсти (а не на верхней) с высокой долей вероятности приводит к более выраженной резорбции костного материала. Дистальные отделы нижней челюсти обычно представлены плотной костью с более толстым кортикальным слоем, и результат НКР здесь менее предсказуем, даже в сочетании с кортикальными перфорациями [26]. Существенными факторами также были возраст и ширина костного дефекта (Р<0,01). Это означает, что в более старшем возрасте и при более узких щелевидных дефектах, скорее всего, будет наблюдаться большая резорбция костного материала. У пожилых пациентов, как правило, ниже потенциал регенерации тканей и выше риск несостоятельности имплантатов [27]. В области крупных дефектов костные материалы используются в большем объеме, а титановая сетка дополнительно их стабилизирует. Ультратонкая титановая 3D-мембрана идеального контурирует костный гребень, особенно на уровне платформы имплантата [16–18]. Окончатый дефект в области имплантата в большей степени заполняется костной тканью и ассоциируется с меньшим числом осложнений, чем щелевидный дефект, если оба они расположены в пределах исходного костного контура [28]. Таким образом, нельзя утверждать, что высота дефекта значимым образом влияет на изменение объема регенерации.
В отличие от НКМ, аллогенные костные материалы стимулируют активное формирование костной ткани (т. е. обладают остеоиндуктивными свойствами), что подтверждается гистологическими исследованиями [29]. Сегодня для устранения дефектов и восстановления объема гребня в области имплантации обычно применяется послойное внесение материалов разного типа [30]. Как правило, первым слоем, на поверхность имплантата, наносят аутогенную стружку; также в качестве альтернативы или дополнительно в тех случаях, когда одной аутогенной кости недостаточно, используется аллогенная кость [29,31]. В настоящей работе на аллогенный материал нанесли НКМ для увеличения объема кости и компенсации резорбции, затем все перекрыли резорбируемой коллагеновой мембраной, которая изолирует пространство регенерации от мягкотканных и неостеогенных клеток [4,30]. Таким образом, коллагеновая мембрана выполняет барьерную функцию и предотвращает преждевременное истончение надлежащей десны, а титановая сетка обеспечивает стабильность кровяного сгустка и благоприятные условия для регенерации [15]. Титановая сетка не резорбируется и требует обязательного удаления; в ходе такого вмешательства можно оценить количество и качество новообразованной кости и эффективность НКР. В целом, объем кости определяется рентгенологически посредством 3D-реконструкции изображений КЛКТ [32], а для того, чтобы оценить ее качество, требуется гистологическое или гистоморфометрическое исследование биоптата в участке НКР [33]. В настоящей работе качество кости определяли по степени кортикализации в области регенерации и по глубине зондирования на этапе раскрытия имплантатов. Забрать фрагмент костной ткани в области имплантата технически сложно, а часто и невозможно. Осмотр сразу после удаления титановой мембраны выявил плотный альвеолярный гребень, покрытый мягкими тканями толщиной 1–2 мм [13]. Этот мягкотканный слой называется «псевдонадкостница», которая гистологически представляет собой грануляционную соединительную ткань; ее клиническое значение пока неясно [34]. Однако отмечается, что псевдонадкостница стабильна и удалять ее при раскрытии имплантатов не требуется [16]. Глубина зондирования в этом исследовании составила 2,8 ± 0,7 мм (Bio-Oss) и 2,6 ± 0,8 мм (A-Oss), включая в том числе и толщину незрелой костной ткани (в т.ч. псевдонадкостницы), которая со временем, по-видимому, преобразуется в кортикальную кость. Такой способ определения качества регенерировавшей кости является основным ограничением данной работы. Необходимы дальнейшие гистологические и гистоморфометрические исследования, которые позволят составить более полное представление об эффективности НКР.
Во всех трех случаях послеоперационные дефекты (небольшое [2 пациента] и значительное [1 пациент] обнажение титановой сетки) не реэпителизировались, однако миграции костного материала и экссудации не наблюдалось, заживление протекало без особенностей, поэтому ранее удаление титановой мембраны и дополнительное внесение костного материала не потребовались. Тем не менее глубина зондирования увеличилась до 3–4 мм из-за наличия более толстой псевдонадкостницы, которая была необходима для стабилизации костного материала в случаях прорезывания титановой мембраны. Ранее опубликованное исследование также продемонстрировало, что обнажение титановой сетки не ухудшает клинический результат и не снижает эффективность костной пластики [35]. В частности, все послеоперационные осложнения возникали в случаях, когда титановая мембрана была фиксирована заглушками, хотя это не были статистически значимыми. Заглушки фиксировали на имплантаты с низкой первичной стабильностью, а мягкие ткани над ними плотно ушивали, т. е. допустимо предположить, что более высокая частота послеоперационного расхождения краев раны вызвана большим натяжением мягких тканей в области погруженных, чем непогруженных имплантатов. Статистически значимая разница в частоте послеоперационных осложнениях между группами Bio-Oss и A-Oss отсутствовала.
Выводы
С учетом ограничений данного исследования можно сделать следующие выводы:
- Щелевидный костный дефект в области имплантата можно успешно устранить при помощи НКР с послойным внесением аллогенной кости и НКМ и с последующей фиксацией ультратонкой титановой 3D-мембраны и резорбируемой коллагеновой мембраны.
- Известно, что НКМ относительно медленно резорбируется, однако на этапе T2 объем регенерации уменьшился примерно на 27,8% ое было отмечено в резорбции. При этом существенной разницы между группами Bio-Oss и A-Oss не обнаружено, в том числе и по качеству регенерировашей кости.
- Уменьшение объема регенерации (в среднем на 43,2%) продолжалось до этапа T3, статистически значимая разница между группами Bio-Oss и A-Oss отсутствовала.
Авторы
- Джэ Хён Лим, Отделение челюстно-лицевой хирургии, больница Ансан Корейского университета, Ансан-си 15355, Корея; †
- Сан Хо Джун, Отделение челюстно-лицевой хирургии, больница Анам Корейского университета, Сеул 02841, Корея; †
- Марко Талларико, Кафедра медицины, хирургии и фармации, Университет Сассари, 07100 Сассари, Италия;
- Чун Бом Пак, Кафедра пародонтологии, Медицинский колледж, Католический университет Кореи, Сеул 06591, Корея;
- Дэ Хо Парк, Отделение челюстно-лицевой хирургии, кафедра стоматологии, медицинский колледж, университет Ханьянг, Сеул 04763, Корея;
- Кён Гюн Хван, Отделение челюстно-лицевой хирургии, кафедра стоматологии, медицинский колледж, университет Ханьянг, Сеул 04763, Корея;
- Чан Джу Пак, Отделение челюстно-лицевой хирургии, кафедра стоматологии, медицинский колледж, университет Ханьянг, Сеул 04763, Корея;
† Оба автора внесли равный вклад в написание статьи.
Вклад авторов. Д.Х.Л., С.Х.Д. и Ч.Д.П. придумали идею и руководили написанием статьи. Д.Х.Л., С.Х.Д. и Д.Х.П. собрали данные; Д.Х.Л., К.Г.Х. и Ч.Б.П. проанализировали полученные данные. MT и Ч.Д.П. рецензировали рукопись; MT, Ч.Б.П., К.Г.Х. и Ч.Д.П. отредактировали рукопись. Все авторы прочитали и согласились с опубликованной версией рукописи.
Финансирование. Данная работа выполнена при поддержке гранта Корейского института оценки промышленных технологий, финансируемым Министерством торговли, промышленности и энергетики (MOTIE, Корея) (№20016543, «Разработка прутка из титанового сплава диаметром не более 50μм для области применения биомедицинских и стоматологических/ортопедических имплантатов).
Заявление Институционального наблюдательного совета. Исследование проводилось в соответствии с Хельсинкской декларацией, одобрено Институциональным наблюдательным советом больницы университета Ханьян (IRB №2018-03-006) и зарегистрировано на международной платформе реестра клинических испытаний ВОЗ (KCT0004906).
Заявление об информированном согласии. Все участники исследования предоставили подписанное информированное согласие.
Заявление о предоставлении данных. Все данные предоставляются по запросу.
Заявление о конфликте интересов. Авторы заявляют об отсутствии конфликта интересов.
Литература
1. Pjetursson, B.E.; Thoma, D.; Jung, R.; Zwahlen, M.; Zembic, A. A systematic review of the survival and complication rates of implant-supported fixed dental prostheses (FDP s) after a mean observation period of at least 5 years. Clin. Oral Implant. Res. 2012, 23, 22–38. [CrossRef] [PubMed]
2. . Urban, I.; Caplanis, N.; Lozada, J.L. Simultaneous vertical guided bone regeneration and guided tissue regeneration in the posterior maxilla using recombinant human platelet-derived growth factor: A case report. J. Oral Implantol. 2009, 35, 251–256. [CrossRef]
3. 9Adeyemo, W.; Reuther, T.; Bloch, W.; Korkmaz, Y.; Fischer, J.H.; Zöller, J.E.; Kuebler, A.C. Healing of onlay mandibular bone grafts covered with collagen membrane or bovine bone substitutes: A microscopical and immunohistochemical study in the sheep. Int. J. Oral Maxillofac. Surg. 2008, 37, 651–659. [CrossRef] [PubMed]
4. Block, M.S.; Kaleem, A. Use of sintered xenograft over allograft for ridge augmentation: Technique note. J. Oral Maxillofac. Surg. 2014, 72, 496–502. [CrossRef] [PubMed]
5. Buser, D.; Chappuis, V.; Kuchler, U.; Bornstein, M.; Wittneben, J.; Buser, R.; Cavusoglu, Y.; Belser, U.C. Long-term stability of early implant placement with contour augmentation. J. Dent. Res. 2013, 92, 176S–182S. [CrossRef] [PubMed]
6. Jensen, S.S.; Bosshardt, D.D.; Gruber, R.; Buser, D. Long-term stability of contour augmentation in the esthetic zone: Histologic and histomorphometric evaluation of 12 human biopsies 14 to 80 months after augmentation. J. Periodontol. 2014, 85, 1549–1556. [CrossRef] [PubMed]
7. Cho, Y.S.; Hwang, K.G.; Jun, S.H.; Tallarico, M.; Kwon, A.M.; Park, C.J. Radiologic comparative analysis between saline and platelet-rich fibrin filling after hydraulic transcrestal sinus lifting without adjunctive bone graft: A randomized controlled trial. Clin. Oral Implant. Res. 2020, 31, 1087–1093. [CrossRef]
8. Nevins, M.; Nevins, M.L.; Kim, S.-W.; Schupbach, P.; Kim, D.M. The use of mucograft collagen matrix to augment the zone of keratinized tissue around teeth: A pilot study. Int. J. Periodontics Restor. Dent. 2011, 31, 367–373.
9. Lee, J.S.; Shin, H.K.; Yun, J.H.; Cho, K.S. Randomized clinical trial of maxillary sinus grafting using deproteinized porcine and bovine bone mineral. Clin. Implant. Dent. Relat. Res. 2017, 19, 140–150. [CrossRef] [PubMed]
10. Susin, C.; Lee, J.; Fiorini, T.; Koo, K.T.; Schüpbach, P.; Angst, P.D.; Finger Stadler, A.; Wikesjö, U.M. Screening of candidate biomaterials for alveolar augmentation using a critical-size rat calvaria defect model. J. Clin. Periodontol. 2018, 45, 884–893. [CrossRef]
11. Amara,H.B.; Lee, J.-W.; Kim, J.-J.; Kang, Y.-M.; Kang, E.-J.; Koo, K.-T. Influence of rhBMP-2 on Guided Bone Regeneration for Placement and Functional Loading of Dental Implants: A Radiographic and Histologic Study in Dogs. Int. J. Oral Maxillofac. Implant. 2017, 32, e265–e276. [CrossRef] [PubMed]
12. Cho,J.S.; Kim, H.S.; Um, S.H.; Rhee, S.H. Preparation of a novel anorganic bovine bone xenograft with enhanced bioactivity and osteoconductivity. J. Biomed. Mater. Res. Part B Appl. Biomater. 2013, 101, 855–869. [CrossRef] [PubMed]
13. Her, S.; Kang, T.; Fien, M.J. Titanium mesh as an alternative to a membrane for ridge augmentation. J. Oral Maxillofac. Surg. 2012, 70, 803–810. [CrossRef]
14. Louis, P.J.; Gutta, R.; Said-Al-Naief, N.; Bartolucci, A.A. Reconstruction of the maxilla and mandible with particulate bone graft and titanium mesh for implant placement. J. Oral Maxillofac. Surg. 2008, 66, 235–245. [CrossRef] [PubMed]
15. Rakhmatia, Y.D.; Ayukawa, Y.; Furuhashi, A.; Koyano, K. Current barrier membranes: Titanium mesh and other membranes for guided bone regeneration in dental applications. J. Prosthodont. Res. 2013, 57, 3–14. [CrossRef]
16. Jung, G.-U.; Jeon, J.-Y.; Hwang, K.-G.; Park, C.-J. Preliminary evaluation of a three-dimensional, customized, and preformed titanium mesh in peri-implant alveolar bone regeneration. J. Korean Assoc. Oral Maxillofac. Surg. 2014, 40, 181. [CrossRef]
17. Lee, S.-H.; Moon, J.-H.; Jeong, C.-M.; Bae, E.-B.; Park, C.-E.; Jeon, G.-R.; Lee, J.-J.; Jeon, Y.-C.; Huh, J.-B. The mechanical properties and biometrical effect of 3D preformed titanium membrane for guided bone regeneration on alveolar bone defect. BioMed Res. Int. 2017, 2017, 7102123. [CrossRef]
18. Tallarico, M.; Ceruso, F.M.; Muzzi, L.; Meloni, S.M.; Kim, Y.-J.; Gargari, M.; Martinolli, M. Effect of simultaneous immediate implant placement and guided bone reconstruction with ultra-fine titanium mesh membranes on radiographic and clinical parameters after 18 months of loading. Materials 2019, 12, 1710. [CrossRef] [PubMed]
19. Fontana, F.; Maschera, E.; Rocchietta, I.; Simion, M. Clinical classification of complications in guided bone regeneration procedures by means of a nonresorbable membrane. Int. J. Periodontics Restor. Dent. 2011, 31, 265. Materials 2022, 15, 5294 12 of 12
20. Liyanage, L.; Lee, N.J.; Cook, T.; Herrmann, H.C.; Jagasia, D.; Litt, H.; Han, Y. The impact of gender on cardiovascular system calcification in very elderly patients with severe aortic stenosis. Int. J. Cardiovasc. Imaging 2016, 32, 173–179. [CrossRef]
21. Lodewick,T.M.; Arnoldussen, C.W.; Lahaye, M.J.; van Mierlo, K.M.; Neumann, U.P.; Beets-Tan, R.G.; Dejong, C.H.; van Dam, R.M. Fast and accurate liver volumetry prior to hepatectomy. HPB 2016, 18, 764–772. [CrossRef] [PubMed]
22. Pang, K.-M.; Lee, J.-K.; Choi, S.-H.; Kim, Y.-K.; Kim, B.-J.; Lee, J.-H. Maxillary sinus augmentation with calcium phosphate double-coated anorganic bovine bone: Comparative multicenter randomized clinical trial with histological and radiographic evaluation. Implant. Dent. 2019, 28, 39–45. [CrossRef] [PubMed]
23. Ohe,J.Y.; Kim, G.T.; Lee, J.W.; Al Nawas, B.; Jung, J.; Kwon, Y.D. Volume stability of hydroxyapatite and-tricalcium phosphate biphasic bone graft material in maxillary sinus floor elevation: A radiographic study using 3D cone beam computed tomography. Clin. Oral Implant. Res. 2016, 27, 348–353. [CrossRef] [PubMed]
24. Mir-Mari, J.; Wui, H.; Jung, R.E.; Hämmerle, C.H.; Benic, G.I. Influence of blinded wound closure on the volume stability of different GBR materials: An in vitro cone-beam computed tomographic examination. Clin. Oral Implant. Res. 2016, 27, 258–265. [CrossRef] [PubMed] 25. Mir-Mari, J.; Benic, G.I.; Valmaseda-Castellón, E.; Hämmerle, C.H.; Jung, R.E. Influence of wound closure on the volume stability of particulate and non-particulate GBR materials: An in vitro cone-beam computed tomographic examination. Part II. Clin. Oral Implant. Res. 2017, 28, 631–639. [CrossRef] [PubMed]
26. Esposito, M.; Maghaireh, H.; Grusovin, M.G.; Ziounas, I.; Worthington, H.V. Soft tissue management for dental implants: What are the most effective techniques? A Cochrane systematic review. Eur. J. Oral. Implant. 2012, 5, 221–238.
27. Jemt, T. Implant failures and age at the time of surgery: A retrospective study on implant treatment in 2915 partially edentulous jaws. Clin. Implant. Dent. Relat. Res. 2019, 21, 686–692. [CrossRef] [PubMed]
28. Jensen, S.S.; Terheyden, H. Bone augmentation procedures in localized defects in the alveolar ridge: Clinical results with different bone grafts and bone-substitute materials. Int. J. Oral Maxillofac. Implant. 2009, 24, 218–236.
29. Scheyer, E.T.; Heard, R.; Janakievski, J.; Mandelaris, G.; Nevins, M.L.; Pickering, S.R.; Richardson, C.R.; Pope, B.; Toback, G.; Velásquez, D.; et al. A randomized, controlled, multicentre clinical trial of post-extraction alveolar ridge preservation. J. Clin. Periodontol. 2016, 43, 1188–1199. [CrossRef]
30. Wang, H.-L.; Misch, C.; Neiva, R.F. “Sandwich” bone augmentation technique: Rationale and report of pilot cases. Int. J. Periodontics Restor. Dent. 2004, 24, 232–245.
31. Sarnachiaro, G.O.; Chu, S.J.; Sarnachiaro, E.; Gotta, S.L.; Tarnow, D.P. Immediate implant placement into extraction sockets with labial plate dehiscence defects: A clinical case series. Clin. Implant. Dent. Relat. Res. 2016, 18, 821–829. [CrossRef]
32. Meloni, S.M.; Jovanovic, S.A.; Urban, I.; Baldoni, E.; Pisano, M.; Tallarico, M. Horizontal ridge augmentation using GBR with a native collagen membrane and 1:1 ratio of particulate xenograft and autologous bone: A 3-year after final loading prospective clinical study. Clin. Implant. Dent. Relat. Res. 2019, 21, 669–677. [CrossRef] [PubMed]
33. Cucchi, A.; Sartori, M.; Parrilli, A.; Aldini, N.N.; Vignudelli, E.; Corinaldesi, G. Histological and histomorphometric analysis of bone tissue after guided bone regeneration with non-resorbable membranes vs resorbable membranes and titanium mesh. Clin. Implant. Dent. Relat. Res. 2019, 21, 693–701. [CrossRef]
34. Proussaefs, P.; Lozada, J. Use of titanium mesh for staged localized alveolar ridge augmentation: Clinical and histologic histomorphometric evaluation. J. Oral Implantol. 2006, 32, 237–247. [CrossRef]
35. Sagheb, K.; Schiegnitz, E.; Moergel, M.; Walter, C.; Al-Nawas, B.; Wagner, W. Clinical outcome of alveolar ridge augmentation with individualized CAD-CAM-produced titanium mesh. Int. J. Implant. Dent. 2017, 3, 1–7. [CrossRef] [PubMed]
Реклама ООО "Осстем", erid:2VtzqwZTQyU
Производители:
Цель данного исследования заключается в сравнении эффективности двух неорганических костных материалов (НКМ) бычьего происхождения, полученных по технологии низкотемпературного спекания: Bio-Oss (Geistlich, Вольхузен, Швейцария) и A-Oss (Osstem, Сеул, Корея), – при направленной костной регенерации (НКР) для устранения щелевидных дефектов в области имплантатов.

Введение
Сегодня все больше внимания уделяется изучению инновационных устройств и технологий, которые позволят свести к минимуму травму тканей, продолжительность хирургического вмешательства и тяжесть послеоперационных осложнений при имплантологическом лечениии [1]. Направленная костная регенерация (НКР) — это хирургическое вмешательство, нацеленное на увеличение объема костной ткани в области дентальных имплантатов с использованием различных костных материалов и барьерных мембран [2]. Неорганические костные материалы (НКМ) бычьего происхождения широко используются при синус-лифтинге, сохранении объема гребня, немедленной имплантации и НКР [3–7]. НКМ отличаются способностью сохранять объем регенерации и медленнее замещаются новой костной тканью, по сравнению с аутогенной и аллогенной костью.
На стоматологическом рынке представлены разные типы НКМ, которые спекаются при высокой температуре [8] или изготовлены из свиного или лошадиного материала [9]. Однако, по некоторым данным, преобладают именно НКМ бычьего происхождения, полученные по технологии низкотемпературного спекания [10]. Долгое время золотым стандартом среди таких материалов считался именно Bio-Oss (Geistlich, Вольхузен, Швейцария), в первую очередь, благодаря убедительной научно-доказательной базе. Материал A-Oss (Osstem, Сеул, Корея) получают путем химической обработки ароматическим сильнощелочным растворителем с последующим обжигом при температуре ниже 400◦С с крайне низкой скоростью нагрева (<0,3◦С в минуту) [11]. Физико-химические характеристики A-Oss по сути сопоставимы с Bio-Oss с учетом более высокой пористости и более низкой степени кристалличности. В отличие от других ксеногенных костных материалов, у A-Oss ниже степень резорбции и ремоделирования (рис. 1) [11,12].
Рис. 1. Сравнительная сканирующая электронная микроскопия материалов Bio-Oss и A-Oss. Частицы Bio-Oss при увеличении ×50 (а), ×500 (с) и ×60 000 (е); частицы A-Oss при увеличении ×50 (b), ×500 (d) и ×60 000 (f)

В стоматологической и челюстно-лицевой хирургии титановые сетки применяются для устранения крупных костных дефектов; такие сетки отличаются биосовместимостью и высокой жесткостью [13–15]. Все большей популярностью пользуются предварительно сформированные ультратонкие титановые 3D-мембраны с фиксацией непосредственно к имплантату [16,17]. Они сохраняют стабильность на протяжении всего периода заживления, а наличие большого числа отверстий разного размера позволяет добиться оптимальных результатов НКР [18].
Цель данного рандомизированного контролируемого клинического исследования (РКИ) заключается в сравнении двух НКМ, спеченных при низкой температуре (Bio-Oss и A-Oss), в комбинации с ультратонкой титановой 3D-мембраной при устранении щелевидных костных дефектов в области одиночного имплантата. По имеющейся у авторов информации, это первое исследование, в котором измеряют и сравнивают изменения объема НКМ во всех трех плоскостях для количественной оценки результатов НКР. Нулевая гипотеза предполагала отсутствие между группами разницы в изменениях объема регенерации (количество), плотности костной ткани (качество), а также частоты послеоперационных осложнений.
Материалы и методы
Рандомизированное контролируемое исследование с параллельными группами проводилось в отделении стоматологической и челюстно-лицевой хирургии больницы университета Ханьян в период с июня 2018 г. по июль 2019 г. Исследование одобрено Институциональным наблюдательным советом больницы университета Ханьян (IRB №2018-03-006) и зарегистрировано на международной платформе регистрации клинических испытаний ВОЗ (KCT0004906). Исследование проведено в соответствии с Хельсинкской декларацией и международными принципами проведения РКИ, в том числе со стандартом CONSORT (версия от 2 марта 2018 г.). Все хирургические вмешательства и протезирование выполнены одним специалистом (Ч.Д.П.).
Выборка пациентов
В исследование включили здоровых пациентов в возрасте от 18 лет, которым по результатам клинического обследования и рентгенологического исследования, в том числе с помощью конусно-лучевой компьютерной томографии (КЛКТ), показана установка одиночного имплантата в заживший альвеолярный гребень одновременно с НКР для устранения щелевидного костного дефекта, возникшего при имплантации в ортопедически правильном положении (OneGuide, Osstem, Сеул, Корея). При этом костные дефекты ограничивались только щечной и/или проксимальной поверхностью без вовлечения соседних зубов и не распространялись на язычную поверхность. Критериями исключения были необходимость установить рядом более двух имплантатов и наличие системных или местных противопоказаний для имплантации, включая некомпенсированные метаболические нарушения в анамнезе, курение, бруксизм, нелеченный пародонтит. Пациентов проинформировали об особенностях хирургического вмешательства, используемых материалах, преимуществах, потенциальных рисках и возможных осложнениях. Все пациенты предоставили подписанное информированное согласие на участие в исследовании.
Хирургический этап
Все вмешательства выполняли в условиях местной анестезии и внутривенной седации среднего уровня. Сформировали и отслоили полнослойный лоскут, иссекли грануляционные ткани. Остеотомическое отверстие наметили в кортикальной кости с помощью направляющего сверла.
Ложе имплантата сформировали коническими сверлами в соответствующей последовательности (набор OneGuide или 122 Taper, Osstem), уделяя особое внимание правильному трехмерному позиционированию. Имплантат (TS III SOI, Osstem или T01 SA, Toplan, Сеул, Корея) установили на 1 мм апикальнее края альвеолярного гребня с язычной/небной стороны. Образование щелевидного дефекта сопровождалось обнажением резьбы на щечной и/или проксимальной поверхности имплантата.
Измерили расстояние от платформы имплантата до участка первого контакта имплантата с костью (высота дефекта; рис. 2a) и расстояние от мезиального до дистального костного края на уровне платформы имплантата (ширина дефекта; рис. 2b); таким образом определили размер дефекта. С учетом этих параметров подобрали наиболее подходящую титановую 3D-мембрану (OssBuilder, Osstem): в области щечных щелевидных дефектов – тип I, в области комбинированных щечно-проксимальных дефектов – тип II (рис. 3). При необходимости мембрану немного обрезали так, чтобы обеспечить большую стабильность костного материала. Многократно перфорировали кортикальную кость для создания доступа к костному мозгу и стимулирования остеогенных клеткок с целью ускорения регенерации костной ткани.
Рис. 2. Измерение высоты (а) и ширины дефекта (b) для определения его размера, а также оценка плотности регенерированной кости путем измерения глубины зондирования (с)

Рис. 3. Компоненты титановой 3D-мембраны, использованной в рамках этого исследования для устранения щелевидных костных дефектов в области имплантатов

Пациентов случайным образом распределили в одну из двух групп: Bio-Oss или A-Oss. Непосредственно на обнаженную поверхность имплантата нанесли лиофилизированную аллогенную кость (SureOss, HansBiomed, Сеул, Корея), которую затем покрыли соответствующим НКМ (Bio-Oss или A-Oss) в том же объеме для восстановления альвеолярного контура. Переходник – промежуточный компонент для установки титановой мембраны на имплантат – фиксировали вручную, а к нему прикрепили выбранную титановая мембрану (рис. 3). На имплантаты, установленные с крутящим моментом ≤30 Нсм или с коэффициентом стабильности ISQ≤70, фиксировали заглушку из комплекта, а мягкие ткани плотно ушивали. Во всех других случаях сразу устанавливали специальный формирователь десны. Кроме того, поверх титановой мембраны дополнительно накладывали резорбируемую коллагеновую мембрану (OssGuide, SK Bioland, Чхонан, Корея или OssMem hard, Osstem), чтобы свести к минимуму риск обнажения титановой сетки на ранних этапах заживления. Предварительное рассечение надкостницы в основании полнослойного лоскута позволяет ушить рану без натяжения. В послеоперационном периоде пациентам назначили анальгетики для купирования боли и антибиотики в течение 10 дней для профилактики инфицирования тканей. Также рекомендовали дважды в день полоскать рот раствором хлоргексидина. Швы сняли через 10 дней после операции.
Через 8 месяцев под местной анестезией сформировали лоскут аналогичного дизайна и раскрыли имплантаты. Удалили титановую мембрану и определили плотность кости щечно, примерно по центру области регенерации при помощи зондирования с усилием 0,25 Н (рис. 2c). Специальную заглушку или формирователь десны заменили на стандартный формирователь десны, вокруг которого ушили мягкие ткани. Швы сняли через 10 дней. Дожидались полного заживления мягких тканей и только после этого получили оттиск. Временную реставрацию фиксировали на индивидуальный титановый абатмент и прогрессивно нагружали; окончательное протезирование провели через 12 месяцев после имплантации. Все послеоперационные осложнения НКР регистрировались в соответствии с ранее предложенной классификацией осложнений НКР [19], лечение выполнял тот же специалист (Ч.Д.П.).
Оценка объема регенерации
Изменения объема регенерации оценивали по изображениям КЛКТ до операции (T0), сразу после имплантации и НКР (T1), после раскрытия имплантатов (T2) и на этапе окончательного протезирования (T3). Параметры КЛКТ задали с учетом принципов минимальной эффективной дозы излучения (ALARA): FOV 35×50 мм; размер вокселя 0,2 мм; время 10,8 с; кВ 75; мА 10; произведение дозы на площадь 240 мГр·см2. В программном обеспечении Aquarium iNtuition (TeraRecon, Дарем, Северная Каролина, США) реконструировали трехмерное изображение участка вмешательства и сегментировали его по прилежащим анатомическим образованиям (соседние зубы, дно верхнечелюстной пазухи, нижнечелюстной канал). Однородные по плотности и размеру структуры (например, имплантат и формирователь десны) вычли из снимка, после чего независимый эксперт без доступа к клинической информации (К.Г.Х.) рассчитал остаточный объем (см3) на разных этапах наблюдения (рис. 4). Это программное обеспечение широко используется в медицине, например, для точного определения степени кальцификации крупных сосудов [20] и измерения объема органа перед трансплантацией [21]; в данном исследовании его использовали совместно с КТ для измерения объема области регенерации.
Статистический анализ
Размер выборки определили так, чтобы статистическая мощность теста составила 90% при уровне α = 0,05 в соответствии с предположением о равенстве дисперсий, основанном на средних значениях внутригрупповых и междиндивидуальных различий из предыдущего РКИ, в котором Bio-Oss сравнивали с НКМ с покрытием из фосфата кальция при выполнении синус-лифтинга [22]. На основании этих результатов минимальный размер выборки оценили в 9 человек в каждой группе, учитывая возможный уровень отсева в 10% по ходу исследования.
Разницу в изменениях объема регенерации в группах Bio-Oss и A-Oss изучали с помощью смешанной модели с поправкой на ковариаты при измерениях в трех последовательных временных периодах, а также на исходном уровне (T0). Значимость ковариатных эффектов и прогнозируемых изменений объема проверяли при α = 0,05. Описательная статистика проводилась с указанием средних значений (СЗ)±стандартное отклонение (СО) для количественных переменных и с указанием процентов для качественных переменных.
Для статистического анализа использовалась программа SAS, версия 9.4 (SAS Inc., Кэри, Северная Каролина, США). Значение Р < 0,05 считали статистически значимым.
Рис. 4. Снимки КЛКТ, схематические изображения и прицельные рентгенограммы на разных этапах наблюдения. Объем регенерации рассчитали по 3D-реконструкции изображений КЛКТ с помощью ПО Aquarium iNtuition, версия 4.4.12 (TeraRecon, Дарем, Северная Каролина, США). T0 – до вмешательства (а, е, i), T1 – cразу после имплантации и НКР (b, f, j), T2 – после раскрытия имплантатов (с, g, k), T3 – на этапе окончательного протезирования (d, h, l)

Результаты
Всего в исследование последовательно включили 18 пациентов, в процессе наблюдения два пациента (по одному в каждой группе) выбыли из исследования. В табл. 1 объединены данные 16 пациентов (7 мужчин и 9 женщин) в возрасте от 28 до 72 лет (в среднем 54,3±11,7 лет). Межгрупповое сравнение демографических параметров представлено в табл. 2. Статистически значимая разница между группами Bio-Oss и A-Oss наблюдалась только по переменной «длина имплантата» (Р < 0,01).
Таблица 1. Характеристики пациентов

НКМ – неорганический костный материал бычьего происхождения, ГЗ – глубина зондирования, З – заглушка, Ф – формирователь десны, OG – OssGuide, OM – OssMem hard. Тип I – титановая 3D-мембрана для устранения щечного щелевидного дефекта; тип II – титановая 3D-мембрана для для устранения комбинированного щечно-проксимального щелевидного дефекта. Класс I – небольшое обнажение мембраны (≤3 мм) без экссудации; класс II – значительное обнажение мембраны (>3 мм) без экссудации. T0 – до вмешательства, T1 – сразу после имплантации и НКР, T2 – после раскрытия имплантатов, T3 – на этапе окончательного протезирования.
Таблица 2. Демографическое сравнение пациентов в группах Bio-Oss и A-Oss
|
Переменная |
Bio-Oss |
A-Oss |
Значение P |
|
|
Пол |
Мужчины |
3 (37.5) |
4 (50.0) |
0.6143 |
|
Женщины |
5 (62.5) |
4 (50.0) |
||
|
Возраст |
Лет |
53.8 ± 10.8 |
54.8 ± 12.2 |
0.9258 |
|
Локализация |
Верхняя челюсть |
5 (62.5) |
4 (50.0) |
0.6143 |
|
Нижняя челюсть |
3 (37.5) |
4 (50.0) |
||
|
Передний отдел |
4 (50.0) |
3 (37.5) |
0.6143 |
|
|
Дистальный отдел |
4 (50.0) |
5 (62.5) |
||
|
Дефект |
Ширина |
5.3 ± 1.1 |
5.8 ± 0.8 |
0.1542 |
|
Высота |
3.8 ± 0.6 |
4.6 ± 1.5 |
0.0892 |
|
|
Имплантат |
Диаметр (мм) |
4.4 ± 0.4 |
4.2 ± 0.4 |
0.0850 |
|
Длина (мм) |
8.3 ± 0.9 |
9.1 ± 0.7 |
0.0050* |
|
|
Глубина зондирования |
(мм) |
2.8 ± 0.7 |
2.6 ± 0.8 |
0.5001 |
|
Титановая мембрана |
Заглушка |
3 (37.5) |
4 (50.0) |
0.6143 |
|
Формирователь |
5 (62.5) |
4 (50.0) |
||
|
Тип I (щечный) |
4 (50.0) |
2 (25.0) |
0.2369 |
|
|
Тип II (щечно-проксимальный) |
4 (50.0) |
6 (75.0) |
||
|
Осложение |
(Да) |
2 (25.0) |
1 (12.5) |
0.4103 |
* Число случаев (%) суммировалось для качественных переменных и сравнивалось с помощью точного теста Фишера. СЗ±СО суммировались для количественных переменных и *Р<0,01 по тесту Вилкоксона.
В обеих группах максимальный объем регенерации наблюдался на этапе T1 и достигал 1,70±0,50 см3 в группе Bio-Oss и 1,94±0,26 см3 в группе A-Oss, после чего постепенно сокращался до этапа T3 включительно. На этапе T2 объем регенерации уменьшился до 1,17±0,38 см3 в группе Bio-Oss и 1,46±0,14 см3 в группе A-Oss, на этапе T3 – до 0,92± 0,37 см3 и 1,15±0,16 см3 соответственно. Разница в объеме регенерации на разных временных этапах была статистически значимой (Р<0,001; табл. 3). При этом существенной разницы между двумя группами на протяжении всего наблюдения не отмечалось (Р>0,05; рис. 5). Кроме того, на этапе T3 между группами не выявлено значимой разницы в плотности регенерировавшей кости (Р>0,05).
Таблица 3. Сравнение объема регенерации на разных этапах наблюдения
|
Прогноз |
Значение Т |
Значение Р |
|
|
Т2 – Т3 |
-0.2244 |
-5.02 |
0.0007* |
|
Т2 – Т1 |
-2.3194 |
-15.62 |
<0.0001* |
|
Т3 – Т1 |
-2.0950 |
-16.87 |
<0.0001* |
*Р<0,001 при сравнении СЗ, полученных методом наименьших квадратов в смешанной модели при α = 0,05. T1 – сразу после имплантации и НКР, T2 – после раскрытия имплантатов, T3 – на этапе окончательного протезирования.
Анализ по смешанной модели выявил, что значительное уменьшение объема регенерации происходило на этапах T2 и T3 (Р<0,001), у пациентов старшей возрастной группы (Р<0,01), а также при наличии осложнений (Р<0,05). Напротив, более широкий дефект (Р<0,01) и его локализация на верхней челюсти (Р<0,05) ассоциировались с менее выраженной потерей объема регенерации (табл. 4). Послеоперационные осложнения отмечались у трех пациентов: два (обнажение титановой мембраны классов I и II по линии ушивания) в группе Bio-Oss и один (обнажение титановой мембраны класса I в проекции ее мезиально-щечного края) в группе A-Oss. Во всех трех случаях мембрана была фиксирована заглушками; статистически значимая разница между двумя группами отсутствовала. Пациентам рекомендовали дважды в день тщательно и осторожно очищать область дефекта мягкой зубной щеткой, смоченной хлоргексидинсодержащим (1%) гелем. Титановые мембраны не требовалось удалять раньше времени, даже несмотря на отсутствие реэпителизации в области дефекта. Обнажение витков резьбы имплантата, а также выраженная утрата костного материала с экссудацией в ходе заживления не наблюдались. На этапе T2 дополнительное внесение костного материала не потребовалось.
Рис. 5. Сравнение объемов регенерации между группами Bio-Oss и A-Oss в разные временные промежутки после корректировки уровня α с помощью поправки Бонферрони. СЗ±СО (мм) с доверительным интервалом (ДИ) 95%. T0 – до вмешательства, T1 – сразу после имплантации и НКР, T2 – после раскрытия имплантатов, T3 – на этапе окончательного протезирования

Таблица 4. Прогностические коэффициенты для изменения объема регенерации по смешанной модели
Эффекты |
| Прогноз | Значение Т | Значение Р |
Группа | -0.2112 | -1.12 | 0.2906 | |
Время | T2 | -2.4125 | -11.49 | <0.0001*** |
T3 | -2.2475 | -12.80 | <0.0001*** | |
Группа×Время † | (T2) | 0.1863 | 0.63 | 0.5460 |
(T3) | 0.3050 | 1.23 | 0.2505 | |
Возраст | -0.0045 | -4.17 | 0.0024** | |
Осложнения | (Да) | -0.1184 | -2.79 | 0.0210* |
Дефект | (Ширина) | 0.0796 | 4.58 | 0.0013** |
Локализация | (Дистальный) | -0.0624 | -2.17 | 0.0583 |
(Верхняя челюсть) | 0.0684 | 2.77 | 0.0218* |
* * *Р<0,001; **Р<0,01; *Р<0,05 по смешанной модели при α = 0,05.
† Анализ эффекта взаимодействия группы и времени с учетом предположения, что изменения объема регенерации в двух группах могут зависеть от временной точки наблюдения. T2 – объем на этапе раскрытия имплантатов, T3 – объем на этапе окончательного протезирования. Пол пациента (мужской), фиксация титановой мембраны (заглушка), тип титановой мембраны (щечная) и глубина зондирования не были статистически значимыми факторами, значения P составили 0,8457, 0,0638, 0,2369 и 0,4256 соответственно. Имплантат (диаметр), имплантат (длина) и дефект (высота) также не были статистически значимыми факторами, значения P составили 0,4215, 0,0604 и 0,0969 соответственно.
Обсуждение
Методика представленного РКИ разработана для оценки эффективности материала A-Oss при НКР по сравнению с другим НКМ, полученным по технологии низкотемпературного спекания (Bio-Oss). Нулевая гипотеза предполагала отсутствие различий между A-Oss и Bio-Oss. НКМ отличаются более длительным сохранением объема, однако в процессе замещения новообразованной костью объем Bio-Oss и A-Oss уменьшился на 46% (0,78±0,37 см3) и 40,8% (0,79±0,33 см3) соответственно. Эти значения превысили ожидаемые, что можно объяснить разницей рентгенологической картины: на этапе T1 костный материал был четко очерчен тонкой рентгеноконтрастной титановой сеткой, в то время как на этапах T2 и T3 эта рентгенологическая граница между костью и мягкими тканями размывалась, что и привело к недооценке объема регенерации после извлечения мембраны. По разным данным, на протяжении 6 месяцев после синус-лифтинга объем внесенного костного материала постепенно уменьшается на 17,3~23,9% [22,23]. Считается, что при НКР этот показатель может быть еще больше из-за давления со стороны надлежащих мягких тканей. В представленном исследовании в области НКР выполнялись только линейные измерения по изображениям КЛКТ с ограниченным полем обзора. Полученные результаты выглядят закономерными, учитывая, что в других работах с применением Bio-Oss уменьшение линейного размера в области платформы имплантата варьировалось от 20,2% до 42,8% [24,25]. Однако также следует признать, что при наличии в поле обзора КЛКТ металлических объектов (например, имплантата и титановой мембраны) существует риск ошибки измерения из-за артефактов изображения.
Выяснили, что объем регенерации зависит от развития послеоперационных осложнений и от локализации хирургического поля (Р < 0,05). Наличие послеоперационных дефектов или вмешательство в дистальном отделе (а не в переднем, Р = 0,0583) и на нижней челюсти (а не на верхней) с высокой долей вероятности приводит к более выраженной резорбции костного материала. Дистальные отделы нижней челюсти обычно представлены плотной костью с более толстым кортикальным слоем, и результат НКР здесь менее предсказуем, даже в сочетании с кортикальными перфорациями [26]. Существенными факторами также были возраст и ширина костного дефекта (Р<0,01). Это означает, что в более старшем возрасте и при более узких щелевидных дефектах, скорее всего, будет наблюдаться большая резорбция костного материала. У пожилых пациентов, как правило, ниже потенциал регенерации тканей и выше риск несостоятельности имплантатов [27]. В области крупных дефектов костные материалы используются в большем объеме, а титановая сетка дополнительно их стабилизирует. Ультратонкая титановая 3D-мембрана идеального контурирует костный гребень, особенно на уровне платформы имплантата [16–18]. Окончатый дефект в области имплантата в большей степени заполняется костной тканью и ассоциируется с меньшим числом осложнений, чем щелевидный дефект, если оба они расположены в пределах исходного костного контура [28]. Таким образом, нельзя утверждать, что высота дефекта значимым образом влияет на изменение объема регенерации.
В отличие от НКМ, аллогенные костные материалы стимулируют активное формирование костной ткани (т. е. обладают остеоиндуктивными свойствами), что подтверждается гистологическими исследованиями [29]. Сегодня для устранения дефектов и восстановления объема гребня в области имплантации обычно применяется послойное внесение материалов разного типа [30]. Как правило, первым слоем, на поверхность имплантата, наносят аутогенную стружку; также в качестве альтернативы или дополнительно в тех случаях, когда одной аутогенной кости недостаточно, используется аллогенная кость [29,31]. В настоящей работе на аллогенный материал нанесли НКМ для увеличения объема кости и компенсации резорбции, затем все перекрыли резорбируемой коллагеновой мембраной, которая изолирует пространство регенерации от мягкотканных и неостеогенных клеток [4,30]. Таким образом, коллагеновая мембрана выполняет барьерную функцию и предотвращает преждевременное истончение надлежащей десны, а титановая сетка обеспечивает стабильность кровяного сгустка и благоприятные условия для регенерации [15]. Титановая сетка не резорбируется и требует обязательного удаления; в ходе такого вмешательства можно оценить количество и качество новообразованной кости и эффективность НКР. В целом, объем кости определяется рентгенологически посредством 3D-реконструкции изображений КЛКТ [32], а для того, чтобы оценить ее качество, требуется гистологическое или гистоморфометрическое исследование биоптата в участке НКР [33]. В настоящей работе качество кости определяли по степени кортикализации в области регенерации и по глубине зондирования на этапе раскрытия имплантатов. Забрать фрагмент костной ткани в области имплантата технически сложно, а часто и невозможно. Осмотр сразу после удаления титановой мембраны выявил плотный альвеолярный гребень, покрытый мягкими тканями толщиной 1–2 мм [13]. Этот мягкотканный слой называется «псевдонадкостница», которая гистологически представляет собой грануляционную соединительную ткань; ее клиническое значение пока неясно [34]. Однако отмечается, что псевдонадкостница стабильна и удалять ее при раскрытии имплантатов не требуется [16]. Глубина зондирования в этом исследовании составила 2,8 ± 0,7 мм (Bio-Oss) и 2,6 ± 0,8 мм (A-Oss), включая в том числе и толщину незрелой костной ткани (в т.ч. псевдонадкостницы), которая со временем, по-видимому, преобразуется в кортикальную кость. Такой способ определения качества регенерировавшей кости является основным ограничением данной работы. Необходимы дальнейшие гистологические и гистоморфометрические исследования, которые позволят составить более полное представление об эффективности НКР.
Во всех трех случаях послеоперационные дефекты (небольшое [2 пациента] и значительное [1 пациент] обнажение титановой сетки) не реэпителизировались, однако миграции костного материала и экссудации не наблюдалось, заживление протекало без особенностей, поэтому ранее удаление титановой мембраны и дополнительное внесение костного материала не потребовались. Тем не менее глубина зондирования увеличилась до 3–4 мм из-за наличия более толстой псевдонадкостницы, которая была необходима для стабилизации костного материала в случаях прорезывания титановой мембраны. Ранее опубликованное исследование также продемонстрировало, что обнажение титановой сетки не ухудшает клинический результат и не снижает эффективность костной пластики [35]. В частности, все послеоперационные осложнения возникали в случаях, когда титановая мембрана была фиксирована заглушками, хотя это не были статистически значимыми. Заглушки фиксировали на имплантаты с низкой первичной стабильностью, а мягкие ткани над ними плотно ушивали, т. е. допустимо предположить, что более высокая частота послеоперационного расхождения краев раны вызвана большим натяжением мягких тканей в области погруженных, чем непогруженных имплантатов. Статистически значимая разница в частоте послеоперационных осложнениях между группами Bio-Oss и A-Oss отсутствовала.
Выводы
С учетом ограничений данного исследования можно сделать следующие выводы:
- Щелевидный костный дефект в области имплантата можно успешно устранить при помощи НКР с послойным внесением аллогенной кости и НКМ и с последующей фиксацией ультратонкой титановой 3D-мембраны и резорбируемой коллагеновой мембраны.
- Известно, что НКМ относительно медленно резорбируется, однако на этапе T2 объем регенерации уменьшился примерно на 27,8% ое было отмечено в резорбции. При этом существенной разницы между группами Bio-Oss и A-Oss не обнаружено, в том числе и по качеству регенерировашей кости.
- Уменьшение объема регенерации (в среднем на 43,2%) продолжалось до этапа T3, статистически значимая разница между группами Bio-Oss и A-Oss отсутствовала.
Авторы
- Джэ Хён Лим, Отделение челюстно-лицевой хирургии, больница Ансан Корейского университета, Ансан-си 15355, Корея; †
- Сан Хо Джун, Отделение челюстно-лицевой хирургии, больница Анам Корейского университета, Сеул 02841, Корея; †
- Марко Талларико, Кафедра медицины, хирургии и фармации, Университет Сассари, 07100 Сассари, Италия;
- Чун Бом Пак, Кафедра пародонтологии, Медицинский колледж, Католический университет Кореи, Сеул 06591, Корея;
- Дэ Хо Парк, Отделение челюстно-лицевой хирургии, кафедра стоматологии, медицинский колледж, университет Ханьянг, Сеул 04763, Корея;
- Кён Гюн Хван, Отделение челюстно-лицевой хирургии, кафедра стоматологии, медицинский колледж, университет Ханьянг, Сеул 04763, Корея;
- Чан Джу Пак, Отделение челюстно-лицевой хирургии, кафедра стоматологии, медицинский колледж, университет Ханьянг, Сеул 04763, Корея;
† Оба автора внесли равный вклад в написание статьи.
Вклад авторов. Д.Х.Л., С.Х.Д. и Ч.Д.П. придумали идею и руководили написанием статьи. Д.Х.Л., С.Х.Д. и Д.Х.П. собрали данные; Д.Х.Л., К.Г.Х. и Ч.Б.П. проанализировали полученные данные. MT и Ч.Д.П. рецензировали рукопись; MT, Ч.Б.П., К.Г.Х. и Ч.Д.П. отредактировали рукопись. Все авторы прочитали и согласились с опубликованной версией рукописи.
Финансирование. Данная работа выполнена при поддержке гранта Корейского института оценки промышленных технологий, финансируемым Министерством торговли, промышленности и энергетики (MOTIE, Корея) (№20016543, «Разработка прутка из титанового сплава диаметром не более 50μм для области применения биомедицинских и стоматологических/ортопедических имплантатов).
Заявление Институционального наблюдательного совета. Исследование проводилось в соответствии с Хельсинкской декларацией, одобрено Институциональным наблюдательным советом больницы университета Ханьян (IRB №2018-03-006) и зарегистрировано на международной платформе реестра клинических испытаний ВОЗ (KCT0004906).
Заявление об информированном согласии. Все участники исследования предоставили подписанное информированное согласие.
Заявление о предоставлении данных. Все данные предоставляются по запросу.
Заявление о конфликте интересов. Авторы заявляют об отсутствии конфликта интересов.
Литература
1. Pjetursson, B.E.; Thoma, D.; Jung, R.; Zwahlen, M.; Zembic, A. A systematic review of the survival and complication rates of implant-supported fixed dental prostheses (FDP s) after a mean observation period of at least 5 years. Clin. Oral Implant. Res. 2012, 23, 22–38. [CrossRef] [PubMed]
2. . Urban, I.; Caplanis, N.; Lozada, J.L. Simultaneous vertical guided bone regeneration and guided tissue regeneration in the posterior maxilla using recombinant human platelet-derived growth factor: A case report. J. Oral Implantol. 2009, 35, 251–256. [CrossRef]
3. 9Adeyemo, W.; Reuther, T.; Bloch, W.; Korkmaz, Y.; Fischer, J.H.; Zöller, J.E.; Kuebler, A.C. Healing of onlay mandibular bone grafts covered with collagen membrane or bovine bone substitutes: A microscopical and immunohistochemical study in the sheep. Int. J. Oral Maxillofac. Surg. 2008, 37, 651–659. [CrossRef] [PubMed]
4. Block, M.S.; Kaleem, A. Use of sintered xenograft over allograft for ridge augmentation: Technique note. J. Oral Maxillofac. Surg. 2014, 72, 496–502. [CrossRef] [PubMed]
5. Buser, D.; Chappuis, V.; Kuchler, U.; Bornstein, M.; Wittneben, J.; Buser, R.; Cavusoglu, Y.; Belser, U.C. Long-term stability of early implant placement with contour augmentation. J. Dent. Res. 2013, 92, 176S–182S. [CrossRef] [PubMed]
6. Jensen, S.S.; Bosshardt, D.D.; Gruber, R.; Buser, D. Long-term stability of contour augmentation in the esthetic zone: Histologic and histomorphometric evaluation of 12 human biopsies 14 to 80 months after augmentation. J. Periodontol. 2014, 85, 1549–1556. [CrossRef] [PubMed]
7. Cho, Y.S.; Hwang, K.G.; Jun, S.H.; Tallarico, M.; Kwon, A.M.; Park, C.J. Radiologic comparative analysis between saline and platelet-rich fibrin filling after hydraulic transcrestal sinus lifting without adjunctive bone graft: A randomized controlled trial. Clin. Oral Implant. Res. 2020, 31, 1087–1093. [CrossRef]
8. Nevins, M.; Nevins, M.L.; Kim, S.-W.; Schupbach, P.; Kim, D.M. The use of mucograft collagen matrix to augment the zone of keratinized tissue around teeth: A pilot study. Int. J. Periodontics Restor. Dent. 2011, 31, 367–373.
9. Lee, J.S.; Shin, H.K.; Yun, J.H.; Cho, K.S. Randomized clinical trial of maxillary sinus grafting using deproteinized porcine and bovine bone mineral. Clin. Implant. Dent. Relat. Res. 2017, 19, 140–150. [CrossRef] [PubMed]
10. Susin, C.; Lee, J.; Fiorini, T.; Koo, K.T.; Schüpbach, P.; Angst, P.D.; Finger Stadler, A.; Wikesjö, U.M. Screening of candidate biomaterials for alveolar augmentation using a critical-size rat calvaria defect model. J. Clin. Periodontol. 2018, 45, 884–893. [CrossRef]
11. Amara,H.B.; Lee, J.-W.; Kim, J.-J.; Kang, Y.-M.; Kang, E.-J.; Koo, K.-T. Influence of rhBMP-2 on Guided Bone Regeneration for Placement and Functional Loading of Dental Implants: A Radiographic and Histologic Study in Dogs. Int. J. Oral Maxillofac. Implant. 2017, 32, e265–e276. [CrossRef] [PubMed]
12. Cho,J.S.; Kim, H.S.; Um, S.H.; Rhee, S.H. Preparation of a novel anorganic bovine bone xenograft with enhanced bioactivity and osteoconductivity. J. Biomed. Mater. Res. Part B Appl. Biomater. 2013, 101, 855–869. [CrossRef] [PubMed]
13. Her, S.; Kang, T.; Fien, M.J. Titanium mesh as an alternative to a membrane for ridge augmentation. J. Oral Maxillofac. Surg. 2012, 70, 803–810. [CrossRef]
14. Louis, P.J.; Gutta, R.; Said-Al-Naief, N.; Bartolucci, A.A. Reconstruction of the maxilla and mandible with particulate bone graft and titanium mesh for implant placement. J. Oral Maxillofac. Surg. 2008, 66, 235–245. [CrossRef] [PubMed]
15. Rakhmatia, Y.D.; Ayukawa, Y.; Furuhashi, A.; Koyano, K. Current barrier membranes: Titanium mesh and other membranes for guided bone regeneration in dental applications. J. Prosthodont. Res. 2013, 57, 3–14. [CrossRef]
16. Jung, G.-U.; Jeon, J.-Y.; Hwang, K.-G.; Park, C.-J. Preliminary evaluation of a three-dimensional, customized, and preformed titanium mesh in peri-implant alveolar bone regeneration. J. Korean Assoc. Oral Maxillofac. Surg. 2014, 40, 181. [CrossRef]
17. Lee, S.-H.; Moon, J.-H.; Jeong, C.-M.; Bae, E.-B.; Park, C.-E.; Jeon, G.-R.; Lee, J.-J.; Jeon, Y.-C.; Huh, J.-B. The mechanical properties and biometrical effect of 3D preformed titanium membrane for guided bone regeneration on alveolar bone defect. BioMed Res. Int. 2017, 2017, 7102123. [CrossRef]
18. Tallarico, M.; Ceruso, F.M.; Muzzi, L.; Meloni, S.M.; Kim, Y.-J.; Gargari, M.; Martinolli, M. Effect of simultaneous immediate implant placement and guided bone reconstruction with ultra-fine titanium mesh membranes on radiographic and clinical parameters after 18 months of loading. Materials 2019, 12, 1710. [CrossRef] [PubMed]
19. Fontana, F.; Maschera, E.; Rocchietta, I.; Simion, M. Clinical classification of complications in guided bone regeneration procedures by means of a nonresorbable membrane. Int. J. Periodontics Restor. Dent. 2011, 31, 265. Materials 2022, 15, 5294 12 of 12
20. Liyanage, L.; Lee, N.J.; Cook, T.; Herrmann, H.C.; Jagasia, D.; Litt, H.; Han, Y. The impact of gender on cardiovascular system calcification in very elderly patients with severe aortic stenosis. Int. J. Cardiovasc. Imaging 2016, 32, 173–179. [CrossRef]
21. Lodewick,T.M.; Arnoldussen, C.W.; Lahaye, M.J.; van Mierlo, K.M.; Neumann, U.P.; Beets-Tan, R.G.; Dejong, C.H.; van Dam, R.M. Fast and accurate liver volumetry prior to hepatectomy. HPB 2016, 18, 764–772. [CrossRef] [PubMed]
22. Pang, K.-M.; Lee, J.-K.; Choi, S.-H.; Kim, Y.-K.; Kim, B.-J.; Lee, J.-H. Maxillary sinus augmentation with calcium phosphate double-coated anorganic bovine bone: Comparative multicenter randomized clinical trial with histological and radiographic evaluation. Implant. Dent. 2019, 28, 39–45. [CrossRef] [PubMed]
23. Ohe,J.Y.; Kim, G.T.; Lee, J.W.; Al Nawas, B.; Jung, J.; Kwon, Y.D. Volume stability of hydroxyapatite and-tricalcium phosphate biphasic bone graft material in maxillary sinus floor elevation: A radiographic study using 3D cone beam computed tomography. Clin. Oral Implant. Res. 2016, 27, 348–353. [CrossRef] [PubMed]
24. Mir-Mari, J.; Wui, H.; Jung, R.E.; Hämmerle, C.H.; Benic, G.I. Influence of blinded wound closure on the volume stability of different GBR materials: An in vitro cone-beam computed tomographic examination. Clin. Oral Implant. Res. 2016, 27, 258–265. [CrossRef] [PubMed] 25. Mir-Mari, J.; Benic, G.I.; Valmaseda-Castellón, E.; Hämmerle, C.H.; Jung, R.E. Influence of wound closure on the volume stability of particulate and non-particulate GBR materials: An in vitro cone-beam computed tomographic examination. Part II. Clin. Oral Implant. Res. 2017, 28, 631–639. [CrossRef] [PubMed]
26. Esposito, M.; Maghaireh, H.; Grusovin, M.G.; Ziounas, I.; Worthington, H.V. Soft tissue management for dental implants: What are the most effective techniques? A Cochrane systematic review. Eur. J. Oral. Implant. 2012, 5, 221–238.
27. Jemt, T. Implant failures and age at the time of surgery: A retrospective study on implant treatment in 2915 partially edentulous jaws. Clin. Implant. Dent. Relat. Res. 2019, 21, 686–692. [CrossRef] [PubMed]
28. Jensen, S.S.; Terheyden, H. Bone augmentation procedures in localized defects in the alveolar ridge: Clinical results with different bone grafts and bone-substitute materials. Int. J. Oral Maxillofac. Implant. 2009, 24, 218–236.
29. Scheyer, E.T.; Heard, R.; Janakievski, J.; Mandelaris, G.; Nevins, M.L.; Pickering, S.R.; Richardson, C.R.; Pope, B.; Toback, G.; Velásquez, D.; et al. A randomized, controlled, multicentre clinical trial of post-extraction alveolar ridge preservation. J. Clin. Periodontol. 2016, 43, 1188–1199. [CrossRef]
30. Wang, H.-L.; Misch, C.; Neiva, R.F. “Sandwich” bone augmentation technique: Rationale and report of pilot cases. Int. J. Periodontics Restor. Dent. 2004, 24, 232–245.
31. Sarnachiaro, G.O.; Chu, S.J.; Sarnachiaro, E.; Gotta, S.L.; Tarnow, D.P. Immediate implant placement into extraction sockets with labial plate dehiscence defects: A clinical case series. Clin. Implant. Dent. Relat. Res. 2016, 18, 821–829. [CrossRef]
32. Meloni, S.M.; Jovanovic, S.A.; Urban, I.; Baldoni, E.; Pisano, M.; Tallarico, M. Horizontal ridge augmentation using GBR with a native collagen membrane and 1:1 ratio of particulate xenograft and autologous bone: A 3-year after final loading prospective clinical study. Clin. Implant. Dent. Relat. Res. 2019, 21, 669–677. [CrossRef] [PubMed]
33. Cucchi, A.; Sartori, M.; Parrilli, A.; Aldini, N.N.; Vignudelli, E.; Corinaldesi, G. Histological and histomorphometric analysis of bone tissue after guided bone regeneration with non-resorbable membranes vs resorbable membranes and titanium mesh. Clin. Implant. Dent. Relat. Res. 2019, 21, 693–701. [CrossRef]
34. Proussaefs, P.; Lozada, J. Use of titanium mesh for staged localized alveolar ridge augmentation: Clinical and histologic histomorphometric evaluation. J. Oral Implantol. 2006, 32, 237–247. [CrossRef]
35. Sagheb, K.; Schiegnitz, E.; Moergel, M.; Walter, C.; Al-Nawas, B.; Wagner, W. Clinical outcome of alveolar ridge augmentation with individualized CAD-CAM-produced titanium mesh. Int. J. Implant. Dent. 2017, 3, 1–7. [CrossRef] [PubMed]
Реклама ООО "Осстем", erid:2VtzqwZTQyU





























































































































































0 комментариев