Полость синуса представляет собой один из наименее васкуляризованных участков челюстно-лицевой области, и, как следствие этого – для заживления раны после выполнения процедуры субантральной аугментации требуется более длительный период времени, что, в свою очередь, повышает риск развития осложнений и клинической неудачи проведённого лечения. Данный участок является также проблемным не только из-за распространенного дефицита костной поддержки, но и из-за уменьшенного количества защитных иммунных клеток (лейкоцитов), что повышает возможность развития в области синуса различных инфекционных поражений.

Хотя PRP широко используется в стоматологии при выполнении регенеративных процедур (также в сочетании со стромальными клетками костного мозга), она, однако, характеризуется наличием двух основных недостатков. Во-первых, для приготовления PRP необходимо как минимум два цикла центрифугирования, что занимает около 30 минут времени. Во-вторых, для предупреждения коагуляции в ходе циклов центрифугирования, необходимо дополнительно использовать антикоагулянты, которые влияют на процесс естественного заживления раны.
Учитывая эти недостатки, Choukroun в 2001 году разработал тромбоцитарный концентрат второго поколения, который представлял собой фибрин, обогащенный тромбоцитами (PRF), который не требовал использования антикоагулянтов. PRF также отличался необходимостью проведения лишь одной процедуры центрифугирования – 8-12 минут. После центрифугирования забирали верхний слой плазмы с высокой концентрацией тромбоцитов, лейкоцитов и факторов роста. Последние из структуры фибрина выделяются гораздо медленнее на протяжении довольно длительного периода времени, в то время как из структуры плазмы они выделяются почти сразу на протяжении нескольких минут/часов. Долгосрочное выделение факторов роста более позитивно влияет на механизм клеточного взаимодействия, способствует реализации процессов миграции и дифференциации клеток. Учитывая эти преимущества PRF, в последнее время данный тромбоцитарный концентрат начал использоваться как в качестве основного материала для аугментации, так и в комбинации с другими костными заменителями. В данное время всем уже понятно, что PRF улучшает процесс регенерации полости пазухи, нерешенным остается лишь аспект изолированного или комбинированного применения фибрина в ходе процедуры субантральной аугментации.
Синус-лифт с использованием обогащенного тромбоцитами фибрина
Биологические преимущества использования PRF для процедуры синус-лифта предварительно уже были доказаны в ходе многих исследований. PRF служит своеобразным каркасом, который обеспечивает защиту Шнейдеровой мембраны, и при этом может быть смешан с другими костными заменителями, повышая как свою, так и их размерную и локальную стабильность. Кроме того, фибрин способствует увеличению васкуляризации области камеры пазухи (фото 1-3).
Фото 1. Обычно полученные PRF-мембраны после центрифугирования сегментируют на небольшие фрагменты.
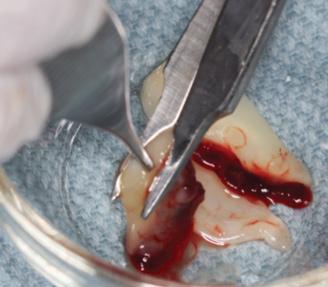
Фото 2. Вид PRF-мембраны, порезанной на сегменты около 1 мм в размере.
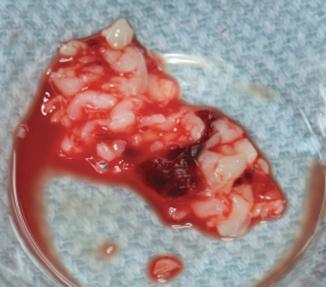
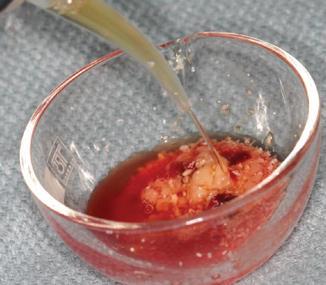
Фото 3. Смешивание PRF с костным трансплантатом.
Фактором, определяющим изолированный или комбинированный характер применения PRF, является размер гайморовой пазухи. Некоторые исследования указывают на возможность восстановления до 7,5 мм костной ткани при изолированном использовании PRF в ходе субантральной аугментации. Однако большинство подобных исследований не являлись достаточно объективными, а также не придерживались строгого протокола проведения или отбора пациентов. Большинство из них представлены сериями клинических случаев или даже отдельными клиническими случаями, где не уделено достаточно внимания фактору размера пазухи, как основному влияющему на алгоритм комплексного лечения.
При проведении субантральной аугментации посредством PRF клиницист должен учитывать роль нескольких влияющих факторов. Во-первых, если PRF используется в качестве основного материала для аугментации, в таком случае необходимо одновременно проводить и процедуру дентальной аугментации. В противном случае прогрессирует резорбция фибрина на протяжении 10-14 дней. То есть поверхность имплантата обеспечивает лучшую ретенцию тромбоцитарного концентрата. Остеоиндуктивные свойства PRF являются ограниченными, а его основная роль состоит в быстрой стимуляции костного формирования и кровоснабжения. При отсутствии же остеоиндуктивной поверхности имплантата или костного заменителя не удастся добиться необходимых результатов реконструкции костного гребня. Кроме того, геометрия имплантата является формирователем пространства, обеспечивающего объем для дальнейшего его заполнения костной тканью. Такие выводы согласуются с результатами, которые были получены в недавнем систематическом обзоре: ученым удалось установить, что сформированный вокруг дентального имплантата кровяной сгусток способствует формирования новой костной ткани, если удалось добиться надлежащей первичной стабильности титановой инфраконструкции.
PRF нежелательно использовать изолированно при широком объеме синуса, поскольку данные, полученные Avila, указывают на то, что процедуры аугментации в области пазух маленького и среднего размера (менее 10 мм или в диапазоне 10-15 мм) позволяют добиться в три раза большего формирования костной ткани, чем аналогичные процедуры, выполненные в области пазух размером более 15 мм (фото 4). Исходя из этого, рекомендовано проводить процедуры синус-лифта в области пазух размером более 15 мм при помощи PRF в комбинации с разными видами костных заменителей (фото 5-6). При размере пазухи менее 10 мм PRF является прогнозированным материалом для восстановления объема утраченной кости. Что же касается пазух размером 10-15 мм – то аугментации в области таковых нужно проводить с огромной осторожностью, учитывая все нюансы еще на этапе планирования. При реализации подобных вмешательств можно использовать адаптированы подходы ятрогенных вмешательств, предусматривающие применение специальных боров или же инструментов в ходе подготовки костного ложа (фото 7-8). В 2015 году был проведен систематический обзор, который оценивал успешность использования PRF в ходе выполнения процедур синус-лифта. Несмотря на то, что авторами изначально было найдено 290 исследований, посвященных изучению данного вопроса, только восемь из них являлись достаточно доказательными и характеризовались наличием групп сравнения. Полученные в ходе анализа результаты были весьма вариабельные, поскольку изначально отличались сами процедуры вмешательства, протоколы дальнейшей установки имплантатов, данные, полученные в ходе биопсии, и факты проведения контрольных гистологических исследований. Такие различия исключают возможность разработки единственного идеального подхода применения PRF в структуре проведения процедуры синус-лифта. Логический алгоритм выбора PRF для применения в ходе процедуры субантральной аугментации может быть описан следующим образом.
Фото 4. Измерение ширины гайморовой пазухи на КЛКТ-срезах. Параметры ширины пазухи являются критериями дл аргументации применения PRF.
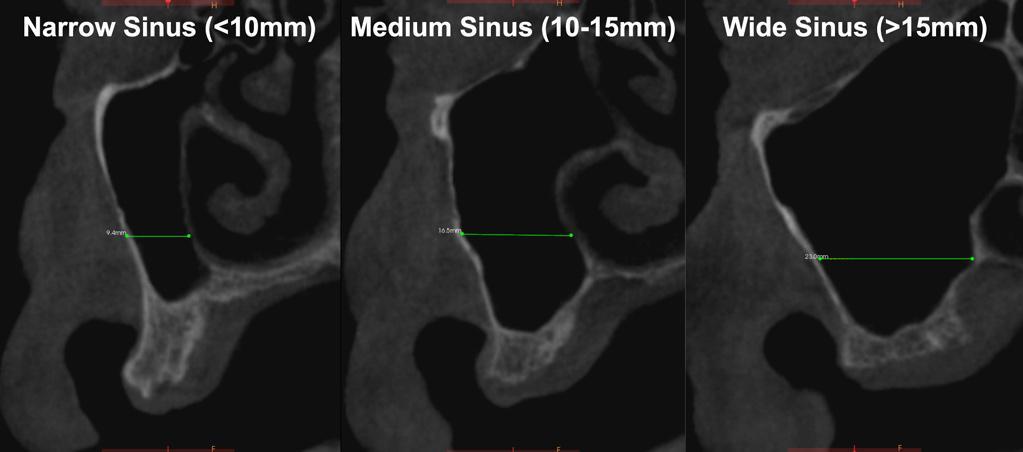
Фото 5. Заполнение полости синуса среднего размера смесью PRF и костного трансплантата.
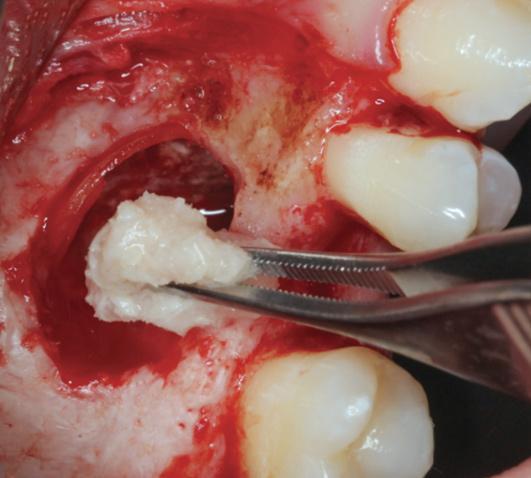
Фото 6. Упаковка смеси PRF и костного материала является довольно простой процедурой из-за специфической консистенции смеси.
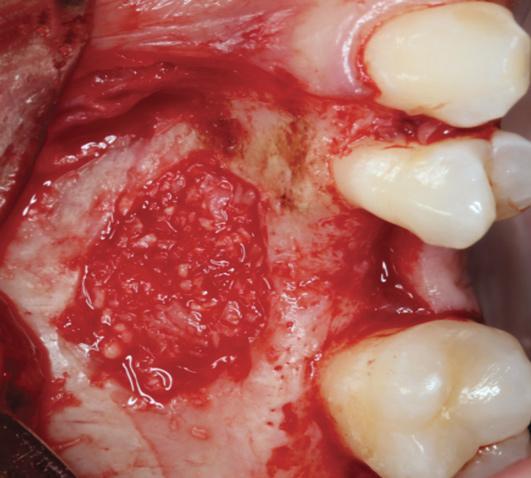
Фото 7. Бор для конденсации кости в области остеотомии.
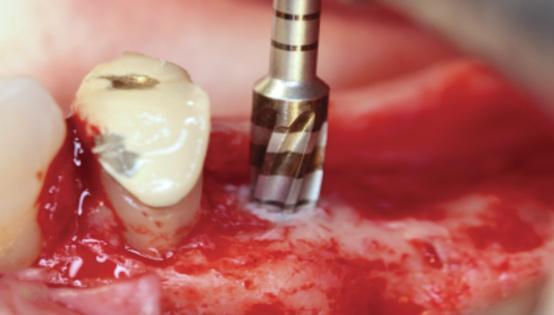
Фото 8. Боры с функцией конденсации кости могут быть успешно использованы в ходе процедуры синус-лифта.
Если ширина синуса менее 10 мм, можно прогнозировано использовать фибрин для достижения необходимых результатов реконструкции костного гребня. Если же ширина пазухи более 15 мм рекомендовано смешивать PRF с костным трансплантатом. Когда же размер пазухи в щечно-небном направлении колеблется от 10 мм до 15 мм, клиницист может смешать PRF с костным аугментатом, но выбор стоит делать, исходя из собственного опыта предварительного применения PRF в аналогичных ситуациях.
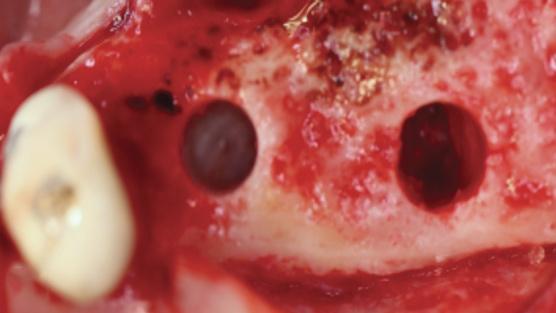
Кроме того, авторы рекомендуют учитывать специфику проведения хирургической процедуры. Если синус-лифт выполняют через боковое окно и отмечаются признаки разрыва Шнайдеровой мембраны, область дефекта следует перекрыть PRF и сверху – еще 2 PRF-мембранами, если размер такого дефекта менее 5 мм. Если же размер дефекта мембраны превышает 5 мм, его следует сначала перекрыть коллагеновой мембраной, а потом и PRF-мембраной. При целостном состоянии Шнейдеровой мембраны в субантральную область можно запаковать 2 PRF-мембраны. При формировании латерального окна также следует учитывать время установки имплантатов: при отсроченном протоколе используют PRF с костным аугментатом, а процедуру имплантации выполняют через 6-8 месяцев после заживления; при реализации протокола немедленной имплантации и ширине синуса менее 10 мм используют только PRF-мембрану, если же ширина пазухи более 10 мм – дополнительно применяют костный трансплантат. При транскрестальном доступе к пазухе определяют необходимость упаковки костного трансплантата, и при наличие таковой сначала позиционируют 2 PRF-мембраны для защиты слизистой дна пазухи, потом уплотняют костный заменитель, смешанный с PRF, и уже после проводят установку титановой инфраконстуркции. При отсутствии необходимости упаковки костного аугментата после формирования транскрестального доступа к пазухе применяют две PRF-мембраны для защиты Шнейдеровой мембраны и сразу проводят установку имплантата. Но для формулирования более детализированных рекомендаций по этому поводу необходимо проведение дальнейших клинических исследований. В качестве подходящего костного заменителя авторы рекомендуют использовать смесь минерализованного аллотрансплантата (лиофилизированного костного аллотрансплантата [FDBA] - 50/50 смесь кортикогубчатого трансплантата) и нерезорбируемого ксенографта в соотношении 1:1. FDBA индуцирует образование новой кости, в то время как нерезорбируемый ксенотрансплантат обеспечивает ретенцию необходимого объема.
Фибрин, обогащенный тромбоцитами, для реконструкции перфораций Шнейдеровой мембраны
PRF также полноценно может использоваться для реконструкции перфораций слизистой дна гайморовой пазухи (фото 11-12). Распространенность подобных осложнений достигает 20%, и обычно для закрытия дефектов мембраны использовались коллагеновые мембраны. Однако, PRF, учитывая его природную «липкость», является достойной альтернативой коллагеновой резорбируемой мембране. Кроме того, использование PRF уменьшает цену процедуры закрытия перфорации, и, в отличие от синтезированного коллагена, фибрин – полностью натурален и аутологичен, а значит не может вызвать никакой реакции по типу «реакции на чужеродное тело».
На фото 11 изображена ситуация перекрытия небольшого разрыва Шнейдеровой мембраны посредством PRF. В случаях, когда размер перфорации превышает 5 мм рекомендуется все же использовать коллагеновый аналог. При надрывах менее 5 мм использование PRF способствует регенерации области поражения и также является более мануально-простой и технически доступной процедурой. Кроме того, в случаях больших разрывов можно применять несколько слоев PRF мембран, и цена лечения при этом, по сути, не увеличивается, поскольку все они приготавливаются с порций крови, собранной у пациента. Учитывая, что период деградации PRF составляет 10-14 дней, целесообразно упаковывать несколько слоев фибрина для полноценного перекрытия участка разрыва слизистой (фото 9). Таким образом, также удается минимизировать риск развития синусита после процедуры имплантации, который ассоциирован со значительным уровнем пневматизации пазухи и дефицитом необходимого костного объема.
Фото 9. Алгоритм выбора алгоритма лечения с использованием PRF.
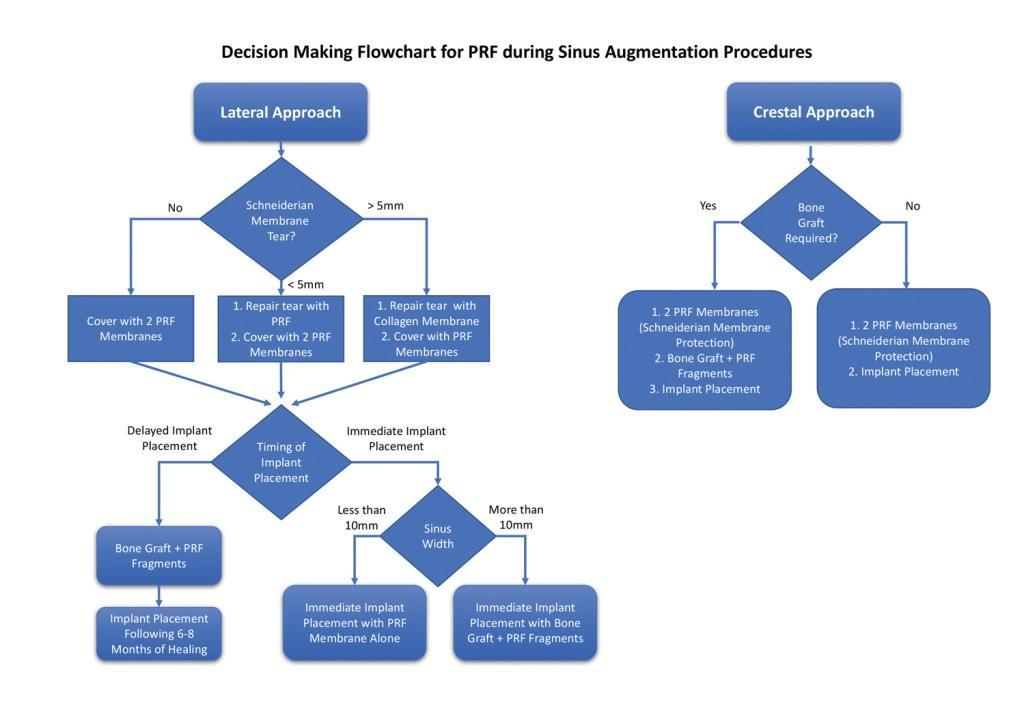
Фото 10. Вид небольшой перфорации Шнайдеровой мембраны.
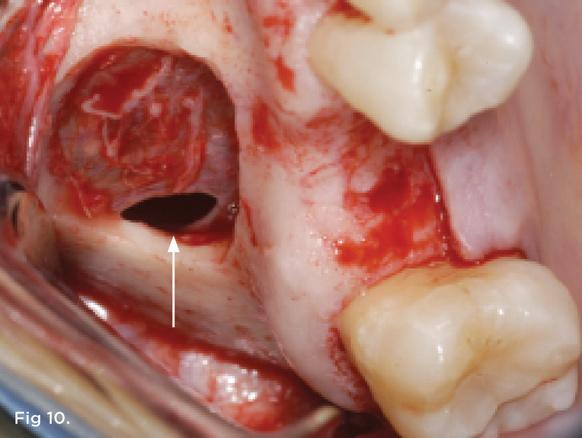
Фото 11. Покрытие перфорации мембраны Шнайдера PRF.
Фибрин, обогащенный тромбоцитами, при процедуре синус-лифта через латеральное окно
Учитывая, что PRF также проявляет заметный эффект и относительно мягких тканей, было предложено использовать его в качестве материала для изоляции после субантральной аугментации через латеральное окно (фото 12-13). В двух проведенных исследованиях PRF –мембраны оказались настолько же эффективны, как и их коллагеновые аналоги при использовании для перекрытия латерального доступа. Дилемма состоит лишь в том, что PRF резорбируется через 10-14 дней, поэтому насколько подобный барьер является эффективным по отношению к мягким тканям – пока не понятно. Учитывая эти факты, коллагеновая мембрана продолжает использоваться в качестве основного изолирующего материала при закрытие латерального костного окна после проведения субантральной аугментации, PRF же в свою очередь может использоваться и как дополнительное средство для стимуляции процесса заживления и ангиогенеза (фото 14).
Фото 12. Субантральная аугментация через латеральный доступ с помощью смеси PRF и костного аугментата.
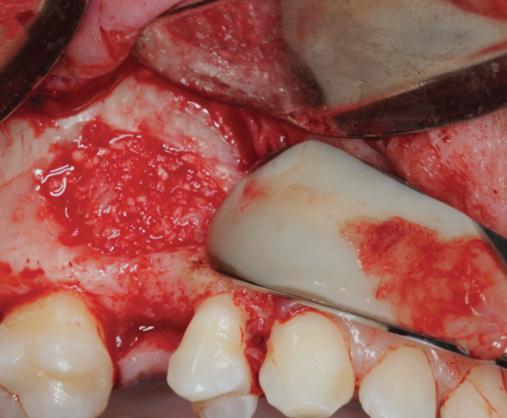
Фото 13. Покрытие области доступа PRF-мембраной.
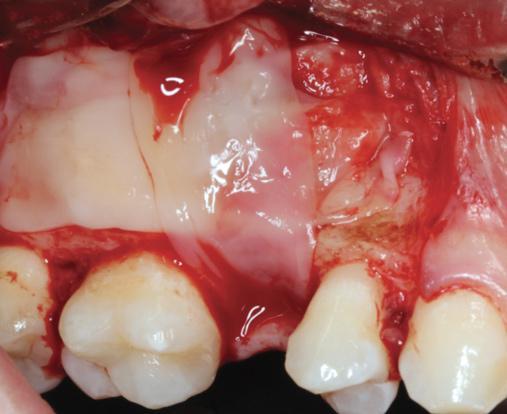
Фото 14. PRF-мембраной перекрывают коллагеновую мембрану.
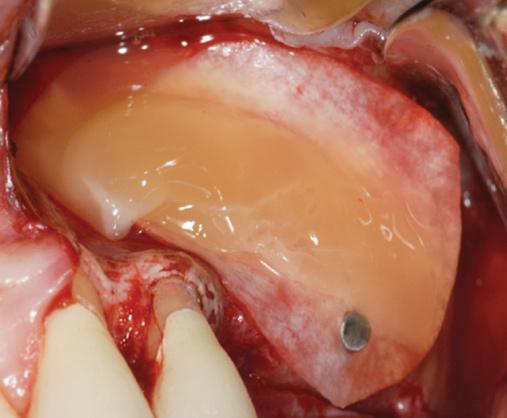
Прогнозируемость регенерации синуса при использовании PRF
Регенерация пневматизированного синуса после потери зубов является часто выполняемой хирургически корректируемой процедурой, которая является достаточно продолжительной во времени, учитывая низкий уровень васкуляризации пазухи по сравнению с другими органами ротовой полости. Применение PRF ускоряет процесс ангиогенеза, и, таким образом, стимулирует более быстрое образование костной ткани. Но цель данной статьи состоит не в дискуссии хирургических концепций выполнения синус-лифта и оценки их исходов, а в конкретном обсуждении необходимости и возможности применения PRF в разных клинических ситуациях. При реализации отстроченного протокола имплантации в ходе синус-лифта PRF всегда используют с костным заменителем. В подобных случаях использовать в качестве аугментата лишь PRF категорически нельзя. Также фактором, влияющим на целесообразность и технику упаковки PRF, является щечно-небный размер пазухи. Когда ширина синуса превышает 10 мм, рекомендовано смешивать PRF вместе с костным аугментатом, в случаях же, когда ширина пазухи составляет менее 10 мм, – PRF можно использовать как изолированный материал для аугментации. Аналогична ситуация и при разрывах слизистой пазухи: когда размеры дефекта менее 5 мм его можно закрыть PRF-мембраной, когда же размеры разрыва превышают 5 мм – дефект дополнительно закрывают коллагеновой мембраной, а потом – и PRF (фото 9). При формировании транскрестального доступа, перед упаковкой аугментата или установкой имплантата, всегда рекомендуется позиционировать две PRF–мембраны. Таким образом удается максимально защитить поверх лежащую Шнайдеровую мембрану (фото 15).
Фото 15. Пример использования PRF при транскрестальном синус-лифте: сгусток проталкивают в область остеотомии.
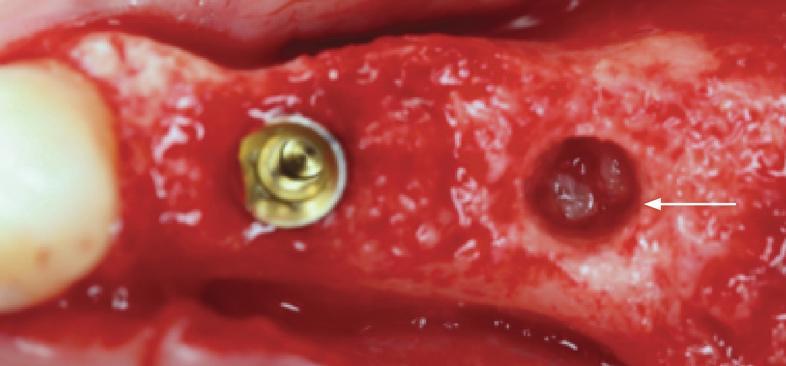
Биологические каркасы из PRF играют роль не только активных биоматериалов, которые улучшают васкуляризацию, но также минимизируют потенциальный риск развития разрывов и перфораций слизистой гайморовой пазухи. Кроме того, PRF обеспечивает инкорпорацию лейкоцитов, которые, кроме участия в секреции факторов роста, также обеспечивают профилактику развития бактериальных инфекций. В контролируемом исследовании по использованию PRF для упаковки в область постэкстракционной лунки нижнего третьего моляра удалось установить, что такой подход позволяет в 9,5 раз снизить риск развития инфекции, а также других осложнений в форме сухой лунки.
Применение PRF вместе с анальгетиками после хирургического вмешательства позволяет также снизить уровень болезненных ощущений среди реабилитируемых пациентов. Таким образом, дальнейшие применение PRF в клинической стоматологической практике, особенно в случаях проведения процедуры синус-лифта, представляет собой значительный научный и практический интерес. Рекомендации, приведенные в данной статье, способствуют максимизации результатов хирургических вмешательства, направленных на формирование необходимых параметров мягких и твердых тканей в области имплантации.
Выводы
Использование PRF в ходе проведения субантральной аугментации в последние годы приобрело значительную распространённость в стоматологической практике, поскольку подобная процедура является относительно дешевой и предусматривает применение полностью аутологического биологического материала. В данной статье резюмированы рекомендации по клиническому применению фибрина, обогащенного тромбоцитами, а также приведен анализ эффективности хирургических подходов, предусматривающих использование PRF и других костных аугментатов, а также коллагеновых мембран. Кроме того, приведены конкретные примеры и показания использования PRF при различных доступах к области Шнайдеровой мембраны, и даже в случаях отдельных хирургических осложнений.
Авторы:
Richard J. Miron, Dr. Med. Dent., DDS, PhD
Michael A. Pikos, DDS
Полость синуса представляет собой один из наименее васкуляризованных участков челюстно-лицевой области, и, как следствие этого – для заживления раны после выполнения процедуры субантральной аугментации требуется более длительный период времени, что, в свою очередь, повышает риск развития осложнений и клинической неудачи проведённого лечения. Данный участок является также проблемным не только из-за распространенного дефицита костной поддержки, но и из-за уменьшенного количества защитных иммунных клеток (лейкоцитов), что повышает возможность развития в области синуса различных инфекционных поражений.

Хотя PRP широко используется в стоматологии при выполнении регенеративных процедур (также в сочетании со стромальными клетками костного мозга), она, однако, характеризуется наличием двух основных недостатков. Во-первых, для приготовления PRP необходимо как минимум два цикла центрифугирования, что занимает около 30 минут времени. Во-вторых, для предупреждения коагуляции в ходе циклов центрифугирования, необходимо дополнительно использовать антикоагулянты, которые влияют на процесс естественного заживления раны.
Учитывая эти недостатки, Choukroun в 2001 году разработал тромбоцитарный концентрат второго поколения, который представлял собой фибрин, обогащенный тромбоцитами (PRF), который не требовал использования антикоагулянтов. PRF также отличался необходимостью проведения лишь одной процедуры центрифугирования – 8-12 минут. После центрифугирования забирали верхний слой плазмы с высокой концентрацией тромбоцитов, лейкоцитов и факторов роста. Последние из структуры фибрина выделяются гораздо медленнее на протяжении довольно длительного периода времени, в то время как из структуры плазмы они выделяются почти сразу на протяжении нескольких минут/часов. Долгосрочное выделение факторов роста более позитивно влияет на механизм клеточного взаимодействия, способствует реализации процессов миграции и дифференциации клеток. Учитывая эти преимущества PRF, в последнее время данный тромбоцитарный концентрат начал использоваться как в качестве основного материала для аугментации, так и в комбинации с другими костными заменителями. В данное время всем уже понятно, что PRF улучшает процесс регенерации полости пазухи, нерешенным остается лишь аспект изолированного или комбинированного применения фибрина в ходе процедуры субантральной аугментации.
Синус-лифт с использованием обогащенного тромбоцитами фибрина
Биологические преимущества использования PRF для процедуры синус-лифта предварительно уже были доказаны в ходе многих исследований. PRF служит своеобразным каркасом, который обеспечивает защиту Шнейдеровой мембраны, и при этом может быть смешан с другими костными заменителями, повышая как свою, так и их размерную и локальную стабильность. Кроме того, фибрин способствует увеличению васкуляризации области камеры пазухи (фото 1-3).
Фото 1. Обычно полученные PRF-мембраны после центрифугирования сегментируют на небольшие фрагменты.

Фото 2. Вид PRF-мембраны, порезанной на сегменты около 1 мм в размере.

Фото 3. Смешивание PRF с костным трансплантатом.

Фактором, определяющим изолированный или комбинированный характер применения PRF, является размер гайморовой пазухи. Некоторые исследования указывают на возможность восстановления до 7,5 мм костной ткани при изолированном использовании PRF в ходе субантральной аугментации. Однако большинство подобных исследований не являлись достаточно объективными, а также не придерживались строгого протокола проведения или отбора пациентов. Большинство из них представлены сериями клинических случаев или даже отдельными клиническими случаями, где не уделено достаточно внимания фактору размера пазухи, как основному влияющему на алгоритм комплексного лечения.
При проведении субантральной аугментации посредством PRF клиницист должен учитывать роль нескольких влияющих факторов. Во-первых, если PRF используется в качестве основного материала для аугментации, в таком случае необходимо одновременно проводить и процедуру дентальной аугментации. В противном случае прогрессирует резорбция фибрина на протяжении 10-14 дней. То есть поверхность имплантата обеспечивает лучшую ретенцию тромбоцитарного концентрата. Остеоиндуктивные свойства PRF являются ограниченными, а его основная роль состоит в быстрой стимуляции костного формирования и кровоснабжения. При отсутствии же остеоиндуктивной поверхности имплантата или костного заменителя не удастся добиться необходимых результатов реконструкции костного гребня. Кроме того, геометрия имплантата является формирователем пространства, обеспечивающего объем для дальнейшего его заполнения костной тканью. Такие выводы согласуются с результатами, которые были получены в недавнем систематическом обзоре: ученым удалось установить, что сформированный вокруг дентального имплантата кровяной сгусток способствует формирования новой костной ткани, если удалось добиться надлежащей первичной стабильности титановой инфраконструкции.
PRF нежелательно использовать изолированно при широком объеме синуса, поскольку данные, полученные Avila, указывают на то, что процедуры аугментации в области пазух маленького и среднего размера (менее 10 мм или в диапазоне 10-15 мм) позволяют добиться в три раза большего формирования костной ткани, чем аналогичные процедуры, выполненные в области пазух размером более 15 мм (фото 4). Исходя из этого, рекомендовано проводить процедуры синус-лифта в области пазух размером более 15 мм при помощи PRF в комбинации с разными видами костных заменителей (фото 5-6). При размере пазухи менее 10 мм PRF является прогнозированным материалом для восстановления объема утраченной кости. Что же касается пазух размером 10-15 мм – то аугментации в области таковых нужно проводить с огромной осторожностью, учитывая все нюансы еще на этапе планирования. При реализации подобных вмешательств можно использовать адаптированы подходы ятрогенных вмешательств, предусматривающие применение специальных боров или же инструментов в ходе подготовки костного ложа (фото 7-8). В 2015 году был проведен систематический обзор, который оценивал успешность использования PRF в ходе выполнения процедур синус-лифта. Несмотря на то, что авторами изначально было найдено 290 исследований, посвященных изучению данного вопроса, только восемь из них являлись достаточно доказательными и характеризовались наличием групп сравнения. Полученные в ходе анализа результаты были весьма вариабельные, поскольку изначально отличались сами процедуры вмешательства, протоколы дальнейшей установки имплантатов, данные, полученные в ходе биопсии, и факты проведения контрольных гистологических исследований. Такие различия исключают возможность разработки единственного идеального подхода применения PRF в структуре проведения процедуры синус-лифта. Логический алгоритм выбора PRF для применения в ходе процедуры субантральной аугментации может быть описан следующим образом.
Фото 4. Измерение ширины гайморовой пазухи на КЛКТ-срезах. Параметры ширины пазухи являются критериями дл аргументации применения PRF.

Фото 5. Заполнение полости синуса среднего размера смесью PRF и костного трансплантата.

Фото 6. Упаковка смеси PRF и костного материала является довольно простой процедурой из-за специфической консистенции смеси.

Фото 7. Бор для конденсации кости в области остеотомии.

Фото 8. Боры с функцией конденсации кости могут быть успешно использованы в ходе процедуры синус-лифта.

Если ширина синуса менее 10 мм, можно прогнозировано использовать фибрин для достижения необходимых результатов реконструкции костного гребня. Если же ширина пазухи более 15 мм рекомендовано смешивать PRF с костным трансплантатом. Когда же размер пазухи в щечно-небном направлении колеблется от 10 мм до 15 мм, клиницист может смешать PRF с костным аугментатом, но выбор стоит делать, исходя из собственного опыта предварительного применения PRF в аналогичных ситуациях.
Кроме того, авторы рекомендуют учитывать специфику проведения хирургической процедуры. Если синус-лифт выполняют через боковое окно и отмечаются признаки разрыва Шнайдеровой мембраны, область дефекта следует перекрыть PRF и сверху – еще 2 PRF-мембранами, если размер такого дефекта менее 5 мм. Если же размер дефекта мембраны превышает 5 мм, его следует сначала перекрыть коллагеновой мембраной, а потом и PRF-мембраной. При целостном состоянии Шнейдеровой мембраны в субантральную область можно запаковать 2 PRF-мембраны. При формировании латерального окна также следует учитывать время установки имплантатов: при отсроченном протоколе используют PRF с костным аугментатом, а процедуру имплантации выполняют через 6-8 месяцев после заживления; при реализации протокола немедленной имплантации и ширине синуса менее 10 мм используют только PRF-мембрану, если же ширина пазухи более 10 мм – дополнительно применяют костный трансплантат. При транскрестальном доступе к пазухе определяют необходимость упаковки костного трансплантата, и при наличие таковой сначала позиционируют 2 PRF-мембраны для защиты слизистой дна пазухи, потом уплотняют костный заменитель, смешанный с PRF, и уже после проводят установку титановой инфраконстуркции. При отсутствии необходимости упаковки костного аугментата после формирования транскрестального доступа к пазухе применяют две PRF-мембраны для защиты Шнейдеровой мембраны и сразу проводят установку имплантата. Но для формулирования более детализированных рекомендаций по этому поводу необходимо проведение дальнейших клинических исследований. В качестве подходящего костного заменителя авторы рекомендуют использовать смесь минерализованного аллотрансплантата (лиофилизированного костного аллотрансплантата [FDBA] - 50/50 смесь кортикогубчатого трансплантата) и нерезорбируемого ксенографта в соотношении 1:1. FDBA индуцирует образование новой кости, в то время как нерезорбируемый ксенотрансплантат обеспечивает ретенцию необходимого объема.
Фибрин, обогащенный тромбоцитами, для реконструкции перфораций Шнейдеровой мембраны
PRF также полноценно может использоваться для реконструкции перфораций слизистой дна гайморовой пазухи (фото 11-12). Распространенность подобных осложнений достигает 20%, и обычно для закрытия дефектов мембраны использовались коллагеновые мембраны. Однако, PRF, учитывая его природную «липкость», является достойной альтернативой коллагеновой резорбируемой мембране. Кроме того, использование PRF уменьшает цену процедуры закрытия перфорации, и, в отличие от синтезированного коллагена, фибрин – полностью натурален и аутологичен, а значит не может вызвать никакой реакции по типу «реакции на чужеродное тело».
На фото 11 изображена ситуация перекрытия небольшого разрыва Шнейдеровой мембраны посредством PRF. В случаях, когда размер перфорации превышает 5 мм рекомендуется все же использовать коллагеновый аналог. При надрывах менее 5 мм использование PRF способствует регенерации области поражения и также является более мануально-простой и технически доступной процедурой. Кроме того, в случаях больших разрывов можно применять несколько слоев PRF мембран, и цена лечения при этом, по сути, не увеличивается, поскольку все они приготавливаются с порций крови, собранной у пациента. Учитывая, что период деградации PRF составляет 10-14 дней, целесообразно упаковывать несколько слоев фибрина для полноценного перекрытия участка разрыва слизистой (фото 9). Таким образом, также удается минимизировать риск развития синусита после процедуры имплантации, который ассоциирован со значительным уровнем пневматизации пазухи и дефицитом необходимого костного объема.
Фото 9. Алгоритм выбора алгоритма лечения с использованием PRF.

Фото 10. Вид небольшой перфорации Шнайдеровой мембраны.

Фото 11. Покрытие перфорации мембраны Шнайдера PRF.

Фибрин, обогащенный тромбоцитами, при процедуре синус-лифта через латеральное окно
Учитывая, что PRF также проявляет заметный эффект и относительно мягких тканей, было предложено использовать его в качестве материала для изоляции после субантральной аугментации через латеральное окно (фото 12-13). В двух проведенных исследованиях PRF –мембраны оказались настолько же эффективны, как и их коллагеновые аналоги при использовании для перекрытия латерального доступа. Дилемма состоит лишь в том, что PRF резорбируется через 10-14 дней, поэтому насколько подобный барьер является эффективным по отношению к мягким тканям – пока не понятно. Учитывая эти факты, коллагеновая мембрана продолжает использоваться в качестве основного изолирующего материала при закрытие латерального костного окна после проведения субантральной аугментации, PRF же в свою очередь может использоваться и как дополнительное средство для стимуляции процесса заживления и ангиогенеза (фото 14).
Фото 12. Субантральная аугментация через латеральный доступ с помощью смеси PRF и костного аугментата.

Фото 13. Покрытие области доступа PRF-мембраной.

Фото 14. PRF-мембраной перекрывают коллагеновую мембрану.

Прогнозируемость регенерации синуса при использовании PRF
Регенерация пневматизированного синуса после потери зубов является часто выполняемой хирургически корректируемой процедурой, которая является достаточно продолжительной во времени, учитывая низкий уровень васкуляризации пазухи по сравнению с другими органами ротовой полости. Применение PRF ускоряет процесс ангиогенеза, и, таким образом, стимулирует более быстрое образование костной ткани. Но цель данной статьи состоит не в дискуссии хирургических концепций выполнения синус-лифта и оценки их исходов, а в конкретном обсуждении необходимости и возможности применения PRF в разных клинических ситуациях. При реализации отстроченного протокола имплантации в ходе синус-лифта PRF всегда используют с костным заменителем. В подобных случаях использовать в качестве аугментата лишь PRF категорически нельзя. Также фактором, влияющим на целесообразность и технику упаковки PRF, является щечно-небный размер пазухи. Когда ширина синуса превышает 10 мм, рекомендовано смешивать PRF вместе с костным аугментатом, в случаях же, когда ширина пазухи составляет менее 10 мм, – PRF можно использовать как изолированный материал для аугментации. Аналогична ситуация и при разрывах слизистой пазухи: когда размеры дефекта менее 5 мм его можно закрыть PRF-мембраной, когда же размеры разрыва превышают 5 мм – дефект дополнительно закрывают коллагеновой мембраной, а потом – и PRF (фото 9). При формировании транскрестального доступа, перед упаковкой аугментата или установкой имплантата, всегда рекомендуется позиционировать две PRF–мембраны. Таким образом удается максимально защитить поверх лежащую Шнайдеровую мембрану (фото 15).
Фото 15. Пример использования PRF при транскрестальном синус-лифте: сгусток проталкивают в область остеотомии.

Биологические каркасы из PRF играют роль не только активных биоматериалов, которые улучшают васкуляризацию, но также минимизируют потенциальный риск развития разрывов и перфораций слизистой гайморовой пазухи. Кроме того, PRF обеспечивает инкорпорацию лейкоцитов, которые, кроме участия в секреции факторов роста, также обеспечивают профилактику развития бактериальных инфекций. В контролируемом исследовании по использованию PRF для упаковки в область постэкстракционной лунки нижнего третьего моляра удалось установить, что такой подход позволяет в 9,5 раз снизить риск развития инфекции, а также других осложнений в форме сухой лунки.
Применение PRF вместе с анальгетиками после хирургического вмешательства позволяет также снизить уровень болезненных ощущений среди реабилитируемых пациентов. Таким образом, дальнейшие применение PRF в клинической стоматологической практике, особенно в случаях проведения процедуры синус-лифта, представляет собой значительный научный и практический интерес. Рекомендации, приведенные в данной статье, способствуют максимизации результатов хирургических вмешательства, направленных на формирование необходимых параметров мягких и твердых тканей в области имплантации.
Выводы
Использование PRF в ходе проведения субантральной аугментации в последние годы приобрело значительную распространённость в стоматологической практике, поскольку подобная процедура является относительно дешевой и предусматривает применение полностью аутологического биологического материала. В данной статье резюмированы рекомендации по клиническому применению фибрина, обогащенного тромбоцитами, а также приведен анализ эффективности хирургических подходов, предусматривающих использование PRF и других костных аугментатов, а также коллагеновых мембран. Кроме того, приведены конкретные примеры и показания использования PRF при различных доступах к области Шнайдеровой мембраны, и даже в случаях отдельных хирургических осложнений.
Авторы:
Richard J. Miron, Dr. Med. Dent., DDS, PhD
Michael A. Pikos, DDS






























































































































































0 комментариев