Одним из условий, которое обеспечивает достижение успешного результата дентальной имплантации, является наличие достаточного объема резидуальной кости в области хирургического вмешательства. С целью улучшения подходов костной пластики было проведено множество исследований, и в данной статье мы представим еще один из методов оптимизации реконструкции альвеолярного гребня с использованием костного трансплантата и соответствующих факторов роста.
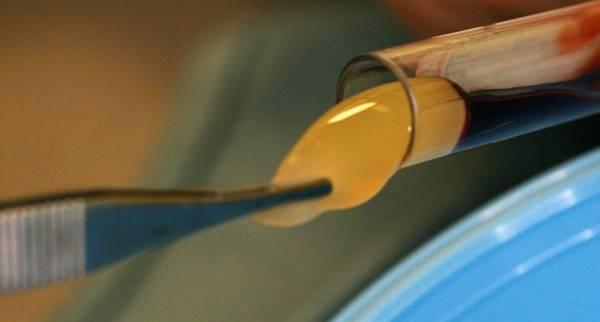
Факторы роста являются биологически активными белками, которые принимают участие в реализации таких биологических процессов, как рост, пролиферация и дифференцирование клеточных структур; кроме того, они могут способствовать восстановлению и регенерации мягких и твердых тканей в процессе их заживления. После связывания со специфическими рецепторами клеточной поверхности, факторы роста могут воздействовать на клетку-мишень посредством сразу нескольких механизмов, стимулируя при этом процессы миграции, деления и дифференциации клеток, а также позитивно влияя на экспрессию белков в области раны в период ее заживления.
Есть восемь основных классов факторов роста, которые синтезируются на разных клеточных уровнях, и эффект каждого из них регулируется комплексной системой обратной биологической связи. Современные достижения в областях клеточной и молекулярной биологии позволили врачам лучше понять механизм действия и вообще функцию факторов роста как биологических агентов. Клинические и лабораторные исследования подтвердили факт стимуляции процессов заживления раны со стороны факторов роста посредством их воздействия на процессы хемоатракции, дифференциации и пролиферации.
Параллельно исследователями был изучен эффект применения факторов роста для лучшей регенерации альвеолярной кости в ходе пародонтологических, реконструктивных и имплантологических манипуляций, а также на этапах предоперационной подготовки. Тромбоциты, выделенные из периферической крови, являются аутологичным источником факторов роста.
В 1974 году Ross и коллеги опубликовали одну из первых работ, описывающих регенеративный потенциал тромбоцитов. В общемедицинских целях данные клетки используются для контроля кровотечения при тромбоцитопении, острых геморрагиях или лейкемии. Использование фибринового клея или адгезива, который в основном состоит из фибриногена и тромбина, помогает инициировать процесс формирования тромбоцитарного концентрата как дополнительной субстанции, используемой в хирургической практике. Кроме того, наличие компонентов крови в области раны, по своей сути, уже способствует ее заживлению даже без какого-либо дополнительного ятрогенного влияния. С другой стороны, протекание процессов репарации и регенерации мягких и твердых тканей после пародонтологических хирургических процедур можно улучшить за счет тромбоцитарных концентратов, поскольку факторы роста, которые выделяются после активации тромбоцитов, стимулируют митогенную реакцию периоста в ходе восстановления костной ткани.
В общей сложности из кровяного сгустка можно получить следующие типы факторов роста:
- трансформирующий фактор роста бета (TGF-b)
- тромбоцитарный факторов роста (PDGF)
- инсулиноподобный фактор роста (ИФР)
- фактор роста сосудистого эндотелия (VEGF),
- эпидермальный фактор роста (ЕGF)
- фактор роста фибробластов-2 (FGF-2)
Тромбоцитарный фактор роста (PDGF), который синтезируется тромбоцитами, моноцитами, макрофагами, эндотелиальными клетками и остеобластами, является широко исследуемым объектом, ценным для клинического применения ввиду своих значительных репарационных свойств. Данный протеин можно найти в костном матриксе, при этом он может высвобождаться тромбоцитами локально во время свертывания крови после травмы мягких или твердых тканей. После выхода из тромбоцитов PDGF связывается со специфическими рецепторами на поверхности клетки и способствует быстрой миграции и пролиферации клеток в поврежденную область. И в лабораторных, и в естественных условиях было установлено, что PDGF является мощным хемотаксическим и митогенным фактором относительно клеток фибробластов периодонтальной связки, цементобластов и остеобластов.
Первоначальная идея состояла в том, чтобы сконцентрировать тромбоциты и их факторы роста в области операционного поля, что, очевидно, должно было бы улучшить процесс заживления. Исследования продемонстрировали перспективные результаты более быстрого заживления раны и регенерации тканей, что, в свою очередь, снижает риск инфицирования, развития комплекса сухой лунки, дезинтеграции имплантатов или материала трансплантата. Подобный алгоритм лечения особенно ценный для людей с диабетом, курильщиков или таковых с острыми или хроническими соматическими заболеваниями. Аутологические концентраты тромбоцитов можно использовать в различных формах. Первое поколение таковых было представлено в форме плазмы, обогащенной тромбоцитами, а также последующего в очереди фибрина, обогащенного тромбоцитами, который представлял уже второе поколение биоматериала.
Плазма, обогащенная тромбоцитами
В 1998 году Marx и коллеги впервые описали применение PRP, которая, по сути, является аутологичным концентратом тромбоцитов в небольшом объеме плазмы после процедуры центрифугирования. Полученные исследователями данные свидетельствовали о позитивном эффекте скорости и степени формирования костной ткани. PRP было разработано с целью объединить герметизирующие свойства фибринового сгустка с биологическими эффектами факторов роста, которые выделяются тромбоцитами и влияют на процесс заживления раны. PRP является довольно простым методом обогащения кровяного сгустка, поскольку таковой в нормальных условиях на 94 % состоит из красных кровяных телец (эритроцитов), 5% тромбоцитов и 1% белых кровяных телец (лейкоцитов). В отличие от этого, PRP почти полностью состоит из тромбоцитов (95%).
В настоящее время использование PRP продемонстрировало свои преимущества в ряде клинических применений, среди которых:
- ускорение заживление областей костной аугментации, независимо от типа трансплантата;
- уменьшение признаков воспаления, стимуляция прироста костной ткани, предотвращение поражения нервных структур в симптомокомплексе сухой лунки после удаления зубов мудрости;
- ускорение процедуры аугментации резидуального гребня;
- возможность применения в качестве фибринового клея при реконструктивных операциях в области челюстей;
- возможность заполнения внутрикостных или костных дефектов;
- возможность применения при выполнении вмешательств на мягких тканях при использовании десневых или субэпителиальных трансплантатов.
Фибрин, обогащенный тромбоцитами
Вторым поколением производных тромбоцитов, является PRF, который был впервые разработан во Франции Choukroun и коллегами для использования в челюстно-лицевой хирургии. PRF отличается от других видов концентратов тромбоцитов тем, что он не требует применения ни антикоагулянтов, ни бычьего тромбина, ни какого-либо другого агента для достижения гелеобразной фазы. PRF состоит из фибриновой матрицы, полимеризированной в тетрамолекулярную структуру, которая, в свою очередь, содержит тромбоциты, лейкоциты, цитокины и циркулирующие стволовые клетки. Данные клеточные элементы со временем выделяются из структуры матрицы, при этом именно архитектура фибриновой сетки отвечает за медленный релизинг факторов роста на протяжении 7-21 дня. Медленная полимеризация фибриновой сетки во время ее приготовления помогает достичь такой ее структуры, которая практически не отличается от естественной. PRF может быть более эффективным препаратом, нежели PRP, ввиду более простого алгоритма приготовления концентрата, который не предусматривает биохимической обработки крови. Кроме того, некоторые данные указывают на то, что PRF демонстрирует лучшие результаты, нежели PRP, а также превосходные репаративные свойства.
Клиническое применение PRF включает:
- PRF и PRF-мембраны, которые используются в сочетании с костными трансплантатами, могут ускорить процесс заживление области вмешательства при выполнении синус-лифта через латеральное костное окно.
- PRF может обеспечить защиту и стабилизацию материалов трансплантата во время проведения процедур аугментации костного гребня.
- После удаления зуба или вывиха PRF может помочь сохранить целостность лунки.
- PRF может быть использован для покрытия корня в области одиночных или множественных рецессий зубов.
- PRF может быть использован в ходе регенеративных процедур при восстановлении 3 стеночных костных дефектов.
- PRF улучшает заживление области палатинального вмешательства после забора свободных десневых трансплантатов.
Клинический случай
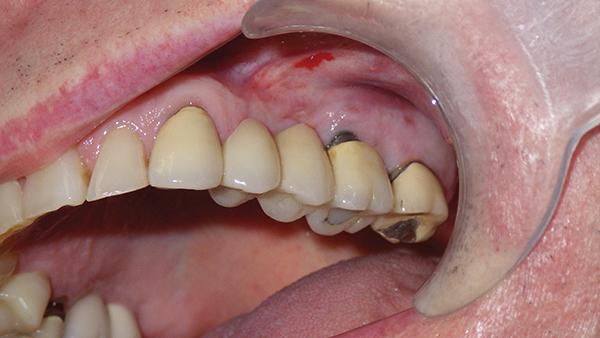
63-летний некурящий мужчина обратился за стоматологической помощью с жалобами на болевые ощущения в области верхней челюсти с левой стороны. Общесоматическое здоровье пациента не было отягощено никакими сопутствующими хроническими заболеваниями. В стоматологическом анамнезе у пациента был зарегистрирован факт установки мостовидной конструкции в области 11-15 зубов 10 лет назад. Очевидно, что боль и припухлость были связаны с неудачным результатом эндодонтического лечения 14 зуба (фото 1).
Фото 1. Вид до вмешательства.
После сбора анамнеза провели все необходимые рентгенологические и клинические исследования: на прицельных рентгенограммах удалось обнаружить обширную периапикальную патологию, а в ходе трехмерного рендеринга было установлено, что размер таковой даже больше, чем предполагалось, и достигал до границ 15 зуба. В ходе клинического осмотра был обнаружен свищевой ход (фото 2 - 3) в области 14 зуба.
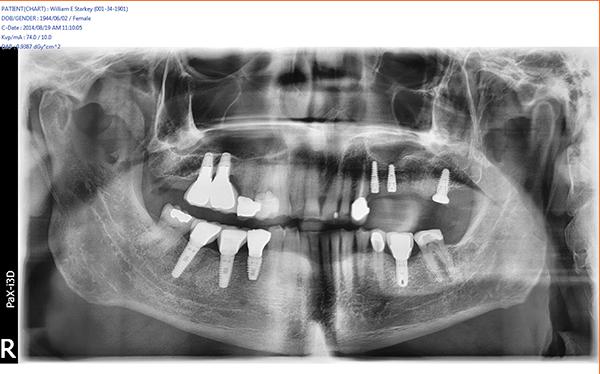
Фото 2. Рентгенограмма до вмешательства.
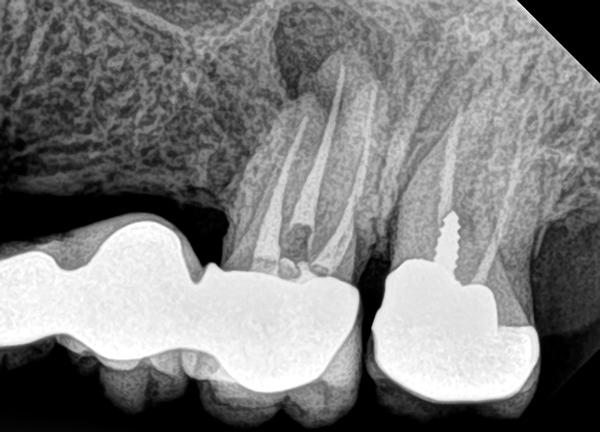
Фото 3. КТ-скан до вмешательства.
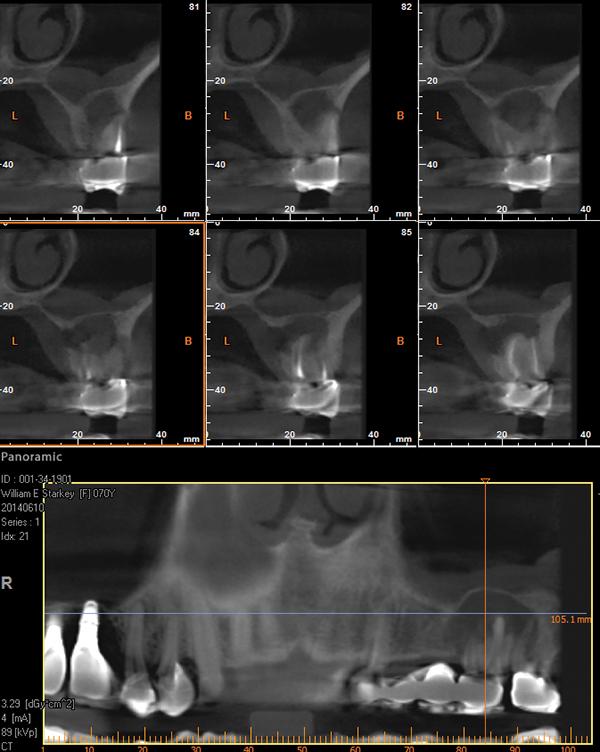
Пациент сообщил, что предварительно он уже был на осмотре у челюстно-лицевого хирурга, который порекомендовал выполнить апикоэктомию, но при этом направил пациента на проведение компьютерно-томмографического исследования. Результаты КТ-сканирования помогли объективизировать размер поражения в области 14 и 15 зубов, которое спровоцировало поражение как щечных так небных стенок обоих зубов.
План лечения предполагал провести фрагментацию мостовидной конструкции, оставляя 11 зуб интактным, с непосредственной установкой имплантатов в области 12, 13 и 15 зубов, используя в ходе аугментации PRF/PRP с лиофилизированным деминерализованным костным трансплантатом. В клинической практике автора статьи жидкость PRP и PRF применяются на постоянной основе в ходе выполнения имплантации, поскольку было доказано, что данные биоматериалы способствуют более быстрому и оптимальному заживлению и восстановлению костной ткани в области вмешательства. При этом также отмечается минимизация риска возможных осложнений, инфицирования и улучшенное заживления мягких тканей поверх костных структур. Суть данной процедуры была объяснена пациенту, который согласился на ее проведение. Вмешательство проводили под местной анестезией, используя две карпулы ультракаина с эпинефрином 1/200 000 и две карпулы лидокаина с эпинефрином 1/200 000.
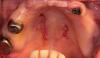
Удаление 14 и 15 зубов проводилось минимально инвазивным хирургическим путем, после чего выполняли сепарацию полнотканного слизисто-надкостничного лоскута с формированием небольшого послабляющего вертикального разреза дистальнее 15 зуба. Затем проводили полную дегрануляцию области вмешательства для достижения максимальной чистоты рабочего поля (фото 4) с дальнейшей установкой имплантатов 4,0-мм х 11,5-мм (AnyRidge, Integrated Dental Systems) в области 12 и 13 зубов при величине торка конструкций выше 40 Нсм. В области 15 зуба был установлен дентальный имплантат AnyRidge с параметрами 4,5-мм х 10 мм при аналогичных показателях торка. Винты-заглушки устанавливали на имплантаты в области 12 и 13 зубов, в то время как на имплантат в области 15 зуба был установлен формирователь десен с параметрами 7 мм х 3 мм. Подобные конструкции формирователей позволяют обеспечить первичное закрытие раны, что показано при выполнении расширенных реконструктивных вмешательств (фото 4).
Фото 4. Дегрануляция лунки 14 и 15 зубов.
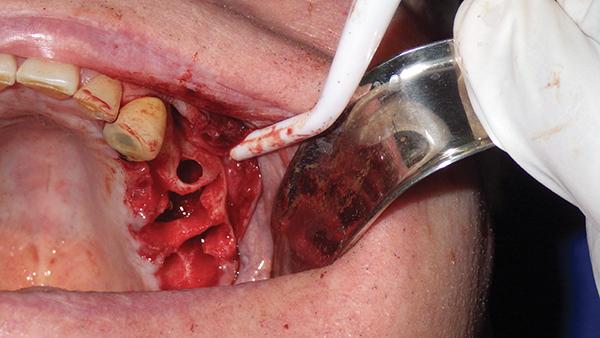
Пациенту было проведено четыре аппликации PRF/PRP, которые выполнялись одновременно для того, чтобы обеспечить консолидированное выделение факторов роста на протяжении 1-10 дней. PRF представляет собой сгусток, который можно сформировать в качестве мембраны в ходе направленной костной регенерации, при этом высвобождение факторов роста происходит в пределах 7-28 дней (фото 5).
Фото 5. Установка имплантата.
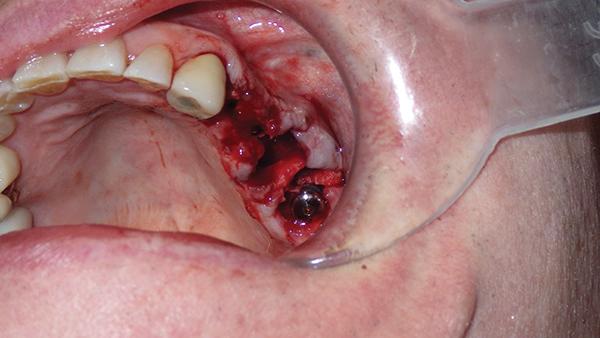
PRP нагнетали вокруг области раны и смешивали с аллотрансплантатом для непосредственного выделения факторов роста, в то время как PRF модифицировали в форме мембраны для использования в процессе аугментации костного гребня. Мембрана была порезана на части с целью покрытия трансплантата, при этом в ней можно было сделать отверстие для того, чтобы обеспечить прохождения шовного материала при достижении первичного закрытия. В данном случае PRF устанавливали вместе с деминерализированным костным трансплантатом и смешивали с PRP, а также покрывали им участок щечной дигисценции в области 13 зуба. PRF/PRP были также установлены в область костного конверта и небной дигисценции около 14 зуба, а дополнительную порцию PRF еще и адаптировали между тканями десен в области того же зуба. Стабилизацию материала проводили при помощи формирователя десен в области 15 зуба, на участке 14 и 15 зубов смесь PRF/PRP устанавливали еще и поверх лоскута, таким образом, стимулируя, по сути, процесс заживления раны вторичным натяжением. Разрез ушили без натяжения по границах лоскута двумя внутренними матрацными швами. Было предвидено, что заживление в области 14 и 15 зубов будет проходить вторичным натяжением по причине помещения PRF в структуру лоскута. Использование PRF по линии шва позволяет добиться заживления первичным натяжением без чрезмерного послабления лоскута, чего невозможно достичь при применении синтетических мембран (фото 6).
Фото 6. Формирование PRF мембран.

Фото 7. Первичное закрытие раны посредством PRF.
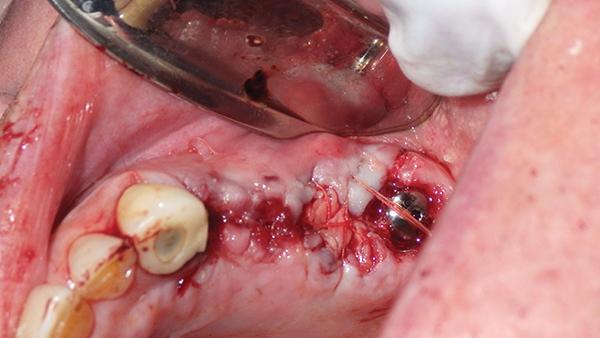
Операция заняла примерно 2 часа, при этом на этап санации полости рта ушло около 45 минут. Пациент перенес процедуру довольно хорошо, утром перед вмешательством он принял четыре таблетки дексаметазона, после завершения операции ему было назначено еще и 875 мг амоксициллина два раза в день в течение последующих 7 дней, плюс две таблетки дексаметазона на следующий день после операции и одна таблетка на 3-й день. В ходе повторного визита через 1 месяц было обнаружено, что область вмешательства зажила, а через 4 месяца заживление можно было охарактеризировать как полное. Через 1 год после вмешательства не удалось зарегистрировать ни признаков редукции костной ткани, ни симптомов периимплантита. Пациент остался доволен как эстетическими, так и функциональным параметрами своей новой мостовидной конструкции. Имплантаты не демонстрировали ни признаков инфицирования, ни воспаления, оставаясь полностью стабильными, и не провоцируя никаких болевых ощущений (фото 8 - 9).
Фото 8. Вид через 4 месяца.
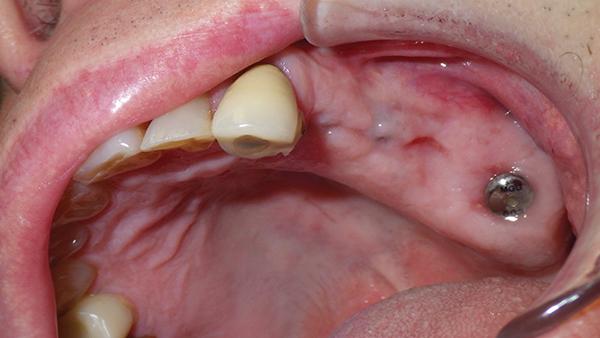
Фото 9. Ортопантомограмма через 4 месяца.
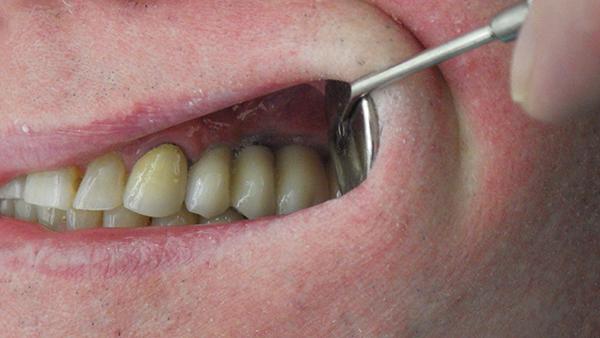
С момента аугментации и имплантации прошло уже более 2 лет, и в ходе мониторинга у пациента не было обнаружено никаких ассоциированных осложнений, при этом использование тромбоцитарных концентратов позволило сократить период постоперационного дискомфорта, ускорить процесс заживления раны до 2 месяцев и исключить необходимость проведения вестибулопластики (фото 10).
Фото 10. Вид через 2 года.
Выводы
Данная статья описывает клинический случай успешной эстетической и функциональной реабилитации пациента посредством проведения процедуры имплантации и сопутствующей PRP и PRF терапии. Подобный подход обеспечивает более быстрое и надежное восстановление костной ткани и сводит к минимуму риск возможных осложнений и перспективу инфицирования раны, позитивно влияя также на процесс заживления окружающих мягких тканей.
Автор: Jamie Oshidar, DMD
Одним из условий, которое обеспечивает достижение успешного результата дентальной имплантации, является наличие достаточного объема резидуальной кости в области хирургического вмешательства. С целью улучшения подходов костной пластики было проведено множество исследований, и в данной статье мы представим еще один из методов оптимизации реконструкции альвеолярного гребня с использованием костного трансплантата и соответствующих факторов роста.

Факторы роста являются биологически активными белками, которые принимают участие в реализации таких биологических процессов, как рост, пролиферация и дифференцирование клеточных структур; кроме того, они могут способствовать восстановлению и регенерации мягких и твердых тканей в процессе их заживления. После связывания со специфическими рецепторами клеточной поверхности, факторы роста могут воздействовать на клетку-мишень посредством сразу нескольких механизмов, стимулируя при этом процессы миграции, деления и дифференциации клеток, а также позитивно влияя на экспрессию белков в области раны в период ее заживления.
Есть восемь основных классов факторов роста, которые синтезируются на разных клеточных уровнях, и эффект каждого из них регулируется комплексной системой обратной биологической связи. Современные достижения в областях клеточной и молекулярной биологии позволили врачам лучше понять механизм действия и вообще функцию факторов роста как биологических агентов. Клинические и лабораторные исследования подтвердили факт стимуляции процессов заживления раны со стороны факторов роста посредством их воздействия на процессы хемоатракции, дифференциации и пролиферации.
Параллельно исследователями был изучен эффект применения факторов роста для лучшей регенерации альвеолярной кости в ходе пародонтологических, реконструктивных и имплантологических манипуляций, а также на этапах предоперационной подготовки. Тромбоциты, выделенные из периферической крови, являются аутологичным источником факторов роста.
В 1974 году Ross и коллеги опубликовали одну из первых работ, описывающих регенеративный потенциал тромбоцитов. В общемедицинских целях данные клетки используются для контроля кровотечения при тромбоцитопении, острых геморрагиях или лейкемии. Использование фибринового клея или адгезива, который в основном состоит из фибриногена и тромбина, помогает инициировать процесс формирования тромбоцитарного концентрата как дополнительной субстанции, используемой в хирургической практике. Кроме того, наличие компонентов крови в области раны, по своей сути, уже способствует ее заживлению даже без какого-либо дополнительного ятрогенного влияния. С другой стороны, протекание процессов репарации и регенерации мягких и твердых тканей после пародонтологических хирургических процедур можно улучшить за счет тромбоцитарных концентратов, поскольку факторы роста, которые выделяются после активации тромбоцитов, стимулируют митогенную реакцию периоста в ходе восстановления костной ткани.
В общей сложности из кровяного сгустка можно получить следующие типы факторов роста:
- трансформирующий фактор роста бета (TGF-b)
- тромбоцитарный факторов роста (PDGF)
- инсулиноподобный фактор роста (ИФР)
- фактор роста сосудистого эндотелия (VEGF),
- эпидермальный фактор роста (ЕGF)
- фактор роста фибробластов-2 (FGF-2)
Тромбоцитарный фактор роста (PDGF), который синтезируется тромбоцитами, моноцитами, макрофагами, эндотелиальными клетками и остеобластами, является широко исследуемым объектом, ценным для клинического применения ввиду своих значительных репарационных свойств. Данный протеин можно найти в костном матриксе, при этом он может высвобождаться тромбоцитами локально во время свертывания крови после травмы мягких или твердых тканей. После выхода из тромбоцитов PDGF связывается со специфическими рецепторами на поверхности клетки и способствует быстрой миграции и пролиферации клеток в поврежденную область. И в лабораторных, и в естественных условиях было установлено, что PDGF является мощным хемотаксическим и митогенным фактором относительно клеток фибробластов периодонтальной связки, цементобластов и остеобластов.
Первоначальная идея состояла в том, чтобы сконцентрировать тромбоциты и их факторы роста в области операционного поля, что, очевидно, должно было бы улучшить процесс заживления. Исследования продемонстрировали перспективные результаты более быстрого заживления раны и регенерации тканей, что, в свою очередь, снижает риск инфицирования, развития комплекса сухой лунки, дезинтеграции имплантатов или материала трансплантата. Подобный алгоритм лечения особенно ценный для людей с диабетом, курильщиков или таковых с острыми или хроническими соматическими заболеваниями. Аутологические концентраты тромбоцитов можно использовать в различных формах. Первое поколение таковых было представлено в форме плазмы, обогащенной тромбоцитами, а также последующего в очереди фибрина, обогащенного тромбоцитами, который представлял уже второе поколение биоматериала.
Плазма, обогащенная тромбоцитами
В 1998 году Marx и коллеги впервые описали применение PRP, которая, по сути, является аутологичным концентратом тромбоцитов в небольшом объеме плазмы после процедуры центрифугирования. Полученные исследователями данные свидетельствовали о позитивном эффекте скорости и степени формирования костной ткани. PRP было разработано с целью объединить герметизирующие свойства фибринового сгустка с биологическими эффектами факторов роста, которые выделяются тромбоцитами и влияют на процесс заживления раны. PRP является довольно простым методом обогащения кровяного сгустка, поскольку таковой в нормальных условиях на 94 % состоит из красных кровяных телец (эритроцитов), 5% тромбоцитов и 1% белых кровяных телец (лейкоцитов). В отличие от этого, PRP почти полностью состоит из тромбоцитов (95%).
В настоящее время использование PRP продемонстрировало свои преимущества в ряде клинических применений, среди которых:
- ускорение заживление областей костной аугментации, независимо от типа трансплантата;
- уменьшение признаков воспаления, стимуляция прироста костной ткани, предотвращение поражения нервных структур в симптомокомплексе сухой лунки после удаления зубов мудрости;
- ускорение процедуры аугментации резидуального гребня;
- возможность применения в качестве фибринового клея при реконструктивных операциях в области челюстей;
- возможность заполнения внутрикостных или костных дефектов;
- возможность применения при выполнении вмешательств на мягких тканях при использовании десневых или субэпителиальных трансплантатов.
Фибрин, обогащенный тромбоцитами
Вторым поколением производных тромбоцитов, является PRF, который был впервые разработан во Франции Choukroun и коллегами для использования в челюстно-лицевой хирургии. PRF отличается от других видов концентратов тромбоцитов тем, что он не требует применения ни антикоагулянтов, ни бычьего тромбина, ни какого-либо другого агента для достижения гелеобразной фазы. PRF состоит из фибриновой матрицы, полимеризированной в тетрамолекулярную структуру, которая, в свою очередь, содержит тромбоциты, лейкоциты, цитокины и циркулирующие стволовые клетки. Данные клеточные элементы со временем выделяются из структуры матрицы, при этом именно архитектура фибриновой сетки отвечает за медленный релизинг факторов роста на протяжении 7-21 дня. Медленная полимеризация фибриновой сетки во время ее приготовления помогает достичь такой ее структуры, которая практически не отличается от естественной. PRF может быть более эффективным препаратом, нежели PRP, ввиду более простого алгоритма приготовления концентрата, который не предусматривает биохимической обработки крови. Кроме того, некоторые данные указывают на то, что PRF демонстрирует лучшие результаты, нежели PRP, а также превосходные репаративные свойства.
Клиническое применение PRF включает:
- PRF и PRF-мембраны, которые используются в сочетании с костными трансплантатами, могут ускорить процесс заживление области вмешательства при выполнении синус-лифта через латеральное костное окно.
- PRF может обеспечить защиту и стабилизацию материалов трансплантата во время проведения процедур аугментации костного гребня.
- После удаления зуба или вывиха PRF может помочь сохранить целостность лунки.
- PRF может быть использован для покрытия корня в области одиночных или множественных рецессий зубов.
- PRF может быть использован в ходе регенеративных процедур при восстановлении 3 стеночных костных дефектов.
- PRF улучшает заживление области палатинального вмешательства после забора свободных десневых трансплантатов.
Клинический случай
63-летний некурящий мужчина обратился за стоматологической помощью с жалобами на болевые ощущения в области верхней челюсти с левой стороны. Общесоматическое здоровье пациента не было отягощено никакими сопутствующими хроническими заболеваниями. В стоматологическом анамнезе у пациента был зарегистрирован факт установки мостовидной конструкции в области 11-15 зубов 10 лет назад. Очевидно, что боль и припухлость были связаны с неудачным результатом эндодонтического лечения 14 зуба (фото 1).
Фото 1. Вид до вмешательства.

После сбора анамнеза провели все необходимые рентгенологические и клинические исследования: на прицельных рентгенограммах удалось обнаружить обширную периапикальную патологию, а в ходе трехмерного рендеринга было установлено, что размер таковой даже больше, чем предполагалось, и достигал до границ 15 зуба. В ходе клинического осмотра был обнаружен свищевой ход (фото 2 - 3) в области 14 зуба.
Фото 2. Рентгенограмма до вмешательства.

Фото 3. КТ-скан до вмешательства.

Пациент сообщил, что предварительно он уже был на осмотре у челюстно-лицевого хирурга, который порекомендовал выполнить апикоэктомию, но при этом направил пациента на проведение компьютерно-томмографического исследования. Результаты КТ-сканирования помогли объективизировать размер поражения в области 14 и 15 зубов, которое спровоцировало поражение как щечных так небных стенок обоих зубов.
План лечения предполагал провести фрагментацию мостовидной конструкции, оставляя 11 зуб интактным, с непосредственной установкой имплантатов в области 12, 13 и 15 зубов, используя в ходе аугментации PRF/PRP с лиофилизированным деминерализованным костным трансплантатом. В клинической практике автора статьи жидкость PRP и PRF применяются на постоянной основе в ходе выполнения имплантации, поскольку было доказано, что данные биоматериалы способствуют более быстрому и оптимальному заживлению и восстановлению костной ткани в области вмешательства. При этом также отмечается минимизация риска возможных осложнений, инфицирования и улучшенное заживления мягких тканей поверх костных структур. Суть данной процедуры была объяснена пациенту, который согласился на ее проведение. Вмешательство проводили под местной анестезией, используя две карпулы ультракаина с эпинефрином 1/200 000 и две карпулы лидокаина с эпинефрином 1/200 000.
Удаление 14 и 15 зубов проводилось минимально инвазивным хирургическим путем, после чего выполняли сепарацию полнотканного слизисто-надкостничного лоскута с формированием небольшого послабляющего вертикального разреза дистальнее 15 зуба. Затем проводили полную дегрануляцию области вмешательства для достижения максимальной чистоты рабочего поля (фото 4) с дальнейшей установкой имплантатов 4,0-мм х 11,5-мм (AnyRidge, Integrated Dental Systems) в области 12 и 13 зубов при величине торка конструкций выше 40 Нсм. В области 15 зуба был установлен дентальный имплантат AnyRidge с параметрами 4,5-мм х 10 мм при аналогичных показателях торка. Винты-заглушки устанавливали на имплантаты в области 12 и 13 зубов, в то время как на имплантат в области 15 зуба был установлен формирователь десен с параметрами 7 мм х 3 мм. Подобные конструкции формирователей позволяют обеспечить первичное закрытие раны, что показано при выполнении расширенных реконструктивных вмешательств (фото 4).
Фото 4. Дегрануляция лунки 14 и 15 зубов.

Пациенту было проведено четыре аппликации PRF/PRP, которые выполнялись одновременно для того, чтобы обеспечить консолидированное выделение факторов роста на протяжении 1-10 дней. PRF представляет собой сгусток, который можно сформировать в качестве мембраны в ходе направленной костной регенерации, при этом высвобождение факторов роста происходит в пределах 7-28 дней (фото 5).
Фото 5. Установка имплантата.

PRP нагнетали вокруг области раны и смешивали с аллотрансплантатом для непосредственного выделения факторов роста, в то время как PRF модифицировали в форме мембраны для использования в процессе аугментации костного гребня. Мембрана была порезана на части с целью покрытия трансплантата, при этом в ней можно было сделать отверстие для того, чтобы обеспечить прохождения шовного материала при достижении первичного закрытия. В данном случае PRF устанавливали вместе с деминерализированным костным трансплантатом и смешивали с PRP, а также покрывали им участок щечной дигисценции в области 13 зуба. PRF/PRP были также установлены в область костного конверта и небной дигисценции около 14 зуба, а дополнительную порцию PRF еще и адаптировали между тканями десен в области того же зуба. Стабилизацию материала проводили при помощи формирователя десен в области 15 зуба, на участке 14 и 15 зубов смесь PRF/PRP устанавливали еще и поверх лоскута, таким образом, стимулируя, по сути, процесс заживления раны вторичным натяжением. Разрез ушили без натяжения по границах лоскута двумя внутренними матрацными швами. Было предвидено, что заживление в области 14 и 15 зубов будет проходить вторичным натяжением по причине помещения PRF в структуру лоскута. Использование PRF по линии шва позволяет добиться заживления первичным натяжением без чрезмерного послабления лоскута, чего невозможно достичь при применении синтетических мембран (фото 6).
Фото 6. Формирование PRF мембран.

Фото 7. Первичное закрытие раны посредством PRF.

Операция заняла примерно 2 часа, при этом на этап санации полости рта ушло около 45 минут. Пациент перенес процедуру довольно хорошо, утром перед вмешательством он принял четыре таблетки дексаметазона, после завершения операции ему было назначено еще и 875 мг амоксициллина два раза в день в течение последующих 7 дней, плюс две таблетки дексаметазона на следующий день после операции и одна таблетка на 3-й день. В ходе повторного визита через 1 месяц было обнаружено, что область вмешательства зажила, а через 4 месяца заживление можно было охарактеризировать как полное. Через 1 год после вмешательства не удалось зарегистрировать ни признаков редукции костной ткани, ни симптомов периимплантита. Пациент остался доволен как эстетическими, так и функциональным параметрами своей новой мостовидной конструкции. Имплантаты не демонстрировали ни признаков инфицирования, ни воспаления, оставаясь полностью стабильными, и не провоцируя никаких болевых ощущений (фото 8 - 9).
Фото 8. Вид через 4 месяца.

Фото 9. Ортопантомограмма через 4 месяца.

С момента аугментации и имплантации прошло уже более 2 лет, и в ходе мониторинга у пациента не было обнаружено никаких ассоциированных осложнений, при этом использование тромбоцитарных концентратов позволило сократить период постоперационного дискомфорта, ускорить процесс заживления раны до 2 месяцев и исключить необходимость проведения вестибулопластики (фото 10).
Фото 10. Вид через 2 года.

Выводы
Данная статья описывает клинический случай успешной эстетической и функциональной реабилитации пациента посредством проведения процедуры имплантации и сопутствующей PRP и PRF терапии. Подобный подход обеспечивает более быстрое и надежное восстановление костной ткани и сводит к минимуму риск возможных осложнений и перспективу инфицирования раны, позитивно влияя также на процесс заживления окружающих мягких тканей.
Автор: Jamie Oshidar, DMD


























































































































































0 комментариев