Успешность дентальных имплантатов, используемых в качестве опор реставраций, замещающих частичные и полные дефекты зубного ряда, хорошо описана в литературе. Кроме того, проведение процедуры аугментации костного гребня значительно расширило возможности имплантологического вмешательства. Но реализация реконструктивной фазы лечения, особенно в случаях увеличения вертикальных параметров верхней и нижней челюстей, является довольно затруднительным заданием для врача-клинициста.
Marx и коллеги описали технику использования временных имплантатов, играющих роль ретенционных элементов для фиксации аутогенных кортикогубчатых трансплантатов. Bach в ходе вертикальной аугментации успешно использовал титановые винты в сочетании с минерализованным гранулированным аллотрансплантатом, формируя из них «тенты» для формирования костной ткани. Fontana и коллеги с этой же целью использовали мини-винты из нержавеющей стали (длиной от 6 до 12 мм) в качестве крепежных элементов для поддержки армированной титаном расширенной политетрафторэтиленовой мембраны (e-PTFE), которая, в свою очередь, обеспечивает ретенцию необходимого объема пространства для последующей регенерации костной ткани. Таким образом авторам также удалось минимизировать уровень резорбции костных блоков, используемых для аугментации, и достичь средних параметров вертикального увеличения кости в 4,02 ± 1,53 мм. С другой стороны, подобные методики вмешательства характеризуются повышенным риском неправильного позиционирования имплантатов, не говоря уже о том, что в подобных случаях могут возникнуть и дефекты в форме дигисценций. Подобные осложнения могут свести на нет все запланированные результаты стоматологической реабилитации. Аналогично концепцию опоры для тента можно реализовать и с использованием имплантатов узкого диаметра (ИУД) (категория 1, диаметр менее 3,0 мм), которые сначала были представлены на рынке в качестве переходных конструкций для поддержки непосредственно нагруженных провизорных реставраций. Учитывая, что подобным имплантатам удавалось достичь хорошего первичного уровня стабильности, они впоследствии стали использоваться не только для ретенции пространства или поддержки временных конструкций, но и в качестве направляющих для позиционирования и аннуляции постоянных титановых внутрикостных элементов.
Цель данной статьи состоит в том, чтобы описать пошаговую методику использования ИУД в качестве опор в ходе проведения процедуры GBR и направляющих ориентиров для конструкций постоянных имплантатов.
Клинический случай
57-летний мужчина обратился за помощью на кафедру пародонтологии и имплантологии им. Ашмана в Нью-Йоркском университете (Нью-Йорк). Пациент желал провести установку имплантата в области верхнего центрального резца слева (зуб № 9). В анамнезе у больного не отмечалось ни системных заболеваний, ни фактов радиационного воздействия, ни проведения химиотерапии. Также пациент не курил, а его пародонтальный статус являлся удовлетворительным. В ходе анализа было обнаружено, что пациенту 2 года назад уже проводилось эндодонтическое лечение и апикоэктомия зуба № 9. Однако в результате лечения зуб был подвергнут структурным нарушениям и его необходимо было экстрагировать (фото 1 - 3).
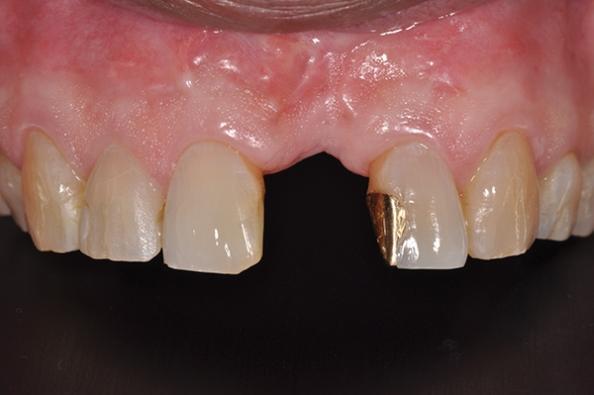
Фото 1. Вид проблемного зуба № 9.
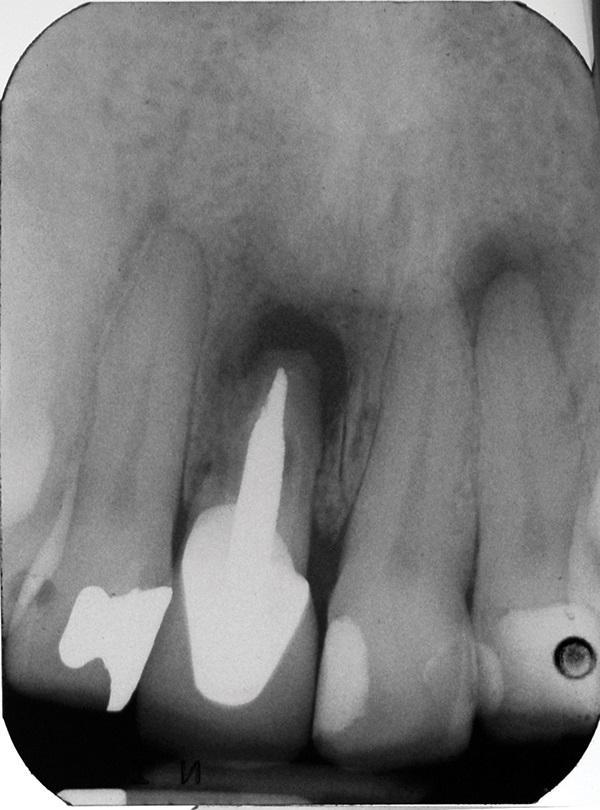
Фото 2. Клинический вид зуба № 9.
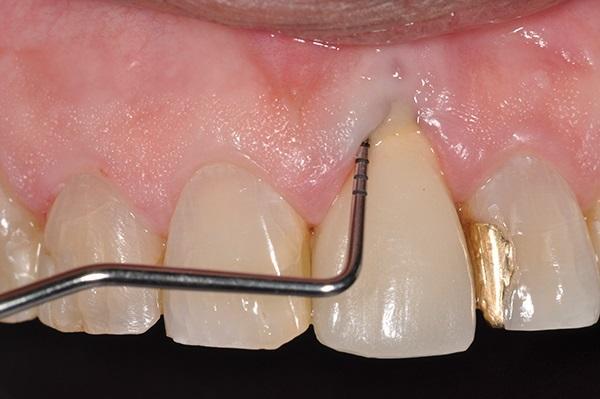
Фото 3. Экстракция зуба № 9.
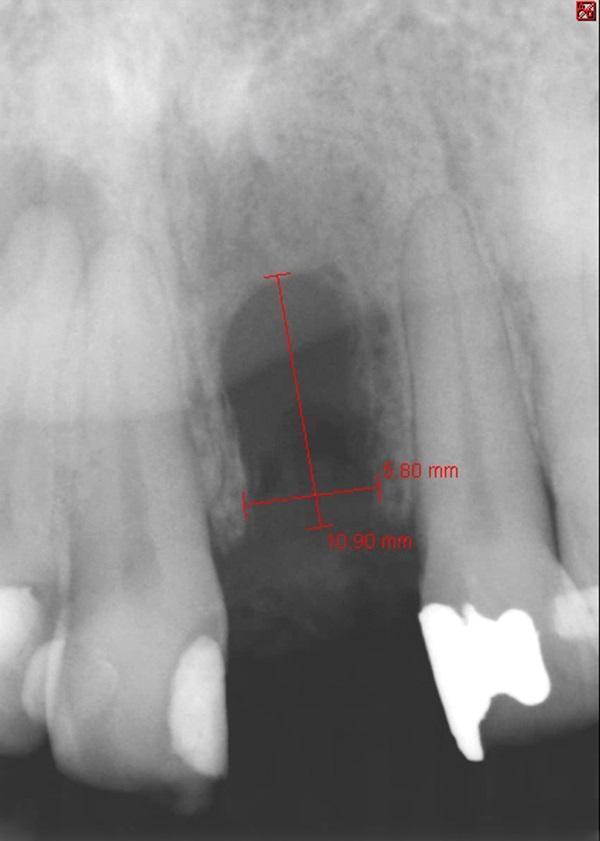
Через 4 месяца после удаления (фото 4 - 5) посредством рентгенографии было установлено вертикальную потерю костной ткани на 10,9 мм, при этом костный гребень с интерапроксимальных сторон соседних зубов не был нарушен (фото 6).
Фото 4. Вид через 4 месяца после экстракции.
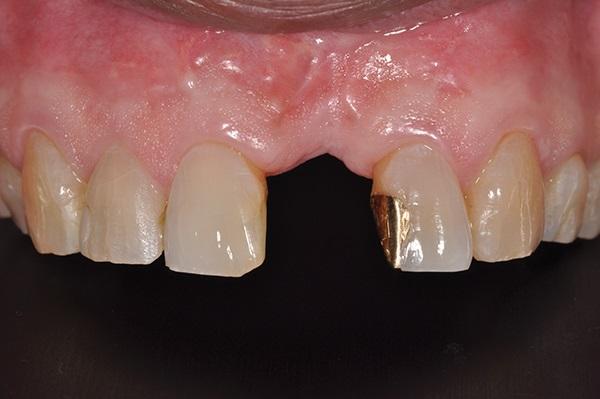
Фото 5. Вид гребня после экстракции.
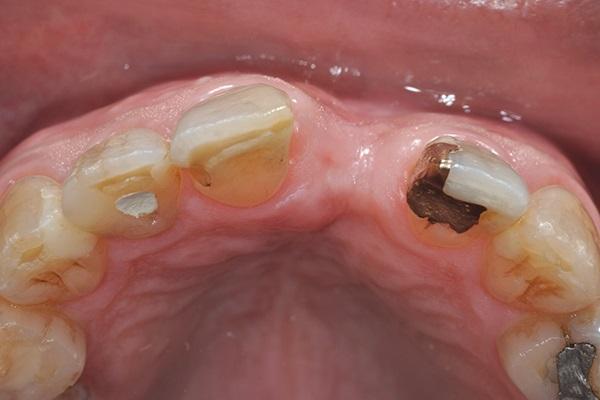
Фото 6. Визуализация значительной вертикальной потери костной ткани и сохранение кости в апроксимальных участках.
Планирование будущего лечения проводилось вместе с врачом-ортопедом. На этапах подготовки были получены томографические срезы зубочелюстного аппарата, диагностические модели, восковые репродукции и хирургические шаблоны. Пациент был проконсультирован относительно будущего вмешательства, после чего подписал форму согласия на проведение соответствующих процедур. Предполагалось провести направленную установку дентальных имплантатов с использованием предварительной аугментации костным заменителем, а также ИУД в качестве ретенционного элемента.
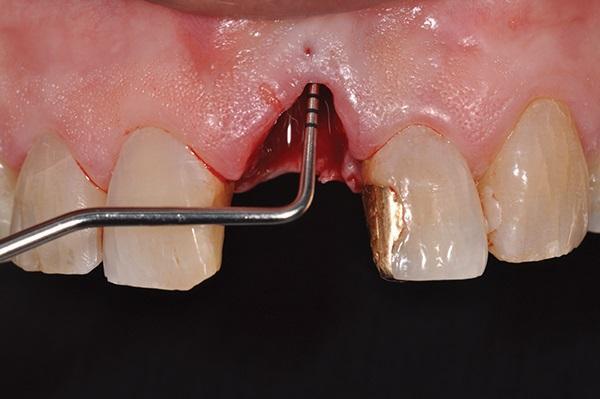
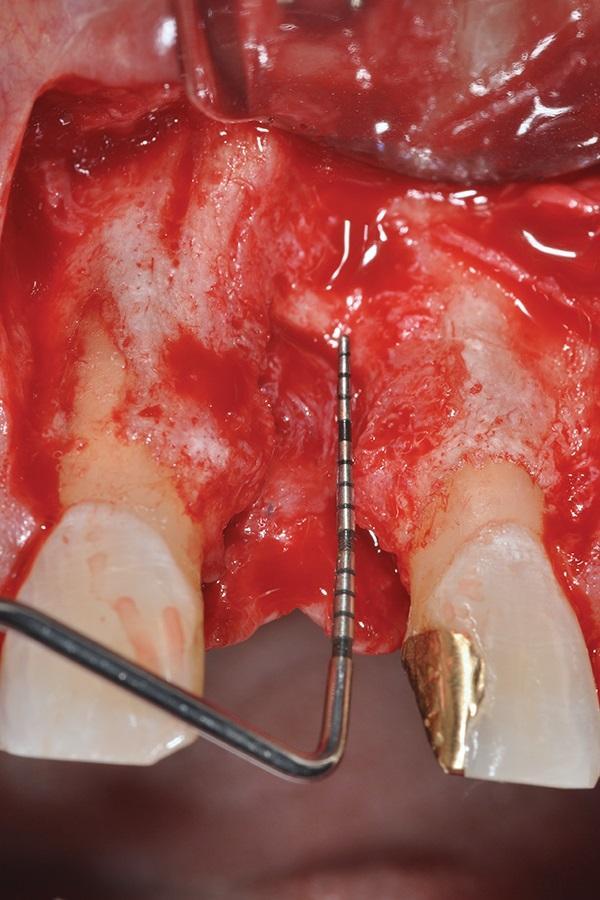
За 1 час перед началом операционной вмешательства пациенту назначали 2 грамма амоксициллина (TEVA Pharmaceuticals, tevausa.com). Местную инфильтрационную анестезию проводили посредством 2% раствора лидокаина с адреналином в концентрации 1: 100 000 адреналина (Henry Schein, henryschein.com). После крестального разреза провели еще два вертикальных послабляющих в области 8 и 10 зубов. Эти надрезы продлевали апикально к границе слизисто-десневого соединения. После сепарации полнотканного слизистонадкостничного лоскута был обнажен костный дефект 3 класса, который в горизонтальном направлении расширялся до 5,8 мм, а в вертикальном – до 10,9 мм (фото 7).
Фото 7. Визуализация дефекта после сепарации гребня.
Остеотомию проводили согласно запланированной позиции имплантата, используя для этого хирургический шаблон. Глубина препарирования кости составляла 4 мм, а диаметр – 1,3 мм (CePo, Dentatus) при скорости в 1500 об./мин. с обильным орошением. Декортикацию проводили только в области кортикальной щечной пластинки посредством круглого алмазного бора № 1 с обильным орошением. ИУД (Smart Slim, EBI North America) диаметром 2,2 мм и длиной 16 мм были помещены в структуру кости на 5,8 мм так, чтобы 10,2 мм внутрикостной опоры оставалась обнаженной (фото 8).
Фото 8. Установка имплантата узкого диаметра (ИУД).
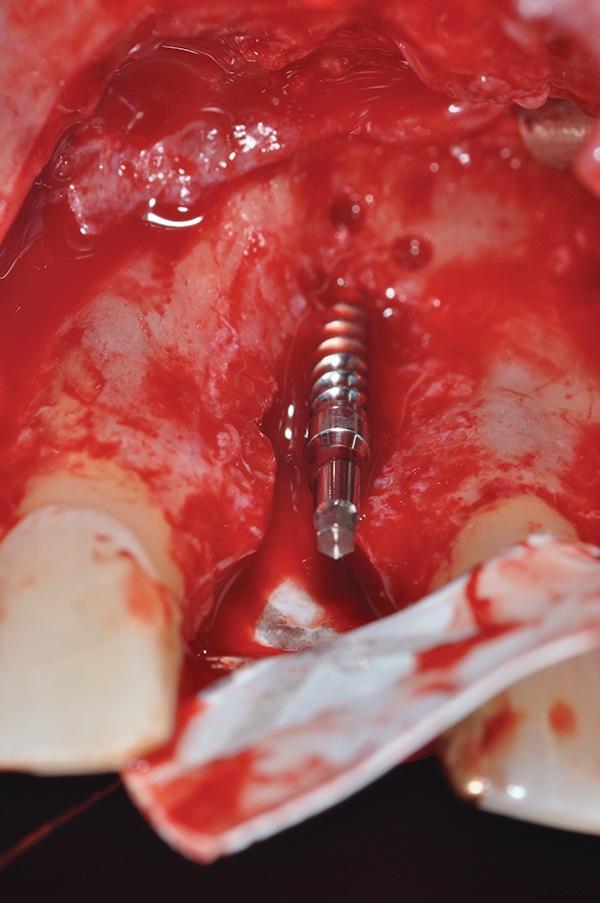
Измерения обнаженной части ИУД проводились с использованием цифрового микрометра (Absolute Snap Caliper Series 573, Mitutoyo) с точностью до 0,01 мм. Процедуру GBR выполняли одновременно с установкой ИУД. Для этого использовали отконтурированную титановую мембрану (Cytoplast Ti-250, Osteogenics Biomedical) и мелкозернистый (от 0,25 до 1,0 мм) неорганический костный трансплантат бычьего происхождения (ABBM) (BioOss, Geistlich Pharma North America). Хромированные кетгутовые нити размером 4,0 (Henry Schein) применялись для фиксации мембраны к надкостнице (фото 9). Непрерывное первичное закрытие крестального разреза было достигнуто за счет резорбируемых швов размером нитей 4.0, а вертикальных разрезов за счет прерывистых швов нитями 5,0. Для оценки позиции ИУД получили рентгеновский снимок (фото 10).
Фото 9. Фиксация нерезорбируемой мембраны.
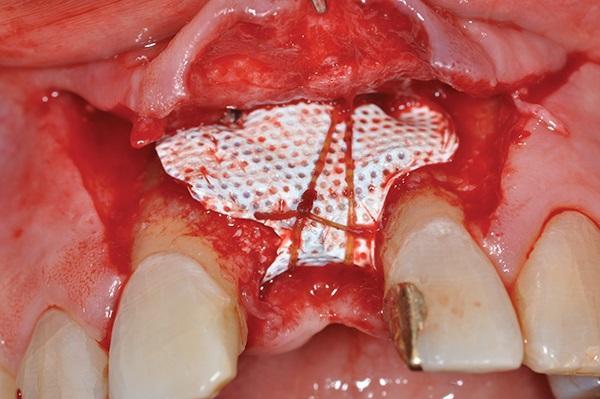
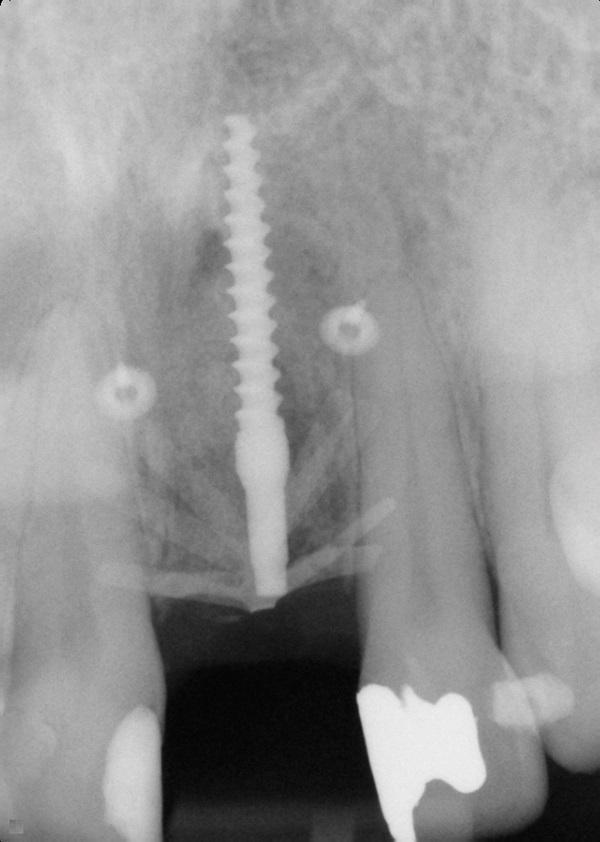
Фото 10. Рентгенограмма после установки ИУД и НКР.
В течение последующих 4 месяцев пациент находился под наблюдением с интервалами в 4-5 недель. Через полгода провели повторный крестальный разрез несколько палатинальнее предыдущего, а после него – и соответствующие внутриборозковые разрезы. Процедуру проводили под местной анестезией, используя 2% лидокаин с концентрацией адреналина 1: 100 000. Сепарацию полнотканного слизистопериостального лоскута проводили только в области вершины гребня, стараясь минимально затронуть щечную часть кости (фото 11).
Фото 11. Повторное вмешательство.
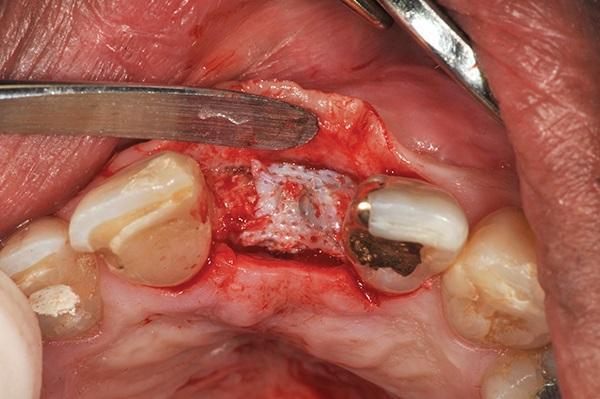
Армированную титановую мембрану разрезали лезвием 15С и хирургическими ножницами для воссоздания необходимого круглого отверстия диаметром 4 мм для последующей установки имплантата. Образование кости наблюдалось непосредственно апикально относительно мембраны. ИУД был удален с помощью адаптера имплантата, соединенного с имплантологическим ключом. До удаления ИУД дополнительно проводили его измерения с точностью до 0,01 мм. Таким образом, относительно вертикальных параметров имплантатов удалось точно измерить и величину прироста кости после аугментации. Постоянные имплантаты диаметром 4,1 мм и длиной 14 мм (SLActive, Straumann) устанавливали по длинной оси области экстракции ИУД, при этом данные конструкции на 3-4 мм входили в интактную кость пациента (фото 12). Стабильности имплантата, превышающей 35 Нсм, достигали за счет динамометрического ключа. Для проверки позиции конструкции провели контрольную рентгенограмму (фото 13). С целью дальнейшего изготовления временной конструкции был получен оттиск на уровне платформы интраоссальной опоры (фото 14).
Фото 12. Установка окончательного имплантата (4,1 мм x 14,0 мм).
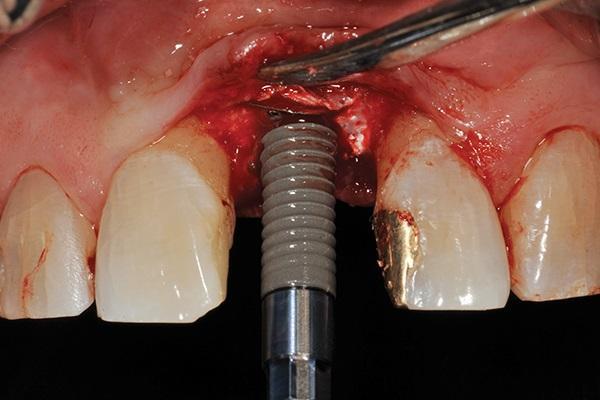
Фото 13. Рентгенограмма после установки имплантата.
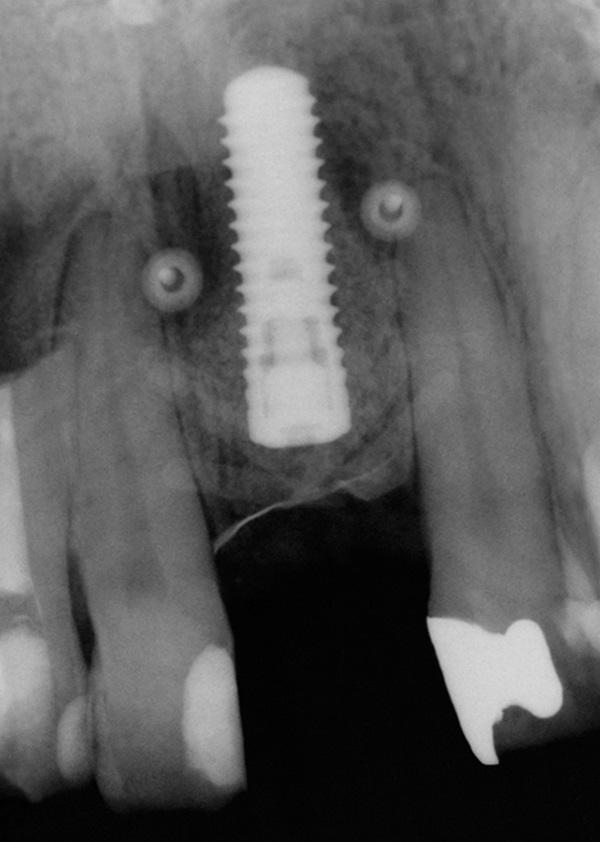
Фото 14. Установка провизорной конструкции.
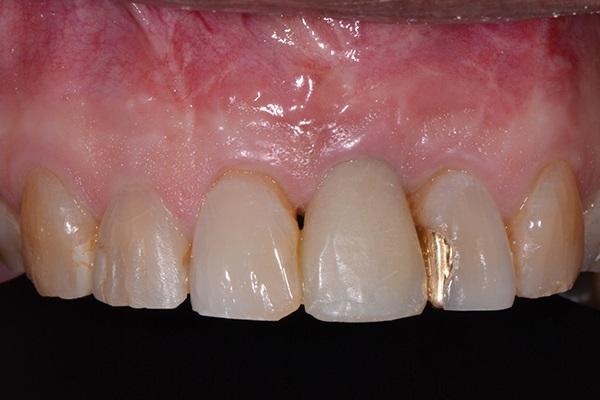
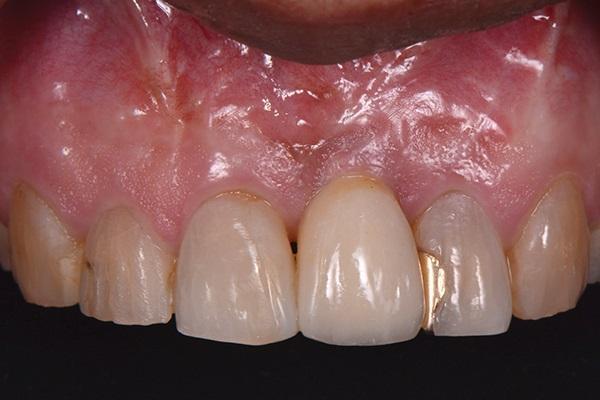
Ушивание области вмешательства проводили прерывистыми швами хромированным кетгутовыми нитями размером 4,0 (Henry Schein). Пациенту были предписаны полоскания 0,12% раствором хлоргексидина глюконата два раза в день на протяжении 2 недель, а также прием 500 мг амоксициллина в течение 1 недели. Тщательный мониторинг за пациентом проводился на протяжении 3-4 месяцев. Спустя полгода несколько с небной стороны был сформирован крестальный разрез в области титановой опоры, на которую зафиксировали провизорную коронку. После достижения необходимого контура мягких тканей провели установку окончательной протетической конструкции (фото 15 - 17).
Фото 15. Установка окончательной коронки.
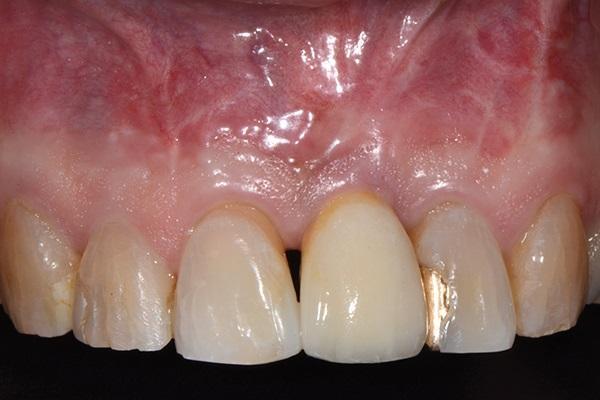
Фото 16. Окклюзионный вид окончательной коронки.
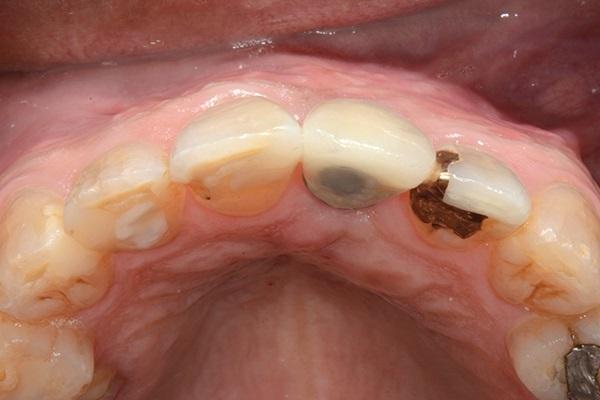
Фото 17. Рентгенограмма после фиксации окончательной коронки.
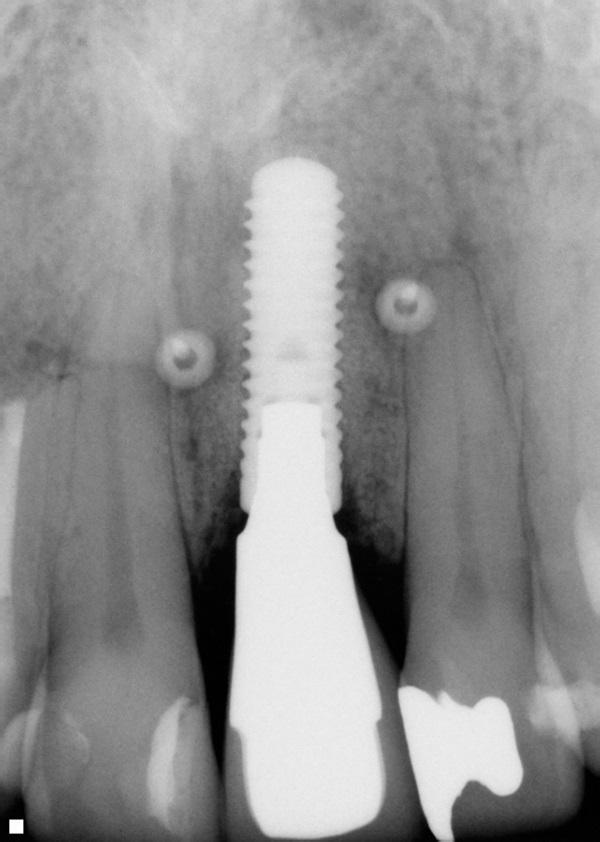
В последующий период пациента наблюдали каждые 3 месяца. Состояние мягких и твердых тканей оценивали через 3 года и через 5 лет после фиксации коронковой реставрации. Глубина зондирования в периимплантатной области составляла 3 мм или менее, кровотечения в ходе зондирования не наблюдалось, а мягкие и твердые ткани оставались максимально стабильными (фото 18 - 23). С медиальной стороны 8 и 9 зубов были выполнены композитные реставрации для закрытия области черных треугольников (фото 24).
Фото 18. Вид через три года после лечения.
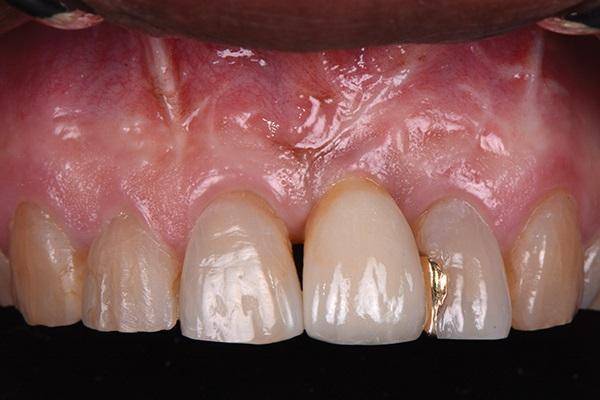
Фото 19. Окклюзионный вид через три года после лечения.
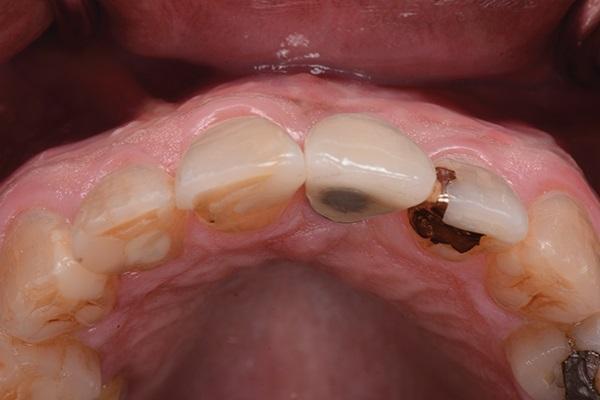
Фото 20. Рентгенограмма через три года после лечения.
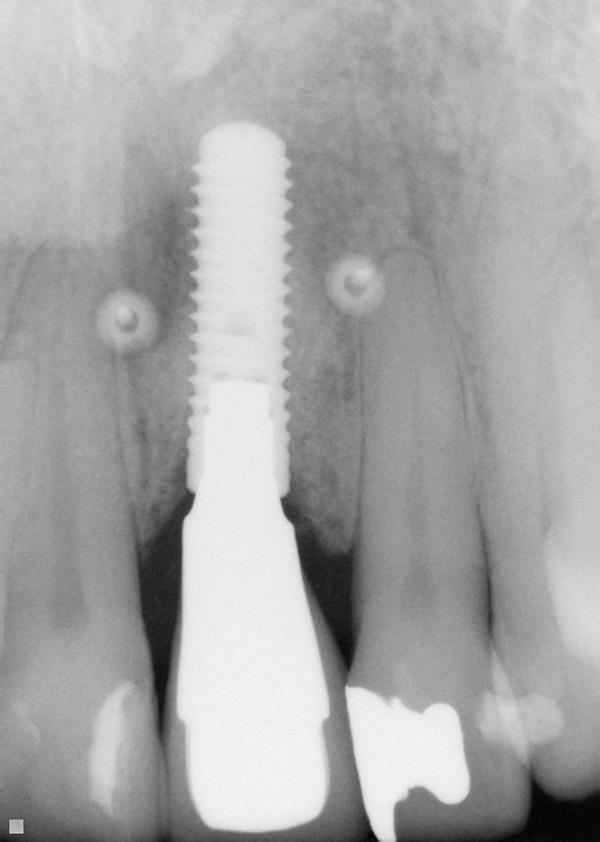
Фото 21. Вид через пять лет после лечения.
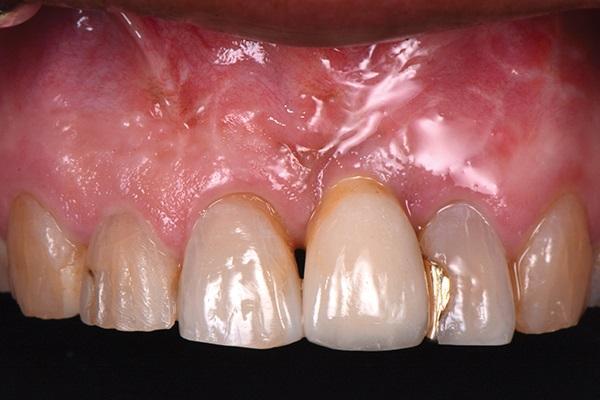
Фото 22. Окклюзионный вид через пять лет после лечения.
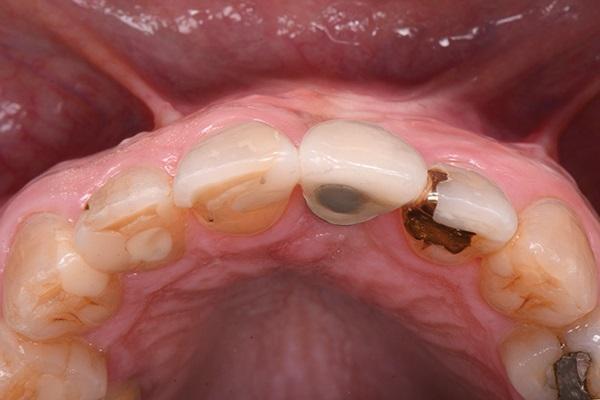
Фото 23. Рентгенограмма через пять лет после лечения.
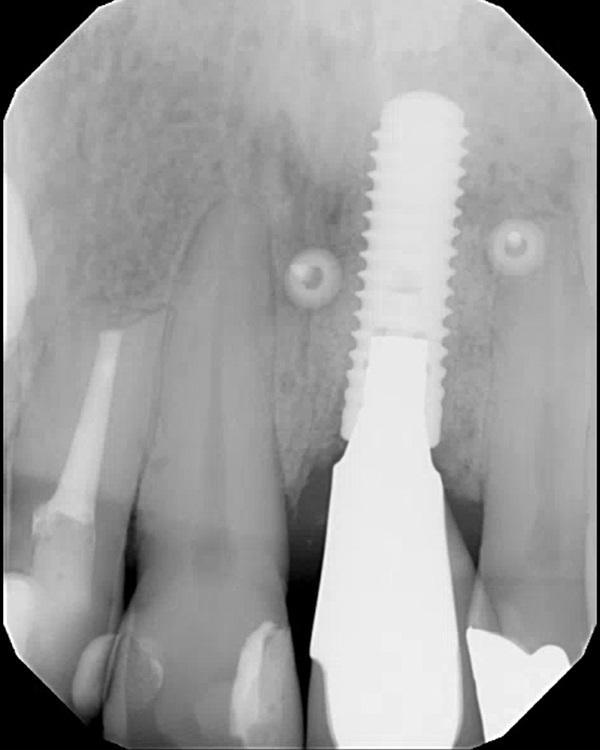
Фото 24. Вид через пять лет после лечения.
Результаты
В данном клиническом случае у пациента наблюдался вертикальный дефект костного гребня размером 10,9 мм. Лечение проводилось с использованием ИУД и техники тентовой опоры, в результате чего удалось полностью восстановить дефицит костной ткани. Стабильность окружающих имплантат мягких и твердых тканей была подтверждена результатами повторных осмотров, проводимых в течение 3 лет после окончания лечения.
Обсуждение
Ремоделирование костной ткани после экстракции зуба приводит к потере вертикальных и горизонтальных параметров костного гребня. В зависимости от анатомического положения и размера дефекта для восстановления дефицита кости и создания условия для установки дентального имплантата могут применяться различные хирургические подходы. Многие авторы сообщали об успешности использования с данной целью аутогенных костных трансплантатов, однако использование таковых является весьма ограниченным при наличии трехмерных объемных дефектов, компрометирующих не только функциональные, но и эстетические параметры проблемной области. Для восстановления подобных участков с большим дефицитом костной ткани для получения надлежащего количества костного материала необходимо провести его забор из внеротовых донорских областей. Техника, предложенная Marx и коллегами, предполагает использование ИУД в качестве тентовых опор, которые обеспечивают максимальную ретенцию костного трансплантата, упакованного по принципу GBR. Такой подход помогает восстановить объемный вертикальный дефект резидуального гребня вообще без использования аутогенного костного материала. Согласно методу Marx, врач должен провести расширения мягких тканей для формирования надлежащего объема, и ИУД играет роль «тентовых опор», используемых для стабилизации гранулированного окружающего трансплантата. Подобный подход помогает минимизировать риск коллапса окружающих мягких тканей и смещения костного заменителя, таким образом, гарантируя достижение наиболее приемлемого результата.
В данном случае в качестве костного заменителя использовали неорганический материал бычьего происхождения, частицы которого гидратировали физиологическим раствором в течение приблизительно 1-2 минут перед размещением, обеспечивая, таким образом, адгезию материала. После этого область аугментации покрывали защитной мембраной d-PTFE, армированной титаном. В исследовании Urban и коллег, подобный подход помог добиться стабильной регенерации кости в случаях увеличения вертикальных параметров костного гребня. Неорганический бычий костный минерал сыграл роль каркаса для формирования новой ткани. Раннее проведенные гистологическое исследование с участием людей показали, что поверхность частиц данного материала, размещенных вокруг имплантатов в 70,3% случаев, впоследствии покрывались зрелой костной тканью. Данные результаты были подтверждены в ходе биопсии через 14-80 месяцев. Berglundh и Lindhe, изучая остеокондуктивный потенциал ABBM при размещении его в области дефектов нижней челюсти у биглей, пришли к выводу, что через 3-7 месяцев наблюдалось полное восстановление дефекта, а частицы трансплантата были окружены и частично замещены параллельными фибриновыми волокнами и пластинчатой костью. Simion и коллеги для увеличения вертикальных параметров кости использовали композитный трансплантат, состоящий из ABBM и аутогенной кости в соотношении 1:1. Они наблюдали, что данный материал подвергается резорбции более медленно, чем его аналоги. Schlegel и коллеги, сравнивая скорость резорбции аутогенного костного материала и ABBM при синус-лифте, пришли выводу, что через 6 месяцев уменьшение объема составляло 15% и 40% для ABBM и аутогенной кости соответственно. Поэтому заменители кости с функцией замедленной послеоперационной резорбции стали перспективным вариантом трансплантационных материалов. Кроме того, в дополнение к восстановлению дефекта твердой ткани частицы трансплантата поддерживают и берут участие в формировании архитектуры мягких тканей, что помогает значительно улучшить эстетический результат реабилитации. Основными преимуществами использования процедуры, описанной в данной статье, являются восстановления полного вертикального объема костной ткани, сокращение общего времени лечения, достижение правильной позиции и углового наклона окончательных конструкций дентальных имплантатов. Buser и коллеги сообщили о формировании костной ткани с использованием нерезорбируемой мембраны в ходе заживления раны на протяжении 7-13 месяцев до установки имплантата. Было доказано, что установка интраоссальных опор одновременно с проведением GBR и использованием нерозорбируемого типа мембран требуют периода заживления приблизительно в 8,5 месяцев. В данном случае для ретенции мембраны и аугментата использовались конструкции ИУД и мембрана, армированная титаном. Установка же окончательных имплантатов проводилась уже после формирования костной ткани на аугментате. Подобный подход помогает установить титановую опору не только в оптимальном положении, но и с учетом объема сформированной кости. Все эти преимущества достигаются путем помещения конечного имплантата по тому же 3-мерному пути, который был использован для установки ИУД. Через 4 месяца после установки окончательных интраоссальных конструкций было отмечено их отличную интеграцию, что позволило удалить нерезорбируемую мембрану. Учитывая данные прежних исследований, ABBM-трансплантат продемонстрировал небольшую, если таковая вообще имело место, резорбцию материала. В одном из исследований скорость биодеградации ABBM сравнивали с таковой у аутогенной кости и смеси аутогенной кости с ABBM в соотношении 80:20. В десятилетней перспективе ABBM продемонстрировал значительно меньший объем резорбции, чем другие 2 исследуемые аналоги. В литературе сообщается, что нерезорбируемые мембраны демонстрируют довольно успешные результаты использования в структуре процедуры GBR. Несмотря на это, в значительном количестве клинических примеров в ходе аналогичных манипуляций сформировались дигисценции мягких тканей, которые возникали в процессе заживления. На ранней стадии такие осложнения обычно вызваны отсутствием факта первичного закрытия раны без напряжения. Подобные осложнения ставят под угрозу результат всей процедуры аугментации. В данном случае правильная фиксация мембраны и отсутствие напряжения при первичном закрытии области вмешательства помогли минимизировать риск возникновения осложнений, связанных с мягкими тканями. Первичная стабильность ИУД была достигнута за счет их установки в костную ткань на 5,8 мм. В исследовании, которое включало анализ 3 клинических случаев, было установлено, что установка ИУД всего лишь на 3 мм в структуру нативной костной ткани уже обеспечивает достаточный уровень стабильности конструкций в ходе GBR-вмешательства. Другим, но не менее важным осложнением при аугментации является инфицирование области вмешательства.
Следует отметить, что формирование дигисценций мягких тканей и инфицирование участков аугментации и имплантации являются тесно взаимосвязанными негативными результатами. Полное закрытие лоскута и назначение антибиотиков в нашем клиническом случае помогло избежать подобных осложнений на конечных этапах лечения.
Выводы
В данной статье представлен клинический случай, в котором продемонстрировано использование ИУД одновременно как ретенционных элементов в ходе аугментации, так и направляющих для установки окончательных дентальных имплантатов. Подобный подход обеспечивал успешную реконструкцию области костного дефекта путем правильного позиционирования, ангуляции и анкоража интраоссальных опор в кости пациента. Однако для оценки стабильности имплантатов и аугментации необходимо проведение дополнительных исследований с долгосрочным периодом наблюдения. Кроме того, для формирования прогноза вышеописанного подхода с использованием тентовых ИУД-опор в ходе GBR, требуется провести анализ большего количества клинических случаев.
Авторы:
Takanori Suzuki, DDS, PhD
Ismael Khouly, DDS, MS, PhD
Sang-Choon Cho, DDS
Stuart Froum, DDS
Успешность дентальных имплантатов, используемых в качестве опор реставраций, замещающих частичные и полные дефекты зубного ряда, хорошо описана в литературе. Кроме того, проведение процедуры аугментации костного гребня значительно расширило возможности имплантологического вмешательства. Но реализация реконструктивной фазы лечения, особенно в случаях увеличения вертикальных параметров верхней и нижней челюстей, является довольно затруднительным заданием для врача-клинициста.

Marx и коллеги описали технику использования временных имплантатов, играющих роль ретенционных элементов для фиксации аутогенных кортикогубчатых трансплантатов. Bach в ходе вертикальной аугментации успешно использовал титановые винты в сочетании с минерализованным гранулированным аллотрансплантатом, формируя из них «тенты» для формирования костной ткани. Fontana и коллеги с этой же целью использовали мини-винты из нержавеющей стали (длиной от 6 до 12 мм) в качестве крепежных элементов для поддержки армированной титаном расширенной политетрафторэтиленовой мембраны (e-PTFE), которая, в свою очередь, обеспечивает ретенцию необходимого объема пространства для последующей регенерации костной ткани. Таким образом авторам также удалось минимизировать уровень резорбции костных блоков, используемых для аугментации, и достичь средних параметров вертикального увеличения кости в 4,02 ± 1,53 мм. С другой стороны, подобные методики вмешательства характеризуются повышенным риском неправильного позиционирования имплантатов, не говоря уже о том, что в подобных случаях могут возникнуть и дефекты в форме дигисценций. Подобные осложнения могут свести на нет все запланированные результаты стоматологической реабилитации. Аналогично концепцию опоры для тента можно реализовать и с использованием имплантатов узкого диаметра (ИУД) (категория 1, диаметр менее 3,0 мм), которые сначала были представлены на рынке в качестве переходных конструкций для поддержки непосредственно нагруженных провизорных реставраций. Учитывая, что подобным имплантатам удавалось достичь хорошего первичного уровня стабильности, они впоследствии стали использоваться не только для ретенции пространства или поддержки временных конструкций, но и в качестве направляющих для позиционирования и аннуляции постоянных титановых внутрикостных элементов.
Цель данной статьи состоит в том, чтобы описать пошаговую методику использования ИУД в качестве опор в ходе проведения процедуры GBR и направляющих ориентиров для конструкций постоянных имплантатов.
Клинический случай
57-летний мужчина обратился за помощью на кафедру пародонтологии и имплантологии им. Ашмана в Нью-Йоркском университете (Нью-Йорк). Пациент желал провести установку имплантата в области верхнего центрального резца слева (зуб № 9). В анамнезе у больного не отмечалось ни системных заболеваний, ни фактов радиационного воздействия, ни проведения химиотерапии. Также пациент не курил, а его пародонтальный статус являлся удовлетворительным. В ходе анализа было обнаружено, что пациенту 2 года назад уже проводилось эндодонтическое лечение и апикоэктомия зуба № 9. Однако в результате лечения зуб был подвергнут структурным нарушениям и его необходимо было экстрагировать (фото 1 - 3).
Фото 1. Вид проблемного зуба № 9.

Фото 2. Клинический вид зуба № 9.

Фото 3. Экстракция зуба № 9.

Через 4 месяца после удаления (фото 4 - 5) посредством рентгенографии было установлено вертикальную потерю костной ткани на 10,9 мм, при этом костный гребень с интерапроксимальных сторон соседних зубов не был нарушен (фото 6).
Фото 4. Вид через 4 месяца после экстракции.

Фото 5. Вид гребня после экстракции.

Фото 6. Визуализация значительной вертикальной потери костной ткани и сохранение кости в апроксимальных участках.

Планирование будущего лечения проводилось вместе с врачом-ортопедом. На этапах подготовки были получены томографические срезы зубочелюстного аппарата, диагностические модели, восковые репродукции и хирургические шаблоны. Пациент был проконсультирован относительно будущего вмешательства, после чего подписал форму согласия на проведение соответствующих процедур. Предполагалось провести направленную установку дентальных имплантатов с использованием предварительной аугментации костным заменителем, а также ИУД в качестве ретенционного элемента.
За 1 час перед началом операционной вмешательства пациенту назначали 2 грамма амоксициллина (TEVA Pharmaceuticals, tevausa.com). Местную инфильтрационную анестезию проводили посредством 2% раствора лидокаина с адреналином в концентрации 1: 100 000 адреналина (Henry Schein, henryschein.com). После крестального разреза провели еще два вертикальных послабляющих в области 8 и 10 зубов. Эти надрезы продлевали апикально к границе слизисто-десневого соединения. После сепарации полнотканного слизистонадкостничного лоскута был обнажен костный дефект 3 класса, который в горизонтальном направлении расширялся до 5,8 мм, а в вертикальном – до 10,9 мм (фото 7).
Фото 7. Визуализация дефекта после сепарации гребня.

Остеотомию проводили согласно запланированной позиции имплантата, используя для этого хирургический шаблон. Глубина препарирования кости составляла 4 мм, а диаметр – 1,3 мм (CePo, Dentatus) при скорости в 1500 об./мин. с обильным орошением. Декортикацию проводили только в области кортикальной щечной пластинки посредством круглого алмазного бора № 1 с обильным орошением. ИУД (Smart Slim, EBI North America) диаметром 2,2 мм и длиной 16 мм были помещены в структуру кости на 5,8 мм так, чтобы 10,2 мм внутрикостной опоры оставалась обнаженной (фото 8).
Фото 8. Установка имплантата узкого диаметра (ИУД).

Измерения обнаженной части ИУД проводились с использованием цифрового микрометра (Absolute Snap Caliper Series 573, Mitutoyo) с точностью до 0,01 мм. Процедуру GBR выполняли одновременно с установкой ИУД. Для этого использовали отконтурированную титановую мембрану (Cytoplast Ti-250, Osteogenics Biomedical) и мелкозернистый (от 0,25 до 1,0 мм) неорганический костный трансплантат бычьего происхождения (ABBM) (BioOss, Geistlich Pharma North America). Хромированные кетгутовые нити размером 4,0 (Henry Schein) применялись для фиксации мембраны к надкостнице (фото 9). Непрерывное первичное закрытие крестального разреза было достигнуто за счет резорбируемых швов размером нитей 4.0, а вертикальных разрезов за счет прерывистых швов нитями 5,0. Для оценки позиции ИУД получили рентгеновский снимок (фото 10).
Фото 9. Фиксация нерезорбируемой мембраны.

Фото 10. Рентгенограмма после установки ИУД и НКР.

В течение последующих 4 месяцев пациент находился под наблюдением с интервалами в 4-5 недель. Через полгода провели повторный крестальный разрез несколько палатинальнее предыдущего, а после него – и соответствующие внутриборозковые разрезы. Процедуру проводили под местной анестезией, используя 2% лидокаин с концентрацией адреналина 1: 100 000. Сепарацию полнотканного слизистопериостального лоскута проводили только в области вершины гребня, стараясь минимально затронуть щечную часть кости (фото 11).
Фото 11. Повторное вмешательство.

Армированную титановую мембрану разрезали лезвием 15С и хирургическими ножницами для воссоздания необходимого круглого отверстия диаметром 4 мм для последующей установки имплантата. Образование кости наблюдалось непосредственно апикально относительно мембраны. ИУД был удален с помощью адаптера имплантата, соединенного с имплантологическим ключом. До удаления ИУД дополнительно проводили его измерения с точностью до 0,01 мм. Таким образом, относительно вертикальных параметров имплантатов удалось точно измерить и величину прироста кости после аугментации. Постоянные имплантаты диаметром 4,1 мм и длиной 14 мм (SLActive, Straumann) устанавливали по длинной оси области экстракции ИУД, при этом данные конструкции на 3-4 мм входили в интактную кость пациента (фото 12). Стабильности имплантата, превышающей 35 Нсм, достигали за счет динамометрического ключа. Для проверки позиции конструкции провели контрольную рентгенограмму (фото 13). С целью дальнейшего изготовления временной конструкции был получен оттиск на уровне платформы интраоссальной опоры (фото 14).
Фото 12. Установка окончательного имплантата (4,1 мм x 14,0 мм).

Фото 13. Рентгенограмма после установки имплантата.

Фото 14. Установка провизорной конструкции.

Ушивание области вмешательства проводили прерывистыми швами хромированным кетгутовыми нитями размером 4,0 (Henry Schein). Пациенту были предписаны полоскания 0,12% раствором хлоргексидина глюконата два раза в день на протяжении 2 недель, а также прием 500 мг амоксициллина в течение 1 недели. Тщательный мониторинг за пациентом проводился на протяжении 3-4 месяцев. Спустя полгода несколько с небной стороны был сформирован крестальный разрез в области титановой опоры, на которую зафиксировали провизорную коронку. После достижения необходимого контура мягких тканей провели установку окончательной протетической конструкции (фото 15 - 17).
Фото 15. Установка окончательной коронки.

Фото 16. Окклюзионный вид окончательной коронки.

Фото 17. Рентгенограмма после фиксации окончательной коронки.

В последующий период пациента наблюдали каждые 3 месяца. Состояние мягких и твердых тканей оценивали через 3 года и через 5 лет после фиксации коронковой реставрации. Глубина зондирования в периимплантатной области составляла 3 мм или менее, кровотечения в ходе зондирования не наблюдалось, а мягкие и твердые ткани оставались максимально стабильными (фото 18 - 23). С медиальной стороны 8 и 9 зубов были выполнены композитные реставрации для закрытия области черных треугольников (фото 24).
Фото 18. Вид через три года после лечения.

Фото 19. Окклюзионный вид через три года после лечения.

Фото 20. Рентгенограмма через три года после лечения.

Фото 21. Вид через пять лет после лечения.

Фото 22. Окклюзионный вид через пять лет после лечения.

Фото 23. Рентгенограмма через пять лет после лечения.

Фото 24. Вид через пять лет после лечения.

Результаты
В данном клиническом случае у пациента наблюдался вертикальный дефект костного гребня размером 10,9 мм. Лечение проводилось с использованием ИУД и техники тентовой опоры, в результате чего удалось полностью восстановить дефицит костной ткани. Стабильность окружающих имплантат мягких и твердых тканей была подтверждена результатами повторных осмотров, проводимых в течение 3 лет после окончания лечения.
Обсуждение
Ремоделирование костной ткани после экстракции зуба приводит к потере вертикальных и горизонтальных параметров костного гребня. В зависимости от анатомического положения и размера дефекта для восстановления дефицита кости и создания условия для установки дентального имплантата могут применяться различные хирургические подходы. Многие авторы сообщали об успешности использования с данной целью аутогенных костных трансплантатов, однако использование таковых является весьма ограниченным при наличии трехмерных объемных дефектов, компрометирующих не только функциональные, но и эстетические параметры проблемной области. Для восстановления подобных участков с большим дефицитом костной ткани для получения надлежащего количества костного материала необходимо провести его забор из внеротовых донорских областей. Техника, предложенная Marx и коллегами, предполагает использование ИУД в качестве тентовых опор, которые обеспечивают максимальную ретенцию костного трансплантата, упакованного по принципу GBR. Такой подход помогает восстановить объемный вертикальный дефект резидуального гребня вообще без использования аутогенного костного материала. Согласно методу Marx, врач должен провести расширения мягких тканей для формирования надлежащего объема, и ИУД играет роль «тентовых опор», используемых для стабилизации гранулированного окружающего трансплантата. Подобный подход помогает минимизировать риск коллапса окружающих мягких тканей и смещения костного заменителя, таким образом, гарантируя достижение наиболее приемлемого результата.
В данном случае в качестве костного заменителя использовали неорганический материал бычьего происхождения, частицы которого гидратировали физиологическим раствором в течение приблизительно 1-2 минут перед размещением, обеспечивая, таким образом, адгезию материала. После этого область аугментации покрывали защитной мембраной d-PTFE, армированной титаном. В исследовании Urban и коллег, подобный подход помог добиться стабильной регенерации кости в случаях увеличения вертикальных параметров костного гребня. Неорганический бычий костный минерал сыграл роль каркаса для формирования новой ткани. Раннее проведенные гистологическое исследование с участием людей показали, что поверхность частиц данного материала, размещенных вокруг имплантатов в 70,3% случаев, впоследствии покрывались зрелой костной тканью. Данные результаты были подтверждены в ходе биопсии через 14-80 месяцев. Berglundh и Lindhe, изучая остеокондуктивный потенциал ABBM при размещении его в области дефектов нижней челюсти у биглей, пришли к выводу, что через 3-7 месяцев наблюдалось полное восстановление дефекта, а частицы трансплантата были окружены и частично замещены параллельными фибриновыми волокнами и пластинчатой костью. Simion и коллеги для увеличения вертикальных параметров кости использовали композитный трансплантат, состоящий из ABBM и аутогенной кости в соотношении 1:1. Они наблюдали, что данный материал подвергается резорбции более медленно, чем его аналоги. Schlegel и коллеги, сравнивая скорость резорбции аутогенного костного материала и ABBM при синус-лифте, пришли выводу, что через 6 месяцев уменьшение объема составляло 15% и 40% для ABBM и аутогенной кости соответственно. Поэтому заменители кости с функцией замедленной послеоперационной резорбции стали перспективным вариантом трансплантационных материалов. Кроме того, в дополнение к восстановлению дефекта твердой ткани частицы трансплантата поддерживают и берут участие в формировании архитектуры мягких тканей, что помогает значительно улучшить эстетический результат реабилитации. Основными преимуществами использования процедуры, описанной в данной статье, являются восстановления полного вертикального объема костной ткани, сокращение общего времени лечения, достижение правильной позиции и углового наклона окончательных конструкций дентальных имплантатов. Buser и коллеги сообщили о формировании костной ткани с использованием нерезорбируемой мембраны в ходе заживления раны на протяжении 7-13 месяцев до установки имплантата. Было доказано, что установка интраоссальных опор одновременно с проведением GBR и использованием нерозорбируемого типа мембран требуют периода заживления приблизительно в 8,5 месяцев. В данном случае для ретенции мембраны и аугментата использовались конструкции ИУД и мембрана, армированная титаном. Установка же окончательных имплантатов проводилась уже после формирования костной ткани на аугментате. Подобный подход помогает установить титановую опору не только в оптимальном положении, но и с учетом объема сформированной кости. Все эти преимущества достигаются путем помещения конечного имплантата по тому же 3-мерному пути, который был использован для установки ИУД. Через 4 месяца после установки окончательных интраоссальных конструкций было отмечено их отличную интеграцию, что позволило удалить нерезорбируемую мембрану. Учитывая данные прежних исследований, ABBM-трансплантат продемонстрировал небольшую, если таковая вообще имело место, резорбцию материала. В одном из исследований скорость биодеградации ABBM сравнивали с таковой у аутогенной кости и смеси аутогенной кости с ABBM в соотношении 80:20. В десятилетней перспективе ABBM продемонстрировал значительно меньший объем резорбции, чем другие 2 исследуемые аналоги. В литературе сообщается, что нерезорбируемые мембраны демонстрируют довольно успешные результаты использования в структуре процедуры GBR. Несмотря на это, в значительном количестве клинических примеров в ходе аналогичных манипуляций сформировались дигисценции мягких тканей, которые возникали в процессе заживления. На ранней стадии такие осложнения обычно вызваны отсутствием факта первичного закрытия раны без напряжения. Подобные осложнения ставят под угрозу результат всей процедуры аугментации. В данном случае правильная фиксация мембраны и отсутствие напряжения при первичном закрытии области вмешательства помогли минимизировать риск возникновения осложнений, связанных с мягкими тканями. Первичная стабильность ИУД была достигнута за счет их установки в костную ткань на 5,8 мм. В исследовании, которое включало анализ 3 клинических случаев, было установлено, что установка ИУД всего лишь на 3 мм в структуру нативной костной ткани уже обеспечивает достаточный уровень стабильности конструкций в ходе GBR-вмешательства. Другим, но не менее важным осложнением при аугментации является инфицирование области вмешательства.
Следует отметить, что формирование дигисценций мягких тканей и инфицирование участков аугментации и имплантации являются тесно взаимосвязанными негативными результатами. Полное закрытие лоскута и назначение антибиотиков в нашем клиническом случае помогло избежать подобных осложнений на конечных этапах лечения.
Выводы
В данной статье представлен клинический случай, в котором продемонстрировано использование ИУД одновременно как ретенционных элементов в ходе аугментации, так и направляющих для установки окончательных дентальных имплантатов. Подобный подход обеспечивал успешную реконструкцию области костного дефекта путем правильного позиционирования, ангуляции и анкоража интраоссальных опор в кости пациента. Однако для оценки стабильности имплантатов и аугментации необходимо проведение дополнительных исследований с долгосрочным периодом наблюдения. Кроме того, для формирования прогноза вышеописанного подхода с использованием тентовых ИУД-опор в ходе GBR, требуется провести анализ большего количества клинических случаев.
Авторы:
Takanori Suzuki, DDS, PhD
Ismael Khouly, DDS, MS, PhD
Sang-Choon Cho, DDS
Stuart Froum, DDS





























































































































































1 комментарий
это золотая пломба или вкладка на резце мне не давала покоя