Фибриновый герметик (ФГ) представляет собой продукт, полученный из крови пациента, который используется при проведении хирургических манипуляций в челюстно-лицевой области. Данный материал начали использовать с 1975 года благодаря его уникальными гемостатическим и адгезивным свойствам у пациентов с имеющимися нарушениями гемостаза.
Cardaropoli D. и коллеги в 2013 году модифицировали технику Corrente посредством добавления к протоколу вмешательства применения коллагеновой мембраны, благодаря чему удалось добиться вертикального прироста костной ткани в 3,95 мм. При выполнении регенераторных манипуляций ФГ позволяет улучшить свойства костного трансплантата, обеспечивая его «липкую» консистенцию, а также пластичную и легко-адаптированную форму, сохраняя при этом всю наполненность гранул. ФГ характеризуется наличием остеоиндуктивных свойств при их смешивании с остеокондуктивными биоматериалами. Кроме того, ФГ способствует ангиогенезу благодаря связи фибриногена с фактором роста VEGF, что в свою очередь стимулирует пролиферацию эндотелиальных клеток. Фибриноген также индуцирует формирование внеклеточного матрикса для поддержания кровообеспечения, развития структур соединительной ткани и костной ткани.
В 2012 году Linsley установил, что фибриноген индуцирует рост мезенхимальных клеток и их последующую дифференциацию в остеобласты. Дополнительной фибриновые герметик также ускоряет заживление раны.
Кортикальная пластинка
Материал кортикальной пластинки (Cortical Lamina Osteobiol от Tecnoss, Coazze, Италия) представляет собой мембрану, используемую при проведении направленной костной регенерации, и изготовленную из коллагенизированной бычьей кости. Данная мембрана является универсальной, поскольку она изготавливается в трех разных версиях: в изогнутом состоянии, в мягкой консистенции и в форме костного слоя. Наличие данных трех вариантов способствует возможности различного использования материала при проведении направленной костной регенерации в случаях горизонтальной, вертикальной или трехмерной реконструкции гребня. Rossi и коллеги провели гистологическое и клиническое исследования, в котором реконструкцию костных участков нижней челюсти у пациентов проводили с применением кортикальной пластинки и коллагенизированного костного ксенотрансплантата (GenOs Osteobiol By Tecnoss, Coazze, Италия), которые смешивали с кровяным сгустком, полученным от пациента. Материал кортикальной пластинки позиционировали поверх аугментированного участка с целью увеличить ширину и высоту последнего. Через 6-8 месяцев после заживления в данные участки были установлены дентальные имплантата, но перед этим аккуратно изымали незначительный объем костной ткани для биопсии. Все установленные внутрикостные опоры интегрировали хорошо, и через год после фиксации окончательных ортопедических конструкций, заметных потерь уровня костного гребня обнаружено не было. Результаты биопсии демонстрировали наличие минерализованной костной ткани в области проведенной аугментации. Костная пластинка в выгнутом состоянии характеризуется определёнными уровнями жесткости и эластичности, что позволяет адаптировать ее к анатомическим условиям конкретного участка челюсти. Мягкая форма пластинки аналогична любой резорбируемой мембране, и может быть зафиксирована при помощи специальных пинов. Таким образом материал кортикальной пластинки является достаточно эффективным для использования при проведении аугментации костного гребня. Мягкий тип пластинки доказал свою эффективность при реализации протокола вмешательства F.I.R.S.T.
F.I.R.S.T.
В 2016 году авторы установили, что фибриновый герметик идеально подходит для обеспечения фиксации материала кортикальной пластинки, исключая необходимость применения винтов. Цель исследования состояла в том, чтобы сформировать такой комплекс материалов, при котором они ставали, по сути, единым целым. Стабильность костного заменителя является одним из ключевых факторов успеха направленной костной регенерации. Кроме того, применение ФГ само по себе улучшает регенерацию тканей через остеоиндуктивную способность фибриногена. Таким образом было сформулировано название подхода F.I.R.S.T. - Fibrinogen-Induced Regeneration Sealing Technique (фибриноген-индуцированная техника герметической регенерации).
Клинический случай
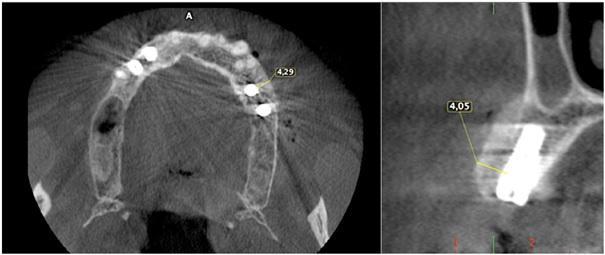
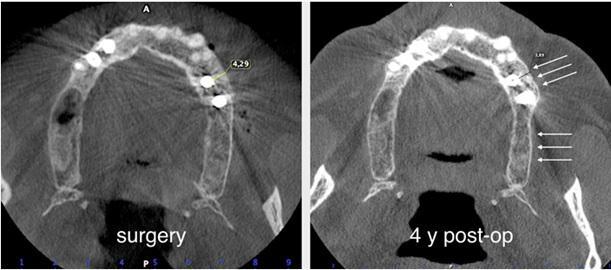
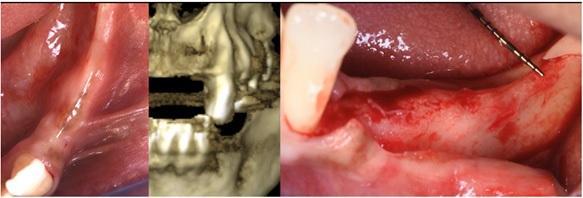
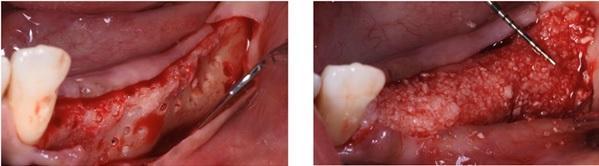
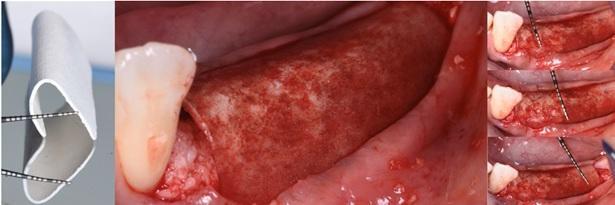
Пациента 64 лет с наличием пародонтита в анамнезе, без отягощающих общесоматических нарушений, аллергий или непереносимости, обратилась за помощью по поводу имеющейся у нее частичной адентии во втором квадранте, которая, кроме того, сопровождалась выраженной горизонтальной резорбцией костной ткани. На первом этапе лечения обеспечили полную дезинфекцию ротовой полости, а также назначили систематическое лечение посредством метронидазола и амоксициллина на период одной недели. Через 3 месяца поддержания оптимального состояния тканей пародонта, провели КЛКТ-диагностику, которая установила, что толщина остаточного гребня составляет менее 5 мм. При этом толщина самой кортикальной пластинки не превышала 1 мм, в то время как рекомендованная толщина таковой для прогнозированного лечения должна составлять 2 мм. После выполнения местной анестезии артикаином с концентрацией адреналина 1:200000 провели крестальный разрез и сепарировали полнотканный вестибулярный лоскут. Для обеспечения надлежащей подвижности лоскута дополнительно сформировали два послабляющие вертикальных разрезы. С небной стороны сепарацию лоскута проводили на 10 мм в апикальном направлении без выполнения дополнительных вертикальных разрезов. Декортикацию вестибулярной костной пластинки проводили посредством пъезотома IM1S PiezoSurgery (Mectron, Carasco, Италия). В проекции 25 и 26 зубов установили дентальные имплантаты IK 3,8x13 мм и IK 3,8x11 мм (Resista Group, Verbania, Италия) устанавливались в области 25 и 26. В ходе установки обнажения резьбы опор не отмечалось, но толщина вестибулярной костной пластинки была критически минимальной. После 10-минутной гидратации в физиологическом растворе, кортикальную пластинку толщиной 0,5 мм и размером 25 мм на 25 мм (Soft Fine Cortical Lamina Osteobiol от Tecnoss, Coazze, Италия) обрезали по размеру имеющегося горизонтального вестибулярного костного дефекта так, чтобы часть материала выходила на небную поверхность. После разбавления тромбина в отношении 1:10 стерильной бидистиллированной водой несколько капель ФГ (Tisseel, Baxter, Рим, Италия) наносили на коллагенизированный ксенотрансплантат (GenOs, Osteobiol от Tecnoss, Coazze, Италия). Разбавление ФГ является необходимым, дабы избежать его немедленной полимеризации, которая в результате может привести к фиброзной инкапсуляции трансплантата без интеграции в область дефекта. Полученную смесь материалов вносили в область горизонтального дефекта, формируя новый анатомический контур. Через 5 минут трансплантат характеризовался устойчивым положением, и был хорошо адаптирован к области дефекта без потери гранул, и с достижением пластилинообразной консистенции. Внутренняя часть материала кортикальной пластинки также была покрыта незначительным количеством ФГ, после чего мембрану позиционировали в области вмешательства. Материал кортикальной пластинки плотно крепился к поверхности костной ткани, исключая необходимость дополнительного применения фиксирующих пинов или швов. В конце операции область вмешательства ушивали горизонтальными матрасными швами 5-0 из полипропилена (Aragò, Барселона, Испания). Пациентке был назначен прием амоксициллина 500 мг каждые 8 часов в течение 7 дней, ибупрофен 600 мгx3 в течение 3 дней, и полоскание полости рта хлоргексидин 0,20%. Данные послеоперационного КЛКТ-сканирования продемонстрировали прирост 4,05 мм костной ткани. Швы удаляли через 2 недели (фото 1-7).
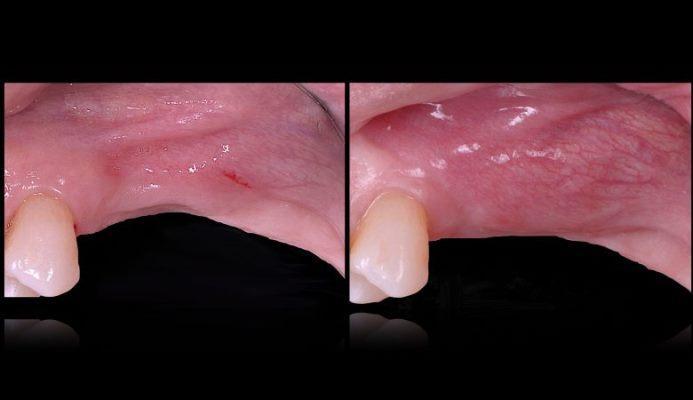
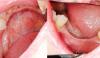
Фото 1. Вид до лечения. Вогнутость вестибулярной щечной пластинки в верхнем левом квадранте челюсти.
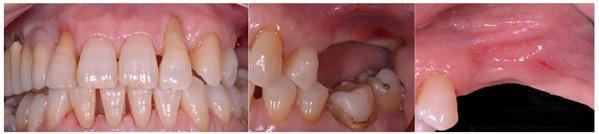
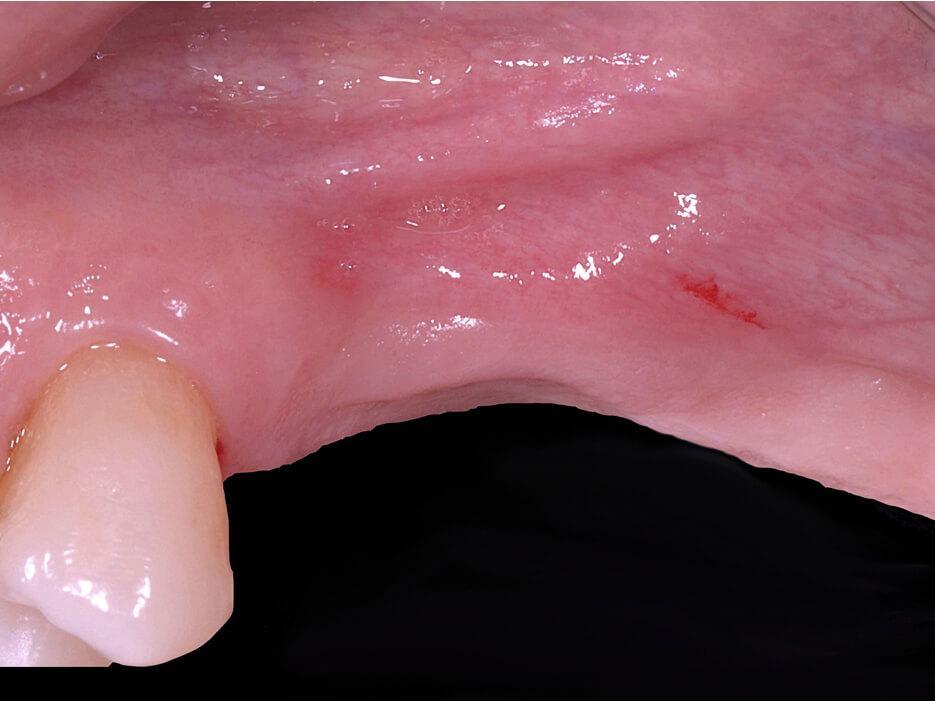
Фото 2. Толщина костной ткани составляла менее 5 мм. В области запланированной позиции имплантата толщина костной ткани составляла менее 1 мм.
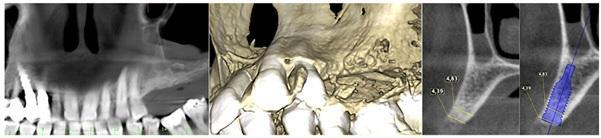
Фото 3. А: Вид костного гребня. В. Гидратация пластинки. С. Адаптация мембраны по контуру гребня.

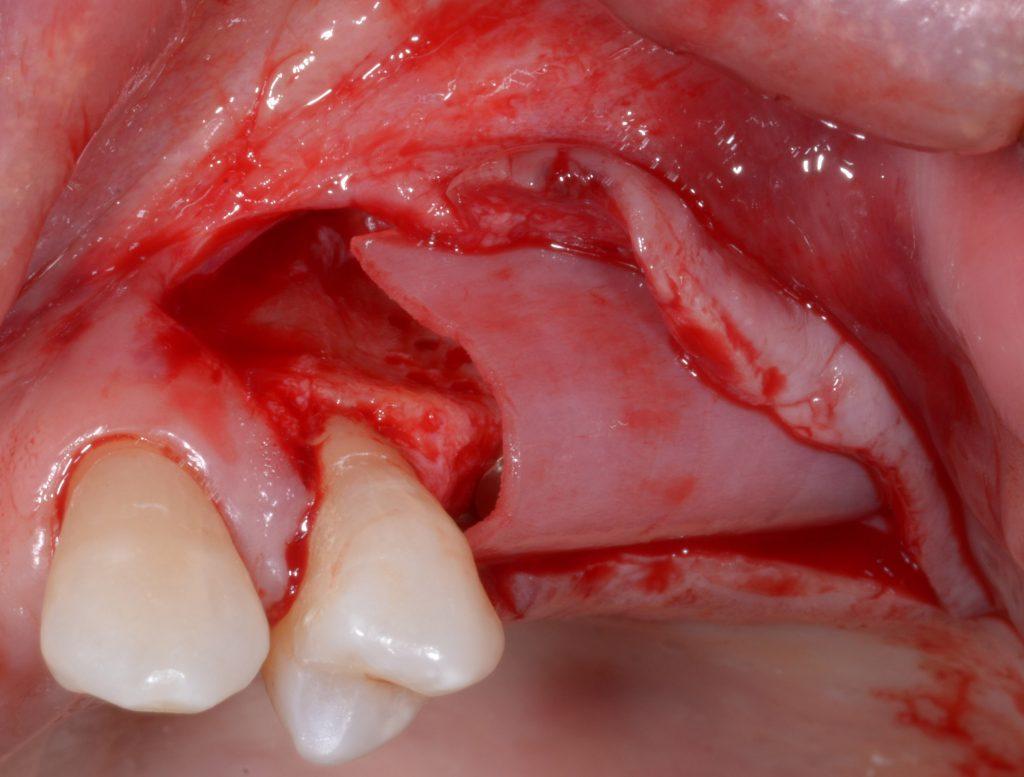
Фото 4. А: Замешивание трансплантата. В. Адгезия трансплантата. С. Объем и стабильность трансплантата.
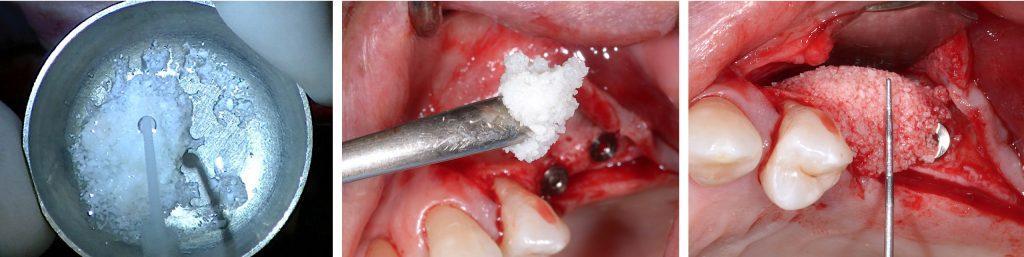
Фото 5. А: Нанесение материала на пластинку. В. Стабилизация при помощи пинов.
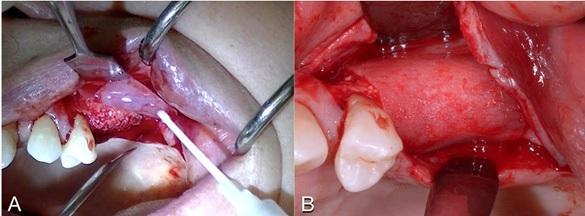
Фото 6. А: Швы. В. Горизонтальные матрасные швы. С. Вид через 2 недели.
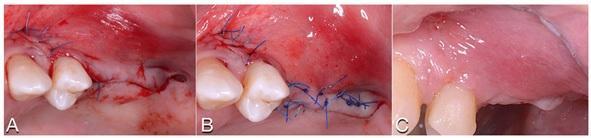
Фото 7. КЛКТ после проведения операции.
Через полгода после оперативного вмешательства данные КЛКТ снова-таки подтвердили наличие дополнительных 4,05 мм костной ткани, которая характеризовалась первичными признаками минерализации. Мезиально установленный имплантат был полностью перекрыт твердыми тканями. В ходе имплантации также проводили забор материала для биопсии. На имплантаты фиксировали формирователи десен и ушивали мягкие ткани. Через 3 месяца пациентке был зафиксирован мостовидный протез, выполненный из золота и внешне перекрытий керамикой. Данные биопсии подтвердили формирование новой трабекулярной кости, в контакте с которой находили остаточные частицы трансплантата, а также наличие остеоидного матрикса с сосудами и клетками костной ткани. Никаких некротических или воспалительных клеток в гистологическом материала обнаружено не было. Через три года после проведения хирургического вмешательства, данные КЛКТ подтвердили стабильность мягких и твердых тканей. Уровень прироста костной ткани, полученный в ходе аугментации, оставался стабильным и составлял 4,05 мм. Прицельные рентгенограммы не демонстрировали потери маргинального костного гребня вокруг имплантатов. Через четыре года после проведенного лечения было отмечено, что материал трансплантата почти полностью резорбировался и был замещен новообразовавшейся костной тканью, которая рентгенологически была аналогична структуре интактной кости. Сформированная кортикальная пластинка с вестибулярной стороны была полностью аналогична интактной пластинке с небной стороны челюсти (фото 8-15).
Фото 8. Новая анатомическая форма через 6 месяцев.
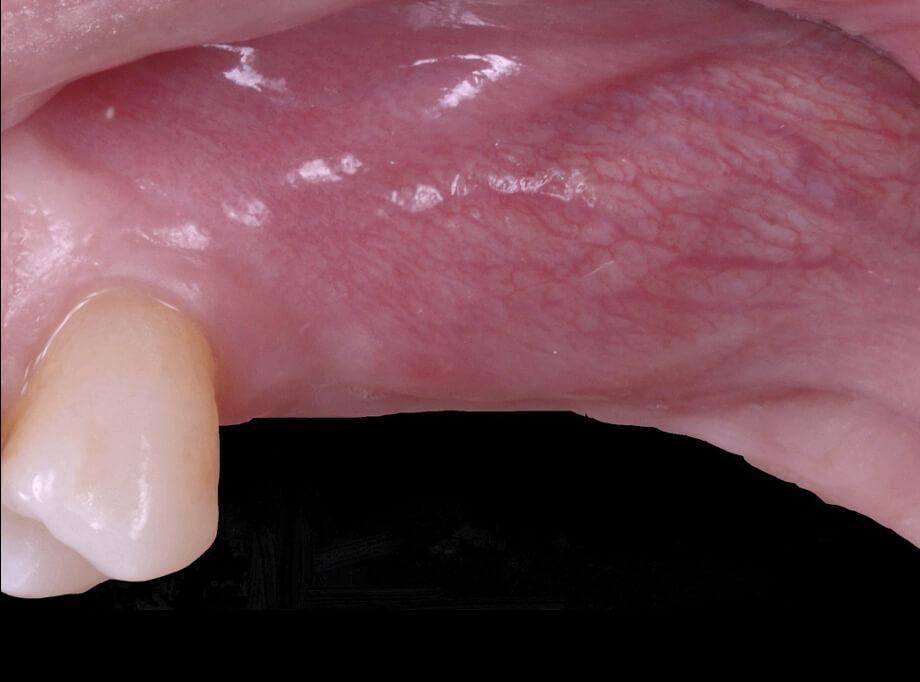
Фото 9. Горизонтальный прирост кости на 4,05 мм. Начальная минерализация сформированной костной ткани.
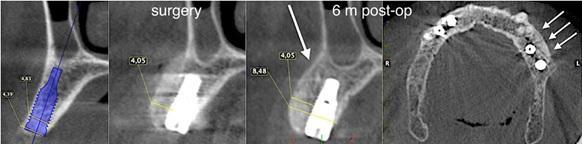
Фото 10. А: Вид на исходной ситуации. В. Удаление костной ткани поверх фиксирующего пина. С. Объем на момент повторного открытия.
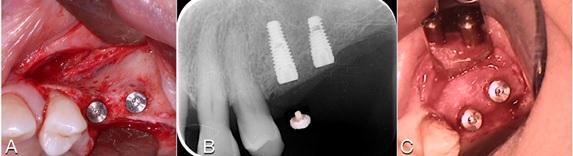
Фото 11. А: Увеличение в 100 раз: Частицы резидуального биоматериала находятся в тесном контакте с новой сформированной трабекулярной костью и остеоидом. Отсутствие некротических или воспалительных клеток. В. Увеличение в 200 раз: Частицы резидуального биоматериала находятся в тесном контакте с новой сформированной трабекулярной костью и остеоидом на периферии участка минерализации. Внутри визуализируются активные остеобласты и новые кровеносные сосуды.
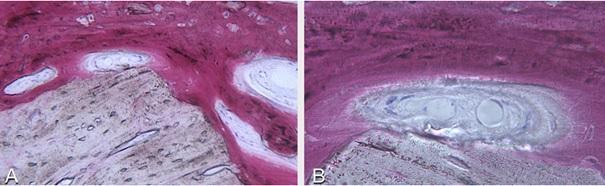
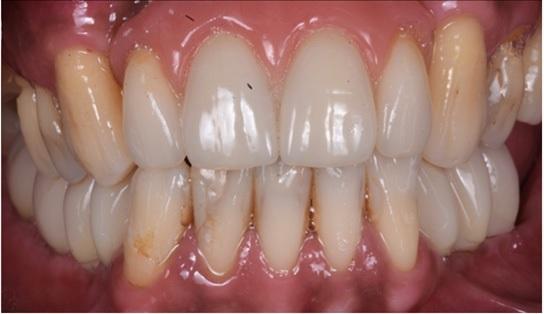
Фото 12. Протетическая реабилитация.
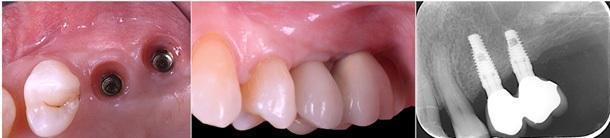
Фото 13. Ретенция достигнутого прироста костной ткани в 4,05 мм. Отсутствие признаков потери костной ткани в области платформы имплантата.
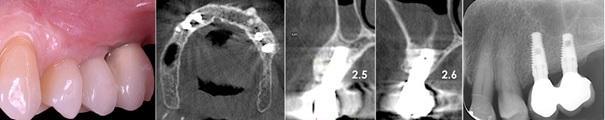
Фото 14. Через 4 года трансплантат почти полностью резорбировался. Визуализируются признаки минерализации новой костной ткани.
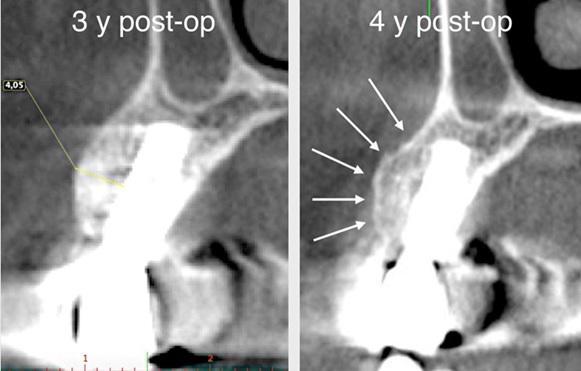
Фото 15. Новая сформированная кортикальная костная ткань почти идентична с естественной.
Клинический случай 2
Пациент 40 лет, страдающий пародонтитом IV степени, обратился в клинику для решения проблемы с беззубыми участками челюстей. Данные КЛКТ подтвердили выраженную резорбцию костного гребня, толщина которого в отдельных участках составляла не более 1 мм. Общесоматическое состояние пациента было хорошим, и согласно критериям отбора, он полностью подходил для проведения вмешательства по алгоритму F.I.R.S.T. Показание к проведения подобного вмешательства в данном конкретном клиническом случае было оправдано фактом тяжелой горизонтальной резорбции. Применение принципа «липкой кости» повысило бы шансы на достижение стабильного положения трансплантата и улучшения качества костной ткани в области аугментации в целом. После выполнения местной анестезии артикаином с концентрацией анестетика 1:200000, приступили к сепарации лоскута со щечной и язычной сторон челюсти (фото 16).
Фото 16. Вид участка адентии челюсти до и после сепарации гребня.
Перфорацию костной ткани посредством пьезотома проводили с целью достижения следующих эффектов:
- Для стимуляции кровотечения с пространств костного мозга.
- Для формирования ниш в структуре гребня, которые бы способствовали достижению надлежащей стабильности костного заменителя (фото 17).
Фото 17. Формирование внутрикортикальных отверстий для обеспечения стабилизации графта.
Протокол гидратации кортико-губчатого ксенотрансплантата (GenOs Osteobiol, Tecnoss, Coazze, Италия) был аналогичен описанному выше. Применение ФГ способствовало достижению надлежащей стабильности графта, и его ретенции на поверхности костной ткани челюсти (фото 18).
Фото 18. Кортикальная пластинка «приклеивается» к поверхности костного гребня.
В данном клиническом случае важно было учесть то, что аугментат все равно буле подлежать некоторой степени ремоделирования. Кроме того, потенциальное ремоделирования кости также может быть связано с использованием пациентом частичного съемного протеза. Следовательно, для компенсации такого эффекта необходимо было сформировать «гиперконтур» костного гребня. Из-за отсутствия зубов невозможно было ограничить пациента от использования протеза, следовательно, это было еще одной причиной, аргументирующей воссоздание гиперконтура твердых тканей посредством аугментации (фото 19). Через полгода пациенту провели установку имплантатов диаметров 3,4 мм, на которые зафиксировали временны акриловые протетические реставрации. Через 3 года после операционного вмешательства состояния мягких и твердых тканей в аугментированных участках оставалось стабильным (фото 20-23).
Фото 19. Вид гребня до и после проведения аугментации.
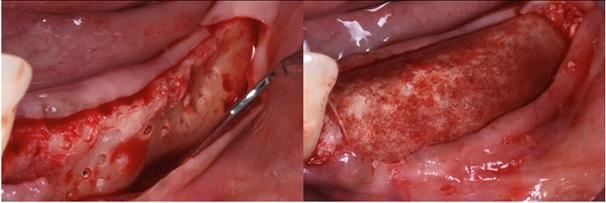
Фото 20. Вид гребня до лечения и через 6 месяцев после аугментации.
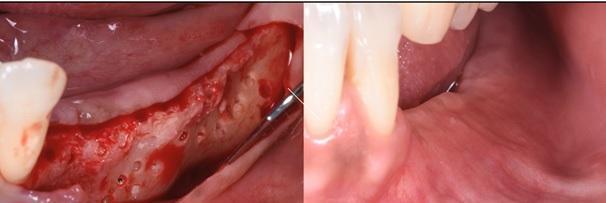
Фото 21. Установку двух имплантатов диаметром 3,4 мм через полгода после аугментации.
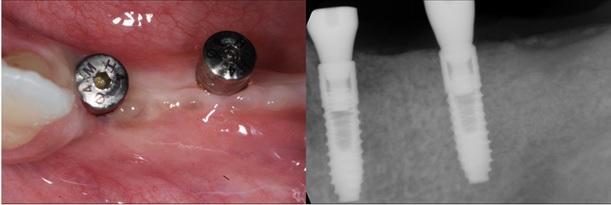
Фото 22. Полная стабильность аугментированного участка через 3 года после нагрузки имплантатов.
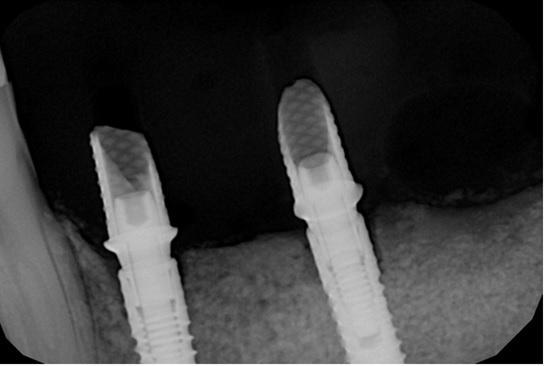
Фото 23. Вид провизорных акриловых реставраций.
Заключение
Направленная костная регенерация является широко используемым подходом для восстановления участков челюстей, характеризующихся дефицитом костной ткани. Ключевыми факторами для успеха данной манипуляции являются: биосовместимость, интеграция тканей, обеспечения надлежащего объема пространства, миграция клеток и особенности клинического вмешательства. Стабильность костного заменителя, как и стабильность барьерных мембран, являются одними из наиболее проблемных аспектов направленной костной регенерации. Добавление фибринового герметика к костному трансплантату и добавление данного герметика к материалу кортикальной мембраны обеспечивает «приклеивание» данных форм аугментатов к анатомическому профилю костного гребня. В вышеописанных клинических случаях ФГ также способствовал:
- Регенерации костной ткани
- Стабильности области вмешательства с целью обеспечения нормального течения процесса остеоинтеграции.
Для подтверждения успешности данной методики, конечно же, необходимо проведение дополнительных исследований, но результаты, полученные в описанных выше двух клинических случаях, являются весьма многообещающими.
Авторы: Foti Vincenzo, Rossi Roberto (частная практика, Генуя, Италия)
Фибриновый герметик (ФГ) представляет собой продукт, полученный из крови пациента, который используется при проведении хирургических манипуляций в челюстно-лицевой области. Данный материал начали использовать с 1975 года благодаря его уникальными гемостатическим и адгезивным свойствам у пациентов с имеющимися нарушениями гемостаза.

Cardaropoli D. и коллеги в 2013 году модифицировали технику Corrente посредством добавления к протоколу вмешательства применения коллагеновой мембраны, благодаря чему удалось добиться вертикального прироста костной ткани в 3,95 мм. При выполнении регенераторных манипуляций ФГ позволяет улучшить свойства костного трансплантата, обеспечивая его «липкую» консистенцию, а также пластичную и легко-адаптированную форму, сохраняя при этом всю наполненность гранул. ФГ характеризуется наличием остеоиндуктивных свойств при их смешивании с остеокондуктивными биоматериалами. Кроме того, ФГ способствует ангиогенезу благодаря связи фибриногена с фактором роста VEGF, что в свою очередь стимулирует пролиферацию эндотелиальных клеток. Фибриноген также индуцирует формирование внеклеточного матрикса для поддержания кровообеспечения, развития структур соединительной ткани и костной ткани.
В 2012 году Linsley установил, что фибриноген индуцирует рост мезенхимальных клеток и их последующую дифференциацию в остеобласты. Дополнительной фибриновые герметик также ускоряет заживление раны.
Кортикальная пластинка
Материал кортикальной пластинки (Cortical Lamina Osteobiol от Tecnoss, Coazze, Италия) представляет собой мембрану, используемую при проведении направленной костной регенерации, и изготовленную из коллагенизированной бычьей кости. Данная мембрана является универсальной, поскольку она изготавливается в трех разных версиях: в изогнутом состоянии, в мягкой консистенции и в форме костного слоя. Наличие данных трех вариантов способствует возможности различного использования материала при проведении направленной костной регенерации в случаях горизонтальной, вертикальной или трехмерной реконструкции гребня. Rossi и коллеги провели гистологическое и клиническое исследования, в котором реконструкцию костных участков нижней челюсти у пациентов проводили с применением кортикальной пластинки и коллагенизированного костного ксенотрансплантата (GenOs Osteobiol By Tecnoss, Coazze, Италия), которые смешивали с кровяным сгустком, полученным от пациента. Материал кортикальной пластинки позиционировали поверх аугментированного участка с целью увеличить ширину и высоту последнего. Через 6-8 месяцев после заживления в данные участки были установлены дентальные имплантата, но перед этим аккуратно изымали незначительный объем костной ткани для биопсии. Все установленные внутрикостные опоры интегрировали хорошо, и через год после фиксации окончательных ортопедических конструкций, заметных потерь уровня костного гребня обнаружено не было. Результаты биопсии демонстрировали наличие минерализованной костной ткани в области проведенной аугментации. Костная пластинка в выгнутом состоянии характеризуется определёнными уровнями жесткости и эластичности, что позволяет адаптировать ее к анатомическим условиям конкретного участка челюсти. Мягкая форма пластинки аналогична любой резорбируемой мембране, и может быть зафиксирована при помощи специальных пинов. Таким образом материал кортикальной пластинки является достаточно эффективным для использования при проведении аугментации костного гребня. Мягкий тип пластинки доказал свою эффективность при реализации протокола вмешательства F.I.R.S.T.
F.I.R.S.T.
В 2016 году авторы установили, что фибриновый герметик идеально подходит для обеспечения фиксации материала кортикальной пластинки, исключая необходимость применения винтов. Цель исследования состояла в том, чтобы сформировать такой комплекс материалов, при котором они ставали, по сути, единым целым. Стабильность костного заменителя является одним из ключевых факторов успеха направленной костной регенерации. Кроме того, применение ФГ само по себе улучшает регенерацию тканей через остеоиндуктивную способность фибриногена. Таким образом было сформулировано название подхода F.I.R.S.T. - Fibrinogen-Induced Regeneration Sealing Technique (фибриноген-индуцированная техника герметической регенерации).
Клинический случай
Пациента 64 лет с наличием пародонтита в анамнезе, без отягощающих общесоматических нарушений, аллергий или непереносимости, обратилась за помощью по поводу имеющейся у нее частичной адентии во втором квадранте, которая, кроме того, сопровождалась выраженной горизонтальной резорбцией костной ткани. На первом этапе лечения обеспечили полную дезинфекцию ротовой полости, а также назначили систематическое лечение посредством метронидазола и амоксициллина на период одной недели. Через 3 месяца поддержания оптимального состояния тканей пародонта, провели КЛКТ-диагностику, которая установила, что толщина остаточного гребня составляет менее 5 мм. При этом толщина самой кортикальной пластинки не превышала 1 мм, в то время как рекомендованная толщина таковой для прогнозированного лечения должна составлять 2 мм. После выполнения местной анестезии артикаином с концентрацией адреналина 1:200000 провели крестальный разрез и сепарировали полнотканный вестибулярный лоскут. Для обеспечения надлежащей подвижности лоскута дополнительно сформировали два послабляющие вертикальных разрезы. С небной стороны сепарацию лоскута проводили на 10 мм в апикальном направлении без выполнения дополнительных вертикальных разрезов. Декортикацию вестибулярной костной пластинки проводили посредством пъезотома IM1S PiezoSurgery (Mectron, Carasco, Италия). В проекции 25 и 26 зубов установили дентальные имплантаты IK 3,8x13 мм и IK 3,8x11 мм (Resista Group, Verbania, Италия) устанавливались в области 25 и 26. В ходе установки обнажения резьбы опор не отмечалось, но толщина вестибулярной костной пластинки была критически минимальной. После 10-минутной гидратации в физиологическом растворе, кортикальную пластинку толщиной 0,5 мм и размером 25 мм на 25 мм (Soft Fine Cortical Lamina Osteobiol от Tecnoss, Coazze, Италия) обрезали по размеру имеющегося горизонтального вестибулярного костного дефекта так, чтобы часть материала выходила на небную поверхность. После разбавления тромбина в отношении 1:10 стерильной бидистиллированной водой несколько капель ФГ (Tisseel, Baxter, Рим, Италия) наносили на коллагенизированный ксенотрансплантат (GenOs, Osteobiol от Tecnoss, Coazze, Италия). Разбавление ФГ является необходимым, дабы избежать его немедленной полимеризации, которая в результате может привести к фиброзной инкапсуляции трансплантата без интеграции в область дефекта. Полученную смесь материалов вносили в область горизонтального дефекта, формируя новый анатомический контур. Через 5 минут трансплантат характеризовался устойчивым положением, и был хорошо адаптирован к области дефекта без потери гранул, и с достижением пластилинообразной консистенции. Внутренняя часть материала кортикальной пластинки также была покрыта незначительным количеством ФГ, после чего мембрану позиционировали в области вмешательства. Материал кортикальной пластинки плотно крепился к поверхности костной ткани, исключая необходимость дополнительного применения фиксирующих пинов или швов. В конце операции область вмешательства ушивали горизонтальными матрасными швами 5-0 из полипропилена (Aragò, Барселона, Испания). Пациентке был назначен прием амоксициллина 500 мг каждые 8 часов в течение 7 дней, ибупрофен 600 мгx3 в течение 3 дней, и полоскание полости рта хлоргексидин 0,20%. Данные послеоперационного КЛКТ-сканирования продемонстрировали прирост 4,05 мм костной ткани. Швы удаляли через 2 недели (фото 1-7).
Фото 1. Вид до лечения. Вогнутость вестибулярной щечной пластинки в верхнем левом квадранте челюсти.


Фото 2. Толщина костной ткани составляла менее 5 мм. В области запланированной позиции имплантата толщина костной ткани составляла менее 1 мм.

Фото 3. А: Вид костного гребня. В. Гидратация пластинки. С. Адаптация мембраны по контуру гребня.


Фото 4. А: Замешивание трансплантата. В. Адгезия трансплантата. С. Объем и стабильность трансплантата.

Фото 5. А: Нанесение материала на пластинку. В. Стабилизация при помощи пинов.

Фото 6. А: Швы. В. Горизонтальные матрасные швы. С. Вид через 2 недели.

Фото 7. КЛКТ после проведения операции.

Через полгода после оперативного вмешательства данные КЛКТ снова-таки подтвердили наличие дополнительных 4,05 мм костной ткани, которая характеризовалась первичными признаками минерализации. Мезиально установленный имплантат был полностью перекрыт твердыми тканями. В ходе имплантации также проводили забор материала для биопсии. На имплантаты фиксировали формирователи десен и ушивали мягкие ткани. Через 3 месяца пациентке был зафиксирован мостовидный протез, выполненный из золота и внешне перекрытий керамикой. Данные биопсии подтвердили формирование новой трабекулярной кости, в контакте с которой находили остаточные частицы трансплантата, а также наличие остеоидного матрикса с сосудами и клетками костной ткани. Никаких некротических или воспалительных клеток в гистологическом материала обнаружено не было. Через три года после проведения хирургического вмешательства, данные КЛКТ подтвердили стабильность мягких и твердых тканей. Уровень прироста костной ткани, полученный в ходе аугментации, оставался стабильным и составлял 4,05 мм. Прицельные рентгенограммы не демонстрировали потери маргинального костного гребня вокруг имплантатов. Через четыре года после проведенного лечения было отмечено, что материал трансплантата почти полностью резорбировался и был замещен новообразовавшейся костной тканью, которая рентгенологически была аналогична структуре интактной кости. Сформированная кортикальная пластинка с вестибулярной стороны была полностью аналогична интактной пластинке с небной стороны челюсти (фото 8-15).
Фото 8. Новая анатомическая форма через 6 месяцев.

Фото 9. Горизонтальный прирост кости на 4,05 мм. Начальная минерализация сформированной костной ткани.

Фото 10. А: Вид на исходной ситуации. В. Удаление костной ткани поверх фиксирующего пина. С. Объем на момент повторного открытия.

Фото 11. А: Увеличение в 100 раз: Частицы резидуального биоматериала находятся в тесном контакте с новой сформированной трабекулярной костью и остеоидом. Отсутствие некротических или воспалительных клеток. В. Увеличение в 200 раз: Частицы резидуального биоматериала находятся в тесном контакте с новой сформированной трабекулярной костью и остеоидом на периферии участка минерализации. Внутри визуализируются активные остеобласты и новые кровеносные сосуды.

Фото 12. Протетическая реабилитация.

Фото 13. Ретенция достигнутого прироста костной ткани в 4,05 мм. Отсутствие признаков потери костной ткани в области платформы имплантата.

Фото 14. Через 4 года трансплантат почти полностью резорбировался. Визуализируются признаки минерализации новой костной ткани.

Фото 15. Новая сформированная кортикальная костная ткань почти идентична с естественной.

Клинический случай 2
Пациент 40 лет, страдающий пародонтитом IV степени, обратился в клинику для решения проблемы с беззубыми участками челюстей. Данные КЛКТ подтвердили выраженную резорбцию костного гребня, толщина которого в отдельных участках составляла не более 1 мм. Общесоматическое состояние пациента было хорошим, и согласно критериям отбора, он полностью подходил для проведения вмешательства по алгоритму F.I.R.S.T. Показание к проведения подобного вмешательства в данном конкретном клиническом случае было оправдано фактом тяжелой горизонтальной резорбции. Применение принципа «липкой кости» повысило бы шансы на достижение стабильного положения трансплантата и улучшения качества костной ткани в области аугментации в целом. После выполнения местной анестезии артикаином с концентрацией анестетика 1:200000, приступили к сепарации лоскута со щечной и язычной сторон челюсти (фото 16).
Фото 16. Вид участка адентии челюсти до и после сепарации гребня.

Перфорацию костной ткани посредством пьезотома проводили с целью достижения следующих эффектов:
- Для стимуляции кровотечения с пространств костного мозга.
- Для формирования ниш в структуре гребня, которые бы способствовали достижению надлежащей стабильности костного заменителя (фото 17).
Фото 17. Формирование внутрикортикальных отверстий для обеспечения стабилизации графта.

Протокол гидратации кортико-губчатого ксенотрансплантата (GenOs Osteobiol, Tecnoss, Coazze, Италия) был аналогичен описанному выше. Применение ФГ способствовало достижению надлежащей стабильности графта, и его ретенции на поверхности костной ткани челюсти (фото 18).
Фото 18. Кортикальная пластинка «приклеивается» к поверхности костного гребня.

В данном клиническом случае важно было учесть то, что аугментат все равно буле подлежать некоторой степени ремоделирования. Кроме того, потенциальное ремоделирования кости также может быть связано с использованием пациентом частичного съемного протеза. Следовательно, для компенсации такого эффекта необходимо было сформировать «гиперконтур» костного гребня. Из-за отсутствия зубов невозможно было ограничить пациента от использования протеза, следовательно, это было еще одной причиной, аргументирующей воссоздание гиперконтура твердых тканей посредством аугментации (фото 19). Через полгода пациенту провели установку имплантатов диаметров 3,4 мм, на которые зафиксировали временны акриловые протетические реставрации. Через 3 года после операционного вмешательства состояния мягких и твердых тканей в аугментированных участках оставалось стабильным (фото 20-23).
Фото 19. Вид гребня до и после проведения аугментации.

Фото 20. Вид гребня до лечения и через 6 месяцев после аугментации.

Фото 21. Установку двух имплантатов диаметром 3,4 мм через полгода после аугментации.

Фото 22. Полная стабильность аугментированного участка через 3 года после нагрузки имплантатов.

Фото 23. Вид провизорных акриловых реставраций.

Заключение
Направленная костная регенерация является широко используемым подходом для восстановления участков челюстей, характеризующихся дефицитом костной ткани. Ключевыми факторами для успеха данной манипуляции являются: биосовместимость, интеграция тканей, обеспечения надлежащего объема пространства, миграция клеток и особенности клинического вмешательства. Стабильность костного заменителя, как и стабильность барьерных мембран, являются одними из наиболее проблемных аспектов направленной костной регенерации. Добавление фибринового герметика к костному трансплантату и добавление данного герметика к материалу кортикальной мембраны обеспечивает «приклеивание» данных форм аугментатов к анатомическому профилю костного гребня. В вышеописанных клинических случаях ФГ также способствовал:
- Регенерации костной ткани
- Стабильности области вмешательства с целью обеспечения нормального течения процесса остеоинтеграции.
Для подтверждения успешности данной методики, конечно же, необходимо проведение дополнительных исследований, но результаты, полученные в описанных выше двух клинических случаях, являются весьма многообещающими.
Авторы: Foti Vincenzo, Rossi Roberto (частная практика, Генуя, Италия)



























































































































































0 комментариев