Было предложено несколько биоабсорбируемых мембран для исключения врастания мягких тканей и стабилизации костного трансплантата при проведении направленной регенерации кости (GBR). Свойства различных мембран незначительно отличаются из-за различий в составе и производственных процессах, оказывающих влияние на их эксплуатацию и пригодность для использования при применении конкретных технологий.
Различные материалы и методы могут быть использованы для достижения регенерации альвеолярного отростка в области дефекта при подготовке к установке имплантата. Было успешно продемонстрировано использование биоабсорбируемой коллагеновой мембраны, действующей в качестве клеточно-окклюзионного барьера для предотвращения врастания мягких тканей в частичный костный трансплантат и удержания материала костного трансплантата в области дефекта, способствуя стабилизации комплекса трансплантат-мембрана. Существует несколько ограничений для использования биоабсорбируемой коллагеновой мембраны для направленной костной регенерации тканей связанных со специфическими характеристиками обработки, присущей памятью формы и ранним всасыванием с потенциальной потерей объема трансплантата, если не избежать перорального воздействия. Было предложено использование дегидратированной амнионо-хорионовой мембраны (dHACM), чтобы избежать таких осложнений. dHACM была описана в медицинской и стоматологической литературе, обеспечивая преимущества улучшенного использования с добавлением функции выработки биологических факторов роста в месте оперативного вмешательства. Полученная из аллотрансплантатов амниотического мешка и обработанная для сохранения состава и биологической активности амниотической мембраны, обезвоженная мембрана содержит более 250 биологических факторов, белки внеклеточного матрикса, цитокины, интерлейкины и тканевые ингибиторы металлопротеиназы, которые, как известно, играют роль в заживлении ран и уменьшении воспаления.
Описанный клинический случай иллюстрирует использование сшитой сахаром коллагеновой мембраны в сочетании с обезвожнной мембраной из омниона/хориона для облегчения стабилизации трансплантата. Этот подход может упростить процедуру направленной регенерации тканей и улучшить результаты лечения благодаря присущим данной мембране биологическим и структурным свойствам.
Техника исполнения (материалы и методы)
Данная предлагаемая процедура выполняется способом, аналогичным ранее описанным методам направленной регенерации костной ткани с использованием рассасывающейся коллагеновой мембраны. Таким образом, доступ к дефекту достигается путем наложения разрезов на область костного дефекта с последующим отслоением слизисто-надкостничного лоскута во всю толщину. Место оперативного вмешательства должно быть свободным от всей гранулематозной ткани, и адекватный отток крови в данной области может быть достигнут путем размещения внутримозговой декортикации в медуллярную кость. Затем давление на лоскуты ослабляется, как было выполнено и описано Ronda и Stacchi в 2015 году. Затем костный аллотрансплантат может быть адаптирован к дефекту альвеолярного гребня с добавлением аутогенной костной стружки или без нее. Было рекомендовано комбинировать аллотрансплантаты с аутогенной костью для повышения качества и количества костной регенерации.
Сшитая сахаром рассасывающаяся коллагеновая мембрана (Ossix Plus, Datum Dental Ltd) обрезается и накладывается поверх материала костного трансплантата. На данный момент обезвоженная мембрана (BioXclude, Snoasis Medical) наносится поверх трансплантата / коллагеновой мембраны с помощью сухого инструмента, такого как тканевые щипцы. Важно, чтобы инструмент был как можно более сухим, чтобы предотвратить преждевременное увлажнение материала, что в свою очередь затрудняет адаптацию и отнимает много времени. Увлажнение материала внутри рта завершается удержанием мембраны в желаемом положении с помощью сухих тканевых щипцов и установлением контакта с мембраной при помощи инструмента, такого как периостальный элеватор, смоченный в стерильном физиологическом растворе. Бережное увлажнение всей мембраны завершается поглаживанием влажным инструментом по всей поверхности мембраны, таким образом, что мембрана теряет всю память формы и всасывается поверх частиц трансплантата и вышележащей биоабсорбируемой коллагеновой мембраны. На этом этапе при желании можно использовать стабилизирующие швы для улучшения процесса приживляемости трансплантата и увеличения количества материала трансплантата, который может быть адаптирован в область дефекта.
Первичное закрытие зоны хирургического вмешательства затем достигается наложением горизонтальных швов с выворачиванием лоскута с помощью не рассасывающегося шовного материала, такого как политетрафторэтилен (PTFE), с последующим наложением множества одиночных прерывистых, непрерывных блокирующих или непрерывных двойных блокирующих швов. Период заживления составляет от 4 до 6 месяцев, данный период времени необходим для полноценной адаптации лоскута и его переворота по размерам операционного поля.
Следующие примеры иллюстрируют этот метод использования коллагеновой мембраны в сочетании с обезвоженной мембраной из омниона/хориона для направленной регенерации тканей.
Клинический случай 1
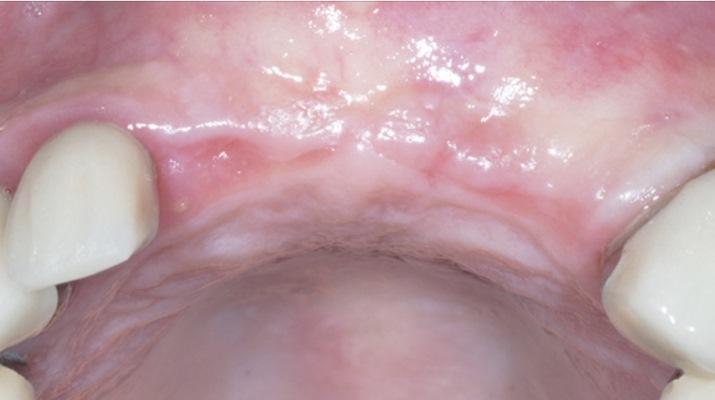
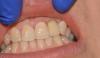
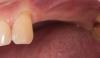
У здорового 65-летнего мужчины был безнадежный прогноз в отношении правых боковых и центральных резцов верхней челюсти. После комплексного внутриротового и рентгенологического обследования пациенту было рекомендовано удаление зубов с последующей немедленной имплантацией в сочетании с с одновременной костной пластикой области дефекта. После достаточной дозы местной анестезии периотомы были использованы для выполнения атравматичной экстракции без подъема слизисто-надкостничного лоскута. Затем вся гранулематозная ткань была удалена из лунки, и было завершено зондирование кости, которое выявило фенестрацию щечной пластинки диаметром 3 мм на вершине бокового резца верхней челюсти, а также расхождение щечной пластинки глубиной от 11 мм до 12 мм на центральном резце верхней челюсти (фото 1). Из-за обширности дефектов щечной пластинки был поднят слизисто-надкостничный лоскут полной толщины, чтобы обеспечить доступ к глубинным дефектам для адаптации и последующего размещения регенеративных материалов.
Фото 1. Фенестрация щечной пластинки на верхушке бокового резца верхней челюсти и большой остаточный горизонтальный дефект на центральном резце верхней челюсти.
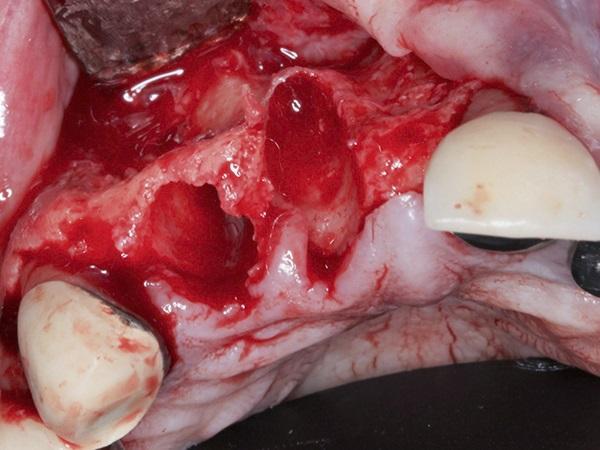
После подтверждения того, что вся гранулематозная ткань была удалена из лунок, было отмечено наличие достаточного количества небной кости, что обеспечивало адекватную первичную стабильность немедленно установленного имплантата. Установка имплантата была завершена в это же время в соответствии с рекомендациями производителя (BioHorizons Tapered Internal, BioHorizons). Затем в имплантаты были вставлены крепежные винты (высотой 0 мм) и затянуты примерно до 10 Нсм.
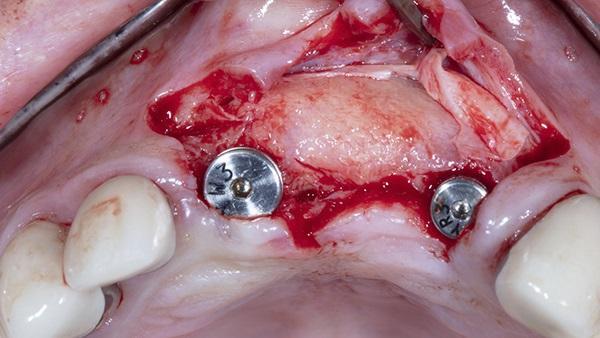
Фото 2. Установка имплантата с помощью вручную затянутых крепежных винтов (0 мм).
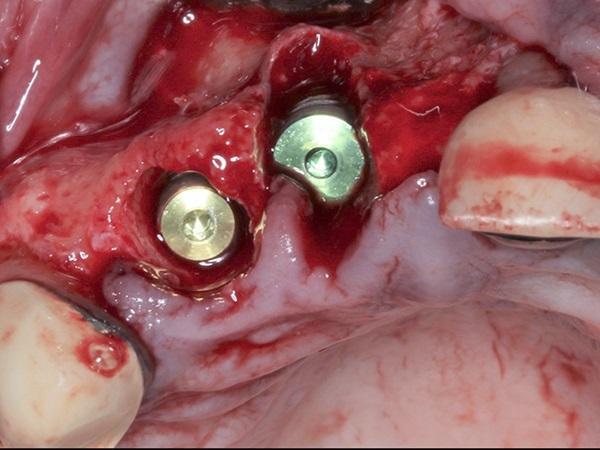
После установки имплантатов был использован сублимированный костный аллотрансплантат (MinerOss, BioHorizons) для пересадки в области остаточных лунок, окружающих имплантаты, а также имеющихся дефектов щечной пластинки. Сшитую коллагеновую мембрану (25 мм х 30 мм) обрезали и гидратировали в стерильном физиологическом растворе в течение 90 секунд. Затем мембрану покрыли поверх материала костного трансплантата с осторожностью, чтобы мембрана проходила апикально на 2-3 мм за пределы дефектов и под углом к щечно-окклюзионной небной линии. Кроме того, между мембраной и соседними зубами поддерживалось расстояние от 1 мм до 2 мм. Затем поверх коллагеновой мембраны поместили обезвоженную мембрану, как описано ранее, чтобы обеспечить прилегание материалов трансплантата к дефекту (фото 3). Затем был выполнен надкостничный разрез глубиной 1 мм по всей длине линии операционного поля, непосредственно апикально к слизисто-десневому соединению, чтобы снять напряжение в лоскуте при подготовке к закрытию. После чего наложили два горизонтальных матрасных шва с из политетрафторэтилена, вместе с нитями, пропитанными хромом 4-0 (фото 4).
Фото 3. Стабилизация мембраны dHACM поверх коллагеновой мембраны и материалов для трансплантации, ограниченных местом дефекта, с помощью горизонтальных матрасных швов из ПТФЭ (PTFE)
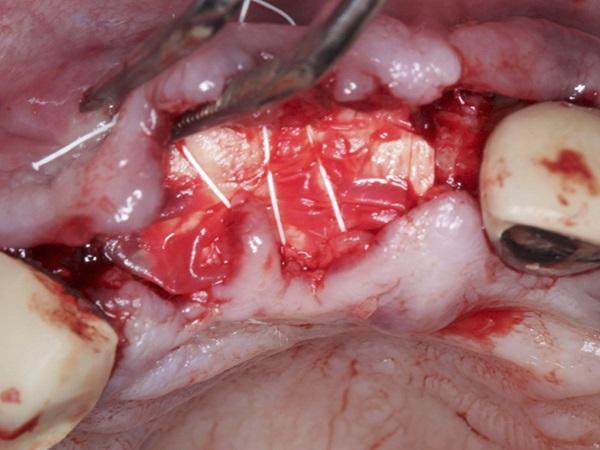
Фото 4. Первичное закрытие с помощью 3-0 непрерывных блокирующих швов из ПТФЭ и 4-0 одиночных прерывистых швов из хромовых нитей.
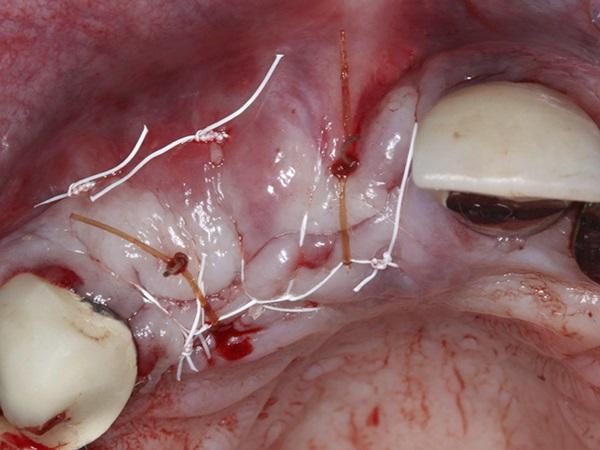
Заживление через 2 недели не выявило никаких признаков инфекции. Однако в это время был отмечен зазор от 2 мм до 3 мм между щечным и небным лоскутами. В пределах этого промежутка можно было увидеть незрелую десну, подвергнувшуюся грануляциина открытой области. Заживление через 5 месяцев после лечения выявило здоровый участок с достаточным объёмом альвеолярного гребня (фото 5). Затем было завершено обнажение имплантата для замены покровных винтов заживляющими абатментами. Горизонтальный разрез был сделан в промежутке отсутствующих зубов , от 2 мм до 3 мм небно до середины альвеолярного гребня. Был поднят слизисто-надкостничный полно тканный лоскут и визуализировалось отличное заживление и поворот материала костного трансплантата (фото 6). Имплантат в месте бокового резца верхней челюсти был частично покрыт зрелой твердой тканью, в то время как имплантат в месте центрального резца был полностью покрыт новой твердой тканью. Никаких остатков гранулированного материала для трансплантации идентифицировать не удалось. Долото обратного действия и хирургический наконечник с алмазным бором были аккуратно использованы, чтобы полностью обнажить покрывные винты имплантатов , и были установлены заживляющие абатменты для подготовки к последующему этапу изготовления коронки имплантата несколько недель спустя.
Фото 5. Заживление мягких тканей через 5 месяцев после операции.
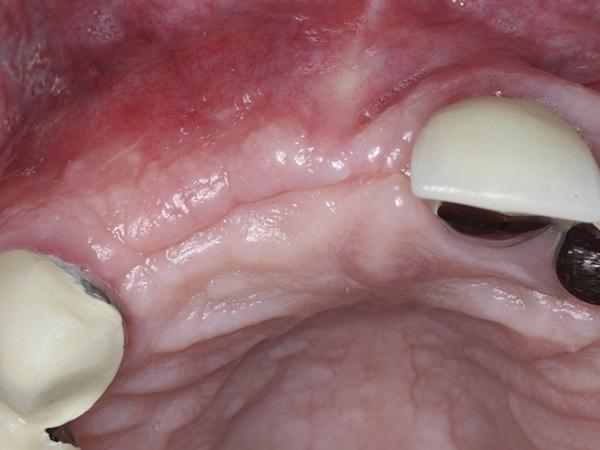
Фото 6. Заживление альвеолярного отростка во время проведения второго этапа операции по имлантации.
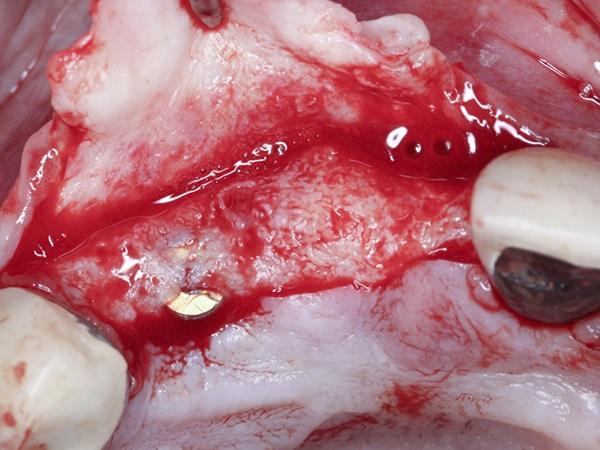
Клинический случай 2
У 60-летнего пациента мужского пола были жалобы на плохое состояние правого центрального резца верхней челюсти, отсутствие левого центрального резца и безнадежное состояние левого бокового резца верхней челюсти. Поскольку у пациента осталась минимальное количество коронки левого центрального резца верхней челюсти, то для его удаления был выполнен бороздчатый разрез, проходящий от клыка до клыка на верхней челюсти и был отслоен лоскут полной толщины. Экстракция была завершена с последующей дегрануляцией гнезд. На месте зуба 1.1. было отмечено расхождение щечной пластинки глубиной 5 мм. Расхождение щечной пластинки толщиной 3 мм, а также фенестрация щечной пластинки диаметром 3 мм наблюдались в области верхушки корня зуба 2.2. При этом был отмечен достаточный объем кости для проведения немедленной имплантации, и была проведена имплантация (BioHorizons Tapered Internal) ограниченная на участке зубов 1.1., 2.1. с последующим размещением винтов крышки высотой 0 мм (фото 7-8).
Фото 7. Фронтальный вид отслоенного полно тканного лоскута с расхождением щечной пластинки в области правого центрального резца верхней челюсти и расхождением тканей, с фенестрацией в области латерального резца верхней челюсти.
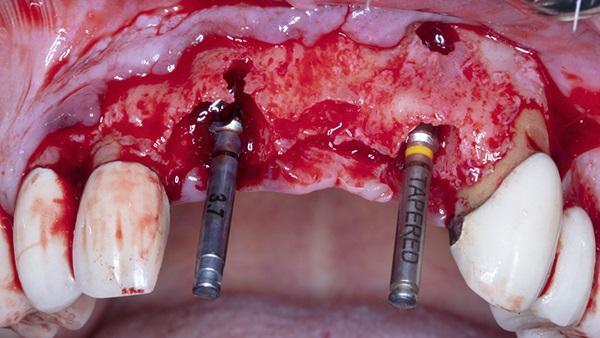
Фото 8. Отслоенный полно тканный лоскут окклюзионный вид.
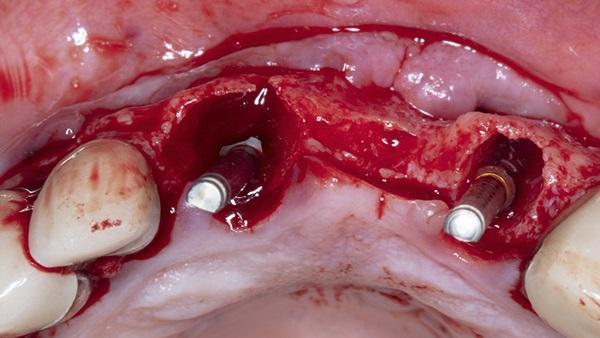
Наблюдалось адекватное кровоснабжение кости, поэтому в данном случае внутрикостную декортикацию сочли не целесообразной. Затем лиофилизированный костный аллотрансплантат, состоящий из смеси кортико-губчатого материала 50/50, был адаптирован к лункам и щечной пластинке зубов 1.1., 2.1., 2.2. После чего сшитую сахаром коллагеновую мембрану (25 мм х 30 мм) обезвожили и адаптировали к углу щечно-окклюзионной небной линии. Из-за размера дефекта и добавления материалов для костного трансплантата мембрана не смогла полностью покрыть костный трансплантат, и от 2 мм до 3 мм материала трансплантата были обнажены с мезиальной и дистальной сторон. Мембрану размером 20 х 30 мм поместили на операционное поле и протягивали за края дефекта мезиально и дистально на 3-4 мм в обоих направлениях. Затем были наложены два надкостничных стабилизирующих шва с рассасывающимся швом для стабилизации коллагена и мембран амниона/хориона поверх материала трансплантата (фото 9). Два горизонтальных матрасных шва с ПТФЭ 3-0 были наложены на расстоянии 5-7 мм от краев мягких тканей, чтобы инициировать первичное закрытие без натяжения. Дополнительные одиночные прерывистые швы с использованием того же ПТФЭ 3-0 также были использованы для завершения первичного закрытия операционного поля (фото 10).
Фото 9. Стабилизация обезвоженной мембраны (dHACM) и коллагеновых мембран поверх материала трансплантата с помощью двух рассасывающихся надкостничных швов.
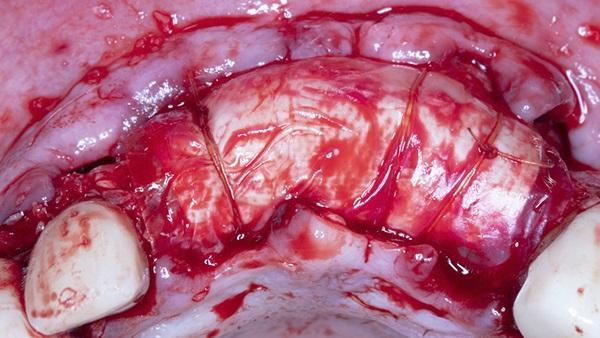
Фото 10. Закрытие достигается с помощью горизонтальных матрасных швов из ПТФЭ 3-0 и одиночных прерывистых швов. Обратите внимание на отсутствие первичного закрытия лунок от удаленных зубов.
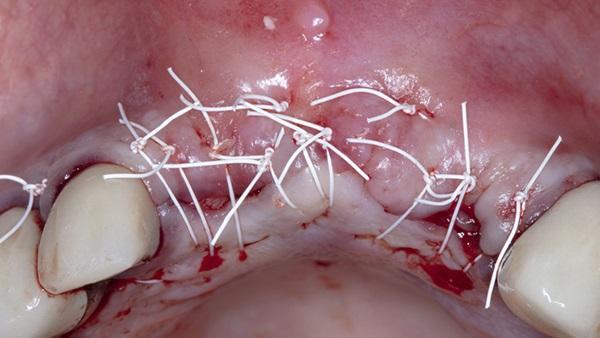
Заживление через 5 месяцев не выявило признаков инфекции и значительного сохранения анатомических размеров альвеолярного гребня в данной области (фото 11). Был выполнен фестончатый горизонтальный разрез альвеолярного гребня с последующим отслоением лоскута во всю толщину, чтобы обнажить имплантаты для установки заживляющих абатментов. При отслоении лоскута наблюдалось полное сохранение ширины и высоты альвеолярного гребня без признаков присутствия какого-либо остаточного материала костного трансплантата. Было отмечено, что имплантаты были погружены в слой толщиной 3-4 мм регенерированной твердой ткани (фото 12).
Фото 11. Заживление мягких тканей через 5 месяцев после операции.
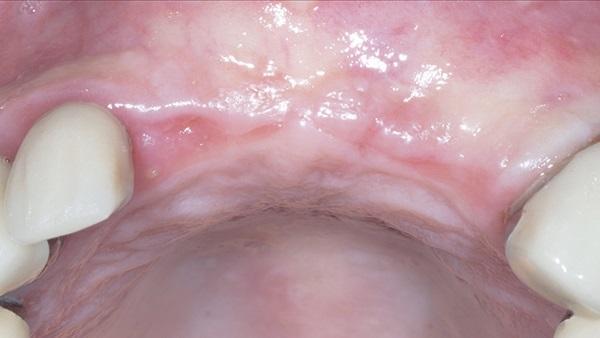
Фото 12. Установка заживляющего абатмента после отслоения лоскута во всю толщину. Наблюдается достаточная ширина и высота гребня без признаков остаточного материала костного трансплантата.
Обсуждение
Многочисленные коллагеновые мембраны в настоящее время используются в качестве барьера для процедур направленной регенерации тканей. Одним из ограничений использования коллагеновых мембран является повышенный риск потери объема трансплантата, когда мембрана остается открытой для полости рта или непреднамеренно обнажается на ранних стадиях заживления. Интересно, что было описано, что dHACM можно безопасно оставлять открытым в полости рта. Отчасти это связано с присущими препарату антибактериальными свойствами, которые помогают снизить риск инфицирования после операции. В результате dHACM использовалась качестве мембраны для различных хирургических процедур полости рта, таких как направленная регенерация тканей при внутрикостных дефектах периодонта и сохранения лунки во время удаления зуба. Важно отметить, что исследования показали сходное формирование новой кости с использованием коллагеновой мембраны по сравнению с использование dHACM. Было также показано, что использование dHACM уменьшает послеоперационный болевой синдром после вмешательства.
Из-за полного отсутствия памяти после гидратации dHACM, эта мембрана может быть пригодна для пересадки в область лунки после удаления зуба и процедур регенерации пародонта, так как ее можно легко адаптировать по альвеолярному гребню и по поверхности зубной дуги для закрытия дефекта большой протяженности. По опыту авторов, dHACM обладает минимальной способность самостоятельно поддерживать форму окружающих тканей, что необходимо при процедуре направленной регенерации тканей при умеренных и серьезных горизонтальных дефектах. С другой стороны, материал можно легко поместить поверх рассасывающейся коллагеновой мембраны, чтобы помочь стабилизировать трансплантат перед окончательным закрытием нужной области.
Заключение
Использование сшитой коллагеновой мембраны в сочетании с dHACM может быть жизнеспособным вариантом для улучшения результатов лечения после процедур направленной регенерации тканей. Как показано в описанной серии примеров, использование двух различных мембран обеспечивает преимущества каждой из конкретных мембран. Использование сшитой коллагеновой мембраны обеспечивает необходимый долгосрочный барьерный эффект, некоторую степень памяти, которая помогает предотвратить коллапс мембраны в дефект, и способность к окостенению с течением времени. Использование dHACM дает большие преимущества в качестве дополнения к рассасывающейся коллагеновой мембране, облегчая адаптацию после установки коллагеновой мембраны поверх костного трансплантата из-за отсутствия у нее памяти. Факторы роста и антибактериальные свойства мембраны амниона/хориона также могут обеспечить существенное преимущество по сравнению с использованием только коллагеновой мембраны. Успех случаев, представленных в этом исследовании, должен быть подтвержден с помощью увеличенной выборки. Следовательно, необходимы дальнейшие исследования по использованию комбинации коллагеновой мембраны с дополнительным использованием мембраны амниона/хориона.
Авторы:
Matthew J. Fien, DDS
Israel Puterman, DMD, MSD
Juan Mesquida, DDS
Ferran Llansana Fitó, DDS
Guillermo Bauza, PhD
Было предложено несколько биоабсорбируемых мембран для исключения врастания мягких тканей и стабилизации костного трансплантата при проведении направленной регенерации кости (GBR). Свойства различных мембран незначительно отличаются из-за различий в составе и производственных процессах, оказывающих влияние на их эксплуатацию и пригодность для использования при применении конкретных технологий.

Различные материалы и методы могут быть использованы для достижения регенерации альвеолярного отростка в области дефекта при подготовке к установке имплантата. Было успешно продемонстрировано использование биоабсорбируемой коллагеновой мембраны, действующей в качестве клеточно-окклюзионного барьера для предотвращения врастания мягких тканей в частичный костный трансплантат и удержания материала костного трансплантата в области дефекта, способствуя стабилизации комплекса трансплантат-мембрана. Существует несколько ограничений для использования биоабсорбируемой коллагеновой мембраны для направленной костной регенерации тканей связанных со специфическими характеристиками обработки, присущей памятью формы и ранним всасыванием с потенциальной потерей объема трансплантата, если не избежать перорального воздействия. Было предложено использование дегидратированной амнионо-хорионовой мембраны (dHACM), чтобы избежать таких осложнений. dHACM была описана в медицинской и стоматологической литературе, обеспечивая преимущества улучшенного использования с добавлением функции выработки биологических факторов роста в месте оперативного вмешательства. Полученная из аллотрансплантатов амниотического мешка и обработанная для сохранения состава и биологической активности амниотической мембраны, обезвоженная мембрана содержит более 250 биологических факторов, белки внеклеточного матрикса, цитокины, интерлейкины и тканевые ингибиторы металлопротеиназы, которые, как известно, играют роль в заживлении ран и уменьшении воспаления.
Описанный клинический случай иллюстрирует использование сшитой сахаром коллагеновой мембраны в сочетании с обезвожнной мембраной из омниона/хориона для облегчения стабилизации трансплантата. Этот подход может упростить процедуру направленной регенерации тканей и улучшить результаты лечения благодаря присущим данной мембране биологическим и структурным свойствам.
Техника исполнения (материалы и методы)
Данная предлагаемая процедура выполняется способом, аналогичным ранее описанным методам направленной регенерации костной ткани с использованием рассасывающейся коллагеновой мембраны. Таким образом, доступ к дефекту достигается путем наложения разрезов на область костного дефекта с последующим отслоением слизисто-надкостничного лоскута во всю толщину. Место оперативного вмешательства должно быть свободным от всей гранулематозной ткани, и адекватный отток крови в данной области может быть достигнут путем размещения внутримозговой декортикации в медуллярную кость. Затем давление на лоскуты ослабляется, как было выполнено и описано Ronda и Stacchi в 2015 году. Затем костный аллотрансплантат может быть адаптирован к дефекту альвеолярного гребня с добавлением аутогенной костной стружки или без нее. Было рекомендовано комбинировать аллотрансплантаты с аутогенной костью для повышения качества и количества костной регенерации.
Сшитая сахаром рассасывающаяся коллагеновая мембрана (Ossix Plus, Datum Dental Ltd) обрезается и накладывается поверх материала костного трансплантата. На данный момент обезвоженная мембрана (BioXclude, Snoasis Medical) наносится поверх трансплантата / коллагеновой мембраны с помощью сухого инструмента, такого как тканевые щипцы. Важно, чтобы инструмент был как можно более сухим, чтобы предотвратить преждевременное увлажнение материала, что в свою очередь затрудняет адаптацию и отнимает много времени. Увлажнение материала внутри рта завершается удержанием мембраны в желаемом положении с помощью сухих тканевых щипцов и установлением контакта с мембраной при помощи инструмента, такого как периостальный элеватор, смоченный в стерильном физиологическом растворе. Бережное увлажнение всей мембраны завершается поглаживанием влажным инструментом по всей поверхности мембраны, таким образом, что мембрана теряет всю память формы и всасывается поверх частиц трансплантата и вышележащей биоабсорбируемой коллагеновой мембраны. На этом этапе при желании можно использовать стабилизирующие швы для улучшения процесса приживляемости трансплантата и увеличения количества материала трансплантата, который может быть адаптирован в область дефекта.
Первичное закрытие зоны хирургического вмешательства затем достигается наложением горизонтальных швов с выворачиванием лоскута с помощью не рассасывающегося шовного материала, такого как политетрафторэтилен (PTFE), с последующим наложением множества одиночных прерывистых, непрерывных блокирующих или непрерывных двойных блокирующих швов. Период заживления составляет от 4 до 6 месяцев, данный период времени необходим для полноценной адаптации лоскута и его переворота по размерам операционного поля.
Следующие примеры иллюстрируют этот метод использования коллагеновой мембраны в сочетании с обезвоженной мембраной из омниона/хориона для направленной регенерации тканей.
Клинический случай 1
У здорового 65-летнего мужчины был безнадежный прогноз в отношении правых боковых и центральных резцов верхней челюсти. После комплексного внутриротового и рентгенологического обследования пациенту было рекомендовано удаление зубов с последующей немедленной имплантацией в сочетании с с одновременной костной пластикой области дефекта. После достаточной дозы местной анестезии периотомы были использованы для выполнения атравматичной экстракции без подъема слизисто-надкостничного лоскута. Затем вся гранулематозная ткань была удалена из лунки, и было завершено зондирование кости, которое выявило фенестрацию щечной пластинки диаметром 3 мм на вершине бокового резца верхней челюсти, а также расхождение щечной пластинки глубиной от 11 мм до 12 мм на центральном резце верхней челюсти (фото 1). Из-за обширности дефектов щечной пластинки был поднят слизисто-надкостничный лоскут полной толщины, чтобы обеспечить доступ к глубинным дефектам для адаптации и последующего размещения регенеративных материалов.
Фото 1. Фенестрация щечной пластинки на верхушке бокового резца верхней челюсти и большой остаточный горизонтальный дефект на центральном резце верхней челюсти.

После подтверждения того, что вся гранулематозная ткань была удалена из лунок, было отмечено наличие достаточного количества небной кости, что обеспечивало адекватную первичную стабильность немедленно установленного имплантата. Установка имплантата была завершена в это же время в соответствии с рекомендациями производителя (BioHorizons Tapered Internal, BioHorizons). Затем в имплантаты были вставлены крепежные винты (высотой 0 мм) и затянуты примерно до 10 Нсм.
Фото 2. Установка имплантата с помощью вручную затянутых крепежных винтов (0 мм).

После установки имплантатов был использован сублимированный костный аллотрансплантат (MinerOss, BioHorizons) для пересадки в области остаточных лунок, окружающих имплантаты, а также имеющихся дефектов щечной пластинки. Сшитую коллагеновую мембрану (25 мм х 30 мм) обрезали и гидратировали в стерильном физиологическом растворе в течение 90 секунд. Затем мембрану покрыли поверх материала костного трансплантата с осторожностью, чтобы мембрана проходила апикально на 2-3 мм за пределы дефектов и под углом к щечно-окклюзионной небной линии. Кроме того, между мембраной и соседними зубами поддерживалось расстояние от 1 мм до 2 мм. Затем поверх коллагеновой мембраны поместили обезвоженную мембрану, как описано ранее, чтобы обеспечить прилегание материалов трансплантата к дефекту (фото 3). Затем был выполнен надкостничный разрез глубиной 1 мм по всей длине линии операционного поля, непосредственно апикально к слизисто-десневому соединению, чтобы снять напряжение в лоскуте при подготовке к закрытию. После чего наложили два горизонтальных матрасных шва с из политетрафторэтилена, вместе с нитями, пропитанными хромом 4-0 (фото 4).
Фото 3. Стабилизация мембраны dHACM поверх коллагеновой мембраны и материалов для трансплантации, ограниченных местом дефекта, с помощью горизонтальных матрасных швов из ПТФЭ (PTFE)

Фото 4. Первичное закрытие с помощью 3-0 непрерывных блокирующих швов из ПТФЭ и 4-0 одиночных прерывистых швов из хромовых нитей.

Заживление через 2 недели не выявило никаких признаков инфекции. Однако в это время был отмечен зазор от 2 мм до 3 мм между щечным и небным лоскутами. В пределах этого промежутка можно было увидеть незрелую десну, подвергнувшуюся грануляциина открытой области. Заживление через 5 месяцев после лечения выявило здоровый участок с достаточным объёмом альвеолярного гребня (фото 5). Затем было завершено обнажение имплантата для замены покровных винтов заживляющими абатментами. Горизонтальный разрез был сделан в промежутке отсутствующих зубов , от 2 мм до 3 мм небно до середины альвеолярного гребня. Был поднят слизисто-надкостничный полно тканный лоскут и визуализировалось отличное заживление и поворот материала костного трансплантата (фото 6). Имплантат в месте бокового резца верхней челюсти был частично покрыт зрелой твердой тканью, в то время как имплантат в месте центрального резца был полностью покрыт новой твердой тканью. Никаких остатков гранулированного материала для трансплантации идентифицировать не удалось. Долото обратного действия и хирургический наконечник с алмазным бором были аккуратно использованы, чтобы полностью обнажить покрывные винты имплантатов , и были установлены заживляющие абатменты для подготовки к последующему этапу изготовления коронки имплантата несколько недель спустя.
Фото 5. Заживление мягких тканей через 5 месяцев после операции.

Фото 6. Заживление альвеолярного отростка во время проведения второго этапа операции по имлантации.

Клинический случай 2
У 60-летнего пациента мужского пола были жалобы на плохое состояние правого центрального резца верхней челюсти, отсутствие левого центрального резца и безнадежное состояние левого бокового резца верхней челюсти. Поскольку у пациента осталась минимальное количество коронки левого центрального резца верхней челюсти, то для его удаления был выполнен бороздчатый разрез, проходящий от клыка до клыка на верхней челюсти и был отслоен лоскут полной толщины. Экстракция была завершена с последующей дегрануляцией гнезд. На месте зуба 1.1. было отмечено расхождение щечной пластинки глубиной 5 мм. Расхождение щечной пластинки толщиной 3 мм, а также фенестрация щечной пластинки диаметром 3 мм наблюдались в области верхушки корня зуба 2.2. При этом был отмечен достаточный объем кости для проведения немедленной имплантации, и была проведена имплантация (BioHorizons Tapered Internal) ограниченная на участке зубов 1.1., 2.1. с последующим размещением винтов крышки высотой 0 мм (фото 7-8).
Фото 7. Фронтальный вид отслоенного полно тканного лоскута с расхождением щечной пластинки в области правого центрального резца верхней челюсти и расхождением тканей, с фенестрацией в области латерального резца верхней челюсти.

Фото 8. Отслоенный полно тканный лоскут окклюзионный вид.

Наблюдалось адекватное кровоснабжение кости, поэтому в данном случае внутрикостную декортикацию сочли не целесообразной. Затем лиофилизированный костный аллотрансплантат, состоящий из смеси кортико-губчатого материала 50/50, был адаптирован к лункам и щечной пластинке зубов 1.1., 2.1., 2.2. После чего сшитую сахаром коллагеновую мембрану (25 мм х 30 мм) обезвожили и адаптировали к углу щечно-окклюзионной небной линии. Из-за размера дефекта и добавления материалов для костного трансплантата мембрана не смогла полностью покрыть костный трансплантат, и от 2 мм до 3 мм материала трансплантата были обнажены с мезиальной и дистальной сторон. Мембрану размером 20 х 30 мм поместили на операционное поле и протягивали за края дефекта мезиально и дистально на 3-4 мм в обоих направлениях. Затем были наложены два надкостничных стабилизирующих шва с рассасывающимся швом для стабилизации коллагена и мембран амниона/хориона поверх материала трансплантата (фото 9). Два горизонтальных матрасных шва с ПТФЭ 3-0 были наложены на расстоянии 5-7 мм от краев мягких тканей, чтобы инициировать первичное закрытие без натяжения. Дополнительные одиночные прерывистые швы с использованием того же ПТФЭ 3-0 также были использованы для завершения первичного закрытия операционного поля (фото 10).
Фото 9. Стабилизация обезвоженной мембраны (dHACM) и коллагеновых мембран поверх материала трансплантата с помощью двух рассасывающихся надкостничных швов.

Фото 10. Закрытие достигается с помощью горизонтальных матрасных швов из ПТФЭ 3-0 и одиночных прерывистых швов. Обратите внимание на отсутствие первичного закрытия лунок от удаленных зубов.

Заживление через 5 месяцев не выявило признаков инфекции и значительного сохранения анатомических размеров альвеолярного гребня в данной области (фото 11). Был выполнен фестончатый горизонтальный разрез альвеолярного гребня с последующим отслоением лоскута во всю толщину, чтобы обнажить имплантаты для установки заживляющих абатментов. При отслоении лоскута наблюдалось полное сохранение ширины и высоты альвеолярного гребня без признаков присутствия какого-либо остаточного материала костного трансплантата. Было отмечено, что имплантаты были погружены в слой толщиной 3-4 мм регенерированной твердой ткани (фото 12).
Фото 11. Заживление мягких тканей через 5 месяцев после операции.

Фото 12. Установка заживляющего абатмента после отслоения лоскута во всю толщину. Наблюдается достаточная ширина и высота гребня без признаков остаточного материала костного трансплантата.

Обсуждение
Многочисленные коллагеновые мембраны в настоящее время используются в качестве барьера для процедур направленной регенерации тканей. Одним из ограничений использования коллагеновых мембран является повышенный риск потери объема трансплантата, когда мембрана остается открытой для полости рта или непреднамеренно обнажается на ранних стадиях заживления. Интересно, что было описано, что dHACM можно безопасно оставлять открытым в полости рта. Отчасти это связано с присущими препарату антибактериальными свойствами, которые помогают снизить риск инфицирования после операции. В результате dHACM использовалась качестве мембраны для различных хирургических процедур полости рта, таких как направленная регенерация тканей при внутрикостных дефектах периодонта и сохранения лунки во время удаления зуба. Важно отметить, что исследования показали сходное формирование новой кости с использованием коллагеновой мембраны по сравнению с использование dHACM. Было также показано, что использование dHACM уменьшает послеоперационный болевой синдром после вмешательства.
Из-за полного отсутствия памяти после гидратации dHACM, эта мембрана может быть пригодна для пересадки в область лунки после удаления зуба и процедур регенерации пародонта, так как ее можно легко адаптировать по альвеолярному гребню и по поверхности зубной дуги для закрытия дефекта большой протяженности. По опыту авторов, dHACM обладает минимальной способность самостоятельно поддерживать форму окружающих тканей, что необходимо при процедуре направленной регенерации тканей при умеренных и серьезных горизонтальных дефектах. С другой стороны, материал можно легко поместить поверх рассасывающейся коллагеновой мембраны, чтобы помочь стабилизировать трансплантат перед окончательным закрытием нужной области.
Заключение
Использование сшитой коллагеновой мембраны в сочетании с dHACM может быть жизнеспособным вариантом для улучшения результатов лечения после процедур направленной регенерации тканей. Как показано в описанной серии примеров, использование двух различных мембран обеспечивает преимущества каждой из конкретных мембран. Использование сшитой коллагеновой мембраны обеспечивает необходимый долгосрочный барьерный эффект, некоторую степень памяти, которая помогает предотвратить коллапс мембраны в дефект, и способность к окостенению с течением времени. Использование dHACM дает большие преимущества в качестве дополнения к рассасывающейся коллагеновой мембране, облегчая адаптацию после установки коллагеновой мембраны поверх костного трансплантата из-за отсутствия у нее памяти. Факторы роста и антибактериальные свойства мембраны амниона/хориона также могут обеспечить существенное преимущество по сравнению с использованием только коллагеновой мембраны. Успех случаев, представленных в этом исследовании, должен быть подтвержден с помощью увеличенной выборки. Следовательно, необходимы дальнейшие исследования по использованию комбинации коллагеновой мембраны с дополнительным использованием мембраны амниона/хориона.
Авторы:
Matthew J. Fien, DDS
Israel Puterman, DMD, MSD
Juan Mesquida, DDS
Ferran Llansana Fitó, DDS
Guillermo Bauza, PhD




























































































































































0 комментариев