В ходе протезирования с опорой на дентальные имплантаты крайне важным остается аспект оптимальной костной поддержки супраконструкции, как и качества связи между титановым элементом и окружающей костной тканью. Кроме того, важное значение играет состояние мягких тканей, с воспаления которых начинаются последующие процессы перимукозита и периимплантита. Следовательно, чтобы обеспечить адекватные условия для имплантации временами приходиться прибегать к трем или даже четырем реконструктивным вмешательствам, и поэтому процесс лечения затягивается на срок до 12-18 месяцев.
Материалы и методы
56-летняя соматически здоровая пациентка обратилась за стоматологической помощью на кафедру имплантологии, Fondazione IRCCS Cà Granda, Ospedale Maggiore Policlinico (Милан, Италия) по поводу дефекта зубного ряда в области левого сегмента верхней челюсти.
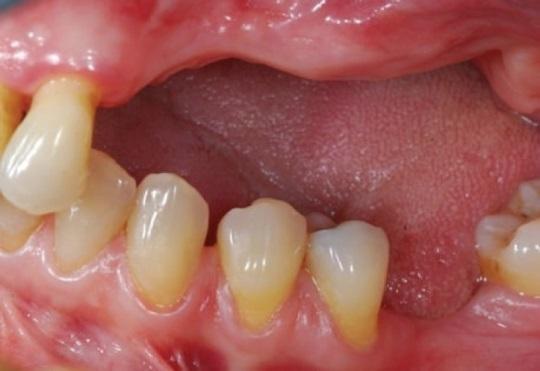
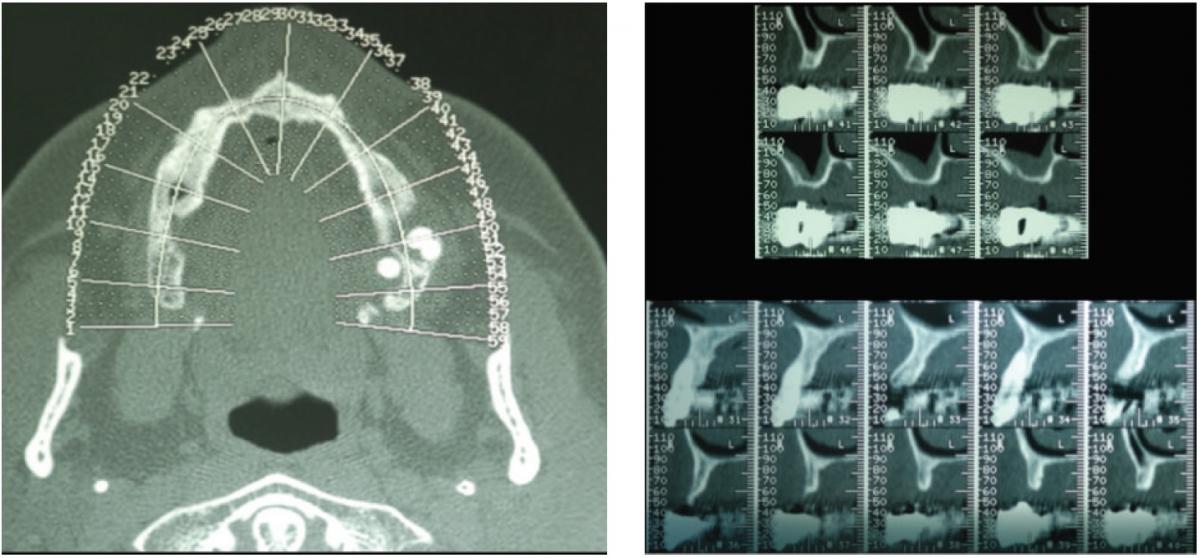
В ходе клинического осмотра было установлено, что объем альвеолярного гребня в данном участке является дефицитным, а взаимоотношение челюстей соответствует перекрёстному прикусу. С правой стороны верхней челюсти у пациентки были зарегистрировано расширение границ гайморовой пазухи. Результаты рентгенографических исследований, панорамной и конусно-лучевой томографий подтвердили атрофию альвеолярного гребня, и помогли визуализировать его специфическую ножеподобную форму в области премоляров, а также резидуальные 3 мм высоты костной ткани в области моляров.
Фото 1: Клинический вид атрофии альвеолярного гребня в левом сегменте верхней челюсти.
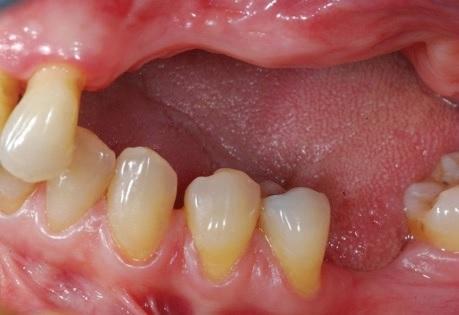
Фото 2: Результаты КТ-диагностики: атрофия костного гребня верхней челюсти, наличие горизонтального дефекта кости. (А) визуализация всех особенностей атрофии в области верхней челюсти; (Б) данный аксиальный срез демонстрирует область, подлежащую будущей аугментации.
План реабилитации состоял из четырех этапов лечения:
- Реконструкция альвеолярного гребня с использованием автогенной костной стружки, ксеногенного трансплантата и титановой сетки, а также синус-лифт посредством ксенногенного костного заменителя:
- Удаление титановой сетки через семь месяцев после первичного вмешательства с последующим выполнением аугментации мягких тканей при помощи коллагеновой матрицы:
- Имплантация;
- Протезирование посредством временного пластмассового протеза с дальнейшей его заменой на золото-керамическую мостовидную конструкцию.
После полной санации ротовой полости пациентке были предоставлены рекомендации относительно особенностей поддержки гигиены полости рта в домашних условиях. Предоперационную санацию синуса начали за 15 дней до операции посредством применения назального спрея с действующей субстанцией мометазона (Nasonex Merck, Sharp Sharp and Dhome, Ch) дважды в день.
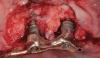
Во время первого хирургического вмешательства, которое проходило под общим наркозом, был отсепарирован полный лоскут в границах от левого верхнего клыка до верхнечелюстного бугра, после чего синус-лифт провели через латеральный доступ, а субантральную полость заполнили ксеногенным костным трансплантатом (Bio-Oss, Geistlich, Wohlusen, Ch). Аугментацию альвеолярного гребня проводили посредством смеси аутогенной костной ткани, собранной при помощи костного скребка из области верхнечелюстного бугра, и ксеногенного трансплантата в соотношении 1: 1. Костный материал накрыли титановой сеткой (OMNIA S.p.A., Fidenza (Parma), Италия), которую, в свою очередь, зафиксировали при помощи винтов. Над титановой сеткой дополнительно установили резорбируемую коллагеновую мембрану (BioGide, Geistlich, Вольхузен, Чиассо), чтобы ограничить миграцию эпителиальных клеток в область аугментации.
Фото 3: Клинический вид костной ткани после сепарации слизисто-надкостичного лоскута.
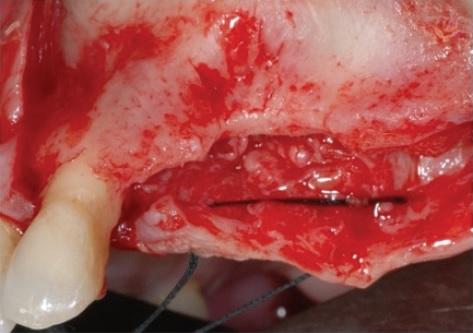
Фото 4: Проведение синус-лифта с целью увеличения параметров высоты костного гребня.
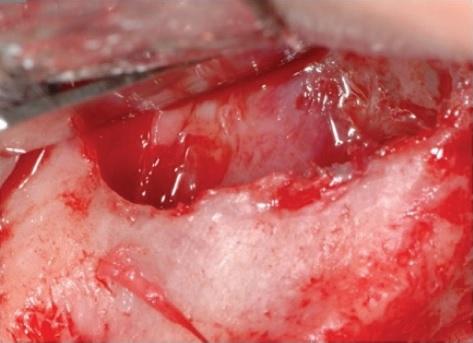
Фото 5: Установка титановой сетки с целью реконструкции альвеолярного гребня.
Для укрытия раны со стороны щечного лоскута были выполнены дополнительные периостальные надрезы, после чего область вмешательства ушили двухслойным швом нитями 4-0 из полиглактина (Vycril, Ethicon, США). С правой стороны синус-лифт был выполнен в области первых моляров с использованием лишь ксеногенного материала. Швы были удалены через 15 дней.
Заживление области вмешательства проходило без осложнений, так что через семь месяцев врач приступил к следующему этапу лечения – удалению титановой сетки и аугментации мягких тканей. Для обнажения титанового элемента под местной анестезией провели разрез посредине альвеолярного гребня, через который аккуратно удалили сетку, а небольшой образец образовавшейся костной ткани посредством трепана взяли для детального гистологического исследования. Для формирования адекватного профиля преддверья полости рта, щечной лоскут переместили апикально и ушили к подлежащей соединительной ткани, а обнаженную часть раны покрыли свинячьей коллагеновой матрицей (Mucograft, Geistlich, Вольхузен, Чиассо). Последнюю фиксировали посредством 5-0 полиглактиновых нитей.
Фото 6: Вид кости после удаления титановой сетки: восстановления объемов альвеолярного гребня.
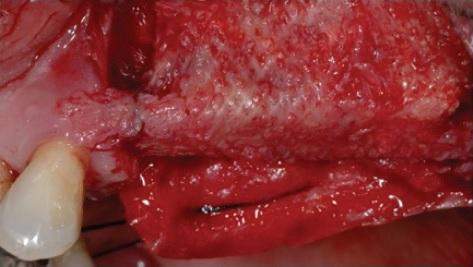
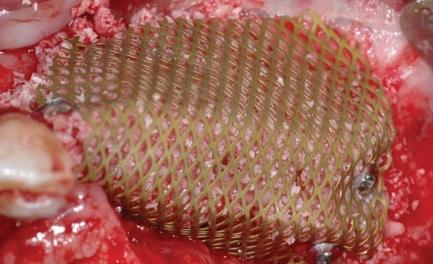
Фото 7: Окклюзионный вид костного гребня после агументации с использованием титановой сетки.

Фото 8: Установка коллагеновой мембраны для адекватного заживления мягких тканей.
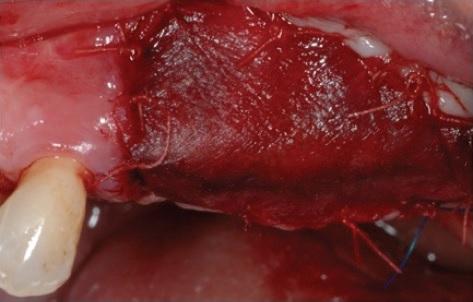
Фото 9: В ходе имплантации часть новообразовавшейся кости была изъята для гистологического анализа.
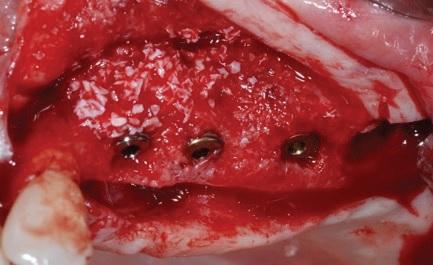
Через сорок дней после операции наблюдалось полное заживление мягких тканей, что позволило врачу приступить к третьему этапу лечения – собственно имплантации. Для этого провели сепарацию полного лоскута с правой и левой сторон, и установили пять имплантатов системы Camlog Screw line (Camlog AG, Ch).
После установки имплантатов с учетом особенностей будущей процедуры протезирования, был обнаружен небольшой горизонтальный дефект в области клыка, который тут же восстановили при помощи Bio-Oss и Biogide.
Фото 10: Установка дентального имплантата и проведение разреза надкостницы для адекватного покрытия инфраосальных титановых конструкций мягкими тканями.
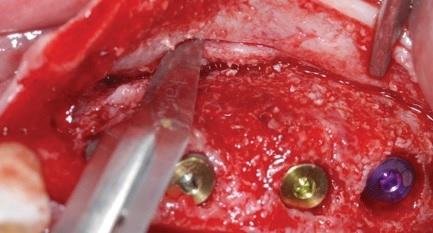
Четыре месяца спустя имплантаты обнажили с целью установки формирователей десен. Последние установили после выполнения простого прямого разреза в области первого правого верхнего моляра и смежно с аугментацией области межзубного сосочка по технике Palacci с левой стороны. Через два месяца сняли оттиск для изготовления временных конструкций, а через пять – для окончательных. В ходе анализа результатов лечения при помощи ортопантомографии через два года после вмешательства был зарегистрирован оптимальный уровень альвеолярного гребня, а профиль мягких тканей выглядел физиологически стабильным без каких-либо признаков воспаления.
Фото 12: Рентгенограмма через два года: остеоинтеграция зубных имплантатов и адекватная поддержка протетических элементов.
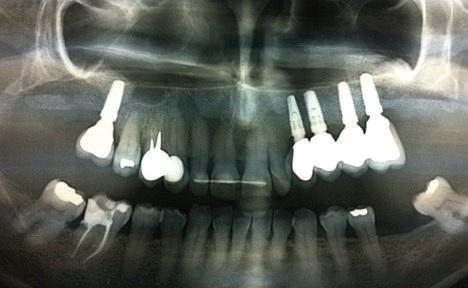
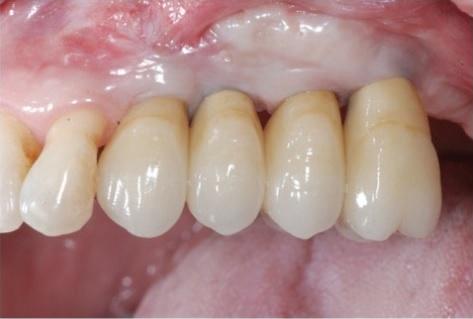
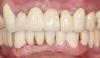
Фото 13: Клинический вид через два года после реабилитации: оптимальный профиль мягких тканей.
Гистологический анализ
Материал для биопсии был взят при помощи трепана с внутренним диаметром 2,6 мм. Кость фиксировали в 10% нейтральном буферном растворе формалина на протяжении 48 часов, после чего ее обрабатывали по методу Donath и Breuner с целью изучения методом световой микроскопии без деминерализации материала.
Дегидратацию проводили путем увеличения концентрации этанола с использованием специальной системы обезвоживания в вакуумных условиях. После этого костные блоки фиксировали в смоле Kulzer Technovit 7200 VLC, и фрагментировали продольно на режущем станке EXAKT (EXAKT, Нордерштедта, Германия).
Каждый срез утончали посредством микропришлифовывания, а затем полировали с использованием аппарата EXAKT до однородной толщины в 20 мм. Окраску материала проводили толуидиновым синим / пиронином F. Гистоморфометрические измерения фракций разных тканей (депротеинизированного бычьего костного трансплантата, аутокости, новообразовавшейся костной ткани и костного мозга, или соединительной ткани) проводились лишь на материале биопсии, изъятой из области аугментации.
Срезы фотографировали при помощи камеры Leica DFC480, зафиксированной на стереомикроскопе Leica MZ16 (Leica, Heerbrugg, Швейцария) с использованием программного обеспечения Image Access (Imagic, Глаттбругге, Швейцария). Используя то же программное обеспечение, проводилось измерение интересующих участков тканей по контуру их визуализации.
В случае неопределенности контуров объектов использовали специальную систему для более детального изучения перекрывающихся элементов изображения, исходя из ранее полученных данных, а также из возможностей визуального увеличения деталей цифрового снимка. Результаты гистологического исследования свидетельствуют о наличии зрелой губчатой кости, а также нерезорбированных гранул Bio-Oss (BO), окруженных новообразованной костной тканью.
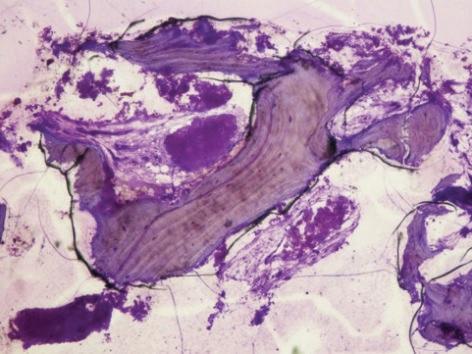
Фото 11: Результаты гистологического исследования (40-кратное увеличение): наличие новых костных клеток и остаточных частиц костного трансплантата.
Обсуждение
Успешность стоматологической реабилитации пациентов с использованием дентальных имплантатов определяется рядом факторов: состоянием мягких и твердых тканей, адекватностью последующего протезирования и восстановления эстетического профиля пациента.
В некоторых случаях использование трансплантатных материалов разной природы может обеспечить наиболее подходящий подход для достижения наиболее желаемого результата. Восстановление адекватного объема альвеолярного гребня, подходящего для установки дентальных имплантатов, является одной из процедур, выполнение которой рекомендовано у ряда пациентов со значительной атрофией костной ткани.
Результаты недавнего ретроспективного исследования 192 имплантатов, установленных в областях аугментации челюстей, доказали, что суммарный процент выживаемости инфраконструкций после выполнения костнопластических манипуляций составляет 96±2% в разрезе 6-летнего периода наблюдения, а статистической разницы этого показателя в зависимости от типа используемых трансплантата или мембраны обнаружено не было. Альтернативой, позволяющей избежать реконструктивных манипуляций в области атрофированной верхней челюсти, остается использование скуловых дентальных имплантатов. Показатели успеха их использования и долговечности функционирования довольно хорошо задокументированы, но для подобной манипуляции требуется не только особенное хирургическое мастерство, но и условия для протезирования посредством полных съемных протезов, поскольку фактов фиксации одиночных коронок на подобные поддерживающие конструкции зафиксировано не было. Кроме того, данные относительно восстановления дефектов зубного ряда протезами с опорой на скуловые имплантаты в большинстве случаев касаются лишь довольно короткого периода наблюдения, в то время как вопрос эффективности аугментационных процедур челюстей изучался более длительный период времени.
В представленном клиническом случае авторы проводили реконструкцию костного гребня с использованием титановой сетки, ауто- и ксеногенного трансплантатов. Реальное преимущество подобного подхода состоит в минимизации риска инфицирования, поскольку результаты систематического обзора помогли обнаружить, что лишь в 20% случаев с зарегистрированными признаками воспаления десен требовалось провести удаление титановой сетки, в то время как в остальных ситуациях успешного лечения дегисценций мягких тканей удавалось достичь применением лишь хлоргексидинового геля, при этом, не ставя под угрозу показатель выживаемости имплантата.
Совсем недавно Lizio и коллеги обнаружили значительную корреляцию между показателями дефицита костной ткани и риском обнажения установленной титановой сетки, покрывающей трансплантат. Цель смешивания аутогенной кости с депротеинизированным бычьим костным трансплантатом состоит в том, чтобы комбинировать поддерживающую функцию ксенографта и остеогенные и остеоиндуктивные свойства собственного аутоматериала.
Кроме того, использование подобной смеси позволяет уменьшить количество необходимой для забора аутогенной кости, что, как следствие, уменьшает травматичность манипуляции, экономит время хирургического вмешательства, а также минимизирует послеоперационный дискомфорт пациента.
В представленном клиническом случае при удалении сетки в некоторых участках между сеткой и новосформированной костной тканью были обнаружены следы соединительной прослойки, тенденция образования которых уже сообщалась в литературе при использовании титановых сеток вместо расширенных политетрафторэтиленовых (e-PTFE) мембран для покрытия участка с адаптированным трансплантатом.
Simion и коллеги в свое время провели гистологические и гистоморфометрические исследования особенностей использования смеси депротеинизированного бычьего костного трансплантата и аутогенной кости в пропорции 1:1 вместе с e-PTFE мембраной для вертикальной аугментации костного гребня. В ходе анализа результатов было обнаружено признаки продолжающегося ремоделирования как аутогенной кости, так и частиц ксенотрансплантата.
Кроме того, авторами было доказано, что независимо от количества этапов ятрогенного вмешательства, во всех случаях была достигнута адекватная остеоинтеграция имплантатов. Также исследователи установили, что как ауто- так и ксенотрансплантат резорбируются на протяжении от 6 до 9 месяцев, но последний более медленно проходит через данный процесс с последующим замещением новосформированной костной тканью. Об этом свидетельствуют наблюдаемые показатели плотности бычьего костного матрикса в 8,63% по сравнению с аналогичными показателями аутогеной кости - 6,23% при их смешивании в пропорции 1:1 (первичная гипотетическая плотность каждого из материалов в момент их адаптации в области атрофии колебалась в диапазоне 25-50% с учетом наличия кровяного сгустка в области аугментации).
Особенности резорбции бычьего костного трансплантата помогают обеспечить долгосрочную стабильность поддерживающего матрикса для регенерации кости. В результате аугментации и увеличения объема костной ткани врач может столкнуться с проблемой недостаточной глубины преддверья полости рта, и неким дефицитом площади кератинизированной слизистой, так как корональное смещение лоскута для закрытия раны значительно влияет на данные параметры. В конце концов, это может скомпрометировать эстетическую составляющую реабилитации пациентов с атрофией резидуального гребня. В подобных случаях пользуются процедурой вестибулопластики, которая помогает адаптировать состояние слизистой полости рта относительно будущей протетической конструкции. Кроме того, важно обеспечить достаточную ширину слизистой вокруг дентальных имплантатов, чтобы минимизировать риск возникновения возможных периимплантитных осложнений, связь между которыми была доказана в ходе численных научных и практических исследований.
В данном клиническом случае для вышеописанной цели был использован свиной коллагеновый матрикс (Mucograft, Geistlich, Вольхузен, Кьяссо), эффективность использования которого достаточно аргументировано доказана в современной литературе. Сравнивая аутогенные свободные десневые трансплантаты и аналог ксеноматериала, Schmitt и коллеги пришли к заключению, что последние обеспечивают достаточно адекватную эффективность восстановления ороговевшей слизистой, и, следовательно, являются подходящими для аугментации мягких тканей в ходе комплексного лечения. Но использование Mucograft исключает необходимость забора собственных мягких тканей, таким образом, уменьшая время ятрогенного вмешательства и степень его травматичности. После вестибулопластики в данном клиническом случае также была проведена процедура апикального перемещения лоскута и пластики отдельного сосочка для имитации наиболее естественной архитектуры мягких тканей. Прикрепленная часть слизистой была диспозирована в более щечную сторону, обеспечивая больший объем пространства для восстановления мягких тканей с вестибулярной стороны имплантатов. Избыток тканей со щечной стороны также позволяет произвести формирование лоскута на ножке с целью заполнения пространства сосочка между смежными протетическими конструкциями с опорой на имплантаты. В данном клиническом случае прогнозированного состояния слизистой удалось добиться еще и за счет использования провизорных протезов.
Выводы
В данной статье рассмотрен ряд передовых методов реконструкции мягких и твердых тканей ротовой полости в ходе стоматологической реабилитации пациентов посредством протетических конструкций с опорой на дентальные имплантаты. Совместное использование трансплантатов разной природы может обеспечить адекватную альтернативу для восстановления архитектуры костного гребня, уменьшая при этом инвазивность данной манипуляции.
Авторы: Carlo Maiorana, Mario Beretta, Davide Rancitelli, Giovanni Battista Grossi, Marco Cicciu, Alan Scott Herford
Производители:
В ходе протезирования с опорой на дентальные имплантаты крайне важным остается аспект оптимальной костной поддержки супраконструкции, как и качества связи между титановым элементом и окружающей костной тканью. Кроме того, важное значение играет состояние мягких тканей, с воспаления которых начинаются последующие процессы перимукозита и периимплантита. Следовательно, чтобы обеспечить адекватные условия для имплантации временами приходиться прибегать к трем или даже четырем реконструктивным вмешательствам, и поэтому процесс лечения затягивается на срок до 12-18 месяцев.

Материалы и методы
56-летняя соматически здоровая пациентка обратилась за стоматологической помощью на кафедру имплантологии, Fondazione IRCCS Cà Granda, Ospedale Maggiore Policlinico (Милан, Италия) по поводу дефекта зубного ряда в области левого сегмента верхней челюсти.
В ходе клинического осмотра было установлено, что объем альвеолярного гребня в данном участке является дефицитным, а взаимоотношение челюстей соответствует перекрёстному прикусу. С правой стороны верхней челюсти у пациентки были зарегистрировано расширение границ гайморовой пазухи. Результаты рентгенографических исследований, панорамной и конусно-лучевой томографий подтвердили атрофию альвеолярного гребня, и помогли визуализировать его специфическую ножеподобную форму в области премоляров, а также резидуальные 3 мм высоты костной ткани в области моляров.
Фото 1: Клинический вид атрофии альвеолярного гребня в левом сегменте верхней челюсти.

Фото 2: Результаты КТ-диагностики: атрофия костного гребня верхней челюсти, наличие горизонтального дефекта кости. (А) визуализация всех особенностей атрофии в области верхней челюсти; (Б) данный аксиальный срез демонстрирует область, подлежащую будущей аугментации.

План реабилитации состоял из четырех этапов лечения:
- Реконструкция альвеолярного гребня с использованием автогенной костной стружки, ксеногенного трансплантата и титановой сетки, а также синус-лифт посредством ксенногенного костного заменителя:
- Удаление титановой сетки через семь месяцев после первичного вмешательства с последующим выполнением аугментации мягких тканей при помощи коллагеновой матрицы:
- Имплантация;
- Протезирование посредством временного пластмассового протеза с дальнейшей его заменой на золото-керамическую мостовидную конструкцию.
После полной санации ротовой полости пациентке были предоставлены рекомендации относительно особенностей поддержки гигиены полости рта в домашних условиях. Предоперационную санацию синуса начали за 15 дней до операции посредством применения назального спрея с действующей субстанцией мометазона (Nasonex Merck, Sharp Sharp and Dhome, Ch) дважды в день.
Во время первого хирургического вмешательства, которое проходило под общим наркозом, был отсепарирован полный лоскут в границах от левого верхнего клыка до верхнечелюстного бугра, после чего синус-лифт провели через латеральный доступ, а субантральную полость заполнили ксеногенным костным трансплантатом (Bio-Oss, Geistlich, Wohlusen, Ch). Аугментацию альвеолярного гребня проводили посредством смеси аутогенной костной ткани, собранной при помощи костного скребка из области верхнечелюстного бугра, и ксеногенного трансплантата в соотношении 1: 1. Костный материал накрыли титановой сеткой (OMNIA S.p.A., Fidenza (Parma), Италия), которую, в свою очередь, зафиксировали при помощи винтов. Над титановой сеткой дополнительно установили резорбируемую коллагеновую мембрану (BioGide, Geistlich, Вольхузен, Чиассо), чтобы ограничить миграцию эпителиальных клеток в область аугментации.
Фото 3: Клинический вид костной ткани после сепарации слизисто-надкостичного лоскута.

Фото 4: Проведение синус-лифта с целью увеличения параметров высоты костного гребня.

Фото 5: Установка титановой сетки с целью реконструкции альвеолярного гребня.

Для укрытия раны со стороны щечного лоскута были выполнены дополнительные периостальные надрезы, после чего область вмешательства ушили двухслойным швом нитями 4-0 из полиглактина (Vycril, Ethicon, США). С правой стороны синус-лифт был выполнен в области первых моляров с использованием лишь ксеногенного материала. Швы были удалены через 15 дней.
Заживление области вмешательства проходило без осложнений, так что через семь месяцев врач приступил к следующему этапу лечения – удалению титановой сетки и аугментации мягких тканей. Для обнажения титанового элемента под местной анестезией провели разрез посредине альвеолярного гребня, через который аккуратно удалили сетку, а небольшой образец образовавшейся костной ткани посредством трепана взяли для детального гистологического исследования. Для формирования адекватного профиля преддверья полости рта, щечной лоскут переместили апикально и ушили к подлежащей соединительной ткани, а обнаженную часть раны покрыли свинячьей коллагеновой матрицей (Mucograft, Geistlich, Вольхузен, Чиассо). Последнюю фиксировали посредством 5-0 полиглактиновых нитей.
Фото 6: Вид кости после удаления титановой сетки: восстановления объемов альвеолярного гребня.

Фото 7: Окклюзионный вид костного гребня после агументации с использованием титановой сетки.

Фото 8: Установка коллагеновой мембраны для адекватного заживления мягких тканей.

Фото 9: В ходе имплантации часть новообразовавшейся кости была изъята для гистологического анализа.

Через сорок дней после операции наблюдалось полное заживление мягких тканей, что позволило врачу приступить к третьему этапу лечения – собственно имплантации. Для этого провели сепарацию полного лоскута с правой и левой сторон, и установили пять имплантатов системы Camlog Screw line (Camlog AG, Ch).
После установки имплантатов с учетом особенностей будущей процедуры протезирования, был обнаружен небольшой горизонтальный дефект в области клыка, который тут же восстановили при помощи Bio-Oss и Biogide.
Фото 10: Установка дентального имплантата и проведение разреза надкостницы для адекватного покрытия инфраосальных титановых конструкций мягкими тканями.

Четыре месяца спустя имплантаты обнажили с целью установки формирователей десен. Последние установили после выполнения простого прямого разреза в области первого правого верхнего моляра и смежно с аугментацией области межзубного сосочка по технике Palacci с левой стороны. Через два месяца сняли оттиск для изготовления временных конструкций, а через пять – для окончательных. В ходе анализа результатов лечения при помощи ортопантомографии через два года после вмешательства был зарегистрирован оптимальный уровень альвеолярного гребня, а профиль мягких тканей выглядел физиологически стабильным без каких-либо признаков воспаления.
Фото 12: Рентгенограмма через два года: остеоинтеграция зубных имплантатов и адекватная поддержка протетических элементов.

Фото 13: Клинический вид через два года после реабилитации: оптимальный профиль мягких тканей.

Гистологический анализ
Материал для биопсии был взят при помощи трепана с внутренним диаметром 2,6 мм. Кость фиксировали в 10% нейтральном буферном растворе формалина на протяжении 48 часов, после чего ее обрабатывали по методу Donath и Breuner с целью изучения методом световой микроскопии без деминерализации материала.
Дегидратацию проводили путем увеличения концентрации этанола с использованием специальной системы обезвоживания в вакуумных условиях. После этого костные блоки фиксировали в смоле Kulzer Technovit 7200 VLC, и фрагментировали продольно на режущем станке EXAKT (EXAKT, Нордерштедта, Германия).
Каждый срез утончали посредством микропришлифовывания, а затем полировали с использованием аппарата EXAKT до однородной толщины в 20 мм. Окраску материала проводили толуидиновым синим / пиронином F. Гистоморфометрические измерения фракций разных тканей (депротеинизированного бычьего костного трансплантата, аутокости, новообразовавшейся костной ткани и костного мозга, или соединительной ткани) проводились лишь на материале биопсии, изъятой из области аугментации.
Срезы фотографировали при помощи камеры Leica DFC480, зафиксированной на стереомикроскопе Leica MZ16 (Leica, Heerbrugg, Швейцария) с использованием программного обеспечения Image Access (Imagic, Глаттбругге, Швейцария). Используя то же программное обеспечение, проводилось измерение интересующих участков тканей по контуру их визуализации.
В случае неопределенности контуров объектов использовали специальную систему для более детального изучения перекрывающихся элементов изображения, исходя из ранее полученных данных, а также из возможностей визуального увеличения деталей цифрового снимка. Результаты гистологического исследования свидетельствуют о наличии зрелой губчатой кости, а также нерезорбированных гранул Bio-Oss (BO), окруженных новообразованной костной тканью.
Фото 11: Результаты гистологического исследования (40-кратное увеличение): наличие новых костных клеток и остаточных частиц костного трансплантата.

Обсуждение
Успешность стоматологической реабилитации пациентов с использованием дентальных имплантатов определяется рядом факторов: состоянием мягких и твердых тканей, адекватностью последующего протезирования и восстановления эстетического профиля пациента.
В некоторых случаях использование трансплантатных материалов разной природы может обеспечить наиболее подходящий подход для достижения наиболее желаемого результата. Восстановление адекватного объема альвеолярного гребня, подходящего для установки дентальных имплантатов, является одной из процедур, выполнение которой рекомендовано у ряда пациентов со значительной атрофией костной ткани.
Результаты недавнего ретроспективного исследования 192 имплантатов, установленных в областях аугментации челюстей, доказали, что суммарный процент выживаемости инфраконструкций после выполнения костнопластических манипуляций составляет 96±2% в разрезе 6-летнего периода наблюдения, а статистической разницы этого показателя в зависимости от типа используемых трансплантата или мембраны обнаружено не было. Альтернативой, позволяющей избежать реконструктивных манипуляций в области атрофированной верхней челюсти, остается использование скуловых дентальных имплантатов. Показатели успеха их использования и долговечности функционирования довольно хорошо задокументированы, но для подобной манипуляции требуется не только особенное хирургическое мастерство, но и условия для протезирования посредством полных съемных протезов, поскольку фактов фиксации одиночных коронок на подобные поддерживающие конструкции зафиксировано не было. Кроме того, данные относительно восстановления дефектов зубного ряда протезами с опорой на скуловые имплантаты в большинстве случаев касаются лишь довольно короткого периода наблюдения, в то время как вопрос эффективности аугментационных процедур челюстей изучался более длительный период времени.
В представленном клиническом случае авторы проводили реконструкцию костного гребня с использованием титановой сетки, ауто- и ксеногенного трансплантатов. Реальное преимущество подобного подхода состоит в минимизации риска инфицирования, поскольку результаты систематического обзора помогли обнаружить, что лишь в 20% случаев с зарегистрированными признаками воспаления десен требовалось провести удаление титановой сетки, в то время как в остальных ситуациях успешного лечения дегисценций мягких тканей удавалось достичь применением лишь хлоргексидинового геля, при этом, не ставя под угрозу показатель выживаемости имплантата.
Совсем недавно Lizio и коллеги обнаружили значительную корреляцию между показателями дефицита костной ткани и риском обнажения установленной титановой сетки, покрывающей трансплантат. Цель смешивания аутогенной кости с депротеинизированным бычьим костным трансплантатом состоит в том, чтобы комбинировать поддерживающую функцию ксенографта и остеогенные и остеоиндуктивные свойства собственного аутоматериала.
Кроме того, использование подобной смеси позволяет уменьшить количество необходимой для забора аутогенной кости, что, как следствие, уменьшает травматичность манипуляции, экономит время хирургического вмешательства, а также минимизирует послеоперационный дискомфорт пациента.
В представленном клиническом случае при удалении сетки в некоторых участках между сеткой и новосформированной костной тканью были обнаружены следы соединительной прослойки, тенденция образования которых уже сообщалась в литературе при использовании титановых сеток вместо расширенных политетрафторэтиленовых (e-PTFE) мембран для покрытия участка с адаптированным трансплантатом.
Simion и коллеги в свое время провели гистологические и гистоморфометрические исследования особенностей использования смеси депротеинизированного бычьего костного трансплантата и аутогенной кости в пропорции 1:1 вместе с e-PTFE мембраной для вертикальной аугментации костного гребня. В ходе анализа результатов было обнаружено признаки продолжающегося ремоделирования как аутогенной кости, так и частиц ксенотрансплантата.
Кроме того, авторами было доказано, что независимо от количества этапов ятрогенного вмешательства, во всех случаях была достигнута адекватная остеоинтеграция имплантатов. Также исследователи установили, что как ауто- так и ксенотрансплантат резорбируются на протяжении от 6 до 9 месяцев, но последний более медленно проходит через данный процесс с последующим замещением новосформированной костной тканью. Об этом свидетельствуют наблюдаемые показатели плотности бычьего костного матрикса в 8,63% по сравнению с аналогичными показателями аутогеной кости - 6,23% при их смешивании в пропорции 1:1 (первичная гипотетическая плотность каждого из материалов в момент их адаптации в области атрофии колебалась в диапазоне 25-50% с учетом наличия кровяного сгустка в области аугментации).
Особенности резорбции бычьего костного трансплантата помогают обеспечить долгосрочную стабильность поддерживающего матрикса для регенерации кости. В результате аугментации и увеличения объема костной ткани врач может столкнуться с проблемой недостаточной глубины преддверья полости рта, и неким дефицитом площади кератинизированной слизистой, так как корональное смещение лоскута для закрытия раны значительно влияет на данные параметры. В конце концов, это может скомпрометировать эстетическую составляющую реабилитации пациентов с атрофией резидуального гребня. В подобных случаях пользуются процедурой вестибулопластики, которая помогает адаптировать состояние слизистой полости рта относительно будущей протетической конструкции. Кроме того, важно обеспечить достаточную ширину слизистой вокруг дентальных имплантатов, чтобы минимизировать риск возникновения возможных периимплантитных осложнений, связь между которыми была доказана в ходе численных научных и практических исследований.
В данном клиническом случае для вышеописанной цели был использован свиной коллагеновый матрикс (Mucograft, Geistlich, Вольхузен, Кьяссо), эффективность использования которого достаточно аргументировано доказана в современной литературе. Сравнивая аутогенные свободные десневые трансплантаты и аналог ксеноматериала, Schmitt и коллеги пришли к заключению, что последние обеспечивают достаточно адекватную эффективность восстановления ороговевшей слизистой, и, следовательно, являются подходящими для аугментации мягких тканей в ходе комплексного лечения. Но использование Mucograft исключает необходимость забора собственных мягких тканей, таким образом, уменьшая время ятрогенного вмешательства и степень его травматичности. После вестибулопластики в данном клиническом случае также была проведена процедура апикального перемещения лоскута и пластики отдельного сосочка для имитации наиболее естественной архитектуры мягких тканей. Прикрепленная часть слизистой была диспозирована в более щечную сторону, обеспечивая больший объем пространства для восстановления мягких тканей с вестибулярной стороны имплантатов. Избыток тканей со щечной стороны также позволяет произвести формирование лоскута на ножке с целью заполнения пространства сосочка между смежными протетическими конструкциями с опорой на имплантаты. В данном клиническом случае прогнозированного состояния слизистой удалось добиться еще и за счет использования провизорных протезов.
Выводы
В данной статье рассмотрен ряд передовых методов реконструкции мягких и твердых тканей ротовой полости в ходе стоматологической реабилитации пациентов посредством протетических конструкций с опорой на дентальные имплантаты. Совместное использование трансплантатов разной природы может обеспечить адекватную альтернативу для восстановления архитектуры костного гребня, уменьшая при этом инвазивность данной манипуляции.
Авторы: Carlo Maiorana, Mario Beretta, Davide Rancitelli, Giovanni Battista Grossi, Marco Cicciu, Alan Scott Herford





























































































































































0 комментариев