Адаптация полных съемных протезов, используемых с целью реабилитации беззубых пациентов, является затруднительной задачей как для врача-стоматолога, так и для самого пациента, нуждающегося в лечении.
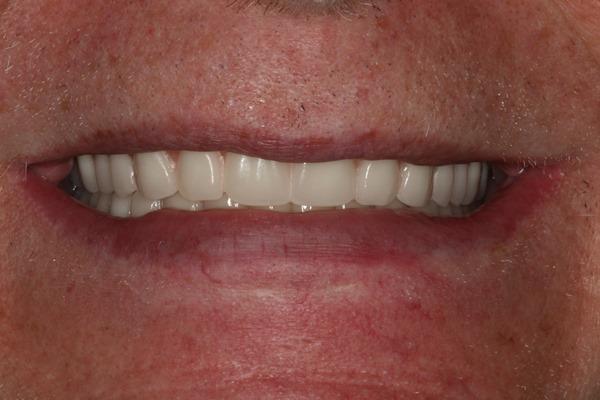
С учетом всего вышеперечисленного, можно резюмировать, что новые стандарты использования полных съемных конструкций сводятся к использованию имплантатов в качестве поддерживающих опор, которые, в свою очередь, помогают решить сразу несколько клинически важных проблем у пациентов с полной адентией.
Полные протезы с опорой на имплантаты в области нижней челюсти могут отличаться в зависимости от количества используемых имплантатов, а также типа соединения, используемого в области интерфейса супра- и инфраконструкций. Применение двух "стандартных" (ширина > 3,3 мм) эндооссальных опор, установленных в области между ментальными отверстиями с эластичным типом соединения считается тем самым минимальным стандартом вмешательства, которое, по возможности, рекомендуется обеспечить для большинства беззубых пациентов.
Подобный подход помогает значительно улучшить общий показатель качества жизни данной группы стоматологических пациентов, страдающих полной адентией нижней челюсти. Но установка имплантатов стандартного диаметра в 3,3 мм или даже немного более широких опор сама по себе может быть весьма затруднительной задачей с учетом возможной объемной редукции костной ткани резидуального гребня. В подобных случаях без проведения дополнительной процедуры костной аугментации попросту не обойтись. С другой стороны, подобное вмешательство значительно увеличивает финансовые затраты на лечение, и является основной причиной отказа большинства пациентов от подобного лечебного алгоритма.
Использование имплантатов меньшого диаметра (2,7-3,3 мм) или так называемых "мини-имплантатов" (диаметром 1,8-2,4 мм) в качестве опор под полные съемные конструкции является достаточно эффективной альтернативой для обеспечения прогнозируемых результатов ортопедического лечения.
В недавнем исследовании было доказано, что установка двух мини-имплантатов в качестве опоры съемного протеза, помогла значительно улучшить показатель качества жизни пациента по сравнению с использованием с той же целью инфраконструкций обычного диаметра. В свою очередь, установка сразу четырех мини-имплантатов обеспечила еще лучшие результаты реабилитации по сравнению с обоими вышеупомянутыми подходами. Уровень выживаемости титановых опор составлял 89%, 82% и 99% для походов с использованием четырех мини-имплантатов, двух мини-имплантатов и двух стандартных имплантатов соответственно. В случаях с мини-имплантатами не использовались жесткие конструкции балок, соединяющие имплантаты, а возможности их установки, по своей сути, не ограничивались имеющимися параметрами кости. В зависимости от производителя мини-имплантатов, особенности их текстуры, профиля резьбы, ширины и длины могут изменяться, что практически никак не влияет на достаточно высокий доказуемый уровень успешности их использования в качестве опор. Исходя из результатов гистологического исследования экстрагированных имплантатов диаметром 1,8 мм, был доказан факт их остеоинтеграции даже при дефицитных параметрах резидуального гребня или в условиях атрофии кости без необходимости проведения дополнительной процедуры твердотканной аугментации. Согласно имеющимся ретроспективным данным, которые являются несколько ограниченными, показатели выживаемости мини-имплантатов, используемых в качестве опор под фиксированные и съемные протетические конструкции, превышает 90%. В случаях достижения адекватных параметров первичной стабильности немедленная и ранняя нагрузка мини-имплантатов характеризируется 91,7% и 96,7% успешностью их функционирования соответственно. Нюанс подобного терапевтического подхода состоит в необходимости замены ретенционных колец в области «мамки» атачмена, которые истираются во время функционирования. Во всех других аспектах лечение с помощью мини-имплантатов ничем не отличается от такового при использовании их аналогов стандартного диаметра.
В общем возможности проведения имплантологического лечения у большинства пациентов значительно ограничены. В среднем только 1,7% пациентов с полной адентией во всем мире были реабилитированы при помощи внутрикостных титановых опор. Однако, следует отметить, что, учитывая более низкую стоимость лечения с использованием мини-имплантатов, а также минимально инвазивный характер вмешательства, подобный комплексный подход может приобрести значительную популярность как среди врачей-стоматологов, так и среди их пациентов. Кроме того, растущее число доказательных фактов и многочисленные, хоть и положительные краткосрочные результаты подобного алгоритма лечения, должны мотивировать стоматологов к более широкому применению мини-имплантатов среди пациентов, требующих реабилитации при полной адентии нижней челюсти.
Клинический случай
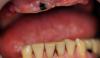
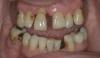
62-летний мужчина обратился за стоматологической помощью с целью замены его старых полных съемных протезов. Он признался, что долгое время не пользовался своими старыми протезами, которые были изготовлены 6 лет назад сразу же после экстракции всех оставшихся у него зубов. По словам пациента, удаление зубов имело последовательный характер, поскольку он попросту пренебрегал своим стоматологическим здоровьем. Также он жаловался на свои старые протезы, которые удерживались во рту ненадлежащим образом, компрометируя функцию жеванию и провоцируя болезненные ощущения. В ходе первого визита он также сообщил, что узнал о возможности ретенции съемных конструкций при помощи имплантатов из телевизионной рекламы, поэтому решил уточнить у стоматолога, насколько дорогой и инвазивной является данная манипуляция.
Согласно классификации Американского сообщества Анестезиологов, исходя из критерия физического состояния, пациента можно было отнести к 3 классу, что обозначает, что у него имеется тяжелое системное заболевание. В анамнезе у него наблюдалась гипертония, в 2014 году - "незначительные" нарушения мозгового кровообращения (инсульт), хроническая боль из-за травмы спины, нарушения опорно-двигательного аппарата и генерализированное ощущение тревоги. Все вышеперечисленные заболевания корригировались при помощи медикаментов. В середине 1970-х годов пациенту проводили частичную замену коленного сустава, на данный момент у него также была зарегистрирована аллергия на пенициллин. Антикоагулянтов по причине наличия инсульта в анамнезе пациент не принимал. Также ранее мужчина злоупотреблял алкоголем и много курил, но, даже учитывая все вышеперечисленные факторы, у больного не было обнаружено абсолютных противопоказаний к проведению процедуры дентальной имплантации.
Системное состояние пациента было хорошо контролируемым, однако для минимизации инвазивности процедуры и снижения ее послеоперационной болезненности классический хирургический алгоритм лечения нуждался в незначительной модификации. Пациенту было предложено несколько подходов к реабилитации с информированием о всех потенциальных рисках каждого из них. Он согласился на алгоритм лечения, предполагающий изготовление нового полного съемного протеза на верхнюю челюсть и аналогичной конструкции на нижнюю челюсть, но с соответствующей ее поддержкой четырьмя мини-имплантатами с шаровидным типом соединения. Среди других вариантов также рассматривались подходы, предполагающие изготовление классических съемных протезов на обе челюсти, имплантацию на обеих челюстях с разными типами и дизайнами инфраконстуркций, а также использование несъемного протеза с опорой на имплантатах. Учитывая, что объем костной ткани был достаточным, пациент был проинформирован о возможности проведения классического протокола имплантации. Но с учетом стоимости и инвазивности процедуры, а также сроков лечения, больной остановился на варианте реабилитации посредством конструкций мини-имплантатов. Оперативное вмешательство было запланировано через 1 неделю после первичной консультации. Пациент не изъявил желания продолжать пользоваться своими старыми протезами до того, как будут изготовлены новые супраконструкции. Предполагалось, что часть установленных имплантатов, которая будет находиться над областью десен, будет соединяться с частью аттачмена в структуре протеза посредством шаровидного утолщения. Использование хирургического шаблона не было показано для данного случая, но при необходимости могло быть имплементировано без каких-либо проблем.
Предоперационная визуализация и оценка
В ходе первичного консультационного визита была получена ортопантомограмма пациента, на которой удалось подтвердить отсутствие каких-либо сопутствующих патологий в области беззубых верхней и нижней челюстей. Уровень костной ткани был достаточным для проведения дентальной имплантации. Передняя часть нижней челюсти должным образом являлась подходящим участком для установки четырех мини-имплантатов. Таким образом, ортопантомография являлась скрининговым методом диагностики, помогающим определить предварительный план лечения уже в ходе первичного визита пациента. Поскольку Американская академия стоматологической и челюстно-лицевой радиологии рекомендует планировать имплантологическое лечение, исходя из результатов КТ-диагностики, в данном клиническом случае мы проводили КЛКТ-сканирование переднего участка нижней челюсти для дальнейшего уточнения хирургического этапа. Подобный подход помогает точно установить позицию ментального отверстия, а также петли ментального нерва (фото 1), с учетом всех возможных анатомических вариаций.
Фото 1. КЛКТ-снимок нижней челюсти с запланированными имплантатами.
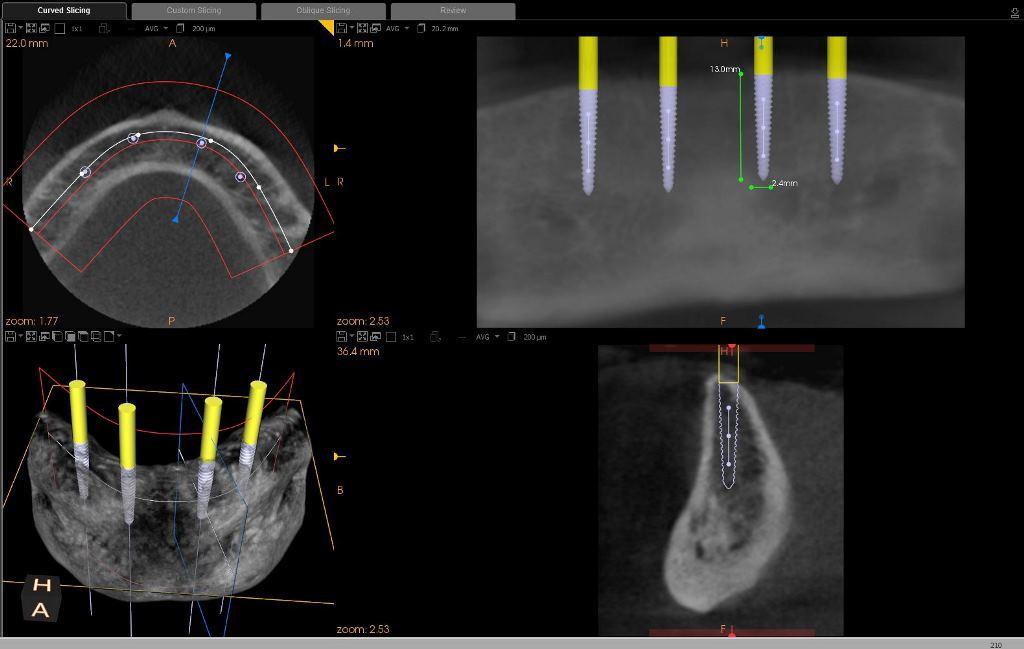
Учитывая параметры костной ткани, было решено проводить установку имплантатов диаметром 2,4 мм и длиной 13 мм. Положение двух имплантатов несколько дистально позволило бы обеспечить достаточную прочность конструкции и спозиционировать их при этом максимально удаленно от двух передних интраоссальных опор. Кроме того, увеличение переднезаднего расстояния между имплантатами позволяет исключить необходимость формирования консольных частей протеза, которые являются слабым звеном во время функциональной нагрузки. В ходе оценки мягких тканей также не было обнаружено никаких сопутствующих патологий, прикрепление мышц и уздечек также было в норме. В области гребня нижней челюсти была обнаружена кератинизированная часть слизистой, которая идеально подходила для установки имплантологических конструкций, однако не являлась обязательным клиническим аспектом для достижения успешных результатов реабилитации.
Хирургический этап
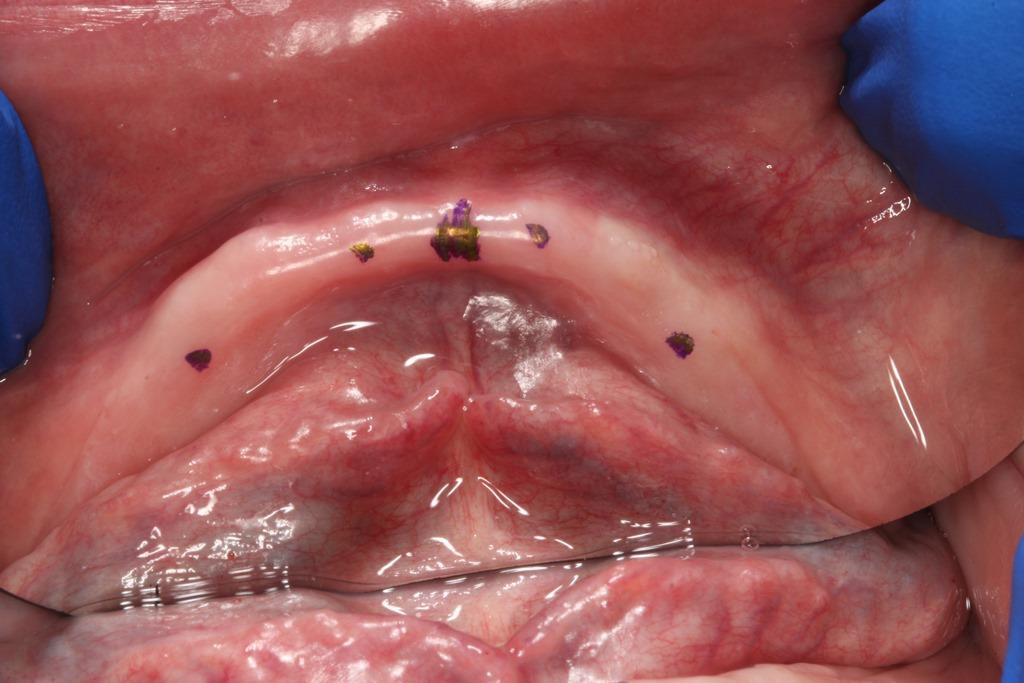
После обеспечения стерильности операционного поля была подтверждена позиция ментального отверстия путем пальпации передней части нижней челюсти. Процедуру проводили в соответствии с анализом результатов КЛКТ-сканирования. При необходимости большей детализации можно использовать рентгенологические маркеры, в роли которых часто используются имеющиеся протезы пациентов. Для удержания оптимального 3-милимметрового расстояния между имплантатами был использован хирургический маркер (фото 2).
Фото 2. Вид нижней челюсти для маркеров установки имплантатов.
После уточнения позиции ментального нерва с целью профилактики образования подслизистой гематомы приступили к выполнению процедуры инфильтрационной анестезии. Для минимизации действия адреналина на организм пациента были предприняты соответствующие меры. Для выполнения остеотомии и перфорации слизистой использовали хирургический наконечник, которым обеспечили формирование трансмукозного доступа к кости (безлоскутная операция). В отдельных случаях, когда необходимо визуализировать структуру костной ткани, может понадобиться проведение сепарации слизисто-накостничного лоскута, но в данной ситуации такой потребности не было. Остеотомию проводили спиральным сверлом 1,2 мм в диаметре со скоростью 1200 оборотов в минуту на глубину 10 мм (фото 3), что было продиктовано конструкционными параметрами выбранных интраоссальных опор.
Фото 3. Проведение безлоскутной операции: остеотомия сверлом 1,2 мм в диаметре на 10 мм вглубь на скорости 1200 оборотов в минуту при достаточной ирригации. Морфология гребня была достаточной для адекватного проведения остеотомии.

При достаточном клиническом опыте удается провести остеотомию, не перфорируя ни щечную, ни язычную кортикальные пластинки. Подобного мастерства удается достичь, учитывая ангуляцию костного гребня на разных топографических участках. Кроме того, очень важно правильно сынтерпретировать полученные результаты КЛКТ-сканирования, которые играют основную роль в процессе детализирующей диагностики особенностей морфологии костной ткани. Если риск перфорации маргинальных костных пластинок достаточно велик, лучше использовать направляющий хирургический шаблон, предварительно обеспечив сепарацию полного лоскута. Для проверки параллельности участков препарирования часто используют направляющие штифты или же имплантаты, которые устанавливают лишь частично.
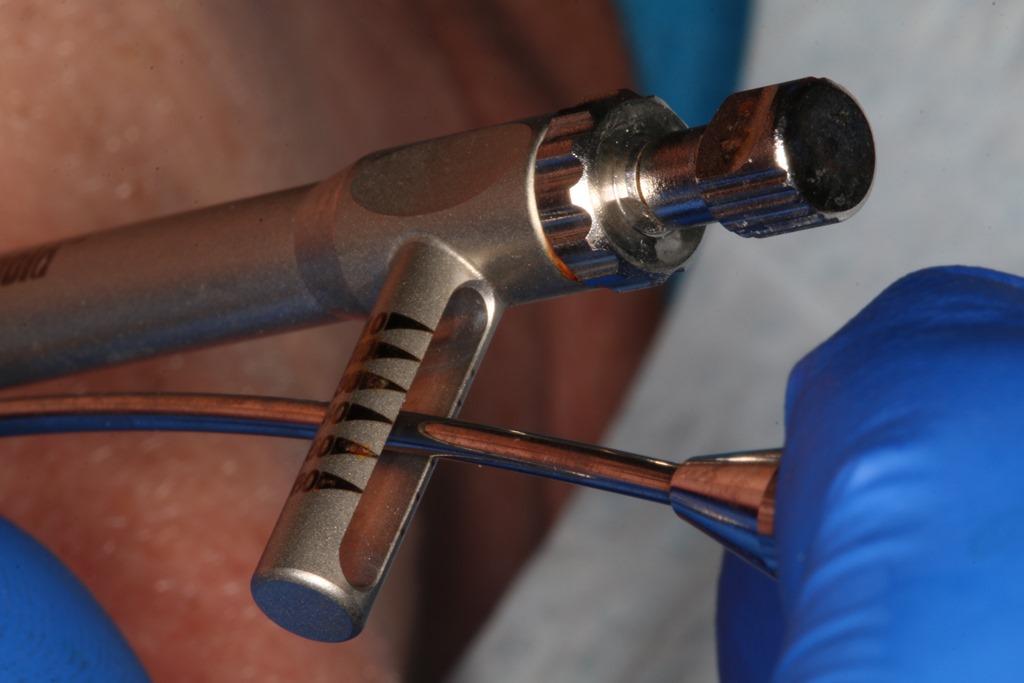
Имплантат был удален из стерильной упаковки (фото 4) и установлен в область остеотомии при помощи ручного рифленого ключа (фото 5). С этой же целью можно использовать хирургический наконечник, установленный на 50 оборотов в минуту при торке 30 Нсм (фото 6). Благодаря резьбе, имплантат продвигается вглубь отпрепарированного участка кости, а для того чтобы обеспечить более высокие показатели торка можно использовать Т-образный или реверсивный ключи (фото 7).
Фото 4. Ручной рифленый ключ для переноса имплантата из стерильной упаковки в область остеотомии.

Фото 5. Большего торка можно достичь при помощи Т-образного ключа.
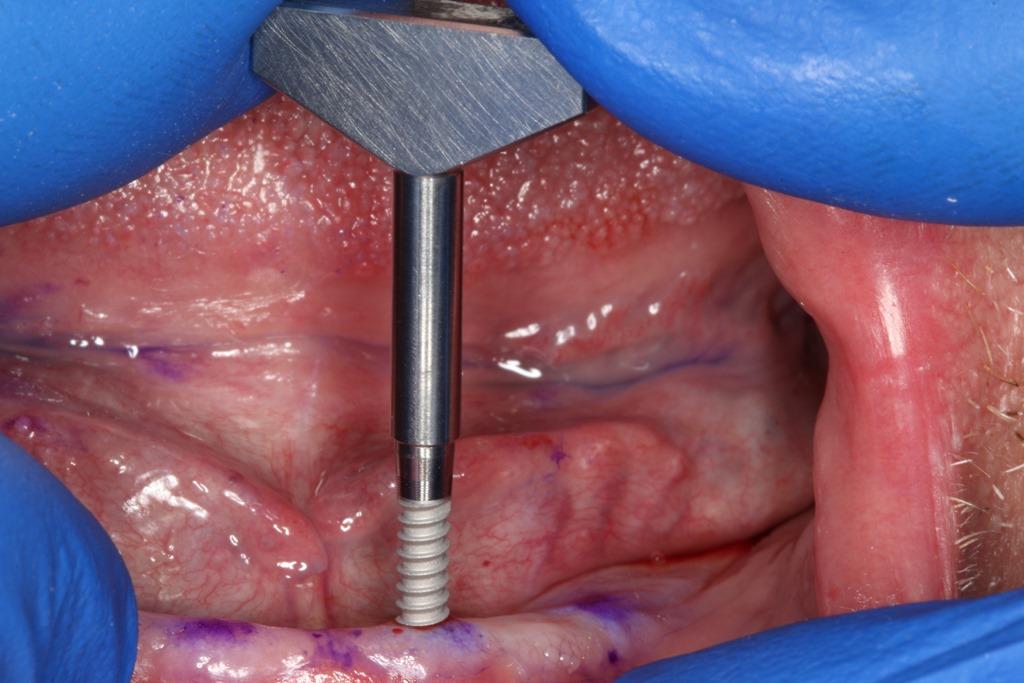
Фото 6. Установку имплантата также можно провести при помощи наконечника и адаптера.
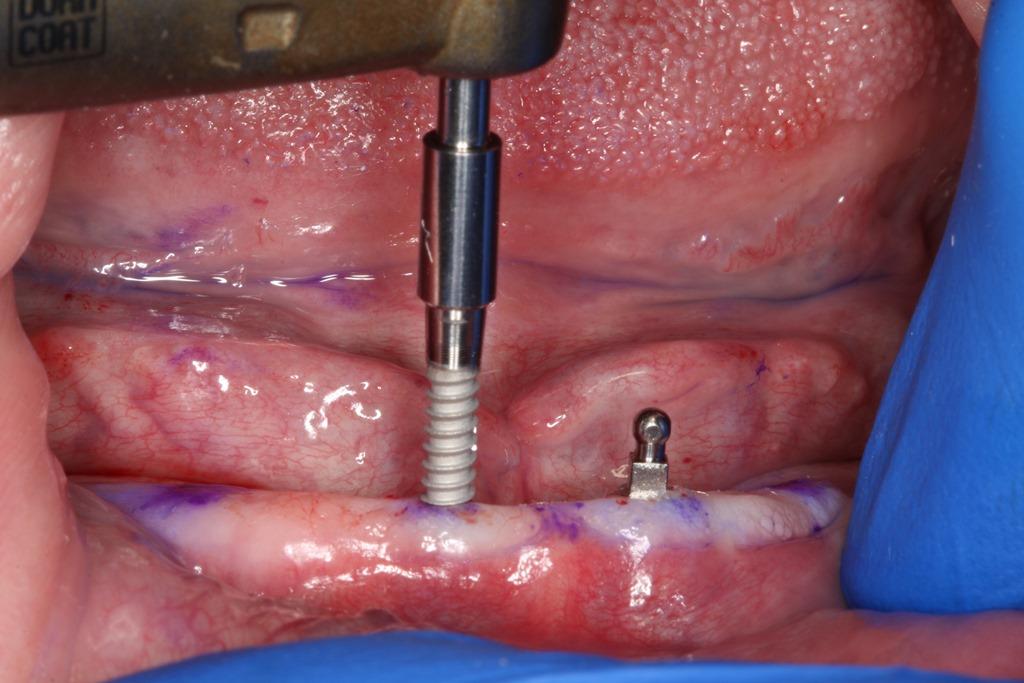
Фото 7. Определение первичной стабильности посредством динамометрического ключа (в данной ситуации большей 40 Нсм).
Окончательный уровень установки интраоссальной конструкции достигается, когда все витки резьбы имплантата находятся ниже или же на уровне имеющейся высоты костной ткани. В случаях безлоскутных операций на этапе установки всегда нужно уточнять толщину покрывающей слизистой с использованием пародонтологического зонда. Окончательного продвижения конструкции на нужную глубину можно достичь при помощи динамометрического ключа, которым заодно можно проверить и первичную стабильность установленных титановых опор, в данном случае она составляла более 40 Нсм (фото 7). Окончательную позицию имплантата определяли как в ходе клинического осмотра, так и с помощью прицельной рентгенограммы (фото 8 и 9). Пациенту были предоставлены необходимые послеоперационные инструкции, а, учитывая, что он уже принимал опиаты для купирования хронических болей, никаких дополнительных анальгетиков уже не назначали. Отдельно был выписан рецепт на упаковку азитромицина 250 мг, а повторный визит для изготовления протетических супраконструкций назначили ровно через две недели.
Фото 8. Вид имплантатов после установки.
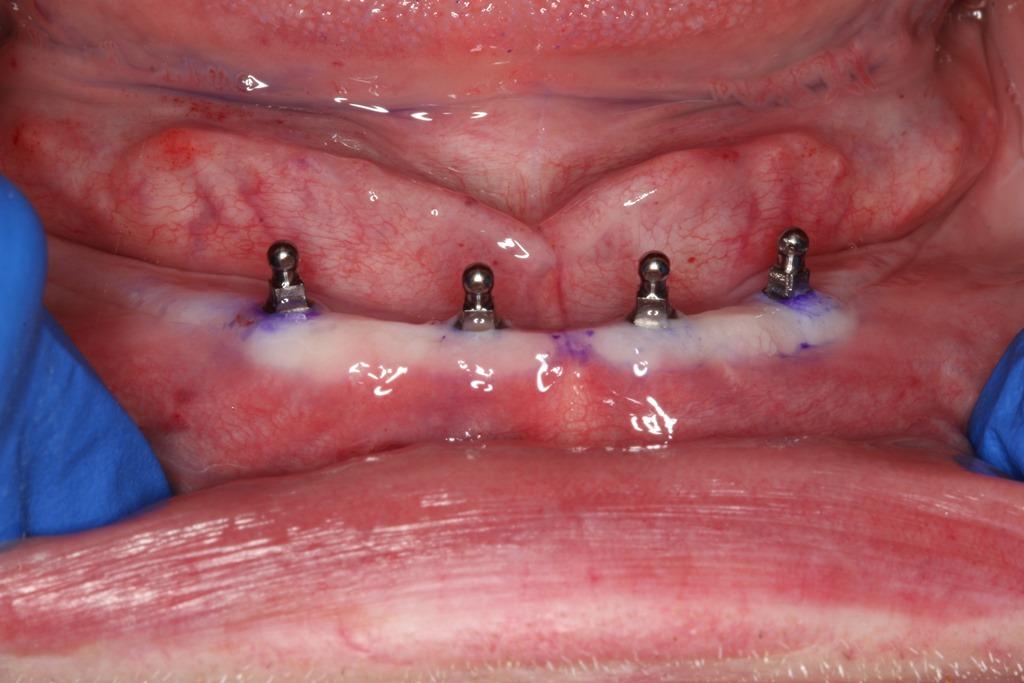
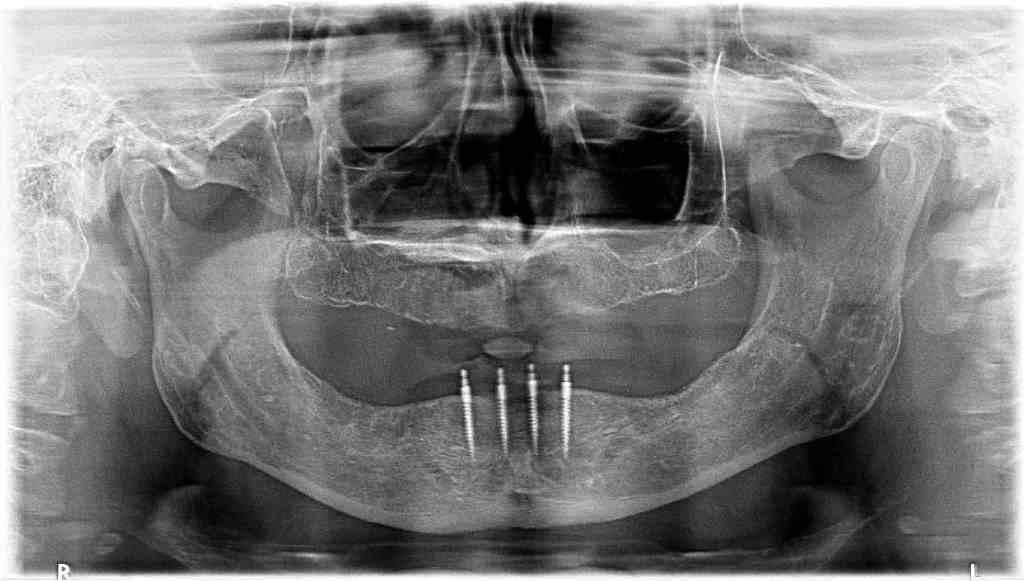
Фото 9. Ортопантомограмма сразу после установки титановых опор.
Ортопедическая фаза
Изготовление протеза с опорой на мини-имплантаты, в общем, ничем особо не отличается от изготовления обычного съемного протеза.
После установки имплантатов были получены окончательные оттиски по двухэтапной технике. В качестве базы использовали А-силикон, а по полученному оттиску проверяли качество проснятия протезного ложа и областей прикрепления мышц. После этого с помощью корригирующей базы проводили детализацию необходимых и клинически важных участков челюсти (фото 10). Использование слепочных трансферов было противопоказано; лаборатория проводила установку аналогов в соответствующих полостях оттиска еще до отливки окончательной модели (фото 11).
Фото 10. Вид окончательного оттиска, полученного при помощи А-силикона.
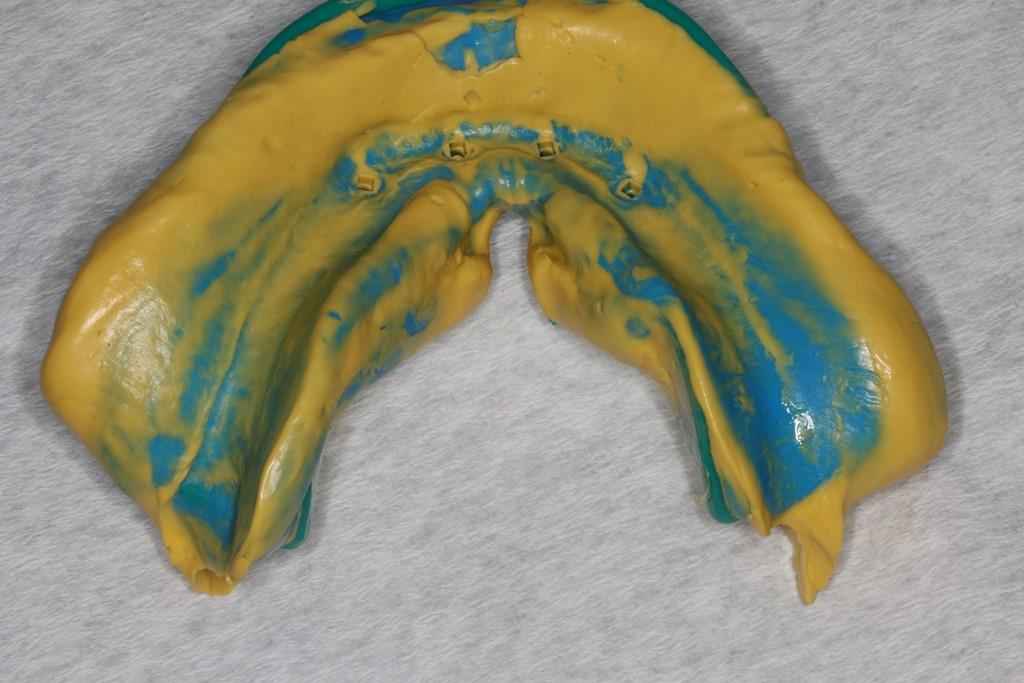
Фото 11. Отверстия в оттиске, сформированные супрадесневой частью имплантатов. Аналоги в лаборатории будут устанавливаться именно по данным отверстиям.
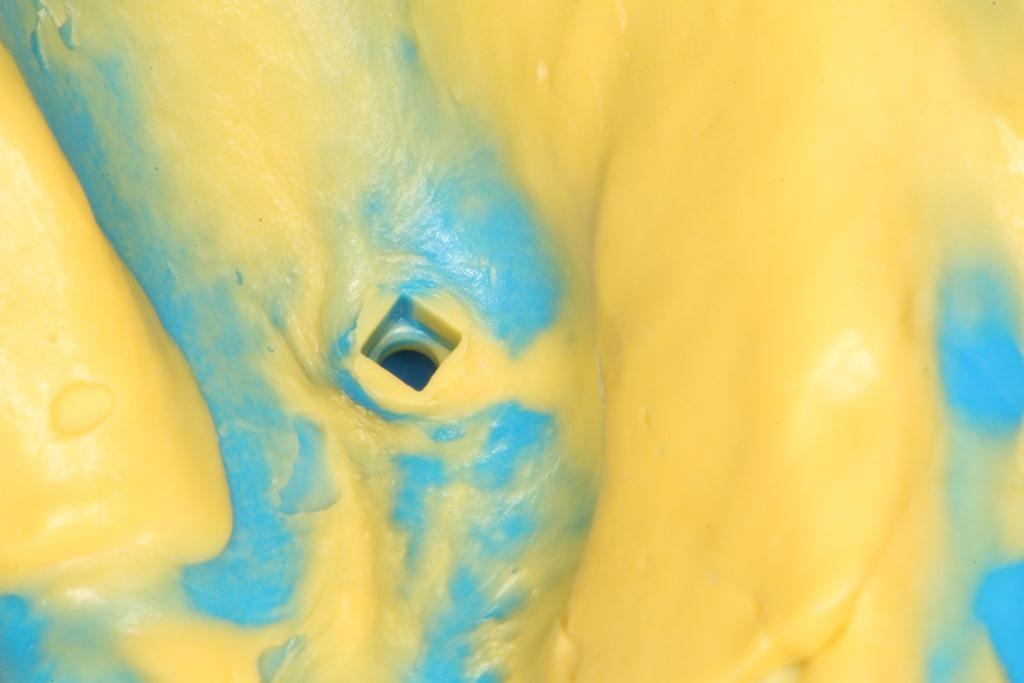
Для комфорта пациента между двумя основными визитами на шаровидные части имплантатов были установлены эластичные уплотнительные кольца. Для обеспечения необходимой прочности и жесткости акрилового протеза была изготовлена поддерживающая кобальт-хромовая рамка, при этом в ходе производства супраконструкции в ее состав сразу были имплементированы «мамки» аттачменов, которые в дальнейшем зафиксировали на имплантате. Для регистрации межчелюстных соотношений использовали восковые валики. Комплексный подход к формированию окончательной конструкции протеза помог добиться его успешной стабильности как на этапах примерки, так и в перспективе долгосрочного использования (фото 12 и 13). Через 6 недель после операции был достигнут оптимальный уровень заживления тканей вокруг имплантатов (фото 14), после чего врач приступил к припасовке протетической супраконструкции (фото 15). Коррекцию протеза проводили по мере необходимости.
Фото 12. Внутренняя поверхность протеза, укрепленная металлической рамкой и аттачменами.
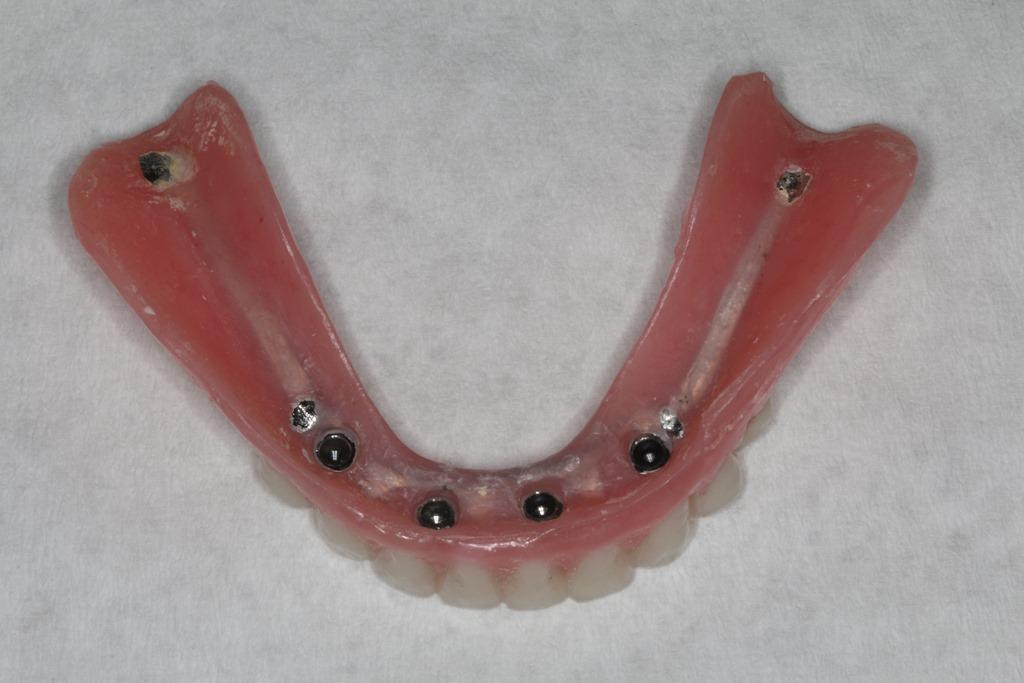
Фото 13. Окончательные конструкции, одобренные пациентом.
Фото 14. Вид через 6 недель после операции: здоровый вид окружающих тканей вокруг имплантатов.
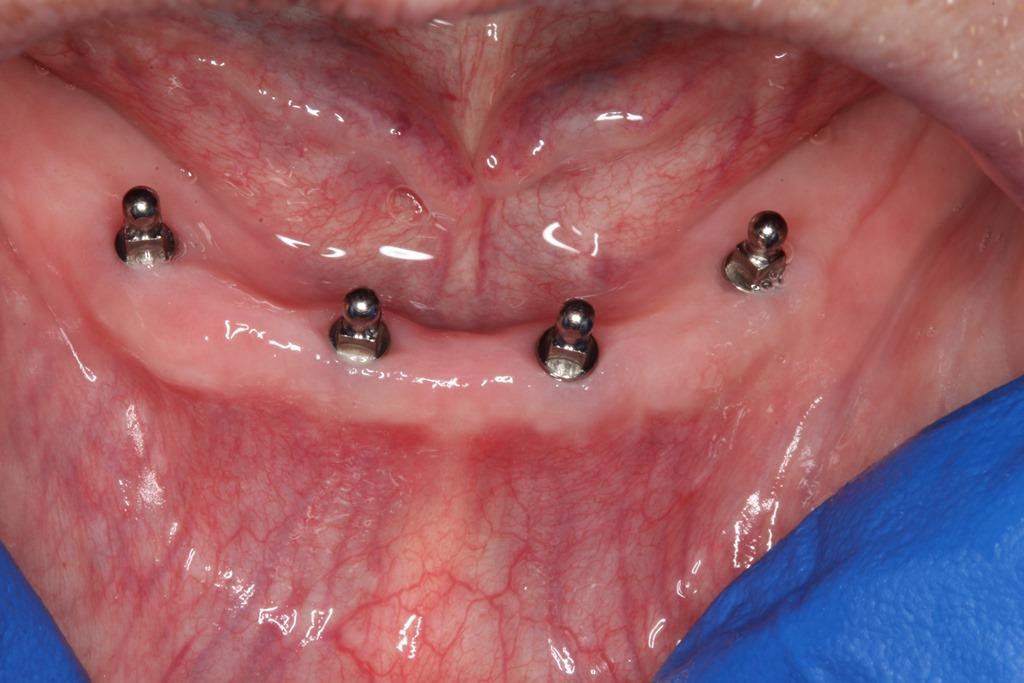
Фото 15. Вид протеза с опорой на мини-имплантаты в ротовой полости.
Повторные визиты
Протокол последующих визитов был адаптирован к особенностям реабилитации пациентов с помощью съемных конструкций с опорами на мини-имплантатах. Сначала пациент пришел на повторный осмотр через 2 недели для проверки заживления тканей в области имплантатов, в ходе этого же визита была зафиксирована протетическая супраконструкция. Следующий визит был назначен через месяц для проверки функционирования протеза. Дополнительный визит был назначен еще через 3 месяца после имплантации для верификации костной ткани в области опор после фиксации супраэлементов. Каждый год рекомендуется проверять состояние имплантатов при помощи рентгенограмм, а замену уплотнительных колец проводить каждые 6-12 месяцев.
Выводы
Возможность фиксации полного съемного протеза на мини-имплантаты следует учитывать всякий раз при реабилитации пациентов с полной адентией нижней челюсти. Подобный подход имеет свои специфические показания, которые касаются больных с дефицитом поддерживающей костной ткани, необходимости проведения микроинвазивного вмешательства или снижения общей стоимости лечения с повышением параметров качества жизни данной группы стоматологических пациентов.
Авторы:
Benjamin D. Oppenheimer, DDS
Benjamin E. Hauer, DDS
Адаптация полных съемных протезов, используемых с целью реабилитации беззубых пациентов, является затруднительной задачей как для врача-стоматолога, так и для самого пациента, нуждающегося в лечении.

С учетом всего вышеперечисленного, можно резюмировать, что новые стандарты использования полных съемных конструкций сводятся к использованию имплантатов в качестве поддерживающих опор, которые, в свою очередь, помогают решить сразу несколько клинически важных проблем у пациентов с полной адентией.
Полные протезы с опорой на имплантаты в области нижней челюсти могут отличаться в зависимости от количества используемых имплантатов, а также типа соединения, используемого в области интерфейса супра- и инфраконструкций. Применение двух "стандартных" (ширина > 3,3 мм) эндооссальных опор, установленных в области между ментальными отверстиями с эластичным типом соединения считается тем самым минимальным стандартом вмешательства, которое, по возможности, рекомендуется обеспечить для большинства беззубых пациентов.
Подобный подход помогает значительно улучшить общий показатель качества жизни данной группы стоматологических пациентов, страдающих полной адентией нижней челюсти. Но установка имплантатов стандартного диаметра в 3,3 мм или даже немного более широких опор сама по себе может быть весьма затруднительной задачей с учетом возможной объемной редукции костной ткани резидуального гребня. В подобных случаях без проведения дополнительной процедуры костной аугментации попросту не обойтись. С другой стороны, подобное вмешательство значительно увеличивает финансовые затраты на лечение, и является основной причиной отказа большинства пациентов от подобного лечебного алгоритма.
Использование имплантатов меньшого диаметра (2,7-3,3 мм) или так называемых "мини-имплантатов" (диаметром 1,8-2,4 мм) в качестве опор под полные съемные конструкции является достаточно эффективной альтернативой для обеспечения прогнозируемых результатов ортопедического лечения.
В недавнем исследовании было доказано, что установка двух мини-имплантатов в качестве опоры съемного протеза, помогла значительно улучшить показатель качества жизни пациента по сравнению с использованием с той же целью инфраконструкций обычного диаметра. В свою очередь, установка сразу четырех мини-имплантатов обеспечила еще лучшие результаты реабилитации по сравнению с обоими вышеупомянутыми подходами. Уровень выживаемости титановых опор составлял 89%, 82% и 99% для походов с использованием четырех мини-имплантатов, двух мини-имплантатов и двух стандартных имплантатов соответственно. В случаях с мини-имплантатами не использовались жесткие конструкции балок, соединяющие имплантаты, а возможности их установки, по своей сути, не ограничивались имеющимися параметрами кости. В зависимости от производителя мини-имплантатов, особенности их текстуры, профиля резьбы, ширины и длины могут изменяться, что практически никак не влияет на достаточно высокий доказуемый уровень успешности их использования в качестве опор. Исходя из результатов гистологического исследования экстрагированных имплантатов диаметром 1,8 мм, был доказан факт их остеоинтеграции даже при дефицитных параметрах резидуального гребня или в условиях атрофии кости без необходимости проведения дополнительной процедуры твердотканной аугментации. Согласно имеющимся ретроспективным данным, которые являются несколько ограниченными, показатели выживаемости мини-имплантатов, используемых в качестве опор под фиксированные и съемные протетические конструкции, превышает 90%. В случаях достижения адекватных параметров первичной стабильности немедленная и ранняя нагрузка мини-имплантатов характеризируется 91,7% и 96,7% успешностью их функционирования соответственно. Нюанс подобного терапевтического подхода состоит в необходимости замены ретенционных колец в области «мамки» атачмена, которые истираются во время функционирования. Во всех других аспектах лечение с помощью мини-имплантатов ничем не отличается от такового при использовании их аналогов стандартного диаметра.
В общем возможности проведения имплантологического лечения у большинства пациентов значительно ограничены. В среднем только 1,7% пациентов с полной адентией во всем мире были реабилитированы при помощи внутрикостных титановых опор. Однако, следует отметить, что, учитывая более низкую стоимость лечения с использованием мини-имплантатов, а также минимально инвазивный характер вмешательства, подобный комплексный подход может приобрести значительную популярность как среди врачей-стоматологов, так и среди их пациентов. Кроме того, растущее число доказательных фактов и многочисленные, хоть и положительные краткосрочные результаты подобного алгоритма лечения, должны мотивировать стоматологов к более широкому применению мини-имплантатов среди пациентов, требующих реабилитации при полной адентии нижней челюсти.
Клинический случай
62-летний мужчина обратился за стоматологической помощью с целью замены его старых полных съемных протезов. Он признался, что долгое время не пользовался своими старыми протезами, которые были изготовлены 6 лет назад сразу же после экстракции всех оставшихся у него зубов. По словам пациента, удаление зубов имело последовательный характер, поскольку он попросту пренебрегал своим стоматологическим здоровьем. Также он жаловался на свои старые протезы, которые удерживались во рту ненадлежащим образом, компрометируя функцию жеванию и провоцируя болезненные ощущения. В ходе первого визита он также сообщил, что узнал о возможности ретенции съемных конструкций при помощи имплантатов из телевизионной рекламы, поэтому решил уточнить у стоматолога, насколько дорогой и инвазивной является данная манипуляция.
Согласно классификации Американского сообщества Анестезиологов, исходя из критерия физического состояния, пациента можно было отнести к 3 классу, что обозначает, что у него имеется тяжелое системное заболевание. В анамнезе у него наблюдалась гипертония, в 2014 году - "незначительные" нарушения мозгового кровообращения (инсульт), хроническая боль из-за травмы спины, нарушения опорно-двигательного аппарата и генерализированное ощущение тревоги. Все вышеперечисленные заболевания корригировались при помощи медикаментов. В середине 1970-х годов пациенту проводили частичную замену коленного сустава, на данный момент у него также была зарегистрирована аллергия на пенициллин. Антикоагулянтов по причине наличия инсульта в анамнезе пациент не принимал. Также ранее мужчина злоупотреблял алкоголем и много курил, но, даже учитывая все вышеперечисленные факторы, у больного не было обнаружено абсолютных противопоказаний к проведению процедуры дентальной имплантации.
Системное состояние пациента было хорошо контролируемым, однако для минимизации инвазивности процедуры и снижения ее послеоперационной болезненности классический хирургический алгоритм лечения нуждался в незначительной модификации. Пациенту было предложено несколько подходов к реабилитации с информированием о всех потенциальных рисках каждого из них. Он согласился на алгоритм лечения, предполагающий изготовление нового полного съемного протеза на верхнюю челюсть и аналогичной конструкции на нижнюю челюсть, но с соответствующей ее поддержкой четырьмя мини-имплантатами с шаровидным типом соединения. Среди других вариантов также рассматривались подходы, предполагающие изготовление классических съемных протезов на обе челюсти, имплантацию на обеих челюстях с разными типами и дизайнами инфраконстуркций, а также использование несъемного протеза с опорой на имплантатах. Учитывая, что объем костной ткани был достаточным, пациент был проинформирован о возможности проведения классического протокола имплантации. Но с учетом стоимости и инвазивности процедуры, а также сроков лечения, больной остановился на варианте реабилитации посредством конструкций мини-имплантатов. Оперативное вмешательство было запланировано через 1 неделю после первичной консультации. Пациент не изъявил желания продолжать пользоваться своими старыми протезами до того, как будут изготовлены новые супраконструкции. Предполагалось, что часть установленных имплантатов, которая будет находиться над областью десен, будет соединяться с частью аттачмена в структуре протеза посредством шаровидного утолщения. Использование хирургического шаблона не было показано для данного случая, но при необходимости могло быть имплементировано без каких-либо проблем.
Предоперационная визуализация и оценка
В ходе первичного консультационного визита была получена ортопантомограмма пациента, на которой удалось подтвердить отсутствие каких-либо сопутствующих патологий в области беззубых верхней и нижней челюстей. Уровень костной ткани был достаточным для проведения дентальной имплантации. Передняя часть нижней челюсти должным образом являлась подходящим участком для установки четырех мини-имплантатов. Таким образом, ортопантомография являлась скрининговым методом диагностики, помогающим определить предварительный план лечения уже в ходе первичного визита пациента. Поскольку Американская академия стоматологической и челюстно-лицевой радиологии рекомендует планировать имплантологическое лечение, исходя из результатов КТ-диагностики, в данном клиническом случае мы проводили КЛКТ-сканирование переднего участка нижней челюсти для дальнейшего уточнения хирургического этапа. Подобный подход помогает точно установить позицию ментального отверстия, а также петли ментального нерва (фото 1), с учетом всех возможных анатомических вариаций.
Фото 1. КЛКТ-снимок нижней челюсти с запланированными имплантатами.

Учитывая параметры костной ткани, было решено проводить установку имплантатов диаметром 2,4 мм и длиной 13 мм. Положение двух имплантатов несколько дистально позволило бы обеспечить достаточную прочность конструкции и спозиционировать их при этом максимально удаленно от двух передних интраоссальных опор. Кроме того, увеличение переднезаднего расстояния между имплантатами позволяет исключить необходимость формирования консольных частей протеза, которые являются слабым звеном во время функциональной нагрузки. В ходе оценки мягких тканей также не было обнаружено никаких сопутствующих патологий, прикрепление мышц и уздечек также было в норме. В области гребня нижней челюсти была обнаружена кератинизированная часть слизистой, которая идеально подходила для установки имплантологических конструкций, однако не являлась обязательным клиническим аспектом для достижения успешных результатов реабилитации.
Хирургический этап
После обеспечения стерильности операционного поля была подтверждена позиция ментального отверстия путем пальпации передней части нижней челюсти. Процедуру проводили в соответствии с анализом результатов КЛКТ-сканирования. При необходимости большей детализации можно использовать рентгенологические маркеры, в роли которых часто используются имеющиеся протезы пациентов. Для удержания оптимального 3-милимметрового расстояния между имплантатами был использован хирургический маркер (фото 2).
Фото 2. Вид нижней челюсти для маркеров установки имплантатов.

После уточнения позиции ментального нерва с целью профилактики образования подслизистой гематомы приступили к выполнению процедуры инфильтрационной анестезии. Для минимизации действия адреналина на организм пациента были предприняты соответствующие меры. Для выполнения остеотомии и перфорации слизистой использовали хирургический наконечник, которым обеспечили формирование трансмукозного доступа к кости (безлоскутная операция). В отдельных случаях, когда необходимо визуализировать структуру костной ткани, может понадобиться проведение сепарации слизисто-накостничного лоскута, но в данной ситуации такой потребности не было. Остеотомию проводили спиральным сверлом 1,2 мм в диаметре со скоростью 1200 оборотов в минуту на глубину 10 мм (фото 3), что было продиктовано конструкционными параметрами выбранных интраоссальных опор.
Фото 3. Проведение безлоскутной операции: остеотомия сверлом 1,2 мм в диаметре на 10 мм вглубь на скорости 1200 оборотов в минуту при достаточной ирригации. Морфология гребня была достаточной для адекватного проведения остеотомии.

При достаточном клиническом опыте удается провести остеотомию, не перфорируя ни щечную, ни язычную кортикальные пластинки. Подобного мастерства удается достичь, учитывая ангуляцию костного гребня на разных топографических участках. Кроме того, очень важно правильно сынтерпретировать полученные результаты КЛКТ-сканирования, которые играют основную роль в процессе детализирующей диагностики особенностей морфологии костной ткани. Если риск перфорации маргинальных костных пластинок достаточно велик, лучше использовать направляющий хирургический шаблон, предварительно обеспечив сепарацию полного лоскута. Для проверки параллельности участков препарирования часто используют направляющие штифты или же имплантаты, которые устанавливают лишь частично.
Имплантат был удален из стерильной упаковки (фото 4) и установлен в область остеотомии при помощи ручного рифленого ключа (фото 5). С этой же целью можно использовать хирургический наконечник, установленный на 50 оборотов в минуту при торке 30 Нсм (фото 6). Благодаря резьбе, имплантат продвигается вглубь отпрепарированного участка кости, а для того чтобы обеспечить более высокие показатели торка можно использовать Т-образный или реверсивный ключи (фото 7).
Фото 4. Ручной рифленый ключ для переноса имплантата из стерильной упаковки в область остеотомии.

Фото 5. Большего торка можно достичь при помощи Т-образного ключа.

Фото 6. Установку имплантата также можно провести при помощи наконечника и адаптера.

Фото 7. Определение первичной стабильности посредством динамометрического ключа (в данной ситуации большей 40 Нсм).

Окончательный уровень установки интраоссальной конструкции достигается, когда все витки резьбы имплантата находятся ниже или же на уровне имеющейся высоты костной ткани. В случаях безлоскутных операций на этапе установки всегда нужно уточнять толщину покрывающей слизистой с использованием пародонтологического зонда. Окончательного продвижения конструкции на нужную глубину можно достичь при помощи динамометрического ключа, которым заодно можно проверить и первичную стабильность установленных титановых опор, в данном случае она составляла более 40 Нсм (фото 7). Окончательную позицию имплантата определяли как в ходе клинического осмотра, так и с помощью прицельной рентгенограммы (фото 8 и 9). Пациенту были предоставлены необходимые послеоперационные инструкции, а, учитывая, что он уже принимал опиаты для купирования хронических болей, никаких дополнительных анальгетиков уже не назначали. Отдельно был выписан рецепт на упаковку азитромицина 250 мг, а повторный визит для изготовления протетических супраконструкций назначили ровно через две недели.
Фото 8. Вид имплантатов после установки.

Фото 9. Ортопантомограмма сразу после установки титановых опор.

Ортопедическая фаза
Изготовление протеза с опорой на мини-имплантаты, в общем, ничем особо не отличается от изготовления обычного съемного протеза.
После установки имплантатов были получены окончательные оттиски по двухэтапной технике. В качестве базы использовали А-силикон, а по полученному оттиску проверяли качество проснятия протезного ложа и областей прикрепления мышц. После этого с помощью корригирующей базы проводили детализацию необходимых и клинически важных участков челюсти (фото 10). Использование слепочных трансферов было противопоказано; лаборатория проводила установку аналогов в соответствующих полостях оттиска еще до отливки окончательной модели (фото 11).
Фото 10. Вид окончательного оттиска, полученного при помощи А-силикона.

Фото 11. Отверстия в оттиске, сформированные супрадесневой частью имплантатов. Аналоги в лаборатории будут устанавливаться именно по данным отверстиям.

Для комфорта пациента между двумя основными визитами на шаровидные части имплантатов были установлены эластичные уплотнительные кольца. Для обеспечения необходимой прочности и жесткости акрилового протеза была изготовлена поддерживающая кобальт-хромовая рамка, при этом в ходе производства супраконструкции в ее состав сразу были имплементированы «мамки» аттачменов, которые в дальнейшем зафиксировали на имплантате. Для регистрации межчелюстных соотношений использовали восковые валики. Комплексный подход к формированию окончательной конструкции протеза помог добиться его успешной стабильности как на этапах примерки, так и в перспективе долгосрочного использования (фото 12 и 13). Через 6 недель после операции был достигнут оптимальный уровень заживления тканей вокруг имплантатов (фото 14), после чего врач приступил к припасовке протетической супраконструкции (фото 15). Коррекцию протеза проводили по мере необходимости.
Фото 12. Внутренняя поверхность протеза, укрепленная металлической рамкой и аттачменами.

Фото 13. Окончательные конструкции, одобренные пациентом.

Фото 14. Вид через 6 недель после операции: здоровый вид окружающих тканей вокруг имплантатов.

Фото 15. Вид протеза с опорой на мини-имплантаты в ротовой полости.

Повторные визиты
Протокол последующих визитов был адаптирован к особенностям реабилитации пациентов с помощью съемных конструкций с опорами на мини-имплантатах. Сначала пациент пришел на повторный осмотр через 2 недели для проверки заживления тканей в области имплантатов, в ходе этого же визита была зафиксирована протетическая супраконструкция. Следующий визит был назначен через месяц для проверки функционирования протеза. Дополнительный визит был назначен еще через 3 месяца после имплантации для верификации костной ткани в области опор после фиксации супраэлементов. Каждый год рекомендуется проверять состояние имплантатов при помощи рентгенограмм, а замену уплотнительных колец проводить каждые 6-12 месяцев.
Выводы
Возможность фиксации полного съемного протеза на мини-имплантаты следует учитывать всякий раз при реабилитации пациентов с полной адентией нижней челюсти. Подобный подход имеет свои специфические показания, которые касаются больных с дефицитом поддерживающей костной ткани, необходимости проведения микроинвазивного вмешательства или снижения общей стоимости лечения с повышением параметров качества жизни данной группы стоматологических пациентов.
Авторы:
Benjamin D. Oppenheimer, DDS
Benjamin E. Hauer, DDS




























































































































































0 комментариев