Обследованы 36 человек (средний возраст — 42,0±2,1 года) с хроническим генерализованным пародонтитом (ХГП) легкой и средней степени; больные были распределены на 2 группы в зависимости от метода лечения:
1-я (18 человек) — базисная терапия, с использованием традиционного комплекса общих и местных мер;
2-я (18 человек) — базисная и фототерапия (инфракрасный лазерный свет);
группу сравнения составили 10 человек — с интактным пародонтом.
Контроль эффективности лечения больных ХГП осуществляли, определяя локальный цитокиновый профиль (ИЛ-1β, ИЛ-1ra, ИЛ-6, ИЛ-10, фактор некроза опухолей-α — ФНО-α, остеопрогерина (ОПГ) и лиганда рецептора, активир. фактор транскрипции ядерного фактора — кВ. У больных ХГП в пародонтальном комплексе наблюдался выраженный воспалительный процесс, о чем свидетельствовала повышенная концентрация провоспалительных цитокинов ФНО-α, ИЛ-1β и ИЛ-6; уровень остеопрогерина (ОПГ) у них оказался сниженным относительно показателя группы сравнения, а RANKL — достоверно повышен. После соответствующей терапии ХГП у больных обеих основных групп произошло снижение концентрации цитокинов ФНО-α и ИЛ-6; уровень ИЛ-1β не изменился. Что касается цитокина RANKL у больных 2-й группы, то значения его достоверно снизились — в 6,7 раза — относительно соответствующего параметра до лечения.
По данным ВОЗ (1995), патология тканей пародонта занимает 2-е место в структуре стоматологической заболеваемости и является главной причиной преждевременной потери зубов. Xронический генерализованный пародонтит (ХГП) развивается под влиянием местных и общих факторов; ведущим этиологическим фактором является бактериальный. При попадании микробов из зубной бляшки в ткани пародонтального комплекса запускается ряд иммунных механизмов. Известно, что у больных ХГП в тканях пародонта увеличивается количество нейтрофильных лейкоцитов (что обычно нехарактерно для хронического течения воспалительного процесса), но их функциональная активность относительно невысока. В настоящее время установлена важная роль про- и противовоспалительных цитокинов в регуляции воспаления в пародонтальном комплексе. Однако взаимосвязи между клинико-морфологическими показателями и медиаторами воспалительно-деструктивного процесса в пародонте изучены недостаточно.
Традиционные методы лечения ХГП, направленные на устранение микробного фактора, не всегда достаточно
эффективны, о чем свидетельствует хронический характер заболевания с периодическими обострениями. Особое внимание исследователей привлекают физические методы воздействия на ткани пародонтита, в частности различные виды лазерного излучения. Широкое применение при лечении воспалительных заболеваний пародонта получил низкоинтенсивный лазерный свет благодаря его уникальным физическим и биологическим свойствам. Важное достоинство этого бесконтактного метода воздействия на биологические ткани — высокая проникающая способность. Исходя из вышесказанного, представляются актуальными дальнейшее исследование молекулярных механизмов местного иммунитета при хроническом пародонтите и оценка на этой основе эффективности его лечения.
Цель работы состояла в оценке эффективности фототерапии ХГП с помощью локального цитокинового профиля.
Материал и методы
Под наблюдением находились 36 человек с ХГП легкой и средней степени без соматической патологии в возрасте 20—53 лет (средний возраст — 42,0±2,1 года), в том числе 25 (69,5%) женщин и 11 (30,5%) мужчин. Диагностику заболеваний пародонта проводили по данным клинических и рентгенологических исследований в соответствии с классификацией, принятой XVI Пленумом правления Всесоюзного научного общества стоматологов (1983) и дополненной Президиумом секции пародонтологии Академии стоматологии (2001).
Для выявления воспаления десны применяли пробу Шиллера—Писарева; состояние тканей пародонта определяли, используя индекс PMA (Parma, 1960); интенсивность поражения пародонтального комплекса оценивали по пародонтальному индексу — ПИ. Глубину пародонтальных карманов (ПК) измеряли со всех сторон зуба с помощью градуированного зонда, фиксируя наибольшую ее величину (Т.В. Никитина, В.С. Иванов, 1989). Степень подвижности зубов оценивали, используя пинцет (Никитина, 1982; Данилевский и соавт., 1993); гигиеническое состояние полости рта квалифицировали, применяя количественный гигиенический индекс — ГИ (Федоров, Володкина, 1971). У всех пациентов определяли состояние сосудов пародонта методом дозированного вакуума по В.И. Кулаженко (1967). Состояние костной ткани межзубных перегородок оценивали по данным внутриротовой рентгенографии (В.С. Иванов, 1989; Н.Ф. Данилевский и соавт., 1993).
Больные ХГП были распределены в зависимости от метода лечения на 2 группы, сопоставимые по полу, возрасту, клиническим проявлениям воспалительно-дистрофического процесса в пародонтальном комплексе. Больные 1-й группы (18 человек) получали базисную терапию, предусматривавшую комплекс общих и местных мер. Так, общее лечение состояло из рекомендаций по диетическому питанию и витаминотерапии (поливитамины «Центрум» в течение 2 мес). Местное лечение начинали с профессиональной гигиены и санации полости рта. Одновременно пациентов обучали методам рациональной индивидуальной гигиены с последующим контролем при каждом посещении. В дальнейшем проводили медикаментозную терапию с целью ликвидации воспаления в десне, устранения нарушений микроциркуляции и гипоксии, приостановления процесса деструкции кости, повышения регенераторной способности тканей пародонта. Комплексная противовоспалительная терапия состояла: в инфузии ПК растворами 0,05% хлоргексидина и 0,01% мирамистина; наложении пародонтальных повязок: с аспириновой мазью (Россия), с 25% гелем Metrogyl Denta («Unic Pharmasutical», Индия), с пастами Cupral («Humanchemie», Германия) и Iodo-glycol («Neo Dental», Япония). Наряду с этим применяли пленки Диплен-дента, в состав которых входят хлоргексидин и солкосерил. Для укрепления сосудистой стенки выполняли инъекции 5% раствора аскорбиновой кислоты; курс — 5 процедур. После снятия явлений воспаления осуществляли вакуум-терапию по В.И. Кулаженко; курс — 5 процедур.
Во 2-й группе (18 человек) пациенты получали базисную и фототерапию — инфракрасный лазерный свет (ИЛС) аппарата Оптодан, генерирующий световой поток в импульсном режиме (длина волны — 0,85—0,89 мкм). Методика предусматривала применение ИЛС сканирующим способом по квадрантам челюстей: вначале с использованием на 1-м канале противовоспалительных параметров (80—100 Гц; 1,5—1,8 Вт; 2 мин), затем — на 2-м канале — стимулирующих (1,5—2,0 кГц; 0,3—0,5 Вт; 1 мин). Процедуры ежедневные, на курс — 5 процедур.
Группу сравнения составили 10 человек (средний возраст — 31,0±0,1 года) с интактным пародонтом, обратившихся для профилактического осмотра.
Контроль эффективности лечения осуществляли по локальному цитокиновому профилю. Материалом для исследования цитокинов служила жидкость пародонтальных карманов — ПК (ЖПК), для забора которой применяли оригинальную методику, разработанную в лаборатории Института экологии и генетики микроорганизмов УрО РАН. В работе использованы: тест-системы ООО «Цитокин» (Санкт-Петербург) для определения ИЛ-1β, ИЛ-1ra, ИЛ-6, ИЛ-10 и факторы некроза опухолей-α (ФНО-α); наборы «Biomedica Medizinprodukte GmbH & Co KG» (Австрия) — для определения остеопрогерина (ОПГ) и лиганда рецептора, актив. фактор транскрипции ядерного фактора — кВ (RANK-лиганд).
При статистической обработке цифрового материала рассчитывали средние арифметические величины (М) и
их ошибки (m). Для оценки достоверности различий между средними величинами использовали t-критерий Стьюдента. Дополнительно для установления различий по частотам применяли метод четырехпольных таблиц с определением достоверности точным методом Фишера. Влияние различных факторов на изменение цитокинового профиля оценивали методом дисперсионного анализа. Для выявления у больных ХГП взаимосвязей между изменениями концентраций цитокинов в ЖПК и клиническими показателями тяжести заболевания до и после лечения был проведен корреляционный анализ с расчетом коэффициента Пирсона. Статистическую обработку данных проводили с помощью компьютерных программ Excel 2000 (Microsoft Inc., 1999) и Statistica for Windows, v. 5.0 (Stat Soft Inc., 1995).
Результаты и обсуждение
При оценке стоматологического статуса у больных ХГП ортогнатический прикус диагностирован в 86,1% случаев (у 31 человека), глубокий — в 13,9% случаев (у 5 человек). Показатель интенсивности кариеса зубов (индекс КПУ) колебался в диапазоне от 5 до 23 (среднее значение — 12,75±1,04). Уровень гигиены полости рта оценивали либо как «неудовлетворительный» (22,2% — 8 человек), либо как «плохой» (77,8% — 28 человек). Среднее значение индекса PMA составило: в 1-й группе — 62,53±0,07%, во 2-й группе 59,68±1,17%; ПИ соответственно 3,30±0,16 и 3,29±0,14; глубина ПК — 3,87±0,10 и 4,04±0,13 мм. Приведенные данные свидетельствуют о выраженных воспалительно-деструктивных изменениях в пародонте у больных ХГП, что подтверждалось рентгенологическими критериями, характерными для пародонтита легкой и средней степени. Пародонтальный статус в группе сравнения соответствовал характеристикам клинически интактного пародонта, в частности ПИ и PMA были нулевыми.
При исследовании концентрации провоспалительных цитокинов в ЖПК у больных ХГП выявлены следующие закономерности: содержание ФНО-α было повышено в 3,8 раза, а ИЛ-1β — в 4,8 раза относительно соответствующего параметра в группе сравнения. ИЛ-6 в десневой жидкости обнаружен лишь у 20% пациентов со здоровым пародонтом; у больных ХГП частота выявления этого цитокина была в 3 раза выше (61%) — табл. 1.
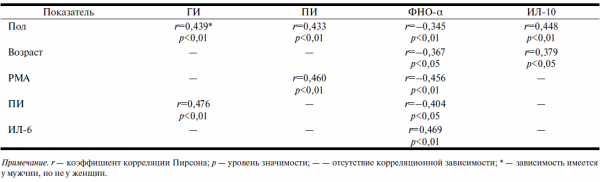
Таблица 1. Показатели корреляционного анализа у больных ХГП до лечения
Таким образом, полученные данные позволяют заключить, что у больных ХГП выражен воспалительный процесс в пародонтальном комплексе, о чем свидетельствует повышенная концентрация провоспалительных цитокинов ФНО-α, ИЛ-1β и ИЛ-6.
Что касается концентрации противовоспалительных цитокинов в ЖПК у больных ХГП, то исследование дало следующие результаты. Уровень ИЛ-1ra существенно (в 2,75 раза) и достоверно превышал аналогичный показатель у здоровых субъектов, что свидетельствует о развитии в тканях пародонтального комплекса компенсаторных реакций, направленных на подавление воспалительного процесса. Однако содержание ИЛ-10 у пациентов с ХГП было ниже, чем у людей с интактным пародонтом (табл. 2).
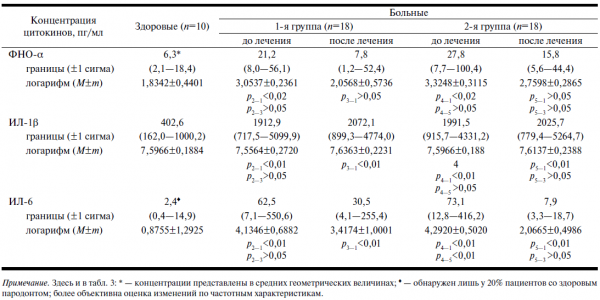
Таблица 2. Содержание провоспалительных цитокинов в ЖПК у больных ХГП
Исследование концентрации ОПГ и RANK-лиганда в ЖПК у больных ХГП показало, что уровень ОПГ у них был ниже, чем в группе сравнения, а уровень RANKL — наоборот, достоверно выше (рис. 1). Известно, что ОПГ связывается с RANK-лиганда и блокирует его взаимодействие с RANK, подавляя тем самым стимуляцию остеокластов. Полученные данные позволяют предположить, что низкий уровень ОПГ в ЖПК у больных пародонтитом обеспечивает условия для активации костных макрофагов и способствует резорбции костной ткани альвеолярных отростков челюстей.
Рис. 1. Уровень OPG и RANKL в ЖПК в группах наблюдений.
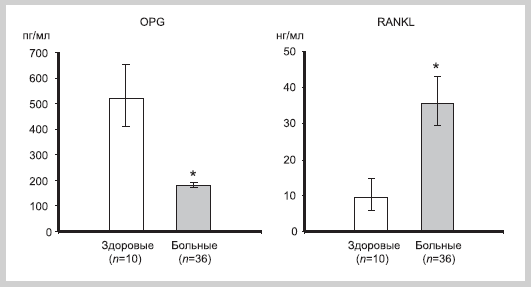
По оси абсцисс — группы обследованных; по оси ординат — концентрация OPG и RANKL; * — достоверность различий между группами (p<0,05).
У больных ХГП до лечения обнаружена зависимость между полом и значениями пародонтологических индексов. Так, у мужчин ГИ и ПИ были выше, чем у женщин (см. табл. 1). Установленную закономерность можно объяснить тем, что мужчины, как правило, уделяют меньше внимания гигиене полости рта (кратность и время чистки зубов), чем женщины, больше курят, что оказывает дополнительное негативное влияние на состояние тканей пародонтального комплекса. Выявлена также отрицательная корреляционная зависимость между возрастом больных ХГП и концентрацией в ЖПК провоспалительного цитокина ФНО-α. Наличие такой взаимосвязи может отражать сниженную реакцию на внедрение инфекционного агента, недостаточную эффективность формируемых иммунных механизмов и, как следствие, — развитие хронического воспалительно-деструктивного процесса. Одновременно корреляционный анализ выявил у больных ХГП обратную зависимость между концентрацией ФНО-α и индексами, отражающими степень поражения пародонта (PMA, ПИ) — см. табл. 1. Установленный факт свидетельствует о том, что при пародонтите ФНО-α выступает как защитный фактор, действие которого направлено на развитие эффективной воспалительной реакции в тканях пародонтального комплекса и устранение бактериального агента.
Помимо этого, выявлена прямая корреляционная зависимость между возрастом больных ГП и концентрацией
противовоспалительного цитокина ИЛ-10. По-видимому, на фоне возрастных изменений иммунной системы у
больных ХГП из-за высокого уровня ИЛ-10 в ЖПК не развивается полноценная воспалительная реакция, в связи с чем патологический процесс в пародонте приобретает хроническое течение.
Результаты лечения больных ХГП показали, что содержание провоспалительных цитокинов ФНО-α и ИЛ-1β в ЖПК находилось в прямой связи с индексом РМА. Установленная положительная корреляционная зависимость между этими показателями свидетельствует о том, что у больных ХГП нейтрофилы являются важным источником провоспалительных медиаторов ФНО-α и ИЛ-1β.
После курса комплексного лечения больных ХГП отмечены достоверные позитивные изменения по всем исследованным клиническим параметрам. Так, гигиеническое состояние полости рта в 1-й группе (базисная терапия) и 2-й группе (базисная терапия + ИЛС) оценено как «удовлетворительное»; пародонтальные индексы снизились соответственно: PMA — на 36,7 и 34,8%; ПИ — на 1,4 и 1,4; глубина ПК уменьшилась на 1,41 и 1,75 мм. Что же касается показателей цитокинового профиля в ЖПК у больных ХГП, то концентрация провоспалительного цитокина ФНО-α в 1-й группе уменьшилась в 2,7 раза, а во 2-й — в 1,7 раза (см. табл. 2). Содержание провоспалительного цитокина ИЛ-1β в ЖПК у больных ХГП как до, так и после лечения оказалось более чем в 4 раза выше, чем в группе сравнения. Использование точного метода Фишера позволило сделать следующее заключение: под влиянием базовой терапии частота определения провоспалительного цитокина ИЛ-6 в ЖПК у больных ХГП достоверно снизилась с 55,6 до 22,2% (p<0,05), а в случае базисной терапии + ИЛС — с 66,7 до 16,7% (p<0,01).
Таким образом, после соответствующей терапии ХГП у больных обеих групп произошло снижение в ЖПК уровня провоспалительных цитокинов ФНО-α и ИЛ-6; концентрация ИЛ-1β оставалась неизменной.
После курса комплексного лечения больных ХГП отмечено снижение содержания противовоспалительного
цитокина ИЛ-1ra: в 1-й группе — в 1,8 раза, во 2-й — в 2 раза (табл. 3). Что же касается противовоспалительного цитокина ИЛ-10, то повышение его уровня в ЖПК у больных обеих групп после лечения было статистически недостоверным.
Таблица 3. Содержание противовоспалительных цитокинов в ЖПК у больных ХГП
В результате терапии ХГП у пациентов произошло достоверное повышение концентрации ОПГ: в 1-й группе — в 2,1 раза, во 2-й — в 1,8 раза. После базисной терапии у больных ХГП снижение уровня RANK-лиганда в 2,5 раза относительно соответствующего показателя в контроле оказалось недостоверным. Уровень RANK-лиганда в ЖПК у больных ХГП, получавших базисную терапию + ИЛС, достоверно снизился — в 6,7 раза относительно соответствующего параметра до лечения (рис. 2).
Рис. 2. Содержание RANKL в ЖПК в группах наблюдений.
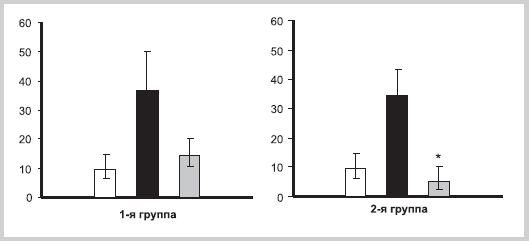
По оси абсцисс — группы обследованных; по оси ординат — концентрация RANKL (в нг/мл); белые столбцы — уровень RANKL у здоровых людей, черные — уровень RANKL у больных пародонтитом, серые столбцы — уровень RANKL у больных пародонтитом после лечения; * — достоверность различий между группой больных ХГП до лечения и группой этих больных после лечения.
Таким образом, по результатам исследования можно сделать вывод, что введение в комплексную терапию хронического пародонтита ИЛС позволяет более эффективно снизить содержание RANK-лиганда в ЖПК у таких больных.
Используемые стандартные статистические методы (например, тест Стьюдента) могут сравнить между собой только 2 выборки. В связи с этим был дополнительно проведен дисперсионный анализ, который позволил оценить воздействие сразу нескольких факторов на локальный цитокиновый профиль пациентов. В качестве таких факторов выделены: пародонтит, базисное лечение и роль ИЛС в этом комплексе (табл. 4).
Таблица 4. Роль вариантов лечения ХГП в изменении концентрации цитокинов ЖПК (факторный анализ)
Результаты многофакторного анализа в основном подтвердили изменения, установленные методом Стьюдента: зафиксированы статистически значимые эффекты пародонтита и влияние базисной терапии на изменение цитокинового профиля ЖПК. Факторный анализ показал также, что ИЛС существенно не меняет эффекты базисной терапии — это отражают пародонтальные индексы, а также концентрация про- и противовоспалительных цитокинов. Вместе с тем нами впервые обнаружено выраженное влияние ИЛС на локальные концентрации RANK-лиганда, что подтверждено как методом Стьюдента, так и более объективным дисперсионным анализом.
Итак, многофакторное исследование показало, что определение в жидкости ПК уровня про- и противовоспалительных цитокинов может служить контролем эффективности терапии больных ХГП. Включение ИЛС в лечебный комплекс у больных ХГП способствует эффективному снижению локальной концентрации уровня RANK-лиганда в ЖПК, что обосновывает применение этого физического фактора для уменьшения деструкции альвеолярных отростков челюстей. Низкоинтенсивный ИЛС у больных ХГП может быть использован как самостоятельно — в случаях, когда пациенту противопоказаны те или иные медикаменты из-за их непереносимости — так и в качестве потенцирующего физиотерапевтического средства.
Авторы: Д.м.н., проф. Л.А. Мозговая, к.м.н. Д.В. Шмидт, А.Ю. Новиков
Пермская государственная медицинская академия им. акад. Е.А. Вагнера Росздрава, Пермская краевая клиническая стоматологическая поликлиника
Обследованы 36 человек (средний возраст — 42,0±2,1 года) с хроническим генерализованным пародонтитом (ХГП) легкой и средней степени; больные были распределены на 2 группы в зависимости от метода лечения:
1-я (18 человек) — базисная терапия, с использованием традиционного комплекса общих и местных мер;
2-я (18 человек) — базисная и фототерапия (инфракрасный лазерный свет);
группу сравнения составили 10 человек — с интактным пародонтом.

Контроль эффективности лечения больных ХГП осуществляли, определяя локальный цитокиновый профиль (ИЛ-1β, ИЛ-1ra, ИЛ-6, ИЛ-10, фактор некроза опухолей-α — ФНО-α, остеопрогерина (ОПГ) и лиганда рецептора, активир. фактор транскрипции ядерного фактора — кВ. У больных ХГП в пародонтальном комплексе наблюдался выраженный воспалительный процесс, о чем свидетельствовала повышенная концентрация провоспалительных цитокинов ФНО-α, ИЛ-1β и ИЛ-6; уровень остеопрогерина (ОПГ) у них оказался сниженным относительно показателя группы сравнения, а RANKL — достоверно повышен. После соответствующей терапии ХГП у больных обеих основных групп произошло снижение концентрации цитокинов ФНО-α и ИЛ-6; уровень ИЛ-1β не изменился. Что касается цитокина RANKL у больных 2-й группы, то значения его достоверно снизились — в 6,7 раза — относительно соответствующего параметра до лечения.
По данным ВОЗ (1995), патология тканей пародонта занимает 2-е место в структуре стоматологической заболеваемости и является главной причиной преждевременной потери зубов. Xронический генерализованный пародонтит (ХГП) развивается под влиянием местных и общих факторов; ведущим этиологическим фактором является бактериальный. При попадании микробов из зубной бляшки в ткани пародонтального комплекса запускается ряд иммунных механизмов. Известно, что у больных ХГП в тканях пародонта увеличивается количество нейтрофильных лейкоцитов (что обычно нехарактерно для хронического течения воспалительного процесса), но их функциональная активность относительно невысока. В настоящее время установлена важная роль про- и противовоспалительных цитокинов в регуляции воспаления в пародонтальном комплексе. Однако взаимосвязи между клинико-морфологическими показателями и медиаторами воспалительно-деструктивного процесса в пародонте изучены недостаточно.
Традиционные методы лечения ХГП, направленные на устранение микробного фактора, не всегда достаточно
эффективны, о чем свидетельствует хронический характер заболевания с периодическими обострениями. Особое внимание исследователей привлекают физические методы воздействия на ткани пародонтита, в частности различные виды лазерного излучения. Широкое применение при лечении воспалительных заболеваний пародонта получил низкоинтенсивный лазерный свет благодаря его уникальным физическим и биологическим свойствам. Важное достоинство этого бесконтактного метода воздействия на биологические ткани — высокая проникающая способность. Исходя из вышесказанного, представляются актуальными дальнейшее исследование молекулярных механизмов местного иммунитета при хроническом пародонтите и оценка на этой основе эффективности его лечения.
Цель работы состояла в оценке эффективности фототерапии ХГП с помощью локального цитокинового профиля.
Материал и методы
Под наблюдением находились 36 человек с ХГП легкой и средней степени без соматической патологии в возрасте 20—53 лет (средний возраст — 42,0±2,1 года), в том числе 25 (69,5%) женщин и 11 (30,5%) мужчин. Диагностику заболеваний пародонта проводили по данным клинических и рентгенологических исследований в соответствии с классификацией, принятой XVI Пленумом правления Всесоюзного научного общества стоматологов (1983) и дополненной Президиумом секции пародонтологии Академии стоматологии (2001).
Для выявления воспаления десны применяли пробу Шиллера—Писарева; состояние тканей пародонта определяли, используя индекс PMA (Parma, 1960); интенсивность поражения пародонтального комплекса оценивали по пародонтальному индексу — ПИ. Глубину пародонтальных карманов (ПК) измеряли со всех сторон зуба с помощью градуированного зонда, фиксируя наибольшую ее величину (Т.В. Никитина, В.С. Иванов, 1989). Степень подвижности зубов оценивали, используя пинцет (Никитина, 1982; Данилевский и соавт., 1993); гигиеническое состояние полости рта квалифицировали, применяя количественный гигиенический индекс — ГИ (Федоров, Володкина, 1971). У всех пациентов определяли состояние сосудов пародонта методом дозированного вакуума по В.И. Кулаженко (1967). Состояние костной ткани межзубных перегородок оценивали по данным внутриротовой рентгенографии (В.С. Иванов, 1989; Н.Ф. Данилевский и соавт., 1993).
Больные ХГП были распределены в зависимости от метода лечения на 2 группы, сопоставимые по полу, возрасту, клиническим проявлениям воспалительно-дистрофического процесса в пародонтальном комплексе. Больные 1-й группы (18 человек) получали базисную терапию, предусматривавшую комплекс общих и местных мер. Так, общее лечение состояло из рекомендаций по диетическому питанию и витаминотерапии (поливитамины «Центрум» в течение 2 мес). Местное лечение начинали с профессиональной гигиены и санации полости рта. Одновременно пациентов обучали методам рациональной индивидуальной гигиены с последующим контролем при каждом посещении. В дальнейшем проводили медикаментозную терапию с целью ликвидации воспаления в десне, устранения нарушений микроциркуляции и гипоксии, приостановления процесса деструкции кости, повышения регенераторной способности тканей пародонта. Комплексная противовоспалительная терапия состояла: в инфузии ПК растворами 0,05% хлоргексидина и 0,01% мирамистина; наложении пародонтальных повязок: с аспириновой мазью (Россия), с 25% гелем Metrogyl Denta («Unic Pharmasutical», Индия), с пастами Cupral («Humanchemie», Германия) и Iodo-glycol («Neo Dental», Япония). Наряду с этим применяли пленки Диплен-дента, в состав которых входят хлоргексидин и солкосерил. Для укрепления сосудистой стенки выполняли инъекции 5% раствора аскорбиновой кислоты; курс — 5 процедур. После снятия явлений воспаления осуществляли вакуум-терапию по В.И. Кулаженко; курс — 5 процедур.
Во 2-й группе (18 человек) пациенты получали базисную и фототерапию — инфракрасный лазерный свет (ИЛС) аппарата Оптодан, генерирующий световой поток в импульсном режиме (длина волны — 0,85—0,89 мкм). Методика предусматривала применение ИЛС сканирующим способом по квадрантам челюстей: вначале с использованием на 1-м канале противовоспалительных параметров (80—100 Гц; 1,5—1,8 Вт; 2 мин), затем — на 2-м канале — стимулирующих (1,5—2,0 кГц; 0,3—0,5 Вт; 1 мин). Процедуры ежедневные, на курс — 5 процедур.
Группу сравнения составили 10 человек (средний возраст — 31,0±0,1 года) с интактным пародонтом, обратившихся для профилактического осмотра.
Контроль эффективности лечения осуществляли по локальному цитокиновому профилю. Материалом для исследования цитокинов служила жидкость пародонтальных карманов — ПК (ЖПК), для забора которой применяли оригинальную методику, разработанную в лаборатории Института экологии и генетики микроорганизмов УрО РАН. В работе использованы: тест-системы ООО «Цитокин» (Санкт-Петербург) для определения ИЛ-1β, ИЛ-1ra, ИЛ-6, ИЛ-10 и факторы некроза опухолей-α (ФНО-α); наборы «Biomedica Medizinprodukte GmbH & Co KG» (Австрия) — для определения остеопрогерина (ОПГ) и лиганда рецептора, актив. фактор транскрипции ядерного фактора — кВ (RANK-лиганд).
При статистической обработке цифрового материала рассчитывали средние арифметические величины (М) и
их ошибки (m). Для оценки достоверности различий между средними величинами использовали t-критерий Стьюдента. Дополнительно для установления различий по частотам применяли метод четырехпольных таблиц с определением достоверности точным методом Фишера. Влияние различных факторов на изменение цитокинового профиля оценивали методом дисперсионного анализа. Для выявления у больных ХГП взаимосвязей между изменениями концентраций цитокинов в ЖПК и клиническими показателями тяжести заболевания до и после лечения был проведен корреляционный анализ с расчетом коэффициента Пирсона. Статистическую обработку данных проводили с помощью компьютерных программ Excel 2000 (Microsoft Inc., 1999) и Statistica for Windows, v. 5.0 (Stat Soft Inc., 1995).
Результаты и обсуждение
При оценке стоматологического статуса у больных ХГП ортогнатический прикус диагностирован в 86,1% случаев (у 31 человека), глубокий — в 13,9% случаев (у 5 человек). Показатель интенсивности кариеса зубов (индекс КПУ) колебался в диапазоне от 5 до 23 (среднее значение — 12,75±1,04). Уровень гигиены полости рта оценивали либо как «неудовлетворительный» (22,2% — 8 человек), либо как «плохой» (77,8% — 28 человек). Среднее значение индекса PMA составило: в 1-й группе — 62,53±0,07%, во 2-й группе 59,68±1,17%; ПИ соответственно 3,30±0,16 и 3,29±0,14; глубина ПК — 3,87±0,10 и 4,04±0,13 мм. Приведенные данные свидетельствуют о выраженных воспалительно-деструктивных изменениях в пародонте у больных ХГП, что подтверждалось рентгенологическими критериями, характерными для пародонтита легкой и средней степени. Пародонтальный статус в группе сравнения соответствовал характеристикам клинически интактного пародонта, в частности ПИ и PMA были нулевыми.
При исследовании концентрации провоспалительных цитокинов в ЖПК у больных ХГП выявлены следующие закономерности: содержание ФНО-α было повышено в 3,8 раза, а ИЛ-1β — в 4,8 раза относительно соответствующего параметра в группе сравнения. ИЛ-6 в десневой жидкости обнаружен лишь у 20% пациентов со здоровым пародонтом; у больных ХГП частота выявления этого цитокина была в 3 раза выше (61%) — табл. 1.
Таблица 1. Показатели корреляционного анализа у больных ХГП до лечения

Таким образом, полученные данные позволяют заключить, что у больных ХГП выражен воспалительный процесс в пародонтальном комплексе, о чем свидетельствует повышенная концентрация провоспалительных цитокинов ФНО-α, ИЛ-1β и ИЛ-6.
Что касается концентрации противовоспалительных цитокинов в ЖПК у больных ХГП, то исследование дало следующие результаты. Уровень ИЛ-1ra существенно (в 2,75 раза) и достоверно превышал аналогичный показатель у здоровых субъектов, что свидетельствует о развитии в тканях пародонтального комплекса компенсаторных реакций, направленных на подавление воспалительного процесса. Однако содержание ИЛ-10 у пациентов с ХГП было ниже, чем у людей с интактным пародонтом (табл. 2).
Таблица 2. Содержание провоспалительных цитокинов в ЖПК у больных ХГП

Исследование концентрации ОПГ и RANK-лиганда в ЖПК у больных ХГП показало, что уровень ОПГ у них был ниже, чем в группе сравнения, а уровень RANKL — наоборот, достоверно выше (рис. 1). Известно, что ОПГ связывается с RANK-лиганда и блокирует его взаимодействие с RANK, подавляя тем самым стимуляцию остеокластов. Полученные данные позволяют предположить, что низкий уровень ОПГ в ЖПК у больных пародонтитом обеспечивает условия для активации костных макрофагов и способствует резорбции костной ткани альвеолярных отростков челюстей.
Рис. 1. Уровень OPG и RANKL в ЖПК в группах наблюдений.

По оси абсцисс — группы обследованных; по оси ординат — концентрация OPG и RANKL; * — достоверность различий между группами (p<0,05).
У больных ХГП до лечения обнаружена зависимость между полом и значениями пародонтологических индексов. Так, у мужчин ГИ и ПИ были выше, чем у женщин (см. табл. 1). Установленную закономерность можно объяснить тем, что мужчины, как правило, уделяют меньше внимания гигиене полости рта (кратность и время чистки зубов), чем женщины, больше курят, что оказывает дополнительное негативное влияние на состояние тканей пародонтального комплекса. Выявлена также отрицательная корреляционная зависимость между возрастом больных ХГП и концентрацией в ЖПК провоспалительного цитокина ФНО-α. Наличие такой взаимосвязи может отражать сниженную реакцию на внедрение инфекционного агента, недостаточную эффективность формируемых иммунных механизмов и, как следствие, — развитие хронического воспалительно-деструктивного процесса. Одновременно корреляционный анализ выявил у больных ХГП обратную зависимость между концентрацией ФНО-α и индексами, отражающими степень поражения пародонта (PMA, ПИ) — см. табл. 1. Установленный факт свидетельствует о том, что при пародонтите ФНО-α выступает как защитный фактор, действие которого направлено на развитие эффективной воспалительной реакции в тканях пародонтального комплекса и устранение бактериального агента.
Помимо этого, выявлена прямая корреляционная зависимость между возрастом больных ГП и концентрацией
противовоспалительного цитокина ИЛ-10. По-видимому, на фоне возрастных изменений иммунной системы у
больных ХГП из-за высокого уровня ИЛ-10 в ЖПК не развивается полноценная воспалительная реакция, в связи с чем патологический процесс в пародонте приобретает хроническое течение.
Результаты лечения больных ХГП показали, что содержание провоспалительных цитокинов ФНО-α и ИЛ-1β в ЖПК находилось в прямой связи с индексом РМА. Установленная положительная корреляционная зависимость между этими показателями свидетельствует о том, что у больных ХГП нейтрофилы являются важным источником провоспалительных медиаторов ФНО-α и ИЛ-1β.
После курса комплексного лечения больных ХГП отмечены достоверные позитивные изменения по всем исследованным клиническим параметрам. Так, гигиеническое состояние полости рта в 1-й группе (базисная терапия) и 2-й группе (базисная терапия + ИЛС) оценено как «удовлетворительное»; пародонтальные индексы снизились соответственно: PMA — на 36,7 и 34,8%; ПИ — на 1,4 и 1,4; глубина ПК уменьшилась на 1,41 и 1,75 мм. Что же касается показателей цитокинового профиля в ЖПК у больных ХГП, то концентрация провоспалительного цитокина ФНО-α в 1-й группе уменьшилась в 2,7 раза, а во 2-й — в 1,7 раза (см. табл. 2). Содержание провоспалительного цитокина ИЛ-1β в ЖПК у больных ХГП как до, так и после лечения оказалось более чем в 4 раза выше, чем в группе сравнения. Использование точного метода Фишера позволило сделать следующее заключение: под влиянием базовой терапии частота определения провоспалительного цитокина ИЛ-6 в ЖПК у больных ХГП достоверно снизилась с 55,6 до 22,2% (p<0,05), а в случае базисной терапии + ИЛС — с 66,7 до 16,7% (p<0,01).
Таким образом, после соответствующей терапии ХГП у больных обеих групп произошло снижение в ЖПК уровня провоспалительных цитокинов ФНО-α и ИЛ-6; концентрация ИЛ-1β оставалась неизменной.
После курса комплексного лечения больных ХГП отмечено снижение содержания противовоспалительного
цитокина ИЛ-1ra: в 1-й группе — в 1,8 раза, во 2-й — в 2 раза (табл. 3). Что же касается противовоспалительного цитокина ИЛ-10, то повышение его уровня в ЖПК у больных обеих групп после лечения было статистически недостоверным.
Таблица 3. Содержание противовоспалительных цитокинов в ЖПК у больных ХГП

В результате терапии ХГП у пациентов произошло достоверное повышение концентрации ОПГ: в 1-й группе — в 2,1 раза, во 2-й — в 1,8 раза. После базисной терапии у больных ХГП снижение уровня RANK-лиганда в 2,5 раза относительно соответствующего показателя в контроле оказалось недостоверным. Уровень RANK-лиганда в ЖПК у больных ХГП, получавших базисную терапию + ИЛС, достоверно снизился — в 6,7 раза относительно соответствующего параметра до лечения (рис. 2).
Рис. 2. Содержание RANKL в ЖПК в группах наблюдений.

По оси абсцисс — группы обследованных; по оси ординат — концентрация RANKL (в нг/мл); белые столбцы — уровень RANKL у здоровых людей, черные — уровень RANKL у больных пародонтитом, серые столбцы — уровень RANKL у больных пародонтитом после лечения; * — достоверность различий между группой больных ХГП до лечения и группой этих больных после лечения.
Таким образом, по результатам исследования можно сделать вывод, что введение в комплексную терапию хронического пародонтита ИЛС позволяет более эффективно снизить содержание RANK-лиганда в ЖПК у таких больных.
Используемые стандартные статистические методы (например, тест Стьюдента) могут сравнить между собой только 2 выборки. В связи с этим был дополнительно проведен дисперсионный анализ, который позволил оценить воздействие сразу нескольких факторов на локальный цитокиновый профиль пациентов. В качестве таких факторов выделены: пародонтит, базисное лечение и роль ИЛС в этом комплексе (табл. 4).
Таблица 4. Роль вариантов лечения ХГП в изменении концентрации цитокинов ЖПК (факторный анализ)

Результаты многофакторного анализа в основном подтвердили изменения, установленные методом Стьюдента: зафиксированы статистически значимые эффекты пародонтита и влияние базисной терапии на изменение цитокинового профиля ЖПК. Факторный анализ показал также, что ИЛС существенно не меняет эффекты базисной терапии — это отражают пародонтальные индексы, а также концентрация про- и противовоспалительных цитокинов. Вместе с тем нами впервые обнаружено выраженное влияние ИЛС на локальные концентрации RANK-лиганда, что подтверждено как методом Стьюдента, так и более объективным дисперсионным анализом.
Итак, многофакторное исследование показало, что определение в жидкости ПК уровня про- и противовоспалительных цитокинов может служить контролем эффективности терапии больных ХГП. Включение ИЛС в лечебный комплекс у больных ХГП способствует эффективному снижению локальной концентрации уровня RANK-лиганда в ЖПК, что обосновывает применение этого физического фактора для уменьшения деструкции альвеолярных отростков челюстей. Низкоинтенсивный ИЛС у больных ХГП может быть использован как самостоятельно — в случаях, когда пациенту противопоказаны те или иные медикаменты из-за их непереносимости — так и в качестве потенцирующего физиотерапевтического средства.
Авторы: Д.м.н., проф. Л.А. Мозговая, к.м.н. Д.В. Шмидт, А.Ю. Новиков
Пермская государственная медицинская академия им. акад. Е.А. Вагнера Росздрава, Пермская краевая клиническая стоматологическая поликлиника




























































































































































0 комментариев