Одним из факторов, определяющих эндодонтиста как успешного врача-стоматолога, является его способность эффективно справляться с рефрактерными эндодонтическими поражениями. Рефрактерная патология представляет собой очаг поражения, адекватно не реагирующий на проводимую терапию, постоянно обостряющийся и рецидивирующий. Хотя характер патогенных рефрактерных эндодонтических патологий должным образом не изучен, очевидно, что на его развитие в значительной мере влияет характер взаимодействия бактериальной составляющей в структуре эндодонта и иммунологического ответа со стороны организма человека. Неудачность эндодонтического лечения часто объясняется персистенцией бактериальных производных в структуре канала или же повторным его инфицированием из-за феномена коронального микроподтекания или в результате развития трещины. Реже рефрактерные поражения могут развиваться и по причине влияния внеэндодонтических факторов: периапикального актиномикоза, накопления кристаллов холестерина, развития реакций на стороннее тело, незаживающих кистозных поражений и внекорневой бактериальной биопленки. В подобных случаях не обойтись без хирургического подхода к лечению, который в определенных случаях подразумевает необходимость удаления зуба.
Рефрактерная эндодонтическая патология
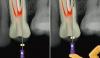
На фото 1a – d изображен клинический случай рефрактерной эндодонтической патологии. Он был размещен в сети одним из врачей-специалистов, и публикуется в данной статье с его разрешения. В данном случае проводилось повторное лечение правого первого моляра нижней челюсти с поставленным диагнозом симптоматического периапикального периодонтита.
Фото 1 a-d. a) рентгенограмма до лечения; b) повязка из кальций гидроксида; c) повязка из кальций гидроксида; d) вид после завершения лечения.
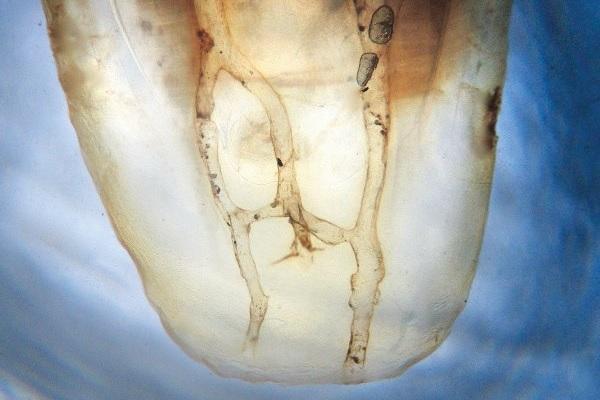
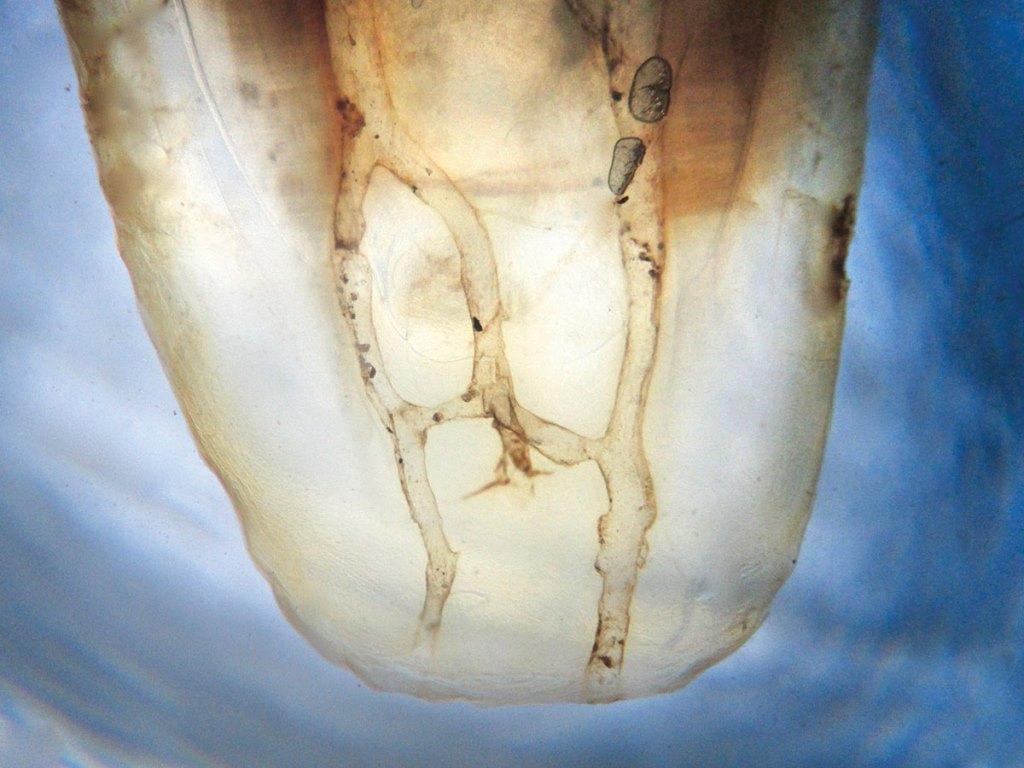
Результаты пародонологического зондирования не свидетельствовали о наличии карманов, признаков развития перелома зуба также не отмечалось. Лечение было проведено по стандартному эндодонтическому протоколу с длительным применением кальций гидроксида, который вносили в пространства корневого канала дважды на протяжении семи месяцев. После улучшения клинических симптомов каналы были обтурированы, а зуб – восстановлен. Однако через неделю его пришлось удалить из-за того, что симптомы периапикального поражения стали еще более выраженными и постоянными. Хота причина неуспешности проведенного лечения не была объективизирована, однако существует высокий риск того, что используемый протокол эндодонтического вмешательств попросту не позволил уменьшить бактериальную нагрузку в канале до необходимого уровня. Зубы человека характеризуются значительными анатомическими вариациями, особенно в медиальной системе каналов (фото 2а и фото 2b), поэтому применение стандартных протоколов эндодонтического лечения не всегда может обеспечить надлежащую очистку подобной периапикальной дельты.
Фото 2a-b. Сложное строение системы корневых каналов мезиальных корней нижних моляров.
Клинический случай 1
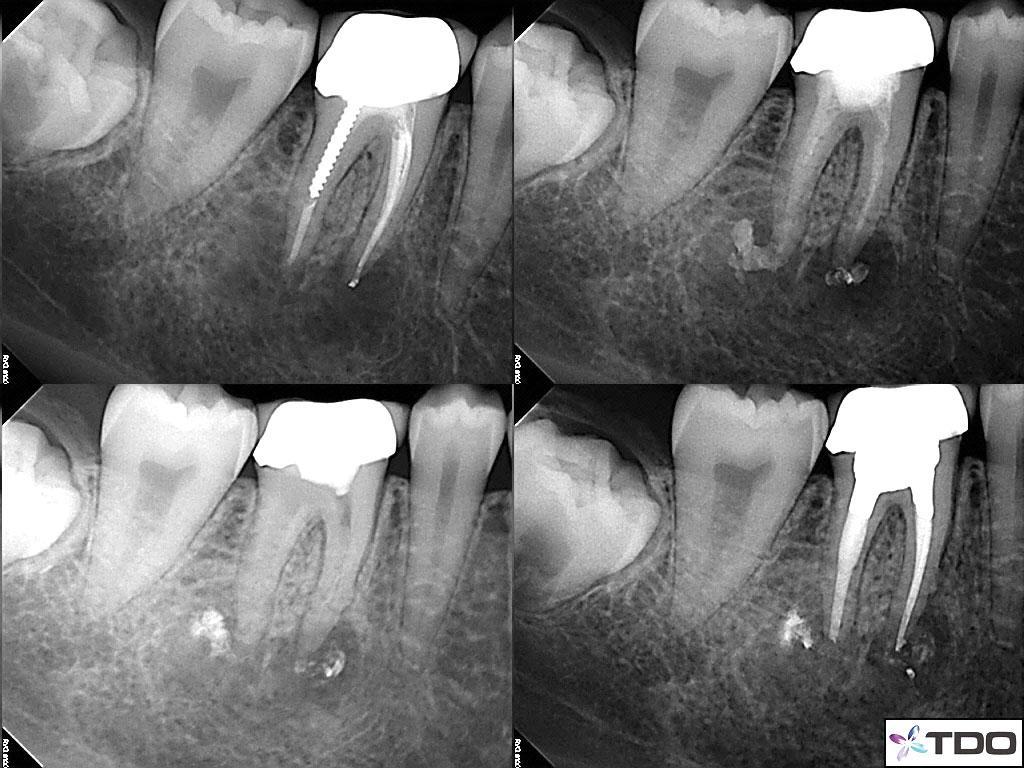
58-летний пациент мужского пола с наличием рака щитовидной железы в анамнезе был направлен к стоматологу с диагнозом рецидивирующего эндодонтического поражения в области правого второго моляр нижней челюсти. Повторное эндодонтического лечение было инициировано лечащим стоматологом пациента. Пациент жаловался на болезненность во время перкуссии. Несмотря на то, что предыдущий врач проводил какие-то манипуляции, состояние пациента за последнее время заметно не улучшалось. Чрезмерного окллюзионного контакта в области проблемного зуба не отмечалось. Глубина пародонтального зондирования вокруг зуба демонстрировала нормальные показатели, а в ходе трансиллюминационной диагностики признаков перелома зуба обнаружено не было. Пациенту был поставлен диагноз периапикального периодонтита. Данные КЛКТ также подтвердили отсутствие перелома зуба и адекватный уровень обтурации имеющихся корневых каналов (фото 3).
Фото 3. КЛКТ-срезы.
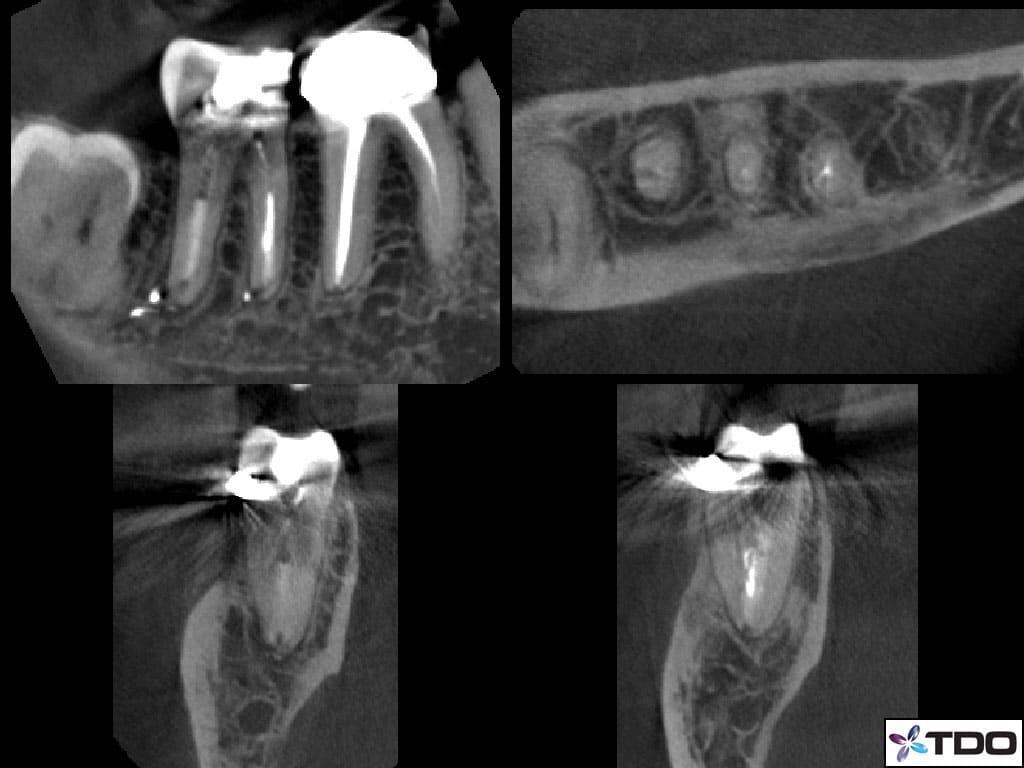
После выполнения анестезии эндодонтическое лечение зуба проводилось в соответствии с протоколом радиальной апикальной очистки (РАО), после чего эндопространство выполняли гидроксидом кальция (фото 4а-с).
Фото 4a-c. a) рентгенограмма до лечения; b) вид после лечения; c) вид через 1,5 года после лечения.
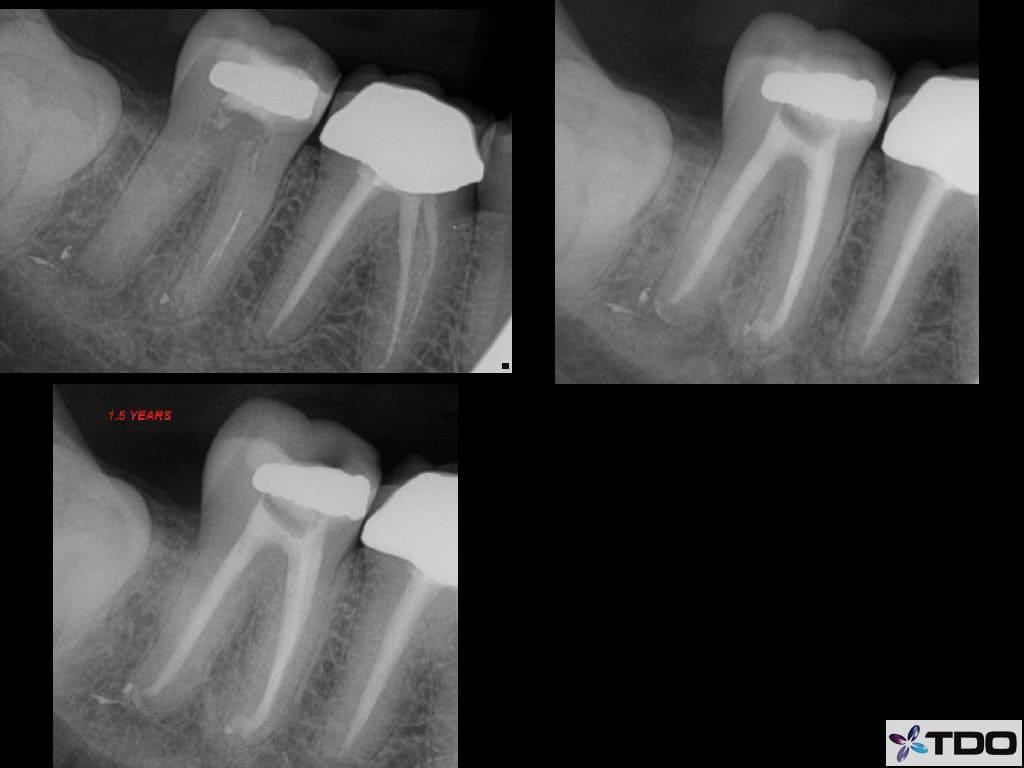
Также пациенту был предписан прием амоксициллина (500 мг, три раза в день на протяжении 7 дней). В ходе второго визита зуб уже не демонстриовал никаких симптомов, и был обтурирован посредством биокерамического силлера (EndoSequence BC Sealer and Points, Brasseler) и гуттаперчевого мастер-штифта. Через 1,5 года наблюдения зуб являлся полностью функциональным и оставался бессимптомным, клинических признаков поражения не отмечалось, а рентгенологически было зарегистрировано заживление периапикального очага поражения. В дальнейшем зуб подлежал реставрации с применением коронки.
Клинический случай 2
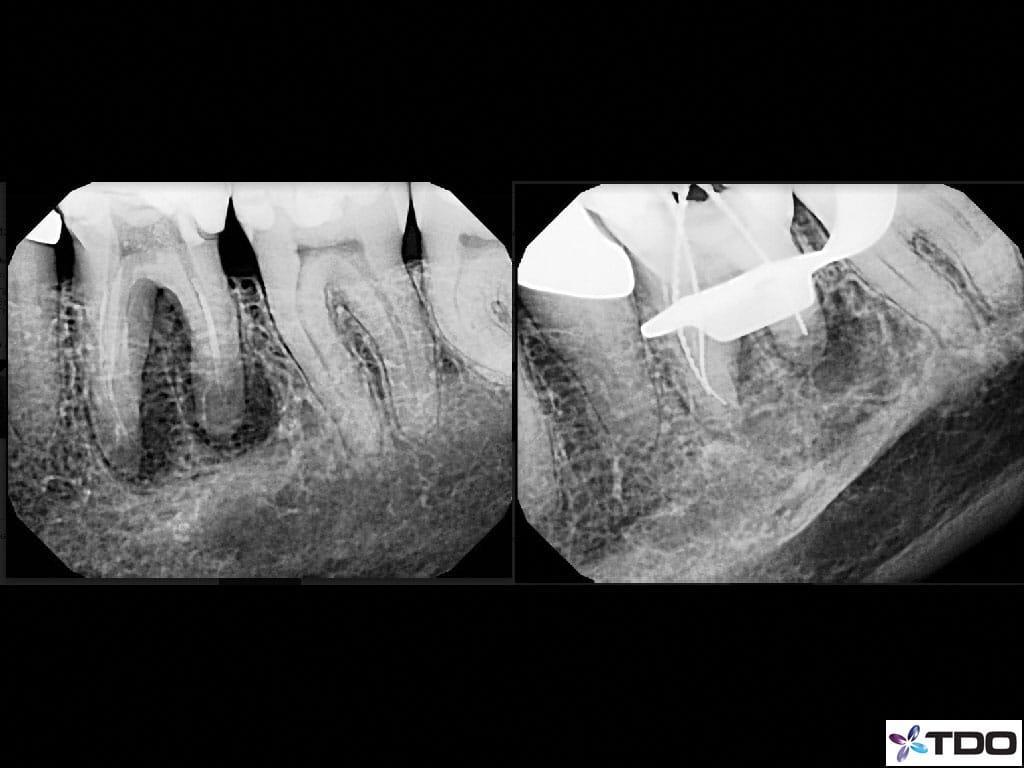
У 77-летней пациентки появились боли и отек в области первого моляра нижней челюсти слева. Ранее данный зуб был пролечен эндодонтически дважды (фото 5a и b).
Фото 5a-b. Рентгенограммы, полученные от врача-эндодонтиста.
В ходе клинического осмотра отек был идентифицирован в проекции слизисто-щечной складки, а зуб демонстрировал позитивную реакцию на перкуссию. В ходе пародонтального зондирования был обнаружен узкий 7 мм канал со щечной стороны медиального корня. В ходе использования трансиллюминации, как метода диагностики, признаков перелома зуба обнаружено не было. Данные рентгенологического обследования свидетельствовали о наличие J-образной рентгенпрозрачности в области мезильного корня, а также небольшой зоны поражений в области дистального корня (фото 6).
Фото 6. КЛКТ срезы: визуализация J-образного поражения в области мезиального и дистального корней.
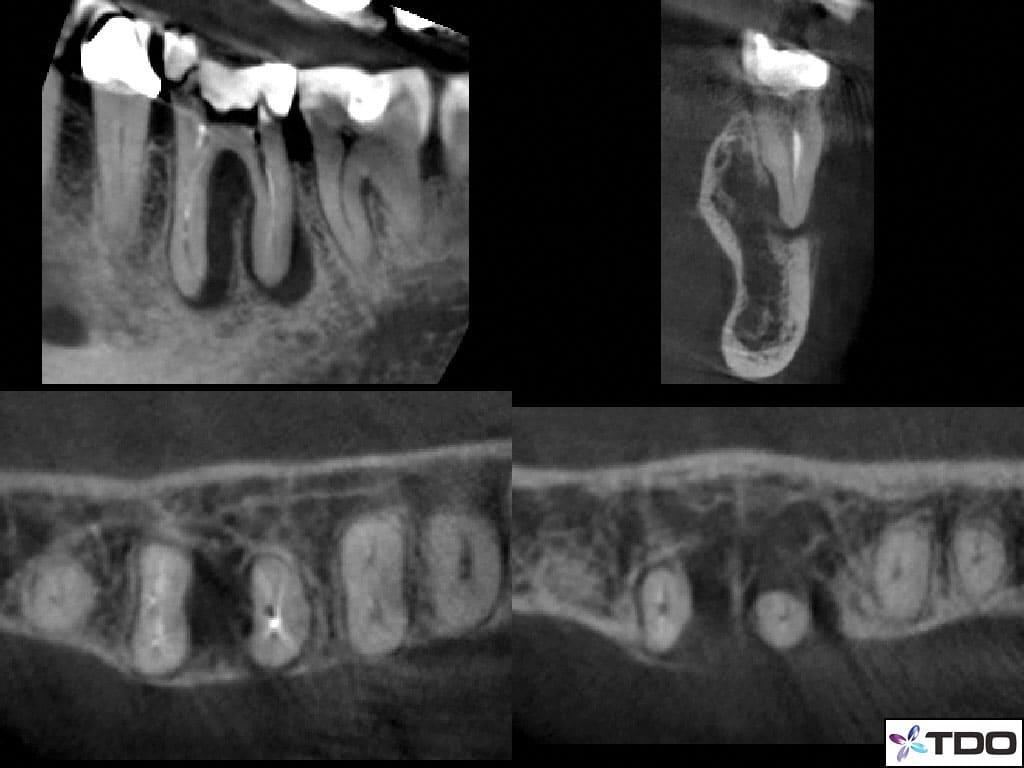
Пациенту был поставлен диагноз симптоматического периапикального периодонтита с формированием свища со щечной стороны. После выполнения анестезии зуб был эндодонтически пролечен согласно протоколу РАО, после чего эндопространство выполнили пастой на основе гидроксида кальция (фото 7a-d).
Фото 7a-d. a) рентгенограмма до лечения; b) повязка из кальций гидроксида; c) вид после лечения; d) вид через 9 месяцев после завершения лечения.
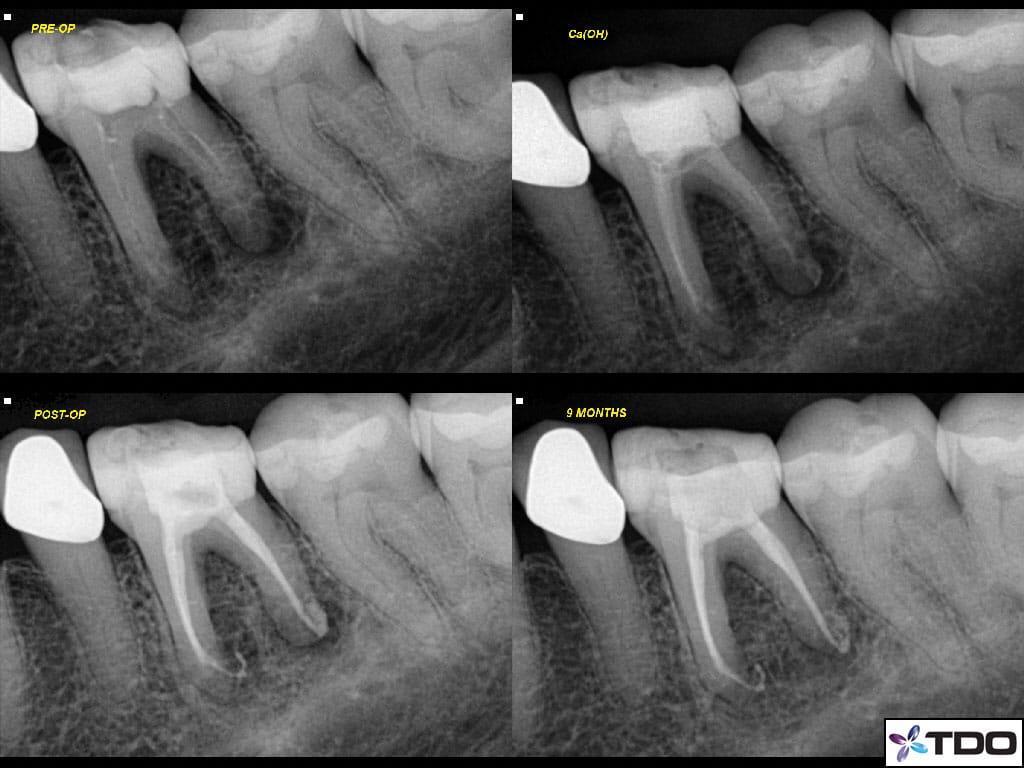
Также пациенту был предписан прием амоксициллина (500 мг, три раза в день на протяжении 7 дней). В ходе второго визита зуб уже не демонстриовал никаких симптомов, и был обтурирован посредством биокерамического силлера (EndoSequence BC Sealer and Points, Brasseler) и гуттаперчевого мастер-штифта. В ходе повторного осмотра через десять месяцев показатели пародонологического зондирования были в норме, зуб был полностью функциональным и не демонстрировал никаких признаков поражения, при этом на рентгеновском снимке отмечалось заживление периапикального очага поражения.
Радиальная апикальная очистка (РАО)
РАО представляет собой протокол лечения, который обеспечивает отличную очистку и дезинфекцию корневых каналов сложного анатомического строения, с применением в этих целях методов хемомеханической и лазерной обработки. Протокол включается следующие этапы:
Инструментальная обработка:
- формирование ковровой дорожки с использованием ручных и роторных файлов 0,06 и 0,08 размеров;
- обработка апикальной части канала разогретыми никель-титановыми файлами с сохранением структур корня в корональной трети и пришеечной области;
Ирригация:
- эффективная ирригация апикальной части канала с негативным давлением посредством системы (KaVo Kerr) и 6% раствора гипохлорита натрия (NaOCl);
- звуковая активация ирриганта;
Очистка:
- активация ирриганта посредством лазера Er, Cr: YSGG (Waterlase iPlus, BIOLASE) с насадками RFT2 и RFT3 и следующими настройками системы: 1,25 Вт, режим 20 Гц (импульсов в секунду), 30% воздуха, 10% воды и 62,5 мДж/импульс;
Дезинфекция:
- лазерная дезинфекция выполняется с помощью лазера Er, Cr: YSGG (Waterlase iPlus) с использованием наконечников RFT2 и RFT3 laser и следующими настройками системы: 1 Вт, режим H, 20 Гц (импульсов в секунду), 10% воздуха, 0% воды и 50 мДж / импульс;
- глубокая дезинфекция дентина проводится диодным лазером с длиной волны 940 нм (Epic X, BIOLASE) с использованием неактивированного наконечника на мощности 1 Вт в режиме непрерывной волны во влажном канале. В идеале, как для чистки, так и для дезинфекции каналов, лазерный наконечник должен быть на 1 мм короче рабочей длины и активироваться в ходе его извлечения из эндопространства круговыми движениями со скоростью 1-2 мм в секунду. Данный этап повторяется по четыре раза в каждом канале. Позиционирование лазерного наконечника зависит от анатомии корневого канала, диаметра эндопространства и факта наличия/отсутствия его проходимости. Эффективность использования лазерного наконечника сохраняется даже при 5 мм расстоянии от апикального отверстия.
Эрбиевые лазеры в эндодонтии
Эрбиевые лазеры характеризуются самой востребованной длиной волны для применения в эндодонтическом лечении. Данный тип лазеров может быть использован как при работе с мягкими, так и с твердым тканями, и характеризуется самим большим количеством официальных разрешений от FDA для выполнения разных стоматологических процедур. Первичными хромофорами эрбиевых лазеров являются вода, и в меньше степени – гидроксиапатит. При работе с мягкими тканями эрбиевые лазеры характеризуются преимущественно фототермическим механизмом взаимодействия, при работе с твёрдыми тканями – фотодеструктивным. При соблюдении необходимых параметров процесс терморелаксации проходит без каких либо нарушений с минимальным коллатеральным повреждением окружающих тканей.
Действие в системах корневых каналов
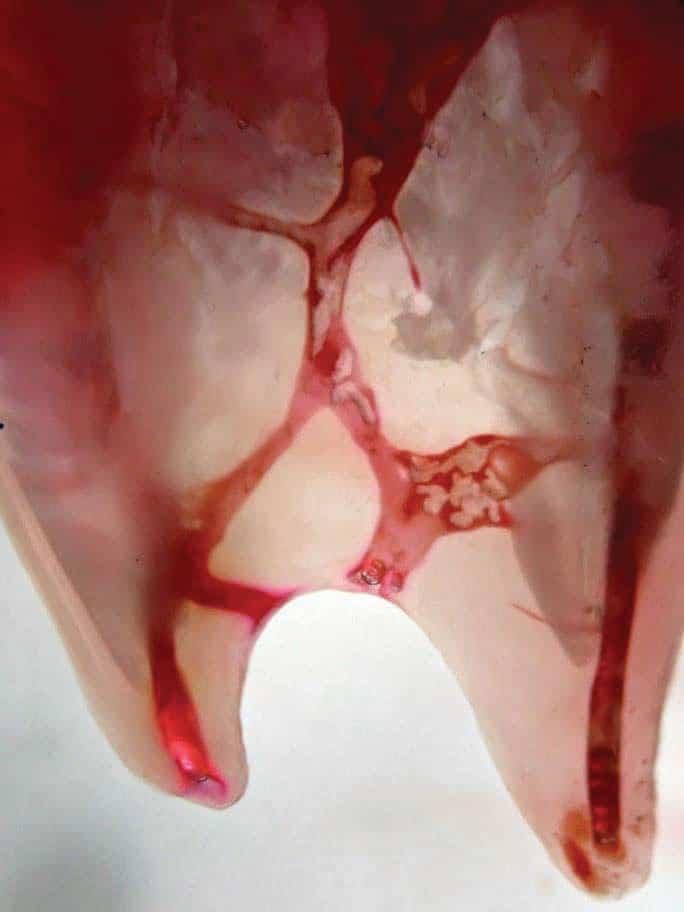
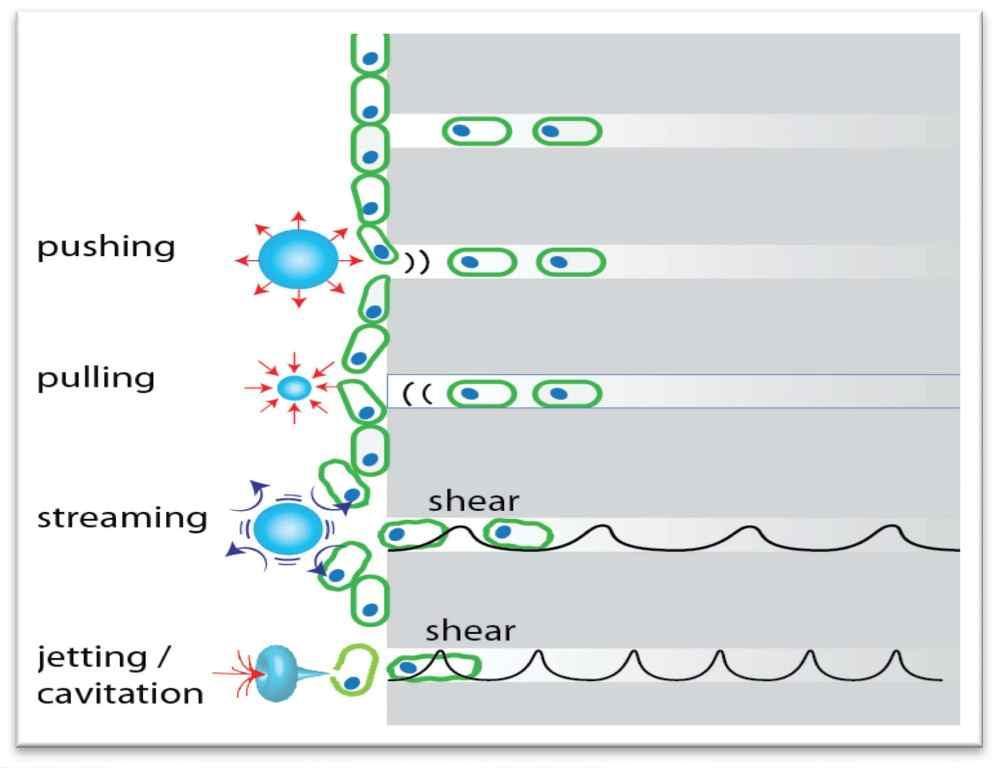
При активации лазера в присутствии воды происходит мгновенное испарение, при котором формируются пузырьки воздуха на кончике наконечника (фото 8). Быстро расширяющиеся и вздувающиеся пузырьки создают эффект кавитации, который также ассоциирован с ускорением водяных потоков в структуре эндопространства. Все это приводит к развитию напряжения сдвига вдоль стенки канала. Вторичные эффекты кавитации также способствуют очистке и стерилизации эндопространства. На границах жидкость-твердое тело (стенки канала) микроскопические пузырьки генерируются силами сдвига от проходящей акустической волны, что приводит к эффекту микропотока и микрокавитации, который обеспечивает проникновение раствора в дентинные канальцы и микроскопические ответвления (фото 9). Расширение и коллапс жидкости, которая находится внутри дентинных тубул достигает глубины 1000 мкм и более, чего вполне достаточно чтобы разрушить биопленку и уничтожить бактерии.
Фото 8. Формирование и разрыв воздушного пузыря под действием лазера.

Фото 9. Эффекты микропотока и микрокавитации на границе раствора и твердых стенок корня.
Обсуждение
Эндодонтическая патология провоцируется наличием бактериальной биопленки, следовательно, успех эндодонтического лечения зависит от возможности данную биопленку удалить и обеспечить очистку эндопространства от бактериальной контаминации. Для достижения этой цели в эндодонтии используют комплекс методов хемомеханической очистки каналов, но из-за сложности анатомии до 30-45% эндодонтического пространства все равно остается по больше мере не тронутым ни раствором ирриганта, ни режущими гранями файла. С другой стороны, чрезмерная хемомеханическая очистка эндопространства может привести к биомеханическому ослаблению зуба, и может спровоцировать развитие апикальной трещины. В результате получается так, что стоматолог в ходе эндодонтического лечения обеспечивает больше удаление именно планктонных форм бактерий, нежели тех, которые входят в состав биопленки, а резистентность таковых к действию антибактериальных агентов больше в 1000 раз по сравнению с теми, которые находятся в свободном состоянии (состоянии планктона). Результаты предыдущих исследований свидетельствуют о том, что инструментальная обработка и ирригация канала раствором NaOCl позволяет уничтожить до 50–75% бактерий в структуре эндопространства, при этом оставшиеся бактерии могут быть элиминированы или самим организмом, или же оставаться в неактивном состоянии до наступления благоприятных для них условий. В своем исследовании Nair и коллеги показали, что 88% эндодонтически пролеченных моляров нижней челюсти демонстрировали наличие остаточной инфекции в системе мезиальных каналов даже после выполнения инструментальной обработки, ирригации NaOCl и обтурации. Для того, чтобы очистка канала была эффективной, необходимо добиться его обработки вплоть до апикального отверстия. Chow установил, что эффект «вымывания» вдали от отверстия эндодонтической иглы по сути является минимальным, следовательно, дабы повысить эффективность такового целесообразно использовать дополнительное негативное давление.
С другой стороны, обеспечить ирригацию с использованием негативного давления в условиях реализации принципов мини-инвазивной эндодонтии достаточно сложно и крайне затруднительно. Активация ирригационного раствора посредством лазера вызывает генерирование напряжения вдоль стенок канала, которое способствует разрушению имеющейся биопленки, тем самым обеспечивая переход бактерий в планктонное состояние. Данный механизм разрушения биопленки может быть обоснован за счет нарушения когезионных связей между слоями бактерий, или же адгезивных связей между бактериями и стенками канала. В любом случае бактерии в состоянии планктона более чувствительны к действию ирригационных растворов, которые формируют поры в их мембране и провоцируют деструкцию клеток микроорганизмов.
Если же сформированных напряжений вдоль стенки канала недостаточно для того, чтобы разрушить биопленку, она попросту деформируется и со временем переходит в исходное состояние. Активация ирригационных растворов посредством лазера также способствует удалению смазанного слоя и дентинных пробок, тем самым обеспечивая условия для достижения полной проходимости канала. Удаление апикальной воздушной пробки также является одним из преимуществ использования лазера в ходе эндодонтического лечения. Дезинфекция корневого канала в структуре протокола РАО обеспечивается за счет эрбиевого лазера Er, Cr: YSGG в сухих условиях. Энергия лазера вызывает абляцию биопленки и микроорганизмов за счет мгновенного испарения воды. Таким образом удается достичь дезинфекции канала на глубине дентина до 200 микрон. О возможностях более глубокого уровня дезинфекции было описано при применении диодного лазера в лабораторных условиях. Первичными хромофорами для диодного лазера являются пигменты (меланин и гемоглобин) и, в меньшей степени, вода. Это способствует более глубокому проникновению света через структуру дентина без нарушения его структуры, но обеспечением уничтожения всех микроорганизмов в дентинных канальцах.
Выводы
Проблема рефрактерной эндодонтической патологии была резюмирована Ricucci следующим образом: «Мы должны разработать стратегии, инструменты и медикаментозные агенты, которые бы позволили нам эффективно работать с контаминацией в глубине корневого канала для того, чтобы снизить уровень бактериальной нагрузки настолько, что она станет преодолимой для организма, после чего мы сможем обеспечивать заживления участков периапикальных патологий». Протокол лечения РАО разработан для нехирургической терапии рефрактерных эндодонтических поражений, и предполагает синергетическое использование лазерной активации Er,Cr:YSGG и негативного давления при ирригации эндопространства 6% раствором гипохлорита натрия. Такой подход позволяет разрушить биопленку и обеспечивает очистку дентинных канальцев, тем самым максимизируя эффект хемомеханической дезинфекции. Хотя в некоторых литературных источниках рефрактерная эндодонтическая патология ассоциируется cо специфическим видом резистентной микрофлоры, но, по нашему мнению, основная проблема состоит в успешной очистке эндопространства, с которой подход РАО может успешно справиться. Основным изменением по отношению к классическому протоколу эндодонтического лечения является использование лазерных технологий в ходе очистки и дезинфекции эндодонтического пространства.
Автор: Dr Justin Kolnick (частная практика, Нью-Йорк, США)
Одним из факторов, определяющих эндодонтиста как успешного врача-стоматолога, является его способность эффективно справляться с рефрактерными эндодонтическими поражениями. Рефрактерная патология представляет собой очаг поражения, адекватно не реагирующий на проводимую терапию, постоянно обостряющийся и рецидивирующий. Хотя характер патогенных рефрактерных эндодонтических патологий должным образом не изучен, очевидно, что на его развитие в значительной мере влияет характер взаимодействия бактериальной составляющей в структуре эндодонта и иммунологического ответа со стороны организма человека. Неудачность эндодонтического лечения часто объясняется персистенцией бактериальных производных в структуре канала или же повторным его инфицированием из-за феномена коронального микроподтекания или в результате развития трещины. Реже рефрактерные поражения могут развиваться и по причине влияния внеэндодонтических факторов: периапикального актиномикоза, накопления кристаллов холестерина, развития реакций на стороннее тело, незаживающих кистозных поражений и внекорневой бактериальной биопленки. В подобных случаях не обойтись без хирургического подхода к лечению, который в определенных случаях подразумевает необходимость удаления зуба.

Рефрактерная эндодонтическая патология
На фото 1a – d изображен клинический случай рефрактерной эндодонтической патологии. Он был размещен в сети одним из врачей-специалистов, и публикуется в данной статье с его разрешения. В данном случае проводилось повторное лечение правого первого моляра нижней челюсти с поставленным диагнозом симптоматического периапикального периодонтита.
Фото 1 a-d. a) рентгенограмма до лечения; b) повязка из кальций гидроксида; c) повязка из кальций гидроксида; d) вид после завершения лечения.

Результаты пародонологического зондирования не свидетельствовали о наличии карманов, признаков развития перелома зуба также не отмечалось. Лечение было проведено по стандартному эндодонтическому протоколу с длительным применением кальций гидроксида, который вносили в пространства корневого канала дважды на протяжении семи месяцев. После улучшения клинических симптомов каналы были обтурированы, а зуб – восстановлен. Однако через неделю его пришлось удалить из-за того, что симптомы периапикального поражения стали еще более выраженными и постоянными. Хота причина неуспешности проведенного лечения не была объективизирована, однако существует высокий риск того, что используемый протокол эндодонтического вмешательств попросту не позволил уменьшить бактериальную нагрузку в канале до необходимого уровня. Зубы человека характеризуются значительными анатомическими вариациями, особенно в медиальной системе каналов (фото 2а и фото 2b), поэтому применение стандартных протоколов эндодонтического лечения не всегда может обеспечить надлежащую очистку подобной периапикальной дельты.
Фото 2a-b. Сложное строение системы корневых каналов мезиальных корней нижних моляров.


Клинический случай 1
58-летний пациент мужского пола с наличием рака щитовидной железы в анамнезе был направлен к стоматологу с диагнозом рецидивирующего эндодонтического поражения в области правого второго моляр нижней челюсти. Повторное эндодонтического лечение было инициировано лечащим стоматологом пациента. Пациент жаловался на болезненность во время перкуссии. Несмотря на то, что предыдущий врач проводил какие-то манипуляции, состояние пациента за последнее время заметно не улучшалось. Чрезмерного окллюзионного контакта в области проблемного зуба не отмечалось. Глубина пародонтального зондирования вокруг зуба демонстрировала нормальные показатели, а в ходе трансиллюминационной диагностики признаков перелома зуба обнаружено не было. Пациенту был поставлен диагноз периапикального периодонтита. Данные КЛКТ также подтвердили отсутствие перелома зуба и адекватный уровень обтурации имеющихся корневых каналов (фото 3).
Фото 3. КЛКТ-срезы.

После выполнения анестезии эндодонтическое лечение зуба проводилось в соответствии с протоколом радиальной апикальной очистки (РАО), после чего эндопространство выполняли гидроксидом кальция (фото 4а-с).
Фото 4a-c. a) рентгенограмма до лечения; b) вид после лечения; c) вид через 1,5 года после лечения.

Также пациенту был предписан прием амоксициллина (500 мг, три раза в день на протяжении 7 дней). В ходе второго визита зуб уже не демонстриовал никаких симптомов, и был обтурирован посредством биокерамического силлера (EndoSequence BC Sealer and Points, Brasseler) и гуттаперчевого мастер-штифта. Через 1,5 года наблюдения зуб являлся полностью функциональным и оставался бессимптомным, клинических признаков поражения не отмечалось, а рентгенологически было зарегистрировано заживление периапикального очага поражения. В дальнейшем зуб подлежал реставрации с применением коронки.
Клинический случай 2
У 77-летней пациентки появились боли и отек в области первого моляра нижней челюсти слева. Ранее данный зуб был пролечен эндодонтически дважды (фото 5a и b).
Фото 5a-b. Рентгенограммы, полученные от врача-эндодонтиста.

В ходе клинического осмотра отек был идентифицирован в проекции слизисто-щечной складки, а зуб демонстрировал позитивную реакцию на перкуссию. В ходе пародонтального зондирования был обнаружен узкий 7 мм канал со щечной стороны медиального корня. В ходе использования трансиллюминации, как метода диагностики, признаков перелома зуба обнаружено не было. Данные рентгенологического обследования свидетельствовали о наличие J-образной рентгенпрозрачности в области мезильного корня, а также небольшой зоны поражений в области дистального корня (фото 6).
Фото 6. КЛКТ срезы: визуализация J-образного поражения в области мезиального и дистального корней.

Пациенту был поставлен диагноз симптоматического периапикального периодонтита с формированием свища со щечной стороны. После выполнения анестезии зуб был эндодонтически пролечен согласно протоколу РАО, после чего эндопространство выполнили пастой на основе гидроксида кальция (фото 7a-d).
Фото 7a-d. a) рентгенограмма до лечения; b) повязка из кальций гидроксида; c) вид после лечения; d) вид через 9 месяцев после завершения лечения.

Также пациенту был предписан прием амоксициллина (500 мг, три раза в день на протяжении 7 дней). В ходе второго визита зуб уже не демонстриовал никаких симптомов, и был обтурирован посредством биокерамического силлера (EndoSequence BC Sealer and Points, Brasseler) и гуттаперчевого мастер-штифта. В ходе повторного осмотра через десять месяцев показатели пародонологического зондирования были в норме, зуб был полностью функциональным и не демонстрировал никаких признаков поражения, при этом на рентгеновском снимке отмечалось заживление периапикального очага поражения.
Радиальная апикальная очистка (РАО)
РАО представляет собой протокол лечения, который обеспечивает отличную очистку и дезинфекцию корневых каналов сложного анатомического строения, с применением в этих целях методов хемомеханической и лазерной обработки. Протокол включается следующие этапы:
Инструментальная обработка:
- формирование ковровой дорожки с использованием ручных и роторных файлов 0,06 и 0,08 размеров;
- обработка апикальной части канала разогретыми никель-титановыми файлами с сохранением структур корня в корональной трети и пришеечной области;
Ирригация:
- эффективная ирригация апикальной части канала с негативным давлением посредством системы (KaVo Kerr) и 6% раствора гипохлорита натрия (NaOCl);
- звуковая активация ирриганта;
Очистка:
- активация ирриганта посредством лазера Er, Cr: YSGG (Waterlase iPlus, BIOLASE) с насадками RFT2 и RFT3 и следующими настройками системы: 1,25 Вт, режим 20 Гц (импульсов в секунду), 30% воздуха, 10% воды и 62,5 мДж/импульс;
Дезинфекция:
- лазерная дезинфекция выполняется с помощью лазера Er, Cr: YSGG (Waterlase iPlus) с использованием наконечников RFT2 и RFT3 laser и следующими настройками системы: 1 Вт, режим H, 20 Гц (импульсов в секунду), 10% воздуха, 0% воды и 50 мДж / импульс;
- глубокая дезинфекция дентина проводится диодным лазером с длиной волны 940 нм (Epic X, BIOLASE) с использованием неактивированного наконечника на мощности 1 Вт в режиме непрерывной волны во влажном канале. В идеале, как для чистки, так и для дезинфекции каналов, лазерный наконечник должен быть на 1 мм короче рабочей длины и активироваться в ходе его извлечения из эндопространства круговыми движениями со скоростью 1-2 мм в секунду. Данный этап повторяется по четыре раза в каждом канале. Позиционирование лазерного наконечника зависит от анатомии корневого канала, диаметра эндопространства и факта наличия/отсутствия его проходимости. Эффективность использования лазерного наконечника сохраняется даже при 5 мм расстоянии от апикального отверстия.
Эрбиевые лазеры в эндодонтии
Эрбиевые лазеры характеризуются самой востребованной длиной волны для применения в эндодонтическом лечении. Данный тип лазеров может быть использован как при работе с мягкими, так и с твердым тканями, и характеризуется самим большим количеством официальных разрешений от FDA для выполнения разных стоматологических процедур. Первичными хромофорами эрбиевых лазеров являются вода, и в меньше степени – гидроксиапатит. При работе с мягкими тканями эрбиевые лазеры характеризуются преимущественно фототермическим механизмом взаимодействия, при работе с твёрдыми тканями – фотодеструктивным. При соблюдении необходимых параметров процесс терморелаксации проходит без каких либо нарушений с минимальным коллатеральным повреждением окружающих тканей.
Действие в системах корневых каналов
При активации лазера в присутствии воды происходит мгновенное испарение, при котором формируются пузырьки воздуха на кончике наконечника (фото 8). Быстро расширяющиеся и вздувающиеся пузырьки создают эффект кавитации, который также ассоциирован с ускорением водяных потоков в структуре эндопространства. Все это приводит к развитию напряжения сдвига вдоль стенки канала. Вторичные эффекты кавитации также способствуют очистке и стерилизации эндопространства. На границах жидкость-твердое тело (стенки канала) микроскопические пузырьки генерируются силами сдвига от проходящей акустической волны, что приводит к эффекту микропотока и микрокавитации, который обеспечивает проникновение раствора в дентинные канальцы и микроскопические ответвления (фото 9). Расширение и коллапс жидкости, которая находится внутри дентинных тубул достигает глубины 1000 мкм и более, чего вполне достаточно чтобы разрушить биопленку и уничтожить бактерии.
Фото 8. Формирование и разрыв воздушного пузыря под действием лазера.

Фото 9. Эффекты микропотока и микрокавитации на границе раствора и твердых стенок корня.

Обсуждение
Эндодонтическая патология провоцируется наличием бактериальной биопленки, следовательно, успех эндодонтического лечения зависит от возможности данную биопленку удалить и обеспечить очистку эндопространства от бактериальной контаминации. Для достижения этой цели в эндодонтии используют комплекс методов хемомеханической очистки каналов, но из-за сложности анатомии до 30-45% эндодонтического пространства все равно остается по больше мере не тронутым ни раствором ирриганта, ни режущими гранями файла. С другой стороны, чрезмерная хемомеханическая очистка эндопространства может привести к биомеханическому ослаблению зуба, и может спровоцировать развитие апикальной трещины. В результате получается так, что стоматолог в ходе эндодонтического лечения обеспечивает больше удаление именно планктонных форм бактерий, нежели тех, которые входят в состав биопленки, а резистентность таковых к действию антибактериальных агентов больше в 1000 раз по сравнению с теми, которые находятся в свободном состоянии (состоянии планктона). Результаты предыдущих исследований свидетельствуют о том, что инструментальная обработка и ирригация канала раствором NaOCl позволяет уничтожить до 50–75% бактерий в структуре эндопространства, при этом оставшиеся бактерии могут быть элиминированы или самим организмом, или же оставаться в неактивном состоянии до наступления благоприятных для них условий. В своем исследовании Nair и коллеги показали, что 88% эндодонтически пролеченных моляров нижней челюсти демонстрировали наличие остаточной инфекции в системе мезиальных каналов даже после выполнения инструментальной обработки, ирригации NaOCl и обтурации. Для того, чтобы очистка канала была эффективной, необходимо добиться его обработки вплоть до апикального отверстия. Chow установил, что эффект «вымывания» вдали от отверстия эндодонтической иглы по сути является минимальным, следовательно, дабы повысить эффективность такового целесообразно использовать дополнительное негативное давление.
С другой стороны, обеспечить ирригацию с использованием негативного давления в условиях реализации принципов мини-инвазивной эндодонтии достаточно сложно и крайне затруднительно. Активация ирригационного раствора посредством лазера вызывает генерирование напряжения вдоль стенок канала, которое способствует разрушению имеющейся биопленки, тем самым обеспечивая переход бактерий в планктонное состояние. Данный механизм разрушения биопленки может быть обоснован за счет нарушения когезионных связей между слоями бактерий, или же адгезивных связей между бактериями и стенками канала. В любом случае бактерии в состоянии планктона более чувствительны к действию ирригационных растворов, которые формируют поры в их мембране и провоцируют деструкцию клеток микроорганизмов.
Если же сформированных напряжений вдоль стенки канала недостаточно для того, чтобы разрушить биопленку, она попросту деформируется и со временем переходит в исходное состояние. Активация ирригационных растворов посредством лазера также способствует удалению смазанного слоя и дентинных пробок, тем самым обеспечивая условия для достижения полной проходимости канала. Удаление апикальной воздушной пробки также является одним из преимуществ использования лазера в ходе эндодонтического лечения. Дезинфекция корневого канала в структуре протокола РАО обеспечивается за счет эрбиевого лазера Er, Cr: YSGG в сухих условиях. Энергия лазера вызывает абляцию биопленки и микроорганизмов за счет мгновенного испарения воды. Таким образом удается достичь дезинфекции канала на глубине дентина до 200 микрон. О возможностях более глубокого уровня дезинфекции было описано при применении диодного лазера в лабораторных условиях. Первичными хромофорами для диодного лазера являются пигменты (меланин и гемоглобин) и, в меньшей степени, вода. Это способствует более глубокому проникновению света через структуру дентина без нарушения его структуры, но обеспечением уничтожения всех микроорганизмов в дентинных канальцах.
Выводы
Проблема рефрактерной эндодонтической патологии была резюмирована Ricucci следующим образом: «Мы должны разработать стратегии, инструменты и медикаментозные агенты, которые бы позволили нам эффективно работать с контаминацией в глубине корневого канала для того, чтобы снизить уровень бактериальной нагрузки настолько, что она станет преодолимой для организма, после чего мы сможем обеспечивать заживления участков периапикальных патологий». Протокол лечения РАО разработан для нехирургической терапии рефрактерных эндодонтических поражений, и предполагает синергетическое использование лазерной активации Er,Cr:YSGG и негативного давления при ирригации эндопространства 6% раствором гипохлорита натрия. Такой подход позволяет разрушить биопленку и обеспечивает очистку дентинных канальцев, тем самым максимизируя эффект хемомеханической дезинфекции. Хотя в некоторых литературных источниках рефрактерная эндодонтическая патология ассоциируется cо специфическим видом резистентной микрофлоры, но, по нашему мнению, основная проблема состоит в успешной очистке эндопространства, с которой подход РАО может успешно справиться. Основным изменением по отношению к классическому протоколу эндодонтического лечения является использование лазерных технологий в ходе очистки и дезинфекции эндодонтического пространства.
Автор: Dr Justin Kolnick (частная практика, Нью-Йорк, США)





























































































































































0 комментариев