Аутологичные концентраты факторов свертываемости крови (АВС), частности обогащенная тромбоцитами плазма (БоТП), впервые были описаны в литературе 60 лет назад. С тех пор методы получения БоТП из крови пациента неуклонно развивались с целью создания более качественных продуктов с более эффективными клиническими результатами. Ключом к эволюции протокола стала разработка компонентов плазмы с более высоким содержанием тромбоцитов и других компонентов крови, которые улучшают заживление мягких и твердых тканей и, следовательно, регенерацию. Авторы представляют протокол получения БоТП с высокой концентрацией тромбоцитов и аутогенного тромбина. Этот протокол пятого поколения позволяет произвести богатую тромбоцитами плазму, в шесть раз превышающую по концентрации массу тромбоцитов в исходном материале. Данный метод получения БоТП при помощи двойного центрифугирования относительно прост и недорог, поскольку он не требует специального оборудования или передовых технических знаний от практикующего врача и может быть легко проведен в частной стоматологической клинике.
В 1980-х годах в нескольких исследованиях была описана ключевая роль кислорода в заживлении ран, так выявлены факторы роста, способствующие заживлению, в ответ на реакцию макрофагов вызванную повышением градиента кислорода, которые в свою очередь, секретируют факторы роста способствуя заживлению ран.
Фактор заживления ран, полученный из тромбоцитов, был впервые введен в клиническую практику, а разработка БоТП продолжилась и использовалась более двух десятилетий для запуска процесса заживления ран. Было обнаружено, что тромбоциты, высвобождающие тромбин, стимулируют синтез коллагена с фибрином, высвобождая клеточный экссудат, сопровождающийся ангиогенезом. В начале 1990-х годов Маркс и Гарг начали работу с образцом взятой у пациента крови, используемой как источник синтеза фибрина, путем смешивания с костными трансплантатами для улучшения адгезии костных мембран, такой фибриновый клей был представлен в 1994 году.
Тромбоциты секретируют факторы роста (производные тромбоцитов факторы роста PDGF-AA, PDGF-BB и PDGF-AB), которые стимулируют мезенхимальные стволовые клетки к репликации твердых и мягких тканей, остеобласты к репликации и производству остеоидов, эндотелиальные клетки к репликации, секретирующие базальную пластинку для новых кровеносных сосудов, и фибробласты к репликации, продуцирующие коллаген. Кроме того, присутствуют трансформирующие факторы роста (TGF-β1 и TGF-β2) и костный морфогенный белок, которые стимулируют выработку матрикса и направляют дифференцировку клеток в кости. Другие факторы, присутствующие в концентратах аутологичной крови, включают фактор роста эндотелия сосудов, который поддерживает развитие новых кровеносных сосудов, и фактор роста эпителия, который стимулирует миграцию окружающих мягких тканей, чтобы покрыть поврежденную область и сформировать базальную мембрану. Включение в материал для трансплантата специфических факторов свертывания крови (АВС), таких как обогащенная тромбоцитами плазмацитарная масса в виде частиц обеспечивает выработку факторов роста для ускорения приживления трансплантата, стимулируя клетки-хозяева, прилегающие к трансплантату, к трансформации в нативную кость. При использовании мембран, полученных из плазмы крови можно ожидать ускоренного закрытия раны мягкими тканями при использовании собственных факторов пациента в качестве стимулирующего механизма.
Производство факторов свертывания
Обогащенная тромбоцитами плазма представляет собой фракцию плазмы, содержащую тромбоциты и лейкоциты, полученную путем центрифугирования части цельной крови при 200 RCF (относительная сила центрифугирования) в течение 10 минут. После центрифугирования собирают верхнюю часть эритроцитов в пробирке, включая зону охристого покрытия, которая добавляется к лейкоцитарной фракции образца плазмы крови. Для облегчения и обеспечения того, чтобы присутствующие в образце факторы роста могли высвобождаться в желаемом месте, получают гель путем добавления аутологичного тромбина или просто 10% глюконата кальция в концентрат плазмы крови пробирку, когда кровь собирается в процессе флеботомии. Этот метод широко распространен и используется на международном уровне, он показал свою эффективность в нескольких областях медицины, в частности в стоматологии.
В 2001 году Choukroun и соавт. разработали простой протокол для получения агрегата тромбоцитов, аналогичного БоТП, использованием только цельной крови, без добавления антикоагулянтов. Полученный фибриновый гель назвали обогащенным тромбоцитами фибрином (PRF). Протокол Choukroun, называемый протоколом второго поколения, был очень простым и предусматривал центрифугирование образца цельной крови без антикоагулянтов сразу после его сбора в серологической центрифуге в течение 10 минут при 400 RCF. При такой скорости центрифугирования тромбоциты расслаиваются на фракции, во время их расслоения из клеток высвобождается тромбопластин, и в конце центрифугирования образуется фракция сгустка внутри пробирки, в результате более тяжелые части крови остаются на дне пробирки, а легкие частицы в виде плазмы, тромбоцитов и лейкоцитов со дна всплывают на поверхность. Использование данной методики позволяет подучить коогулят без добавления тромбина и глюконата кальция. Данный метод может быть использован для получения однородных мембран, содержащих фибрин, факторы роста и лейкоциты. Полученные таким образом мембраны могут быть сшиты или разделены на мелкие кусочки или добавлены к костному материалу для трансплантации биоптата плазмы крови, его явное преимущество в том, что данный материал можно смешивать с частицами костного трансплантата или биоматериалами, подлежащими трансплантации, для образования консистенции, подобной сметане, что невозможно при использовании других мембран.
В работах Choukroun и соавт. Было описано несколько протоколов с разными скоростями и временем процесса центрифугирования. , в которых предлагалось несколько вариантов использования полученного агрегата тромбоцитов. этих статьях, по большей части, не объяснялось, что g-force используется путем ограничения оборотов (оборотов в минуту) и времени. Известно, что g-сила (которая получается при центрифугировании) зависит от частоты вращения, времени центрифугирования и радиуса центрифуги. Таким образом, формула для этого расчета такова: RCF = 1,12 x радиус x (об/мин/1000)2.
На рынке представлены различные лабораторные центрифуги. Некоторые состоят из вращающейся центральной части, в которой размещены центрифугируемые пробирки, фиксирующие их в положении с фиксированным углом (центрифуга с фиксированным углом). В других центрифугах трубка помещается в фиксированное вертикальное положение (с целью уменьшения размера системы) и не допускает перемещения трубки во время вращения (вертикальная трубчатая центрифуга). Центрифуги третьего типа позволяют размещать пробирки в горизонтальном направлении во время центрифугирования с использованием поворотного ковша, в который трубки загружаются вертикально и возвращаются в вертикальное положение после завершения горизонтального центрифугирования (центрифуга с поворотным ковшом или горизонтальная центрифуга.
Направление трубки во время центрифугирования также определяет, как факторы свертывания будут разделены и на качественное разделение слоев между собой. Центрифуга с фиксированным углом наклона приведет к образованию слоев внутри трубки под углом; желаемое разделение слоев для извлечения из трубки для клинического использования в хирургических и косметических целях получится не вполне приемлемым. Вертикальное центрифугирование крови приводит к образованию вертикальных фракций, что затрудняет выделение нужных слоев, в отличии от систем с фиксированным углом наклона пробирок. Горизонтальное центрифугирование приводит к получению пробирок с горизонтальными слоями, что облегчает извлечение из пробирки и позволяет легче различать слои. Также горизонтальное центрифугирование позволяет получить самый стабильный и объёмный слой геля. Нужно учитывать, что при центрифугировании с фиксированным углом барьерный слой геля образуется под углом 45 градусов к пробирке, поэтому тот же объем геля должен заполнять собой площадь на 40% больше поверхности, по сравнению с горизонтальной центрифугой.
Радиус (расстояние между центральным винтом люльки центрифуги и трубкой) можно измерить несколькими способами. Его можно измерить от центрального винта до нижней части трубки (максимальный радиус, Rmax), середины трубки (или второй трети) или крышки трубки (минимальный радиус, Rmin). Это позволяет получать три различных значения g-силы в одной и той же системе в зависимости от измеряемого расстояния и типа используемой центрифуги. Если эти значения применить к формуле, описанной выше, результатом будут три разных числа оборотов в минуту. Эти различия никогда не рассматривались (или не описывались) в литературе, что может вызвать путаницу у профессионалов, пытающихся воспроизвести на своем собственном оборудовании протоколы, предложенные Choukroun и соавт. Наконец, еще одним фактором, требующим внимания, является объем образца крови в каждой пробирке; хотя сами по себе пробирки имеют одинаковый размер ( объёмную емкость), вакуумный насос не всегда забирает одинаковый объем крови. Подобная информация должна быть освящена дополнительно в публикуемых исследованиях, особенно в тех, где авторы проводят сравнительный анализ различных методов, для получения однородных результатов.
Новые протоколы
С момента первой публикации об использовании костных трансплантатов в 1999 году были предприняты попытки создать протоколы, которые можно было бы воспроизвести без необходимости использования специального оборудования с особыми характеристиками и входными данными. По существу, данные протоколы можно было бы воспроизвести используя обычные центрифуги с обычными входными данными для обеспечения желаемых результатов для разделения элементов крови. Представленные здесь протоколы можно использовать с обычными центрифугами, поскольку инструкции соответствуют их техническим характеристикам. В этих протоколах измеряется радиус центрифуги от центрального винта до дна пробирки. Протокол третьего поколения, опубликованный в 2017 году, позволяет получать обогащенную тромбоцитами плазму крови в жидкой форме (то есть БоТП в форме для инъекций), которую затем можно смешивать с биоматериалами или частицами кости для формирования компактного, податливого и пакуемого трансплантата, который называют "липкой костью" или костным блоком. Эти протоколы также могут быть применены для достижения большего количества фракций элементов свёртывания крови или выделения концентрата фактора роста (CGF) из биоптата.
Метод выделения БоТП третьего поколения
В этом протоколе третьего поколения кровь собирается в четыре вакуумные пробирки объемом 10 мл (например, BD Vacutainer Red Cap, Becton, Dickinson and Company; Трубки Streck BCT, Streck; трубки AlphaLab, AlphaProMed) без каких-либо добавок в тюбике. Пробирки немедленно помещают в обычную гематологическую центрифугу и вращают при 600 RCF в течение 3 минут. После центрифугирования пробирки извлекаются из центрифуги, и кровь теперь отделяется внутри пробирок, оставляя эритроциты в нижней части пробирки, белую промежуточную часть, содержащую лейкоциты и стволовые клетки CD (кластер протокола дифференцировки), и желтую верхнюю часть, содержащую тромбоциты и плазмы (Фото 1).
Фото 1. Слои, полученные после центрифугирования пробирки, содержащей взятую у пациента кровь: желтая часть = плазма и тромбоциты (~55%); белая часть = охристая оболочка (лейкоциты) (~4%); красная часть = эритроциты (~41%).

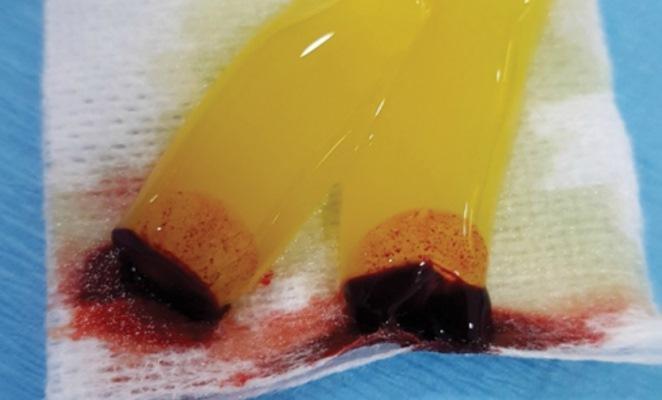
Две пробирки вскрывают и всю верхнюю желтую фракцию вместе с небольшой частью белой фракции, которая остается в жидком состоянии (И-БоТП), немедленно собирают шприцем объемом 5 мл (например, BD Luer-Lok, Becton, Dickinson and Company; шприц Hamilton, Sigma-Aldrich, Inc.; SOL-CARE, Sol-Millennium Medical Group), и содержимое немедленно добавляется в сосуд, содержащий материал для костного трансплантата, который будет использоваться (Фото 2).
Фото 2. После центрифугирования желтая жидкость набирается в шприц и данную субстанцию принято называть Инфекционную обогащенную тромбоцитами плазму (И-БоТП). Как показано на фото И-БоТП помещают в стерильную чашку с частицами костного трансплантата и оставляют для соединения между собой примерно на 10 минут.
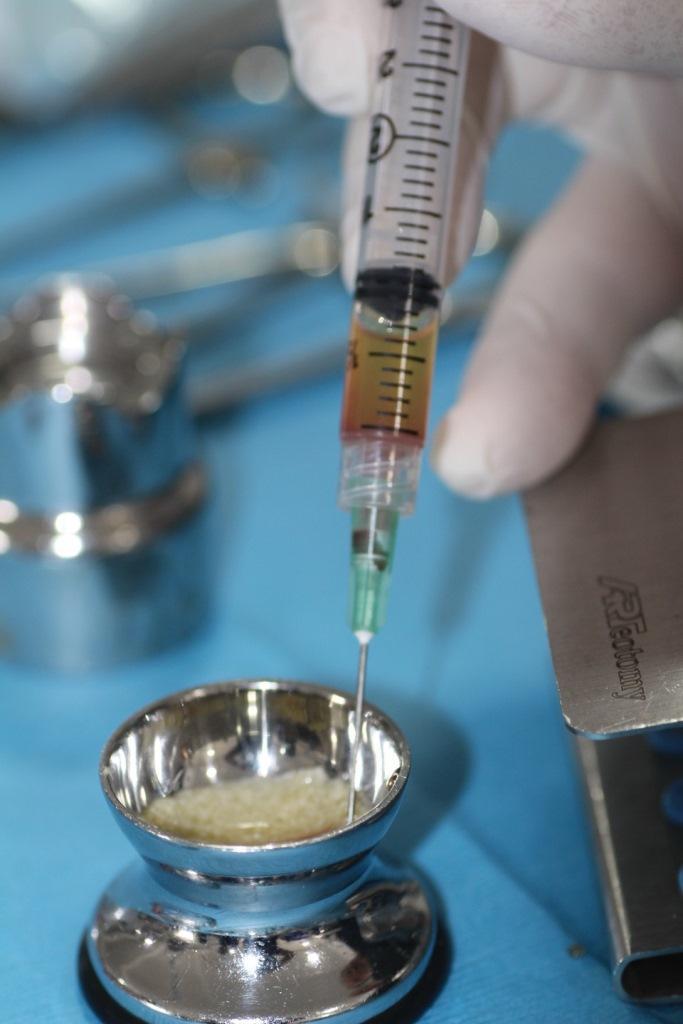
Частицы И-БоТП и костного трансплантата оставляют на 10 минут для адгезии между собой (Фото 3).
Фото 3. Образование клейкой костной ткани после слияния частиц И-БоТП и костного трансплантата.
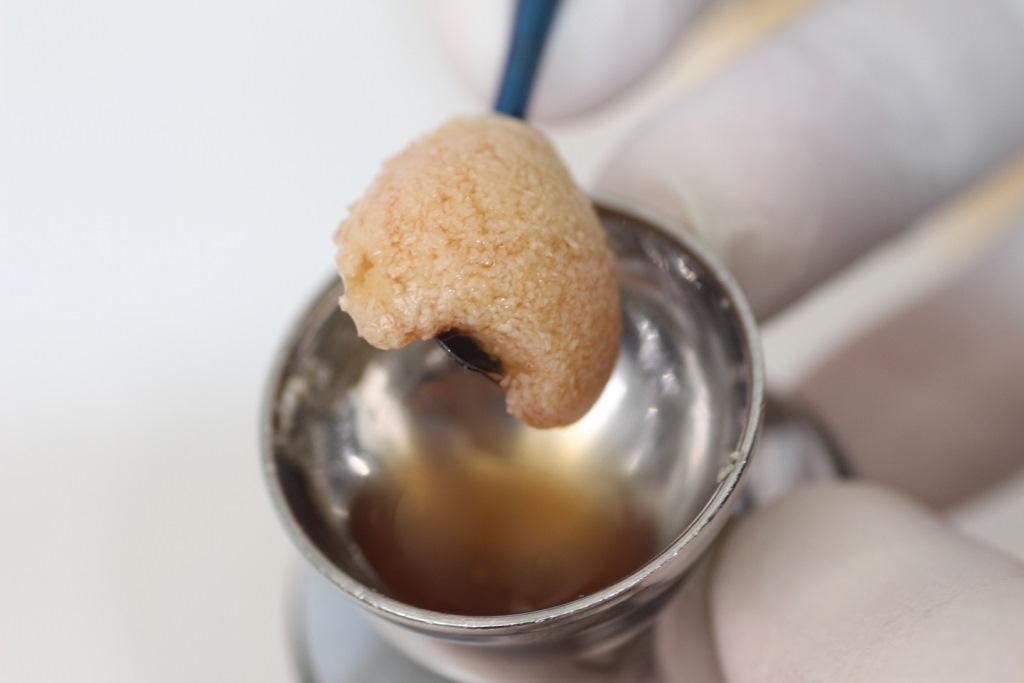
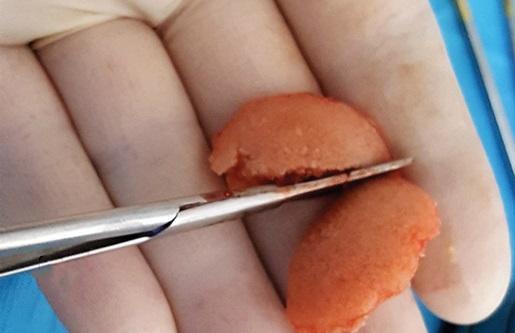
В результате получается застывшая масса, называемая "клейкая кость", которую можно разрезать на кусочки подходящего размера для предполагаемого применения (Фото 4).
Фото 4. Полученную клейкую кость можно сегментировать на образцы, соответствующего операционному полу размера, в которое затем кость будет помещена.
Белая часть центрифугированной крови (т.е. охристая оболочка) содержит моноциты, которые представляют собой мезенхимальные стволовые клетки, присутствующие в крови (CD34), и факторы роста, которые высвобождаются тромбоцитами, которые будут дифференцировать остеобласты. Добавление этой белой порции было предложено в первоначальном протоколе авторов 1999 года, наряду с центрифугированием на более низких скоростях и с меньшим показателем силы-q.
Две другие пробирки помещают в стойку для пробирок и выдерживают около 10 минут, чтобы обеспечить образование мембран обогащенной плазмы крови. После удаления коагулированной части мембраны из пробирок, которые оставались в покое (Фото 5), слой, состоящий из эритроцитов, остается жидким (не коагулированным) (Фото 6), демонстрируя, что тромбоциты находились только в верхней части пробирки, где они перешли из состояния гранул и образовали мембрану богатой тромбоцитами плазмы (Фото 7). Данное состояние отличает конечный продукт от жидкого фибрина обогащенного тромбоцитами (PRF), где тромбоциты находятся как в верхней, так и в нижней части пробирки, что приводит к полной коагуляции. Таким образом, с применении данной методики, можно заполучить большее количество тромбоцитов в образце, создавая мембрану большего объема и лучшего качества.
Фото 5. Разделение слоев после центрифугирования отстаивания пробирки в состоянии покоя, в результате в верхней части пробирки образуется слой обогащенной тромбоцитами плазматической мембраны.
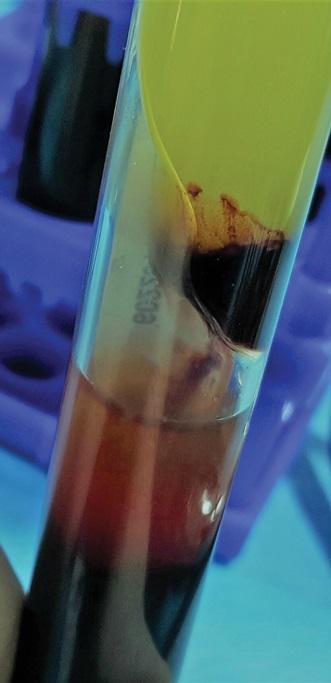
Фото 6. Эритроциты находятся в жидком состоянии в нижней части пробирки.

Фото 7. Мембраны БоТП прохождения цикла двойного центрифугирования и извлечения вещества из пробирок.
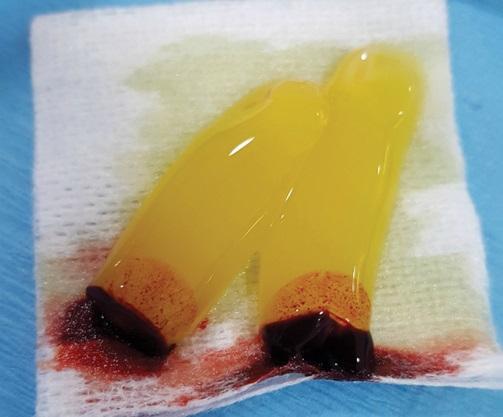
Применение данного метода для получения И-БоТП, вязкого костного материала и обогащенных тромбацитарной массой мембран, которые можно хирургически сшивать между собой, это довольно легко реализуемое решение в клинических условиях. Метод позволяет получить пакуемый костный трансплантат который обеспечивает большую стабильность используемого биоматериала и биологических мембран, которые улучшают заживление мягких тканей и костей за счет собственных факторов роста пациента, содержащихся в полученных материалах. Содержащиеся факторы роста, а также другие компоненты, полученные от пациента, улучшают первичное закрытие раны и заживление мягких тканей. В литературе поддерживается мнение, что в сравнение с костными блоками смешанными с физиологическим раствором или кровью, полученная БоТП пакуемая костная ткань является превосходным материалом для трансплантации, обладающим как остеокондуктивными, так и остеоиндуктивными свойствами, вызывая при этом наименьший иммунологический ответ и улучшает дальнейший клинический результат.
Протоколы получения БоТП пятого поколения
В то время как протокол третьего поколения используется для получения БоТП в жидком состоянии, а представленный протокол четвертого поколения подходит только для получения мембран, протокол пятого поколения (5G) нацелен на получение БоТП с высокой концентрацией тромбоцитов и аутогенного тромбина. Данный протокол 5G позволяет получить обогащенную тромбоцитами плазму, концентрация тромбоцитов в биоптате в шесть раз выше, чем в исходном сгустке. В протоколах, где используется только одна пробирка с цельной кровью и центрифугируется только один раз, результатом всегда является сгусток, содержащий примерно 90% тромбоцитов в объеме собранной крови. Тромбоциты разрываются во время процесса центрифугирования, что приводит к образованию сгустка в конце или в течение нескольких минут после окончания центрифугирования, в зависимости от используемой силы тяжести. Согласно протоколу 5G, во время флеботомии собирают шесть пробирок крови в пробирки с антикоагулянтом, а тромбоциты отделяют при первом центрифугировании. За этим следует забор тромбоцитов из шести пробирок вместе с плазмой, которую затем помещают в две сухие пробирки и центрифугируют во второй раз. Это приводит к тому, что тромбоциты оказываются на дне пробирки, оставляя всю плазму в верхней части пробирки. Плазму (составляющую от 50% до 70% объема) удаляют, а тромбоциты ресуспендируют в оставшейся плазме, создавая таким образом концентрат с более высоким содержанием тромбоцитов, чем тот, который был в первых шести пробирках.
Протокол 5G конкретно описывается следующим образом. Кровь собирают в шесть вакуумных пробирок объемом 10 мл (например, BD Vacutainer Синий колпачок, пробирки Streck BCT, пробирки AlphaLab) с присутствующим в пробирках антикоагулянтом (10% цитрат натрия) и две вакуумные пробирки (например, BD Vacutainer Красный колпачок, пробирки Streck BCT, пробирки AlphaLab) без добавления какого-либо вещества (Фото 8 А). Пробирки немедленно помещают в обычную гематологическую центрифугу и вращают при центробежной силе 150 RCF относительная величина центробежного ускорения) в течение 15 минут. Когда центрифугирование завершено, пробирки с синими колпачками удаляются; после отделения крови в нижней части пробирки остаются эритроциты, желтая часть, состоящая из плазмы и тромбоцитов, и белый промежуточный слой, содержащий лейкоциты и стволовые клетки (CD34) (Фото 8 B). Содержимое пробирок собирают и помещают в две сухие пробирки (красная крышка) в равных объемах, чтобы уравновесить центрифугу, и снова центрифугируют при 300 RCF в течение 10 минут. Эта процедура перемещает тромбоциты, лейкоциты и стволовые клетки CD34 на дно пробирки, а плазма остается в верхней части пробирки (Фото 8 C). Таким образом, теперь собрано от 50% до 80% плазмы, а оставшаяся часть остается в пробирке (Фото 8 D). Эту плазму можно использовать для получения фибринового альбуминового геля, если нагреть биоптат при 75°C в течение 15 минут. Остаток в пробирке затем осторожно встряхивают вручную, чтобы собрать остаток тромбоцитов и подучить концентрированную плазму БоТП (Фото 8 Е).
Фото 8
А. Протокол получения обогащенной тромбоцитами плазмы пятого поколения (5G). Шаг 1: После сбора крови в вакуумную пробирку происходит первое вращение центрифуги (усилие 150 g в течение 15 минут) разделяет кровь на три слоя.
В. Показана разделенная на фракции плазма крови: эритроциты (нижняя часть пробирки, красная), лейкоциты (средняя часть пробирки, белая) и плазма с тромбоцитами (верхняя часть пробирки, желтая).
C. Шаг 2: Желтую порцию материала извлекают из пробирки с с синей крышкой и помещают в сухую стерильную пробирку с красной крышкой, затем повторно подвергали центрифугированию при усилии 300 g, в течение 10 минут. После этого второго вращения центрифуги все тромбоциты должны оказаться на дне пробирки.
D. Шаг 3: 50% плазмы удаляют из недавно отфильтрованной пробирки, при этом тромбоциты остаются на дне пробирки.
E. Шаг 4: Пробирку осторожно встряхивают, чтобы собрать оставшиеся в плазме тромбоциты.
При извлечении из центрифуги пробирки с красными колпачками будут коагулированы. Отделившуюся желтую часть удаляют из этих пробирок и помещают в стерильную посуду, где в течение 5-10 минут медленно выделяют жидкую часть, содержащую большой объем аутогенного тромбина. Эта жидкость собирается в шприц и будет использоваться для образования БоТП-геля при необходимости. Во время создания геля к порции обращенной тромбоцитами плазмы добавляют тромбин (в пропорции от 10% до 15%), который можно смешивать с костью или биоматериалами, как было описано ранее, для образования пакуемого костного материала.
Обсуждение
Концентраты аутологичной крови, в частности первый описанный метод получения обогащенной тромбоцитами плазмы был упомянут в литературе более 60 лет назад. С тех пор протоколы получения БоТп постоянно совершенствовались, для получения биоматериалов лучшего качества и достижения более эффективных клинических результатов По мере развития протокола ключевым моментом стала разработка выделенных факторов свёртываемости (ABC) с более высоким содержанием тромбоцитов и других компонентов крови в образце, благодаря чему улучшается заживление мягких и твердых тканей и следовательно, регенерация.
Продолжаются дебаты относительно того, влияют ли изменения в протоколе обработки элементов крови на качественный состав факторов свертываемости в конечном образце. К сожалению протоколы приготовления плазмы крови в настоящее время не стандартизированы. Разность методов, опирающихся на неодинаковые показатели процесса центрифугирования (скорость вращения и время), дают на выходе продукты БоТП с разнящимися характеристиками, касающимися концентрации тромбоцитов и факторов роста, а также активации тромбоцитов. Многочисленные исследования БоТП показали, что внесение плазмы в зону операционного поля или раны является безопасным и эффективным методом стимуляции быстрого заживления мягких тканей, стимулирует рост новой костной ткани. Для приготовления БоТП было разработано множество протоколов с небольшими, но в тоже время существенными различиями между ними.
Исследования показали, что при использовании протокола двойного центрифугирования (5G) образуется биоматериал с более высокой концентрацией тромбоцитов в образце, несмотря на то, что лейкоциты не сохраняют в данном случае. По сравнению с протоколом однократного центрифугирования, этот протокол обеспечивает повышенную активацию и агрегацию тромбоцитов, и, как было описано, концентрация TGF-β1 также выше при данном методе. Обнаружен позитивный процент корреляции между количеством тромбоцитов и концентрацией TGF-β1 относительно коэффициента корреляции Пирсона. Хотя при использовании данного метода двойного центрифугирования крови и происходит преждевременная агрегация тромбоцитов, он по-прежнему представляется эффективным для получения БоТП с высокой концентрацией тромбоцитов и TGF-β1. В то время как уровни TGF-β1 и PDGF выше в препаратах, содержащих лейкоциты, по сравнению с препаратами с меньшим количеством лейкоцитов, но концентрация тромбоцитов является наиболее важным параметром при сравнении различных образцов материала. Данный протокол 5G позволяет извлекать 80% тромбоцитов из цельной крови с увеличением концентрации тромбоцитов в шесть раз по сравнению с однократным центрифугированием, и он обеспечивает самую высокую концентрацию PDGF-BB в активированных фракциях.
Протокол получения БоТП при помощи двойного центрифугирования является относительно простым и недорогим методом получения плазмы, богатой тромбоцитами. Он не требует дорогостоящего оборудования или высоких технических навыков практикующего врача или персонала и может быть легко применен в условиях частной стоматологической клиники.
Заключение
В многочисленных опубликованных исследованиях подтверждается улучшенная регенерация мягких и твердых тканей с использованием концентратов аутологичной крови. Регенерация может быть ускорена с помощью введения факторов роста, полученных из крови пациента, и заживление раны ускоренными темпами, зависящее от концентрации тромбоцитов во внесенном в рану образце БоТП может ожидаться в месте операции. Представленные протоколы пятого поколения увеличивают концентрацию тромбоцитов и факторов роста по сравнению с предыдущими протоколами центрифугирования, обеспечивая тем самым более высокую концентрацию желаемых факторов в месте для улучшения результатов регенерации.
По мере обезвоживания образца трансплантата, можно восполнить объем жидкости используя жидкую фракцию БоТП, для регидратации трансплантата и оставляют некоторый объем жидкости для поддержания. частиц трансплантата. Поскольку идеальное количество факторов роста для данного объема кости до сих пор неизвестно, необходимы дальнейшие исследования, чтобы определить, какое количество лучше всего подходит для каждого типа используемых трансплантатов. Информация и принципы, обсуждаемые в этой статье, также могут быть применены к другим элементам крови (тромбоциты обогащенные фибрином и факторы роста), которые врачи используют в своей практике, не ограничиваясь использованием только БоТП. Понимание типов доступных центрифуг и их влияния на качество получаемых элементов крови может помочь практикующему специалисту в принятии решений относительно выбора центрифуги.
Авторы:
Renato Rossi Jr., DMD, MSc, PhD
Arun K. Garg, DMD
Gregori M. Kurtzman, DDS, MAGD
Аутологичные концентраты факторов свертываемости крови (АВС), частности обогащенная тромбоцитами плазма (БоТП), впервые были описаны в литературе 60 лет назад. С тех пор методы получения БоТП из крови пациента неуклонно развивались с целью создания более качественных продуктов с более эффективными клиническими результатами. Ключом к эволюции протокола стала разработка компонентов плазмы с более высоким содержанием тромбоцитов и других компонентов крови, которые улучшают заживление мягких и твердых тканей и, следовательно, регенерацию. Авторы представляют протокол получения БоТП с высокой концентрацией тромбоцитов и аутогенного тромбина. Этот протокол пятого поколения позволяет произвести богатую тромбоцитами плазму, в шесть раз превышающую по концентрации массу тромбоцитов в исходном материале. Данный метод получения БоТП при помощи двойного центрифугирования относительно прост и недорог, поскольку он не требует специального оборудования или передовых технических знаний от практикующего врача и может быть легко проведен в частной стоматологической клинике.

В 1980-х годах в нескольких исследованиях была описана ключевая роль кислорода в заживлении ран, так выявлены факторы роста, способствующие заживлению, в ответ на реакцию макрофагов вызванную повышением градиента кислорода, которые в свою очередь, секретируют факторы роста способствуя заживлению ран.
Фактор заживления ран, полученный из тромбоцитов, был впервые введен в клиническую практику, а разработка БоТП продолжилась и использовалась более двух десятилетий для запуска процесса заживления ран. Было обнаружено, что тромбоциты, высвобождающие тромбин, стимулируют синтез коллагена с фибрином, высвобождая клеточный экссудат, сопровождающийся ангиогенезом. В начале 1990-х годов Маркс и Гарг начали работу с образцом взятой у пациента крови, используемой как источник синтеза фибрина, путем смешивания с костными трансплантатами для улучшения адгезии костных мембран, такой фибриновый клей был представлен в 1994 году.
Тромбоциты секретируют факторы роста (производные тромбоцитов факторы роста PDGF-AA, PDGF-BB и PDGF-AB), которые стимулируют мезенхимальные стволовые клетки к репликации твердых и мягких тканей, остеобласты к репликации и производству остеоидов, эндотелиальные клетки к репликации, секретирующие базальную пластинку для новых кровеносных сосудов, и фибробласты к репликации, продуцирующие коллаген. Кроме того, присутствуют трансформирующие факторы роста (TGF-β1 и TGF-β2) и костный морфогенный белок, которые стимулируют выработку матрикса и направляют дифференцировку клеток в кости. Другие факторы, присутствующие в концентратах аутологичной крови, включают фактор роста эндотелия сосудов, который поддерживает развитие новых кровеносных сосудов, и фактор роста эпителия, который стимулирует миграцию окружающих мягких тканей, чтобы покрыть поврежденную область и сформировать базальную мембрану. Включение в материал для трансплантата специфических факторов свертывания крови (АВС), таких как обогащенная тромбоцитами плазмацитарная масса в виде частиц обеспечивает выработку факторов роста для ускорения приживления трансплантата, стимулируя клетки-хозяева, прилегающие к трансплантату, к трансформации в нативную кость. При использовании мембран, полученных из плазмы крови можно ожидать ускоренного закрытия раны мягкими тканями при использовании собственных факторов пациента в качестве стимулирующего механизма.
Производство факторов свертывания
Обогащенная тромбоцитами плазма представляет собой фракцию плазмы, содержащую тромбоциты и лейкоциты, полученную путем центрифугирования части цельной крови при 200 RCF (относительная сила центрифугирования) в течение 10 минут. После центрифугирования собирают верхнюю часть эритроцитов в пробирке, включая зону охристого покрытия, которая добавляется к лейкоцитарной фракции образца плазмы крови. Для облегчения и обеспечения того, чтобы присутствующие в образце факторы роста могли высвобождаться в желаемом месте, получают гель путем добавления аутологичного тромбина или просто 10% глюконата кальция в концентрат плазмы крови пробирку, когда кровь собирается в процессе флеботомии. Этот метод широко распространен и используется на международном уровне, он показал свою эффективность в нескольких областях медицины, в частности в стоматологии.
В 2001 году Choukroun и соавт. разработали простой протокол для получения агрегата тромбоцитов, аналогичного БоТП, использованием только цельной крови, без добавления антикоагулянтов. Полученный фибриновый гель назвали обогащенным тромбоцитами фибрином (PRF). Протокол Choukroun, называемый протоколом второго поколения, был очень простым и предусматривал центрифугирование образца цельной крови без антикоагулянтов сразу после его сбора в серологической центрифуге в течение 10 минут при 400 RCF. При такой скорости центрифугирования тромбоциты расслаиваются на фракции, во время их расслоения из клеток высвобождается тромбопластин, и в конце центрифугирования образуется фракция сгустка внутри пробирки, в результате более тяжелые части крови остаются на дне пробирки, а легкие частицы в виде плазмы, тромбоцитов и лейкоцитов со дна всплывают на поверхность. Использование данной методики позволяет подучить коогулят без добавления тромбина и глюконата кальция. Данный метод может быть использован для получения однородных мембран, содержащих фибрин, факторы роста и лейкоциты. Полученные таким образом мембраны могут быть сшиты или разделены на мелкие кусочки или добавлены к костному материалу для трансплантации биоптата плазмы крови, его явное преимущество в том, что данный материал можно смешивать с частицами костного трансплантата или биоматериалами, подлежащими трансплантации, для образования консистенции, подобной сметане, что невозможно при использовании других мембран.
В работах Choukroun и соавт. Было описано несколько протоколов с разными скоростями и временем процесса центрифугирования. , в которых предлагалось несколько вариантов использования полученного агрегата тромбоцитов. этих статьях, по большей части, не объяснялось, что g-force используется путем ограничения оборотов (оборотов в минуту) и времени. Известно, что g-сила (которая получается при центрифугировании) зависит от частоты вращения, времени центрифугирования и радиуса центрифуги. Таким образом, формула для этого расчета такова: RCF = 1,12 x радиус x (об/мин/1000)2.
На рынке представлены различные лабораторные центрифуги. Некоторые состоят из вращающейся центральной части, в которой размещены центрифугируемые пробирки, фиксирующие их в положении с фиксированным углом (центрифуга с фиксированным углом). В других центрифугах трубка помещается в фиксированное вертикальное положение (с целью уменьшения размера системы) и не допускает перемещения трубки во время вращения (вертикальная трубчатая центрифуга). Центрифуги третьего типа позволяют размещать пробирки в горизонтальном направлении во время центрифугирования с использованием поворотного ковша, в который трубки загружаются вертикально и возвращаются в вертикальное положение после завершения горизонтального центрифугирования (центрифуга с поворотным ковшом или горизонтальная центрифуга.
Направление трубки во время центрифугирования также определяет, как факторы свертывания будут разделены и на качественное разделение слоев между собой. Центрифуга с фиксированным углом наклона приведет к образованию слоев внутри трубки под углом; желаемое разделение слоев для извлечения из трубки для клинического использования в хирургических и косметических целях получится не вполне приемлемым. Вертикальное центрифугирование крови приводит к образованию вертикальных фракций, что затрудняет выделение нужных слоев, в отличии от систем с фиксированным углом наклона пробирок. Горизонтальное центрифугирование приводит к получению пробирок с горизонтальными слоями, что облегчает извлечение из пробирки и позволяет легче различать слои. Также горизонтальное центрифугирование позволяет получить самый стабильный и объёмный слой геля. Нужно учитывать, что при центрифугировании с фиксированным углом барьерный слой геля образуется под углом 45 градусов к пробирке, поэтому тот же объем геля должен заполнять собой площадь на 40% больше поверхности, по сравнению с горизонтальной центрифугой.
Радиус (расстояние между центральным винтом люльки центрифуги и трубкой) можно измерить несколькими способами. Его можно измерить от центрального винта до нижней части трубки (максимальный радиус, Rmax), середины трубки (или второй трети) или крышки трубки (минимальный радиус, Rmin). Это позволяет получать три различных значения g-силы в одной и той же системе в зависимости от измеряемого расстояния и типа используемой центрифуги. Если эти значения применить к формуле, описанной выше, результатом будут три разных числа оборотов в минуту. Эти различия никогда не рассматривались (или не описывались) в литературе, что может вызвать путаницу у профессионалов, пытающихся воспроизвести на своем собственном оборудовании протоколы, предложенные Choukroun и соавт. Наконец, еще одним фактором, требующим внимания, является объем образца крови в каждой пробирке; хотя сами по себе пробирки имеют одинаковый размер ( объёмную емкость), вакуумный насос не всегда забирает одинаковый объем крови. Подобная информация должна быть освящена дополнительно в публикуемых исследованиях, особенно в тех, где авторы проводят сравнительный анализ различных методов, для получения однородных результатов.
Новые протоколы
С момента первой публикации об использовании костных трансплантатов в 1999 году были предприняты попытки создать протоколы, которые можно было бы воспроизвести без необходимости использования специального оборудования с особыми характеристиками и входными данными. По существу, данные протоколы можно было бы воспроизвести используя обычные центрифуги с обычными входными данными для обеспечения желаемых результатов для разделения элементов крови. Представленные здесь протоколы можно использовать с обычными центрифугами, поскольку инструкции соответствуют их техническим характеристикам. В этих протоколах измеряется радиус центрифуги от центрального винта до дна пробирки. Протокол третьего поколения, опубликованный в 2017 году, позволяет получать обогащенную тромбоцитами плазму крови в жидкой форме (то есть БоТП в форме для инъекций), которую затем можно смешивать с биоматериалами или частицами кости для формирования компактного, податливого и пакуемого трансплантата, который называют "липкой костью" или костным блоком. Эти протоколы также могут быть применены для достижения большего количества фракций элементов свёртывания крови или выделения концентрата фактора роста (CGF) из биоптата.
Метод выделения БоТП третьего поколения
В этом протоколе третьего поколения кровь собирается в четыре вакуумные пробирки объемом 10 мл (например, BD Vacutainer Red Cap, Becton, Dickinson and Company; Трубки Streck BCT, Streck; трубки AlphaLab, AlphaProMed) без каких-либо добавок в тюбике. Пробирки немедленно помещают в обычную гематологическую центрифугу и вращают при 600 RCF в течение 3 минут. После центрифугирования пробирки извлекаются из центрифуги, и кровь теперь отделяется внутри пробирок, оставляя эритроциты в нижней части пробирки, белую промежуточную часть, содержащую лейкоциты и стволовые клетки CD (кластер протокола дифференцировки), и желтую верхнюю часть, содержащую тромбоциты и плазмы (Фото 1).
Фото 1. Слои, полученные после центрифугирования пробирки, содержащей взятую у пациента кровь: желтая часть = плазма и тромбоциты (~55%); белая часть = охристая оболочка (лейкоциты) (~4%); красная часть = эритроциты (~41%).

Две пробирки вскрывают и всю верхнюю желтую фракцию вместе с небольшой частью белой фракции, которая остается в жидком состоянии (И-БоТП), немедленно собирают шприцем объемом 5 мл (например, BD Luer-Lok, Becton, Dickinson and Company; шприц Hamilton, Sigma-Aldrich, Inc.; SOL-CARE, Sol-Millennium Medical Group), и содержимое немедленно добавляется в сосуд, содержащий материал для костного трансплантата, который будет использоваться (Фото 2).
Фото 2. После центрифугирования желтая жидкость набирается в шприц и данную субстанцию принято называть Инфекционную обогащенную тромбоцитами плазму (И-БоТП). Как показано на фото И-БоТП помещают в стерильную чашку с частицами костного трансплантата и оставляют для соединения между собой примерно на 10 минут.

Частицы И-БоТП и костного трансплантата оставляют на 10 минут для адгезии между собой (Фото 3).
Фото 3. Образование клейкой костной ткани после слияния частиц И-БоТП и костного трансплантата.

В результате получается застывшая масса, называемая "клейкая кость", которую можно разрезать на кусочки подходящего размера для предполагаемого применения (Фото 4).
Фото 4. Полученную клейкую кость можно сегментировать на образцы, соответствующего операционному полу размера, в которое затем кость будет помещена.

Белая часть центрифугированной крови (т.е. охристая оболочка) содержит моноциты, которые представляют собой мезенхимальные стволовые клетки, присутствующие в крови (CD34), и факторы роста, которые высвобождаются тромбоцитами, которые будут дифференцировать остеобласты. Добавление этой белой порции было предложено в первоначальном протоколе авторов 1999 года, наряду с центрифугированием на более низких скоростях и с меньшим показателем силы-q.
Две другие пробирки помещают в стойку для пробирок и выдерживают около 10 минут, чтобы обеспечить образование мембран обогащенной плазмы крови. После удаления коагулированной части мембраны из пробирок, которые оставались в покое (Фото 5), слой, состоящий из эритроцитов, остается жидким (не коагулированным) (Фото 6), демонстрируя, что тромбоциты находились только в верхней части пробирки, где они перешли из состояния гранул и образовали мембрану богатой тромбоцитами плазмы (Фото 7). Данное состояние отличает конечный продукт от жидкого фибрина обогащенного тромбоцитами (PRF), где тромбоциты находятся как в верхней, так и в нижней части пробирки, что приводит к полной коагуляции. Таким образом, с применении данной методики, можно заполучить большее количество тромбоцитов в образце, создавая мембрану большего объема и лучшего качества.
Фото 5. Разделение слоев после центрифугирования отстаивания пробирки в состоянии покоя, в результате в верхней части пробирки образуется слой обогащенной тромбоцитами плазматической мембраны.

Фото 6. Эритроциты находятся в жидком состоянии в нижней части пробирки.

Фото 7. Мембраны БоТП прохождения цикла двойного центрифугирования и извлечения вещества из пробирок.

Применение данного метода для получения И-БоТП, вязкого костного материала и обогащенных тромбацитарной массой мембран, которые можно хирургически сшивать между собой, это довольно легко реализуемое решение в клинических условиях. Метод позволяет получить пакуемый костный трансплантат который обеспечивает большую стабильность используемого биоматериала и биологических мембран, которые улучшают заживление мягких тканей и костей за счет собственных факторов роста пациента, содержащихся в полученных материалах. Содержащиеся факторы роста, а также другие компоненты, полученные от пациента, улучшают первичное закрытие раны и заживление мягких тканей. В литературе поддерживается мнение, что в сравнение с костными блоками смешанными с физиологическим раствором или кровью, полученная БоТП пакуемая костная ткань является превосходным материалом для трансплантации, обладающим как остеокондуктивными, так и остеоиндуктивными свойствами, вызывая при этом наименьший иммунологический ответ и улучшает дальнейший клинический результат.
Протоколы получения БоТП пятого поколения
В то время как протокол третьего поколения используется для получения БоТП в жидком состоянии, а представленный протокол четвертого поколения подходит только для получения мембран, протокол пятого поколения (5G) нацелен на получение БоТП с высокой концентрацией тромбоцитов и аутогенного тромбина. Данный протокол 5G позволяет получить обогащенную тромбоцитами плазму, концентрация тромбоцитов в биоптате в шесть раз выше, чем в исходном сгустке. В протоколах, где используется только одна пробирка с цельной кровью и центрифугируется только один раз, результатом всегда является сгусток, содержащий примерно 90% тромбоцитов в объеме собранной крови. Тромбоциты разрываются во время процесса центрифугирования, что приводит к образованию сгустка в конце или в течение нескольких минут после окончания центрифугирования, в зависимости от используемой силы тяжести. Согласно протоколу 5G, во время флеботомии собирают шесть пробирок крови в пробирки с антикоагулянтом, а тромбоциты отделяют при первом центрифугировании. За этим следует забор тромбоцитов из шести пробирок вместе с плазмой, которую затем помещают в две сухие пробирки и центрифугируют во второй раз. Это приводит к тому, что тромбоциты оказываются на дне пробирки, оставляя всю плазму в верхней части пробирки. Плазму (составляющую от 50% до 70% объема) удаляют, а тромбоциты ресуспендируют в оставшейся плазме, создавая таким образом концентрат с более высоким содержанием тромбоцитов, чем тот, который был в первых шести пробирках.
Протокол 5G конкретно описывается следующим образом. Кровь собирают в шесть вакуумных пробирок объемом 10 мл (например, BD Vacutainer Синий колпачок, пробирки Streck BCT, пробирки AlphaLab) с присутствующим в пробирках антикоагулянтом (10% цитрат натрия) и две вакуумные пробирки (например, BD Vacutainer Красный колпачок, пробирки Streck BCT, пробирки AlphaLab) без добавления какого-либо вещества (Фото 8 А). Пробирки немедленно помещают в обычную гематологическую центрифугу и вращают при центробежной силе 150 RCF относительная величина центробежного ускорения) в течение 15 минут. Когда центрифугирование завершено, пробирки с синими колпачками удаляются; после отделения крови в нижней части пробирки остаются эритроциты, желтая часть, состоящая из плазмы и тромбоцитов, и белый промежуточный слой, содержащий лейкоциты и стволовые клетки (CD34) (Фото 8 B). Содержимое пробирок собирают и помещают в две сухие пробирки (красная крышка) в равных объемах, чтобы уравновесить центрифугу, и снова центрифугируют при 300 RCF в течение 10 минут. Эта процедура перемещает тромбоциты, лейкоциты и стволовые клетки CD34 на дно пробирки, а плазма остается в верхней части пробирки (Фото 8 C). Таким образом, теперь собрано от 50% до 80% плазмы, а оставшаяся часть остается в пробирке (Фото 8 D). Эту плазму можно использовать для получения фибринового альбуминового геля, если нагреть биоптат при 75°C в течение 15 минут. Остаток в пробирке затем осторожно встряхивают вручную, чтобы собрать остаток тромбоцитов и подучить концентрированную плазму БоТП (Фото 8 Е).
Фото 8
А. Протокол получения обогащенной тромбоцитами плазмы пятого поколения (5G). Шаг 1: После сбора крови в вакуумную пробирку происходит первое вращение центрифуги (усилие 150 g в течение 15 минут) разделяет кровь на три слоя.
В. Показана разделенная на фракции плазма крови: эритроциты (нижняя часть пробирки, красная), лейкоциты (средняя часть пробирки, белая) и плазма с тромбоцитами (верхняя часть пробирки, желтая).
C. Шаг 2: Желтую порцию материала извлекают из пробирки с с синей крышкой и помещают в сухую стерильную пробирку с красной крышкой, затем повторно подвергали центрифугированию при усилии 300 g, в течение 10 минут. После этого второго вращения центрифуги все тромбоциты должны оказаться на дне пробирки.
D. Шаг 3: 50% плазмы удаляют из недавно отфильтрованной пробирки, при этом тромбоциты остаются на дне пробирки.
E. Шаг 4: Пробирку осторожно встряхивают, чтобы собрать оставшиеся в плазме тромбоциты.

При извлечении из центрифуги пробирки с красными колпачками будут коагулированы. Отделившуюся желтую часть удаляют из этих пробирок и помещают в стерильную посуду, где в течение 5-10 минут медленно выделяют жидкую часть, содержащую большой объем аутогенного тромбина. Эта жидкость собирается в шприц и будет использоваться для образования БоТП-геля при необходимости. Во время создания геля к порции обращенной тромбоцитами плазмы добавляют тромбин (в пропорции от 10% до 15%), который можно смешивать с костью или биоматериалами, как было описано ранее, для образования пакуемого костного материала.
Обсуждение
Концентраты аутологичной крови, в частности первый описанный метод получения обогащенной тромбоцитами плазмы был упомянут в литературе более 60 лет назад. С тех пор протоколы получения БоТп постоянно совершенствовались, для получения биоматериалов лучшего качества и достижения более эффективных клинических результатов По мере развития протокола ключевым моментом стала разработка выделенных факторов свёртываемости (ABC) с более высоким содержанием тромбоцитов и других компонентов крови в образце, благодаря чему улучшается заживление мягких и твердых тканей и следовательно, регенерация.
Продолжаются дебаты относительно того, влияют ли изменения в протоколе обработки элементов крови на качественный состав факторов свертываемости в конечном образце. К сожалению протоколы приготовления плазмы крови в настоящее время не стандартизированы. Разность методов, опирающихся на неодинаковые показатели процесса центрифугирования (скорость вращения и время), дают на выходе продукты БоТП с разнящимися характеристиками, касающимися концентрации тромбоцитов и факторов роста, а также активации тромбоцитов. Многочисленные исследования БоТП показали, что внесение плазмы в зону операционного поля или раны является безопасным и эффективным методом стимуляции быстрого заживления мягких тканей, стимулирует рост новой костной ткани. Для приготовления БоТП было разработано множество протоколов с небольшими, но в тоже время существенными различиями между ними.
Исследования показали, что при использовании протокола двойного центрифугирования (5G) образуется биоматериал с более высокой концентрацией тромбоцитов в образце, несмотря на то, что лейкоциты не сохраняют в данном случае. По сравнению с протоколом однократного центрифугирования, этот протокол обеспечивает повышенную активацию и агрегацию тромбоцитов, и, как было описано, концентрация TGF-β1 также выше при данном методе. Обнаружен позитивный процент корреляции между количеством тромбоцитов и концентрацией TGF-β1 относительно коэффициента корреляции Пирсона. Хотя при использовании данного метода двойного центрифугирования крови и происходит преждевременная агрегация тромбоцитов, он по-прежнему представляется эффективным для получения БоТП с высокой концентрацией тромбоцитов и TGF-β1. В то время как уровни TGF-β1 и PDGF выше в препаратах, содержащих лейкоциты, по сравнению с препаратами с меньшим количеством лейкоцитов, но концентрация тромбоцитов является наиболее важным параметром при сравнении различных образцов материала. Данный протокол 5G позволяет извлекать 80% тромбоцитов из цельной крови с увеличением концентрации тромбоцитов в шесть раз по сравнению с однократным центрифугированием, и он обеспечивает самую высокую концентрацию PDGF-BB в активированных фракциях.
Протокол получения БоТП при помощи двойного центрифугирования является относительно простым и недорогим методом получения плазмы, богатой тромбоцитами. Он не требует дорогостоящего оборудования или высоких технических навыков практикующего врача или персонала и может быть легко применен в условиях частной стоматологической клиники.
Заключение
В многочисленных опубликованных исследованиях подтверждается улучшенная регенерация мягких и твердых тканей с использованием концентратов аутологичной крови. Регенерация может быть ускорена с помощью введения факторов роста, полученных из крови пациента, и заживление раны ускоренными темпами, зависящее от концентрации тромбоцитов во внесенном в рану образце БоТП может ожидаться в месте операции. Представленные протоколы пятого поколения увеличивают концентрацию тромбоцитов и факторов роста по сравнению с предыдущими протоколами центрифугирования, обеспечивая тем самым более высокую концентрацию желаемых факторов в месте для улучшения результатов регенерации.
По мере обезвоживания образца трансплантата, можно восполнить объем жидкости используя жидкую фракцию БоТП, для регидратации трансплантата и оставляют некоторый объем жидкости для поддержания. частиц трансплантата. Поскольку идеальное количество факторов роста для данного объема кости до сих пор неизвестно, необходимы дальнейшие исследования, чтобы определить, какое количество лучше всего подходит для каждого типа используемых трансплантатов. Информация и принципы, обсуждаемые в этой статье, также могут быть применены к другим элементам крови (тромбоциты обогащенные фибрином и факторы роста), которые врачи используют в своей практике, не ограничиваясь использованием только БоТП. Понимание типов доступных центрифуг и их влияния на качество получаемых элементов крови может помочь практикующему специалисту в принятии решений относительно выбора центрифуги.
Авторы:
Renato Rossi Jr., DMD, MSc, PhD
Arun K. Garg, DMD
Gregori M. Kurtzman, DDS, MAGD































































































































































0 комментариев