Верхнечелюстной синусит одонтогенной этиологии, также известен как хронический верхнечелюстной одонтогенный синусит, или одонтогенный верхнечелюстной синусит (ОВС), является довольно распространённой, но в то же время и комплексной патологией ввиду его стоматологических, ЛОР и аллергологических аспектов. Любая патология, связанная с зубами или иными структурами зубочелюстного аппарата, может спровоцировать поражение Шнайдеровой мембраны (ШМ), что, в свою очередь, приводит к развитию нарушений в пространстве гайморовой пазухи. Точная и правильная диагностика патологии верхнечелюстного синуса позволяет избежать необоснованного медикаментозного или хирургического лечения, что, в свою очередь, повышает общий прогноз проведенных терапевтических вмешательств. Цель данной статьи состоит в систематизации информации относительно патофизиологии ОВС, сравнении хронических и острых форм верхнечелюстного синусита, в том числе хронического риносинусита (ХРС) и острого бактериального риносинусита (ОБРС). Также в статье будут рассмотрены аспекты патогенеза и микробиологии ОВС, а также соответствующие им методы эффективного лечения данной патологии.
Хронический и острый риносинусит
Важность правильной диагностики и лечения хронического или острого риносинусита обоснована ассоциациями данных патологий с такими симптомами, как заложенность носа, обструкция носовых дыхательных путей, экссудация и обильные носовые выделения, которые утрудняют дыхание и ухудшают общее самочувствие пациента.
Классификация риносинуситов
Ринит часто путают с риносинуситом, однако на самом деле первая патология ассоциирована с воспалительным процессом внутренней стенки носовой полости, а вторая предполагает еще и воспаление смежных параназальных пазух. Для постановки диагноза риносинусита необходимо наличие как минимум двух из следующих симптомов: обструкция носа, боль в области срединной трети лица, выделение слизисто-гнойного экссудата, снижение чувства обоняния, выраженные признаки воспаления слизистой. Лечение риносинусита зависит от этиологии; в свою очередь, для точной дифференциальной диагностики острой и хронической форм патологии необходимо тщательно проанализировать диагноз пациента, имеющиеся у него симптомы и результаты дополнительных исследований, в том числе и эндоскопических. Первичное лечение можно начать с уже известных и доказательных методов, однако в случаях наличия симптомов, которые не поддаются терапии, врачу нужно направить пациента с целью дополнительной иммунологической диагностики к аллергологу. Острый риносинусит (ОРС) диагностируется по следующим критериям: инфекционная форма ОБРС - наличие гнойного экссудата, обструкции и болевые ощущения на протяжении 4 недель; субострый риносинусит (СРС) – наличие симптомов на протяжении от 4 до 8 недель; ХРС – при наличии симптомов более чем 8 недель подряд независимо от проводимого медикаментозного лечения. Риносинусит также можно классифицировать на аллергический, неаллергический, ассоциированный с родом трудовой деятельности и другие формы.
Мукоцилиарный клиренс как показатель функции ШМ
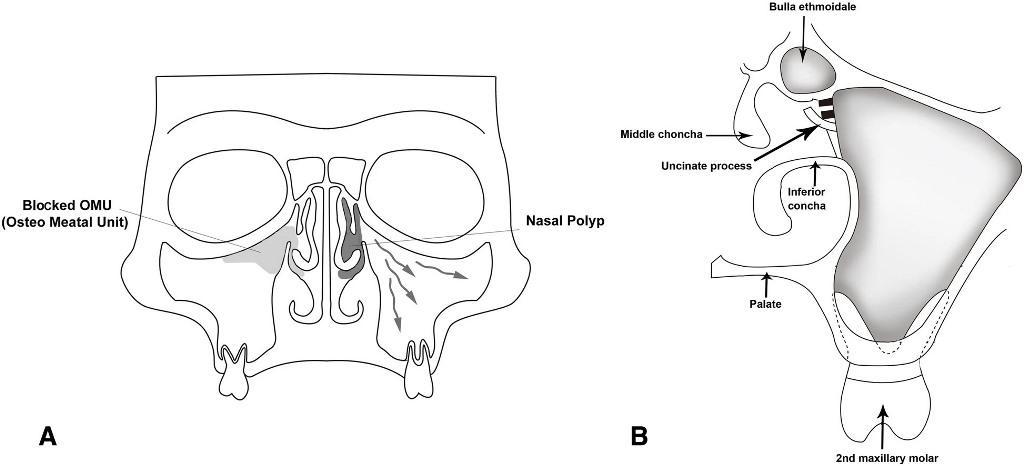
Псевдомногослойный реснитчатый столбчатый эпителий, также известный как шнайдерова мембрана, выстилает внутреннюю поверхность слизистой верхнечелюстного синуса. Клетки Шнайдеровой мембраны продуцируют слизь, которая перемещается в область естественного устья, и, таким образом, обеспечивает дренаж носовой полости под действием гравитации. При этом движения ресничек эпителия в структуре пазухи являются синхронными и скоординированными (фото 1). При движении слизи через назальную полость в носоглотку, она проглатывается человеком, попадая дальше таким образом в пищевод и желудок. Нарушения такого пути движения слизи за счет сниженной активности эпителия или обструкции устья может спровоцировать развитие патологии синуса с ассоциированными симптомами. Естественные выводные отверстия передней решетчатой пазухи, фронтального синуса и гайморовой пазухи выходят близко друг к другу в пространстве среднего носового хода, таким образом формируя так называемый остео-меатальный комплекс (ОМК). Воспаление или блокада ОМК может вызывать развитие или же прогрессирование симптомов синусита с возможностью потенциального воспаления всех околоносовых пазух – пансинусита.
Фото 1. А. Схематический корональный срез взаимоотношения дистальных зубов верхней челюсти с синусовым комплексом. Направление нормальной активности мукоцилиарного эпителия в сторону остеомеатального комплексна отмечено стрелками. При наличии антрохоанальных полипов на передней или медиальной стенках пазухи они будут визуализироваться в форме черных элементов на рентгеновском снимке, в то время как полипы решетчатой пазухи будут выглядеть более серыми. В. Остео-меатальный комплекс с визуализацией средней и нижней носовых раковин, крючковидного отростка и решётчатой буллы.
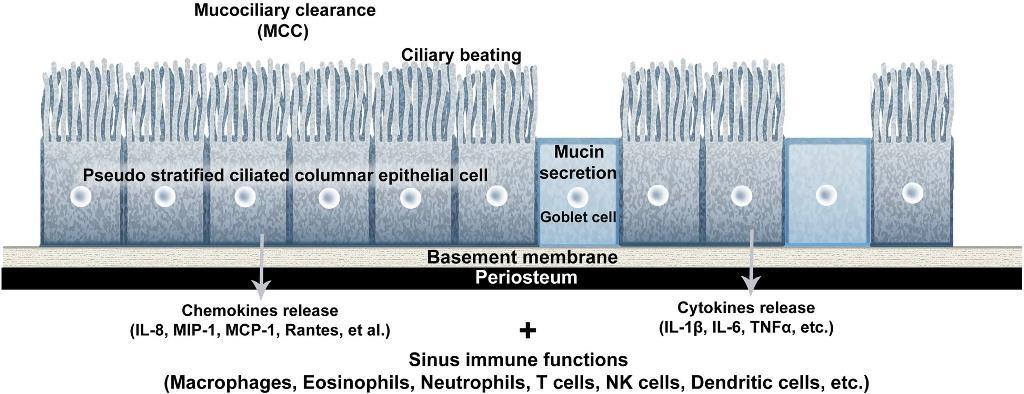
Эпителиальные клетки ШМ играют важную роль в обеспечении мукоцилиарного клиренса (МЦК), обеспечивая проходимость верхних дыхательных путей за счет постоянной миграции слизи со всеми ее возможными составляющими в сторону ротоглотки. Данный механизм также поддерживается секрецией муцина, который выделяется дыхательным эпителием – в таких условиях формируется ионный транспорт жидкостей, благодаря чему слизь поддерживает соответствующий уровень вязкости. В ответ на наличие определенных патогенов эпителием также могут секретироваться специфические хемокины, который запускают механизм иммунного ответа путем активации макрофагов, дендритных клеток, эозинофилов, нейтрофилов, Т-клеток и NK-клеток (фото 2). Такие цитокины, как IL-1β, IL-6, TNFα, IL-8 и хемотаксический белок моноцитов 1 также могут секретироваться дыхательным и реснитчатым эпителием. Эпителиальные клетки ШМ тесно связаны между собой, формируя условный защитный барьер, а мукоцилиарный транспорт обеспечивается за счет формирования реактивных соединений оксигена и нитрогена. Последние выделяются в условиях контроля биохимических процессов такими антимикробными пептидами, как лактотрансферрин, лизоцим и дефензины.
Фото 2. Схематическое изображение механизма мукоцилиарного клиренса псевдомногослойным реснитчатым столбчатым эпителием в пространстве верхнечелюстного синуса. Сокращения: МСС - мукоцилиарный клиренс, МСР-1 - хемотаксический белок 1 моноцитов, МIP-1 - воспалительный белок макрофагов 1, IL - интерлейкин, TNF - фактор некроза опухолей.
Определение и клиническая картина острого бактериального риносинусита (ОБРС)
Основным этиологическим фактором ОБРС является инфицирование нативными бактериями, находящимися в атмосферном воздухе, структур верхних дыхательных путей. Таким образом, первая цель лечения ОБРС состоит в снижении уровня бактериальной инфекции и достижении симптоматического улучшения состояния пациента. Большинство случаев воспалительного синусита, включая ОБРС, развиваются на протяжении 7-10 дней по причине вирусной инфекции. Даже после элиминации вирусной инфекции пациенты с ОБРС могут отмечать наличие болевых ощущений в области лица и заложенность носа с ринореей. Носовой или синусовый стаз может возникнуть из-за сниженной активности мукоцилиарного механизма и слишком высокого положения естественного устья. Иногда имеющиеся этмоидальные или же антрохоанальные полипы, которые, по сути, являются вариациями анатомической структуры, могут усложнять состояние блокады физиологического дренирования пазухи через нижний носовой ход (фото 1). Учитывая вариативность патофизиологических процессов при верхнечелюстном синусите одонтогенной этиологии, стоматологическое лечение следует проводить параллельно с общесоматическим. Обычно пациентам с ОБРС назначают амоксициллин, а с целью диагностики часто используют компьютерную томографию для объективизации состояния пазухи и идентификации возможных осложнений по типу внутричерепных расслоений тканей.
Определение и клиническая картина хронического риносинусита (ХРС)
Типичная картина хронического риносинусита характеризуется наличием более чем двух нижеописанных симптомов на протяжении более 12 недель: боль в области лица при надавливании, снижение обоняния, заложенность носа, ринорея или постоянное выделение экссудата из носовой полости. Боль в области лица при надавливании обычно является тупой и локализируется в области верхней чести щеки с развитием головной боли с той же стороны. Снижение чувства обоняния может быть представлено частичной его потерей – гипосмией, или же полной – тотальной аносмией, и ассоциировано с обструкцией передней слизистой этмоидальной оболочки. Иногда пациенты также могут жаловаться на снижение вкусовой чувствительности, известной как агезия. Заложенность носа характеризуется наличием чувства переполнения носовой полости и ее полной блокадой. Для передней или задней ринореи характерно выделение густого жёлтого или коричневого экссудата. Данный симптом, однако, чаще ассоциирован с ОБРС, чем с ХРС.
Этиология ХЛБ связана с разнообразными анатомическими вариациями и последствием вдыхания инородных тел. На развитие данного состояния также влияют курение, аллергический ринит и социальный статус пациента. Смещение костной перегородки или средних носовых раковин, аномальный размер клеток Галлера или увеличение объема назальных клеток может спровоцировать обструкцию остеомеатального комплекса, что, в свою очередь, может повлиять на развитие хронического риносинусита. Такие химические образования, как диоксид серы, озон и формальдегид также негативно могут влиять на функцию мукоцилиарного клиренса. ХРС также может быть ассоциирован с аллергическим риносинуситом и влиянием определенных генетических и иммунных факторов.
ХРС можно классифицировать на форму патологии без образования полипов, а также на аллергический грибковый синусит, ассоциированный с полипозом или грибковой инфекцией. Результаты последних исследований указывают на то, что патогенез ХРС предусматривает реализацию определенных иммунологических реакций, которые связаны с гипертрофией тканей. Формирование полипов или же кистозного фиброза приводит к аномальным изменениям синусо-назального эпителия, и как результат – к нарушению функции мукоцилиарного клиренса. Вдыхание бактериальных контаминантов, в том числе Staphylococcus aureus (S. aureus), грибков, вирусов и протеаз ухудшает функцию дыхательных эпителиальных барьеров. Нарушения регуляции эпителиальных клеток могут провоцировать высвобождение воспалительных молекул по типу тимусного стромального лимфопоэтина, которые, в свою очередь, могут усугублять развитие иммунных индукторных реакций 2 типа в условиях ХРС у пациентов с имеющимися внутриносовыми полипами. Увеличение иммунных клеток по типу лимфоидных II типа, тучных и эозинофилов приводит к высвобождению цитокинов 2 типа, среди которых IL-4, IL-5 и IL-13, которые еще больше усугубляют продолжающуюся воспалительную реакцию.
Напротив, количество адаптивных иммунных клеток, таких как дендритные, T-хелперы типа 2, нативные B-клетки и активированные плазматические клетки также увеличивается при форме ХРС с носовыми полипами, что, в свою очередь, способствует увеличению локальной продукции антител в синоназальной ткани. Считается, что цитокины типа 2 также способствуют снижению уровня тканевого активатора плазминогена и повышению уровня фактора XIIIa, что ассоциировано с увеличением депозиции фибрина и образованием полипов внутри полости носа (фото 2). Лечение ХРС основывается на тяжести патологии и этиологии нарушения. Кортикостероиды и дополнительные антибиотики могут быть полезны в сочетании с солевыми ирригациями носовой полости. При этом для достижения необходимого терапевтического эффекта целесообразно поставить правильный первичный диагноз ХРС, детально анализируя все имеющиеся у пациента симптомы. Несмотря на вариативность протоколов лечения ХРС, все они характеризуются ограниченной эффективностью, учитывая гетерогенную природу и патогенез хронического риносинусита.
Одонтогенный верхнечелюстной синусит (ОВС)
Имеющиеся показатели распространённости ОВС явно занижены, ведь по данным литературы по вопросам ЛОР-заболеваний только 10-12% случаев верхнечелюстного синусита связаны с одонтогенной инфекцией. Последние исследования указывают на то, что около 30-40% всех случаев хронического верхнечелюстного синусита ассоциированы с патологиями зубочелюстного аппарата, таким образом, подчеркивая важность стоматологического аспекта в развитии данной формы заболевания.
Развитие и рост верхнечелюстной пазухи
Верхнечелюстная пазуха может иногда отсутствовать или быть уменьшенной, при этом пики увеличения ее размеров отмечают в возрастном диапазоне 0-3 и 7-12 лет. Данный период развития ребенка также связан с развитием и прорезыванием постоянных зубов и формированием контура лица в пубертатном возрасте. Процесс пневматизации пазухи продолжается на протяжении всей жизни пациента до момента, пока уровень таковой не опуститься ниже уровня дна полости носа после потери пораженных зубов. Наиболее близко к нижней стенке синуса находятся первые и вторые моляры, реже – премоляры, и совсем редко при эктопическом положении – клыки. Остеомеатальный комплекс локализируется более высоко и в среднем в диаметре составляет около 2,4 мм, при этом само костное окно может быть гораздо большим. Размер физиологического отверстия может быть уменьшен за счет проецирования на данную область крючковидного отростка, который является расширением нижней носовой раковины и окружающих мягких тканей (фото 1).
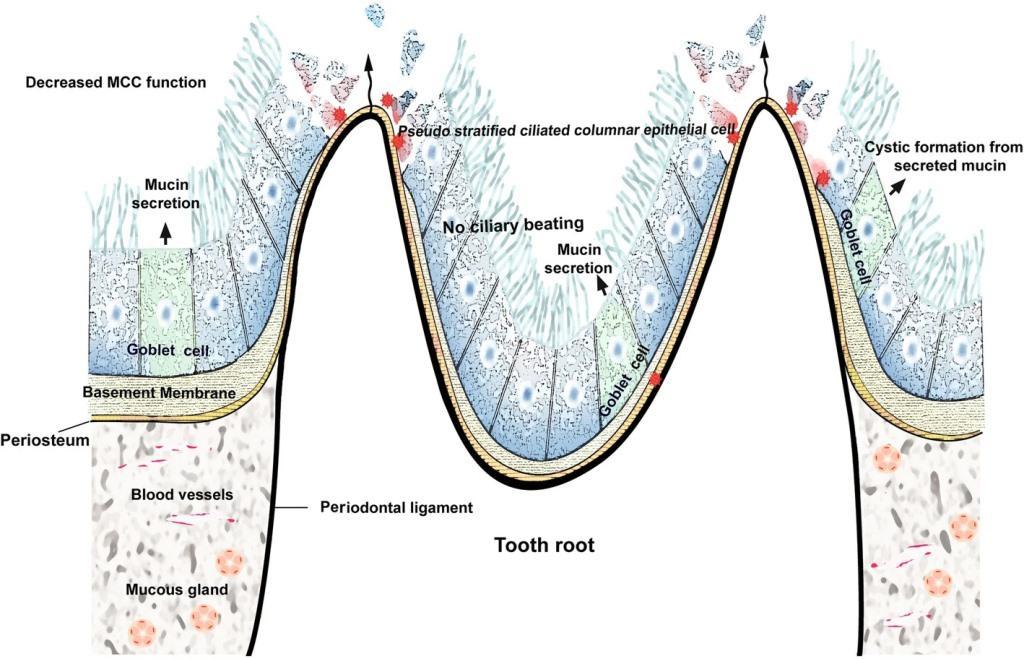
Толщина костной стенки, отделяющей верхнечелюстную пазуху от корней зубов, варьирует от почти полного ее отсутствия, при котором корни зубов напрямую перекрываются Шнайдеровой мембраной, до толщины более 12 мм. Среднее расстояние между корнями моляров и премоляров и дном пазухи составляет 1,97 мм, что может провоцировать такое положение, при котором верхушки корней зубов формируют своеобразные возвышения в структуре костного дна синуса, покрытые слизистой (Шнайдеровой мембраной). Учитывая такую близость верхних моляров и верхнечелюстной пазухи, становиться понятным почему периапикальные или пародонтальные одонтогенные инфекции могут настолько сильно влиять на состояние тканей синуса (фото 3).
Фото 3. Схематическое изображение нарушения функции мукоцилиарного клиренса (MЦК) из-за одонтогенной инфекции. Дисрегуляция эпителиального барьера слизистой оболочки увеличивается в зависимости от тяжести и продолжительности инфекции.
Определение и этиология ОМС
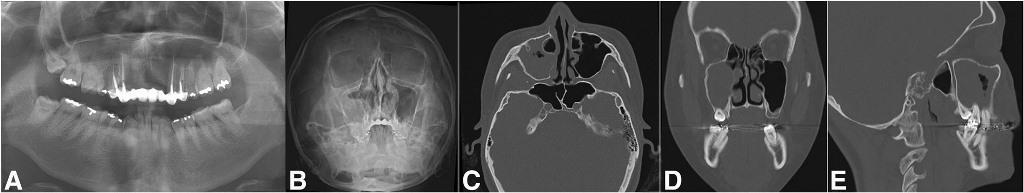
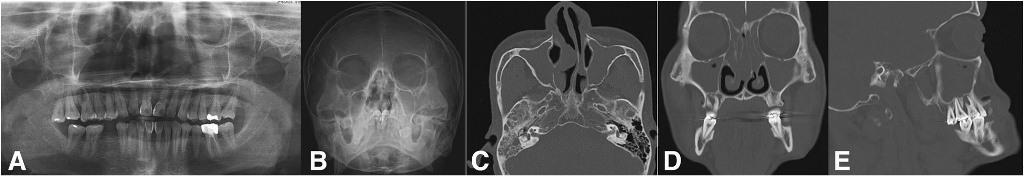
Поражение верхнечелюстной пазухи может быть спровоцировано рядом одонтогенных заболеваний других приносовых пазух или непосредственно самих зубов, а также влиянием патологий в структуре окружающей костной ткани (фото 3). Наиболее часто с ОВС связаны факты экстракции зубов (фото 4), патологии одонтогенных кист (фото 5), периапикальные поражения зубов (фото 6), кариес (фото 7) и инфекционные поражения ретинированных зубов или зубов, подверженных внешней резорбции (фото 8). При верхнечелюстном одонтогенном синусите врачи наиболее часто идентифицируют поражение области верхних моляров (47,68%), конкретно области первого моляра в 22,51% случаев, третьего моляра – в 17,21% случаев и второго моляра – в 3,97% случаев. Ассоциированное поражение области премоляров отмечается в 5,96% случаев ОВС, а области клыков - в 0,66% клинических ситуаций.
Фото 4. Хронический ороназальный свищ после удаления второго моляра с признаками резорбции альвеолярной костной ткани и патологии одотогенного гайморита. Ортопантомограмма до лечения (а), проекция Уотерса (б), коронарный КТ-срез (с) и аксиальный Кт-срез (d).
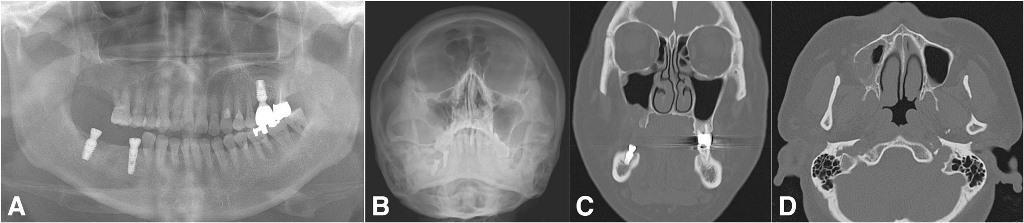
Фото 5. Случай одонтогенного верхнечелюстного синусита, возникшего по причине одонтогенной кисты. Ортопантомограмма до лечения (a), проекция Уотерса (b), корональный КТ-срез, демонстрирующий распространение патологии на костные структуры с обструкцией устья (c), аксиальный КТ-срез, демонстрирующий переднезадние границы поражения (d).
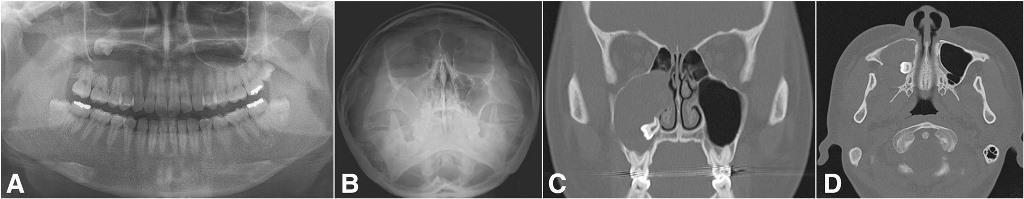
Фото 6. Типичный случай одонтогенного верхнечелюстного синусита, происходящего из апикального поражения правого верхнего второго моляра. Ортопантомограмма до лечения (a), проекция Уотерса (b), аксиальный КЛКТ-срез (с) и корональный КЛКТ-срез (d).
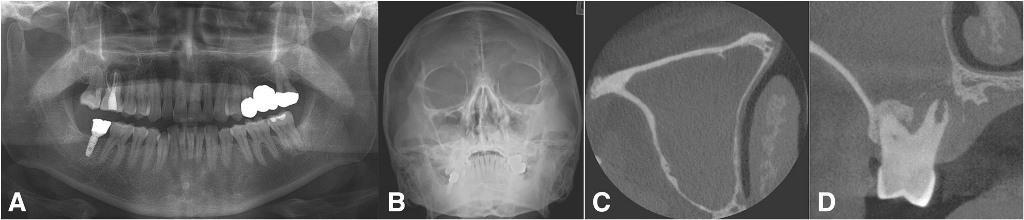
Фото 7. Хронический верхнечелюстной синусит от правого второго премоляра, коронка которого была подвержена постоянной нагрузке со стороны протеза. Ортопантомограмма до лечения (a), проекция Уотерса (b), и аксиальный КТ-срез, демонстрирующий признаки грибкового шарика в структуре пораженной пазухи (с), и коронарный КТ-срез, демонстрирующий признаки грибкового синусита с обструкцией устья (d).
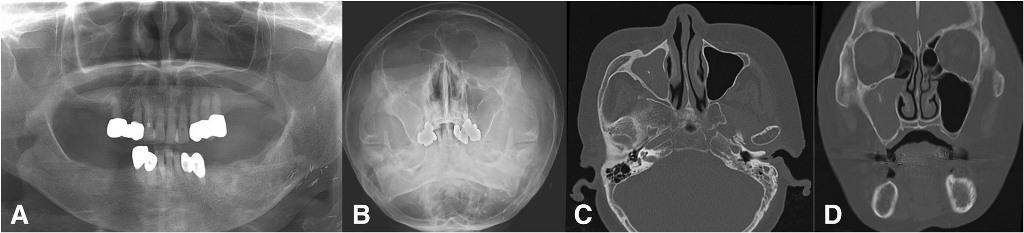
Фото 8. Одонтогенный верхнечелюстной синусит от пораженного третьего моляра и от первого моляра с признаками внешней резорбции. Ортопантомограмма до лечения (a), проекция Уотерса (b), осевой КТ-срез, на котором видны пузырьки воздуха и новообразование в пазухе синуса (с). Корональный КТ-срез показывает вовлеченность в процесс правого первого моляра (d), и сагиттальный КТ-срез, демонстрирующий признаки ассоциации поражения пазухи с третьим моляром (e).
Оториноларингологи и врачи общей практики часто определяют ОВС как ятрогенное заболевание, но такая трактовка является не полностью объективной, учитывая имеющийся дефицит знаний об анатомии и физиологии верхнечелюстного синуса. Наиболее часто этиология ОВС связана с формированием ороантрального свища (ОАС) после экстракции или даже без проведения таковой, персистиурющей инфекцией в области корней зубов, пародонтитом и другими формами патологий зубов (фото 3). Ятрогенным причинами развития ОВС чаще являются процедуры проведения субантральной аугментации, перфорации Шнайдеровой мембраны, неадекватное позиционирование дентальных имплантатов, экструзия эндодонтических материалов в пространство пазухи, попадание инородных тел после процедуры апикоэктомии, а также хирургические экстракции ретинированных третьих моляров. Тем не менее, при безопасной и точной реализации данные процедуры не являются причинными в патогенезе ОВС даже у пациентов с достаточно пневматизированными верхнечелюстными пазухами.
Диагностика ОВС
Наиболее частые клинические признаки ОВС можно разделить на стоматологические симптомы и симптомы, связанные непосредственно с поражением синуса. Стоматологические симптомы включают зубную боль и гиперчувствительность, и во многих случаях их тяжело идентифицировать как те, что связаны с поражением пазухи. Однако, довольно редко у пациента не отмечается стоматологических симптомов при прогрессировании патологии синуса даже в условиях сохранения проходимости остеомеатального комплекса. Синус-ассоциированными признаками являются односторонние болевые ощущения в области щеки, обструкция носовой полости, гнойная ринорея, неприятный запах, нарушение вкусовых ощущений, головные боли, болезненность в области передней стенки пазухи, постназальный синдром. Следует понимать, что такие же симптомы могут наблюдаться и при рините. Односторонняя обструкция носа с болевыми симптомами и ощущениями сдавливания в области лица отмечаются довольно часто при ОВС, в то время как наличие неприятного запаха и гнилостного привкуса при болезненности зуба позволяет дифференцировать хронический верхнечелюстной синусит и одонтогенный гайморит.
Наиболее частыми причинами развития одонтогенной формы поражения гайморовой пазухи являются периапикальные абсцессы, экстракция зуба, пародонтальные патологии, формирование ороантрального соустья и наличие инородных тел в пространстве верхнечелюстного синуса. ОВС также может развиться вследствие остеомиелита верхней челюсти, радикулярных кист, механической травмы слизистой пазухи в ходе эндодонтического лечения, выведения материала силера за апекс корня, неправильного позиционирования имплантатов и неадекватно проведенной субантральной аугментации.
Патогенез ОВС
Кроме тесного анатомического взаиморасположения моляров и премоляров верхней челюсти к гайморовой пазухи, на патогенез поражения последней могут влиять и ряд других не менее значимых факторов. Эндоантральный синдром был идентифицирован Селденом как распространение пульпарного поражения в пространство синуса. Данный синдром характеризуется наличием поражения пульповой камеры, рентгенологической зоны периапикального поражения, рентгенологической потерей костной разделяющей пластинки, рентгенологическим распространением поражения в пространство пазухи и вариациями рентгенконстрастных следов на нижней стенке синуса. Молниеносное распространение одонтогенной инфекции кроме верхнечелюстного синусита может спровоцировать развитие подглазничного целлюлита, временной слепоты и даже опасного для жизни тромбоза кавернозного синуса. Распространенность ОВС с признаками вторичных периапикальных поражений составляет 16–65%, а лечение данной формы патологии является более сложным по сравнению с первичными поражениями синуса. Эндоассоцированные поражения, которые проникают в пространство пазухи, характеризуются наличием эпителиальных клеток, которые окружены соединительной воспалительной тканью. Развитие данных поражений отмечается в ходе острой, инвазивной или даже хронической фазы заболеваний. Острая фаза поражения характеризуется значительной инвазией первичного очага и распространением бактерий в пространство пазухи и на поверхность Шнайдеровой мембраны, что, в свою очередь, вызывает гипертрофические изменения слизистой. Если в ходе эндодонтического лечения данные микроорганизмы не будут элиминированы, данные гипертрофические изменения могут спровоцировать развитие рецидива пародонтита или вторичных периапикальных поражений. Еще одной причиной ОВС является отек Шнайдеровой мембраны с формированием инфильтратов из воспалительных клеток, ретенционных кист, гипертрофических рубцов и грануляций, очагов гиалинизации и некроза. Апикальные поражения могут привести сначала к воспалению и утолщению Шнайдеровой мембраны топографически смежной с проблемными корнями зубов, а позже – и к развитию периапикального остеита с гиперплазией слизистой верхнечелюстного синуса.
Микробиологические аспекты синусита и гипотеза биопленки
При ОВС отмечают наличие полимикробных ассоциаций с преобладанием количества анаэробных микроорганизмов как в ротовой полости, так и в верхних дыхательных путях. Более чем в 75% клинических случаев ОВС отмечают наличие таких аэробных бактерий, как Staphylococcus aureus и Streptococcus pneumonia (S. pneumonia) и анаэробных Peptostreptococcus и Prevotella spp., у 10-12% пациентов с ОВС идентифицируют наличие метициллин-резистентного Staphylococcus aureus. Такие бактерии и грибки как Streptococcus, Propionibacterium и Candida albicans могут вызывать развитие вторичных периапикальных поражений, при этом этиология таковых предусматривает возможности для потенциального участия более чем 158 бактериальных видов и 3 видов грибков. Наиболее распространенным видом бактерий при вторичных периапикальных поражениях являются бактерии Enterococcus faecalis. В структуре ОВС-ассоциированных периапикальных очагов отмечают наличие гранул биопленки, что и стало основой для развития гипотезы роли биоплёнки в механизме патогенеза поражений синуса. Согласно данной теории, предусматривается наличие динамических полимикробных ассоциаций с медленно реплицирующимися штаммами, встроенными в структуру внеклеточного полимерного матрикса, включая экзополисахариды, белки и нуклеиновые кислоты. Эти вещества внутри матрикса расположены в дискретных слоях между метаболически активными штаммами, находящимися во внешних покрытиях, подверженных воздействию более высоких концентраций кислорода и питательных веществ. При этом неподвижные бактерии локализируются в более глубоком и неактивном анаэробном ядре. Эти глубокие слои матрикса относительно защищены от антибиотиков, детергентов и антимикробных соединений, которые входят в состав реактивного комплекса при ответе гуморального или клеточного иммунитета. Эти же глубоконаходящиеся бактерии и отвечают за развитие хронических форм инфекционных поражений, что делает их ответственными за хронические инфекции. Бактериальная биопленка характеризуется уровнем идентификации в 70% у 25–100% образцов, собранных у пациентов с хроническим ринусинуситом. Основными патогенными компонентами биопленки, которые принимают непосредственное участие в развитие ОВС, являются S. aureus, Haemophilus influenza (H. influenza), P. aeruginosa (P. aeruginosa), коагулазонегативные стафилококки, Moraxella catarrhalis, S. pneumoniae и другие виды грибков и анаэробов. При исключении в ходе диагностики сопутствующих заболеваний носа за счет оценки состояния остеометальаного комплекса, врач всегда должен обеспечить направление образцов пациента на верификацию бактериальной биопленки в случаях наличия у него клинических признаков одонтогенного верхнечелюстного синусита.
Актиномицеты в верхнечелюстной пазухе
Определенные виды Actinomyces, включая A. israelii и A. radicidentis, могут быть обнаружены в экстрарадикулярных гранулах внутри пространства верхнечелюстной пазухи благодаря их своеобразным поверхностным свойствам, которые обеспечивают возможность прикрепление эпителия к воспалительным клеткам и бактериям полости рта. Поражения синуса, не ассоциированные с эндодонтическими патологиями, но вызваны актиномицетами, являются резистентными к реакциям иммунной системы хозяина, антибиотикам и ортоградному лечению, поскольку таковое не обеспечивает их полной элиминации. Трудность лечения инфекций верхнечелюстной пазухи, связанных с Actinomyces, состоит в необходимости реализаций хирургических методов вмешательства. При этом, наличие актиномицетов чаще всего рассматривается как специфический симптом соответствующей формы именно одонтогенного верхнечелюстного синусита.
Грибковый синусит
У пациентов с компрометированным состоянием иммунной системы, включая пациентов с плохо контролируемым сахарным диабетом, ВИЧ-инфекцией или пациентов, проходящих химиотерапию, поражения верхнечелюстного синуса могут быть вызваны грибковыми инфекциями. Аспергиллез или мукомикоз могут распространяться на стенку орбиты, в область височной ямки и даже в структуру мозга, вызывая признаки и симптомы аналогичные тем, которые развиваются при злокачественных поражениях. Большинство этих грибковых контаминантов проникают во внутрь через дыхательные пути и сохраняются в слизистой оболочке пазухи, образуя плесени и споры. Очаги грибковой инфекции могут привести к процессу дистрофической кальцификации и образованию ринолитов, которые можно увидеть на разного типа рентгенограммах. Особенно крупные ринолиты также известны как грибковые шарики. Развитие грибкового поражения пазухи также возможно при попадании в ее пространство разных инородных контаминированных объектов.
Фото 9. Одотогенный пансинусит, вызванный инфекцией в области правого первого моляра. Предоперационная ортопантомограмма (a), проекция Уотерса (b), аксиальный срез компьютерной томограммы с визуализацией синусита в структуре обеих верхнечелюстных пазух (c), коронарный срез компьютерной томограммы с визуализацией поражения этмоидальных и лобных пазух (d), и сагиттальный срез компьютерной томограммы с визуализацией очага инфекции в области правого первого моляра (е).
Цель хирургического лечения патологии верхнечелюстного синусита состоит в радикальной элиминации воздействия всех провоцирующих факторов и восстановлении функции мукоцилиарного клиренса. Учитывая, что пациенты с грибковым синуситом характеризуются наличием иммунодефицитных состояний, целесообразно максимально рано обеспечить верификацию клинически важных признаков и симптомов.
Лечение одонтогенного верхнечелюстного синусита
Ранняя диагностика и лечение
Хотя хронический синусит, включая ХРИ и OВС, является распространенным заболеванием, проблемными остаются аспекты его ранней и правильной диагностики. Хронический риносинусит сначала не вызывает болевых ощущений в области лица, поэтому врачи-стоматологи часто могут пропускать таких пациентов на своем приеме. Однако при верификации обструкции полости носа и полипов (с помощью КТ или в ходе эндоскопического вмешательства) врач может назначить внутриносовые ирригации и противоотечные средства. При подтверждении наличия полипов в ходе диагностики пациенту назначаются системные стероидные препараты и уменьшается доза противоотечных средств. При рецидивах патологии пазухи показано проведение хирургических вмешательств с целью восстановления нормальной функции мукоцилиарного клиренса и обеспечения проходимости остеометального комплекса. Эндоскопические вмешательства могут быть показаны при девиациях костной перегородки, блокировке носовой раковины, увеличение размера устья и гипертрофии тканей в среднем носовом ходе. Слизистые ретенционные кисты часто могут быть обнаружены на ортопантомограммах и компьютерных томографах дна верхнечелюстной пазухи, и часто могут быть спутаны с одонтогенными воспалительными кистами (фото 5 и 6). Несмотря на то, что зачастую лечение ретенционных кист проводить не рекомендуется, ретенционные кисты могут быть легко удалены с помощью эндоскопа. В структуре гайморовой и лобной пазухи также могут отмечаться мукоцеле, которые развиваются вследствие блокады физиологического дренажа, когда секретируемая слизь накапливается и приводит к расширению костных границ из-за значительного давления. В случаях хронического риносинусита у пациентов после прохождения радиотерапии, а также у пациентов с признаками кистозного фиброза, также всегда нужно рассматривать необходимость проведения раннего хирургического вмешательства, учитывая возможность секреции очень густой слизи в условиях патологии, и потенциал слизистой к рецидивирующему образованию рубцов.
Оперативное лечение
Даже несмотря на наличие постоянного дискомфорта в одной из пазух и присутствие при этом неприятного запаха, что типично для ОВС, диагностика данной патологии со стороны стоматолога является довольно сложной. Кроме методов КТ и КЛКТ, для диагностики также можно использовать ортопантомограммы и снимки в проекции Уотерса. После постановки диагноза сначала можно приняться за лечения одонтогенных причин патологии, а уже потом – и за хирургическим вмешательтсва (функциональную хирургическую эндоскопию или же операцию по Колдуэллу-Люку). Иногда болевые ощущения в области лица с напряженными головными болями и болями в области височно-нижнечелюстного сустава могут быть ошибочно диагностированы как ОВС, хотя на самом деле они могут быть вызваны и рядом других патологий. Выбор техники формирования доступа к пазухе базируется на опыте хирурга и учете имеющихся клинических возможностей. Очень часто с данной целью применяют операцию по Колдуэллу-Люку, которая, однако чревата возможными негативными последствиями. Последние включают риск формирования постоперационных верхнечелюстных кист, развития послеоперационных отеков лица вследствие кровотечения, возникновения парестезий из-за поражения подглазничного нерва и склероза стенки гайморовой пазухи (фото 10). Кроме того, после операции по Колдуэллу-Люку довольно нелегко провести реконструкцию альвеолярного гребня для последующей установки в него дентальных имплантатов.
Фото 10. Схематические чертежи хирургических подходов формирования доступа к пазухе у пациентов с одонтогенным верхнечелюстным синуситом: по Колдуэллу-Люку (a), функциональная хирургическая эндоскопия (b) и модифицированная хирургическая эндоскопия (c, d, e)
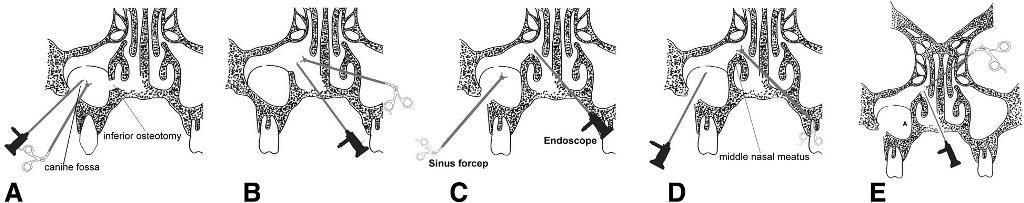
Функциональная хирургическая эндоскопия характеризуется определенными преимуществами, включая возможности формирования более широкого и гибкого доступа в условиях ограниченных размеров гайморовой пазухи. Удаление пораженных тканей через расширение физиологического отверстия в среднем носовом ходе позволяет восстановить функцию синуса при минимальном дискомфорте для пациента и при этом еще и сохранить целостность Шнайдеровой мембраны (фото 10b). Однако и эндоскопические вмешательства также связаны с определенными осложнениями: при неадекватно обширном подходе можно удалить излишнее количество тканей, при недостаточном – наоборот, не полностью удалить все пораженные структуры, таким образом, увеличив риск развития рецидива.
Консолидированное лечение
Учитывая одонтогенную природу ОВС, целесообразным является обеспечение полной элиминации инфекции со стороны проблемного зуба. Для этого можно провести экстракцию зуба, или же апикальную хирургию с эндодонтическим лечением. Кроме того, учитывая, что патология ОВС «стареет», у пациентов пожилого возраста после синус-направленного вмешательства, сразу можно проводить и реконструкцию костного гребня для обеспечения дальнейшей поддержки разных видов стоматологических протезов. Консолидация разных подходов к лечению ОВС может предусматривать реализацию трех алгоритмов формирования доступа: во-первых, формирование интраорального доступа через область проблемного зуба, во-вторых – достижение пространства пазухи эндоскопически через нос и остеомеатальный комплекс, в-третьих – формирование костного окна через стенку верхней челюсти. В последнее время врачи все чаще стали использовать модифицированный эндоскопический подход, который позволяет эффективно скорректировать последствия перелома орбиты, удалить пораженные ткани из пространства синуса и изъять «мигрирующие имплантаты» (фото 10). Благодаря модифицированному эндоскопическому подходу удается максимально сохранить физиологическую функцию пазухи и избежать осложнений, ассоциированных с другими хирургическими методами формирования доступа к верхнечелюстному синусу.
Профилактика ожидаемых осложнений
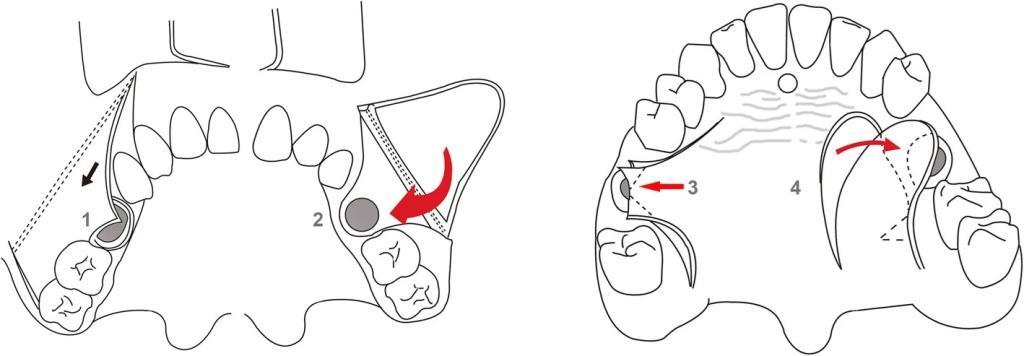
Формирование ороантрального соустья является наиболее распространенным осложнением, связанным с патологией ОВС. Основными причинами формирования ороантрального соустья являются удаления моляров, из-за которых развиваются около 80% всех случаев данных осложнений. Такое соустье также называют ороантральной фистулой или ороантральным соединением. Основными симптомами наличия ороанатрального соединения являются незаживающий характер отверстия между пазухой и ротовой полотью, через которое выделяется гнойный экссудат, особенно в случаях, когда пациент пьет или выдувает нос. Для эффективного закрытия ороантрального соустья нужно учитывать его размер и глубину. Небольшие соустья могут закрываться сами посредством эпителия и грануляционной ткани, однако в противных случаях в результате гиперплазии слизистой синуса могут формироваться большие и стабильные свищи между приносовым пространством и ротовой полостью. Закрывать подобные образования можно также посредством эндоскопического вмешательства. Для этой же цели можно использовать расширенные лоскуты, островообразные лоскуты и лоскуты на ножках (фото 11). При тяжелых формах фистул прибегают к применению резорбируемых мембран, золотой фольги и жировых лоскутов. При этом в любом случае закрытия соустья первоначально важно убедиться в том, что сама пазуха остается чистой и не демонстрирует признаков инфекционного поражения.
Фото 11. Схематические рисунки закрытия ороантрального свища в полости рта. Непосредственное закрытие (1), щечный лоскут (2), небный лоскут (3) и небный вращающийся лоскут на ножке (4).
Выводы
Частота развития одонтогенного верхнечелюстного синусита значительно выше той, которая отмечается в литературных источниках. Приблизительно от 30% до 40% случаев хронического гайморита ассоциированы с одонтогенной этиологией. Этиопатогенез данного поражения остается не до конца изученным, но наиболее частыми причинами развития ОВС являются последствия стоматологического лечения дистальных зубов верхней челюсти и результаты неадекватно-спланированных процедур установки дентальных имплантатов. При подозрении на связь поражения пазухи с проблемным зубом можно проверить состояние Шнайдеровой мембраны на наличие бактериальной биопленки. Ранняя эндоскопическая и рентгенологическая диагностика, даже посредством прицельных снимков в проекции Уотерса или обычных ортопантомограмм, позволит более объективно оценить состояние пазухи у пациентов с признаками хронического риносинусита. При выборе метода лечения ОВС врачи должны быть осведомлены о возможностях современных эндоскопических подходов, которые характеризуются меньшими уровнями рисков развития осложнений и возможностями для сохранения физиологической функции верхнечелюстного синуса.
Автор: Soung Min Kim (Южная Корея)
Верхнечелюстной синусит одонтогенной этиологии, также известен как хронический верхнечелюстной одонтогенный синусит, или одонтогенный верхнечелюстной синусит (ОВС), является довольно распространённой, но в то же время и комплексной патологией ввиду его стоматологических, ЛОР и аллергологических аспектов. Любая патология, связанная с зубами или иными структурами зубочелюстного аппарата, может спровоцировать поражение Шнайдеровой мембраны (ШМ), что, в свою очередь, приводит к развитию нарушений в пространстве гайморовой пазухи. Точная и правильная диагностика патологии верхнечелюстного синуса позволяет избежать необоснованного медикаментозного или хирургического лечения, что, в свою очередь, повышает общий прогноз проведенных терапевтических вмешательств. Цель данной статьи состоит в систематизации информации относительно патофизиологии ОВС, сравнении хронических и острых форм верхнечелюстного синусита, в том числе хронического риносинусита (ХРС) и острого бактериального риносинусита (ОБРС). Также в статье будут рассмотрены аспекты патогенеза и микробиологии ОВС, а также соответствующие им методы эффективного лечения данной патологии.

Хронический и острый риносинусит
Важность правильной диагностики и лечения хронического или острого риносинусита обоснована ассоциациями данных патологий с такими симптомами, как заложенность носа, обструкция носовых дыхательных путей, экссудация и обильные носовые выделения, которые утрудняют дыхание и ухудшают общее самочувствие пациента.
Классификация риносинуситов
Ринит часто путают с риносинуситом, однако на самом деле первая патология ассоциирована с воспалительным процессом внутренней стенки носовой полости, а вторая предполагает еще и воспаление смежных параназальных пазух. Для постановки диагноза риносинусита необходимо наличие как минимум двух из следующих симптомов: обструкция носа, боль в области срединной трети лица, выделение слизисто-гнойного экссудата, снижение чувства обоняния, выраженные признаки воспаления слизистой. Лечение риносинусита зависит от этиологии; в свою очередь, для точной дифференциальной диагностики острой и хронической форм патологии необходимо тщательно проанализировать диагноз пациента, имеющиеся у него симптомы и результаты дополнительных исследований, в том числе и эндоскопических. Первичное лечение можно начать с уже известных и доказательных методов, однако в случаях наличия симптомов, которые не поддаются терапии, врачу нужно направить пациента с целью дополнительной иммунологической диагностики к аллергологу. Острый риносинусит (ОРС) диагностируется по следующим критериям: инфекционная форма ОБРС - наличие гнойного экссудата, обструкции и болевые ощущения на протяжении 4 недель; субострый риносинусит (СРС) – наличие симптомов на протяжении от 4 до 8 недель; ХРС – при наличии симптомов более чем 8 недель подряд независимо от проводимого медикаментозного лечения. Риносинусит также можно классифицировать на аллергический, неаллергический, ассоциированный с родом трудовой деятельности и другие формы.
Мукоцилиарный клиренс как показатель функции ШМ
Псевдомногослойный реснитчатый столбчатый эпителий, также известный как шнайдерова мембрана, выстилает внутреннюю поверхность слизистой верхнечелюстного синуса. Клетки Шнайдеровой мембраны продуцируют слизь, которая перемещается в область естественного устья, и, таким образом, обеспечивает дренаж носовой полости под действием гравитации. При этом движения ресничек эпителия в структуре пазухи являются синхронными и скоординированными (фото 1). При движении слизи через назальную полость в носоглотку, она проглатывается человеком, попадая дальше таким образом в пищевод и желудок. Нарушения такого пути движения слизи за счет сниженной активности эпителия или обструкции устья может спровоцировать развитие патологии синуса с ассоциированными симптомами. Естественные выводные отверстия передней решетчатой пазухи, фронтального синуса и гайморовой пазухи выходят близко друг к другу в пространстве среднего носового хода, таким образом формируя так называемый остео-меатальный комплекс (ОМК). Воспаление или блокада ОМК может вызывать развитие или же прогрессирование симптомов синусита с возможностью потенциального воспаления всех околоносовых пазух – пансинусита.
Фото 1. А. Схематический корональный срез взаимоотношения дистальных зубов верхней челюсти с синусовым комплексом. Направление нормальной активности мукоцилиарного эпителия в сторону остеомеатального комплексна отмечено стрелками. При наличии антрохоанальных полипов на передней или медиальной стенках пазухи они будут визуализироваться в форме черных элементов на рентгеновском снимке, в то время как полипы решетчатой пазухи будут выглядеть более серыми. В. Остео-меатальный комплекс с визуализацией средней и нижней носовых раковин, крючковидного отростка и решётчатой буллы.

Эпителиальные клетки ШМ играют важную роль в обеспечении мукоцилиарного клиренса (МЦК), обеспечивая проходимость верхних дыхательных путей за счет постоянной миграции слизи со всеми ее возможными составляющими в сторону ротоглотки. Данный механизм также поддерживается секрецией муцина, который выделяется дыхательным эпителием – в таких условиях формируется ионный транспорт жидкостей, благодаря чему слизь поддерживает соответствующий уровень вязкости. В ответ на наличие определенных патогенов эпителием также могут секретироваться специфические хемокины, который запускают механизм иммунного ответа путем активации макрофагов, дендритных клеток, эозинофилов, нейтрофилов, Т-клеток и NK-клеток (фото 2). Такие цитокины, как IL-1β, IL-6, TNFα, IL-8 и хемотаксический белок моноцитов 1 также могут секретироваться дыхательным и реснитчатым эпителием. Эпителиальные клетки ШМ тесно связаны между собой, формируя условный защитный барьер, а мукоцилиарный транспорт обеспечивается за счет формирования реактивных соединений оксигена и нитрогена. Последние выделяются в условиях контроля биохимических процессов такими антимикробными пептидами, как лактотрансферрин, лизоцим и дефензины.
Фото 2. Схематическое изображение механизма мукоцилиарного клиренса псевдомногослойным реснитчатым столбчатым эпителием в пространстве верхнечелюстного синуса. Сокращения: МСС - мукоцилиарный клиренс, МСР-1 - хемотаксический белок 1 моноцитов, МIP-1 - воспалительный белок макрофагов 1, IL - интерлейкин, TNF - фактор некроза опухолей.

Определение и клиническая картина острого бактериального риносинусита (ОБРС)
Основным этиологическим фактором ОБРС является инфицирование нативными бактериями, находящимися в атмосферном воздухе, структур верхних дыхательных путей. Таким образом, первая цель лечения ОБРС состоит в снижении уровня бактериальной инфекции и достижении симптоматического улучшения состояния пациента. Большинство случаев воспалительного синусита, включая ОБРС, развиваются на протяжении 7-10 дней по причине вирусной инфекции. Даже после элиминации вирусной инфекции пациенты с ОБРС могут отмечать наличие болевых ощущений в области лица и заложенность носа с ринореей. Носовой или синусовый стаз может возникнуть из-за сниженной активности мукоцилиарного механизма и слишком высокого положения естественного устья. Иногда имеющиеся этмоидальные или же антрохоанальные полипы, которые, по сути, являются вариациями анатомической структуры, могут усложнять состояние блокады физиологического дренирования пазухи через нижний носовой ход (фото 1). Учитывая вариативность патофизиологических процессов при верхнечелюстном синусите одонтогенной этиологии, стоматологическое лечение следует проводить параллельно с общесоматическим. Обычно пациентам с ОБРС назначают амоксициллин, а с целью диагностики часто используют компьютерную томографию для объективизации состояния пазухи и идентификации возможных осложнений по типу внутричерепных расслоений тканей.
Определение и клиническая картина хронического риносинусита (ХРС)
Типичная картина хронического риносинусита характеризуется наличием более чем двух нижеописанных симптомов на протяжении более 12 недель: боль в области лица при надавливании, снижение обоняния, заложенность носа, ринорея или постоянное выделение экссудата из носовой полости. Боль в области лица при надавливании обычно является тупой и локализируется в области верхней чести щеки с развитием головной боли с той же стороны. Снижение чувства обоняния может быть представлено частичной его потерей – гипосмией, или же полной – тотальной аносмией, и ассоциировано с обструкцией передней слизистой этмоидальной оболочки. Иногда пациенты также могут жаловаться на снижение вкусовой чувствительности, известной как агезия. Заложенность носа характеризуется наличием чувства переполнения носовой полости и ее полной блокадой. Для передней или задней ринореи характерно выделение густого жёлтого или коричневого экссудата. Данный симптом, однако, чаще ассоциирован с ОБРС, чем с ХРС.
Этиология ХЛБ связана с разнообразными анатомическими вариациями и последствием вдыхания инородных тел. На развитие данного состояния также влияют курение, аллергический ринит и социальный статус пациента. Смещение костной перегородки или средних носовых раковин, аномальный размер клеток Галлера или увеличение объема назальных клеток может спровоцировать обструкцию остеомеатального комплекса, что, в свою очередь, может повлиять на развитие хронического риносинусита. Такие химические образования, как диоксид серы, озон и формальдегид также негативно могут влиять на функцию мукоцилиарного клиренса. ХРС также может быть ассоциирован с аллергическим риносинуситом и влиянием определенных генетических и иммунных факторов.
ХРС можно классифицировать на форму патологии без образования полипов, а также на аллергический грибковый синусит, ассоциированный с полипозом или грибковой инфекцией. Результаты последних исследований указывают на то, что патогенез ХРС предусматривает реализацию определенных иммунологических реакций, которые связаны с гипертрофией тканей. Формирование полипов или же кистозного фиброза приводит к аномальным изменениям синусо-назального эпителия, и как результат – к нарушению функции мукоцилиарного клиренса. Вдыхание бактериальных контаминантов, в том числе Staphylococcus aureus (S. aureus), грибков, вирусов и протеаз ухудшает функцию дыхательных эпителиальных барьеров. Нарушения регуляции эпителиальных клеток могут провоцировать высвобождение воспалительных молекул по типу тимусного стромального лимфопоэтина, которые, в свою очередь, могут усугублять развитие иммунных индукторных реакций 2 типа в условиях ХРС у пациентов с имеющимися внутриносовыми полипами. Увеличение иммунных клеток по типу лимфоидных II типа, тучных и эозинофилов приводит к высвобождению цитокинов 2 типа, среди которых IL-4, IL-5 и IL-13, которые еще больше усугубляют продолжающуюся воспалительную реакцию.
Напротив, количество адаптивных иммунных клеток, таких как дендритные, T-хелперы типа 2, нативные B-клетки и активированные плазматические клетки также увеличивается при форме ХРС с носовыми полипами, что, в свою очередь, способствует увеличению локальной продукции антител в синоназальной ткани. Считается, что цитокины типа 2 также способствуют снижению уровня тканевого активатора плазминогена и повышению уровня фактора XIIIa, что ассоциировано с увеличением депозиции фибрина и образованием полипов внутри полости носа (фото 2). Лечение ХРС основывается на тяжести патологии и этиологии нарушения. Кортикостероиды и дополнительные антибиотики могут быть полезны в сочетании с солевыми ирригациями носовой полости. При этом для достижения необходимого терапевтического эффекта целесообразно поставить правильный первичный диагноз ХРС, детально анализируя все имеющиеся у пациента симптомы. Несмотря на вариативность протоколов лечения ХРС, все они характеризуются ограниченной эффективностью, учитывая гетерогенную природу и патогенез хронического риносинусита.
Одонтогенный верхнечелюстной синусит (ОВС)
Имеющиеся показатели распространённости ОВС явно занижены, ведь по данным литературы по вопросам ЛОР-заболеваний только 10-12% случаев верхнечелюстного синусита связаны с одонтогенной инфекцией. Последние исследования указывают на то, что около 30-40% всех случаев хронического верхнечелюстного синусита ассоциированы с патологиями зубочелюстного аппарата, таким образом, подчеркивая важность стоматологического аспекта в развитии данной формы заболевания.
Развитие и рост верхнечелюстной пазухи
Верхнечелюстная пазуха может иногда отсутствовать или быть уменьшенной, при этом пики увеличения ее размеров отмечают в возрастном диапазоне 0-3 и 7-12 лет. Данный период развития ребенка также связан с развитием и прорезыванием постоянных зубов и формированием контура лица в пубертатном возрасте. Процесс пневматизации пазухи продолжается на протяжении всей жизни пациента до момента, пока уровень таковой не опуститься ниже уровня дна полости носа после потери пораженных зубов. Наиболее близко к нижней стенке синуса находятся первые и вторые моляры, реже – премоляры, и совсем редко при эктопическом положении – клыки. Остеомеатальный комплекс локализируется более высоко и в среднем в диаметре составляет около 2,4 мм, при этом само костное окно может быть гораздо большим. Размер физиологического отверстия может быть уменьшен за счет проецирования на данную область крючковидного отростка, который является расширением нижней носовой раковины и окружающих мягких тканей (фото 1).
Толщина костной стенки, отделяющей верхнечелюстную пазуху от корней зубов, варьирует от почти полного ее отсутствия, при котором корни зубов напрямую перекрываются Шнайдеровой мембраной, до толщины более 12 мм. Среднее расстояние между корнями моляров и премоляров и дном пазухи составляет 1,97 мм, что может провоцировать такое положение, при котором верхушки корней зубов формируют своеобразные возвышения в структуре костного дна синуса, покрытые слизистой (Шнайдеровой мембраной). Учитывая такую близость верхних моляров и верхнечелюстной пазухи, становиться понятным почему периапикальные или пародонтальные одонтогенные инфекции могут настолько сильно влиять на состояние тканей синуса (фото 3).
Фото 3. Схематическое изображение нарушения функции мукоцилиарного клиренса (MЦК) из-за одонтогенной инфекции. Дисрегуляция эпителиального барьера слизистой оболочки увеличивается в зависимости от тяжести и продолжительности инфекции.

Определение и этиология ОМС
Поражение верхнечелюстной пазухи может быть спровоцировано рядом одонтогенных заболеваний других приносовых пазух или непосредственно самих зубов, а также влиянием патологий в структуре окружающей костной ткани (фото 3). Наиболее часто с ОВС связаны факты экстракции зубов (фото 4), патологии одонтогенных кист (фото 5), периапикальные поражения зубов (фото 6), кариес (фото 7) и инфекционные поражения ретинированных зубов или зубов, подверженных внешней резорбции (фото 8). При верхнечелюстном одонтогенном синусите врачи наиболее часто идентифицируют поражение области верхних моляров (47,68%), конкретно области первого моляра в 22,51% случаев, третьего моляра – в 17,21% случаев и второго моляра – в 3,97% случаев. Ассоциированное поражение области премоляров отмечается в 5,96% случаев ОВС, а области клыков - в 0,66% клинических ситуаций.
Фото 4. Хронический ороназальный свищ после удаления второго моляра с признаками резорбции альвеолярной костной ткани и патологии одотогенного гайморита. Ортопантомограмма до лечения (а), проекция Уотерса (б), коронарный КТ-срез (с) и аксиальный Кт-срез (d).

Фото 5. Случай одонтогенного верхнечелюстного синусита, возникшего по причине одонтогенной кисты. Ортопантомограмма до лечения (a), проекция Уотерса (b), корональный КТ-срез, демонстрирующий распространение патологии на костные структуры с обструкцией устья (c), аксиальный КТ-срез, демонстрирующий переднезадние границы поражения (d).

Фото 6. Типичный случай одонтогенного верхнечелюстного синусита, происходящего из апикального поражения правого верхнего второго моляра. Ортопантомограмма до лечения (a), проекция Уотерса (b), аксиальный КЛКТ-срез (с) и корональный КЛКТ-срез (d).

Фото 7. Хронический верхнечелюстной синусит от правого второго премоляра, коронка которого была подвержена постоянной нагрузке со стороны протеза. Ортопантомограмма до лечения (a), проекция Уотерса (b), и аксиальный КТ-срез, демонстрирующий признаки грибкового шарика в структуре пораженной пазухи (с), и коронарный КТ-срез, демонстрирующий признаки грибкового синусита с обструкцией устья (d).

Фото 8. Одонтогенный верхнечелюстной синусит от пораженного третьего моляра и от первого моляра с признаками внешней резорбции. Ортопантомограмма до лечения (a), проекция Уотерса (b), осевой КТ-срез, на котором видны пузырьки воздуха и новообразование в пазухе синуса (с). Корональный КТ-срез показывает вовлеченность в процесс правого первого моляра (d), и сагиттальный КТ-срез, демонстрирующий признаки ассоциации поражения пазухи с третьим моляром (e).

Оториноларингологи и врачи общей практики часто определяют ОВС как ятрогенное заболевание, но такая трактовка является не полностью объективной, учитывая имеющийся дефицит знаний об анатомии и физиологии верхнечелюстного синуса. Наиболее часто этиология ОВС связана с формированием ороантрального свища (ОАС) после экстракции или даже без проведения таковой, персистиурющей инфекцией в области корней зубов, пародонтитом и другими формами патологий зубов (фото 3). Ятрогенным причинами развития ОВС чаще являются процедуры проведения субантральной аугментации, перфорации Шнайдеровой мембраны, неадекватное позиционирование дентальных имплантатов, экструзия эндодонтических материалов в пространство пазухи, попадание инородных тел после процедуры апикоэктомии, а также хирургические экстракции ретинированных третьих моляров. Тем не менее, при безопасной и точной реализации данные процедуры не являются причинными в патогенезе ОВС даже у пациентов с достаточно пневматизированными верхнечелюстными пазухами.
Диагностика ОВС
Наиболее частые клинические признаки ОВС можно разделить на стоматологические симптомы и симптомы, связанные непосредственно с поражением синуса. Стоматологические симптомы включают зубную боль и гиперчувствительность, и во многих случаях их тяжело идентифицировать как те, что связаны с поражением пазухи. Однако, довольно редко у пациента не отмечается стоматологических симптомов при прогрессировании патологии синуса даже в условиях сохранения проходимости остеомеатального комплекса. Синус-ассоциированными признаками являются односторонние болевые ощущения в области щеки, обструкция носовой полости, гнойная ринорея, неприятный запах, нарушение вкусовых ощущений, головные боли, болезненность в области передней стенки пазухи, постназальный синдром. Следует понимать, что такие же симптомы могут наблюдаться и при рините. Односторонняя обструкция носа с болевыми симптомами и ощущениями сдавливания в области лица отмечаются довольно часто при ОВС, в то время как наличие неприятного запаха и гнилостного привкуса при болезненности зуба позволяет дифференцировать хронический верхнечелюстной синусит и одонтогенный гайморит.
Наиболее частыми причинами развития одонтогенной формы поражения гайморовой пазухи являются периапикальные абсцессы, экстракция зуба, пародонтальные патологии, формирование ороантрального соустья и наличие инородных тел в пространстве верхнечелюстного синуса. ОВС также может развиться вследствие остеомиелита верхней челюсти, радикулярных кист, механической травмы слизистой пазухи в ходе эндодонтического лечения, выведения материала силера за апекс корня, неправильного позиционирования имплантатов и неадекватно проведенной субантральной аугментации.
Патогенез ОВС
Кроме тесного анатомического взаиморасположения моляров и премоляров верхней челюсти к гайморовой пазухи, на патогенез поражения последней могут влиять и ряд других не менее значимых факторов. Эндоантральный синдром был идентифицирован Селденом как распространение пульпарного поражения в пространство синуса. Данный синдром характеризуется наличием поражения пульповой камеры, рентгенологической зоны периапикального поражения, рентгенологической потерей костной разделяющей пластинки, рентгенологическим распространением поражения в пространство пазухи и вариациями рентгенконстрастных следов на нижней стенке синуса. Молниеносное распространение одонтогенной инфекции кроме верхнечелюстного синусита может спровоцировать развитие подглазничного целлюлита, временной слепоты и даже опасного для жизни тромбоза кавернозного синуса. Распространенность ОВС с признаками вторичных периапикальных поражений составляет 16–65%, а лечение данной формы патологии является более сложным по сравнению с первичными поражениями синуса. Эндоассоцированные поражения, которые проникают в пространство пазухи, характеризуются наличием эпителиальных клеток, которые окружены соединительной воспалительной тканью. Развитие данных поражений отмечается в ходе острой, инвазивной или даже хронической фазы заболеваний. Острая фаза поражения характеризуется значительной инвазией первичного очага и распространением бактерий в пространство пазухи и на поверхность Шнайдеровой мембраны, что, в свою очередь, вызывает гипертрофические изменения слизистой. Если в ходе эндодонтического лечения данные микроорганизмы не будут элиминированы, данные гипертрофические изменения могут спровоцировать развитие рецидива пародонтита или вторичных периапикальных поражений. Еще одной причиной ОВС является отек Шнайдеровой мембраны с формированием инфильтратов из воспалительных клеток, ретенционных кист, гипертрофических рубцов и грануляций, очагов гиалинизации и некроза. Апикальные поражения могут привести сначала к воспалению и утолщению Шнайдеровой мембраны топографически смежной с проблемными корнями зубов, а позже – и к развитию периапикального остеита с гиперплазией слизистой верхнечелюстного синуса.
Микробиологические аспекты синусита и гипотеза биопленки
При ОВС отмечают наличие полимикробных ассоциаций с преобладанием количества анаэробных микроорганизмов как в ротовой полости, так и в верхних дыхательных путях. Более чем в 75% клинических случаев ОВС отмечают наличие таких аэробных бактерий, как Staphylococcus aureus и Streptococcus pneumonia (S. pneumonia) и анаэробных Peptostreptococcus и Prevotella spp., у 10-12% пациентов с ОВС идентифицируют наличие метициллин-резистентного Staphylococcus aureus. Такие бактерии и грибки как Streptococcus, Propionibacterium и Candida albicans могут вызывать развитие вторичных периапикальных поражений, при этом этиология таковых предусматривает возможности для потенциального участия более чем 158 бактериальных видов и 3 видов грибков. Наиболее распространенным видом бактерий при вторичных периапикальных поражениях являются бактерии Enterococcus faecalis. В структуре ОВС-ассоциированных периапикальных очагов отмечают наличие гранул биопленки, что и стало основой для развития гипотезы роли биоплёнки в механизме патогенеза поражений синуса. Согласно данной теории, предусматривается наличие динамических полимикробных ассоциаций с медленно реплицирующимися штаммами, встроенными в структуру внеклеточного полимерного матрикса, включая экзополисахариды, белки и нуклеиновые кислоты. Эти вещества внутри матрикса расположены в дискретных слоях между метаболически активными штаммами, находящимися во внешних покрытиях, подверженных воздействию более высоких концентраций кислорода и питательных веществ. При этом неподвижные бактерии локализируются в более глубоком и неактивном анаэробном ядре. Эти глубокие слои матрикса относительно защищены от антибиотиков, детергентов и антимикробных соединений, которые входят в состав реактивного комплекса при ответе гуморального или клеточного иммунитета. Эти же глубоконаходящиеся бактерии и отвечают за развитие хронических форм инфекционных поражений, что делает их ответственными за хронические инфекции. Бактериальная биопленка характеризуется уровнем идентификации в 70% у 25–100% образцов, собранных у пациентов с хроническим ринусинуситом. Основными патогенными компонентами биопленки, которые принимают непосредственное участие в развитие ОВС, являются S. aureus, Haemophilus influenza (H. influenza), P. aeruginosa (P. aeruginosa), коагулазонегативные стафилококки, Moraxella catarrhalis, S. pneumoniae и другие виды грибков и анаэробов. При исключении в ходе диагностики сопутствующих заболеваний носа за счет оценки состояния остеометальаного комплекса, врач всегда должен обеспечить направление образцов пациента на верификацию бактериальной биопленки в случаях наличия у него клинических признаков одонтогенного верхнечелюстного синусита.
Актиномицеты в верхнечелюстной пазухе
Определенные виды Actinomyces, включая A. israelii и A. radicidentis, могут быть обнаружены в экстрарадикулярных гранулах внутри пространства верхнечелюстной пазухи благодаря их своеобразным поверхностным свойствам, которые обеспечивают возможность прикрепление эпителия к воспалительным клеткам и бактериям полости рта. Поражения синуса, не ассоциированные с эндодонтическими патологиями, но вызваны актиномицетами, являются резистентными к реакциям иммунной системы хозяина, антибиотикам и ортоградному лечению, поскольку таковое не обеспечивает их полной элиминации. Трудность лечения инфекций верхнечелюстной пазухи, связанных с Actinomyces, состоит в необходимости реализаций хирургических методов вмешательства. При этом, наличие актиномицетов чаще всего рассматривается как специфический симптом соответствующей формы именно одонтогенного верхнечелюстного синусита.
Грибковый синусит
У пациентов с компрометированным состоянием иммунной системы, включая пациентов с плохо контролируемым сахарным диабетом, ВИЧ-инфекцией или пациентов, проходящих химиотерапию, поражения верхнечелюстного синуса могут быть вызваны грибковыми инфекциями. Аспергиллез или мукомикоз могут распространяться на стенку орбиты, в область височной ямки и даже в структуру мозга, вызывая признаки и симптомы аналогичные тем, которые развиваются при злокачественных поражениях. Большинство этих грибковых контаминантов проникают во внутрь через дыхательные пути и сохраняются в слизистой оболочке пазухи, образуя плесени и споры. Очаги грибковой инфекции могут привести к процессу дистрофической кальцификации и образованию ринолитов, которые можно увидеть на разного типа рентгенограммах. Особенно крупные ринолиты также известны как грибковые шарики. Развитие грибкового поражения пазухи также возможно при попадании в ее пространство разных инородных контаминированных объектов.
Фото 9. Одотогенный пансинусит, вызванный инфекцией в области правого первого моляра. Предоперационная ортопантомограмма (a), проекция Уотерса (b), аксиальный срез компьютерной томограммы с визуализацией синусита в структуре обеих верхнечелюстных пазух (c), коронарный срез компьютерной томограммы с визуализацией поражения этмоидальных и лобных пазух (d), и сагиттальный срез компьютерной томограммы с визуализацией очага инфекции в области правого первого моляра (е).

Цель хирургического лечения патологии верхнечелюстного синусита состоит в радикальной элиминации воздействия всех провоцирующих факторов и восстановлении функции мукоцилиарного клиренса. Учитывая, что пациенты с грибковым синуситом характеризуются наличием иммунодефицитных состояний, целесообразно максимально рано обеспечить верификацию клинически важных признаков и симптомов.
Лечение одонтогенного верхнечелюстного синусита
Ранняя диагностика и лечение
Хотя хронический синусит, включая ХРИ и OВС, является распространенным заболеванием, проблемными остаются аспекты его ранней и правильной диагностики. Хронический риносинусит сначала не вызывает болевых ощущений в области лица, поэтому врачи-стоматологи часто могут пропускать таких пациентов на своем приеме. Однако при верификации обструкции полости носа и полипов (с помощью КТ или в ходе эндоскопического вмешательства) врач может назначить внутриносовые ирригации и противоотечные средства. При подтверждении наличия полипов в ходе диагностики пациенту назначаются системные стероидные препараты и уменьшается доза противоотечных средств. При рецидивах патологии пазухи показано проведение хирургических вмешательств с целью восстановления нормальной функции мукоцилиарного клиренса и обеспечения проходимости остеометального комплекса. Эндоскопические вмешательства могут быть показаны при девиациях костной перегородки, блокировке носовой раковины, увеличение размера устья и гипертрофии тканей в среднем носовом ходе. Слизистые ретенционные кисты часто могут быть обнаружены на ортопантомограммах и компьютерных томографах дна верхнечелюстной пазухи, и часто могут быть спутаны с одонтогенными воспалительными кистами (фото 5 и 6). Несмотря на то, что зачастую лечение ретенционных кист проводить не рекомендуется, ретенционные кисты могут быть легко удалены с помощью эндоскопа. В структуре гайморовой и лобной пазухи также могут отмечаться мукоцеле, которые развиваются вследствие блокады физиологического дренажа, когда секретируемая слизь накапливается и приводит к расширению костных границ из-за значительного давления. В случаях хронического риносинусита у пациентов после прохождения радиотерапии, а также у пациентов с признаками кистозного фиброза, также всегда нужно рассматривать необходимость проведения раннего хирургического вмешательства, учитывая возможность секреции очень густой слизи в условиях патологии, и потенциал слизистой к рецидивирующему образованию рубцов.
Оперативное лечение
Даже несмотря на наличие постоянного дискомфорта в одной из пазух и присутствие при этом неприятного запаха, что типично для ОВС, диагностика данной патологии со стороны стоматолога является довольно сложной. Кроме методов КТ и КЛКТ, для диагностики также можно использовать ортопантомограммы и снимки в проекции Уотерса. После постановки диагноза сначала можно приняться за лечения одонтогенных причин патологии, а уже потом – и за хирургическим вмешательтсва (функциональную хирургическую эндоскопию или же операцию по Колдуэллу-Люку). Иногда болевые ощущения в области лица с напряженными головными болями и болями в области височно-нижнечелюстного сустава могут быть ошибочно диагностированы как ОВС, хотя на самом деле они могут быть вызваны и рядом других патологий. Выбор техники формирования доступа к пазухе базируется на опыте хирурга и учете имеющихся клинических возможностей. Очень часто с данной целью применяют операцию по Колдуэллу-Люку, которая, однако чревата возможными негативными последствиями. Последние включают риск формирования постоперационных верхнечелюстных кист, развития послеоперационных отеков лица вследствие кровотечения, возникновения парестезий из-за поражения подглазничного нерва и склероза стенки гайморовой пазухи (фото 10). Кроме того, после операции по Колдуэллу-Люку довольно нелегко провести реконструкцию альвеолярного гребня для последующей установки в него дентальных имплантатов.
Фото 10. Схематические чертежи хирургических подходов формирования доступа к пазухе у пациентов с одонтогенным верхнечелюстным синуситом: по Колдуэллу-Люку (a), функциональная хирургическая эндоскопия (b) и модифицированная хирургическая эндоскопия (c, d, e)

Функциональная хирургическая эндоскопия характеризуется определенными преимуществами, включая возможности формирования более широкого и гибкого доступа в условиях ограниченных размеров гайморовой пазухи. Удаление пораженных тканей через расширение физиологического отверстия в среднем носовом ходе позволяет восстановить функцию синуса при минимальном дискомфорте для пациента и при этом еще и сохранить целостность Шнайдеровой мембраны (фото 10b). Однако и эндоскопические вмешательства также связаны с определенными осложнениями: при неадекватно обширном подходе можно удалить излишнее количество тканей, при недостаточном – наоборот, не полностью удалить все пораженные структуры, таким образом, увеличив риск развития рецидива.
Консолидированное лечение
Учитывая одонтогенную природу ОВС, целесообразным является обеспечение полной элиминации инфекции со стороны проблемного зуба. Для этого можно провести экстракцию зуба, или же апикальную хирургию с эндодонтическим лечением. Кроме того, учитывая, что патология ОВС «стареет», у пациентов пожилого возраста после синус-направленного вмешательства, сразу можно проводить и реконструкцию костного гребня для обеспечения дальнейшей поддержки разных видов стоматологических протезов. Консолидация разных подходов к лечению ОВС может предусматривать реализацию трех алгоритмов формирования доступа: во-первых, формирование интраорального доступа через область проблемного зуба, во-вторых – достижение пространства пазухи эндоскопически через нос и остеомеатальный комплекс, в-третьих – формирование костного окна через стенку верхней челюсти. В последнее время врачи все чаще стали использовать модифицированный эндоскопический подход, который позволяет эффективно скорректировать последствия перелома орбиты, удалить пораженные ткани из пространства синуса и изъять «мигрирующие имплантаты» (фото 10). Благодаря модифицированному эндоскопическому подходу удается максимально сохранить физиологическую функцию пазухи и избежать осложнений, ассоциированных с другими хирургическими методами формирования доступа к верхнечелюстному синусу.
Профилактика ожидаемых осложнений
Формирование ороантрального соустья является наиболее распространенным осложнением, связанным с патологией ОВС. Основными причинами формирования ороантрального соустья являются удаления моляров, из-за которых развиваются около 80% всех случаев данных осложнений. Такое соустье также называют ороантральной фистулой или ороантральным соединением. Основными симптомами наличия ороанатрального соединения являются незаживающий характер отверстия между пазухой и ротовой полотью, через которое выделяется гнойный экссудат, особенно в случаях, когда пациент пьет или выдувает нос. Для эффективного закрытия ороантрального соустья нужно учитывать его размер и глубину. Небольшие соустья могут закрываться сами посредством эпителия и грануляционной ткани, однако в противных случаях в результате гиперплазии слизистой синуса могут формироваться большие и стабильные свищи между приносовым пространством и ротовой полостью. Закрывать подобные образования можно также посредством эндоскопического вмешательства. Для этой же цели можно использовать расширенные лоскуты, островообразные лоскуты и лоскуты на ножках (фото 11). При тяжелых формах фистул прибегают к применению резорбируемых мембран, золотой фольги и жировых лоскутов. При этом в любом случае закрытия соустья первоначально важно убедиться в том, что сама пазуха остается чистой и не демонстрирует признаков инфекционного поражения.
Фото 11. Схематические рисунки закрытия ороантрального свища в полости рта. Непосредственное закрытие (1), щечный лоскут (2), небный лоскут (3) и небный вращающийся лоскут на ножке (4).

Выводы
Частота развития одонтогенного верхнечелюстного синусита значительно выше той, которая отмечается в литературных источниках. Приблизительно от 30% до 40% случаев хронического гайморита ассоциированы с одонтогенной этиологией. Этиопатогенез данного поражения остается не до конца изученным, но наиболее частыми причинами развития ОВС являются последствия стоматологического лечения дистальных зубов верхней челюсти и результаты неадекватно-спланированных процедур установки дентальных имплантатов. При подозрении на связь поражения пазухи с проблемным зубом можно проверить состояние Шнайдеровой мембраны на наличие бактериальной биопленки. Ранняя эндоскопическая и рентгенологическая диагностика, даже посредством прицельных снимков в проекции Уотерса или обычных ортопантомограмм, позволит более объективно оценить состояние пазухи у пациентов с признаками хронического риносинусита. При выборе метода лечения ОВС врачи должны быть осведомлены о возможностях современных эндоскопических подходов, которые характеризуются меньшими уровнями рисков развития осложнений и возможностями для сохранения физиологической функции верхнечелюстного синуса.
Автор: Soung Min Kim (Южная Корея)

























































































































































0 комментариев