Представлены результаты исследования слизистой оболочки верхнечелюстной пазухи при неинвазивном и хроническом инвазивном аспергиллезе. Методами световой, электронной микроскопии и морфометрии установлено, что основными признаками внутриклеточной реорганизации эпителиоцитов при неивазивной форме являются снижение белок-синтетической и пластической функций. На отдельных участках эпителия присутствуют клетки, характеризующиеся малоизмененными цитоплазматическими органеллами. В целом выявленные изменения свидетельствуют об утрате эпителием защитных и барьерных свойств и, как следствие, о неполноценном его участии в микоцилиарном клиренсе. При инвазивной форме аспергиллезного синусита, несмотря на выявленную однослойную метаплазию, в эпителиоцитах наблюдались интенсивные белок-синтетические и пластические процессы, что может указывать на высокие репаративные возможности эпителия.
Введение
Проблема микотических инфекций околоносовых синусов в настоящее время приобрела важное медико-социальное значение в связи со значительным их распространением. При этом возросли не только число и тяжесть грибковых инфекций, но также разнообразие грибов, выступающих в качестве этиологических агентов. До последнего времени считалось, что такие микозы, как инвазивный аспергиллез, кокцидиоидоз, криптококкоз, встречаются только в странах с тропическим климатом и в связи с этим являются эндемичными заболеваниями. Однако в последнее время спорадические случаи тяжелых микозов отмечаются и в России. По данным Московского научно-практического центра оториноларингологии, пациенты с грибковыми поражениями носа и околоносовых пазух составляют 14% от всех больных микозами ЛОР-органов.
Согласно классификации W.J. Fokkens и соавт. выделяют пять форм грибковых заболеваний околоносовых пазух: острый инвазивный риносинусит, хронический инвазивный риносинусит, гранулематозный инвазивный риносинусит, грибковый шар (мицетома, или аспергиллема), неинвазивный (аллергический) грибковый синусит. Наиболее распространенной формой микоза верхнечелюстных пазух синусов является грибковое тело. Возбудителями этой группы заболеваний являются условно-патогенные плесневые грибы рода Aspergillus. Данному роду грибов присущи адгезивная активность к клеткам эпителия, способность к внутриклеточному паразитированию, продукция токсинов и протеолитических ферментов.
Основную категорию больных составляют люди зрелого и пожилого возраста с наличием предрасполагающих факторов: сахарный диабет, длительный прием антибиотиков, кортикостероидов, иммунодефициты. На ранних стадиях заболевания клиническая картина сходна с таковой при хроническом синусите. Проводимое консервативное лечение неэффективно. При компьютерной и магнитно-резонансной томографии обнаруживаются воспалительные изменения слизистой оболочки (СО) с рентгенологическими симптомами грибкового синусита. Однако единственно надежным методом верификации диагноза является гистологическое исследование с обнаружением мицелия грибов в СО пазухи, кровеносных сосудах или кости. В литературе имеются отрывочные сведения, касающиеся гистологической картины аспергиллезного верхнечелюстного синусита. Наиболее актуальным является морфологическое исследование СО верхнечелюстной пазухи (ВЧП), способное обеспечить диагностику типа воспаления и прогноз течения одонтогенных грибковых неинвазивных и инвазивных синуситов.
Цель исследования — изучить ультраструктурные изменения слизистой оболочки верхнечелюстной пазухи (СО ВЧП) при неинвазивном и хроническом инвазивном аспергиллезе.
Материал и методы
За период 2005—2010 гг. проведено обследование 87 больных с диагнозом «хронический одонтогенный грибковый синусит». Все больные были разделены на две группы: 1-я — 64 пациента в возрасте от 21 до 42 лет (средний возраст (28,81 ± 2,36) года) с аспергиллемой верхнечелюстных синусов; 2-я группа — 23 пациента в возрасте от 43 до 55 лет (средний возраст (48,30 ± 3,42) года) с хроническим инвазивным аспергиллезом верхнечелюстных пазух. У всех участников исследования в пазухах был обнаружен пломбировочный материал. Диагноз основывался на клинических, лучевых, эндоскопических и микологических методах исследования. У представителей 1-й группы при микологическом исследовании грибковое тело идентифицировано как род гриба Aspergillus. Видовая принадлежность не определялась. Во 2-й группе больных выявлены предрасполагающие факторы: у 11 пациентов в анамнезе установлен длительный (в течение 7—9 лет) прием антибиотиков, 12 человек имели сопутствующие заболевания: сахарный диабет 1-го типа (6 пациентов), бронхиальную астму средней степени тяжести (6 человек). При культуральном исследовании во всех случаях в этой группе пациентов выделен гриб рода Aspergillus. IgE-антитела к А. fumigatus в сыворотке крови обнаружены у всех больных и находились в диапазоне от 1,3 до 14,6 ЕД RAST, галактоманнан в сыворотке крови (оптическая плотность более 1,0) выявлен у 21 пациента (91,3%). При анализе компьютерных томограмм ни в одном случае деструкции костных стенок пазух не обнаружено.
Морфологическое исследование СО ВЧП проведено у 14 пациентов с диагнозом «аспергиллема» и у 8 пациентов с хроническим инвазивным аспергиллезом верхнечелюстных пазух.
Контрольная группа представлена биоптатами визуально неизмененной СО ВЧП, полученными в ходе оперативных вмешательств по поводу ретенционных кист у 6 пациентов. Возраст больных составил от 17 до 26 лет (средний возраст (23,83 ± 2,51) года). Биопсийный материал был получен в соответствии с требованиями этических комитетов Сибирского государственного медицинского университета (г. Томск) и ГУЗ «Новосибирская областная клиническая больница» (г. Новосибирск) и при наличии письменного согласия пациентов.
Для светооптического исследования биоптаты СО фиксировали в 10%-м нейтральном формалине в течение 1 сут и заливали в парафин. Депарафинированные срезы толщиной 5—7 мкм окрашивали гематоксилином и эозином, ставили PAS-реакцию.
Для электронно-микроскопического исследования материал фиксировали в 4%-м растворе параформальдегида, постфиксировали в 1%-м растворе четырехокиси осмия, обрабатывали по стандартной методике и заключали в смесь эпона и аралдита. Полутонкие и ультратонкие срезы готовили на ультратоме Ultra-tome III (LKB, Швеция). Полутонкие срезы окрашивали 1%-м раствором азура II или толуидиновым синим и исследовали под световым микроскопом. Ультратонкие срезы наносили на сетки-подложки с формваровой пленкой-подложкой и контрастировали 2%-м раствором уранилацетата и цитратом свинца. Полученные препараты исследовали в электронном микроскопе JEM-100 CXII (JEOL, Япония). На электронных микрофотографиях эпителиоцитов с использованием сетки Автандилова рассчитывали удельный объем (%) митохондрий, гранулярной эндоплазматической сети (ГЭС), ядерно-цитоплазматическое отношение (ЯЦО) (отношение удельного объема ядра к объему клетки).
Полученные цифровые данные статистически обрабатывали при помощи программы Microsoft Exсel. Для оценки межгрупповых различий применяли t-критерий Стьюдента. Критический уровень значимости p принимали равным 0,05.
Результаты и обсуждение
В контрольной группе СО ВЧП выстлана много-рядным реснитчатым эпителием. При исследовании биоптатов 1-й группы с помощью световой микроскопии в первую очередь обращали на себя внимание атрофия, гидропическая дистрофия эпителиоцитов, выраженные плазморрагии, отек и истончение собственной пластинки СО ВЧП. Отмечалось уменьшение высоты эпителиоцитов или их уплощение. Зачастую эпителий не представлял единого пласта. На некоторых участках эпителий имел типичное строение. Особенностями биоптатов 2-й группы явились выраженная клеточная инфильтрация собственной пластинки, обширные геморрагии, зоны фокального некроза и грибковый мицелий. СО ВЧП выстлана однослойным кубическим или призматическим эпителием.
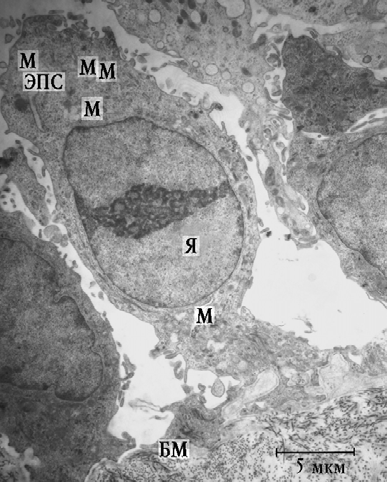
При электронно-микроскопическом исследовании биоптатов СО ВЧП 1-й группы установлено, что эпителиоциты имели эндотелиоподобную или призматическую форму без признаков специализации на реснитчатые или бокаловидные клетки. Зачастую наблюдались клетки, имеющие расширенную апикальную часть и суженную базальную (рис. 1). В связи с выраженной метаплазией эпителия и отсутствием дифференцировки клеток на реснитчатые и бокаловидные в 1-й и 2-й группах морфометрическому исследованию подвергались только базальные эпителиоциты (таблица).
Рис. 1. Фрагмент эпителия СО ВЧП пациентки 1-й группы: Я — ядро; М — митохондрии; ЭПС — эндоплазматическая сеть; БМ — базальная мембрана
Результаты морфометрического исследования эпителиоцитов СО ВЧП при неинвазивной и инвазивной формах аспергиллезного синусита (M ± m), %
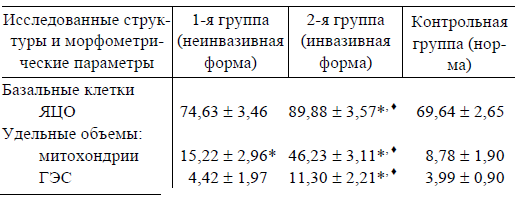
* Различия статистически значимы по сравнению с показателями в контроле (p < 0,05).
♦ Различия статистически значимы по сравнению с показателями в 1-й группе (p < 0,05).
В электронно-прозрачной цитоплазме в апикальном отделе клеток определялись единичные мелкие митихондрии с плотным матриксом, короткие цистерны ГЭС и малое число рибосом. Удельный объем митохондрий был увеличен в 1,73 раза, а ГЭС — в 1,11 раза по сравнению с таковыми в контроле (таблица). Ядро эухромное овальной формы, нередко с неглубокими инвагинациями кариолеммы локализовалось в центральной или базальной частях цитоплазмы. В некоторых эпителиоцитах определялись одно-два эксцентрично расположенных ядрышка с преобладанием фибриллярного компонента. В подъядерной зоне визуализировались тонкие пучки тонофиламентов. Все это свидетельствует не только о снижении белок-синтетической и пластической функций эпителиоцитов, но и об их дегенеративных изменениях. Подобную картину — десквамацию эпителиоцитов — описали J.F. Tomee и соавт. при обработке культур клеток протеазами A. fumigatus; используя различные ингибиторы, авторы установили роль сериновых протеаз в процессе разрушения клеточного слоя.
Базальная мембрана сохраняла тонкофибриллярное строение. Местами неравномерно утолщена, главным образом за счет ее темной части.
В собственной пластинке популяция тканевых базофилов отличалась функциональной разнородностью. Часть из них находилась в стадии дегрануляции, при этом секрет гранул имел относительно гомогенную структуру, что свидетельствует об его незрелости. Коллагеновые волокна в зоне расположения гранул подвергались мукоидному набуханию. Некоторые тучные клетки имели овальное эухромное ядро с ровными контурами кариолеммы. Секреторные гранулы гетерогенной структуры и плотности: сетевидной, гомогенной, часть из них опустошены. Единичные тучные клетки апоптотически изменены.
Эпителиоидные клетки имели разную форму и функциональную активность. Часть из них продуцировала секреторные гранулы в межклеточное пространство. В зонах расположения эпителиоидных клеток выявлялись участки лизиса коллагеновых волокон и их фибриноидные изменения. Фибробласты в большинстве своем находились в состоянии функционального покоя. В цитоплазме некоторых фибробластов определялись набухшие митохондрии с просветленным матриксом и деструктивными кристами, крупными фагосомами и миелиноподобными тельцами.
Исследование ультраструктуры микрососудов в биоптатах 1-й группы позволило выявить два основных типа эндотелиоцитов. При первом типе обращала на себя внимание альтерация эндотелиальной выстилки. Стенка кровеносных сосудов значительно истончена, с периваскулярным отеком и формирующимся склерозом. Ядра эндотелиоцитов неправильной формы с изрезанными контурами. Мелкие глыбки гетерохроматина рассеяны по нуклеоплазме, вдоль кариолеммы выражена конденсация хроматина. Цитоплазма эндотелиоцитов высокой электронной плотности, вследствие чего идентификация органелл затруднена. В околоядерной зоне определялись митохондрии с плотным матриксом со слабовизуализированными кристами. Отростки эндотелиоцитов утолщены. Люминальная поверхность эндотелиоцитов формировала неровный контур с элементами клазматоза. Микропиноцитозные пузырьки выявлялись вдоль базальной и люминальной поверхностей. Базальная мембрана капилляров утолщена, что свидетельствует о десквамации эндотелиальных клеток. Другие эндотелиоциты имели умеренной электронной плотности цитоплазму. Ядра крупные полиморфные, с маргинальной полоской гетерохроматина. В цитоплазме определялись короткие цистерны ГЭС, три-четыре митохондрии с редкими кристами. Люминальная поверхность имела неровный контур с явлениями клазматоза. Пиноцитозные пузырьки располагались вдоль люминальной и базальной поверхностей эндотелиоцитов. Периваскулярно выражен отек собственной пластинки. Отмечалась трансэндотелиальная миграция нейтрофильных лейкоцитов и эпителиоидных клеток. В периваскулярной зоне тучные клетки с признаками дегрануляции, иногда наблюдались свободно лежащие гранулы. В целом изменения микроциркуляторного русла носят признаки дегенерации и компенсаторной гиперплазии эндотелиальных клеток, плазматическое пропитывание и гиалиноз базальной мембраны.
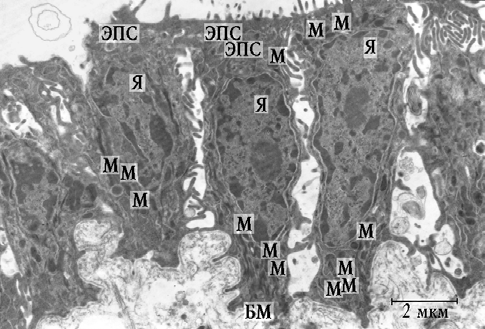
Во 2-й группе биоптатов СО ВЧП при электронно-микроскопическом исследовании определялись эпителиоциты разнообразной формы: кубической, призматической, уплощенной, многоугольной формы. Зачастую отсутствовал контакт между клетками (рис. 2).
Рис. 2. Фрагмент эпителия СО ВЧП пациента 2-й группы: Я — ядро; М — митохондрии; ЭПС — эндоплазматическая сеть; БМ — базальная мембрана
Цитоплазма формировала многочисленные длинные отростки. На апикальной поверхности эпителиоцитов определялись цитоплазматические выросты, напоминающие микроворсинки. Ядра содержали гетерохроматин и располагались в центральной или апикальной частях клеток. Вследствие множественных инвагинаций кариолеммы ядра приобретали лопастную или двудольчатую форму. Ядрышко крупное с преобладанием гранулярного компонента, расположено эксцентрично или маргинально. Клетки отличались высоким ядерно-цитоплазматическим отношением (таблица).
В осмиофильной цитоплазме эпителиоцитов отчетливо определялись митохондрии с электронно-плотным гомогенным матриксом, короткие, диффузно расположенные цистерны ГЭС. Удельный объем митохондрий увеличен в 5,27 раза, а ГЭС — в 2,83 раза по сравнению с показателями в контроле (таблица). Перинуклеарно и в базальном отделе клеток отчетливо визуализировались толстые пучки спирально ориентированных тонофиламентов. Все это свидетельствует об интенсивных белок-синтетической и пластической функциях эпителиоцитов и, как следствие, высоких репаративных возможностях эпителия. В связи с этим можно предполагать, что такие «темные» клетки являются предшественниками специализированных эпителиоцитов. Это согласуется с данными K. Fukazawa и соавт.. Базальная мембрана на всем протяжении образовывала множественные глубокие складки. Ее светлая часть была неравномерно утолщена на всем протяжении. Непосредственно под базальной мембраной располагались нейтрофильные лейкоциты. В собственной пластинке лимфоциты имели множественные псевдоподии, что свидетельствует о возможностях их активного передвижения. Имелись единичные эпителиоидные клетки. Коллагеновые волокна теряли свою правильную ориентацию. Нередко наблюдались участки их фибриноидных изменений.
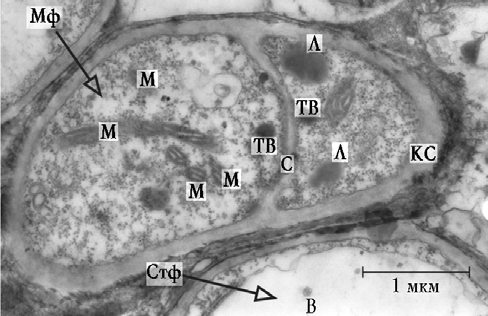
В глубоких отделах собственной пластинки СО ВЧП определялся вегетативный мицелий грибов Asper-gillus spp. На электронно-микроскопическом уровне клетки вегетативного мицелия находились на разных стадиях своего развития: от молодых до стареющих (рис. 3). Молодые формы гиф содержали одно эухромное ядро овальной формы. Кариолемма форми-ровала незначительные инвагинации. В некоторых ядрах определялось одно ядрышко гранулярно-фибриллярного строения. Вблизи ядра локализовались разнообразной формы и размеров митохондрии. Цитозоль содержал запасные вещества в виде липидных включений, разных по размеру, форме и электронной плотности. Наиболее крупные липидные включения располагались вблизи септ. В стареющих клетках мицелия отмечалось формирование центральной вакуоли, занимающей половину или большую часть цитоплазмы, а иногда почти весь ее объем. Образование центральной вакуоли было сопряжено с аутолизом органелл и цитозоля.
Рис. 3. Фрагмент вегетативного мицелия гриба Aspergillus spp.: М — митхондрии; ТВ — тельца Воронина; Л — липидные включения; С — септа; КС — клеточная стенка; В — вакуоль; Мф — молодая форма клетки; Стф — стареющая форма клетки
Латеральные клеточные стенки истончены, определялась неравномерность их толщины и контрастности. Иногда можно было наблюдать разрывы клеточной стенки с выходом содержимого наружу. Старению подвергались и межклеточные септы. Последние на продольном разрезе имели извитую форму и низкую электронную плотность, возникшую вследствие лизиса микрофибрилл септ. По периферии мицелий окружен нейтрофильными лейкоцитами, лимфоцитами, фибробластами и участками лизиса ткани. Нейтрофилы находились в активированном состоянии, о чем свидетельствовало наличие большого числа псевдоподий, содержащих специфические гранулы. Нейтрофилы способны распознавать галактоманан клеточной стенки грибов. Основным механизмом киллинга является продукция перекисных радикалов кислорода, а также дегрануляция нейтрофилов. Предполагается, что сериновая протеаза, входящая в состав гранул фагоцитов, является основным агентом, повреждающим стенку клеток грибов. Зачастую наблюдалось проникновение нейтрофилов между клетками вегетативного мицелия (рис. 4). При этом фунгицидный эффект представляется весьма сомнительным. Ни в одном случае явления фагоцитоза не зарегистрированы. Некоторые фибробласты, расположенные по периферии мицелия, находились в стадии активного коллагеногенеза. Тем не менее на отдельных участках ограничивающая фиброзная капсула отсутствовала.
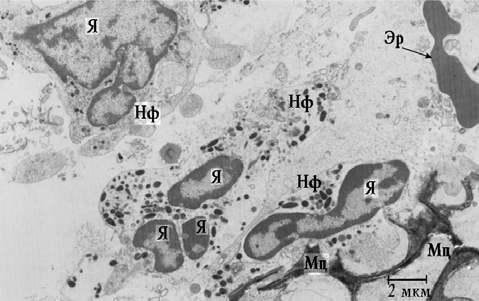
Рис. 4. Фрагмент собственной пластинки СО ВЧП пациента 2-й группы. Проникновение нейтрофилов между клетками мицелия Aspergillus sp.: Мц — мицелий; Нф — нейтрофил; Я — ядро
Важнейшим свойством грибов Aspergillus spp. является способность прорастать в кровеносные сосуды с последующим их тромбозом. Это, в свою очередь, приводит к нарушению микроциркуляции вплоть до образования некрозов. Последний факт нашел от-ражение в данном исследовании (см. рис. 1).
Значительные изменения обнаружены в ультра-структурной организации микрососудов СО ВЧП. Ядра эндотелиоцитов имели продолговатую форму с глу-бокими инвагинациями нуклеолеммы. Отростки эндотелиальных клеток утолщены. Цитоплазма умеренной плотности содержала в околоядерной зоне митохондрии с хлопьевидным матриксом и деструкцией крист. Апикальная плазмолемма преимущественно имела ровный контур, иногда с единичными инвагинациями. Микропиноцитозные везикулы не определялись.
Заключение
Таким образом, при верхнечелюстном синусите с формированием аспергиллемы в эпителии СО ВЧП преобладают дегенеративно-дистрофические процессы, вероятно, связанные с экзотоксинами грибов. Основным признаком внутриклеточной реорганизации эпителиоцитов является снижение белок-синтетической и пластической функций. На отдельных участках эпителия присутствуют клетки, характеризующиеся малоизмененными цитоплазматическими органеллами. Данные изменения носят адаптивно-приспособительный характер, направленный на усиление защитного потенциала СО ВЧП. В целом выявленные изменения свидетельствуют об утрате эпителием защитных и барьерных свойств и, как следствие, неполноценном его участии в микоцилиарном клиренсе.
При инвазивной форме аспергиллезного синусита в СО ВЧП отмечаются признаки гранулематозного воспаления. Несмотря на выявленную однослойную метаплазию, в эпителиоцитах наблюдались интенсивные белок-синтетические и пластические процессы, что может указывать на высокие репаративные возможности эпителия.
Авторы: О.Д. Байдик канд. мед. наук, доцент кафедры стоматологии СибГМУ (г. Томск).
П.Г. Сысолятин - заслуженный деятель науки РФ, д-р мед. наук, профессор кафедры госпитальной хирургической стоматологии и челюстно-лицевой хирургии НГМУ, врач отделения челюстно-лицевой хирургии ГУЗ «Новосибирская ОКБ» (г. Новосибирск).
О.В. Логинова - аспирант кафедры факультетской хирургической стоматологии Первого МГМУ им. И.М. Сеченова (г. Москва)
Представлены результаты исследования слизистой оболочки верхнечелюстной пазухи при неинвазивном и хроническом инвазивном аспергиллезе. Методами световой, электронной микроскопии и морфометрии установлено, что основными признаками внутриклеточной реорганизации эпителиоцитов при неивазивной форме являются снижение белок-синтетической и пластической функций. На отдельных участках эпителия присутствуют клетки, характеризующиеся малоизмененными цитоплазматическими органеллами. В целом выявленные изменения свидетельствуют об утрате эпителием защитных и барьерных свойств и, как следствие, о неполноценном его участии в микоцилиарном клиренсе. При инвазивной форме аспергиллезного синусита, несмотря на выявленную однослойную метаплазию, в эпителиоцитах наблюдались интенсивные белок-синтетические и пластические процессы, что может указывать на высокие репаративные возможности эпителия.
Введение
Проблема микотических инфекций околоносовых синусов в настоящее время приобрела важное медико-социальное значение в связи со значительным их распространением. При этом возросли не только число и тяжесть грибковых инфекций, но также разнообразие грибов, выступающих в качестве этиологических агентов. До последнего времени считалось, что такие микозы, как инвазивный аспергиллез, кокцидиоидоз, криптококкоз, встречаются только в странах с тропическим климатом и в связи с этим являются эндемичными заболеваниями. Однако в последнее время спорадические случаи тяжелых микозов отмечаются и в России. По данным Московского научно-практического центра оториноларингологии, пациенты с грибковыми поражениями носа и околоносовых пазух составляют 14% от всех больных микозами ЛОР-органов.
Согласно классификации W.J. Fokkens и соавт. выделяют пять форм грибковых заболеваний околоносовых пазух: острый инвазивный риносинусит, хронический инвазивный риносинусит, гранулематозный инвазивный риносинусит, грибковый шар (мицетома, или аспергиллема), неинвазивный (аллергический) грибковый синусит. Наиболее распространенной формой микоза верхнечелюстных пазух синусов является грибковое тело. Возбудителями этой группы заболеваний являются условно-патогенные плесневые грибы рода Aspergillus. Данному роду грибов присущи адгезивная активность к клеткам эпителия, способность к внутриклеточному паразитированию, продукция токсинов и протеолитических ферментов.
Основную категорию больных составляют люди зрелого и пожилого возраста с наличием предрасполагающих факторов: сахарный диабет, длительный прием антибиотиков, кортикостероидов, иммунодефициты. На ранних стадиях заболевания клиническая картина сходна с таковой при хроническом синусите. Проводимое консервативное лечение неэффективно. При компьютерной и магнитно-резонансной томографии обнаруживаются воспалительные изменения слизистой оболочки (СО) с рентгенологическими симптомами грибкового синусита. Однако единственно надежным методом верификации диагноза является гистологическое исследование с обнаружением мицелия грибов в СО пазухи, кровеносных сосудах или кости. В литературе имеются отрывочные сведения, касающиеся гистологической картины аспергиллезного верхнечелюстного синусита. Наиболее актуальным является морфологическое исследование СО верхнечелюстной пазухи (ВЧП), способное обеспечить диагностику типа воспаления и прогноз течения одонтогенных грибковых неинвазивных и инвазивных синуситов.
Цель исследования — изучить ультраструктурные изменения слизистой оболочки верхнечелюстной пазухи (СО ВЧП) при неинвазивном и хроническом инвазивном аспергиллезе.
Материал и методы
За период 2005—2010 гг. проведено обследование 87 больных с диагнозом «хронический одонтогенный грибковый синусит». Все больные были разделены на две группы: 1-я — 64 пациента в возрасте от 21 до 42 лет (средний возраст (28,81 ± 2,36) года) с аспергиллемой верхнечелюстных синусов; 2-я группа — 23 пациента в возрасте от 43 до 55 лет (средний возраст (48,30 ± 3,42) года) с хроническим инвазивным аспергиллезом верхнечелюстных пазух. У всех участников исследования в пазухах был обнаружен пломбировочный материал. Диагноз основывался на клинических, лучевых, эндоскопических и микологических методах исследования. У представителей 1-й группы при микологическом исследовании грибковое тело идентифицировано как род гриба Aspergillus. Видовая принадлежность не определялась. Во 2-й группе больных выявлены предрасполагающие факторы: у 11 пациентов в анамнезе установлен длительный (в течение 7—9 лет) прием антибиотиков, 12 человек имели сопутствующие заболевания: сахарный диабет 1-го типа (6 пациентов), бронхиальную астму средней степени тяжести (6 человек). При культуральном исследовании во всех случаях в этой группе пациентов выделен гриб рода Aspergillus. IgE-антитела к А. fumigatus в сыворотке крови обнаружены у всех больных и находились в диапазоне от 1,3 до 14,6 ЕД RAST, галактоманнан в сыворотке крови (оптическая плотность более 1,0) выявлен у 21 пациента (91,3%). При анализе компьютерных томограмм ни в одном случае деструкции костных стенок пазух не обнаружено.
Морфологическое исследование СО ВЧП проведено у 14 пациентов с диагнозом «аспергиллема» и у 8 пациентов с хроническим инвазивным аспергиллезом верхнечелюстных пазух.
Контрольная группа представлена биоптатами визуально неизмененной СО ВЧП, полученными в ходе оперативных вмешательств по поводу ретенционных кист у 6 пациентов. Возраст больных составил от 17 до 26 лет (средний возраст (23,83 ± 2,51) года). Биопсийный материал был получен в соответствии с требованиями этических комитетов Сибирского государственного медицинского университета (г. Томск) и ГУЗ «Новосибирская областная клиническая больница» (г. Новосибирск) и при наличии письменного согласия пациентов.
Для светооптического исследования биоптаты СО фиксировали в 10%-м нейтральном формалине в течение 1 сут и заливали в парафин. Депарафинированные срезы толщиной 5—7 мкм окрашивали гематоксилином и эозином, ставили PAS-реакцию.
Для электронно-микроскопического исследования материал фиксировали в 4%-м растворе параформальдегида, постфиксировали в 1%-м растворе четырехокиси осмия, обрабатывали по стандартной методике и заключали в смесь эпона и аралдита. Полутонкие и ультратонкие срезы готовили на ультратоме Ultra-tome III (LKB, Швеция). Полутонкие срезы окрашивали 1%-м раствором азура II или толуидиновым синим и исследовали под световым микроскопом. Ультратонкие срезы наносили на сетки-подложки с формваровой пленкой-подложкой и контрастировали 2%-м раствором уранилацетата и цитратом свинца. Полученные препараты исследовали в электронном микроскопе JEM-100 CXII (JEOL, Япония). На электронных микрофотографиях эпителиоцитов с использованием сетки Автандилова рассчитывали удельный объем (%) митохондрий, гранулярной эндоплазматической сети (ГЭС), ядерно-цитоплазматическое отношение (ЯЦО) (отношение удельного объема ядра к объему клетки).
Полученные цифровые данные статистически обрабатывали при помощи программы Microsoft Exсel. Для оценки межгрупповых различий применяли t-критерий Стьюдента. Критический уровень значимости p принимали равным 0,05.
Результаты и обсуждение
В контрольной группе СО ВЧП выстлана много-рядным реснитчатым эпителием. При исследовании биоптатов 1-й группы с помощью световой микроскопии в первую очередь обращали на себя внимание атрофия, гидропическая дистрофия эпителиоцитов, выраженные плазморрагии, отек и истончение собственной пластинки СО ВЧП. Отмечалось уменьшение высоты эпителиоцитов или их уплощение. Зачастую эпителий не представлял единого пласта. На некоторых участках эпителий имел типичное строение. Особенностями биоптатов 2-й группы явились выраженная клеточная инфильтрация собственной пластинки, обширные геморрагии, зоны фокального некроза и грибковый мицелий. СО ВЧП выстлана однослойным кубическим или призматическим эпителием.
При электронно-микроскопическом исследовании биоптатов СО ВЧП 1-й группы установлено, что эпителиоциты имели эндотелиоподобную или призматическую форму без признаков специализации на реснитчатые или бокаловидные клетки. Зачастую наблюдались клетки, имеющие расширенную апикальную часть и суженную базальную (рис. 1). В связи с выраженной метаплазией эпителия и отсутствием дифференцировки клеток на реснитчатые и бокаловидные в 1-й и 2-й группах морфометрическому исследованию подвергались только базальные эпителиоциты (таблица).
Рис. 1. Фрагмент эпителия СО ВЧП пациентки 1-й группы: Я — ядро; М — митохондрии; ЭПС — эндоплазматическая сеть; БМ — базальная мембрана

Результаты морфометрического исследования эпителиоцитов СО ВЧП при неинвазивной и инвазивной формах аспергиллезного синусита (M ± m), %

* Различия статистически значимы по сравнению с показателями в контроле (p < 0,05).
♦ Различия статистически значимы по сравнению с показателями в 1-й группе (p < 0,05).
В электронно-прозрачной цитоплазме в апикальном отделе клеток определялись единичные мелкие митихондрии с плотным матриксом, короткие цистерны ГЭС и малое число рибосом. Удельный объем митохондрий был увеличен в 1,73 раза, а ГЭС — в 1,11 раза по сравнению с таковыми в контроле (таблица). Ядро эухромное овальной формы, нередко с неглубокими инвагинациями кариолеммы локализовалось в центральной или базальной частях цитоплазмы. В некоторых эпителиоцитах определялись одно-два эксцентрично расположенных ядрышка с преобладанием фибриллярного компонента. В подъядерной зоне визуализировались тонкие пучки тонофиламентов. Все это свидетельствует не только о снижении белок-синтетической и пластической функций эпителиоцитов, но и об их дегенеративных изменениях. Подобную картину — десквамацию эпителиоцитов — описали J.F. Tomee и соавт. при обработке культур клеток протеазами A. fumigatus; используя различные ингибиторы, авторы установили роль сериновых протеаз в процессе разрушения клеточного слоя.
Базальная мембрана сохраняла тонкофибриллярное строение. Местами неравномерно утолщена, главным образом за счет ее темной части.
В собственной пластинке популяция тканевых базофилов отличалась функциональной разнородностью. Часть из них находилась в стадии дегрануляции, при этом секрет гранул имел относительно гомогенную структуру, что свидетельствует об его незрелости. Коллагеновые волокна в зоне расположения гранул подвергались мукоидному набуханию. Некоторые тучные клетки имели овальное эухромное ядро с ровными контурами кариолеммы. Секреторные гранулы гетерогенной структуры и плотности: сетевидной, гомогенной, часть из них опустошены. Единичные тучные клетки апоптотически изменены.
Эпителиоидные клетки имели разную форму и функциональную активность. Часть из них продуцировала секреторные гранулы в межклеточное пространство. В зонах расположения эпителиоидных клеток выявлялись участки лизиса коллагеновых волокон и их фибриноидные изменения. Фибробласты в большинстве своем находились в состоянии функционального покоя. В цитоплазме некоторых фибробластов определялись набухшие митохондрии с просветленным матриксом и деструктивными кристами, крупными фагосомами и миелиноподобными тельцами.
Исследование ультраструктуры микрососудов в биоптатах 1-й группы позволило выявить два основных типа эндотелиоцитов. При первом типе обращала на себя внимание альтерация эндотелиальной выстилки. Стенка кровеносных сосудов значительно истончена, с периваскулярным отеком и формирующимся склерозом. Ядра эндотелиоцитов неправильной формы с изрезанными контурами. Мелкие глыбки гетерохроматина рассеяны по нуклеоплазме, вдоль кариолеммы выражена конденсация хроматина. Цитоплазма эндотелиоцитов высокой электронной плотности, вследствие чего идентификация органелл затруднена. В околоядерной зоне определялись митохондрии с плотным матриксом со слабовизуализированными кристами. Отростки эндотелиоцитов утолщены. Люминальная поверхность эндотелиоцитов формировала неровный контур с элементами клазматоза. Микропиноцитозные пузырьки выявлялись вдоль базальной и люминальной поверхностей. Базальная мембрана капилляров утолщена, что свидетельствует о десквамации эндотелиальных клеток. Другие эндотелиоциты имели умеренной электронной плотности цитоплазму. Ядра крупные полиморфные, с маргинальной полоской гетерохроматина. В цитоплазме определялись короткие цистерны ГЭС, три-четыре митохондрии с редкими кристами. Люминальная поверхность имела неровный контур с явлениями клазматоза. Пиноцитозные пузырьки располагались вдоль люминальной и базальной поверхностей эндотелиоцитов. Периваскулярно выражен отек собственной пластинки. Отмечалась трансэндотелиальная миграция нейтрофильных лейкоцитов и эпителиоидных клеток. В периваскулярной зоне тучные клетки с признаками дегрануляции, иногда наблюдались свободно лежащие гранулы. В целом изменения микроциркуляторного русла носят признаки дегенерации и компенсаторной гиперплазии эндотелиальных клеток, плазматическое пропитывание и гиалиноз базальной мембраны.
Во 2-й группе биоптатов СО ВЧП при электронно-микроскопическом исследовании определялись эпителиоциты разнообразной формы: кубической, призматической, уплощенной, многоугольной формы. Зачастую отсутствовал контакт между клетками (рис. 2).
Рис. 2. Фрагмент эпителия СО ВЧП пациента 2-й группы: Я — ядро; М — митохондрии; ЭПС — эндоплазматическая сеть; БМ — базальная мембрана

Цитоплазма формировала многочисленные длинные отростки. На апикальной поверхности эпителиоцитов определялись цитоплазматические выросты, напоминающие микроворсинки. Ядра содержали гетерохроматин и располагались в центральной или апикальной частях клеток. Вследствие множественных инвагинаций кариолеммы ядра приобретали лопастную или двудольчатую форму. Ядрышко крупное с преобладанием гранулярного компонента, расположено эксцентрично или маргинально. Клетки отличались высоким ядерно-цитоплазматическим отношением (таблица).
В осмиофильной цитоплазме эпителиоцитов отчетливо определялись митохондрии с электронно-плотным гомогенным матриксом, короткие, диффузно расположенные цистерны ГЭС. Удельный объем митохондрий увеличен в 5,27 раза, а ГЭС — в 2,83 раза по сравнению с показателями в контроле (таблица). Перинуклеарно и в базальном отделе клеток отчетливо визуализировались толстые пучки спирально ориентированных тонофиламентов. Все это свидетельствует об интенсивных белок-синтетической и пластической функциях эпителиоцитов и, как следствие, высоких репаративных возможностях эпителия. В связи с этим можно предполагать, что такие «темные» клетки являются предшественниками специализированных эпителиоцитов. Это согласуется с данными K. Fukazawa и соавт.. Базальная мембрана на всем протяжении образовывала множественные глубокие складки. Ее светлая часть была неравномерно утолщена на всем протяжении. Непосредственно под базальной мембраной располагались нейтрофильные лейкоциты. В собственной пластинке лимфоциты имели множественные псевдоподии, что свидетельствует о возможностях их активного передвижения. Имелись единичные эпителиоидные клетки. Коллагеновые волокна теряли свою правильную ориентацию. Нередко наблюдались участки их фибриноидных изменений.
В глубоких отделах собственной пластинки СО ВЧП определялся вегетативный мицелий грибов Asper-gillus spp. На электронно-микроскопическом уровне клетки вегетативного мицелия находились на разных стадиях своего развития: от молодых до стареющих (рис. 3). Молодые формы гиф содержали одно эухромное ядро овальной формы. Кариолемма форми-ровала незначительные инвагинации. В некоторых ядрах определялось одно ядрышко гранулярно-фибриллярного строения. Вблизи ядра локализовались разнообразной формы и размеров митохондрии. Цитозоль содержал запасные вещества в виде липидных включений, разных по размеру, форме и электронной плотности. Наиболее крупные липидные включения располагались вблизи септ. В стареющих клетках мицелия отмечалось формирование центральной вакуоли, занимающей половину или большую часть цитоплазмы, а иногда почти весь ее объем. Образование центральной вакуоли было сопряжено с аутолизом органелл и цитозоля.
Рис. 3. Фрагмент вегетативного мицелия гриба Aspergillus spp.: М — митхондрии; ТВ — тельца Воронина; Л — липидные включения; С — септа; КС — клеточная стенка; В — вакуоль; Мф — молодая форма клетки; Стф — стареющая форма клетки

Латеральные клеточные стенки истончены, определялась неравномерность их толщины и контрастности. Иногда можно было наблюдать разрывы клеточной стенки с выходом содержимого наружу. Старению подвергались и межклеточные септы. Последние на продольном разрезе имели извитую форму и низкую электронную плотность, возникшую вследствие лизиса микрофибрилл септ. По периферии мицелий окружен нейтрофильными лейкоцитами, лимфоцитами, фибробластами и участками лизиса ткани. Нейтрофилы находились в активированном состоянии, о чем свидетельствовало наличие большого числа псевдоподий, содержащих специфические гранулы. Нейтрофилы способны распознавать галактоманан клеточной стенки грибов. Основным механизмом киллинга является продукция перекисных радикалов кислорода, а также дегрануляция нейтрофилов. Предполагается, что сериновая протеаза, входящая в состав гранул фагоцитов, является основным агентом, повреждающим стенку клеток грибов. Зачастую наблюдалось проникновение нейтрофилов между клетками вегетативного мицелия (рис. 4). При этом фунгицидный эффект представляется весьма сомнительным. Ни в одном случае явления фагоцитоза не зарегистрированы. Некоторые фибробласты, расположенные по периферии мицелия, находились в стадии активного коллагеногенеза. Тем не менее на отдельных участках ограничивающая фиброзная капсула отсутствовала.
Рис. 4. Фрагмент собственной пластинки СО ВЧП пациента 2-й группы. Проникновение нейтрофилов между клетками мицелия Aspergillus sp.: Мц — мицелий; Нф — нейтрофил; Я — ядро

Важнейшим свойством грибов Aspergillus spp. является способность прорастать в кровеносные сосуды с последующим их тромбозом. Это, в свою очередь, приводит к нарушению микроциркуляции вплоть до образования некрозов. Последний факт нашел от-ражение в данном исследовании (см. рис. 1).
Значительные изменения обнаружены в ультра-структурной организации микрососудов СО ВЧП. Ядра эндотелиоцитов имели продолговатую форму с глу-бокими инвагинациями нуклеолеммы. Отростки эндотелиальных клеток утолщены. Цитоплазма умеренной плотности содержала в околоядерной зоне митохондрии с хлопьевидным матриксом и деструкцией крист. Апикальная плазмолемма преимущественно имела ровный контур, иногда с единичными инвагинациями. Микропиноцитозные везикулы не определялись.
Заключение
Таким образом, при верхнечелюстном синусите с формированием аспергиллемы в эпителии СО ВЧП преобладают дегенеративно-дистрофические процессы, вероятно, связанные с экзотоксинами грибов. Основным признаком внутриклеточной реорганизации эпителиоцитов является снижение белок-синтетической и пластической функций. На отдельных участках эпителия присутствуют клетки, характеризующиеся малоизмененными цитоплазматическими органеллами. Данные изменения носят адаптивно-приспособительный характер, направленный на усиление защитного потенциала СО ВЧП. В целом выявленные изменения свидетельствуют об утрате эпителием защитных и барьерных свойств и, как следствие, неполноценном его участии в микоцилиарном клиренсе.
При инвазивной форме аспергиллезного синусита в СО ВЧП отмечаются признаки гранулематозного воспаления. Несмотря на выявленную однослойную метаплазию, в эпителиоцитах наблюдались интенсивные белок-синтетические и пластические процессы, что может указывать на высокие репаративные возможности эпителия.
Авторы: О.Д. Байдик канд. мед. наук, доцент кафедры стоматологии СибГМУ (г. Томск).
П.Г. Сысолятин - заслуженный деятель науки РФ, д-р мед. наук, профессор кафедры госпитальной хирургической стоматологии и челюстно-лицевой хирургии НГМУ, врач отделения челюстно-лицевой хирургии ГУЗ «Новосибирская ОКБ» (г. Новосибирск).
О.В. Логинова - аспирант кафедры факультетской хирургической стоматологии Первого МГМУ им. И.М. Сеченова (г. Москва)































































































































































0 комментариев