Когда зуб должен быть удален, а место используется для установки имплантата, будь то отсроченная или немедленная имплантация, удаленный зуб может быть обработан и использован в качестве аутологичного материала для трансплантации и размещения ткани в зоне операции для процесса направленной регенерации кости. Этот подход устраняет потенциальные иммунологические проблемы, которые могут возникнуть при использовании аллотрансплантата, ксенотрансплантата или синтетических материалов, плюс он обеспечивает стимуляцию организма для трансформации ткани в кость хозяина в предполагаемом месте. Восстановление тканей на уровне периодонта на месте утраты костной опоры в зоне будущего удаления зубов и прилегающих тканей также является идеальной возможностью для применения аутологичного трансплантата из клеточного материала дентина. В данной статье рассматриваются несколько различных клинических ситуаций с использованием аутологичной трансплантации клеток дентина во время процедуры удаления зуба с целью направленной регенерации костной ткани.
Биоактивный материал дентина
В литературе описаны различные костные материалы для трансплантации и для лечения лунок после удаления зубов. К таким материалам относятся аутотрансплантаты, обычно полученные зоны бугра верхней челюсти, ветви или передней части нижней челюсти, аллотрансплантаты, ксенотрансплантаты и синтетические материалы, каждый из которых демонстрирует клинический успех, а также потенциальные недостатки.
Альтернативой этим материалам для трансплантации при использовании в качестве вспомогательного средства с целью сохранения или увеличения объема лунки во время немедленной установки имплантата является использование удаленного зуба в качестве материала для трансплантата. Этот аутологичный трансплантат тканей дентина который после подготовки добавляется либо к минерализованному, либо к частично деминерализованному дентинному матриксу (DDM), гистологически доказано, что использование данного материала хорошо переносится хозяином без каких-либо воспалительных реакций и, данный материал. обладает высокой биосовместимостью и остеогенностью по своей природе с полным превращением в кость хозяина в течение 4-6 месяцев. DDM продемонстрировал большой потенциал остеоиндуктивности при низкой антигенности, не вызывая иммунологической реакции. Гистологически было показано, что DDM хорошо работает в сочетании с прилегающей к материалу поверхностью имплантата с преобразованием частиц дентина с течением времени и без каких-либо клинических проблем. Сообщалось, что аутогенный трансплантат из частиц дентина зуба обладает способностью к образованию кости в ранний период имплантации. DDM действует как каркас для остеобластов, обеспечивая остеокондуктивные свойства материала. Кроме того, было документально подтверждено что его остеоиндуктивные свойства улучшают конверсию трансплантата и замену материала на кость хозяина, обеспечивая образование участка заживления, который способен подстроиться к установке имплантата. Во время подсадки трансплантата также возможно восстановить объем тканей в области открытых витков абатмента имплантата, которые обнажились в следствие проблем пародонта.
Подготовка аутологичного трансплантата из тканей дентина зуба
Чтобы подготовить аутологичный материал трансплантата из тканей дентина зуба все реставрации и прочие инородные материалы с удаленного зуба удаляются с помощью высокоскоростного наконечника. Эмаль не нужно удалять с удаленного зуба перед обработкой. Зуб высушивают стерильной марлей и помещают в устройство для измельчения дентина (Smart Dentin Grinder, KometaBio),для последующей обработки. Если зуб депульпирован его можно использовать таким образом. Однако, если зуб был запломбирован эндодонтическим материалом для пломбирования каналов, то к сожалению еще не было опубликовано исследований о том как полностью удалить пломбировочный материал, ирригационные жидкости или цемент перед шлифованием зуба из корневой части, таким образом авторы статьи не включают такие зубы в свои хирургические протоколы.
После обработки в измельчителе дентина образуются частицы трансплантата в диапазоне от 250 мкм до 1200 мкм. К частицам добавляется очищающее средство (Dentin Cleanser, KometaBio) из гидроксида натрия в 20% этаноле с высоким рН (очень щелочной) для удаления любых бактерий и остатков органического материала. Через 5 минут очищающее средство удаляют с помощью стерильной марли, чтобы удалить влагу. В качестве дополнительной стадии этилендиаминтетрауксусную кислоту (ЭДТА) можно использовать для частичной деминерализации частиц, чтобы выявить больше частиц коллагена и, таким образом, ускорить активацию участка в процессе заживления. Затем в смесь добавляют средство для промывания дентина (Dentin Wash, KometaBio), состоящее из забуференного фосфатом физиологического раствора, и оставляют на несколько секунд. После этого второго замачивания жидкий смыв удаляют стерильной марлей.
Теперь трансплантат готов к использованию. Чтобы улучшить обработку материала, частицы аутологичного трансплантата дентина могут быть смешаны с фибрином, богатым лейкоцитами и тромбоцитами (L-PRF), для образования студенистой массы перед размещением материала в лунку. Тип трансплантата и размеры частиц выбираются в зависимости от конкретного использования трансплантата и того, как долго он должен оставаться на месте. Во время обработки зуба протоколы измельчения и сортировки могут варьироваться, так что могут быть получены частицы меньшего или большего размера, что изменяет общую скорость резорбции трансплантата и встраивания новой кости в нужный участок. При небольших дефектах, таких как поднадкостничные пародонтальные карманы или непосредственные промежутки между местами размещения имплантатов, мелкие частицы могут быть полезны для более быстрого получения новой кости. В тех случаях, когда имеются большие дефекты кости, возможно, отсутствуют костные стенки, наличие более высокой доли крупных частиц должно позволить материалу дольше сохранять свои свойства восполнения объема и архитектуры тканей.
Примеры клинических случаев
Случай 1: Отсроченная установка имплантата после сохранения объема лунки от удаленного зуба
У 52-летнего мужчины обнаружили гнойный экссудат, стекающий между вторым премоляром верхней челюсти и первым моляром (зубы 2.5., 2.6.) Обследование подтвердило подвижность обоих зубов класса 2+ ( второй степени) и зондирование периодонта в области контакта данных зубов до верхушек их корней на величину ≥10 мм. Пациент сообщил о некоторой заложенности пазух носа с левой стороны. Была сделана периапикальная рентгенограмма, которая подтвердила потерю межпроксимальной кости с большим апикальным поражением, включающим второй премоляр и мезио-щечный корень первого моляра (фото 1). При оценке КЛКТ исследования было отмечено отсутствие щечной и язычной кости, связанной с двумя зубами, а также вовлечение пазух в результате проникновения одонтогенной инфекции, что выражалось в появлении серой тени на снимке, что и проявлялось обтурацией пазух. Кроме того, было отмечено отсутствие кости в месте трифуркации корней первого моляра.
Фото 1. Пациент обратился с жалобой на боль в области верхней челюсти сзади, слева, которая рентгенологически имела большую периапикальную область, связанную с апикальной частью второго премоляра и мезио-щечной частью корня первого моляра, и глубину зондирования пародонтальных карманов ≥10 мм в межпроксимальной зоне.
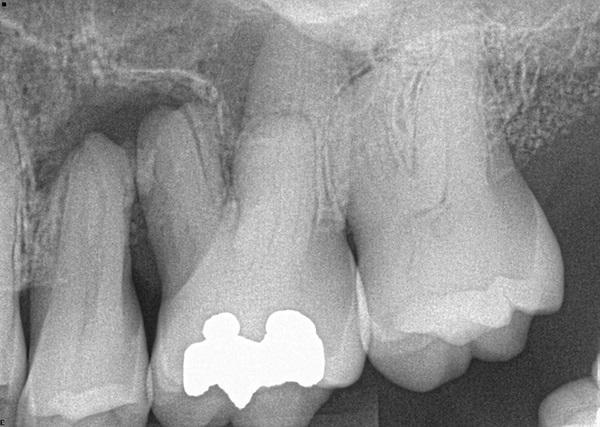
Был введен местный анестетик. И был произведен забор крови для создания L-PRF, который должен быть смешан н с аутогенным материалом трансплантата. Имевшийся на зубе материал от реставрации был удален с двух зубов с помощью твердосплавного бора и высокоскоростного наконечника (фото 2). Зубы были удалены атравматично с помощью периотомов, прямых элеваторов и щипцов. Они были очищены от мягких тканей и зубного камня, а затем помещены в виде частиц материала для обработки измельчительном аппарате для выделения дентина (Smart Dentin Grinder). Удаленные зубы были преобразованы в аутогенный материал трансплантата из дентина, вещество было стерилизовано в аппарате и частично деминерализовано. Затем материал трансплантата смешали с кусочками мембраны L-PRF, полученной из взятого образца крови пациента, мембрану обезвожили и добавили частицы трансплантата дентина создавая блок L-PRF ("костный блок"). Соседние зубы были очищены от зубных отложений и был проведен кюретаж корней, а лунки от удаленных зубов были тщательно обработаны, чтобы избежать разрыва (Шнейдеровой) мембраны, выстилающей пазуху, которая была обнажена (фото 3). Была выполнена рентгенограмма, что бы оценить расстояние от лунок после удаления зубов до пазухи верхней челюсти и выявить возможное наличие перфорации. Прилегающие открытые поверхности корней обрабатывали лимонной кислотой в течение 2 минут и тщательно промывали, чтобы облегчить повторное прикрепление частиц во время заживления участка проведенной манипуляции после размещения трансплантата.
Фото 2. Имевшиеся реставрации из амальгамы были удалены с первого моляра перед экстракцией.
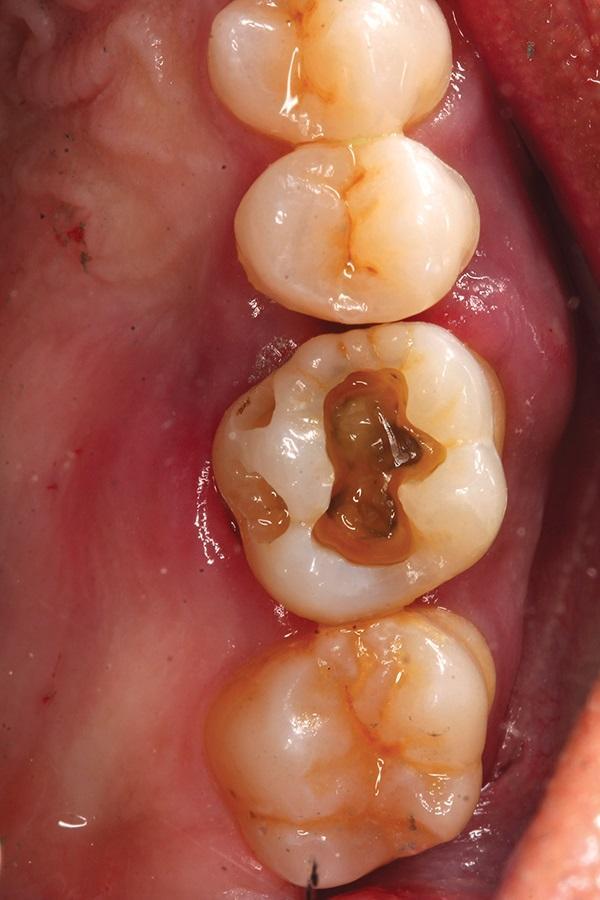
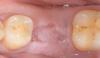
Фото 3. Экстракционные лунки были тщательно обработаны для удаления любых, возможно присутствующих, кист в области корня зуба.
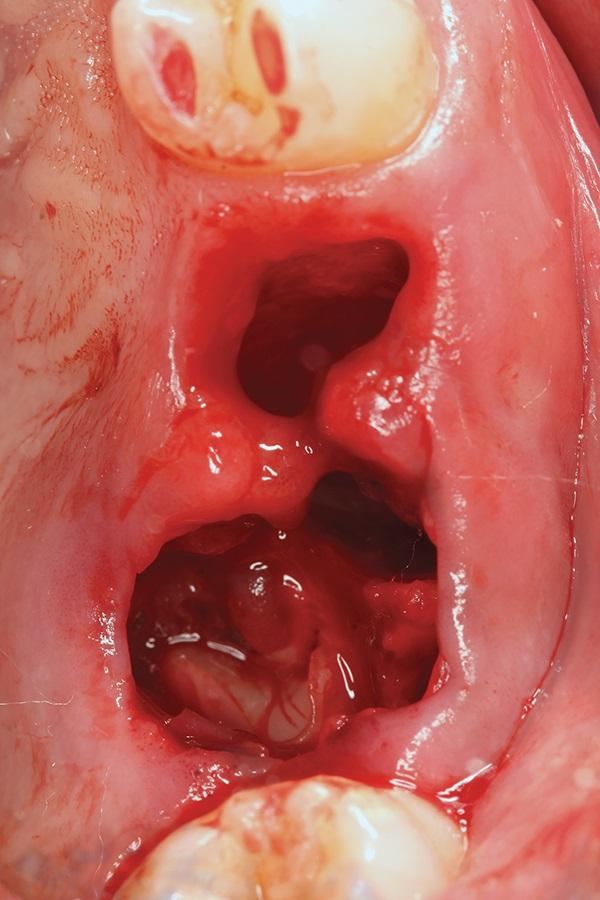
Мембрана L-PRF была помещена поверх открытой мембраны Шнейдера внутрь лунок от удаленных зубов и лунки были заполнены блоком L-PRF из аутологичного материала трансплантата из частиц дентина (Фото 4). Амнион-хорионный барьер (BioXclude, Snoasis Medical) помещали поверх материала трансплантата, с добавлением мембраны PRF в качестве дополнительного изолирующего материала поверх амнион-хорионовой мембраны (фото 5). Поскольку первичное закрытие было не осуществимо и, таким образом, большая площадь альвеолярного гребня осталась бы открытой для окружающей среды полости рта, плотный политетрафторэтиленовый (PTFE) барьер (Cytoplast TXT, Osteogenics) был помещен поверх участка в области первого моляра, чтобы уменьшить вероятность того, что пациент нарушит формирование сгустка в процессе раннего заживления раны во жевания или чистки зубов. Швы накладывали без натяжения, чтобы стабилизировать мягкие ткани, но не для получения первичного закрытия или сжатия материала трансплантата. Пациенту назначали антибиотики (Аугментин по 875 мг два раза в день в течение 7 дней) и безрецептурные обезболивающие препараты в течение 2 дней. Была выполнена периапикальная рентгенограмма, чтобы удостовериться в заполнении экстракционных лунок материалом трансплантата.
Фото 4. Аутологичный трансплантат из клеток дентина, полученный после обработки удаленных зубов, был помещен в экстракционные лунки.
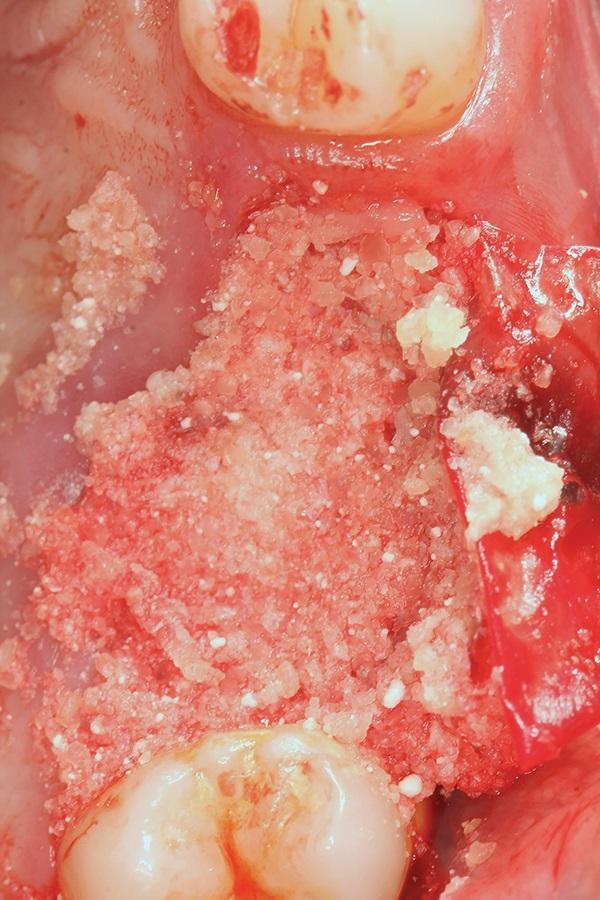
Фото 5. Амнион-хорионическую мембрану поместили поверх материала трансплантата из дентина и заправили под края лоскута перед наложением швов.
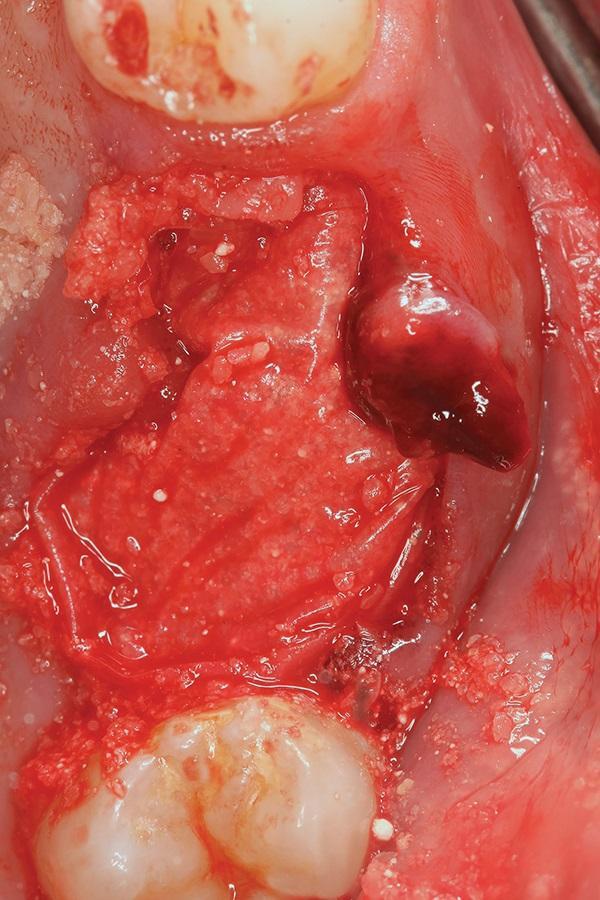
Через год после операции при клиническом обследовании была отмечено образование здоровой ороговевшей мягкой ткани, покрывающей место проведенной трансплантации (фото 6). Было проведено КЛКТ исследование, что бы оценить степень приживления и интеграцию материала в кость хозяина, а также определить, имеется ли достаточный объем кости для установки имплантата (фото 7). КЛКТ показало количество кости, чтобы можно было установить два имплантата. После введения местного анестетика был выполнен разрез области альвеолярного гребня и гребень был обнажен, чтобы выявить плотную кость без видимых частиц трансплантата. Начальная остеотомия была произведена в месте второго премоляра и первого моляра с помощью направленного хирургического вмешательства. Для обеспечения возможности постановки имплантата нужной длины было запланировано увеличение объема альвеолярного гребня в области пазухи, для улучшения качества кости, окружающей устанавливаемый имплантат, был использован протокол остеоденсификации. Увеличение объема альвеолярного гребня в области пазухи было выполнено с помощью комбинации пьезохирургии (Mectron) и остеоденсификации (Versah). Эти запатентованные сверла также использовались для увеличения плотности кости и одновременного улучшения остеоинтеграции.
Фото 6. Заживление тканей по прошествии 12-ти месяцев после пересадки тканей, продемонстрировано восстановление альвеолярного гребня и отсутствие признаков воспаления.
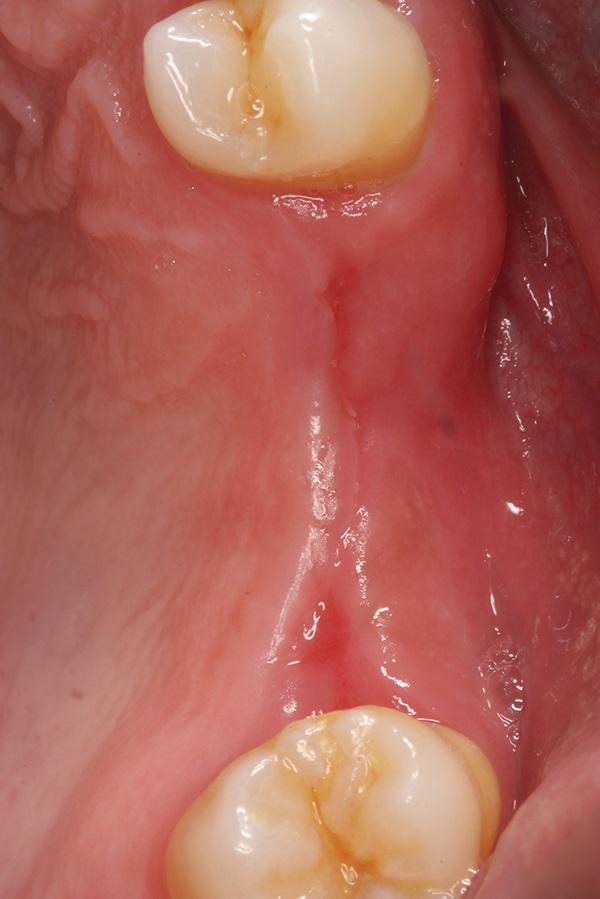
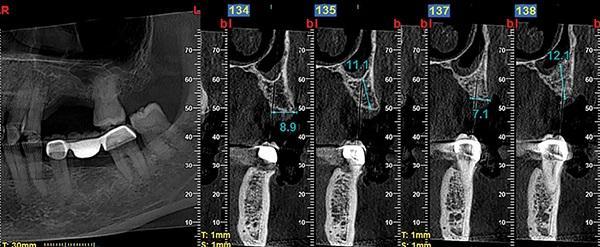
Фото 7. Продемонстрированы срезы КЛКТ участков трансплантации через 10 месяцев после вмешательства, видно увеличение высоты и ширины гребня в местах удаления зубов, обеспечен нужный объем для размещения имплантатов.
Два имплантата (Touareg, Adin), диаметром 4,2 мм в участке отсутствия зуба 2.5 и диаметром 5 мм в области отсутствующего зуба 2.6. были размещены с помощью аугментации альвеолярного гребня при помощи специальной зубной матрицы NovaBone Dental Putty, Osteogenics). Вторичная пересадка тканей осуществлялась с использованием костного материала (SynOss, коллагеновая матрица) была наложена для расширения альвеолы на вестибулярной стороне гребня. Трансплантат гидратировали в жидкости из препарата L-PRF, а также как и барьерный слой из коллагеновой мембраны (MatrixDerm, Collagen Matrix), который поместили поверх вестибулярной стенки трансплантата на альвеолярном гребне. Зона вмешательства была ушита швами, способствующими первичному закрытию раны, что позволило имплантатам приживаться в толще тканей.
Пациент вернулся через 7 месяцев после установки имплантата, чтобы начать восстановительную фазу лечения. После введения местного анестетика имплантаты были вскрыты. Стабильность имплантата была проверена с использованием коэффициента стабильности имплантата (ISQ) (Osstell), регистрируя измерения ISQ 72 для имплантата в области зуба 2.5. и для имплантата в области зуба 2.6., подтверждая стабильность, позволяющую начать восстановление. Имплантаты были нагружены протезными конструкциями с винтовой опорой. Через 2,5 года после установки реставраций рентгенограмма продемонстрировала стабильность костной ткани и трансплантата альвеолярного гребня в зоне установки имплантатов и интеграцию кости хозяина со смесью аутогенного трансплантата дентина (фото 8).
Фото 8. Рентгенограмма через 2,5 года после вмешательства (более 3 лет после установки трансплантата), демонстрирующая стабильность трансплантата и поддержание его в области альвеолярного гребня при функциональной нагрузке.
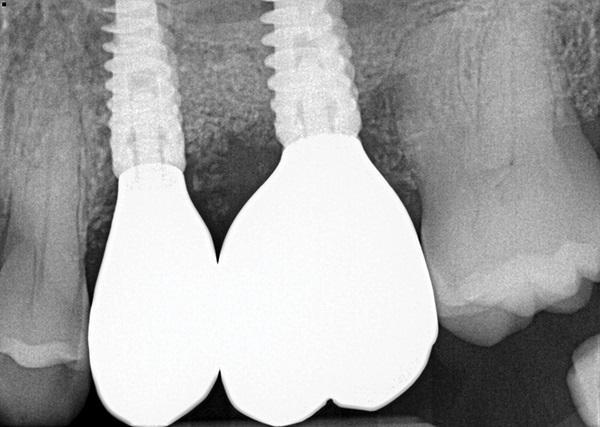
Случай 2: Немедленная имплантация с аугментацией лунки от удаленного зуба
Здоровая пациентка 97,5 лет обратилась на экстренный прием с переломом левого первого премоляра верхней челюсти (зуб 2.4). При осмотре было отмечено, что у зуба отсутствует коронковая часть и он находится на одном уровне с краем десны. Была выполнена периапикальная рентгенограмма, и зуб был признан не подлежащим восстановлению из-за степени отсутствия структуры зуба (фото 9). Поперечный срез КЛКТ пораженного зуба продемонстрировал размеры полости и не поврежденную часть альвеолярного гребня со стороны щеки (фото 10). С пациентом были обсуждены варианты лечения, которые включали удаление оставшегося корня с последующим препарированием зубов мезиально и дистально к промежутку и установкой не съемного частичного протеза, либо установкой имплантата и реставрации дефекта коронкой. Пациентка сказала, что не хочет, чтобы у ей "срезали зубы", и выбрала вариант лечения имплантатом.
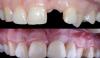
Фото 9. Периапикальная рентгенограмма, демонстрирующая перелом левого первого премоляра верхней челюсти с потерей коронковой части зуба, по отношению к кости альвеолярного гребня, в результате чего зуб не подлежит восстановлению.
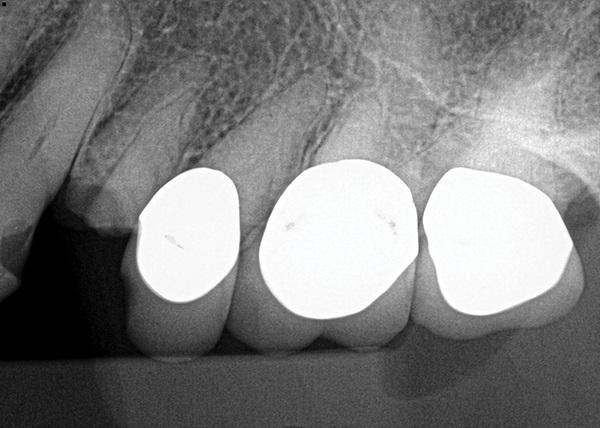
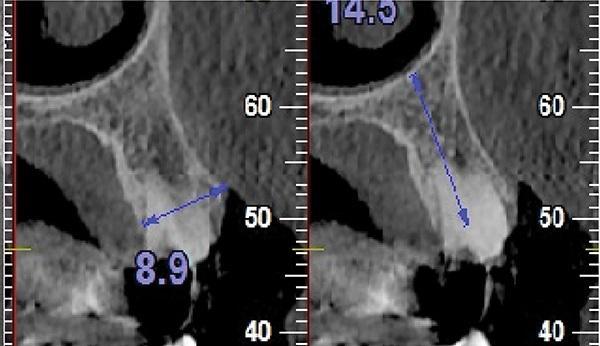
Фото 10. Представлен поперечный срез КЛКТ пораженного зуба.
Пациентка просмотрела и подписала формы согласия. Был введен местный анестетик, и остатки корня зуба были удалены с помощью пьезохирургии. Предвидя необходимость размещения трансплантата вокруг имплантата для заполнения любой пустоты в лунке, врач использовал насадку скалера от пьезохирургического аппарата для удаления мягких тканей с поверхности корня. Затем корень был обработан с помощью Smart Dentin Grinder в соответствии с инструкциями производителя для создания аутологичного материала для трансплантата. Лунка была обработана и была проведена остеотомия области для размещения имплантата размером 3,7 х 13 мм (Intrahex, BioHorizons), который был помещен по направлению к небной стенке лунки от удаленного зуба (фото 11). Измерение ISQ было проведено для проверки начальной стабильности и показало значение 58. В направлении щеки имелся зазор, создающий пустоту между имплантатом и стенкой лунки. Промежуток был заполнен частично деминерализованным материалом дентина, полученным на приеме ранее; материал был смешан с L-PRF плазмой из сыворотки крови, взятой в начале приема, для создания "липкой кости". Дополнительный материал трансплантата был помещен поверх плеча имплантата, чтобы покрыть альвеолярный гребень и частично распространиться на высоту соединительной ткани. Амнион-хорионный барьер (BioXclude) был помещен поверх участка и заправлен под край лоскута на щечной и небной сторонах, а затем покрыт пробкой из PRF фибрина (фото 12). Для закрепления нижележащих материалов были наложены швы с полигликолевой кислотой. Хотя PRF не был необходим для заживления, он был установлен так, чтобы пациентка избегала жевания с левой стороны и не чистила область после операции в течение начального периода заживления. Пациентка была инструктирована, о том, что нужно избегать жевания с левой стороны и не чистить область после операции в течение начального периода заживления. Пациент был осмотрен через 1 месяц после операции, и было отмечено полное закрытие раны тканью десны в месте проведения вмешательства.
Фото 11. После извлечения корня зуба имплантат немедленно поместили небно в лунку, оставляя большой зазор между имплантатом и щечной стенкой лунки.
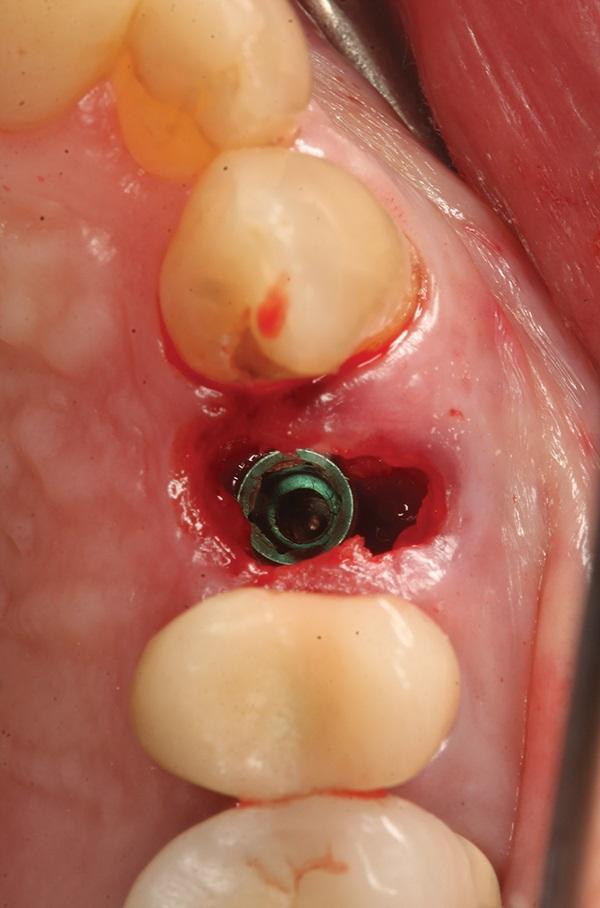
Фото 12. Аутогенный дентинный трансплантат, созданный из удаленного зуба, был помещен в пустоту в лунке для заполнения дефекта.
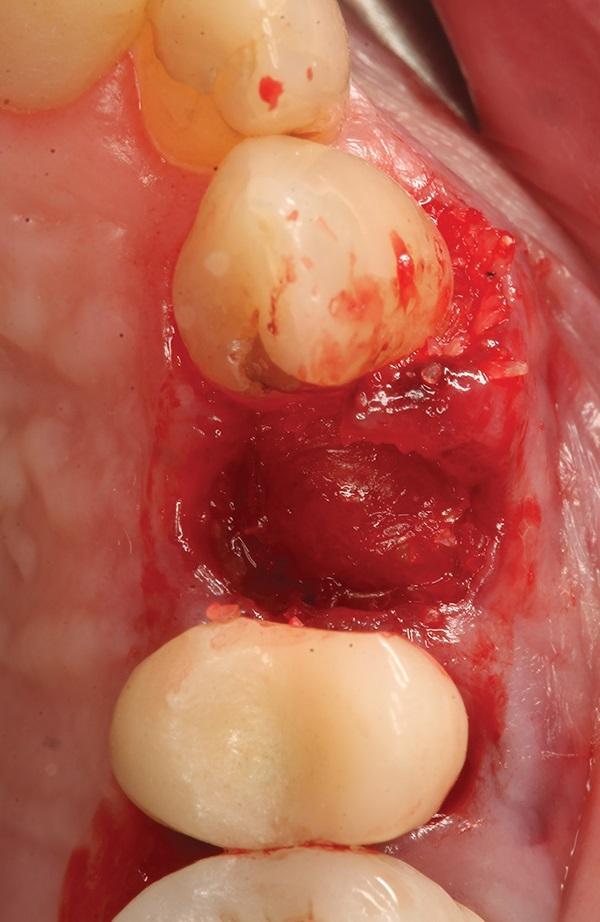
Пациентка вернулась через 3 месяца после установки имплантата, и была выполнена периапикальная рентгенография, чтобы проверить приживление имплантата и трансплантата. Трансплантат, который был помещен в щечную стенку лунки щель для заполнения пустоты, соединился с окружающей костью хозяина, и было решено, что можно начинать дальнейшее протезирование. и имплантат был открыт небольшим хирургическим надрезом. Было проведено измерение стабильности имплантата ISQ, равное 78, и был установлен заживляющий абатмент. После заживления десен была начата восстановительная фаза и получен оттиск. Была изготовлена и поставлена коронка на основе циркония и титана, конструкция была закреплена на винтовую часть имплантата.
Пациентка продолжала регулярно посещать гигиенические процедуры. Периапикальная рентгенограмма через 1 год после протезирования подтвердила стабильность кости по отношению к имплантату и кости альвеолярного гребня (фото 13). Область была выстлана здоровой тканью десны, без признаков воспаления, было отмечено, однако, имелось минимальное образование карманов и, при этом, сохранялась приемлемая эстетика (фото 14). На момент написания этой статьи самое последнее наблюдение составляло 4,5 года после лечения, при этом пациентке было 102,5 года, и ее здоровье оставалось хорошим. Поперечные срезы КЛКТ, выполненные на тот момент, продемонстрировали сохранение объема тканей в щечно-небной части альвеолярного гребня за счет аутологичного трансплантата дентина, помещенного в щечную щель экстракционной лунки (фото 15).
Фото 13. Периапикальная рентгенограмма через 12 месяцев после проверенного лечения и протезирования при помощи имплантата, продемонстрирован тесный контакт окружающей кости с имплантатом и полное слияние аутогенного дентинного трансплантата, который был положен в рану при установке имплантата. Здоровая десневая ткань вокруг протеза очевидна.
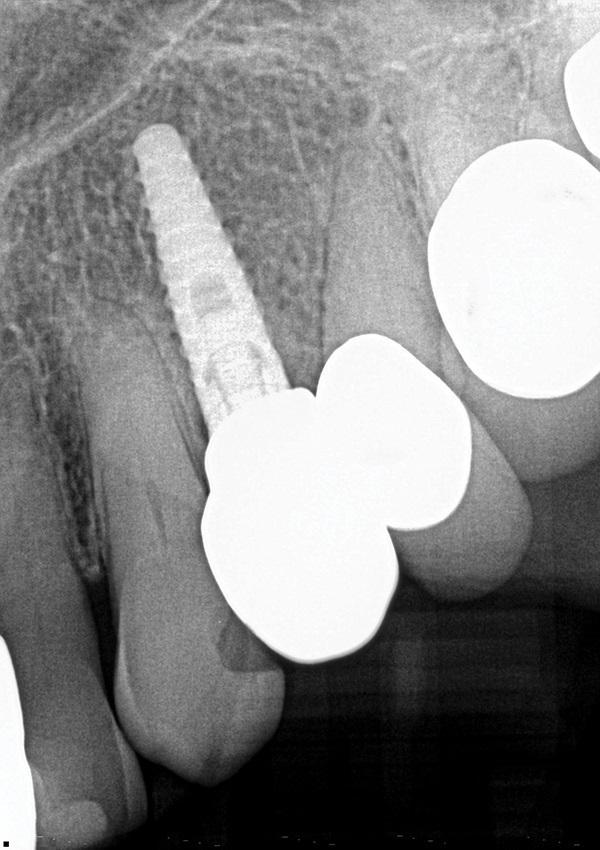
Фото 14. Клинический вид через 12 месяцев после проведения процедуры имплантации видна здоровая слизистая, окружающая конку имплантата.
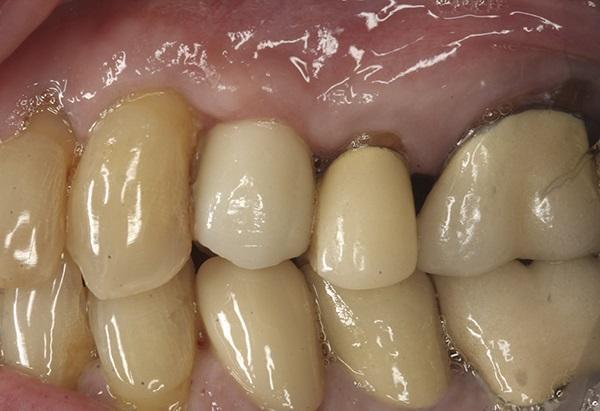
Фото 15. Аксиальные срезы КЛКТ исследования через 51 месяц после лечения, демонстрирующее сохранение кости вокруг имплантата со стабильностью аутогенного дентинного трансплантата на щечной стороне участка.
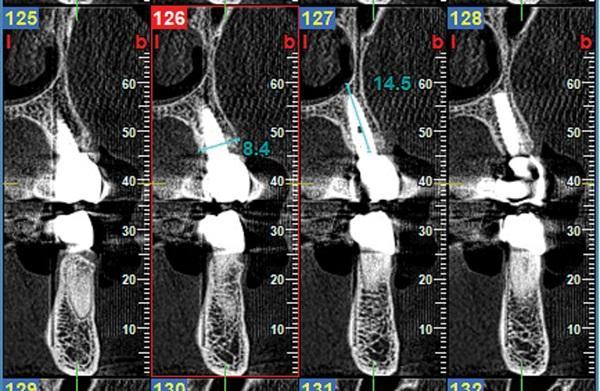
Случай 3: Сохранение Экстракционной Лунки с Имплантацией Соседнего зуба/ имплантата в периодонте
У 75-летнего пациента мужского пола, который начал курить в возрасте 72 лет, но не имел других сопутствующих медицинских патологий, возникли проблемы, связанные с одномоментным имплантатом, который был установлен и протезирован на месте расположения правого центрального резца нижней челюсти 12 лет назад. Осмотр показал отсутствие сосочка на мезиальной и дистальной сторонах реставрации имплантата с тесным контактом между коронкой имплантата и левым центральным резцом от шейки до резцового края с рецессией десневого края на двух центральных резцах. Периапикальная рентгенограмма выявила поражение области корня левого центрального резца со значительной потерей костной ткани вокруг этого зуба и примерно 30-45% потери костной массы вокруг имплантата (фото 16). При зондировании пародонта была отмечена глубина 6 мм между коронкой имплантата и правым боковым резцом, 5 мм между коронкой имплантата и левым центральным резцом и 5 мм между правым боковым резцом и клыком, измеренная с вестибулярной стороны десны, при этом на этих зубах отмечено наличие рецессии десны. Имплантат не обладал подвижностью и считался стабильным.
Фото 16. Периапикальная рентгенограмма, демонстрирующая поражение окружающих на левом центральном резце, прилегающем к ранее установленному и протезированному имплантату.
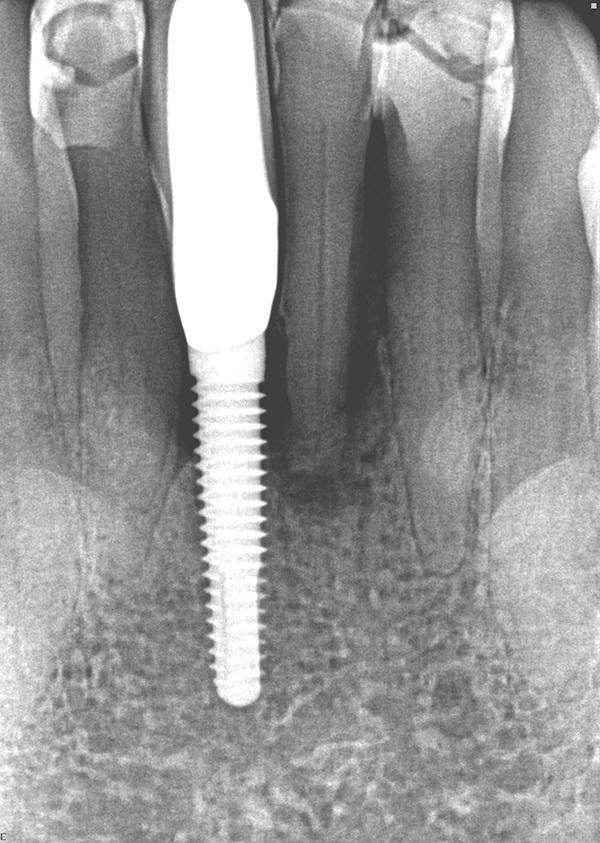
На основании клинических данных левый центральный резец был признан безнадежным, и пациенту было рекомендовано удалить зуб, подсадить костную ткань в лунку от удаленного зуба и также вокруг оголенных соседних нити имплантата, а также использовать консольный понтик от имплантата для восстановления. Пациент принял рекомендации по лечению, подписал и просмотрел форму согласия.
После введения местного анестетика был удален зуб 31 (фото 17), с зуба была удалена любая мягкая ткань, прилипшая к корню, а затем зуб был отшлифован и обработан с помощью Smart Dentin Grinder. В то время как аутологичный дентин обрабатывался, лоскут был приподнят на лицевой и язычной сторонах в области зуба 41., для обнажения нитей имплантата, которые были расположены выше уровня альвеолярного гребня. Они были обработаны кюретами и титановой щеткой (RotoBrush-набор щеток для чистки нитей Titanium, Salvin), предназначенной для удаления поверхностных отложений. Лунка в области зуба 3.1. и прилегающие к ней поверхности корня были обработаны на всю длину корня зуба для установки ткани трансплантата. Все открытые участки были обработаны при помощи лимонной кислоты.
Фото 17. После удаления поврежденного центрального резца был очевиден дефицит мезиодистального пространства, что исключало использование имплантата для восполнения потери пострадавшего резца.
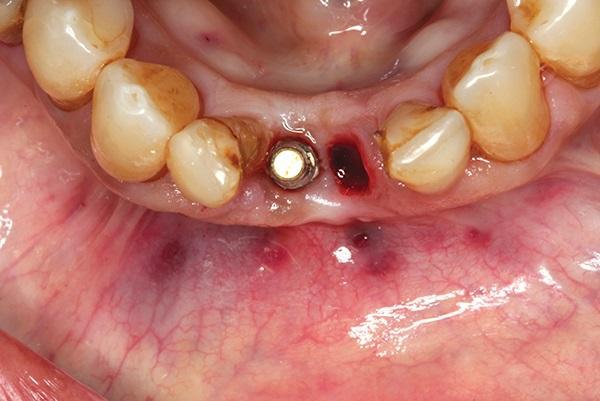
Аутологичный измельченный дентин смешали в равной пропорции с минирализованным губчатым аллотрансплантатом (Ossif-I, Surgical Esthetics) и гидратиповали в физиологическом растворе для увеличения объема трансплантата. Затем смесь для трансплантата поместили в лунку от удаленного зуба и вокруг имплантата, и соседних зубов до достижения идеального уровня альвеолярного гребня (фото 18). Вокруг имплантата был установлен барьер из амнион-хорионной мембраны (BioXclude), позволяющий головке имплантата выходить через мембрану, а также данный барьер был установлен над прилегающей к зоне трансплантации областью и заправлен под края лоскута (фото 19). Лоскуты были стабилизированы вокруг открытого плеча имплантата, и были наложены швы с полигликолевой кислотой, чтобы закрепить их в ране (фото 20). Была выполнена периапикальная рентгенограмма, чтобы оценить уровень прилегания трансплантата к костным структурам (фото 21). На имплантат была установлена консольная временная коронка.
Фото 18. Аутогенный дентинный трансплантат, созданный из тканей удаленного зуба, был помещен в постэкстракционную лунку и вокруг имплантата крестовидно.
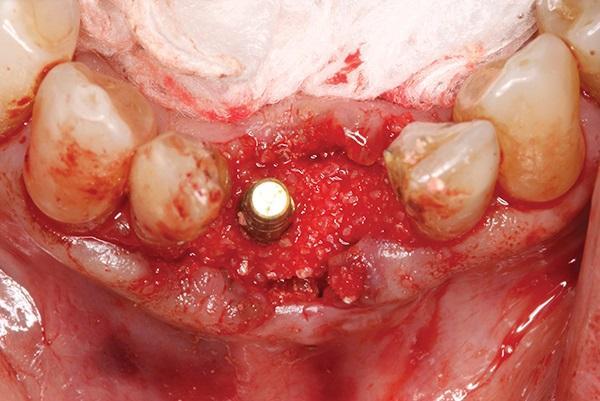
Фото 19. Амнион-хорионная мембрана была помещена так, чтобы покрыть трансплантат, и заправлена под края лоскута.
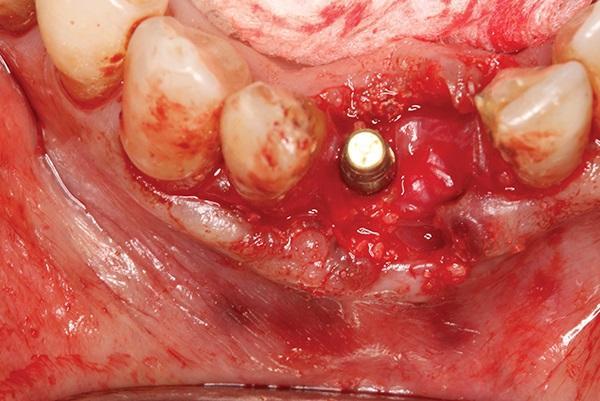
Фото 20. Были наложены швы для получения первичного закрытия участка трансплантации.
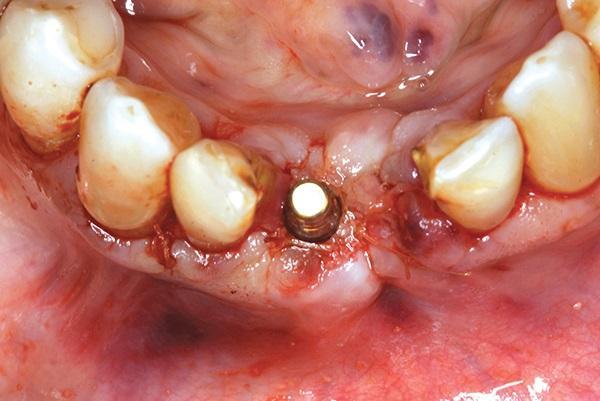
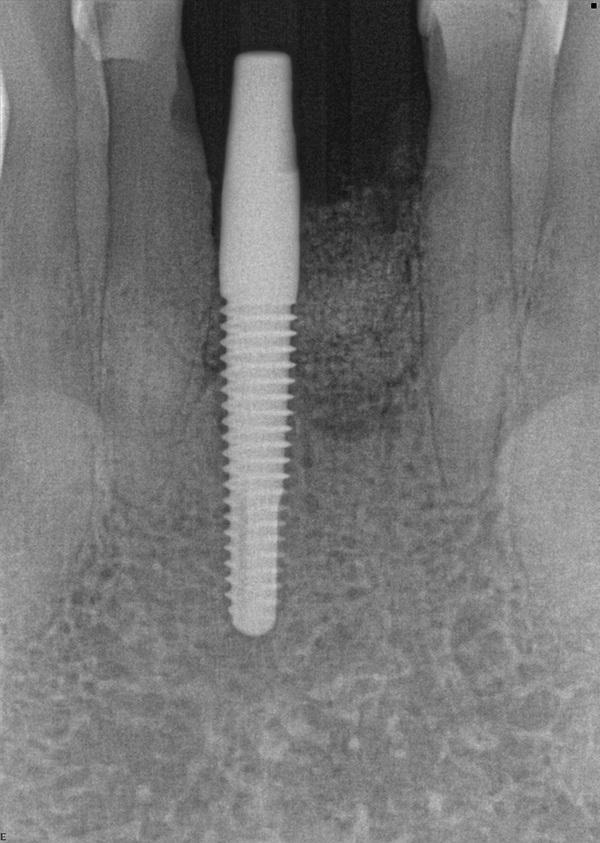
Фото 21. Периапикальная рентгенограмма, сделанная сразу после экстракции и установки аутогенного дентинного трансплантата.
Участки заживали хорошо и без осложнений. Во время очередного приема с целью динамического наблюдения, по прошествии 18 месяцев с момента операции, коронка была удалена, обнажив толстые, здоровые ткани десны. Вокруг имплантата. Зондирование по границам имплантата выявило прохождение инструмента на глубину 2 мм, в толщу тканей, без явлений кровотечения, а коронка соприкасалась со здоровыми мягкими тканями. Рентгенологически на соседних зубах было отмечено вертикальное увеличение объема костной ткани в пределах от 3 мм до 5 мм, и большинство ранее открытых нитей на существующем имплантате были покрыты костью (фото 22). Аутологичный дентинный трансплантат полностью слился с окружающей костью хозяина, и рентгенологически не было отмечено никакой дифференциации между костью и ранее размещенной тканью трансплантата.
Фото 22. Периапикальная рентгенограмма окончательной консольной реставрации, демонстрирующая включение аутогенной ткани трансплантата клеток дентина зуба в костную ткань хозяина через 18 месяцев после операции.
Обсуждение
Материал костного трансплантата из тканей зуба должен обладать остеокондуктивными свойствами и, в идеале, быть остеоиндуктивным. Он должен обладать остеостимулирующими свойствами с минерализованным матриксом и нативными коллагеновыми и неколлагеновыми белками. Ключевым аспектом при выборе материала для трансплантата должны быть остеокондуктивные свойства, действующие как каркас для регенерации кости, но также, в идеале, остеоиндуктивные свойства, стимулирующие ускоренную регенерацию кости и динамику заживления. Аутологичный материал для трансплантации, такой как дентин, представляет собой минерализованный матрикс с нативными коллагеновыми и не коллагеновыми белками.
В данной статье продемонстрировано, что удаленные зубы, используемые в качестве аутогенного материала костного блока для трансплантации тканей с целью увеличения объема альвеолярного гребня или преобразованные в частицы стружки дентина, подвергаются постепенной резорбции и замене на аналогичную аутогенную кость. Зубы нуждаются в удалении по целому ряду причин, включая запущенные заболевания пародонта, не подлежащую восстановлению структуру коронки зуба, вертикальный перелом корня и другие. После удаления зуба альвеолярный гребень вокруг лунки удаленного зуба подвергается ремоделированию во время заживления, особенно на щечной стороне гребня. Это приводит к уменьшению объема кости в месте планируемой установки имплантата, что может поставить под угрозу стабильность имплантата, эстетичность конструкции и ее функциональность.
В течение первых 3 месяцев после удаления зуба сообщалось о снижении объема альвеолярного отростка на 50%. Исследования показали разные результаты относительно того, выше ли потеря костной массы при отсроченной установке имплантата по сравнению с немедленной установкой.
Таким образом, когда показана отсроченная установка, запечатывание лунки поможет сохранить объем альвеолярного гребня в зоне удаления и ограничит, если не предотвратит, рассасывание во время заживления участка после удаления зуба. Когда возможно проведение немедленной имплантации, как показано ранее, помещение в рану блока трансплантата улучшает стабильность имплантата и повышает уровень краевой, прилегающей кости в операционной зоне, заполняя пустоту между стенками лунки от удаленного зуба и самим имплантатом.
Альвеолярная кость и зубы развиваются из клеток одинаковой макромолекулярной структуры, содержащих коллаген 1-го типа, минерал гидроксиапатит (ГА) и различные неколлагеновые белки, которые являются общими для кости, дентина и цемента. Сами зубы состоят из трех минерализованных структур: эмали (кристаллическая структура ГА без органического матрикса), дентина и цемента; последние два менее минерализованы, чем эмаль, и имеют сходный состав с мембранозной костью. Таким образом, дентин, который составляет 90% структуры зуба, может служить в качестве нативного материала для костной пластики, аналогичного аллотрансплантату или аутотрансплантату кости, используемому для той же цели.
Дентин состоит из 40-45% минерала ГА и аналогичного объема органического матрикса. Органическая матрица на 90% состоит из коллагеновых волокон 1-го типа, к которым прикреплены неколлагеновые молекулы. Это делает органический матрикс аттрактантом для остеогенных клеток, индуцирующих рост и дифференцировку кости. Фосфопротеин дентина, регуляторный белок, экспрессируемый в дентине и в меньшей степени в кости, участвует в минерализации кости и обладает способностью регулировать как начальную минерализацию, так и ремоделирование ткани.
Во время минерализации костного матрикса минералы ГА откладываются вокруг коллагеновых волокон и между ними, защищая органический матрикс дентина от ферментативной деградации. Поскольку сообщалось, что факторы роста сохраняются в зубе, частицы дентина могут распознаваться остеокластами и рассасываться аналогично мембранозной кортикальной кости. Эти частицы дентина затем полностью или частично рассасываются, заменяясь новой костью, поскольку аколлагеновые молекулы, такие как фосфопротеин дентина, фактор роста фибробластов и костный морфогенетический белок, высвобождаются во время резорбции дентина. Резорбция частиц дентина в процессе ремоделирования происходит гораздо медленнее, чем у аллотрансплантационных материалов. Это позволяет сохранить место и объем трансплантата, помогая организму-хозяину преобразовать дентиновый трансплантат в жизнеспособную кость без потери объема, как это наблюдалось с другими материалами для трансплантации, используемыми клинически.
Доказано, что использование деминерализованного дентина в форме обработанного аутогенного дентинного трансплантата способствует высвобождению большего числа остеогенных клеток, образуя большее количество сплетенной кости во время заживления участка и созревания материала трансплантата. Хотя мелкие частицы деминерализованного дентина могут рассасываться быстрее, чем минерализованные частицы дентинного трансплантата, использование комбинации с крупными частицами поможет сохранить объем с течением времени. Было предложено обрабатывать трансплантат из частиц дентина ЭДТА в течение 2 минут для создания тонкого поверхностного слоя деминерализованного дентина толщиной 10 мкм, чтобы индуцировать высвобождение молекул аттрактанта, таким образом, обеспечивая тонкую поверхность деминерализованного дентина большего высвобождения остеогенных клеток с сопутствующим отложением кости во время ранней фазы регенерации операционного участка. Этот процесс оставил бы большую часть минерализованного дентина нетронутым, увеличив время, в течение которого трансплантат будет жизнеспособен и не подвергнется резорбции для преобразования в кость хозяина.
Частицы аутологичного дентина размером от 250 мкм до 1200 мкм, полученные с помощью протокола обработки в аппарате Smart Dentin Grinder, использовались в качестве биоматериала для трансплантации в процедурах костной регенерации при проведении имплантации. Послеоперационная компьютерная томография подтвердила, что дисперсный дентин сохранял трехмерный объем участков лунки. Гистологически сообщалось о формировании новой кости, заполняющей весь объем заполняемого участка трансплантатом, в котором ранее располагались корни от удаленного зуба и материал трансплантата, состоящий из частиц дентина был полностью преобразован в жизнеспособную кость хозяина.
Независимо от того, запечатывается лунка или нет, резорбция на уровне альвеол может быть ограничена путем герметизации коронарной части лунки. Ограничение врастания мягких тканей лунки и/или материала трансплантата позволяет замедлить процесс остеобластической активности и ангиогенеза, сохраняя размеры альвеолярного гребня. Доступны различные изолирующие мембраны для применения с целью сохранения лунки в области удаленного зуба, независимо от того, устанавливаются имплантаты одновременно с материалом трансплантата кости или нет. Было описано, что применение рассасывающихся мембран биологического происхождения обеспечивает наилучшие результаты при минимальном потенциале осложнений, о которых сообщалось при использовании других рассасывающихся или не рассасывающихся мембран, обычно используемых в прошлом.
Доступны биоактивные изолирующие мембраны, некоторые из которых в своей структуре содержат обработанные ткани амниона и хориона человека. Такие мембраны способны стимулировать рост клеток, обладая повышенной механической прочностью ввиду присутствия частиц амнион-хориона при отсутствии иммуногенности, делают данные мембраны идеальным материалом для доставки в необходимый участок аллогенных клеток и для применения их в целях тканевой инженерии. Одна из таких мембран (BioXclude), которая использовалась в случаях, описанных в этом отчете, содержит различные факторы роста и биологические медиаторы, важные для формирования костей и ороговевших тканей. Эти стимулирующие факторы включают фактор роста тромбоцитов, фактор роста эндотелия сосудов, ламинин 5, белки внеклеточного матрикса и различные типы коллагена. Преимущество сохранения лунки от удаленного зуба заключается в том, что мембрана амнион-хорион не требует первичного закрытия, поскольку при обработке лунки следует ожидать некоторой экспозиции тканей. Было, также отмечено, мембрана уменьшает воспалительный процесс. Также сообщалось об антибактериальных свойствах; эти свойства, особенно в отношении участков экстракции, где первичное закрытие невозможно, обеспечивают преимущество использования мембраны для борьбы с накоплением бактерий, которое может возникнуть после завершения хирургического лечения, что приводит к нарушению заживления тканей и снижению их регенеративного потенциала. Клинические исследования продемонстрировали ускоренное заживление пародонта, более быстрое приживление лоскута и уменьшение числа послеоперационных рецессий. Данные мембраны могут использоваться в сочетании с другими изолирующими материалами, например концентратами из сыворотки плазмы аутогенной крови, такими как PRF-фибрин.
Заключение
Когда показано удаление зуба, зуб может быть обработан и использован в качестве дисперсного материала для трансплантации, аналогичного другим доступным материалам для трансплантации. Полученный от пациента, который нуждается в трансплантации костной ткани, аутологичный материал дентина продемонстрировал процесс трансформации в кость хозяина без каких-либо потенциальных иммунологических проблем, о которых, хотя и редко, сообщалось при применении некоторых коммерческих материалов для трансплантации кости. Случаи, описанные в данной статье, показали полное восстановление объема и высоты альвеолярной кости и ороговевшей ткани в зоне вмешательства. Продемонстрированный автором подход может явиться дополнительным преимуществом при снижении рисков возникновения заболеваний пародонта и периимплантата за счет регенерации исходного альвеолярного комплекса. За счет уменьшения аваскулярных пространств вокруг частиц трансплантата и увеличения кровоснабжения в этой области обработанный участок способен вернуться к гистологическому виду "родной" кости. Физиологически аутологичные дентинные трансплантаты способны хорошо активировать регенеративные способности организма для купирования болевых ощущений и уменьшения любой потенциальной воспалительной реакции на появление зубного налета, скопление которого вызывает уменьшение объема костной ткани и способствует развитию периодонтита и периимплантита. Кроме того, стоимость лечения снижается, поскольку не требуются использование пакуемых материалы для трансплантации костной ткани, а также не требуется формирование донорских участков, необходимых при применении аутогенных трансплантатов, полученных из других участков полости рта. Использование биоактивного трансплантата и барьерной мембраны, показанных выше, при описании ряда клинических случаев, может быть рассмотрено, при необходимости осуществления протокола немедленной или отсроченной установки имплантатов или при сохранении объема лунки от удаленного зуба и связанным с этим процессом воспаления потери костной ткани периодонта в области соседних зубов или интегрированных имплантатов.
Авторы:
Robert A. Horowitz, DDS
Gregori M. Kurtzman, DDS, MAGD
José Luis Calvo-Guirado, DDS, PhD, Eu PhD, MS
Когда зуб должен быть удален, а место используется для установки имплантата, будь то отсроченная или немедленная имплантация, удаленный зуб может быть обработан и использован в качестве аутологичного материала для трансплантации и размещения ткани в зоне операции для процесса направленной регенерации кости. Этот подход устраняет потенциальные иммунологические проблемы, которые могут возникнуть при использовании аллотрансплантата, ксенотрансплантата или синтетических материалов, плюс он обеспечивает стимуляцию организма для трансформации ткани в кость хозяина в предполагаемом месте. Восстановление тканей на уровне периодонта на месте утраты костной опоры в зоне будущего удаления зубов и прилегающих тканей также является идеальной возможностью для применения аутологичного трансплантата из клеточного материала дентина. В данной статье рассматриваются несколько различных клинических ситуаций с использованием аутологичной трансплантации клеток дентина во время процедуры удаления зуба с целью направленной регенерации костной ткани.

Биоактивный материал дентина
В литературе описаны различные костные материалы для трансплантации и для лечения лунок после удаления зубов. К таким материалам относятся аутотрансплантаты, обычно полученные зоны бугра верхней челюсти, ветви или передней части нижней челюсти, аллотрансплантаты, ксенотрансплантаты и синтетические материалы, каждый из которых демонстрирует клинический успех, а также потенциальные недостатки.
Альтернативой этим материалам для трансплантации при использовании в качестве вспомогательного средства с целью сохранения или увеличения объема лунки во время немедленной установки имплантата является использование удаленного зуба в качестве материала для трансплантата. Этот аутологичный трансплантат тканей дентина который после подготовки добавляется либо к минерализованному, либо к частично деминерализованному дентинному матриксу (DDM), гистологически доказано, что использование данного материала хорошо переносится хозяином без каких-либо воспалительных реакций и, данный материал. обладает высокой биосовместимостью и остеогенностью по своей природе с полным превращением в кость хозяина в течение 4-6 месяцев. DDM продемонстрировал большой потенциал остеоиндуктивности при низкой антигенности, не вызывая иммунологической реакции. Гистологически было показано, что DDM хорошо работает в сочетании с прилегающей к материалу поверхностью имплантата с преобразованием частиц дентина с течением времени и без каких-либо клинических проблем. Сообщалось, что аутогенный трансплантат из частиц дентина зуба обладает способностью к образованию кости в ранний период имплантации. DDM действует как каркас для остеобластов, обеспечивая остеокондуктивные свойства материала. Кроме того, было документально подтверждено что его остеоиндуктивные свойства улучшают конверсию трансплантата и замену материала на кость хозяина, обеспечивая образование участка заживления, который способен подстроиться к установке имплантата. Во время подсадки трансплантата также возможно восстановить объем тканей в области открытых витков абатмента имплантата, которые обнажились в следствие проблем пародонта.
Подготовка аутологичного трансплантата из тканей дентина зуба
Чтобы подготовить аутологичный материал трансплантата из тканей дентина зуба все реставрации и прочие инородные материалы с удаленного зуба удаляются с помощью высокоскоростного наконечника. Эмаль не нужно удалять с удаленного зуба перед обработкой. Зуб высушивают стерильной марлей и помещают в устройство для измельчения дентина (Smart Dentin Grinder, KometaBio),для последующей обработки. Если зуб депульпирован его можно использовать таким образом. Однако, если зуб был запломбирован эндодонтическим материалом для пломбирования каналов, то к сожалению еще не было опубликовано исследований о том как полностью удалить пломбировочный материал, ирригационные жидкости или цемент перед шлифованием зуба из корневой части, таким образом авторы статьи не включают такие зубы в свои хирургические протоколы.
После обработки в измельчителе дентина образуются частицы трансплантата в диапазоне от 250 мкм до 1200 мкм. К частицам добавляется очищающее средство (Dentin Cleanser, KometaBio) из гидроксида натрия в 20% этаноле с высоким рН (очень щелочной) для удаления любых бактерий и остатков органического материала. Через 5 минут очищающее средство удаляют с помощью стерильной марли, чтобы удалить влагу. В качестве дополнительной стадии этилендиаминтетрауксусную кислоту (ЭДТА) можно использовать для частичной деминерализации частиц, чтобы выявить больше частиц коллагена и, таким образом, ускорить активацию участка в процессе заживления. Затем в смесь добавляют средство для промывания дентина (Dentin Wash, KometaBio), состоящее из забуференного фосфатом физиологического раствора, и оставляют на несколько секунд. После этого второго замачивания жидкий смыв удаляют стерильной марлей.
Теперь трансплантат готов к использованию. Чтобы улучшить обработку материала, частицы аутологичного трансплантата дентина могут быть смешаны с фибрином, богатым лейкоцитами и тромбоцитами (L-PRF), для образования студенистой массы перед размещением материала в лунку. Тип трансплантата и размеры частиц выбираются в зависимости от конкретного использования трансплантата и того, как долго он должен оставаться на месте. Во время обработки зуба протоколы измельчения и сортировки могут варьироваться, так что могут быть получены частицы меньшего или большего размера, что изменяет общую скорость резорбции трансплантата и встраивания новой кости в нужный участок. При небольших дефектах, таких как поднадкостничные пародонтальные карманы или непосредственные промежутки между местами размещения имплантатов, мелкие частицы могут быть полезны для более быстрого получения новой кости. В тех случаях, когда имеются большие дефекты кости, возможно, отсутствуют костные стенки, наличие более высокой доли крупных частиц должно позволить материалу дольше сохранять свои свойства восполнения объема и архитектуры тканей.
Примеры клинических случаев
Случай 1: Отсроченная установка имплантата после сохранения объема лунки от удаленного зуба
У 52-летнего мужчины обнаружили гнойный экссудат, стекающий между вторым премоляром верхней челюсти и первым моляром (зубы 2.5., 2.6.) Обследование подтвердило подвижность обоих зубов класса 2+ ( второй степени) и зондирование периодонта в области контакта данных зубов до верхушек их корней на величину ≥10 мм. Пациент сообщил о некоторой заложенности пазух носа с левой стороны. Была сделана периапикальная рентгенограмма, которая подтвердила потерю межпроксимальной кости с большим апикальным поражением, включающим второй премоляр и мезио-щечный корень первого моляра (фото 1). При оценке КЛКТ исследования было отмечено отсутствие щечной и язычной кости, связанной с двумя зубами, а также вовлечение пазух в результате проникновения одонтогенной инфекции, что выражалось в появлении серой тени на снимке, что и проявлялось обтурацией пазух. Кроме того, было отмечено отсутствие кости в месте трифуркации корней первого моляра.
Фото 1. Пациент обратился с жалобой на боль в области верхней челюсти сзади, слева, которая рентгенологически имела большую периапикальную область, связанную с апикальной частью второго премоляра и мезио-щечной частью корня первого моляра, и глубину зондирования пародонтальных карманов ≥10 мм в межпроксимальной зоне.

Был введен местный анестетик. И был произведен забор крови для создания L-PRF, который должен быть смешан н с аутогенным материалом трансплантата. Имевшийся на зубе материал от реставрации был удален с двух зубов с помощью твердосплавного бора и высокоскоростного наконечника (фото 2). Зубы были удалены атравматично с помощью периотомов, прямых элеваторов и щипцов. Они были очищены от мягких тканей и зубного камня, а затем помещены в виде частиц материала для обработки измельчительном аппарате для выделения дентина (Smart Dentin Grinder). Удаленные зубы были преобразованы в аутогенный материал трансплантата из дентина, вещество было стерилизовано в аппарате и частично деминерализовано. Затем материал трансплантата смешали с кусочками мембраны L-PRF, полученной из взятого образца крови пациента, мембрану обезвожили и добавили частицы трансплантата дентина создавая блок L-PRF ("костный блок"). Соседние зубы были очищены от зубных отложений и был проведен кюретаж корней, а лунки от удаленных зубов были тщательно обработаны, чтобы избежать разрыва (Шнейдеровой) мембраны, выстилающей пазуху, которая была обнажена (фото 3). Была выполнена рентгенограмма, что бы оценить расстояние от лунок после удаления зубов до пазухи верхней челюсти и выявить возможное наличие перфорации. Прилегающие открытые поверхности корней обрабатывали лимонной кислотой в течение 2 минут и тщательно промывали, чтобы облегчить повторное прикрепление частиц во время заживления участка проведенной манипуляции после размещения трансплантата.
Фото 2. Имевшиеся реставрации из амальгамы были удалены с первого моляра перед экстракцией.

Фото 3. Экстракционные лунки были тщательно обработаны для удаления любых, возможно присутствующих, кист в области корня зуба.

Мембрана L-PRF была помещена поверх открытой мембраны Шнейдера внутрь лунок от удаленных зубов и лунки были заполнены блоком L-PRF из аутологичного материала трансплантата из частиц дентина (Фото 4). Амнион-хорионный барьер (BioXclude, Snoasis Medical) помещали поверх материала трансплантата, с добавлением мембраны PRF в качестве дополнительного изолирующего материала поверх амнион-хорионовой мембраны (фото 5). Поскольку первичное закрытие было не осуществимо и, таким образом, большая площадь альвеолярного гребня осталась бы открытой для окружающей среды полости рта, плотный политетрафторэтиленовый (PTFE) барьер (Cytoplast TXT, Osteogenics) был помещен поверх участка в области первого моляра, чтобы уменьшить вероятность того, что пациент нарушит формирование сгустка в процессе раннего заживления раны во жевания или чистки зубов. Швы накладывали без натяжения, чтобы стабилизировать мягкие ткани, но не для получения первичного закрытия или сжатия материала трансплантата. Пациенту назначали антибиотики (Аугментин по 875 мг два раза в день в течение 7 дней) и безрецептурные обезболивающие препараты в течение 2 дней. Была выполнена периапикальная рентгенограмма, чтобы удостовериться в заполнении экстракционных лунок материалом трансплантата.
Фото 4. Аутологичный трансплантат из клеток дентина, полученный после обработки удаленных зубов, был помещен в экстракционные лунки.

Фото 5. Амнион-хорионическую мембрану поместили поверх материала трансплантата из дентина и заправили под края лоскута перед наложением швов.

Через год после операции при клиническом обследовании была отмечено образование здоровой ороговевшей мягкой ткани, покрывающей место проведенной трансплантации (фото 6). Было проведено КЛКТ исследование, что бы оценить степень приживления и интеграцию материала в кость хозяина, а также определить, имеется ли достаточный объем кости для установки имплантата (фото 7). КЛКТ показало количество кости, чтобы можно было установить два имплантата. После введения местного анестетика был выполнен разрез области альвеолярного гребня и гребень был обнажен, чтобы выявить плотную кость без видимых частиц трансплантата. Начальная остеотомия была произведена в месте второго премоляра и первого моляра с помощью направленного хирургического вмешательства. Для обеспечения возможности постановки имплантата нужной длины было запланировано увеличение объема альвеолярного гребня в области пазухи, для улучшения качества кости, окружающей устанавливаемый имплантат, был использован протокол остеоденсификации. Увеличение объема альвеолярного гребня в области пазухи было выполнено с помощью комбинации пьезохирургии (Mectron) и остеоденсификации (Versah). Эти запатентованные сверла также использовались для увеличения плотности кости и одновременного улучшения остеоинтеграции.
Фото 6. Заживление тканей по прошествии 12-ти месяцев после пересадки тканей, продемонстрировано восстановление альвеолярного гребня и отсутствие признаков воспаления.

Фото 7. Продемонстрированы срезы КЛКТ участков трансплантации через 10 месяцев после вмешательства, видно увеличение высоты и ширины гребня в местах удаления зубов, обеспечен нужный объем для размещения имплантатов.

Два имплантата (Touareg, Adin), диаметром 4,2 мм в участке отсутствия зуба 2.5 и диаметром 5 мм в области отсутствующего зуба 2.6. были размещены с помощью аугментации альвеолярного гребня при помощи специальной зубной матрицы NovaBone Dental Putty, Osteogenics). Вторичная пересадка тканей осуществлялась с использованием костного материала (SynOss, коллагеновая матрица) была наложена для расширения альвеолы на вестибулярной стороне гребня. Трансплантат гидратировали в жидкости из препарата L-PRF, а также как и барьерный слой из коллагеновой мембраны (MatrixDerm, Collagen Matrix), который поместили поверх вестибулярной стенки трансплантата на альвеолярном гребне. Зона вмешательства была ушита швами, способствующими первичному закрытию раны, что позволило имплантатам приживаться в толще тканей.
Пациент вернулся через 7 месяцев после установки имплантата, чтобы начать восстановительную фазу лечения. После введения местного анестетика имплантаты были вскрыты. Стабильность имплантата была проверена с использованием коэффициента стабильности имплантата (ISQ) (Osstell), регистрируя измерения ISQ 72 для имплантата в области зуба 2.5. и для имплантата в области зуба 2.6., подтверждая стабильность, позволяющую начать восстановление. Имплантаты были нагружены протезными конструкциями с винтовой опорой. Через 2,5 года после установки реставраций рентгенограмма продемонстрировала стабильность костной ткани и трансплантата альвеолярного гребня в зоне установки имплантатов и интеграцию кости хозяина со смесью аутогенного трансплантата дентина (фото 8).
Фото 8. Рентгенограмма через 2,5 года после вмешательства (более 3 лет после установки трансплантата), демонстрирующая стабильность трансплантата и поддержание его в области альвеолярного гребня при функциональной нагрузке.

Случай 2: Немедленная имплантация с аугментацией лунки от удаленного зуба
Здоровая пациентка 97,5 лет обратилась на экстренный прием с переломом левого первого премоляра верхней челюсти (зуб 2.4). При осмотре было отмечено, что у зуба отсутствует коронковая часть и он находится на одном уровне с краем десны. Была выполнена периапикальная рентгенограмма, и зуб был признан не подлежащим восстановлению из-за степени отсутствия структуры зуба (фото 9). Поперечный срез КЛКТ пораженного зуба продемонстрировал размеры полости и не поврежденную часть альвеолярного гребня со стороны щеки (фото 10). С пациентом были обсуждены варианты лечения, которые включали удаление оставшегося корня с последующим препарированием зубов мезиально и дистально к промежутку и установкой не съемного частичного протеза, либо установкой имплантата и реставрации дефекта коронкой. Пациентка сказала, что не хочет, чтобы у ей "срезали зубы", и выбрала вариант лечения имплантатом.
Фото 9. Периапикальная рентгенограмма, демонстрирующая перелом левого первого премоляра верхней челюсти с потерей коронковой части зуба, по отношению к кости альвеолярного гребня, в результате чего зуб не подлежит восстановлению.

Фото 10. Представлен поперечный срез КЛКТ пораженного зуба.

Пациентка просмотрела и подписала формы согласия. Был введен местный анестетик, и остатки корня зуба были удалены с помощью пьезохирургии. Предвидя необходимость размещения трансплантата вокруг имплантата для заполнения любой пустоты в лунке, врач использовал насадку скалера от пьезохирургического аппарата для удаления мягких тканей с поверхности корня. Затем корень был обработан с помощью Smart Dentin Grinder в соответствии с инструкциями производителя для создания аутологичного материала для трансплантата. Лунка была обработана и была проведена остеотомия области для размещения имплантата размером 3,7 х 13 мм (Intrahex, BioHorizons), который был помещен по направлению к небной стенке лунки от удаленного зуба (фото 11). Измерение ISQ было проведено для проверки начальной стабильности и показало значение 58. В направлении щеки имелся зазор, создающий пустоту между имплантатом и стенкой лунки. Промежуток был заполнен частично деминерализованным материалом дентина, полученным на приеме ранее; материал был смешан с L-PRF плазмой из сыворотки крови, взятой в начале приема, для создания "липкой кости". Дополнительный материал трансплантата был помещен поверх плеча имплантата, чтобы покрыть альвеолярный гребень и частично распространиться на высоту соединительной ткани. Амнион-хорионный барьер (BioXclude) был помещен поверх участка и заправлен под край лоскута на щечной и небной сторонах, а затем покрыт пробкой из PRF фибрина (фото 12). Для закрепления нижележащих материалов были наложены швы с полигликолевой кислотой. Хотя PRF не был необходим для заживления, он был установлен так, чтобы пациентка избегала жевания с левой стороны и не чистила область после операции в течение начального периода заживления. Пациентка была инструктирована, о том, что нужно избегать жевания с левой стороны и не чистить область после операции в течение начального периода заживления. Пациент был осмотрен через 1 месяц после операции, и было отмечено полное закрытие раны тканью десны в месте проведения вмешательства.
Фото 11. После извлечения корня зуба имплантат немедленно поместили небно в лунку, оставляя большой зазор между имплантатом и щечной стенкой лунки.

Фото 12. Аутогенный дентинный трансплантат, созданный из удаленного зуба, был помещен в пустоту в лунке для заполнения дефекта.

Пациентка вернулась через 3 месяца после установки имплантата, и была выполнена периапикальная рентгенография, чтобы проверить приживление имплантата и трансплантата. Трансплантат, который был помещен в щечную стенку лунки щель для заполнения пустоты, соединился с окружающей костью хозяина, и было решено, что можно начинать дальнейшее протезирование. и имплантат был открыт небольшим хирургическим надрезом. Было проведено измерение стабильности имплантата ISQ, равное 78, и был установлен заживляющий абатмент. После заживления десен была начата восстановительная фаза и получен оттиск. Была изготовлена и поставлена коронка на основе циркония и титана, конструкция была закреплена на винтовую часть имплантата.
Пациентка продолжала регулярно посещать гигиенические процедуры. Периапикальная рентгенограмма через 1 год после протезирования подтвердила стабильность кости по отношению к имплантату и кости альвеолярного гребня (фото 13). Область была выстлана здоровой тканью десны, без признаков воспаления, было отмечено, однако, имелось минимальное образование карманов и, при этом, сохранялась приемлемая эстетика (фото 14). На момент написания этой статьи самое последнее наблюдение составляло 4,5 года после лечения, при этом пациентке было 102,5 года, и ее здоровье оставалось хорошим. Поперечные срезы КЛКТ, выполненные на тот момент, продемонстрировали сохранение объема тканей в щечно-небной части альвеолярного гребня за счет аутологичного трансплантата дентина, помещенного в щечную щель экстракционной лунки (фото 15).
Фото 13. Периапикальная рентгенограмма через 12 месяцев после проверенного лечения и протезирования при помощи имплантата, продемонстрирован тесный контакт окружающей кости с имплантатом и полное слияние аутогенного дентинного трансплантата, который был положен в рану при установке имплантата. Здоровая десневая ткань вокруг протеза очевидна.

Фото 14. Клинический вид через 12 месяцев после проведения процедуры имплантации видна здоровая слизистая, окружающая конку имплантата.

Фото 15. Аксиальные срезы КЛКТ исследования через 51 месяц после лечения, демонстрирующее сохранение кости вокруг имплантата со стабильностью аутогенного дентинного трансплантата на щечной стороне участка.

Случай 3: Сохранение Экстракционной Лунки с Имплантацией Соседнего зуба/ имплантата в периодонте
У 75-летнего пациента мужского пола, который начал курить в возрасте 72 лет, но не имел других сопутствующих медицинских патологий, возникли проблемы, связанные с одномоментным имплантатом, который был установлен и протезирован на месте расположения правого центрального резца нижней челюсти 12 лет назад. Осмотр показал отсутствие сосочка на мезиальной и дистальной сторонах реставрации имплантата с тесным контактом между коронкой имплантата и левым центральным резцом от шейки до резцового края с рецессией десневого края на двух центральных резцах. Периапикальная рентгенограмма выявила поражение области корня левого центрального резца со значительной потерей костной ткани вокруг этого зуба и примерно 30-45% потери костной массы вокруг имплантата (фото 16). При зондировании пародонта была отмечена глубина 6 мм между коронкой имплантата и правым боковым резцом, 5 мм между коронкой имплантата и левым центральным резцом и 5 мм между правым боковым резцом и клыком, измеренная с вестибулярной стороны десны, при этом на этих зубах отмечено наличие рецессии десны. Имплантат не обладал подвижностью и считался стабильным.
Фото 16. Периапикальная рентгенограмма, демонстрирующая поражение окружающих на левом центральном резце, прилегающем к ранее установленному и протезированному имплантату.

На основании клинических данных левый центральный резец был признан безнадежным, и пациенту было рекомендовано удалить зуб, подсадить костную ткань в лунку от удаленного зуба и также вокруг оголенных соседних нити имплантата, а также использовать консольный понтик от имплантата для восстановления. Пациент принял рекомендации по лечению, подписал и просмотрел форму согласия.
После введения местного анестетика был удален зуб 31 (фото 17), с зуба была удалена любая мягкая ткань, прилипшая к корню, а затем зуб был отшлифован и обработан с помощью Smart Dentin Grinder. В то время как аутологичный дентин обрабатывался, лоскут был приподнят на лицевой и язычной сторонах в области зуба 41., для обнажения нитей имплантата, которые были расположены выше уровня альвеолярного гребня. Они были обработаны кюретами и титановой щеткой (RotoBrush-набор щеток для чистки нитей Titanium, Salvin), предназначенной для удаления поверхностных отложений. Лунка в области зуба 3.1. и прилегающие к ней поверхности корня были обработаны на всю длину корня зуба для установки ткани трансплантата. Все открытые участки были обработаны при помощи лимонной кислоты.
Фото 17. После удаления поврежденного центрального резца был очевиден дефицит мезиодистального пространства, что исключало использование имплантата для восполнения потери пострадавшего резца.

Аутологичный измельченный дентин смешали в равной пропорции с минирализованным губчатым аллотрансплантатом (Ossif-I, Surgical Esthetics) и гидратиповали в физиологическом растворе для увеличения объема трансплантата. Затем смесь для трансплантата поместили в лунку от удаленного зуба и вокруг имплантата, и соседних зубов до достижения идеального уровня альвеолярного гребня (фото 18). Вокруг имплантата был установлен барьер из амнион-хорионной мембраны (BioXclude), позволяющий головке имплантата выходить через мембрану, а также данный барьер был установлен над прилегающей к зоне трансплантации областью и заправлен под края лоскута (фото 19). Лоскуты были стабилизированы вокруг открытого плеча имплантата, и были наложены швы с полигликолевой кислотой, чтобы закрепить их в ране (фото 20). Была выполнена периапикальная рентгенограмма, чтобы оценить уровень прилегания трансплантата к костным структурам (фото 21). На имплантат была установлена консольная временная коронка.
Фото 18. Аутогенный дентинный трансплантат, созданный из тканей удаленного зуба, был помещен в постэкстракционную лунку и вокруг имплантата крестовидно.

Фото 19. Амнион-хорионная мембрана была помещена так, чтобы покрыть трансплантат, и заправлена под края лоскута.

Фото 20. Были наложены швы для получения первичного закрытия участка трансплантации.

Фото 21. Периапикальная рентгенограмма, сделанная сразу после экстракции и установки аутогенного дентинного трансплантата.

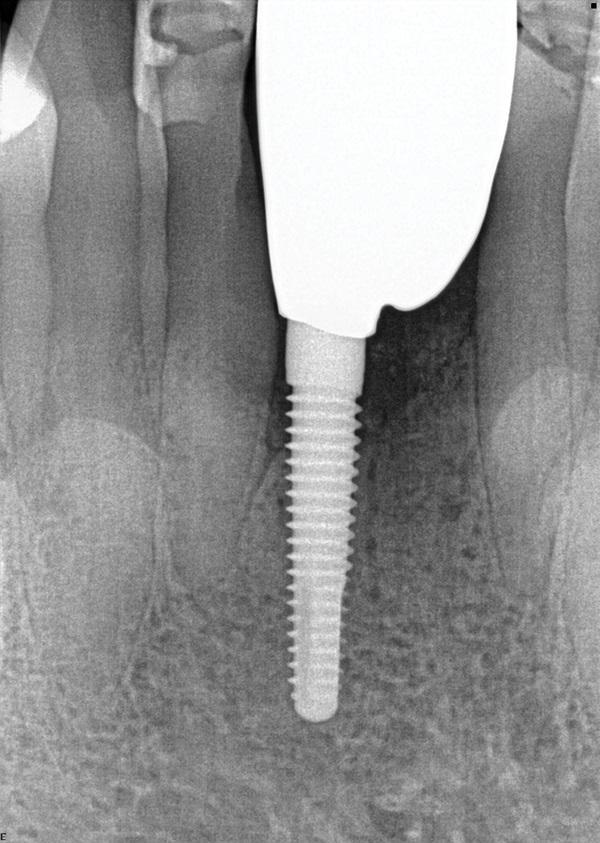
Участки заживали хорошо и без осложнений. Во время очередного приема с целью динамического наблюдения, по прошествии 18 месяцев с момента операции, коронка была удалена, обнажив толстые, здоровые ткани десны. Вокруг имплантата. Зондирование по границам имплантата выявило прохождение инструмента на глубину 2 мм, в толщу тканей, без явлений кровотечения, а коронка соприкасалась со здоровыми мягкими тканями. Рентгенологически на соседних зубах было отмечено вертикальное увеличение объема костной ткани в пределах от 3 мм до 5 мм, и большинство ранее открытых нитей на существующем имплантате были покрыты костью (фото 22). Аутологичный дентинный трансплантат полностью слился с окружающей костью хозяина, и рентгенологически не было отмечено никакой дифференциации между костью и ранее размещенной тканью трансплантата.
Фото 22. Периапикальная рентгенограмма окончательной консольной реставрации, демонстрирующая включение аутогенной ткани трансплантата клеток дентина зуба в костную ткань хозяина через 18 месяцев после операции.

Обсуждение
Материал костного трансплантата из тканей зуба должен обладать остеокондуктивными свойствами и, в идеале, быть остеоиндуктивным. Он должен обладать остеостимулирующими свойствами с минерализованным матриксом и нативными коллагеновыми и неколлагеновыми белками. Ключевым аспектом при выборе материала для трансплантата должны быть остеокондуктивные свойства, действующие как каркас для регенерации кости, но также, в идеале, остеоиндуктивные свойства, стимулирующие ускоренную регенерацию кости и динамику заживления. Аутологичный материал для трансплантации, такой как дентин, представляет собой минерализованный матрикс с нативными коллагеновыми и не коллагеновыми белками.
В данной статье продемонстрировано, что удаленные зубы, используемые в качестве аутогенного материала костного блока для трансплантации тканей с целью увеличения объема альвеолярного гребня или преобразованные в частицы стружки дентина, подвергаются постепенной резорбции и замене на аналогичную аутогенную кость. Зубы нуждаются в удалении по целому ряду причин, включая запущенные заболевания пародонта, не подлежащую восстановлению структуру коронки зуба, вертикальный перелом корня и другие. После удаления зуба альвеолярный гребень вокруг лунки удаленного зуба подвергается ремоделированию во время заживления, особенно на щечной стороне гребня. Это приводит к уменьшению объема кости в месте планируемой установки имплантата, что может поставить под угрозу стабильность имплантата, эстетичность конструкции и ее функциональность.
В течение первых 3 месяцев после удаления зуба сообщалось о снижении объема альвеолярного отростка на 50%. Исследования показали разные результаты относительно того, выше ли потеря костной массы при отсроченной установке имплантата по сравнению с немедленной установкой.
Таким образом, когда показана отсроченная установка, запечатывание лунки поможет сохранить объем альвеолярного гребня в зоне удаления и ограничит, если не предотвратит, рассасывание во время заживления участка после удаления зуба. Когда возможно проведение немедленной имплантации, как показано ранее, помещение в рану блока трансплантата улучшает стабильность имплантата и повышает уровень краевой, прилегающей кости в операционной зоне, заполняя пустоту между стенками лунки от удаленного зуба и самим имплантатом.
Альвеолярная кость и зубы развиваются из клеток одинаковой макромолекулярной структуры, содержащих коллаген 1-го типа, минерал гидроксиапатит (ГА) и различные неколлагеновые белки, которые являются общими для кости, дентина и цемента. Сами зубы состоят из трех минерализованных структур: эмали (кристаллическая структура ГА без органического матрикса), дентина и цемента; последние два менее минерализованы, чем эмаль, и имеют сходный состав с мембранозной костью. Таким образом, дентин, который составляет 90% структуры зуба, может служить в качестве нативного материала для костной пластики, аналогичного аллотрансплантату или аутотрансплантату кости, используемому для той же цели.
Дентин состоит из 40-45% минерала ГА и аналогичного объема органического матрикса. Органическая матрица на 90% состоит из коллагеновых волокон 1-го типа, к которым прикреплены неколлагеновые молекулы. Это делает органический матрикс аттрактантом для остеогенных клеток, индуцирующих рост и дифференцировку кости. Фосфопротеин дентина, регуляторный белок, экспрессируемый в дентине и в меньшей степени в кости, участвует в минерализации кости и обладает способностью регулировать как начальную минерализацию, так и ремоделирование ткани.
Во время минерализации костного матрикса минералы ГА откладываются вокруг коллагеновых волокон и между ними, защищая органический матрикс дентина от ферментативной деградации. Поскольку сообщалось, что факторы роста сохраняются в зубе, частицы дентина могут распознаваться остеокластами и рассасываться аналогично мембранозной кортикальной кости. Эти частицы дентина затем полностью или частично рассасываются, заменяясь новой костью, поскольку аколлагеновые молекулы, такие как фосфопротеин дентина, фактор роста фибробластов и костный морфогенетический белок, высвобождаются во время резорбции дентина. Резорбция частиц дентина в процессе ремоделирования происходит гораздо медленнее, чем у аллотрансплантационных материалов. Это позволяет сохранить место и объем трансплантата, помогая организму-хозяину преобразовать дентиновый трансплантат в жизнеспособную кость без потери объема, как это наблюдалось с другими материалами для трансплантации, используемыми клинически.
Доказано, что использование деминерализованного дентина в форме обработанного аутогенного дентинного трансплантата способствует высвобождению большего числа остеогенных клеток, образуя большее количество сплетенной кости во время заживления участка и созревания материала трансплантата. Хотя мелкие частицы деминерализованного дентина могут рассасываться быстрее, чем минерализованные частицы дентинного трансплантата, использование комбинации с крупными частицами поможет сохранить объем с течением времени. Было предложено обрабатывать трансплантат из частиц дентина ЭДТА в течение 2 минут для создания тонкого поверхностного слоя деминерализованного дентина толщиной 10 мкм, чтобы индуцировать высвобождение молекул аттрактанта, таким образом, обеспечивая тонкую поверхность деминерализованного дентина большего высвобождения остеогенных клеток с сопутствующим отложением кости во время ранней фазы регенерации операционного участка. Этот процесс оставил бы большую часть минерализованного дентина нетронутым, увеличив время, в течение которого трансплантат будет жизнеспособен и не подвергнется резорбции для преобразования в кость хозяина.
Частицы аутологичного дентина размером от 250 мкм до 1200 мкм, полученные с помощью протокола обработки в аппарате Smart Dentin Grinder, использовались в качестве биоматериала для трансплантации в процедурах костной регенерации при проведении имплантации. Послеоперационная компьютерная томография подтвердила, что дисперсный дентин сохранял трехмерный объем участков лунки. Гистологически сообщалось о формировании новой кости, заполняющей весь объем заполняемого участка трансплантатом, в котором ранее располагались корни от удаленного зуба и материал трансплантата, состоящий из частиц дентина был полностью преобразован в жизнеспособную кость хозяина.
Независимо от того, запечатывается лунка или нет, резорбция на уровне альвеол может быть ограничена путем герметизации коронарной части лунки. Ограничение врастания мягких тканей лунки и/или материала трансплантата позволяет замедлить процесс остеобластической активности и ангиогенеза, сохраняя размеры альвеолярного гребня. Доступны различные изолирующие мембраны для применения с целью сохранения лунки в области удаленного зуба, независимо от того, устанавливаются имплантаты одновременно с материалом трансплантата кости или нет. Было описано, что применение рассасывающихся мембран биологического происхождения обеспечивает наилучшие результаты при минимальном потенциале осложнений, о которых сообщалось при использовании других рассасывающихся или не рассасывающихся мембран, обычно используемых в прошлом.
Доступны биоактивные изолирующие мембраны, некоторые из которых в своей структуре содержат обработанные ткани амниона и хориона человека. Такие мембраны способны стимулировать рост клеток, обладая повышенной механической прочностью ввиду присутствия частиц амнион-хориона при отсутствии иммуногенности, делают данные мембраны идеальным материалом для доставки в необходимый участок аллогенных клеток и для применения их в целях тканевой инженерии. Одна из таких мембран (BioXclude), которая использовалась в случаях, описанных в этом отчете, содержит различные факторы роста и биологические медиаторы, важные для формирования костей и ороговевших тканей. Эти стимулирующие факторы включают фактор роста тромбоцитов, фактор роста эндотелия сосудов, ламинин 5, белки внеклеточного матрикса и различные типы коллагена. Преимущество сохранения лунки от удаленного зуба заключается в том, что мембрана амнион-хорион не требует первичного закрытия, поскольку при обработке лунки следует ожидать некоторой экспозиции тканей. Было, также отмечено, мембрана уменьшает воспалительный процесс. Также сообщалось об антибактериальных свойствах; эти свойства, особенно в отношении участков экстракции, где первичное закрытие невозможно, обеспечивают преимущество использования мембраны для борьбы с накоплением бактерий, которое может возникнуть после завершения хирургического лечения, что приводит к нарушению заживления тканей и снижению их регенеративного потенциала. Клинические исследования продемонстрировали ускоренное заживление пародонта, более быстрое приживление лоскута и уменьшение числа послеоперационных рецессий. Данные мембраны могут использоваться в сочетании с другими изолирующими материалами, например концентратами из сыворотки плазмы аутогенной крови, такими как PRF-фибрин.
Заключение
Когда показано удаление зуба, зуб может быть обработан и использован в качестве дисперсного материала для трансплантации, аналогичного другим доступным материалам для трансплантации. Полученный от пациента, который нуждается в трансплантации костной ткани, аутологичный материал дентина продемонстрировал процесс трансформации в кость хозяина без каких-либо потенциальных иммунологических проблем, о которых, хотя и редко, сообщалось при применении некоторых коммерческих материалов для трансплантации кости. Случаи, описанные в данной статье, показали полное восстановление объема и высоты альвеолярной кости и ороговевшей ткани в зоне вмешательства. Продемонстрированный автором подход может явиться дополнительным преимуществом при снижении рисков возникновения заболеваний пародонта и периимплантата за счет регенерации исходного альвеолярного комплекса. За счет уменьшения аваскулярных пространств вокруг частиц трансплантата и увеличения кровоснабжения в этой области обработанный участок способен вернуться к гистологическому виду "родной" кости. Физиологически аутологичные дентинные трансплантаты способны хорошо активировать регенеративные способности организма для купирования болевых ощущений и уменьшения любой потенциальной воспалительной реакции на появление зубного налета, скопление которого вызывает уменьшение объема костной ткани и способствует развитию периодонтита и периимплантита. Кроме того, стоимость лечения снижается, поскольку не требуются использование пакуемых материалы для трансплантации костной ткани, а также не требуется формирование донорских участков, необходимых при применении аутогенных трансплантатов, полученных из других участков полости рта. Использование биоактивного трансплантата и барьерной мембраны, показанных выше, при описании ряда клинических случаев, может быть рассмотрено, при необходимости осуществления протокола немедленной или отсроченной установки имплантатов или при сохранении объема лунки от удаленного зуба и связанным с этим процессом воспаления потери костной ткани периодонта в области соседних зубов или интегрированных имплантатов.
Авторы:
Robert A. Horowitz, DDS
Gregori M. Kurtzman, DDS, MAGD
José Luis Calvo-Guirado, DDS, PhD, Eu PhD, MS





























































































































































0 комментариев