Плотный по своей консистенции политетрафторэтилен (d-PTFE) является нерезорбируемым материалом, который может использоваться в качестве барьерной мембраны в ходе выполнения процедур направленной костной регенерации или же направленной регенерации тканей. Принципами направленной костной регенерации часто пользуются при восстановлении дефектов альвеолярного гребня после проведения экстракции в качестве хирургической подготовки к последующей имплантации или параллельно с установкой имплантата при использовании протокола непосредственного вмешательства. Подобная процедура состоит из установки костного трансплантата, а поверх него – резорбируемой или нерезорбируемой мембраны, которая помогает предотвратить миграцию клеток эпителия и соединительной ткани в толщу костного трансплантата, тем самым обеспечивая адекватное заселение области вмешательства клетками-предшественниками костной ткани.
Использование d-PTFE помогает избежать некоторых потенциальных осложнений, которые могут возникнуть при использовании других типов изолирующих мембран. К примеру, как резорбируемые, так и нерезорбируемые мембраны (по типу пористого политетрафторэтилена [еxpended-PTFE]) нужно в большинстве случаев полностью покрывать мягкими тканями, так как их непосредственное взаимодействие со средой ротовой полости может иметь негативные последствия. Если резорбируемую мембрану не ушить, то под воздействием ротовой жидкости, она теряет свою первостепенную изоляционную способность уже на 7 день, и полностью резорбируется, как правило, уже через 2 недели. Этого времени недостаточно ни для репопуляции костных клеток-предшественников, ни для их дифференциации в ходе образования остеоида (соединительнотканного образования, которое предшествует формированию кости). В случаях обнажения нерезорбируемых мембран при расхождении мягких тканей повышается риск их инфицирования уже на протяжении первых 4 недель. Подобных осложнений можно избежать при использовании d-PTFE. Их не нужно дополнительно изолировать мягкими тканями, и они не резорбируются под воздействием ротовой жидкости. Кроме того, известно, что область хирургического вмешательства при изоляции с использованием d-PTFE не поддается инфицированию от 4 до 6 недель. Данные мембраны представлены на рынке под разными коммерческими названиями, например, Cytoplast [Osteogenics Biomedical], TefGen FD [Lifecore Biomedical, LLC], Symbios OsteoShield [DENTSPLY Implants]. В данной статье рассмотрено использование d-PTFE мембран (Cytoplast) в ходе проведения направленной костной регенерации, а также детально проанализировано их преимущества и недостатки, поскольку в большинстве исследованиях, описанных в литературе, использовался именно Cytoplast как представитель d-PTFE мембран. Именно поэтому в данной статье внимание будет сконцентрировано на данном брендовом материале, уже доказавшем свою эффективность.
Историческая справка
В 1976 году Melcher исследовал потенциал периодонтальной связки (PDL – periodontal ligament) как перспективного депо для продукции клеток-предшественников в ходе регенерации костных дефектов. Впоследствии Nyman с коллегами использовали Millipore-фильтр (барьер) для того, чтобы исключить миграцию эпителия и соединительных тканей в область костного дефекта, таким образом, обеспечивая его наполнение лишь клетками-предшественниками из области периодонтальной связки. Такой подход начали называть направленной регенерацией тканей, целью которого являлось восстановление кости, периодонтальной связки, а также цемента. Позже подобный принцип Dahlin апробировал при аугментации альвеолярного гребня у кролика, и такая специфическая процедура по реконструкции кости начала называться направленной костной регенерацией.
Основными принципами направленной костной регенерации являются:
- исключить проникновение эпителиальных и соединительных тканей в область хирургического вмешательства, чтобы обеспечить процесс репопуляции дефекта клетками-предшественниками костной ткани;
- создать пространство для восстановления структуры костной ткани (обеспечение достаточного объема для регенерации кости). С этой целью барьерную мембрану фиксируют с помощью или самого трансплантата или с помощью удерживающих винтов;
- изолировать кровяной сгусток, образовавшейся после вмешательства, от внешнего воздействия (стабилизация сгустка);
- обеспечить ангиогенез;
- достичь закрытия раны первичным натяжением после формирования лоскута.
Чтобы достичь первичного закрытия часто требуется сформировать послабляющие периостальные и вертикальные разрезы, чтобы избежать эффекта натяжения тканей. Если периостальный послабляющий разрез не обеспечивает достаточной мобильности лоскута, его можно углубить до подслизистого слоя. Это может спровоцировать увеличение отека, образование кровоподтеков и повышение чувства дискомфорта у пациента в послеоперационный период. Поэтому, иногда приходится отказываться от принципа закрытия раны первичным натяжением, но при этом ни в коем случае не нужно пренебрегать возможностью достижения аналогично эффективных регенеративных результатов, которых можно достичь и без первичного закрытия раны с использованием d-PTFE мембран.
Характеристики d-PTFE барьерных мембран
Впервые d-PTFE нерезорбируемые мембраны начали изготавливаться компанией Gore-Tex, после чего коммерчески доступным стал материал TefGen. TefGen считался нанопористой мембраной (n-PTFE) с крайне мелкими порами. Особенности мембран Cytoplast, которые были использованы в четырех клинических случаях, описанных в данной статье (фото 1 - фото 25), состоят в следующем: данные мембраны характеризуются 4-летним сроком службы; Cytoplast Regentex текстурирован с одной стороны (фото 3) в форме мелких шестиугольных углублений, которые увеличивают площадь поверхности мембраны до 250%. При установке мембраны блестящая гладкая сторона позиционируется в контакт с костным трансплантатом, а текстурированная часть контактирует с покрывным лоскутом (фото 6). Под лоскутом фибробласты мигрируют в области неглубоких углублений, обеспечивая, таким образом, возможности для повышенной адгезии мягких тканей. Доступные размеры мембран составляют 12 мм х 20 мм и 25 мм х 30 мм с возможной толщиной от 0,13 мм до 0,25 мм. Кроме того, существуют и другие типы данных мембран, выпускаемые производителем, как, например, армированные титаном.
Барьерные мембраны: d-PTFE против e-PTFE
Материалы, используемые при проведении направленной костной регенерации, могут иметь различные названия: мембраны; барьерные мембраны; биологические барьеры; окклюзионные мембраны; биорезорбируемые материалы (которые деградируют на протяжении своего функционирования), биоабсорбируемые материалы (которые растворяется в жидкостях организма без расщепления их полимерной цепи), и биодеградируемые (которые расщепляются за счет деградации макромолекул) мембраны; или же просто резорбируемые и нерезорбируемые мембраны. Нерезорбируемые представители разделяются на две категории: пористые, они же экспандированные (e-PTFE) и плотные (d-PTFE) мембраны из политетрафторэтилена. Материал изготовления для обеих групп аналогичен, но e-PTFE имеют более растянутую структуру: размер пор e-PTFE (коммерческое название Gore-Tex) составляет от 5 до 30 микрон (мкм), а d-PTFE (Cytoplast) – от 0,2 микрон. Что же касается сроков, в которые нужно удалять нерезорбируемые мембраны, то они колеблются от 4 до 6 недель при проведении направленной регенерации тканей, и от 6 до 9 месяцев при проведении направленной костной регенерации.
Если же говорить об эффективности использования d-PFTE по сравнению с e-PTFE при проведении направленной регенерации тканей в области костных дефектов, то исследования показали, что статистически значимых различий в отношении прироста кости нет. В данных трех клинических случаях мембраны были дополнительно покрыты ушитым лоскутом, а в качестве трансплантата использовались аллопластическая кость или ксенотрансплантат. Мембраны удаляли через 6-8 недель после установки. Однако в проведенных исследованиях не проводили сравнение эффективности использования мембран в случаях их ушивания и покрытия лоскутом и при преднамеренном частичном обнажении поверхности барьера.
Риск инфицирования
Диаметр тела патогенных бактерий, как правило, меньше 10 микрон, поэтому в случаях с e-PTFE увеличенный размер пор от 5 мкм до 30 мкм часто позволяет бактериям проникать в костные ткани прямо через мембрану. Минимальный размер пор d-PTFE – 0,2 мкм, и поэтому возможность возникновения подобного осложнения исключена. В эксперименте с Enterococcus faecalis (с размером тела от 0,5 мкм до 1 мкм), который часто можно найти среди представителей микробиоценоза ротовой полости, было отмечено, что бактерии не могут проникнуть через барьер из d-PTFE (данные взяты из Osteogenics).
Как уже было указано, при использовании e-PTFE мембран и их непосредственном контакте с полостью рта, риск их инфицирования возрастет на протяжении 4 недель, что может привести к потере части или даже всего костного трансплантата. С другой стороны, в многочисленных статьях отмечалось, что даже при обнажении d-PTFE мембран и их взаимодействии со средой полости рта, они остаются интактными от 4 до 6 недель без каких-либо признаков инфицирования области хирургического вмешательства. Жаль, но данных относительно более долгосрочной перспективы пока еще нет в широком доступе.
Закрытие раны первичным натяжением
Для достижения оптимального результата при проведении реконструкции кости с использованием e-PTFE желательно достичь первичного закрытия области вмешательства.
Это, однако, может спровоцировать возникновение сразу двух проблем:
- изменение контура мягких тканей в результате первичного натяжения;
- деформацию положения мукогингивальной границы.
Таким образом, кератинизированные ткани могут переместиться лингвально, оставляя щечную сторону дефекта покрытой лишь тонкой слизистой оболочкой. Кроме того, может произойти потеря вестибулярной глубины при формировании расширенного лоскута. Уместно напомнить, что размер сформированного лоскута прямо связан с постоперационным состоянием пациента: чем объемнее лоскут – тем больше отек, экхимозы и т.д. и тем хуже чувствует себя пациент после вмешательства. При использовании d-PTFE мембран нет необходимости в достижении первичного закрытия раны, хирургическая процедура выполняется более просто, благодаря чему можно избежать повторного вмешательства с целью удаления мембраны.
Сохранение кератинизированных тканей
В случаях, когда d-PTFE мембрана покрывает костный трансплантат в области лунки удаленного зуба без дополнительного поверхностного ушивания мягких тканей, удается сохранить прежние линейные параметры кератинизированных тканей. Если же со щечной стороны присутствует рецессия мягких тканей, а d-PTFE мембрана спозиционирована аналогично поверх лунки зуба, заполненной трансплантатом, можно достичь даже прироста объема ороговевшей десны. Когда же после экстракции не помещать мембрану в область дефекта, а сам дефект не замещать графтом, будет наблюдаться некоторый линейный прирост именно кератинизорованных тканей, однако их объем в целом при этом коллапсирует из-за частично образованного дефекта десен и дефицита кости. В связи с этим Barber с коллегами провели исследование, в котором доказали, что после удаления фронтальных зубов верхней челюсти и установки барьера из d-PTFE поверх костного заменителя, область кератинизированных десен действительно увеличилась.
Эпителизация раны над областью соединительной ткани остеоида, как правило, происходит в течение от 14 до 21 дня и осуществляется путем миграции эпителиальных клеток из поверхности слизистой, к ране со скоростью от 0,5 мм до 1 мм в сутки после 12-часового периода задержки.
Время и стоимость
При сравнении эффективности использования d-PTFE и других мембран, которые нуждаются в дополнительном покрытии мягкими тканями, последние требуют еще и достижения первичного закрытия раны, а это, в свою очередь, ведет к более продолжительному лечению и, соответственно, к более большим затратам как в период установки, так и удаления барьера.
Заживление раны
В период заживления лунки зуба образовавшийся тромб замещается грануляционной тканью (на протяжении 96 часов), которая, в свою очередь, трансформируется в соединительную ткань (в период от 21 до 28 дней). Именно эта образовавшаяся соединительная ткань, она же остеоид, является предшественником костной ткани. Остеобласты инициируют образование кости, секретируя в состав остеоида специфические морфогенетические белки. Остеоид состоит из волокон и основного вещества, представленного комплексами хондроитин сульфата и остеокальцина. Коллаген І типа составляет 90% всей структуры остеоида. В процессе организации и минерализации последнего на протяжении приблизительно 3 месяцев формируется незрелая грубоволокнистая кость. Такой тип кости является незрелым, и в ходе последующей прогрессирующей минерализации начинает формироваться уже морфологически полноценная пластинчатая кость. Этот процесс занимает приблизительно 4 месяца, но пролонгированная кальцификация продолжается еще в течение года.
Удаление мембран
Точные сроки удаления мембран остаются вопросом спорным, поскольку они зависят от продолжительности периода, необходимого для созревания остеоида в зрелую ткань. Сколько же точно времени требуется для реализации последнего процесса? К сожалению, тоже пока точно не известно. Мембраны играют защитную роль для остеоида, предотвращая проникновение других тканей в период, когда его структура недостаточно конденсирована и еще проницаема для эпителиальных или соеднительнотканных клеток, которые могут нарушить физиологическое образование кости. Первоначально некоторые исследователи предполагали, что после установки e-PTFE мембран их нужно сохранять на протяжении длительного периода времени (например, на 16 недель), чтобы обеспечить направленную регенерацию. При исследовании d-PTFE Cytoplast было доказано, что даже при обнажении мембраны и ее удалении в разный период времени (от 3 до 10 недель, от 3 до 4 недель, от 4 до 7 недель, от 4 до 6 недель, и дольше 6 недель) – все равно все результаты лечения можно было оценить как успешные. Это подтвердили в своих исследованиях Bartee (1995, 1998, 2001), изучавший ряд случаев при обнажении мембраны на протяжении 21, 21-28, 21-30 дней, Hoffman (2008), который на 276 клинических случаях доказал эффективность d-PTFE, обнаженной на протяжении 4 недель, Fotek (2009) – в 20 аналогических случаях с обнажением мембраны на протяжении в среднем на 16,6 дней, Zafiropoulous c коллегами (2010) – в 1 клиническом случае, Yun (2011) – в 2, Waasdorp и Feldman (2013) – в 3. Лучше всех эффект обнажения мембран на результат лечения изучил Barboza, который в своем докладе за 2010 год подтвердил благополучный результат ятрогенного вмешательства с использованием биологических барьеров d-PTFE на выборке из 420 клинических случаев.
Однако несколько аспектов все еще требуют дополнительного и более глубокого изучения. Например, производитель рекомендует удалять Сytoplast мембраны через 4 недели после их установки. После удаления может наблюдаться легкое кровотечение, которое спровоцировано нарушением биологической связи между мягкими тканями и d-PTFE мембраной. Однако в реальных условиях мягкие ткани не растут над поверхностью мембраны. В период от 4 до 6 недель нерезорбируемые барьеры легко удаляются даже без проведения местной анестезии, поскольку плотная поверхность мембран не позволяет волокнистым структурам врасти вовнутрь барьера. Если мембрану желательно оставить на период до 8 недель, то после ее удаления может сформироваться эпителиальный карман, образовавшийся в результате инвагинации мягких тканей по краю мембраны. Для удаления поверхностного слоя эпителия, который составляет около 0,3 толщины, некоторые авторы используют обычный алмазный бор. Стенки кармана пришлифовывают, а стенки дефекта ушивают. Последующее заживление, как правило, проходит без каких-либо осложнений.
Удаление d-PTFE мембран в период 4-6 недель негативно не отображается на процессах регенерации костной ткани, что также было продемонстрировано в представленных ниже четырех клинических случаях (фото1 - фото 25), так как остеоид в это время настолько плотный, что проникновение эпителия или соединительной ткани является физически невозможным, а поэтому не может повлиять на заживление области дефекта. Существует несколько объяснений тому, почему ранее удаление мембран негативно не влияет на процесс восстановления структуры костной ткани:
- Некоторые исследователи, базируясь на собственном опыте, предположили, что ранее удаление мембран может скомпрометировать результаты аугментации альвеолярного гребня. Однако, подобное предположение можно расценивать как ошибочное, поскольку ранее удаление биологического барьера само по себе никак непосредственно не влияет на процесс костной регенерации, а неуспешные результаты ятрогенного вмешательства в исследуемых клинических случаях можно объяснить формированием дигисценций мягких тканей и бактериальной контаминацией, что и могло обусловить необходимость раннего удаления мембраны.
- Проведенное исследование на собаках продемонстрировало, что удаление e-PTFE барьера через 4 недели привело к получению менее эффективных результатов, чем при удалении мембран через 16 недель. Но переносить данные, полученные в этом исследовании на аналогичные условия при использовании d-PTFE мембран методологически некорректно, поскольку они противоречат доказательной базе успешных результатов лечения, полученных при удалении d-PTFE барьеров через 4 недели после установки.
- Результатов исследований, которые бы последовательно аргументировали сроки, необходимые для заживления раны и формирования конденсированного остеоида, до сих пор получить пока что не удалось, поэтому невозможно обосновать конкретные сроки удаления мембран с научной точки зрения и с учетом степени минерализации остеоида.
- Факторами, которые в действительности могут повлиять на процесс заживления дефекта, являются его размер и количество времени, необходимое для созревания остеоидной ткани, при этом оба являются индивидуально специфическими.
- В ходе исследований, представленных в данной статье, все дефекты топографически находились в области границ альвеолярной кости, а манипуляции не предусматривали проведения какой-либо вертикальной аугментации гребня. Поэтому добиться восстановления кости в подобных условиях возможно и без достижения условия первичного натяжения раны и при удалении изолирующей мембраны уже через 4 недели после установки. Докладов относительно направленной регенерации кости с использованием мембран вне вышеописанных условий пока что нет.
Системный обзор литературы
Carbonell и коллеги провели системный обзор литературы, касающийся эффективности использования плотного политетрафторэтилена в ходе выполнения регенеративных процедур. Авторы обнаружили 24 статьи, касающиеся использования d-PTFE and n-PTFE мембран для восстановления дефектов костной ткани в области удаленных зубов и вокруг имплантатов. Из данного объема литературных данных две статьи были отчетами о проведении экспериментов in-vitro, семь – описанием результатов экспериментальных исследований, а 15 демонстрировали данные, полученные в ходе проведения клинических исследований. В целом, описанные клинические исследования нельзя назвать научно-достаточными или полностью доказательно аргументированными. Однако в ходе анализа данных было сформировано заключение о том, что использование n-PTFE мембран не является достаточно экспериментально подтвержденным, в то время как d-PTFE продемонстрировали перспективы своего использования при проведении процедур направленной костной регенерации и направленной регенерации тканей в ходе непосредственной установки имплантатов в лунки удаленных зубов. Кроме того, не следует ограничивать возможность использования мембран в случаях или при процедурах, в которых они ранее не были описаны в литературе. Например, в данной статье продемонстрировано эффективность d-PTFE в качестве барьера для сохранения тканей лунки зуба, а также для восстановления утерянной или дефектной вестибулярной костной стенки альвеолы, поддерживающей мягкие ткани. Ведь часто именно клиническая апробация процедуры передует научному обоснованию целесообразности ее использования, ведь как-никак, а проведение специализированных исследований все же предусматривает необходимость финансовых вложений, а дефицит финансирования в науке – проблема извечная. Фото 1-25 демонстрируют различные клинические случаи, подтвержденные рентген-снимками, в которых для регенерации костной ткани использовали именно d-PTFE мембраны и костный трансплантат Puros (Zimmer Dental), установленные в лунки зубов сразу же после их экстракции.
Данные относительно использования d-PTFE: сохранение альвеолы при условии присутствия четырех резидуальных стенок
Ряд авторов подтвердили возможность сохранения лунки зуба при использовании d-PTFE без достижения первичного закрытия раны, а Fotek и коллеги на примере 20 клинических случаев определили перспективу использования Cytoplast именно с этой целью. После экстракции в область лунки помещали деминерализованный лиофилизированный костный аллотрансплантат (demineralized freeze-dried bone allograft – DFDBA), а мембраны фиксировали с помощью небольшого сформированного лоскута на 3 мм в глубину со щечной и язычной сторон. Мембрану заправляли под сформированный лоскут, не нарушая при этом структуры мезиального или дистального сосочков. Часть мембраны все время оставалась обнаженной и находилась в непосредственном контакте со средой ротовой полости. Через 4 недели мембраны удалили. В ходе анализа результатов ученые заявили, что потеря костной ткани составляла 0,3 мм в горизонтальном направлении и 0,25 мм в вертикальном. Hoffman и коллеги аналогично занимались изучением возможности использования мембран для сохранения тканей альвеолы, однако при этом не использовали никакого костного трансплантата. Вертикальная убыль кости при этом составляла от 0,5 мм до 1 мм, а в 14% исследований убыль твердых тканей достигала даже 2 мм, что было вызвано коллапсом мембраны из-за отсутствия поддерживающей кости. Yamashita вместе с костным трансплантатом использовал также Emdogain (Straumann) или плазму, обогащенную протеинами (PRP), которые покрывали d-PTFE мембраной. В ходе исследования не было обнаружено потери костной ткани, однако структура лунки модифицировалась до 0,8 мм в диаметре.
Все вышеупомянутые результаты можно оценивать как успешные относительно предупреждения убыли кости в горизонтальном и вертикальном направлениях после экстракции зубов. В отличие от этого, в последнем систематическом обзоре литературы было указано, что через 6 месяцев после удаления зуба, которое также включало в себя сепарацию лоскута, средние показатели потери кости составляли 1,24 мм по вертикали (в диапазоне от 0,9 мм до 3,6 мм) и 3,79 мм по горизонтали (в диапазоне от 2,46 мм до 4,56 мм). Другие исследователи, использовавшие иные типы резорбируемых и нерезорбируемых мембран также обнаружили вертикальную потерю костной массы около 1 мм, и горизонтальную потерю – до 3 мм. Когда же использовали костный трансплантат и изолирующую мембрану, то горизонтальная потеря кости не превышала 1 мм, а в вертикальном направлении даже наблюдался прирост костной массы до 1,3 мм. Без сепарации лоскута, как правило, наблюдается вертикальная потеря кости, а горизонтальная убыль фактически ничтожно мала.
Особенности направленной костной регенерации в случаях частичной или полной резорбции вестибулярной стенки лунки
Биологические мембраны также можно использовать в случаях резорбции тканей вестибулярной стенки лунки и при этом оставлять часть мембраны обнаженной в полости рта. Barboza с коллегами достигли успеха в лечении 72 пациентов с помощью костного трансплантата и Cytoplast, при этом им удалось достичь именно регенерации тканей вестибулярной стенки альвеолы. В качестве трансплантата была использована лиозилифированная кость для того чтобы предупредить возможный коллапс мембраны. Биологические барьеры удаляли в период от 21 до 28 дней. Однако в ходе исследования авторы не предоставили абсолютных показателей ни изначального размера дефектов, ни прироста кости, полученного в ходе лечения, они лишь подчеркнули, что после реконструкции гребня удалось установить имплантаты во всех запланированных местах.
Hoffman использовал d-PTFE мембраны без каких-либо дополнительных костных заменителей при лечении 276 лунок удаленных зубов. 28 из них имели дефекты вестибулярной стенки, что не превышали 50% их первичных размеров. В данных областях средний прирост костной ткани составлял до 6 мм (от 4 до 8 мм). Однако в данном исследовании не было никакой контрольной группы для сравнения, поэтому сложно утверждать, насколько данная процедура действительно лучше и эффективнее лечения с использованием костных трансплантатов. Тем не менее, полученные результаты лечения с использованием мембран и без установки костного заменителя были весьма перспективны по отношению к возможной регенерации костной ткани в случаях дефектов щечной стенки лунки.
Yamashita с коллегами использовали d-PTFE мембраны для восстановления 86 постэкстракционных лунок и 45 дефектов альвеолярного гребня у 111 пациентов со средним размером дефекта до 5,5 мм. Средний прирост кости в ходе лечения достигал 5 мм, то есть 95,8% объема всех дефектов были успешно восстановлены. В сочетании с аллопластическим костным трансплантатом исследователи также использовали Emdogain и / или PRP. Поэтому установить, какой из факторов наиболее посодействовал достижению настолько эффективных результатов практически невозможно.
Все три описанные выше исследования по восстановлению дефектов альвеолярного гребня отметили позитивный результат лечения, что в итоге поспособствовало проведению процедуры установки дентальных имплантатов у пациентов группы выборки. Четыре клинические случая, описанные авторами данной статьи (фото 1-25), также демонстрируют позитивный исход восстановления дефектов щечных стенок альвеолы с использованием d-PTFE мембран и костного трансплантата (Puros).
Клинические случаи
В четырех клинических случаях, представленных на фото 1-25, лечение было проведено аналогично (детальное описание первого случая на фото 1-11). Во всех четырех случаях зубы с присутствующими патологическими изменениями были удалены, лоскуты были отсепарированы со щечной и язычной сторон, а области лунок были хирургически обработаны. Подогнанную по размерам d-PTFE мембрану Cytoplast устанавливали под щечную сторону лоскута, после чего область лунки заполняли костным трансплантатом, а мембрану фиксировали под язычную сторону лоскута. В конце манипуляции лоскуты ушивались. Костные трансплантаты использовали во всех случаях, поскольку вестибулярные стенки были резорбированы, и графт помогал удерживать мембрану в нужной позиции.
Фото 1. Клинический случай №1: В области 19 зуба с вестибулярной стороны визуализируется свищевой ход, при зондировании вестибулярной стенки обнаружен дефект глубиной 8 мм.
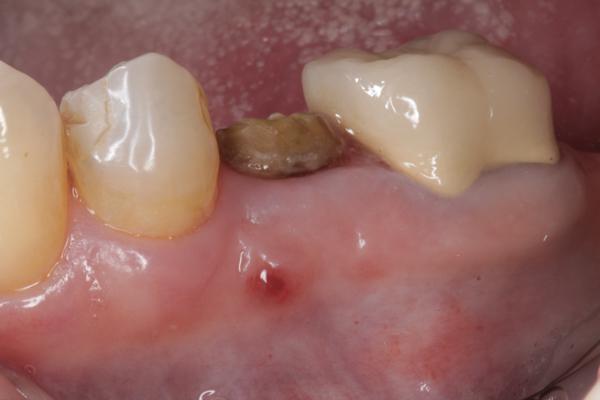
Фото 2. Сепарация лоскута со щечной стороны: визуализация дефекта вестибулярной стенки лунки.
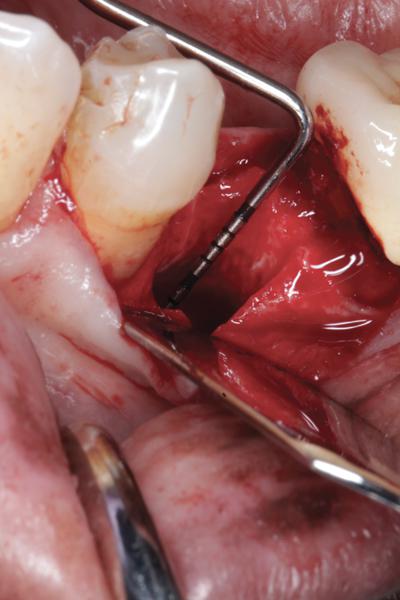
Фото 3. Cytoplast – d-PTFE-мембрана.

Фото 4. d-PTFE-мембрана установлена с язычной стороны. Следующий шаг – позиционирование мембраны под лоскут с вестибулярной стороны.
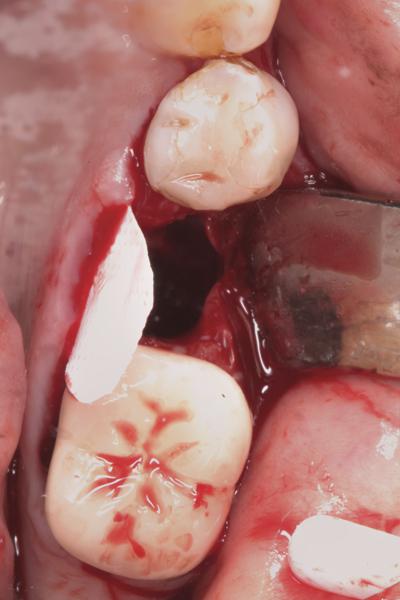
Фото 5. Костный трансплантат, установленный в область лунки.
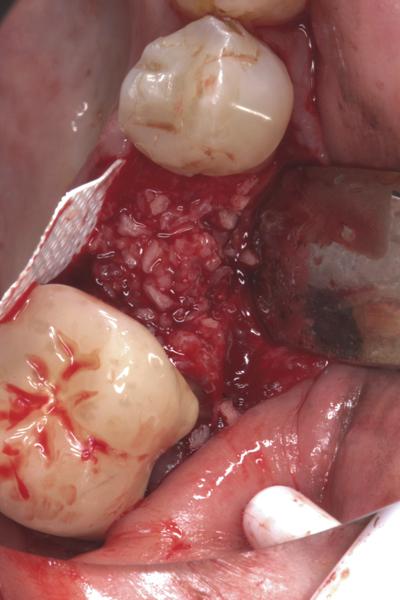
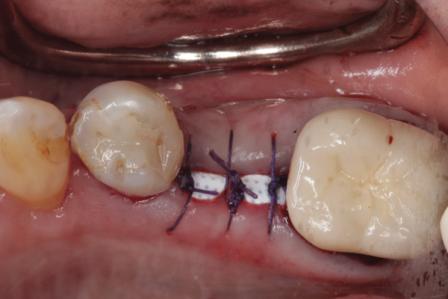
Фото 6. Ушивание раны над установленной d-PTFE-мембраной.
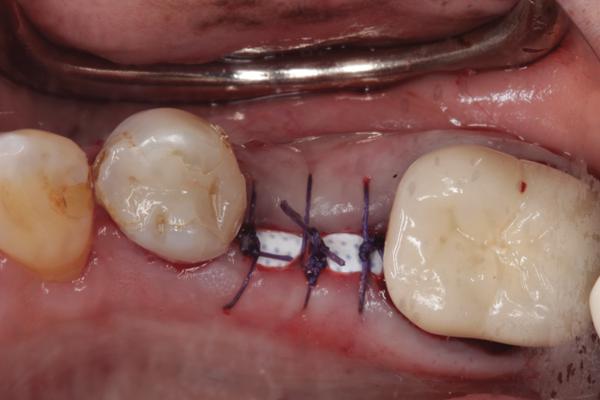
Фото 7. Через 3 недели над областью мембраны не обнаружено признаков пролиферации тканей, мягкие ткани выглядят интактными.
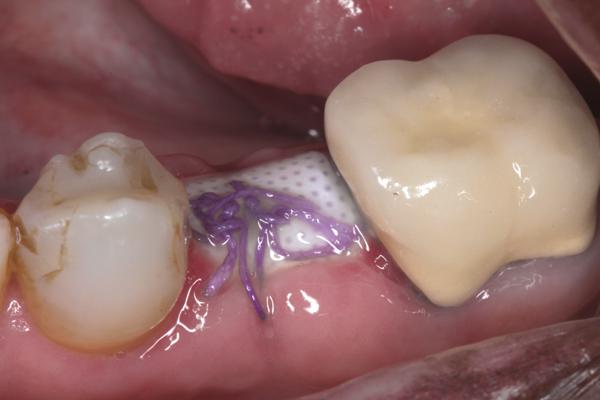
Фото 8. Через 4 недели после вмешательства мембрану удалили, под ней визуализируются ткани сформированного остеоида.
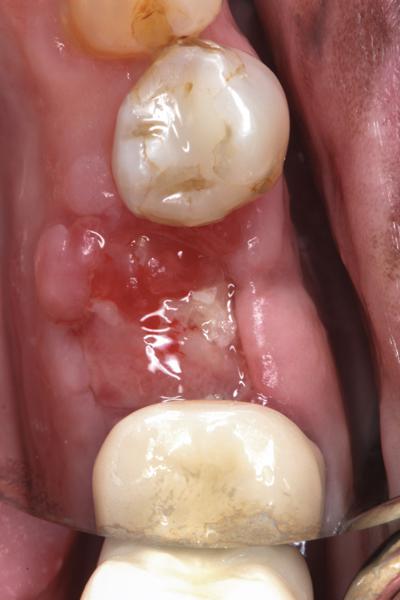
Фото 9. Вид области вмешательства через 8 недель: закрытие дефекта кератинизированной десной.
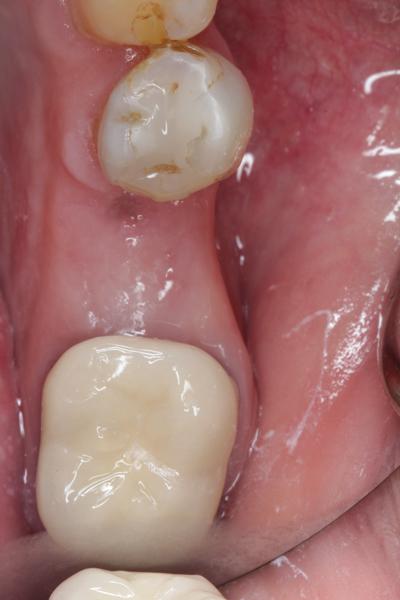
Фото 10. Сепарация лоскута через 3 месяца – восстановление щечной стенки лунки.
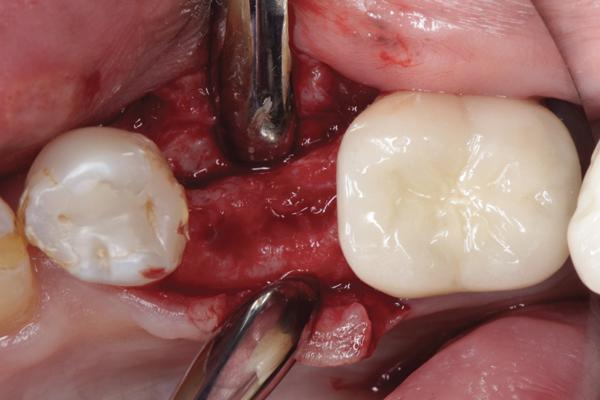
Фото 11. Установка имплантата после хирургической подготовки.
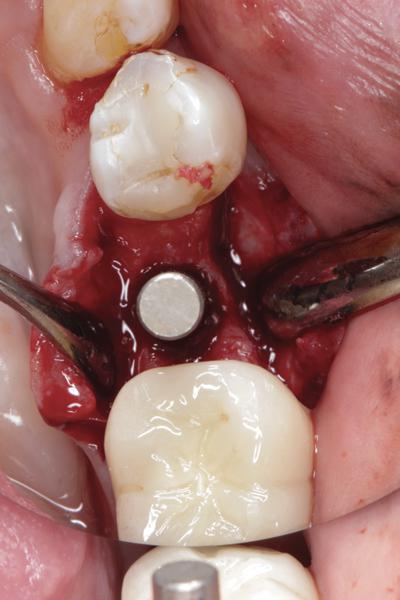
Фото 12. Клинический случай №2: экстракция 9 зуба, дигисценция костной стенки с вестибулярной стороны.
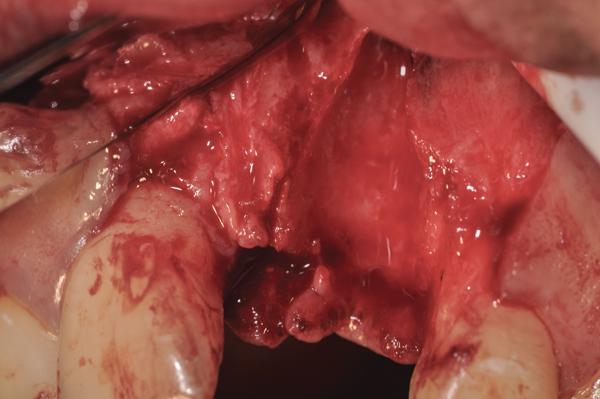
Фото 13. Вид восстановленной щечной стенки лунки (повторная сепарация лоскута через 6 месяцев, мембрану удалили через 4 недели после первичного вмешательства).
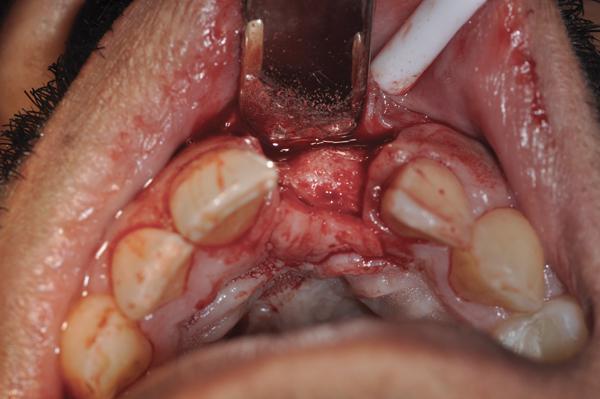
Фото 14. Установка имплантата.
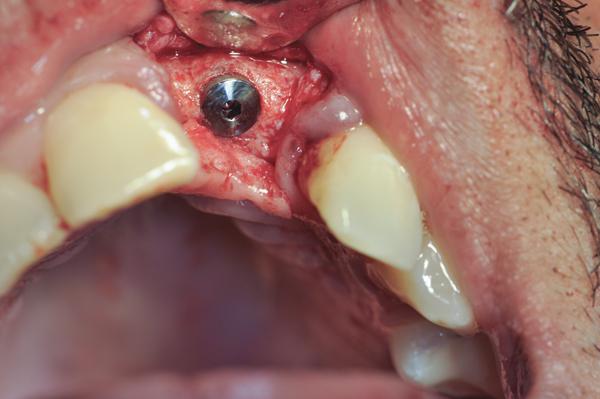
Фото 15. Рентгенограмма области 19 зуба - планирование экстракции и восстановительных манипуляций.
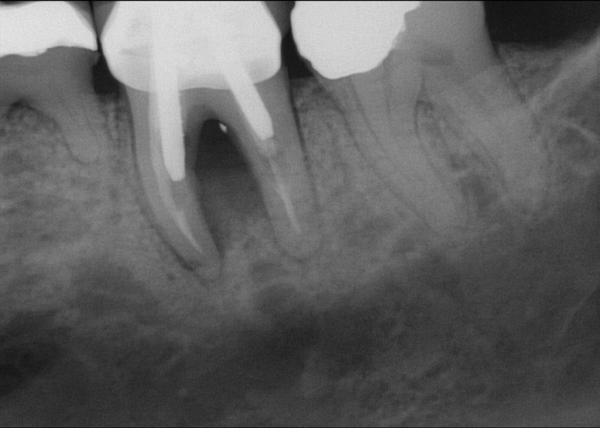
Фото 16. Рентгенограмма области 19 зуба после экстракции: отсутствие щечной и язычной стенок в области дефекта.
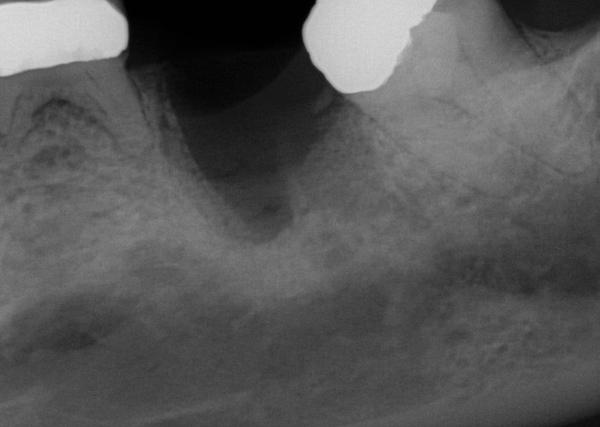
Фото 17. Костный трансплантат был установлен между резидуальными стенками лунки для предупреждения усадки и восстановления необходимой ширины гребня. Трансплантат покрыли мембраной, которую удалили через 6 недель.
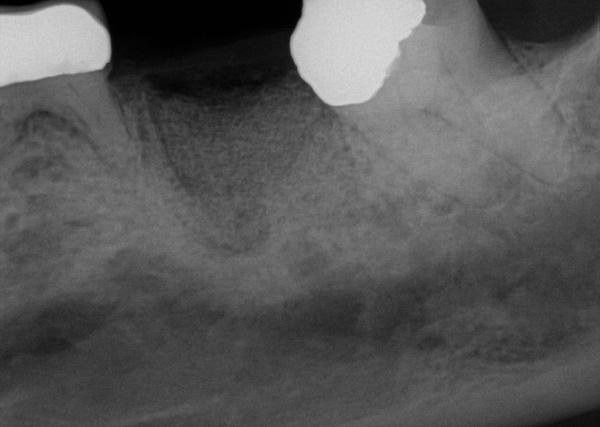
Фото 18. Визуализация костного гребня через 6 месяцев.
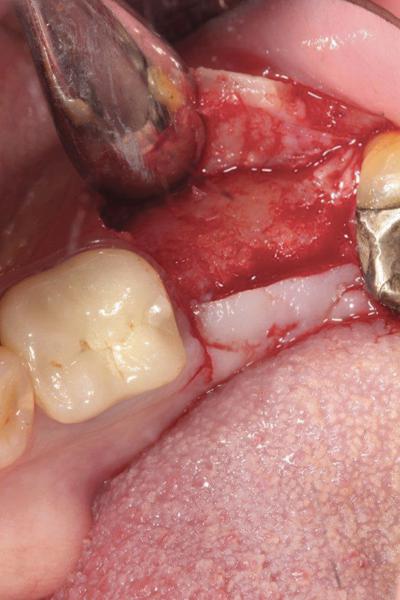
Фото 19. Установка имплантата в области реконструированного альвеолярного гребня.
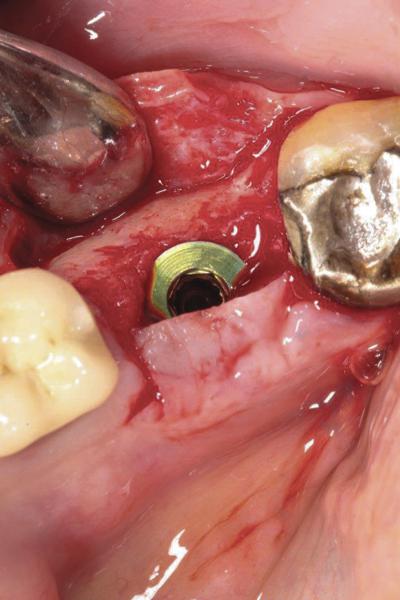
Фото 20. Клинический случай №4: рентгенограмма области 30 зуба.
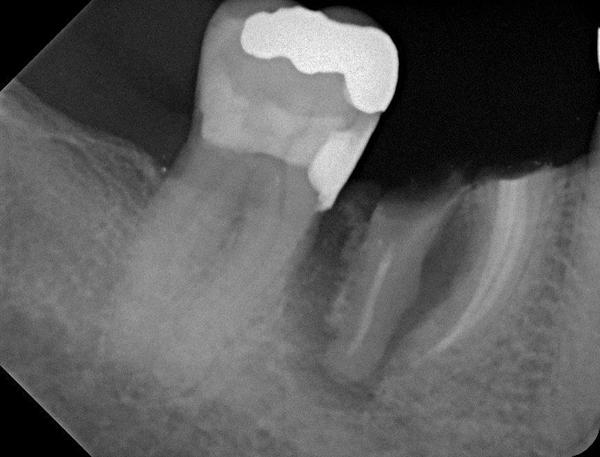
Фото 21. Рентгенограмма после экстракции зуба: щечная стенка резорбирована на 2/3 высоты.
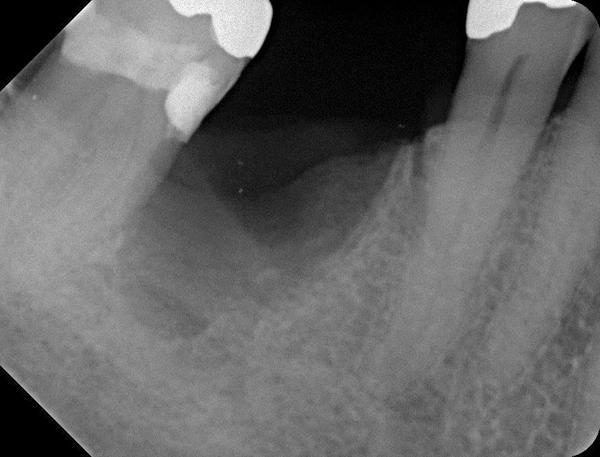
Фото 22. Костный трансплантат был установлен между резидуальными стенками лунки для предупреждения усадки и восстановления необходимой ширины гребня. Трансплантат покрыли мембраной, которую удалили через 5 недель.
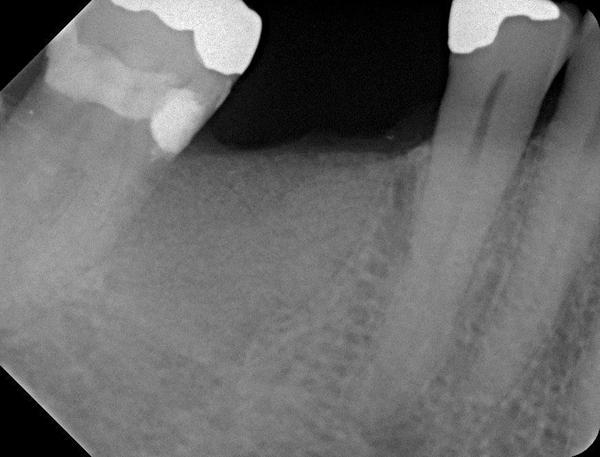
Фото 23. Установка имплантата через 6 месяцев после заживления.
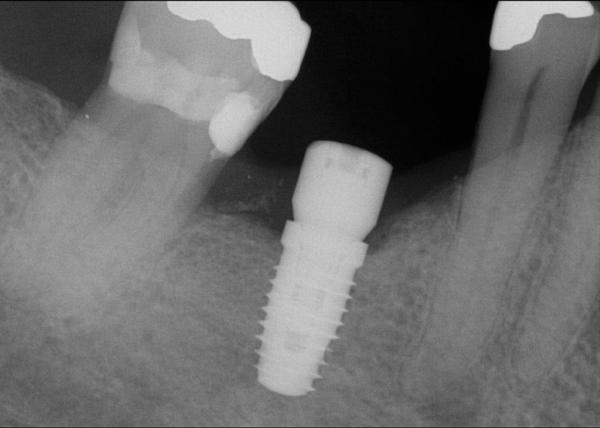
Фото 24. Результаты компьютерной томографии демонстрируют циркулярное восстановление костной ткани вокруг имплантата.
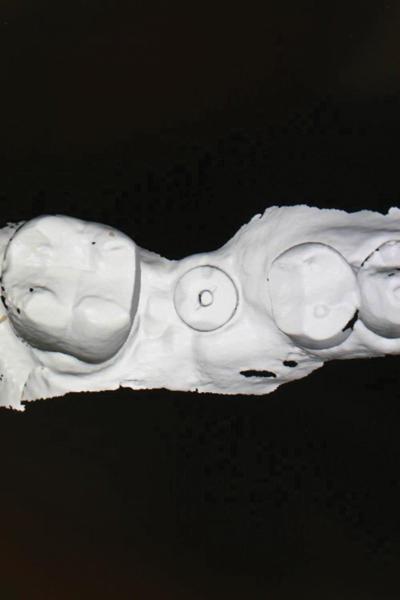
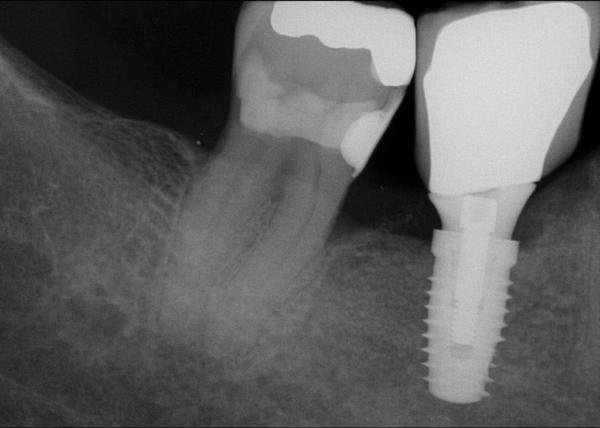
Фото 25. Рентгенограмма через 1 год после установки имплантата.
Заключение и выводы
d-PTFE мембраны имеют много преимуществ: они и биосовместимые, и аналогичны по эффективности с e-PTFE в ходе выполнения направленной регенерации тканей при дополнительном их ушывании мягкими тканями. Однако, исследований, которые могли бы сравнить эффективность использования обнаженной d-PTFE мембраны с погруженными в мягкие ткани e-PTFE мембранами пока что не проводилось. Биологические d-PTFE барьеры легко удалять через 4-6 недель после их установки. Благодаря структуре своей поверхности, эти мембраны обеспечивают клеточную адгезию, но предупреждают прорастание тканей в мембрану. Кроме того, исследования, которые были направлены на оценку эффективности барьеров d-PTFE при их непосредственном контакте с тканями и жидкостями ротовой полости, подтвердили успешные результаты с сохранением тканей альвеолярной лунки после экстракции зубов. Использование костного трансплантата в сочетании с d-PTFE является целесообразным, поскольку помогает избежать коллапса мембраны в области дефекта.
Число исследований, направленных на оценку эффективности использования d-PTFE в сочетании с костными трансплантатами при восстановлении дефектов альвеолярного гребня, довольно ограничено, однако существующие доклады подтверждают эффективность данной процедуры даже в случаях обнажения поверхности мембраны в полости рта. Весь объем восстановления костной ткани происходил в границах альвеолярной части кости челюстей, поэтому ни в одном из исследований не описан прирост костной ткани ни в горизонтальном, ни в вертикальном направлении вне этих границ. В связи с этим, целесообразно дополнительно расширять области аугментации с помощью костного трансплантата и мембраны, чтобы достичь расширения первичных горизонтальных параметров гребня (фото 18).
Мнения относительно нужного количества времени, на протяжении которого мембрана должна оставаться в области дефекта, пока что остаются довольно спорными. Тем не менее, скорее всего, что 4-недельного периода достаточно для формирования плотного остеоида, который подвергается процессу физиологической минерализации и адаптируется к размерам существующего дефекта. Логичным может казаться увеличение времени сохранения мембраны в области больших дефектов, однако это предположение относительно d-PTFE не подтверждено результатами никаких исследований. Если барьер остается на более длительный период времени, иногда после удаления мембраны приходится удалять инвагинированный эпителий с помощью алмазного бора, после чего рану обязательно надо ушить.
Несмотря на полное отсутствие рандомизированных клинических испытаний, многочисленные клинические случаи демонстрируют эффективность использования d-PTFE мембран при восстановлении лингвальной или вестибулярной стенок альвеолярной лунки. Кроме того, проведение направленной костной регенерации значительно упрощается с использованием d-PTFE мембран, минимизируя постоперационную болезненность пациента по сравнению с аналогичными процедурами, проводимыми с формированием полного лоскута для достижения закрытия раны путем первичного натяжения.
Дополнение: гистологические признаки
Недавнее исследование, проведенные Borg и Mealey, было направлено на оценку эффективности сохранения тканей лунки зуба при использовании d-PTFE в сочетании с минерализованным / деминерализованным аллотрансплантатом. При этом полученные результаты лечения сравнивались с результатами при использовании аналогичного подхода, но лишь с установкой 100% минерализованного высушенного и замороженного костного аллографта (FDBA). В ходе выполнения 42 исследований, зубы были удалены, а в области лунок устанавливали костный заменитель, который покрывали d-PTFE мембраной. Внешняя поверхность мембраны оставалась обнаженной в полости рта. Мембраны были удалены через 4 недели после размещения. После этого провели гистологические исследования области восстановления кости, которые подтвердили, что использование костного аллотрансплантата в сочетании с d-PTFE мембраной, приводит к увеличению образования витальной кости и помогает сохранить начальные параметры альвеолярного гребня, а также предупредить убыль костных тканей. В ходе исследования также было подтверждено то, что 4-недельный период является достаточным для достижения оптимальных параметров кости перед удалением мембраны. Результаты других исследований, проведенных ранее, аналогичны вышеописанным и подтверждают образование новой витальной кости под d-PTFE мембраной: Bartee достиг аналогичных результатов с использованием d-PTFE и "костной пасты," а Hoffman доказал возможность образования кости под d-PTFE биологическим барьером даже без дополнительного использования костного трансплантата.
Авторы: Gary Greenstein, DDS, MS; Joseph R. Carpentieri, DDS
Производители:
Плотный по своей консистенции политетрафторэтилен (d-PTFE) является нерезорбируемым материалом, который может использоваться в качестве барьерной мембраны в ходе выполнения процедур направленной костной регенерации или же направленной регенерации тканей. Принципами направленной костной регенерации часто пользуются при восстановлении дефектов альвеолярного гребня после проведения экстракции в качестве хирургической подготовки к последующей имплантации или параллельно с установкой имплантата при использовании протокола непосредственного вмешательства. Подобная процедура состоит из установки костного трансплантата, а поверх него – резорбируемой или нерезорбируемой мембраны, которая помогает предотвратить миграцию клеток эпителия и соединительной ткани в толщу костного трансплантата, тем самым обеспечивая адекватное заселение области вмешательства клетками-предшественниками костной ткани.

Использование d-PTFE помогает избежать некоторых потенциальных осложнений, которые могут возникнуть при использовании других типов изолирующих мембран. К примеру, как резорбируемые, так и нерезорбируемые мембраны (по типу пористого политетрафторэтилена [еxpended-PTFE]) нужно в большинстве случаев полностью покрывать мягкими тканями, так как их непосредственное взаимодействие со средой ротовой полости может иметь негативные последствия. Если резорбируемую мембрану не ушить, то под воздействием ротовой жидкости, она теряет свою первостепенную изоляционную способность уже на 7 день, и полностью резорбируется, как правило, уже через 2 недели. Этого времени недостаточно ни для репопуляции костных клеток-предшественников, ни для их дифференциации в ходе образования остеоида (соединительнотканного образования, которое предшествует формированию кости). В случаях обнажения нерезорбируемых мембран при расхождении мягких тканей повышается риск их инфицирования уже на протяжении первых 4 недель. Подобных осложнений можно избежать при использовании d-PTFE. Их не нужно дополнительно изолировать мягкими тканями, и они не резорбируются под воздействием ротовой жидкости. Кроме того, известно, что область хирургического вмешательства при изоляции с использованием d-PTFE не поддается инфицированию от 4 до 6 недель. Данные мембраны представлены на рынке под разными коммерческими названиями, например, Cytoplast [Osteogenics Biomedical], TefGen FD [Lifecore Biomedical, LLC], Symbios OsteoShield [DENTSPLY Implants]. В данной статье рассмотрено использование d-PTFE мембран (Cytoplast) в ходе проведения направленной костной регенерации, а также детально проанализировано их преимущества и недостатки, поскольку в большинстве исследованиях, описанных в литературе, использовался именно Cytoplast как представитель d-PTFE мембран. Именно поэтому в данной статье внимание будет сконцентрировано на данном брендовом материале, уже доказавшем свою эффективность.
Историческая справка
В 1976 году Melcher исследовал потенциал периодонтальной связки (PDL – periodontal ligament) как перспективного депо для продукции клеток-предшественников в ходе регенерации костных дефектов. Впоследствии Nyman с коллегами использовали Millipore-фильтр (барьер) для того, чтобы исключить миграцию эпителия и соединительных тканей в область костного дефекта, таким образом, обеспечивая его наполнение лишь клетками-предшественниками из области периодонтальной связки. Такой подход начали называть направленной регенерацией тканей, целью которого являлось восстановление кости, периодонтальной связки, а также цемента. Позже подобный принцип Dahlin апробировал при аугментации альвеолярного гребня у кролика, и такая специфическая процедура по реконструкции кости начала называться направленной костной регенерацией.
Основными принципами направленной костной регенерации являются:
- исключить проникновение эпителиальных и соединительных тканей в область хирургического вмешательства, чтобы обеспечить процесс репопуляции дефекта клетками-предшественниками костной ткани;
- создать пространство для восстановления структуры костной ткани (обеспечение достаточного объема для регенерации кости). С этой целью барьерную мембрану фиксируют с помощью или самого трансплантата или с помощью удерживающих винтов;
- изолировать кровяной сгусток, образовавшейся после вмешательства, от внешнего воздействия (стабилизация сгустка);
- обеспечить ангиогенез;
- достичь закрытия раны первичным натяжением после формирования лоскута.
Чтобы достичь первичного закрытия часто требуется сформировать послабляющие периостальные и вертикальные разрезы, чтобы избежать эффекта натяжения тканей. Если периостальный послабляющий разрез не обеспечивает достаточной мобильности лоскута, его можно углубить до подслизистого слоя. Это может спровоцировать увеличение отека, образование кровоподтеков и повышение чувства дискомфорта у пациента в послеоперационный период. Поэтому, иногда приходится отказываться от принципа закрытия раны первичным натяжением, но при этом ни в коем случае не нужно пренебрегать возможностью достижения аналогично эффективных регенеративных результатов, которых можно достичь и без первичного закрытия раны с использованием d-PTFE мембран.
Характеристики d-PTFE барьерных мембран
Впервые d-PTFE нерезорбируемые мембраны начали изготавливаться компанией Gore-Tex, после чего коммерчески доступным стал материал TefGen. TefGen считался нанопористой мембраной (n-PTFE) с крайне мелкими порами. Особенности мембран Cytoplast, которые были использованы в четырех клинических случаях, описанных в данной статье (фото 1 - фото 25), состоят в следующем: данные мембраны характеризуются 4-летним сроком службы; Cytoplast Regentex текстурирован с одной стороны (фото 3) в форме мелких шестиугольных углублений, которые увеличивают площадь поверхности мембраны до 250%. При установке мембраны блестящая гладкая сторона позиционируется в контакт с костным трансплантатом, а текстурированная часть контактирует с покрывным лоскутом (фото 6). Под лоскутом фибробласты мигрируют в области неглубоких углублений, обеспечивая, таким образом, возможности для повышенной адгезии мягких тканей. Доступные размеры мембран составляют 12 мм х 20 мм и 25 мм х 30 мм с возможной толщиной от 0,13 мм до 0,25 мм. Кроме того, существуют и другие типы данных мембран, выпускаемые производителем, как, например, армированные титаном.
Барьерные мембраны: d-PTFE против e-PTFE
Материалы, используемые при проведении направленной костной регенерации, могут иметь различные названия: мембраны; барьерные мембраны; биологические барьеры; окклюзионные мембраны; биорезорбируемые материалы (которые деградируют на протяжении своего функционирования), биоабсорбируемые материалы (которые растворяется в жидкостях организма без расщепления их полимерной цепи), и биодеградируемые (которые расщепляются за счет деградации макромолекул) мембраны; или же просто резорбируемые и нерезорбируемые мембраны. Нерезорбируемые представители разделяются на две категории: пористые, они же экспандированные (e-PTFE) и плотные (d-PTFE) мембраны из политетрафторэтилена. Материал изготовления для обеих групп аналогичен, но e-PTFE имеют более растянутую структуру: размер пор e-PTFE (коммерческое название Gore-Tex) составляет от 5 до 30 микрон (мкм), а d-PTFE (Cytoplast) – от 0,2 микрон. Что же касается сроков, в которые нужно удалять нерезорбируемые мембраны, то они колеблются от 4 до 6 недель при проведении направленной регенерации тканей, и от 6 до 9 месяцев при проведении направленной костной регенерации.
Если же говорить об эффективности использования d-PFTE по сравнению с e-PTFE при проведении направленной регенерации тканей в области костных дефектов, то исследования показали, что статистически значимых различий в отношении прироста кости нет. В данных трех клинических случаях мембраны были дополнительно покрыты ушитым лоскутом, а в качестве трансплантата использовались аллопластическая кость или ксенотрансплантат. Мембраны удаляли через 6-8 недель после установки. Однако в проведенных исследованиях не проводили сравнение эффективности использования мембран в случаях их ушивания и покрытия лоскутом и при преднамеренном частичном обнажении поверхности барьера.
Риск инфицирования
Диаметр тела патогенных бактерий, как правило, меньше 10 микрон, поэтому в случаях с e-PTFE увеличенный размер пор от 5 мкм до 30 мкм часто позволяет бактериям проникать в костные ткани прямо через мембрану. Минимальный размер пор d-PTFE – 0,2 мкм, и поэтому возможность возникновения подобного осложнения исключена. В эксперименте с Enterococcus faecalis (с размером тела от 0,5 мкм до 1 мкм), который часто можно найти среди представителей микробиоценоза ротовой полости, было отмечено, что бактерии не могут проникнуть через барьер из d-PTFE (данные взяты из Osteogenics).
Как уже было указано, при использовании e-PTFE мембран и их непосредственном контакте с полостью рта, риск их инфицирования возрастет на протяжении 4 недель, что может привести к потере части или даже всего костного трансплантата. С другой стороны, в многочисленных статьях отмечалось, что даже при обнажении d-PTFE мембран и их взаимодействии со средой полости рта, они остаются интактными от 4 до 6 недель без каких-либо признаков инфицирования области хирургического вмешательства. Жаль, но данных относительно более долгосрочной перспективы пока еще нет в широком доступе.
Закрытие раны первичным натяжением
Для достижения оптимального результата при проведении реконструкции кости с использованием e-PTFE желательно достичь первичного закрытия области вмешательства.
Это, однако, может спровоцировать возникновение сразу двух проблем:
- изменение контура мягких тканей в результате первичного натяжения;
- деформацию положения мукогингивальной границы.
Таким образом, кератинизированные ткани могут переместиться лингвально, оставляя щечную сторону дефекта покрытой лишь тонкой слизистой оболочкой. Кроме того, может произойти потеря вестибулярной глубины при формировании расширенного лоскута. Уместно напомнить, что размер сформированного лоскута прямо связан с постоперационным состоянием пациента: чем объемнее лоскут – тем больше отек, экхимозы и т.д. и тем хуже чувствует себя пациент после вмешательства. При использовании d-PTFE мембран нет необходимости в достижении первичного закрытия раны, хирургическая процедура выполняется более просто, благодаря чему можно избежать повторного вмешательства с целью удаления мембраны.
Сохранение кератинизированных тканей
В случаях, когда d-PTFE мембрана покрывает костный трансплантат в области лунки удаленного зуба без дополнительного поверхностного ушивания мягких тканей, удается сохранить прежние линейные параметры кератинизированных тканей. Если же со щечной стороны присутствует рецессия мягких тканей, а d-PTFE мембрана спозиционирована аналогично поверх лунки зуба, заполненной трансплантатом, можно достичь даже прироста объема ороговевшей десны. Когда же после экстракции не помещать мембрану в область дефекта, а сам дефект не замещать графтом, будет наблюдаться некоторый линейный прирост именно кератинизорованных тканей, однако их объем в целом при этом коллапсирует из-за частично образованного дефекта десен и дефицита кости. В связи с этим Barber с коллегами провели исследование, в котором доказали, что после удаления фронтальных зубов верхней челюсти и установки барьера из d-PTFE поверх костного заменителя, область кератинизированных десен действительно увеличилась.
Эпителизация раны над областью соединительной ткани остеоида, как правило, происходит в течение от 14 до 21 дня и осуществляется путем миграции эпителиальных клеток из поверхности слизистой, к ране со скоростью от 0,5 мм до 1 мм в сутки после 12-часового периода задержки.
Время и стоимость
При сравнении эффективности использования d-PTFE и других мембран, которые нуждаются в дополнительном покрытии мягкими тканями, последние требуют еще и достижения первичного закрытия раны, а это, в свою очередь, ведет к более продолжительному лечению и, соответственно, к более большим затратам как в период установки, так и удаления барьера.
Заживление раны
В период заживления лунки зуба образовавшийся тромб замещается грануляционной тканью (на протяжении 96 часов), которая, в свою очередь, трансформируется в соединительную ткань (в период от 21 до 28 дней). Именно эта образовавшаяся соединительная ткань, она же остеоид, является предшественником костной ткани. Остеобласты инициируют образование кости, секретируя в состав остеоида специфические морфогенетические белки. Остеоид состоит из волокон и основного вещества, представленного комплексами хондроитин сульфата и остеокальцина. Коллаген І типа составляет 90% всей структуры остеоида. В процессе организации и минерализации последнего на протяжении приблизительно 3 месяцев формируется незрелая грубоволокнистая кость. Такой тип кости является незрелым, и в ходе последующей прогрессирующей минерализации начинает формироваться уже морфологически полноценная пластинчатая кость. Этот процесс занимает приблизительно 4 месяца, но пролонгированная кальцификация продолжается еще в течение года.
Удаление мембран
Точные сроки удаления мембран остаются вопросом спорным, поскольку они зависят от продолжительности периода, необходимого для созревания остеоида в зрелую ткань. Сколько же точно времени требуется для реализации последнего процесса? К сожалению, тоже пока точно не известно. Мембраны играют защитную роль для остеоида, предотвращая проникновение других тканей в период, когда его структура недостаточно конденсирована и еще проницаема для эпителиальных или соеднительнотканных клеток, которые могут нарушить физиологическое образование кости. Первоначально некоторые исследователи предполагали, что после установки e-PTFE мембран их нужно сохранять на протяжении длительного периода времени (например, на 16 недель), чтобы обеспечить направленную регенерацию. При исследовании d-PTFE Cytoplast было доказано, что даже при обнажении мембраны и ее удалении в разный период времени (от 3 до 10 недель, от 3 до 4 недель, от 4 до 7 недель, от 4 до 6 недель, и дольше 6 недель) – все равно все результаты лечения можно было оценить как успешные. Это подтвердили в своих исследованиях Bartee (1995, 1998, 2001), изучавший ряд случаев при обнажении мембраны на протяжении 21, 21-28, 21-30 дней, Hoffman (2008), который на 276 клинических случаях доказал эффективность d-PTFE, обнаженной на протяжении 4 недель, Fotek (2009) – в 20 аналогических случаях с обнажением мембраны на протяжении в среднем на 16,6 дней, Zafiropoulous c коллегами (2010) – в 1 клиническом случае, Yun (2011) – в 2, Waasdorp и Feldman (2013) – в 3. Лучше всех эффект обнажения мембран на результат лечения изучил Barboza, который в своем докладе за 2010 год подтвердил благополучный результат ятрогенного вмешательства с использованием биологических барьеров d-PTFE на выборке из 420 клинических случаев.
Однако несколько аспектов все еще требуют дополнительного и более глубокого изучения. Например, производитель рекомендует удалять Сytoplast мембраны через 4 недели после их установки. После удаления может наблюдаться легкое кровотечение, которое спровоцировано нарушением биологической связи между мягкими тканями и d-PTFE мембраной. Однако в реальных условиях мягкие ткани не растут над поверхностью мембраны. В период от 4 до 6 недель нерезорбируемые барьеры легко удаляются даже без проведения местной анестезии, поскольку плотная поверхность мембран не позволяет волокнистым структурам врасти вовнутрь барьера. Если мембрану желательно оставить на период до 8 недель, то после ее удаления может сформироваться эпителиальный карман, образовавшийся в результате инвагинации мягких тканей по краю мембраны. Для удаления поверхностного слоя эпителия, который составляет около 0,3 толщины, некоторые авторы используют обычный алмазный бор. Стенки кармана пришлифовывают, а стенки дефекта ушивают. Последующее заживление, как правило, проходит без каких-либо осложнений.
Удаление d-PTFE мембран в период 4-6 недель негативно не отображается на процессах регенерации костной ткани, что также было продемонстрировано в представленных ниже четырех клинических случаях (фото1 - фото 25), так как остеоид в это время настолько плотный, что проникновение эпителия или соединительной ткани является физически невозможным, а поэтому не может повлиять на заживление области дефекта. Существует несколько объяснений тому, почему ранее удаление мембран негативно не влияет на процесс восстановления структуры костной ткани:
- Некоторые исследователи, базируясь на собственном опыте, предположили, что ранее удаление мембран может скомпрометировать результаты аугментации альвеолярного гребня. Однако, подобное предположение можно расценивать как ошибочное, поскольку ранее удаление биологического барьера само по себе никак непосредственно не влияет на процесс костной регенерации, а неуспешные результаты ятрогенного вмешательства в исследуемых клинических случаях можно объяснить формированием дигисценций мягких тканей и бактериальной контаминацией, что и могло обусловить необходимость раннего удаления мембраны.
- Проведенное исследование на собаках продемонстрировало, что удаление e-PTFE барьера через 4 недели привело к получению менее эффективных результатов, чем при удалении мембран через 16 недель. Но переносить данные, полученные в этом исследовании на аналогичные условия при использовании d-PTFE мембран методологически некорректно, поскольку они противоречат доказательной базе успешных результатов лечения, полученных при удалении d-PTFE барьеров через 4 недели после установки.
- Результатов исследований, которые бы последовательно аргументировали сроки, необходимые для заживления раны и формирования конденсированного остеоида, до сих пор получить пока что не удалось, поэтому невозможно обосновать конкретные сроки удаления мембран с научной точки зрения и с учетом степени минерализации остеоида.
- Факторами, которые в действительности могут повлиять на процесс заживления дефекта, являются его размер и количество времени, необходимое для созревания остеоидной ткани, при этом оба являются индивидуально специфическими.
- В ходе исследований, представленных в данной статье, все дефекты топографически находились в области границ альвеолярной кости, а манипуляции не предусматривали проведения какой-либо вертикальной аугментации гребня. Поэтому добиться восстановления кости в подобных условиях возможно и без достижения условия первичного натяжения раны и при удалении изолирующей мембраны уже через 4 недели после установки. Докладов относительно направленной регенерации кости с использованием мембран вне вышеописанных условий пока что нет.
Системный обзор литературы
Carbonell и коллеги провели системный обзор литературы, касающийся эффективности использования плотного политетрафторэтилена в ходе выполнения регенеративных процедур. Авторы обнаружили 24 статьи, касающиеся использования d-PTFE and n-PTFE мембран для восстановления дефектов костной ткани в области удаленных зубов и вокруг имплантатов. Из данного объема литературных данных две статьи были отчетами о проведении экспериментов in-vitro, семь – описанием результатов экспериментальных исследований, а 15 демонстрировали данные, полученные в ходе проведения клинических исследований. В целом, описанные клинические исследования нельзя назвать научно-достаточными или полностью доказательно аргументированными. Однако в ходе анализа данных было сформировано заключение о том, что использование n-PTFE мембран не является достаточно экспериментально подтвержденным, в то время как d-PTFE продемонстрировали перспективы своего использования при проведении процедур направленной костной регенерации и направленной регенерации тканей в ходе непосредственной установки имплантатов в лунки удаленных зубов. Кроме того, не следует ограничивать возможность использования мембран в случаях или при процедурах, в которых они ранее не были описаны в литературе. Например, в данной статье продемонстрировано эффективность d-PTFE в качестве барьера для сохранения тканей лунки зуба, а также для восстановления утерянной или дефектной вестибулярной костной стенки альвеолы, поддерживающей мягкие ткани. Ведь часто именно клиническая апробация процедуры передует научному обоснованию целесообразности ее использования, ведь как-никак, а проведение специализированных исследований все же предусматривает необходимость финансовых вложений, а дефицит финансирования в науке – проблема извечная. Фото 1-25 демонстрируют различные клинические случаи, подтвержденные рентген-снимками, в которых для регенерации костной ткани использовали именно d-PTFE мембраны и костный трансплантат Puros (Zimmer Dental), установленные в лунки зубов сразу же после их экстракции.
Данные относительно использования d-PTFE: сохранение альвеолы при условии присутствия четырех резидуальных стенок
Ряд авторов подтвердили возможность сохранения лунки зуба при использовании d-PTFE без достижения первичного закрытия раны, а Fotek и коллеги на примере 20 клинических случаев определили перспективу использования Cytoplast именно с этой целью. После экстракции в область лунки помещали деминерализованный лиофилизированный костный аллотрансплантат (demineralized freeze-dried bone allograft – DFDBA), а мембраны фиксировали с помощью небольшого сформированного лоскута на 3 мм в глубину со щечной и язычной сторон. Мембрану заправляли под сформированный лоскут, не нарушая при этом структуры мезиального или дистального сосочков. Часть мембраны все время оставалась обнаженной и находилась в непосредственном контакте со средой ротовой полости. Через 4 недели мембраны удалили. В ходе анализа результатов ученые заявили, что потеря костной ткани составляла 0,3 мм в горизонтальном направлении и 0,25 мм в вертикальном. Hoffman и коллеги аналогично занимались изучением возможности использования мембран для сохранения тканей альвеолы, однако при этом не использовали никакого костного трансплантата. Вертикальная убыль кости при этом составляла от 0,5 мм до 1 мм, а в 14% исследований убыль твердых тканей достигала даже 2 мм, что было вызвано коллапсом мембраны из-за отсутствия поддерживающей кости. Yamashita вместе с костным трансплантатом использовал также Emdogain (Straumann) или плазму, обогащенную протеинами (PRP), которые покрывали d-PTFE мембраной. В ходе исследования не было обнаружено потери костной ткани, однако структура лунки модифицировалась до 0,8 мм в диаметре.
Все вышеупомянутые результаты можно оценивать как успешные относительно предупреждения убыли кости в горизонтальном и вертикальном направлениях после экстракции зубов. В отличие от этого, в последнем систематическом обзоре литературы было указано, что через 6 месяцев после удаления зуба, которое также включало в себя сепарацию лоскута, средние показатели потери кости составляли 1,24 мм по вертикали (в диапазоне от 0,9 мм до 3,6 мм) и 3,79 мм по горизонтали (в диапазоне от 2,46 мм до 4,56 мм). Другие исследователи, использовавшие иные типы резорбируемых и нерезорбируемых мембран также обнаружили вертикальную потерю костной массы около 1 мм, и горизонтальную потерю – до 3 мм. Когда же использовали костный трансплантат и изолирующую мембрану, то горизонтальная потеря кости не превышала 1 мм, а в вертикальном направлении даже наблюдался прирост костной массы до 1,3 мм. Без сепарации лоскута, как правило, наблюдается вертикальная потеря кости, а горизонтальная убыль фактически ничтожно мала.
Особенности направленной костной регенерации в случаях частичной или полной резорбции вестибулярной стенки лунки
Биологические мембраны также можно использовать в случаях резорбции тканей вестибулярной стенки лунки и при этом оставлять часть мембраны обнаженной в полости рта. Barboza с коллегами достигли успеха в лечении 72 пациентов с помощью костного трансплантата и Cytoplast, при этом им удалось достичь именно регенерации тканей вестибулярной стенки альвеолы. В качестве трансплантата была использована лиозилифированная кость для того чтобы предупредить возможный коллапс мембраны. Биологические барьеры удаляли в период от 21 до 28 дней. Однако в ходе исследования авторы не предоставили абсолютных показателей ни изначального размера дефектов, ни прироста кости, полученного в ходе лечения, они лишь подчеркнули, что после реконструкции гребня удалось установить имплантаты во всех запланированных местах.
Hoffman использовал d-PTFE мембраны без каких-либо дополнительных костных заменителей при лечении 276 лунок удаленных зубов. 28 из них имели дефекты вестибулярной стенки, что не превышали 50% их первичных размеров. В данных областях средний прирост костной ткани составлял до 6 мм (от 4 до 8 мм). Однако в данном исследовании не было никакой контрольной группы для сравнения, поэтому сложно утверждать, насколько данная процедура действительно лучше и эффективнее лечения с использованием костных трансплантатов. Тем не менее, полученные результаты лечения с использованием мембран и без установки костного заменителя были весьма перспективны по отношению к возможной регенерации костной ткани в случаях дефектов щечной стенки лунки.
Yamashita с коллегами использовали d-PTFE мембраны для восстановления 86 постэкстракционных лунок и 45 дефектов альвеолярного гребня у 111 пациентов со средним размером дефекта до 5,5 мм. Средний прирост кости в ходе лечения достигал 5 мм, то есть 95,8% объема всех дефектов были успешно восстановлены. В сочетании с аллопластическим костным трансплантатом исследователи также использовали Emdogain и / или PRP. Поэтому установить, какой из факторов наиболее посодействовал достижению настолько эффективных результатов практически невозможно.
Все три описанные выше исследования по восстановлению дефектов альвеолярного гребня отметили позитивный результат лечения, что в итоге поспособствовало проведению процедуры установки дентальных имплантатов у пациентов группы выборки. Четыре клинические случая, описанные авторами данной статьи (фото 1-25), также демонстрируют позитивный исход восстановления дефектов щечных стенок альвеолы с использованием d-PTFE мембран и костного трансплантата (Puros).
Клинические случаи
В четырех клинических случаях, представленных на фото 1-25, лечение было проведено аналогично (детальное описание первого случая на фото 1-11). Во всех четырех случаях зубы с присутствующими патологическими изменениями были удалены, лоскуты были отсепарированы со щечной и язычной сторон, а области лунок были хирургически обработаны. Подогнанную по размерам d-PTFE мембрану Cytoplast устанавливали под щечную сторону лоскута, после чего область лунки заполняли костным трансплантатом, а мембрану фиксировали под язычную сторону лоскута. В конце манипуляции лоскуты ушивались. Костные трансплантаты использовали во всех случаях, поскольку вестибулярные стенки были резорбированы, и графт помогал удерживать мембрану в нужной позиции.
Фото 1. Клинический случай №1: В области 19 зуба с вестибулярной стороны визуализируется свищевой ход, при зондировании вестибулярной стенки обнаружен дефект глубиной 8 мм.

Фото 2. Сепарация лоскута со щечной стороны: визуализация дефекта вестибулярной стенки лунки.

Фото 3. Cytoplast – d-PTFE-мембрана.

Фото 4. d-PTFE-мембрана установлена с язычной стороны. Следующий шаг – позиционирование мембраны под лоскут с вестибулярной стороны.

Фото 5. Костный трансплантат, установленный в область лунки.

Фото 6. Ушивание раны над установленной d-PTFE-мембраной.

Фото 7. Через 3 недели над областью мембраны не обнаружено признаков пролиферации тканей, мягкие ткани выглядят интактными.

Фото 8. Через 4 недели после вмешательства мембрану удалили, под ней визуализируются ткани сформированного остеоида.

Фото 9. Вид области вмешательства через 8 недель: закрытие дефекта кератинизированной десной.

Фото 10. Сепарация лоскута через 3 месяца – восстановление щечной стенки лунки.

Фото 11. Установка имплантата после хирургической подготовки.

Фото 12. Клинический случай №2: экстракция 9 зуба, дигисценция костной стенки с вестибулярной стороны.

Фото 13. Вид восстановленной щечной стенки лунки (повторная сепарация лоскута через 6 месяцев, мембрану удалили через 4 недели после первичного вмешательства).

Фото 14. Установка имплантата.

Фото 15. Рентгенограмма области 19 зуба - планирование экстракции и восстановительных манипуляций.

Фото 16. Рентгенограмма области 19 зуба после экстракции: отсутствие щечной и язычной стенок в области дефекта.

Фото 17. Костный трансплантат был установлен между резидуальными стенками лунки для предупреждения усадки и восстановления необходимой ширины гребня. Трансплантат покрыли мембраной, которую удалили через 6 недель.

Фото 18. Визуализация костного гребня через 6 месяцев.

Фото 19. Установка имплантата в области реконструированного альвеолярного гребня.

Фото 20. Клинический случай №4: рентгенограмма области 30 зуба.

Фото 21. Рентгенограмма после экстракции зуба: щечная стенка резорбирована на 2/3 высоты.

Фото 22. Костный трансплантат был установлен между резидуальными стенками лунки для предупреждения усадки и восстановления необходимой ширины гребня. Трансплантат покрыли мембраной, которую удалили через 5 недель.

Фото 23. Установка имплантата через 6 месяцев после заживления.

Фото 24. Результаты компьютерной томографии демонстрируют циркулярное восстановление костной ткани вокруг имплантата.

Фото 25. Рентгенограмма через 1 год после установки имплантата.

Заключение и выводы
d-PTFE мембраны имеют много преимуществ: они и биосовместимые, и аналогичны по эффективности с e-PTFE в ходе выполнения направленной регенерации тканей при дополнительном их ушывании мягкими тканями. Однако, исследований, которые могли бы сравнить эффективность использования обнаженной d-PTFE мембраны с погруженными в мягкие ткани e-PTFE мембранами пока что не проводилось. Биологические d-PTFE барьеры легко удалять через 4-6 недель после их установки. Благодаря структуре своей поверхности, эти мембраны обеспечивают клеточную адгезию, но предупреждают прорастание тканей в мембрану. Кроме того, исследования, которые были направлены на оценку эффективности барьеров d-PTFE при их непосредственном контакте с тканями и жидкостями ротовой полости, подтвердили успешные результаты с сохранением тканей альвеолярной лунки после экстракции зубов. Использование костного трансплантата в сочетании с d-PTFE является целесообразным, поскольку помогает избежать коллапса мембраны в области дефекта.
Число исследований, направленных на оценку эффективности использования d-PTFE в сочетании с костными трансплантатами при восстановлении дефектов альвеолярного гребня, довольно ограничено, однако существующие доклады подтверждают эффективность данной процедуры даже в случаях обнажения поверхности мембраны в полости рта. Весь объем восстановления костной ткани происходил в границах альвеолярной части кости челюстей, поэтому ни в одном из исследований не описан прирост костной ткани ни в горизонтальном, ни в вертикальном направлении вне этих границ. В связи с этим, целесообразно дополнительно расширять области аугментации с помощью костного трансплантата и мембраны, чтобы достичь расширения первичных горизонтальных параметров гребня (фото 18).
Мнения относительно нужного количества времени, на протяжении которого мембрана должна оставаться в области дефекта, пока что остаются довольно спорными. Тем не менее, скорее всего, что 4-недельного периода достаточно для формирования плотного остеоида, который подвергается процессу физиологической минерализации и адаптируется к размерам существующего дефекта. Логичным может казаться увеличение времени сохранения мембраны в области больших дефектов, однако это предположение относительно d-PTFE не подтверждено результатами никаких исследований. Если барьер остается на более длительный период времени, иногда после удаления мембраны приходится удалять инвагинированный эпителий с помощью алмазного бора, после чего рану обязательно надо ушить.
Несмотря на полное отсутствие рандомизированных клинических испытаний, многочисленные клинические случаи демонстрируют эффективность использования d-PTFE мембран при восстановлении лингвальной или вестибулярной стенок альвеолярной лунки. Кроме того, проведение направленной костной регенерации значительно упрощается с использованием d-PTFE мембран, минимизируя постоперационную болезненность пациента по сравнению с аналогичными процедурами, проводимыми с формированием полного лоскута для достижения закрытия раны путем первичного натяжения.
Дополнение: гистологические признаки
Недавнее исследование, проведенные Borg и Mealey, было направлено на оценку эффективности сохранения тканей лунки зуба при использовании d-PTFE в сочетании с минерализованным / деминерализованным аллотрансплантатом. При этом полученные результаты лечения сравнивались с результатами при использовании аналогичного подхода, но лишь с установкой 100% минерализованного высушенного и замороженного костного аллографта (FDBA). В ходе выполнения 42 исследований, зубы были удалены, а в области лунок устанавливали костный заменитель, который покрывали d-PTFE мембраной. Внешняя поверхность мембраны оставалась обнаженной в полости рта. Мембраны были удалены через 4 недели после размещения. После этого провели гистологические исследования области восстановления кости, которые подтвердили, что использование костного аллотрансплантата в сочетании с d-PTFE мембраной, приводит к увеличению образования витальной кости и помогает сохранить начальные параметры альвеолярного гребня, а также предупредить убыль костных тканей. В ходе исследования также было подтверждено то, что 4-недельный период является достаточным для достижения оптимальных параметров кости перед удалением мембраны. Результаты других исследований, проведенных ранее, аналогичны вышеописанным и подтверждают образование новой витальной кости под d-PTFE мембраной: Bartee достиг аналогичных результатов с использованием d-PTFE и "костной пасты," а Hoffman доказал возможность образования кости под d-PTFE биологическим барьером даже без дополнительного использования костного трансплантата.
Авторы: Gary Greenstein, DDS, MS; Joseph R. Carpentieri, DDS





























































































































































0 комментариев