Общеизвестно, что электростимуляция тканей сопровождается ускорением кровотока, который, в свою очередь, вызывает явления гиперемии и повышение температуры под электродами. Активизация крово - и лимфообращения происходит так же и в более глубоких тканях межэлектродного пространства. Однако, гиперемия возникает не только в результате рефлекторных влияний электростимуляции, но и за счёт непосредственного воздействия на биологически активные вещества, образующиеся в стимулируемых тканях, например: гистамин, ацетилхолин, адреналин и другие. Активизация кровообращения под воздействием электростимуляции является фактором, обеспечивающим многие компоненты лечебного процесса: это улучшение трофики тканей, уменьшение отёка, регенерация повреждённых тканей, нормализация нарушенных функций.

Наряду с улучшением кровообращения стимулируемой области, активизируются процессы синтеза нуклеиновых кислот, в том числе РНК, которые влияют на митотическую активность стромальных клеток-предшественников костного мозга.
Применительно к стоматологической имплантации, электростимуляция, вызывая полярность установленного имплантата, приводит к скорейшей нормализации импланто-десневого соединения и к более ранним срокам наступления остеоинтеграции.
Основываясь на вышеизложенных предпосылках, нами была разработана электростимуляционная супраструктура предназначенная для повышения эффективности стоматологической имплантации.
При использовании электростимуляционных супраструктур, возникла проблема частой их смены. Это приводило к дополнительной травме самого имплантата, нарушению целостности изолятора, которым покрыт данный элемент и как следствие утечке токов, что в целом вызывало негодность электростимуляционной супраструктуры и требовало её замены.
Указанная техническая проблема послужила причиной для разработки и изготовления (в лаборатории технического отдела МНТК «Микрохирургии глаза», зав. к.т.н. Антропов Г.М.) элекростимуляционной супраструктуры, хранящей в своей основе не гальванический элемент, а индукционную катушку. Это оригинальное решение позволило проводить стимуляцию импульсным электрическим током только при воздействии внешнего источника импульсного магнитного поля. Характеристика электрических токов возникающих в катушке по всем показателям адекватна токам в электростимуляционной супраструктуре.
Для подтверждения эффективности такого решения были проведены аналогичные исследования в лаборатории стромальной регуляции иммунитета ГУ НИИЭМ им. Н.Ф. Гамалеи, (руководитель лаборатории д.м.н. профессор Чайлахян Р.К.). Для этой цели была создана экспериментальная модель воздействия локальных стимуляционных факторов, которая позволила выявить зависимость различных видов физического воздействия на развитие и пролиферативную активность остеогенных стромальных клеток-предшественников костного мозга, чтобы использовать в дальнейшем полученные данные в клинической практике при дентальной имплантации.
Электрическое воздействие на имплантат (имплантант) и вызванная этим воздействием поляризация возможна только при воздействии внешнего магнитного поля, что позволяет, в свою очередь, не менять электростимуляционную супраструктуру, содержащую внутри себя индукционную катушку, избежать травмирования имплантата, и не нарушать имеющийся изоляционный слой на формирователе десны.
Анализ данного варианта воздействия очень важен, т.к. он максимально приближен к реальным условиям использования стимуляционной супраструктуры на имплантате.
Для проведения эксперимента по синхронному воздействию импульсным магнитным полем и электрическим током был изготовлен специальный стенд, на который планировалось поместить культуральные флаконы.
В реальных условиях ВИК (высокоиндуктивная катушка) расположена в корпусе насадки и при наличии (импульсного магнитного поля) – ИМП, на ней наводится ЭДС (электродвижущая сила), за счет которой в обмотке ВИК и тканях протекает импульсный ток. Вариации величины тока определяются ЭДС, омическими сопротивлениями ВИК и окружающих тканей. При этом ток и импульс тока синхронны между собой.
Поскольку было важно определить влияние величины ЭДС и токов на эффективность колониеобразования и пролиферативную активность остеогенных стромальных клеток костного мозга, в электрическую цепь ВИК последовательно были включены омические сопротивления, варьируемые от культурального флакона к культуральному флакону.
Конструкция электродов во всех культуральных флаконах и их геометрическое размещение были одинаковы, как и в опыте при электростимуляции.
Для обеспечения тождественности условий в эксперименте при выборе направления ИМП и токов использовались реальные индукторы ИМП и ВИК, созданные специально для эксперимента.
Рис. 1. Электротехническая схема экспериментального стенда
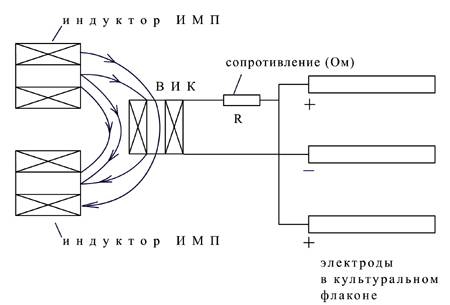
Отрицательный потенциал от ВИК был подключен к центральному электроду, а положительный – к двум боковым.
Омическое балластное сопротивление R подбиралось таким образом, чтобы средний ток в питательной среде в различных группах культуральных флаконов варьировался в следующих пределах - 10 мкА, 40 мкА и 100 мкА.
Схема постановки экспериментов по изучению воздействия электро- и магнитостимуляции на остеогенные стромальные клетки-предшественники в культурах не отличалась от постановки опытов по определению раздельного влияния этих факторов.
Флаконы с одинаковым числом эксплантированных костномозговых клеток – 3х105 (первичные культуры) и остеогенных стромальных клеток 1х105 (пассированные культуры) в зависимости от силы действующего тока были разделены на 4 группы по 3 флакона в каждой группе. Их помещали в термостат и устанавливали на стенде.
* I группа – магнитное и электрическое воздействие осуществлялось силой тока в 10 мкА.
* II группа – магнитное и электрическое воздействие осуществлялось силой тока в 40 мкА.
* III группа – магнитное и электрическое воздействие, осуществлялось током силой в 100 мкА.
* IV группа – группа была контрольной т.е., магнитная и электростимуляция в этой группе не проводилась.
Время воздействия один раз в день в течение 20 минут.
Средняя длительность импульса тока через ВИК не превышала.
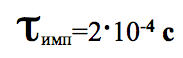
Частота повтора ИМП не более 1 Гц. Электроды полностью покрыты питательной средой, и площадь поверхности каждого не превышает S=0,8 см2 .
При этом средняя плотность тока вблизи поверхности электродов для 3-х вариантов тока, соответственно составляет:
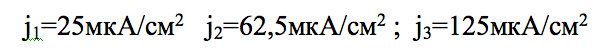
Все индукторы с ВИК располагались на одной плате на расстоянии порядка 10 мм между торцами индукторов и питательной средой. Индукция ИМП в питательной среде составляла в среднем от 100 до 150 мТл.
ВИК размещались на индукторах так, чтобы была возможность получать необходимые ЭДС и соответствующие токи через электроды.
Рис. 2. Внешний вид стенда для проведения эксперимента по сочетанному воздействию на культуру тканей

Рис. 3. Колонии стромальных клеток-предшественников костного мозга при сочетанной стимуляции токами 10 мкА
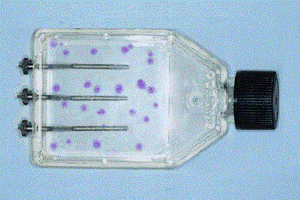
Рис. 4. Колонии стромальных клеток-предшественников костного мозга при сочетанной стимуляции токами 40 мкА
Рис. 5. Колонии стромальных п клеток-предшественников костного мозга при сочетанной стимуляции токами 100 мкА
Таблица 1. Взаимное действие электро и магнитостимуляции на эффективность колониеобразования остеогенных стромальных клеток–предшественников в культурах костного мозга invitro.
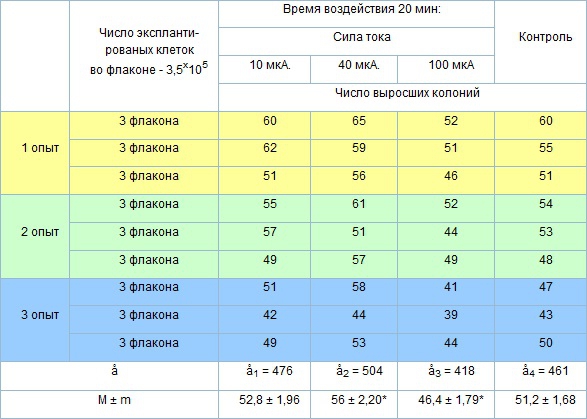
Р < 0,001 статистически достоверные различия.
Анализ данных взаимодействия электро- и магнитостимуляции представленный в таблице 1 показал, что они принципиально не отличаются от показателей полученных при электростимуляции. Эффективность колониеобразования в культурах II группы, при воздействии силой тока 40 мкА, была достоверно выше (56,0 ± 2,20) контрольных значений (51,2 ± 1,68). Небольшое повышение числа образовавшихся колоний отмечается в I группе (52,8 ± 1,96) при воздействии силой тока в 10 мкА. Режим воздействия силой тока в 100 мкА привёл к заметному уменьшению колониеобразования (46,4 ± 1,79).
Таблица 2. Взаимное действие электро и магнитостимуляции на пролиферативную активность штаммов остеогенных стромальных клеток in vitro.
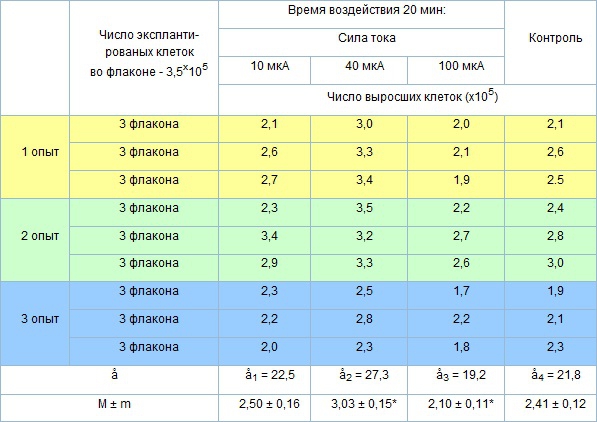
Р < 0,001 статистически достоверные различия.
Реакция пассированных остеогенных стромальных клеток при сочетанном воздействии не отличалась от результатов колониеобразования полученных на первичных культурах клеток. Сила тока в 40 мкА оказалась оптимальной для пролиферативной активности остеогенных стромальных клеток-предшественников костного мозга (3,03 ± 0,15) и была достоверно выше (Р < 0,001) роста численности клеток в контрольной группе (2,41 ± 0,12). Контрольные значения соизмеримы с данными, полученными в культурах I группы (2,50 ± 0,16) при воздействии силой тока в 10 мкА. Результаты опыта по взаимодействию электро и магнитостимуляции на культурах клеток подтвердили данные предыдущих исследований показавших, что сила тока в 100 мкА приводит к стабильному снижению как эффективности клонирования в первичных культурах, так и пролиферативной активности пассированных остеогенных стромальных клеток костного мозга (2,10 ± 0,11).
Результаты проведенных экспериментов, позволили подтвердить имеющиеся данные о целесообразности использования для стимуляции остеорепарации токов силой в пределах 40 мкА. Эти результаты нашли в последствии своё применение при проектировании и конструировании стимуляционных супраструктур с сочетанным электрическим и магнитным воздействием на ткани.
В клинической практике применение стимуляционных супраструктур с индукционной катушкой и осуществление сочетанного электро-магнитного воздействия на установленный имплантат (имплантант) применялось у целого ряда пациентов. Снаружи магнитостимуляция проводилась аппаратом «БИО-МАС», в то время как в полости рта находились стимуляционные супраструктуры с индукционными катушками внутри установленные на имплантаты. В качестве подтверждения положительного результата проведённой работы приведём клинический пример.
Рис. 6. Пациент Б. Ортопантомограмма до лечения
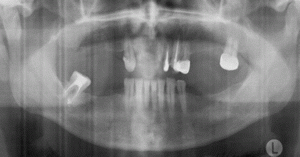
Рис. 7. Ортопантомограмма после установки имплантатов на нижней челюсти (слева с стимуляционными супраструктурами, справа со стандартными формирователями десны)
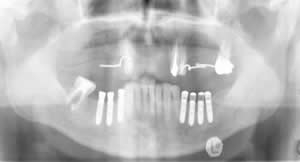
Рис. 8. Состояние в полости на 9 сутки после операции имплантации (слева стимуляционные супраструктуры)
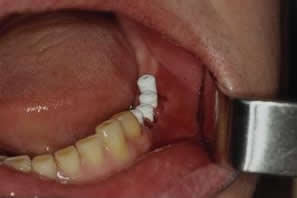
Рис. 9. Состояние в полости на 9 сутки после операции имплантации (справа стандартные формирователи десны)
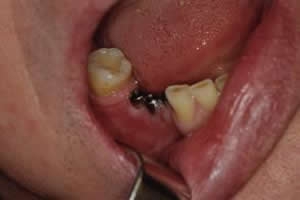
Рис. 10. Состояние в полости рта на 21 день после операции (справа стандартные формирователи десны извлечены)
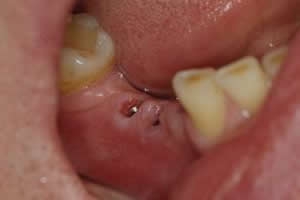
Рис. 11. Установленные стандартные формирователи десны на нижней челюсти слева на 30 сутки наблюдения. Электро- и магнитостимуляция прекращена
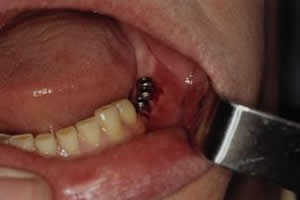
Рис. 12. Ортопаннтомограмма на 30 сутки после операции (стимуляционные супраструктуры слева извлечены и установлены стандартные формирователи десны)
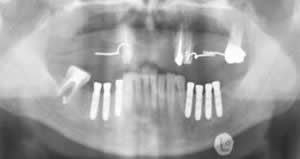
Рис. 13. Вид в полости рта после завершения этапа протезирования
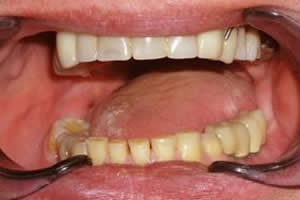
Рис. 14. Состояние в полости рта после завершения этапа протезирования
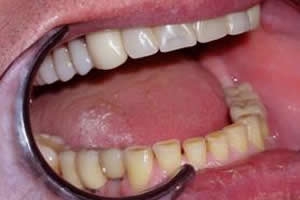
Через год, при профилактическом осмотре общее состояние пациента удовлетворительное. Жалоб нет. Конфигурация лица не изменена.
В полости рта слизистая оболочка в области находящейся ортопедической конструкции обычной окраски. Ортопедическая конструкция стабильна. Гигиеническое состояние удовлетворительное. На ортопантомограмме изменений не выявлено. Костная ткань на рентгенограмме в области установленных имплантатов однородна.
Таким образом, из проведённых исследований можно сделать следующие выводы:
* использование метода электро- и магнитой стимуляции с силой тока в 40 мкА является оптимальной для оказания эффекта электростимуляции в зоне установленного имплантата;
* использование стимуляционных супраструктур показано на любом этапе лечения после операции имплантации и ведения имплантатов двухэтапным открытым методом;
* применение сочетанного магнитного и электрического воздействия значительно облегчает течение послеоперационного состояния пациента и способствует нормализации импланто-десневого соединения, а также сокращению сроков остеоинтеграции.
Авторы: Бычков А. И., Алёшин Н. А., Антропов Г. М.
кафедра факультетской хирургической стоматологии и имплантологии МГМСУ г. Москва
Общеизвестно, что электростимуляция тканей сопровождается ускорением кровотока, который, в свою очередь, вызывает явления гиперемии и повышение температуры под электродами. Активизация крово - и лимфообращения происходит так же и в более глубоких тканях межэлектродного пространства. Однако, гиперемия возникает не только в результате рефлекторных влияний электростимуляции, но и за счёт непосредственного воздействия на биологически активные вещества, образующиеся в стимулируемых тканях, например: гистамин, ацетилхолин, адреналин и другие. Активизация кровообращения под воздействием электростимуляции является фактором, обеспечивающим многие компоненты лечебного процесса: это улучшение трофики тканей, уменьшение отёка, регенерация повреждённых тканей, нормализация нарушенных функций.

Наряду с улучшением кровообращения стимулируемой области, активизируются процессы синтеза нуклеиновых кислот, в том числе РНК, которые влияют на митотическую активность стромальных клеток-предшественников костного мозга.
Применительно к стоматологической имплантации, электростимуляция, вызывая полярность установленного имплантата, приводит к скорейшей нормализации импланто-десневого соединения и к более ранним срокам наступления остеоинтеграции.
Основываясь на вышеизложенных предпосылках, нами была разработана электростимуляционная супраструктура предназначенная для повышения эффективности стоматологической имплантации.
При использовании электростимуляционных супраструктур, возникла проблема частой их смены. Это приводило к дополнительной травме самого имплантата, нарушению целостности изолятора, которым покрыт данный элемент и как следствие утечке токов, что в целом вызывало негодность электростимуляционной супраструктуры и требовало её замены.
Указанная техническая проблема послужила причиной для разработки и изготовления (в лаборатории технического отдела МНТК «Микрохирургии глаза», зав. к.т.н. Антропов Г.М.) элекростимуляционной супраструктуры, хранящей в своей основе не гальванический элемент, а индукционную катушку. Это оригинальное решение позволило проводить стимуляцию импульсным электрическим током только при воздействии внешнего источника импульсного магнитного поля. Характеристика электрических токов возникающих в катушке по всем показателям адекватна токам в электростимуляционной супраструктуре.
Для подтверждения эффективности такого решения были проведены аналогичные исследования в лаборатории стромальной регуляции иммунитета ГУ НИИЭМ им. Н.Ф. Гамалеи, (руководитель лаборатории д.м.н. профессор Чайлахян Р.К.). Для этой цели была создана экспериментальная модель воздействия локальных стимуляционных факторов, которая позволила выявить зависимость различных видов физического воздействия на развитие и пролиферативную активность остеогенных стромальных клеток-предшественников костного мозга, чтобы использовать в дальнейшем полученные данные в клинической практике при дентальной имплантации.
Электрическое воздействие на имплантат (имплантант) и вызванная этим воздействием поляризация возможна только при воздействии внешнего магнитного поля, что позволяет, в свою очередь, не менять электростимуляционную супраструктуру, содержащую внутри себя индукционную катушку, избежать травмирования имплантата, и не нарушать имеющийся изоляционный слой на формирователе десны.
Анализ данного варианта воздействия очень важен, т.к. он максимально приближен к реальным условиям использования стимуляционной супраструктуры на имплантате.
Для проведения эксперимента по синхронному воздействию импульсным магнитным полем и электрическим током был изготовлен специальный стенд, на который планировалось поместить культуральные флаконы.
В реальных условиях ВИК (высокоиндуктивная катушка) расположена в корпусе насадки и при наличии (импульсного магнитного поля) – ИМП, на ней наводится ЭДС (электродвижущая сила), за счет которой в обмотке ВИК и тканях протекает импульсный ток. Вариации величины тока определяются ЭДС, омическими сопротивлениями ВИК и окружающих тканей. При этом ток и импульс тока синхронны между собой.
Поскольку было важно определить влияние величины ЭДС и токов на эффективность колониеобразования и пролиферативную активность остеогенных стромальных клеток костного мозга, в электрическую цепь ВИК последовательно были включены омические сопротивления, варьируемые от культурального флакона к культуральному флакону.
Конструкция электродов во всех культуральных флаконах и их геометрическое размещение были одинаковы, как и в опыте при электростимуляции.
Для обеспечения тождественности условий в эксперименте при выборе направления ИМП и токов использовались реальные индукторы ИМП и ВИК, созданные специально для эксперимента.
Рис. 1. Электротехническая схема экспериментального стенда

Отрицательный потенциал от ВИК был подключен к центральному электроду, а положительный – к двум боковым.
Омическое балластное сопротивление R подбиралось таким образом, чтобы средний ток в питательной среде в различных группах культуральных флаконов варьировался в следующих пределах - 10 мкА, 40 мкА и 100 мкА.
Схема постановки экспериментов по изучению воздействия электро- и магнитостимуляции на остеогенные стромальные клетки-предшественники в культурах не отличалась от постановки опытов по определению раздельного влияния этих факторов.
Флаконы с одинаковым числом эксплантированных костномозговых клеток – 3х105 (первичные культуры) и остеогенных стромальных клеток 1х105 (пассированные культуры) в зависимости от силы действующего тока были разделены на 4 группы по 3 флакона в каждой группе. Их помещали в термостат и устанавливали на стенде.
* I группа – магнитное и электрическое воздействие осуществлялось силой тока в 10 мкА.
* II группа – магнитное и электрическое воздействие осуществлялось силой тока в 40 мкА.
* III группа – магнитное и электрическое воздействие, осуществлялось током силой в 100 мкА.
* IV группа – группа была контрольной т.е., магнитная и электростимуляция в этой группе не проводилась.
Время воздействия один раз в день в течение 20 минут.
Средняя длительность импульса тока через ВИК не превышала.
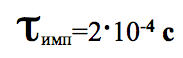
Частота повтора ИМП не более 1 Гц. Электроды полностью покрыты питательной средой, и площадь поверхности каждого не превышает S=0,8 см2 .
При этом средняя плотность тока вблизи поверхности электродов для 3-х вариантов тока, соответственно составляет:
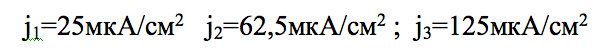
Все индукторы с ВИК располагались на одной плате на расстоянии порядка 10 мм между торцами индукторов и питательной средой. Индукция ИМП в питательной среде составляла в среднем от 100 до 150 мТл.
ВИК размещались на индукторах так, чтобы была возможность получать необходимые ЭДС и соответствующие токи через электроды.
Рис. 2. Внешний вид стенда для проведения эксперимента по сочетанному воздействию на культуру тканей

Рис. 3. Колонии стромальных клеток-предшественников костного мозга при сочетанной стимуляции токами 10 мкА

Рис. 4. Колонии стромальных клеток-предшественников костного мозга при сочетанной стимуляции токами 40 мкА

Рис. 5. Колонии стромальных п клеток-предшественников костного мозга при сочетанной стимуляции токами 100 мкА

Таблица 1. Взаимное действие электро и магнитостимуляции на эффективность колониеобразования остеогенных стромальных клеток–предшественников в культурах костного мозга invitro.

Р < 0,001 статистически достоверные различия.
Анализ данных взаимодействия электро- и магнитостимуляции представленный в таблице 1 показал, что они принципиально не отличаются от показателей полученных при электростимуляции. Эффективность колониеобразования в культурах II группы, при воздействии силой тока 40 мкА, была достоверно выше (56,0 ± 2,20) контрольных значений (51,2 ± 1,68). Небольшое повышение числа образовавшихся колоний отмечается в I группе (52,8 ± 1,96) при воздействии силой тока в 10 мкА. Режим воздействия силой тока в 100 мкА привёл к заметному уменьшению колониеобразования (46,4 ± 1,79).
Таблица 2. Взаимное действие электро и магнитостимуляции на пролиферативную активность штаммов остеогенных стромальных клеток in vitro.

Р < 0,001 статистически достоверные различия.
Реакция пассированных остеогенных стромальных клеток при сочетанном воздействии не отличалась от результатов колониеобразования полученных на первичных культурах клеток. Сила тока в 40 мкА оказалась оптимальной для пролиферативной активности остеогенных стромальных клеток-предшественников костного мозга (3,03 ± 0,15) и была достоверно выше (Р < 0,001) роста численности клеток в контрольной группе (2,41 ± 0,12). Контрольные значения соизмеримы с данными, полученными в культурах I группы (2,50 ± 0,16) при воздействии силой тока в 10 мкА. Результаты опыта по взаимодействию электро и магнитостимуляции на культурах клеток подтвердили данные предыдущих исследований показавших, что сила тока в 100 мкА приводит к стабильному снижению как эффективности клонирования в первичных культурах, так и пролиферативной активности пассированных остеогенных стромальных клеток костного мозга (2,10 ± 0,11).
Результаты проведенных экспериментов, позволили подтвердить имеющиеся данные о целесообразности использования для стимуляции остеорепарации токов силой в пределах 40 мкА. Эти результаты нашли в последствии своё применение при проектировании и конструировании стимуляционных супраструктур с сочетанным электрическим и магнитным воздействием на ткани.
В клинической практике применение стимуляционных супраструктур с индукционной катушкой и осуществление сочетанного электро-магнитного воздействия на установленный имплантат (имплантант) применялось у целого ряда пациентов. Снаружи магнитостимуляция проводилась аппаратом «БИО-МАС», в то время как в полости рта находились стимуляционные супраструктуры с индукционными катушками внутри установленные на имплантаты. В качестве подтверждения положительного результата проведённой работы приведём клинический пример.
Рис. 6. Пациент Б. Ортопантомограмма до лечения

Рис. 7. Ортопантомограмма после установки имплантатов на нижней челюсти (слева с стимуляционными супраструктурами, справа со стандартными формирователями десны)

Рис. 8. Состояние в полости на 9 сутки после операции имплантации (слева стимуляционные супраструктуры)

Рис. 9. Состояние в полости на 9 сутки после операции имплантации (справа стандартные формирователи десны)

Рис. 10. Состояние в полости рта на 21 день после операции (справа стандартные формирователи десны извлечены)

Рис. 11. Установленные стандартные формирователи десны на нижней челюсти слева на 30 сутки наблюдения. Электро- и магнитостимуляция прекращена

Рис. 12. Ортопаннтомограмма на 30 сутки после операции (стимуляционные супраструктуры слева извлечены и установлены стандартные формирователи десны)

Рис. 13. Вид в полости рта после завершения этапа протезирования

Рис. 14. Состояние в полости рта после завершения этапа протезирования

Через год, при профилактическом осмотре общее состояние пациента удовлетворительное. Жалоб нет. Конфигурация лица не изменена.
В полости рта слизистая оболочка в области находящейся ортопедической конструкции обычной окраски. Ортопедическая конструкция стабильна. Гигиеническое состояние удовлетворительное. На ортопантомограмме изменений не выявлено. Костная ткань на рентгенограмме в области установленных имплантатов однородна.
Таким образом, из проведённых исследований можно сделать следующие выводы:
* использование метода электро- и магнитой стимуляции с силой тока в 40 мкА является оптимальной для оказания эффекта электростимуляции в зоне установленного имплантата;
* использование стимуляционных супраструктур показано на любом этапе лечения после операции имплантации и ведения имплантатов двухэтапным открытым методом;
* применение сочетанного магнитного и электрического воздействия значительно облегчает течение послеоперационного состояния пациента и способствует нормализации импланто-десневого соединения, а также сокращению сроков остеоинтеграции.
Авторы: Бычков А. И., Алёшин Н. А., Антропов Г. М.
кафедра факультетской хирургической стоматологии и имплантологии МГМСУ г. Москва
































































































































































0 комментариев