Протезирование на дентальных имплантатах на сегодняшнее время является одним из наиболее предсказуемых методов лечения пациентов с симптомами адентии, особенно при топографии существующих дефектов зубного ряда в эстетически значимом фронтальном участке челюсти. По сравнению с другими клиническими подходами стоматологическое лечение с использованием имплантатов позволяет добиться не только приемлемого эстетического профиля улыбки, но и восстановления соответствующих функциональных параметров зубочелюстного аппарата в целом. Вместе с тем, нужно отметить тот факт, что у пациентов значительно возросли требования относительно именно визуальных аспектов реставраций, поэтому подход к протезированию с опорой на внутрикостные винты должен быть максимально профессиональным и точным. При этом врач-имплантолог в ходе лечения просто обязан учесть фактор стабильности мягких тканей в периимплантатной области, который играет достаточно важную роль в достижении наиболее успешного результата комплексной стоматологической реабилитации.
Другим фактором, определяющим риск возникновения рецессии мягких тканей, является щечно-небная позиция интраоссальной опоры: чем больше имплантат наклонен в вестибулярную сторону, тем больше шанс прогрессирования апикальной миграции десен в результате давления на фронтальную костную стенку. Последнее, в свою очередь, приводит к резорбции кости, после чего запускается патофизиологический механизм рецессии. Кроме того, обязательно нужно учитывать и временные параметры: для формирования окончательного уровня десен, особенно в эстетической зоне, требуется как минимум 4 недели – как раз столько нужно для ремоделирования мягких тканей. При фиксации протетических конструкций до окончания данного срока легко спровоцировать рецессию, поскольку мягкие ткани продолжают адаптироваться к новым условиям. Следовательно, для стабилизации мягких тканей показано долговременное использование именно провизорных конструкций перед фиксацией постоянных их аналогов: такой подход помогает достичь максимально полного дозревания десен, что в будущем минимизирует риск обнажения их маргинальной составляющей над областью титановых опор. Cochran и коллеги предположили, что 3 мм периимплантатной слизистой оболочки является тем необходимым минимумом, именуемым биологической шириной, которого достаточно для стабильного эпителиального прикрепления и защиты низлежащей костной ткани. Параметр биологической ширины, в конечном счете, формируется после ремоделирования твердых тканей, уровень которых, как правило, опускается на 2-3 мм апикальнее места соединения имплантата и абатмента: такого объема как раз достаточно для надлежащих эпителиального и соединительнотканного прикрепления без провоцирования альтерации со стороны зафиксированного протеза. Если этого не учесть, ремоделирование гребня будет происходить до тех пор, пока не будет достигнуто вышеупомянутого параметра в 2-3 мм. Нарушение биологической ширины может быть спровоцировано во время получения оттиска, посредством излишков цемента, или же при чрезмерно глубоком позиционировании краев протетической супраконструкции. Поэтому, даже несмотря на защитный потенциал толстого биотипа, скомпрометировать параметр биоширины достаточно просто, а бороться с результатом подобной ошибки в форме рецессии – задача весьма сложная, следовательно, лучше предупредить, нежели усложнять и без того проблематичную ситуацию.
Вопросы лечения рецессии десен вокруг имплантатов до сих пор остаются недостаточно изученными, в отличие от причин, которые широко описаны в литературе. Отдельные исследования были посвящены изучению успешности применения соединительнотканного трансплантата или же бесклеточного дермального матрикса для восстановления проблемных участков мягких тканей, и лишь в одном групповом исследовании были приведены результаты закрытия участков рецессии вокруг одиночных реставраций с опорой на титановые внутрикостные опоры. Авторы пришли к выводу, что наиболее клинически успешный результат лечения был достигнут при комбинации коронально перемещенного лоскута и соединительнотканного трансплантата, но даже при таком подходе не удалось обеспечить полного закрытия области рецессии вокруг дентальных имплантатов.
Целью текущего проспективного исследования было определение эффективности применения модифицированного хирургического подхода для лечения имплантат-ассоциированной рецессии десен через 9 месяцев после ятрогенного вмешательства.
Материалы и методы
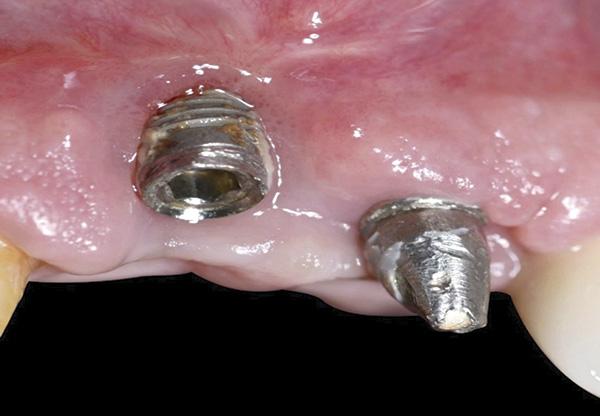
Одной из задач данного исследования было представить новый оригинальный протокол лечения рецессий 2 класса в области дентальных имплантатов. Кроме того, в ходе эксперимента был предложен новый метод регистрации и балльной оценки изменений уровня мягких тканей вокруг титановых инфраконструкций с помощью индивидуализированного акрилового шаблона. Рецессия десен с вестибулярной стороны имплантата может развиться даже через 1 год после фиксации протетических супраконструкций, особенно в случаях наличия тонкого биотипа мягких тканей (фото 1 - 2). Измерение глубины рецессии проводилось от самой глубокой точки дефекта до границы мягких тканей вокруг реставраций с опорой на имплантаты.
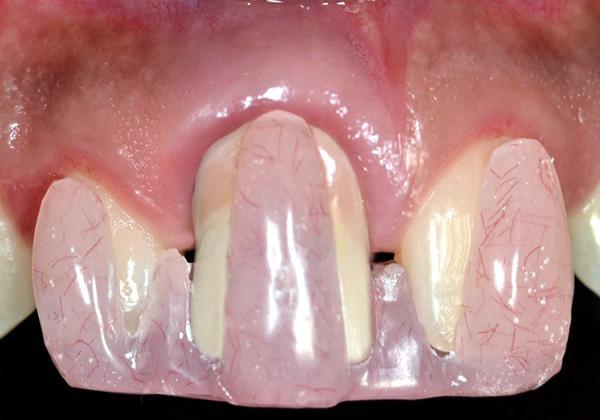
Фото 1. Клиническая фотография зафиксированных реставраций непосредственно после лечения.
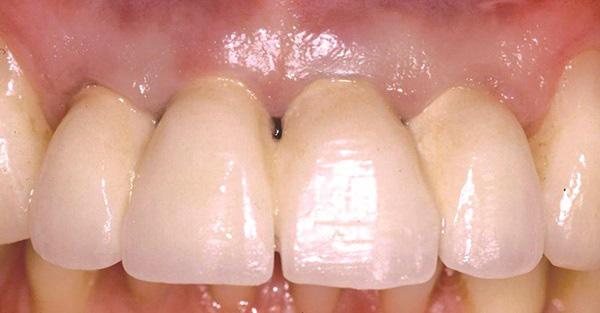
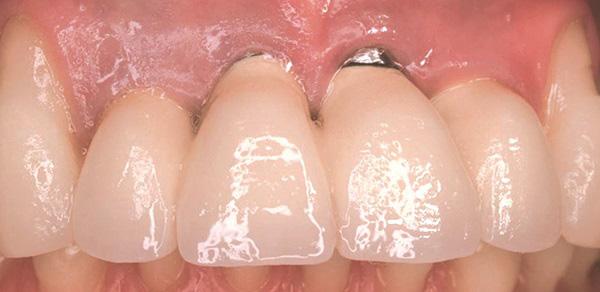
Фото 2. Вид через 1 год после лечения: апикальная миграция мягких тканей в области имплантатов по причине наличия тонкого биотипа десен.
Исследуемая группа
У десяти участников исследования (пять женщин и пять мужчин) возрастом от 24 до 63 лет был диагностирован 2 класс 2 подкласса рецессии десен вокруг реставраций с опорой на дентальные имплантаты. Набор пациентов проводился из Института имплантологического образования в Александрии, Египет. После объяснения алгоритма исследования все участники подписали форму информированного соглашения. После этого исследователями были получены их комплексные медицинские истории в соответствии с требованиями модифицированного опросника Cornell Medical Index. У большинства пациентов не наблюдалось никаких систематических заболеваний, кроме троих: у одного была диагностирована контролированная форма сахарного диабета, у второго – легкая форма гипертензии, а третий ранее уже проходил лечение по поводу язвенной болезни желудка. Степень контроля сахарного диабета определяли при помощи опросника качества жизни, трех тестов измерения уровня глюкозы с недельными интервалами, а также с помощью верификации уровня гликозилированного гемоглобина. Все пациенты, кроме одного, были некурящими. Последний был включен в группу исследования еще как некурящий, но начал курить после выполнения хирургического вмешательства. При этом уровень зубного налета у двоих пациентов достигал 1 балла, и еще у двоих – 2 баллов. Критериями исключения из исследования были курение и алкоголизм. Всем 10 пациентам было выполнено клиническое и рентгенологическое обследование (с использование конусно-лучевой компьютерной томографии), а также определено исходные значения индекса оценки зубного налета. Исходные параметры рецессии были зарегистрированы при помощи специально разработанного акрилового шаблона (фото 3 - 4). Повторная регистрация параметров рецессии проводилась через 4, 6 и 9 месяцев после хирургического вмешательства.
Фото 3. Для регистрации изменений мягких тканей использовался акриловый шаблон.
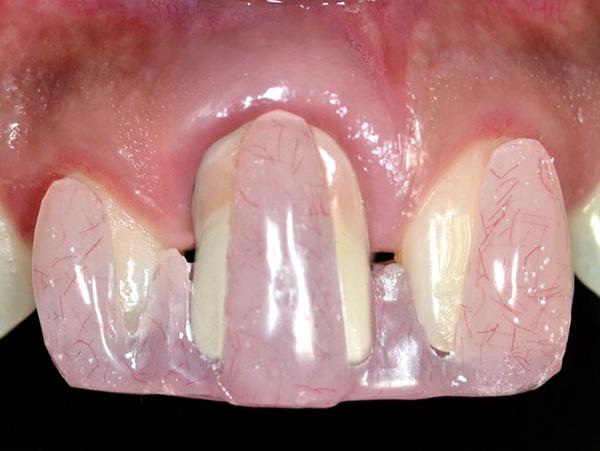
Фото 4. Акриловый шаблон помогает зарегистрировать улучшения позиции десен и миграцию уровня мягких тканей в корональном направлении.
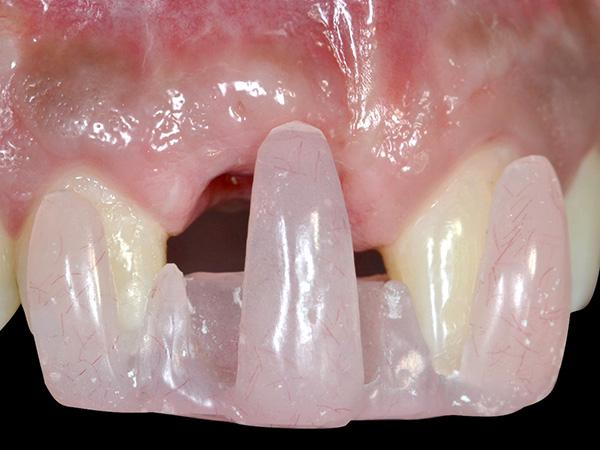
Усовершенствованный шаблон для оценки параметров рецессии
В настоящем исследовании продемонстрировано новое простое устройство, которое оптимизирует процесс мониторинга изменения уровня рецессии десен вокруг дентальных имплантатов до и после стоматологического лечения (фото 3 - 4). Устройство состоит из специально разработанного шаблона, который имеет акриловое расширение для фиксации в области режущего края зубов верхней челюсти и выступа, направляющегося в область дефекта мягких тканей. Шаблон разработан специально для регистрации имплантат-ассоциированной рецессии, поскольку он позволяет зарегистрировать начальный уровень рецессии еще до начала ятрогенного вмешательства. С другой стороны, подобный дизайн шаблона помогает определить объем необходимой коррекции мягких тканей относительно состояния здоровых десен в соседних с рецессией участках (до линии, соединяющей точки середины вестибулярного маргинального края десен по обе стороны от проблемного имплантата). Метод не лишен субъективного влияния, поскольку оценка изменений проводиться именно регистратором, который определяет объем рецессии по шкале от 0 до 2. После лечения рецессии десен, акриловый шаблон используется снова для оценки изменений, полученных после вмешательства путем сравнения уровня глубины дефекта до коррекции и после таковой.
Хирургическая процедура
В данном исследовании представлен комплексный подход лечения имплантат-ассоциированных рецессий 2 класса 2 подкласса, включающий в себя сведение (приближение) двойного сосочкового лоскута и ротацию небного субэпителиального соединительнотканного трансплантата на ножке (фото 5 - 6) с целью покрытия любого гранулированного или аутогенного костного заменителя.
Фото 5. Схематическое изображение техники апроксимизации (сближения) двойного сосочкового лоскута.
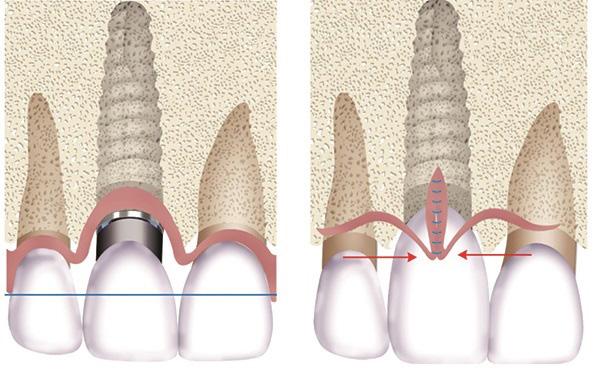
Фото 6. Формирование расширенного субэпителиального лоскута на ножке для закрытия рецессии десен 2 класса.
Все оперативные вмешательства проводились под местной анестезией с использованием 2% ксилокаина (Dentsply) с адреналином после удаления зафиксированной ранее протетической конструкции. По мнению авторов, данную манипуляцию следует выполнять в три этапа: препарирование мягких тканей, удаление старого имплантата и установка новой титановой опоры, и, наконец, проведение костной аугментации. Препарирование мягких тканей состоит из сведения (приближения) двойного сосочкового лоскута и подготовки небного соединительнотканного трансплантата на ножке. Формирование сосочкового лоскута проводили со щечной стороны десен, используя лезвие №15 для выполнения V-образного надреза, следуя контуру дефекта мягких тканей (фото 7).
Фото 7. Линия V-подобного разреза по контуру рецессии для выполнения сближения двойного сосочкового лоскута.
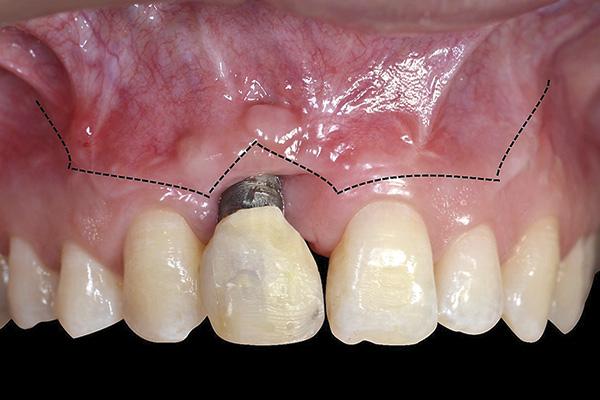
Выполнение данного разреза позволяет получить свежую раневую поверхность для дальнейшего сближения участков слизистой. Два горизонтальных разреза были выполнены с прилегающих сторон медиального и дистального межзубных сосочков в корональном направлении параллельно эмалево-цементной границе тем же лезвием, что обеспечило лучшие условия для сближения тканей. Два послабляющих надреза были сделаны в косом направлении к соседним зубам, после чего они были расширены за пределы слизистодесневой границы. Фенестрация периоста обеспечивала условия для закрытия лоскута без излишнего натяжения. V-образный разрез был затем расширен вместе со щечным лоскутом. Шовной иглой проходили через внешнюю поверхность первого сосочка, а затем продолжали шов через внутреннюю поверхность второго сосочка, чтобы достичь апроксимизации (сближения) двойного лоскута посредством шелковых узловых швов 5-0 (Hu-Friedy) (фото 8 - 9).
Фото 8. Демонстрация сближенного двойного сосочкового лоскута посредством узловых шелковых швов 6-0.
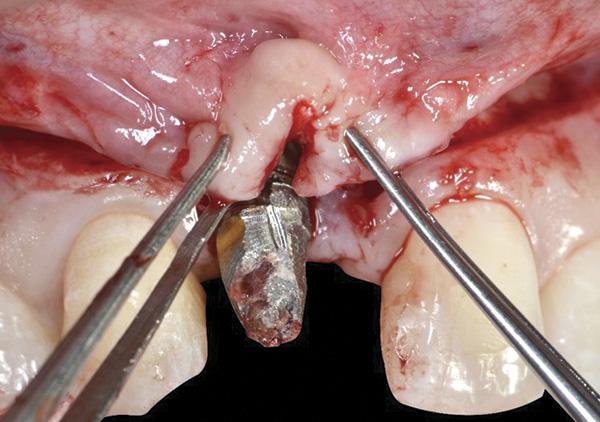
Фото 9. Двойной лоскут был ушит при помощи нитей 06.
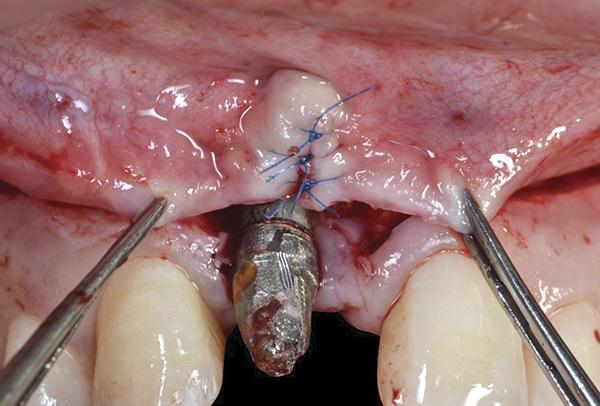
На данном этапе также выполняли сепарацию небного лоскута с целью забора субэпителиального соединительнотканного трансплантата непосредственно напротив области рецессии, который впоследствии ротировали прямо в участок дефекта мягких тканей. Небный парамаргинальный надрез от фронтального участка до области рецессии десен был выполнен согласно алгоритму, предложенного Khoury и Happe. После этого проводили рассечение слизисто-надкостничного лоскута и препарирование субэпителиального лоскута соединительной ткани на глубину от 5 мм до 8 мм. Таким же образом проводили острое рассечение субэпителиальной ткани параллельно первому разрезу для забора субэпителиального соединительнотканного трансплантата, который оставался фиксированным в переднем участке на небольшой ножке (фото 10 - 13).
Фото 10. Субэпителиальный соединительнотканный трансплантат ротировали с области неба для закрытия дефекта с вестибулярной стороны.
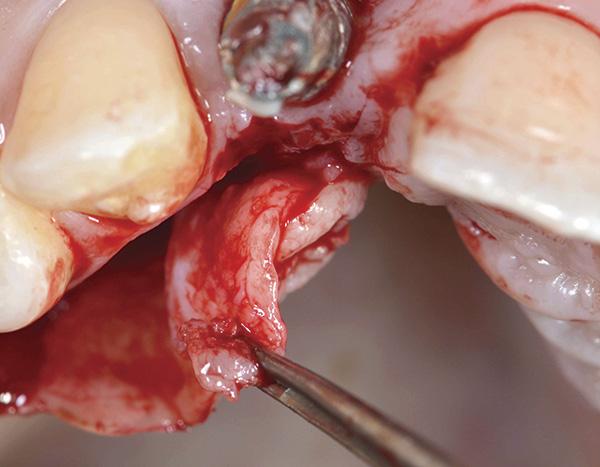
Фото 11. Монокортикальный трансплантат стабилизировали при помощи двух титановых микровинтов для закрытия костного дефекта.
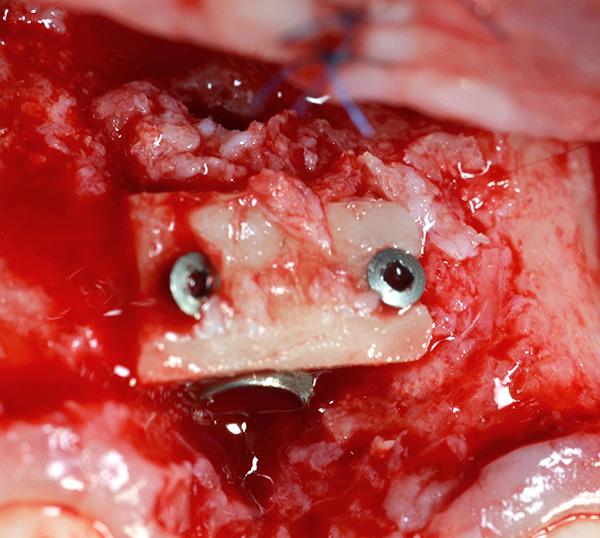
Фото 12. Фиксация мембраны с помощью двух титановых винтов для перекрытия материала трансплантата.
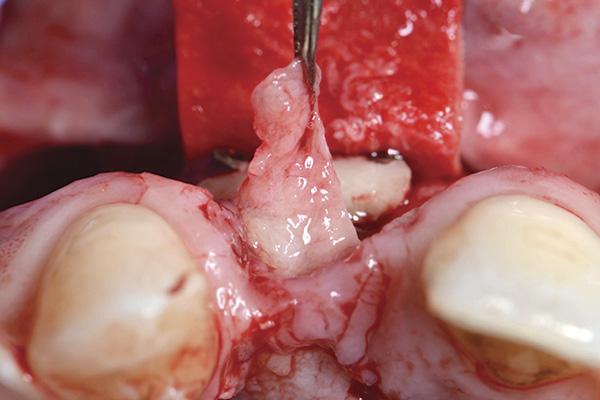
Фото 13. Соединительнотканный трансплантат ушили к коллагеновой мембране.
В представленном протоколе зафиксированные ранее реставрации были удалены вместе в окончательными абатментами. Одномоментно были установлены новые имплантаты (Laser-Lok, BioHorizons), а остаточный дефект твердых тканей заполняли смесью гранулированного костного трансплантата. Смесь костного заменителя была сформирована из аутогенных костных ошурков, полученных из области вмешательства с помощью костного скребка (Hu-Friedy) и депротеинизированного бычьего костного ксенотрансплантата (Biо-Oss, Geistlich Pharma). После аугментации область вмешательства покрывали мембраной из поли-D-L-молочной кислоты (PDLLA) (SonicWeld technology, KLS Martin), зафиксированной при помощи винтов. Палатинальный субэпителиальный трансплантат на ножке ротировали в направлении режущего края и лабиальной поверхности для одновременного покрытия как костного трансплантата, так и защитной мембраны. Трансплантат фиксировали к мембране (SonicWeld technology, KLS Martin) посредством 6-0 полиглактиновых швов Coated VICRYL Suture (Ethicon) (фото 14 - 15).
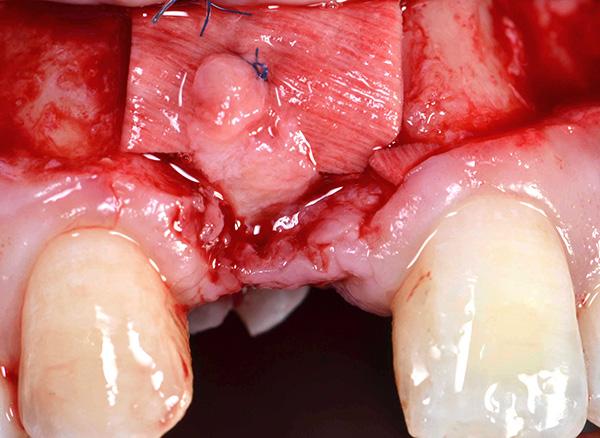
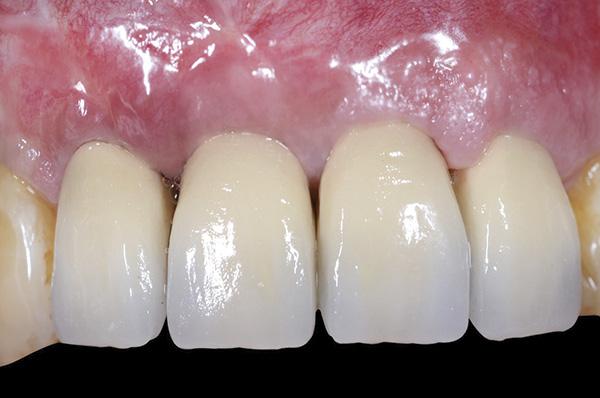
Фото 14. Вид окончательных протетических реставраций: значительное улучшение в области прежних дефектов мягких тканей.
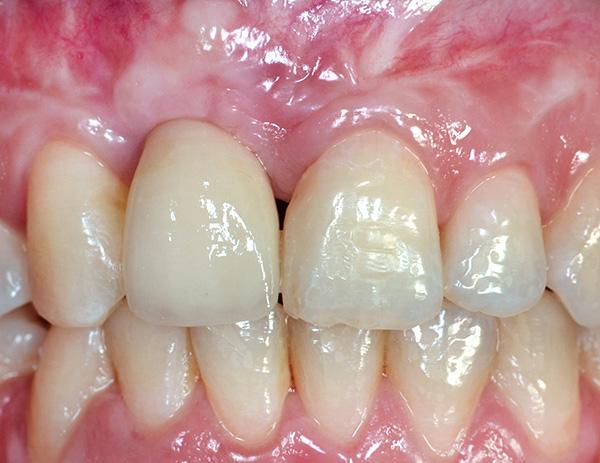
Фото 15. Миграция мягких тканей более чем на 3 мм в направлении режущего края.
Поскольку для закрытия дефекта мягких тканей использовали именно субэпителиальный трансплантат на ножке, то участок раны в области неба удалось полностью ушить 4-0 шелковыми швами (Hu-Friedy). Контрольное рентгенологическое исследование проводили с использованием КЛКТ-сканирования. Новый имплантат оставался закрытым в течение всего периода заживления, а в качестве провизорных конструкций использовали мосты типа Мэриленд (адгезивные протезы). На фото 16 изображен вид окончательной реставрации после восстановления области рецессии мягких тканей вокруг прежнего проблемного имплантата.
Фото 16. Восстановление области рецессии вокруг дентальных имплантатов.
В послеоперационном периоде пациентам рекомендовалось проводить аккуратную чистку ротовой полости вблизи области оперативного вмешательства. Участок непосредственной аугментации было рекомендовано вообще не чистить при помощи щетки на протяжении 3 недель, и ограничится лишь полосканиями 0,12% раствором хлоргексидина (Antiseptol, Kahira Pharmaceuticals, kahira-pharma.com) два раза в день в течение 1 недели. С целью предупреждения постоперативного инфицирования пациентам также был предписан прием амоксициллина (500 мг) (E-mox 500 мг в капсулах, Egyptian Int. Pharmaceutical Industrial Co., A.R.E) три раза в день в течение последующих 5 дней после операции.
Статистический анализ
Анализ данных клинических параметров и их изменений у пациентов проводили с использованием точного критерия Фишера, метода Монте-Карло и повторных калькуляций посредством ANOVA. Все данные были обработаны с помощью компьютеризированного статистического пакета программного обеспечения IBM SPSS Statistics версии 20 для Windows.
Результаты
Контрольный осмотр всех пролеченных пациентов проводился через 4, 6 и 9 месяцев после хирургической коррекции рецессий. Глубина рецессии у 10 пациентов до начала лечения составляла 1,5; 2,5; 2,0; 1,0; 1,5; 1,3; 1,8; 2,5; 2,5; 2,0 мм соответственно, через 4 месяца прирост мягких тканей составлял 1,3; 2,5; 1,8; 1,0; 1,2; 1,2; 1,57; 2,0; 0,00; -0,10 мм соответственно. В период 6 месяцев незначительные изменения уровня десен были отмечены лишь у половины пациентов, колеблясь в диапазоне 0,05-0,2 мм. Прирост уровня десен на последнем контрольном визите через 9 месяцев составлял уже 1,4; 2,30; 1,80; 1,00; 1,00; 1,25; 1,57; 1,80; 0,00; -0,20 мм.
Таким образом, средний исходный показатель глубины рецессии составлял 1,9 мм ± 0,5 мм, при этом в ходе повторного осмотра через 4 месяца после лечения он снизился до 0,6 мм ± 0,9 мм (р < 0,05). Через 6 и 9 месяцев после вмешательства средняя глубина дефекта мягких тканей не превышала 0,7 мм ± 0,9 мм, что также было статистически значимой разницей по сравнению с исходными клиническими параметрами (р <0,05). При сравнении параметров десневой рецессии через 4, 6 и 9 месяцев после хирургического лечения никаких статистически значимых различий обнаружено не было. Полученные результаты свидетельствуют о том, что после операционного вмешательства была достигнута клиническая стабильность полученного уровня мягких тканей, которая значительно не изменялась на протяжении всего периода наблюдения.
В ходе контрольных визитов через 9 месяцев у всех пациентов, за исключением двух, были зарегистрированы улучшенные параметры восстановления мягкотканого покрытия вокруг дентальных имплантатов. Из двух пациентов мужского пола, у которых не удалось добиться адекватной коррекции дефектов десен, один был курильщиком, а у другого был отмечен весьма высокий показатель индекса зубного налета, который достигал 2 баллов, при этом у обоих не было отмечено никаких соматических заболеваний. Таким образом, в конце проведенного исследования удалось добиться восстановления области рецессии у 80% пациентов, (при этом у двоих из них уровень зубного налета достигал 1 балла, а у троих имелись соматические заболевания – диабет, гипертония, язвенная болезнь).
Обсуждение
Долгосрочные клинические исследования доказали, что функциональная остеоинтеграция дентальных имплантатов является достаточно прогнозированным процессом при установке титановых инфраконструкций в области имеющихся дефектов зубного ряда. Однако в конце проведенного лечения с помощью имплантатов пациенты надеются получить не только функционально приемлемый, но и эстетически успешный результат, чем можно объяснить растущий интерес ученых и клиницистов относительно изучения динамики изменений мягких тканей вокруг остеоинтегрированных титановых опор. И хотя успешность конструкции имплантата измеряется именно достижением остеоинтеграции, а успешность протетической реставрации – ее функциональностью, эстетический аспект лечения становиться все более важным и проблемным с точки зрения удовлетворения ожиданий пациента относительно визуального профиля улыбки. Поскольку, несмотря на значительное количество исследований, прогнозированная позиция десен вокруг дентальных имплантатов установленных во фронтальном участке остается своеобразной дилеммой для всей лечащей команды, то комплексное решение данной проблемы состоит в контроле всех возможных факторов риска, влияющих на позицию мягких тканей. С другой стороны, мягкотканые трансплантаты успешно используются в лечении пародонтальных поражений на протяжении уже многих лет, обеспечивая закрытие обнаженных участков корня и соответствующую реконструкцию альвеолярного гребня. И хотя техника двойной апроксимизации (сближения) сосочков является технически чувствительной, но она обеспечивает достаточно хорошие результаты восстановления участков изолированной рецессии. Данная техника используется в тех случаях, когда одних смежных или апикально размещенных мягких тканей недостаточно для выполнения мягкотканой реконструкции. Метод использования частичного двойного сосочкового трансплантата на ножке был впервые предложен Cohen and Ross, которые сообщили о более чем 85% успешности при закрытии обнаженной поверхности корня. Nelson предложил подход, который сочетает в себе комбинированное использование свободного соединительнотканного трансплантата с двойным сосочковым лоскутом. Такой метод аугментации целесообразно использовать в случаях, в которых достижение соответствующего эстетического результата является приоритетным, а цветовое соответствие мягких тканей критическим для достижение успешной реабилитации.
Также в ходе исследований было подтверждено, что использование трансплантата на ножке является более прогнозированным, чем использование свободного лоскута, что аргументировано возможностью адекватного кровоснабжения области ятрогенного вмешательства. Burkhardt и коллеги пришли к выводу, что комбинированное использование субэпителиального трансплантата в сочетании с коронально перемещенным лоскутом способствует лучшему восстановлению имплантат-ассоциированных рецессий, однако даже при таком подходе добиться полного восстановления дефекта практически невозможно: непосредственно после операции возобновление уровня покрытия достигало почти 100%, но уже через месяц данный показатель снижался до 75%, а через 3 и 5 месяцев – до 70% и 66%, соответственно. С другой стороны, Zucchelli и коллеги сообщили, что восстановление мягкотканого покрытия в области рецессий на 96,3-100% через год после вмешательства было зарегистрировано в 75% клинических случаев. Вероятно, подобного результата удалось добиться за счет удаления имеющихся коронок за месяц до аугментации с последующей модификацией и полировкой зафиксированных абатментов. Кроме того, исследователи удаляли заново изготовленные временные коронки непосредственно в момент проведения оперативного вмешательства. В результате подобных манипуляций для мягкотканого трансплантата удалось воссоздать больше места в области интерфейса имплантат-абатмент, а также адаптировать поверхность абатмента надлежащим образом для улучшенного контакта с участком десен. Cosyn и коллеги, в свою очередь, представили годовые результаты успешности 22 имплантатов, установленных по немедленному протоколу. В двух клинических случаях через 3 месяца после установки были зарегистрированы глубокие рецессии величиной от 1,5 мм до 2,0 мм, коррекция которых проводилась посредством соединительнотканного трансплантата. Величина дефекта мягких тканей через год после аугментации не превышала 0,5 мм в обоих случаях.
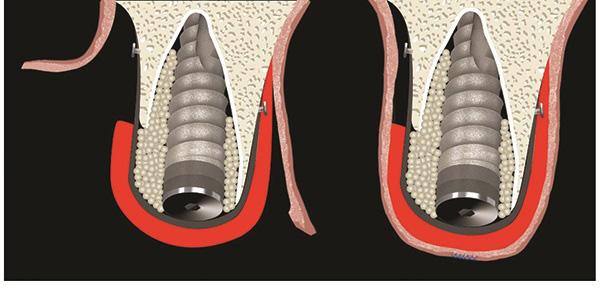
Однако хоть субэпителиальные трансплантаты и могут улучшить вид щечного профиля десен, но спрогнозировать изменения уровня маргинального края мягких тканей довольно сложно. Трансплантаты на ножке являются отличным терапевтическим выходом для вертикальной и вестибулярной аугментации, а также обеспечивают улучшение эстетически скомпрометированных участков в области дентальных имплантатов. Khoury и Happe доказали, что, в случаях с непосредственно установленными имплантатами, небные субэпителиальные соединительнотканные лоскуты на ножке являются более предпочтительными, чем другие варианты аугментации, но и такие лучше комбинировать с дополнительной реконструкцией костной ткани. Ножка является дополнительным слоем для покрытия подсаженного костного заменителя и / или мембраны, а также обеспечивает подстилку для сближения двойного сосочкового лоскута. Кроме того, важное значение играет также первичная фиксация трансплантата к операционному ложу, и условия для адекватной реваскуляризации с рецепиентного участка. Результаты, полученные в ходе нашего исследования, подтверждают данные, полученные в более ранних клинических экспериментах. Несмотря на множество методов мягкотканной аугментации, следует помнить и об обеспечении адекватной костной поддержки в периимплантатной области. Результаты исследований последних двух десятилетий помогли прийти к выводу, что комбинация принципов направленной костной регенерации вместе с использованием аллогенных и ксеногенных костных заменителей способствует восстановлению периимплантатных дефектов. Биорезорбируемые мембраны состоят из твердой мозговой оболочки, поли-L-молочной кислоты, полигликолевой кислоты, полиуретана, и коллагена, что помогает, в свою очередь, избежать необходимости выполнения повторной процедуры их изъятия, поскольку они полностью деградируют в тканях. В недавнем систематическом обзоре, Khojasteh и коллеги, критически оценили имеющиеся доказательства относительно эффективности использования барьерных мембран для наращивания костной ткани. Согласно данным мета-анализа, барьерные мембраны обладают преимуществами при восстановлении вертикальных дефектов кости в периимплантатной области, но для обеспечения подобного эффекта обязательно нужно достичь стабильности изолирующих конструкций. При нестабильности мембран, согласно данных Adeyemo, наблюдается наоборот прогрессирование резорбтивных процессов костной ткани.
В своем обзоре относительно использования барьерных мембран при немедленной установке имплантатов El Helow и El Askary утверждают, что принятие решения о том, покрывать или не покрывать костные заменители зависит от конкретных клинических условий. Большинство костных дефектов по своей сути являются трехмерными, в то время как мембрана является двухмерной структурой. Адаптация мембраны к параметрам дефекта – процесс довольно времязатратный, требующий от той же мембраны определенной механической памяти. Следовательно, использование костного наполнителя помогает не только возобновить дефект, но и сопутствует улучшенной стабилизации биологического барьера. В ходе численных исследований было также доказано, что комбинированное использование мембраны и костного трансплантата гораздо лучше, чем отдельное применение каждого из данных элементов. В ходе восстановления рецессии нашим пациентам были установлены резорбируемые мембраны типа PDLLA, характеризирующиеся биосовместимостью и простотой использования без необходимости последующего их изъятия. В литературе описано несколько подходов костной аугментации с использованием мембран при немедленной установке имплантатов, в том числе и посредством деминерализованного или минерализованного лиофилизированного костного аллотрансплантата, депротеинизированного гранулированного костного заменителя, резорбируемого гидроксиапатита, аутогенных костных опилок, биологически активного стекла, а также с помощью пористого минерального ксенографта. Но из всех модификаций использование аутогенных трансплантатов обеспечивает наиболее перспективные результаты восстановления соответствующего количества и качества костной ткани. El Askary и Pipco, например, утверждают, что использование аутогенной кости является наиболее предпочтительным в ситуациях с обширной потерей твердых тканей.
В нашем исследовании для восстановления периимплантатных дефектов мы использовали смесь гранулированной аутогенной кости и пористой минеральной матрицы костного ксенотрансплантата (Bio-Oss). Еще одна особенность предложенной нами новой хирургической техники заключается в более корональном размещении двойного сосочкового лоскута на ножке, что позволяет достичь большей мобильности для закрытия дефекта мягких тканей. Это, в свою очередь, может позитивно повлиять на восстановление мягкотканного покрытия вокруг установленного трансплантата и изолирующей мембраны. Кроме того, очевидно, что покрытие ножки самого трансплантата также способствует достижению более эстетических результатов.
Хотя отбор пациентов в данном исследовании не был достаточно строгим (с учетом того, что в группу исследования были включены пациенты с диабетом, легкой формой гипертензии и язвой желудка), полученные результаты свидетельствуют о том, что соматические патологии никак не повлияли на успешность стоматлогической реабилитации. Единственными, у кого не удалось достичь приемлемого результата лечения являлись пациент-курильщик и пациент с высоким индексом зубного налета. Для объективной оценки восстановления участков рецессии требовалось сравнить параметры дефектов до начала и после соответствующего лечения. Cabello и коллеги изучали изменения мягких тканей после немедленной установки имплантатов. В своем исследовании они использовали жесткий акриловый шаблон, перекрывающий режущий край смежных зубов с тремя опорными углублениями, соответствующими уровням мезиального и дистального межзубных сосочков, а также положению десневого зенита. Электронный калибратор был использован для измерения расстояний с округлением до десятых долей миллиметра. Более простой способ регистрации изменений уровня мягких тканей описан в данной статье. После коррекции рецессий акриловый шаблон устанавливали повторно, одновременно сравнивая разницу позиции десен до и после вмешательства. Разработанный метод является адаптированным для изучения изменений мягких тканей в области имплантат-ассоциированных рецессий до и после коррекции таковых.
Выводы
Определение фенотипа мягких тканей, как и причины возникновения имплантат-ассоциированных рецессий является ключевым аспектом планирования будущего ятрогенного вмешательства. Для достижения максимального клинического успеха авторы рекомендуют использовать обычный субэпителиальный соединительнотканный трансплантат во время повторной имплантации, что помогает значительно увеличить объем мягких тканей с вестибулярной стороны установленных титановых инфраконструкций. Кроме того, данный подход позволяет использовать долгосрочную временную реставрацию на протяжении 3 месяцев, как и имплантаты с функцией переключения платформы, что, в свою очередь, обеспечивает условия для восстановления как минимум 3 мм ширины кератинизированных десен. Однако коррекция лишь мягких тканей не обеспечивает долгосрочного прогнозированного результата, а повторные хирургические вмешательства на деснах сопутствуют возникновению рубцов в области сформированных лоскутов. Именно поэтому авторы статьи предпочли комплексный подход с проведением дополнительной одновременной аугментации костной ткани, что также помогает свести к минимуму количество необходимых ятрогенных вмешательств в будущем. Дальнейшие перспективы исследований состоят в апробации предложенной методики на более численной выборке пациентов, чтобы подтвердить результаты, полученные в нашем исследовании. Предложенный хирургический подход является новой перспективной стратегией для лечения имплантат-ассоциированной рецессии десен, демонстрирующей успешные клинические исходы восстановления дефектов мягких тканей.
Авторы:
Abd El Salam El Askary, BDS
Noha A. Ghallab, MD
Shuh-Chern Tan, BDS
Paul S. Rosen, DMD, MS
Ahmad Shawkat, BDS, MS, PhD
Производители:
Протезирование на дентальных имплантатах на сегодняшнее время является одним из наиболее предсказуемых методов лечения пациентов с симптомами адентии, особенно при топографии существующих дефектов зубного ряда в эстетически значимом фронтальном участке челюсти. По сравнению с другими клиническими подходами стоматологическое лечение с использованием имплантатов позволяет добиться не только приемлемого эстетического профиля улыбки, но и восстановления соответствующих функциональных параметров зубочелюстного аппарата в целом. Вместе с тем, нужно отметить тот факт, что у пациентов значительно возросли требования относительно именно визуальных аспектов реставраций, поэтому подход к протезированию с опорой на внутрикостные винты должен быть максимально профессиональным и точным. При этом врач-имплантолог в ходе лечения просто обязан учесть фактор стабильности мягких тканей в периимплантатной области, который играет достаточно важную роль в достижении наиболее успешного результата комплексной стоматологической реабилитации.

Другим фактором, определяющим риск возникновения рецессии мягких тканей, является щечно-небная позиция интраоссальной опоры: чем больше имплантат наклонен в вестибулярную сторону, тем больше шанс прогрессирования апикальной миграции десен в результате давления на фронтальную костную стенку. Последнее, в свою очередь, приводит к резорбции кости, после чего запускается патофизиологический механизм рецессии. Кроме того, обязательно нужно учитывать и временные параметры: для формирования окончательного уровня десен, особенно в эстетической зоне, требуется как минимум 4 недели – как раз столько нужно для ремоделирования мягких тканей. При фиксации протетических конструкций до окончания данного срока легко спровоцировать рецессию, поскольку мягкие ткани продолжают адаптироваться к новым условиям. Следовательно, для стабилизации мягких тканей показано долговременное использование именно провизорных конструкций перед фиксацией постоянных их аналогов: такой подход помогает достичь максимально полного дозревания десен, что в будущем минимизирует риск обнажения их маргинальной составляющей над областью титановых опор. Cochran и коллеги предположили, что 3 мм периимплантатной слизистой оболочки является тем необходимым минимумом, именуемым биологической шириной, которого достаточно для стабильного эпителиального прикрепления и защиты низлежащей костной ткани. Параметр биологической ширины, в конечном счете, формируется после ремоделирования твердых тканей, уровень которых, как правило, опускается на 2-3 мм апикальнее места соединения имплантата и абатмента: такого объема как раз достаточно для надлежащих эпителиального и соединительнотканного прикрепления без провоцирования альтерации со стороны зафиксированного протеза. Если этого не учесть, ремоделирование гребня будет происходить до тех пор, пока не будет достигнуто вышеупомянутого параметра в 2-3 мм. Нарушение биологической ширины может быть спровоцировано во время получения оттиска, посредством излишков цемента, или же при чрезмерно глубоком позиционировании краев протетической супраконструкции. Поэтому, даже несмотря на защитный потенциал толстого биотипа, скомпрометировать параметр биоширины достаточно просто, а бороться с результатом подобной ошибки в форме рецессии – задача весьма сложная, следовательно, лучше предупредить, нежели усложнять и без того проблематичную ситуацию.
Вопросы лечения рецессии десен вокруг имплантатов до сих пор остаются недостаточно изученными, в отличие от причин, которые широко описаны в литературе. Отдельные исследования были посвящены изучению успешности применения соединительнотканного трансплантата или же бесклеточного дермального матрикса для восстановления проблемных участков мягких тканей, и лишь в одном групповом исследовании были приведены результаты закрытия участков рецессии вокруг одиночных реставраций с опорой на титановые внутрикостные опоры. Авторы пришли к выводу, что наиболее клинически успешный результат лечения был достигнут при комбинации коронально перемещенного лоскута и соединительнотканного трансплантата, но даже при таком подходе не удалось обеспечить полного закрытия области рецессии вокруг дентальных имплантатов.
Целью текущего проспективного исследования было определение эффективности применения модифицированного хирургического подхода для лечения имплантат-ассоциированной рецессии десен через 9 месяцев после ятрогенного вмешательства.
Материалы и методы
Одной из задач данного исследования было представить новый оригинальный протокол лечения рецессий 2 класса в области дентальных имплантатов. Кроме того, в ходе эксперимента был предложен новый метод регистрации и балльной оценки изменений уровня мягких тканей вокруг титановых инфраконструкций с помощью индивидуализированного акрилового шаблона. Рецессия десен с вестибулярной стороны имплантата может развиться даже через 1 год после фиксации протетических супраконструкций, особенно в случаях наличия тонкого биотипа мягких тканей (фото 1 - 2). Измерение глубины рецессии проводилось от самой глубокой точки дефекта до границы мягких тканей вокруг реставраций с опорой на имплантаты.
Фото 1. Клиническая фотография зафиксированных реставраций непосредственно после лечения.

Фото 2. Вид через 1 год после лечения: апикальная миграция мягких тканей в области имплантатов по причине наличия тонкого биотипа десен.

Исследуемая группа
У десяти участников исследования (пять женщин и пять мужчин) возрастом от 24 до 63 лет был диагностирован 2 класс 2 подкласса рецессии десен вокруг реставраций с опорой на дентальные имплантаты. Набор пациентов проводился из Института имплантологического образования в Александрии, Египет. После объяснения алгоритма исследования все участники подписали форму информированного соглашения. После этого исследователями были получены их комплексные медицинские истории в соответствии с требованиями модифицированного опросника Cornell Medical Index. У большинства пациентов не наблюдалось никаких систематических заболеваний, кроме троих: у одного была диагностирована контролированная форма сахарного диабета, у второго – легкая форма гипертензии, а третий ранее уже проходил лечение по поводу язвенной болезни желудка. Степень контроля сахарного диабета определяли при помощи опросника качества жизни, трех тестов измерения уровня глюкозы с недельными интервалами, а также с помощью верификации уровня гликозилированного гемоглобина. Все пациенты, кроме одного, были некурящими. Последний был включен в группу исследования еще как некурящий, но начал курить после выполнения хирургического вмешательства. При этом уровень зубного налета у двоих пациентов достигал 1 балла, и еще у двоих – 2 баллов. Критериями исключения из исследования были курение и алкоголизм. Всем 10 пациентам было выполнено клиническое и рентгенологическое обследование (с использование конусно-лучевой компьютерной томографии), а также определено исходные значения индекса оценки зубного налета. Исходные параметры рецессии были зарегистрированы при помощи специально разработанного акрилового шаблона (фото 3 - 4). Повторная регистрация параметров рецессии проводилась через 4, 6 и 9 месяцев после хирургического вмешательства.
Фото 3. Для регистрации изменений мягких тканей использовался акриловый шаблон.

Фото 4. Акриловый шаблон помогает зарегистрировать улучшения позиции десен и миграцию уровня мягких тканей в корональном направлении.

Усовершенствованный шаблон для оценки параметров рецессии
В настоящем исследовании продемонстрировано новое простое устройство, которое оптимизирует процесс мониторинга изменения уровня рецессии десен вокруг дентальных имплантатов до и после стоматологического лечения (фото 3 - 4). Устройство состоит из специально разработанного шаблона, который имеет акриловое расширение для фиксации в области режущего края зубов верхней челюсти и выступа, направляющегося в область дефекта мягких тканей. Шаблон разработан специально для регистрации имплантат-ассоциированной рецессии, поскольку он позволяет зарегистрировать начальный уровень рецессии еще до начала ятрогенного вмешательства. С другой стороны, подобный дизайн шаблона помогает определить объем необходимой коррекции мягких тканей относительно состояния здоровых десен в соседних с рецессией участках (до линии, соединяющей точки середины вестибулярного маргинального края десен по обе стороны от проблемного имплантата). Метод не лишен субъективного влияния, поскольку оценка изменений проводиться именно регистратором, который определяет объем рецессии по шкале от 0 до 2. После лечения рецессии десен, акриловый шаблон используется снова для оценки изменений, полученных после вмешательства путем сравнения уровня глубины дефекта до коррекции и после таковой.
Хирургическая процедура
В данном исследовании представлен комплексный подход лечения имплантат-ассоциированных рецессий 2 класса 2 подкласса, включающий в себя сведение (приближение) двойного сосочкового лоскута и ротацию небного субэпителиального соединительнотканного трансплантата на ножке (фото 5 - 6) с целью покрытия любого гранулированного или аутогенного костного заменителя.
Фото 5. Схематическое изображение техники апроксимизации (сближения) двойного сосочкового лоскута.

Фото 6. Формирование расширенного субэпителиального лоскута на ножке для закрытия рецессии десен 2 класса.

Все оперативные вмешательства проводились под местной анестезией с использованием 2% ксилокаина (Dentsply) с адреналином после удаления зафиксированной ранее протетической конструкции. По мнению авторов, данную манипуляцию следует выполнять в три этапа: препарирование мягких тканей, удаление старого имплантата и установка новой титановой опоры, и, наконец, проведение костной аугментации. Препарирование мягких тканей состоит из сведения (приближения) двойного сосочкового лоскута и подготовки небного соединительнотканного трансплантата на ножке. Формирование сосочкового лоскута проводили со щечной стороны десен, используя лезвие №15 для выполнения V-образного надреза, следуя контуру дефекта мягких тканей (фото 7).
Фото 7. Линия V-подобного разреза по контуру рецессии для выполнения сближения двойного сосочкового лоскута.

Выполнение данного разреза позволяет получить свежую раневую поверхность для дальнейшего сближения участков слизистой. Два горизонтальных разреза были выполнены с прилегающих сторон медиального и дистального межзубных сосочков в корональном направлении параллельно эмалево-цементной границе тем же лезвием, что обеспечило лучшие условия для сближения тканей. Два послабляющих надреза были сделаны в косом направлении к соседним зубам, после чего они были расширены за пределы слизистодесневой границы. Фенестрация периоста обеспечивала условия для закрытия лоскута без излишнего натяжения. V-образный разрез был затем расширен вместе со щечным лоскутом. Шовной иглой проходили через внешнюю поверхность первого сосочка, а затем продолжали шов через внутреннюю поверхность второго сосочка, чтобы достичь апроксимизации (сближения) двойного лоскута посредством шелковых узловых швов 5-0 (Hu-Friedy) (фото 8 - 9).
Фото 8. Демонстрация сближенного двойного сосочкового лоскута посредством узловых шелковых швов 6-0.

Фото 9. Двойной лоскут был ушит при помощи нитей 06.

На данном этапе также выполняли сепарацию небного лоскута с целью забора субэпителиального соединительнотканного трансплантата непосредственно напротив области рецессии, который впоследствии ротировали прямо в участок дефекта мягких тканей. Небный парамаргинальный надрез от фронтального участка до области рецессии десен был выполнен согласно алгоритму, предложенного Khoury и Happe. После этого проводили рассечение слизисто-надкостничного лоскута и препарирование субэпителиального лоскута соединительной ткани на глубину от 5 мм до 8 мм. Таким же образом проводили острое рассечение субэпителиальной ткани параллельно первому разрезу для забора субэпителиального соединительнотканного трансплантата, который оставался фиксированным в переднем участке на небольшой ножке (фото 10 - 13).
Фото 10. Субэпителиальный соединительнотканный трансплантат ротировали с области неба для закрытия дефекта с вестибулярной стороны.

Фото 11. Монокортикальный трансплантат стабилизировали при помощи двух титановых микровинтов для закрытия костного дефекта.

Фото 12. Фиксация мембраны с помощью двух титановых винтов для перекрытия материала трансплантата.

Фото 13. Соединительнотканный трансплантат ушили к коллагеновой мембране.

В представленном протоколе зафиксированные ранее реставрации были удалены вместе в окончательными абатментами. Одномоментно были установлены новые имплантаты (Laser-Lok, BioHorizons), а остаточный дефект твердых тканей заполняли смесью гранулированного костного трансплантата. Смесь костного заменителя была сформирована из аутогенных костных ошурков, полученных из области вмешательства с помощью костного скребка (Hu-Friedy) и депротеинизированного бычьего костного ксенотрансплантата (Biо-Oss, Geistlich Pharma). После аугментации область вмешательства покрывали мембраной из поли-D-L-молочной кислоты (PDLLA) (SonicWeld technology, KLS Martin), зафиксированной при помощи винтов. Палатинальный субэпителиальный трансплантат на ножке ротировали в направлении режущего края и лабиальной поверхности для одновременного покрытия как костного трансплантата, так и защитной мембраны. Трансплантат фиксировали к мембране (SonicWeld technology, KLS Martin) посредством 6-0 полиглактиновых швов Coated VICRYL Suture (Ethicon) (фото 14 - 15).
Фото 14. Вид окончательных протетических реставраций: значительное улучшение в области прежних дефектов мягких тканей.

Фото 15. Миграция мягких тканей более чем на 3 мм в направлении режущего края.

Поскольку для закрытия дефекта мягких тканей использовали именно субэпителиальный трансплантат на ножке, то участок раны в области неба удалось полностью ушить 4-0 шелковыми швами (Hu-Friedy). Контрольное рентгенологическое исследование проводили с использованием КЛКТ-сканирования. Новый имплантат оставался закрытым в течение всего периода заживления, а в качестве провизорных конструкций использовали мосты типа Мэриленд (адгезивные протезы). На фото 16 изображен вид окончательной реставрации после восстановления области рецессии мягких тканей вокруг прежнего проблемного имплантата.
Фото 16. Восстановление области рецессии вокруг дентальных имплантатов.

В послеоперационном периоде пациентам рекомендовалось проводить аккуратную чистку ротовой полости вблизи области оперативного вмешательства. Участок непосредственной аугментации было рекомендовано вообще не чистить при помощи щетки на протяжении 3 недель, и ограничится лишь полосканиями 0,12% раствором хлоргексидина (Antiseptol, Kahira Pharmaceuticals, kahira-pharma.com) два раза в день в течение 1 недели. С целью предупреждения постоперативного инфицирования пациентам также был предписан прием амоксициллина (500 мг) (E-mox 500 мг в капсулах, Egyptian Int. Pharmaceutical Industrial Co., A.R.E) три раза в день в течение последующих 5 дней после операции.
Статистический анализ
Анализ данных клинических параметров и их изменений у пациентов проводили с использованием точного критерия Фишера, метода Монте-Карло и повторных калькуляций посредством ANOVA. Все данные были обработаны с помощью компьютеризированного статистического пакета программного обеспечения IBM SPSS Statistics версии 20 для Windows.
Результаты
Контрольный осмотр всех пролеченных пациентов проводился через 4, 6 и 9 месяцев после хирургической коррекции рецессий. Глубина рецессии у 10 пациентов до начала лечения составляла 1,5; 2,5; 2,0; 1,0; 1,5; 1,3; 1,8; 2,5; 2,5; 2,0 мм соответственно, через 4 месяца прирост мягких тканей составлял 1,3; 2,5; 1,8; 1,0; 1,2; 1,2; 1,57; 2,0; 0,00; -0,10 мм соответственно. В период 6 месяцев незначительные изменения уровня десен были отмечены лишь у половины пациентов, колеблясь в диапазоне 0,05-0,2 мм. Прирост уровня десен на последнем контрольном визите через 9 месяцев составлял уже 1,4; 2,30; 1,80; 1,00; 1,00; 1,25; 1,57; 1,80; 0,00; -0,20 мм.
Таким образом, средний исходный показатель глубины рецессии составлял 1,9 мм ± 0,5 мм, при этом в ходе повторного осмотра через 4 месяца после лечения он снизился до 0,6 мм ± 0,9 мм (р < 0,05). Через 6 и 9 месяцев после вмешательства средняя глубина дефекта мягких тканей не превышала 0,7 мм ± 0,9 мм, что также было статистически значимой разницей по сравнению с исходными клиническими параметрами (р <0,05). При сравнении параметров десневой рецессии через 4, 6 и 9 месяцев после хирургического лечения никаких статистически значимых различий обнаружено не было. Полученные результаты свидетельствуют о том, что после операционного вмешательства была достигнута клиническая стабильность полученного уровня мягких тканей, которая значительно не изменялась на протяжении всего периода наблюдения.
В ходе контрольных визитов через 9 месяцев у всех пациентов, за исключением двух, были зарегистрированы улучшенные параметры восстановления мягкотканого покрытия вокруг дентальных имплантатов. Из двух пациентов мужского пола, у которых не удалось добиться адекватной коррекции дефектов десен, один был курильщиком, а у другого был отмечен весьма высокий показатель индекса зубного налета, который достигал 2 баллов, при этом у обоих не было отмечено никаких соматических заболеваний. Таким образом, в конце проведенного исследования удалось добиться восстановления области рецессии у 80% пациентов, (при этом у двоих из них уровень зубного налета достигал 1 балла, а у троих имелись соматические заболевания – диабет, гипертония, язвенная болезнь).
Обсуждение
Долгосрочные клинические исследования доказали, что функциональная остеоинтеграция дентальных имплантатов является достаточно прогнозированным процессом при установке титановых инфраконструкций в области имеющихся дефектов зубного ряда. Однако в конце проведенного лечения с помощью имплантатов пациенты надеются получить не только функционально приемлемый, но и эстетически успешный результат, чем можно объяснить растущий интерес ученых и клиницистов относительно изучения динамики изменений мягких тканей вокруг остеоинтегрированных титановых опор. И хотя успешность конструкции имплантата измеряется именно достижением остеоинтеграции, а успешность протетической реставрации – ее функциональностью, эстетический аспект лечения становиться все более важным и проблемным с точки зрения удовлетворения ожиданий пациента относительно визуального профиля улыбки. Поскольку, несмотря на значительное количество исследований, прогнозированная позиция десен вокруг дентальных имплантатов установленных во фронтальном участке остается своеобразной дилеммой для всей лечащей команды, то комплексное решение данной проблемы состоит в контроле всех возможных факторов риска, влияющих на позицию мягких тканей. С другой стороны, мягкотканые трансплантаты успешно используются в лечении пародонтальных поражений на протяжении уже многих лет, обеспечивая закрытие обнаженных участков корня и соответствующую реконструкцию альвеолярного гребня. И хотя техника двойной апроксимизации (сближения) сосочков является технически чувствительной, но она обеспечивает достаточно хорошие результаты восстановления участков изолированной рецессии. Данная техника используется в тех случаях, когда одних смежных или апикально размещенных мягких тканей недостаточно для выполнения мягкотканой реконструкции. Метод использования частичного двойного сосочкового трансплантата на ножке был впервые предложен Cohen and Ross, которые сообщили о более чем 85% успешности при закрытии обнаженной поверхности корня. Nelson предложил подход, который сочетает в себе комбинированное использование свободного соединительнотканного трансплантата с двойным сосочковым лоскутом. Такой метод аугментации целесообразно использовать в случаях, в которых достижение соответствующего эстетического результата является приоритетным, а цветовое соответствие мягких тканей критическим для достижение успешной реабилитации.
Также в ходе исследований было подтверждено, что использование трансплантата на ножке является более прогнозированным, чем использование свободного лоскута, что аргументировано возможностью адекватного кровоснабжения области ятрогенного вмешательства. Burkhardt и коллеги пришли к выводу, что комбинированное использование субэпителиального трансплантата в сочетании с коронально перемещенным лоскутом способствует лучшему восстановлению имплантат-ассоциированных рецессий, однако даже при таком подходе добиться полного восстановления дефекта практически невозможно: непосредственно после операции возобновление уровня покрытия достигало почти 100%, но уже через месяц данный показатель снижался до 75%, а через 3 и 5 месяцев – до 70% и 66%, соответственно. С другой стороны, Zucchelli и коллеги сообщили, что восстановление мягкотканого покрытия в области рецессий на 96,3-100% через год после вмешательства было зарегистрировано в 75% клинических случаев. Вероятно, подобного результата удалось добиться за счет удаления имеющихся коронок за месяц до аугментации с последующей модификацией и полировкой зафиксированных абатментов. Кроме того, исследователи удаляли заново изготовленные временные коронки непосредственно в момент проведения оперативного вмешательства. В результате подобных манипуляций для мягкотканого трансплантата удалось воссоздать больше места в области интерфейса имплантат-абатмент, а также адаптировать поверхность абатмента надлежащим образом для улучшенного контакта с участком десен. Cosyn и коллеги, в свою очередь, представили годовые результаты успешности 22 имплантатов, установленных по немедленному протоколу. В двух клинических случаях через 3 месяца после установки были зарегистрированы глубокие рецессии величиной от 1,5 мм до 2,0 мм, коррекция которых проводилась посредством соединительнотканного трансплантата. Величина дефекта мягких тканей через год после аугментации не превышала 0,5 мм в обоих случаях.
Однако хоть субэпителиальные трансплантаты и могут улучшить вид щечного профиля десен, но спрогнозировать изменения уровня маргинального края мягких тканей довольно сложно. Трансплантаты на ножке являются отличным терапевтическим выходом для вертикальной и вестибулярной аугментации, а также обеспечивают улучшение эстетически скомпрометированных участков в области дентальных имплантатов. Khoury и Happe доказали, что, в случаях с непосредственно установленными имплантатами, небные субэпителиальные соединительнотканные лоскуты на ножке являются более предпочтительными, чем другие варианты аугментации, но и такие лучше комбинировать с дополнительной реконструкцией костной ткани. Ножка является дополнительным слоем для покрытия подсаженного костного заменителя и / или мембраны, а также обеспечивает подстилку для сближения двойного сосочкового лоскута. Кроме того, важное значение играет также первичная фиксация трансплантата к операционному ложу, и условия для адекватной реваскуляризации с рецепиентного участка. Результаты, полученные в ходе нашего исследования, подтверждают данные, полученные в более ранних клинических экспериментах. Несмотря на множество методов мягкотканной аугментации, следует помнить и об обеспечении адекватной костной поддержки в периимплантатной области. Результаты исследований последних двух десятилетий помогли прийти к выводу, что комбинация принципов направленной костной регенерации вместе с использованием аллогенных и ксеногенных костных заменителей способствует восстановлению периимплантатных дефектов. Биорезорбируемые мембраны состоят из твердой мозговой оболочки, поли-L-молочной кислоты, полигликолевой кислоты, полиуретана, и коллагена, что помогает, в свою очередь, избежать необходимости выполнения повторной процедуры их изъятия, поскольку они полностью деградируют в тканях. В недавнем систематическом обзоре, Khojasteh и коллеги, критически оценили имеющиеся доказательства относительно эффективности использования барьерных мембран для наращивания костной ткани. Согласно данным мета-анализа, барьерные мембраны обладают преимуществами при восстановлении вертикальных дефектов кости в периимплантатной области, но для обеспечения подобного эффекта обязательно нужно достичь стабильности изолирующих конструкций. При нестабильности мембран, согласно данных Adeyemo, наблюдается наоборот прогрессирование резорбтивных процессов костной ткани.
В своем обзоре относительно использования барьерных мембран при немедленной установке имплантатов El Helow и El Askary утверждают, что принятие решения о том, покрывать или не покрывать костные заменители зависит от конкретных клинических условий. Большинство костных дефектов по своей сути являются трехмерными, в то время как мембрана является двухмерной структурой. Адаптация мембраны к параметрам дефекта – процесс довольно времязатратный, требующий от той же мембраны определенной механической памяти. Следовательно, использование костного наполнителя помогает не только возобновить дефект, но и сопутствует улучшенной стабилизации биологического барьера. В ходе численных исследований было также доказано, что комбинированное использование мембраны и костного трансплантата гораздо лучше, чем отдельное применение каждого из данных элементов. В ходе восстановления рецессии нашим пациентам были установлены резорбируемые мембраны типа PDLLA, характеризирующиеся биосовместимостью и простотой использования без необходимости последующего их изъятия. В литературе описано несколько подходов костной аугментации с использованием мембран при немедленной установке имплантатов, в том числе и посредством деминерализованного или минерализованного лиофилизированного костного аллотрансплантата, депротеинизированного гранулированного костного заменителя, резорбируемого гидроксиапатита, аутогенных костных опилок, биологически активного стекла, а также с помощью пористого минерального ксенографта. Но из всех модификаций использование аутогенных трансплантатов обеспечивает наиболее перспективные результаты восстановления соответствующего количества и качества костной ткани. El Askary и Pipco, например, утверждают, что использование аутогенной кости является наиболее предпочтительным в ситуациях с обширной потерей твердых тканей.
В нашем исследовании для восстановления периимплантатных дефектов мы использовали смесь гранулированной аутогенной кости и пористой минеральной матрицы костного ксенотрансплантата (Bio-Oss). Еще одна особенность предложенной нами новой хирургической техники заключается в более корональном размещении двойного сосочкового лоскута на ножке, что позволяет достичь большей мобильности для закрытия дефекта мягких тканей. Это, в свою очередь, может позитивно повлиять на восстановление мягкотканного покрытия вокруг установленного трансплантата и изолирующей мембраны. Кроме того, очевидно, что покрытие ножки самого трансплантата также способствует достижению более эстетических результатов.
Хотя отбор пациентов в данном исследовании не был достаточно строгим (с учетом того, что в группу исследования были включены пациенты с диабетом, легкой формой гипертензии и язвой желудка), полученные результаты свидетельствуют о том, что соматические патологии никак не повлияли на успешность стоматлогической реабилитации. Единственными, у кого не удалось достичь приемлемого результата лечения являлись пациент-курильщик и пациент с высоким индексом зубного налета. Для объективной оценки восстановления участков рецессии требовалось сравнить параметры дефектов до начала и после соответствующего лечения. Cabello и коллеги изучали изменения мягких тканей после немедленной установки имплантатов. В своем исследовании они использовали жесткий акриловый шаблон, перекрывающий режущий край смежных зубов с тремя опорными углублениями, соответствующими уровням мезиального и дистального межзубных сосочков, а также положению десневого зенита. Электронный калибратор был использован для измерения расстояний с округлением до десятых долей миллиметра. Более простой способ регистрации изменений уровня мягких тканей описан в данной статье. После коррекции рецессий акриловый шаблон устанавливали повторно, одновременно сравнивая разницу позиции десен до и после вмешательства. Разработанный метод является адаптированным для изучения изменений мягких тканей в области имплантат-ассоциированных рецессий до и после коррекции таковых.
Выводы
Определение фенотипа мягких тканей, как и причины возникновения имплантат-ассоциированных рецессий является ключевым аспектом планирования будущего ятрогенного вмешательства. Для достижения максимального клинического успеха авторы рекомендуют использовать обычный субэпителиальный соединительнотканный трансплантат во время повторной имплантации, что помогает значительно увеличить объем мягких тканей с вестибулярной стороны установленных титановых инфраконструкций. Кроме того, данный подход позволяет использовать долгосрочную временную реставрацию на протяжении 3 месяцев, как и имплантаты с функцией переключения платформы, что, в свою очередь, обеспечивает условия для восстановления как минимум 3 мм ширины кератинизированных десен. Однако коррекция лишь мягких тканей не обеспечивает долгосрочного прогнозированного результата, а повторные хирургические вмешательства на деснах сопутствуют возникновению рубцов в области сформированных лоскутов. Именно поэтому авторы статьи предпочли комплексный подход с проведением дополнительной одновременной аугментации костной ткани, что также помогает свести к минимуму количество необходимых ятрогенных вмешательств в будущем. Дальнейшие перспективы исследований состоят в апробации предложенной методики на более численной выборке пациентов, чтобы подтвердить результаты, полученные в нашем исследовании. Предложенный хирургический подход является новой перспективной стратегией для лечения имплантат-ассоциированной рецессии десен, демонстрирующей успешные клинические исходы восстановления дефектов мягких тканей.
Авторы:
Abd El Salam El Askary, BDS
Noha A. Ghallab, MD
Shuh-Chern Tan, BDS
Paul S. Rosen, DMD, MS
Ahmad Shawkat, BDS, MS, PhD































































































































































1 комментарий
Статья может и неплохая, но из-за подачи текста в виде портянки ее не прочитал ни один пациент.