Поддерживающая терапия вокруг имплантатов крайне важна для повышения успешности и долговечности имплантатов с опорой на реставрации. Поскольку анатомия естественных зубов и дентальных имплантатов отличается в плане мягких тканей и кровоснабжения, имплантаты более подвержены воспалительным заболеваниям, таким как мукозит и периимплантит, что подчеркивает важность поддерживающей терапии. Основным этиологическим фактором этих воспалительных реакций является накопление зубного налета, то есть орального биопленки, вокруг краевой области имплантатов. Поэтому особое внимание следует уделять методам удаления отложений, включая использование различных механических инструментов и химиотерапевтических средств. Протоколы ухода за имплантатами включают оценку глубины зондирования, соблюдение пациентом гигиены полости рта и стабильности окружающих имплантат тканей. В данной статье рассматриваются терапевтические подходы и стратегии их совершенствования, а также обосновывается необходимость персонализированных схем ухода за имплантатами для достижения благоприятных долгосрочных результатов.
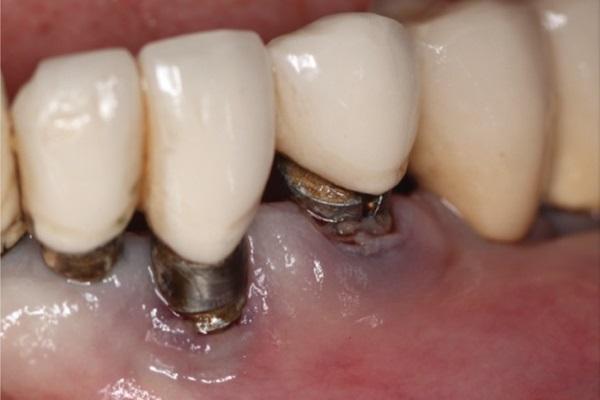
Несмотря на высокие показатели успешности, о которых сообщают клиницисты, пациенты сталкиваются с рядом проблем, связанных как с имплантатами, так и с протезами. Биологические осложнения включают мукозит, периимплантит, рецессии мягких тканей и воспаление под протезом, а протетические проблемы могут заключаться в ослаблении и/или поломке винтов, а также в истирании и/или сколах облицовки реставрации. Хотя правильное планирование лечения и хирургическое исполнение на этапе установки имплантата могут положительно повлиять на многие из этих факторов, поддерживающая терапия позволяет непрерывно контролировать и оценивать существующие осложнения, предотвращая возникновение новых проблем.
Правильная поддерживающая терапия начинается с тщательной фиксации изменений в медицинском и стоматологическом анамнезе пациента, оценки и обучения домашнему уходу, а также проведения полного пародонтологического обследования, дополненного при необходимости новыми рентгеновскими снимками. Клиническая оценка также должна включать анализ толщины мягких тканей, степени кератинизации и глубины преддверия. Хотя основная стабильность имплантата зависит от его остеоинтеграции, окружающие мягкие ткани формируют барьер, необходимый для долговечности и поддержания имплантата.
Анатомия и физиология
В отличие от естественных зубов, дентальные имплантаты не имеют корневого цемента и периодонтальной связки, необходимых для прикрепления волокон Шарпея. Хотя вокруг имплантатов формируется соединительнотканное прикрепление с помощью гемидесмосом в области десневой манжетки, соседние волокна соединительной ткани идут параллельно поверхности имплантата и не проникают в него. Это приводит к более слабому соединению с десной по сравнению с естественными зубами, где волокна расположены перпендикулярно длинной оси зуба. Кроме того, вокруг имплантатов требуется более длинная биологическая ширина, а соединительная ткань содержит больше коллагена и меньше фибробластов, воспалительных клеток и кровеносных сосудов, что свидетельствует о более медленном обновлении тканей. Кроме того, в здоровых тканях вокруг односоставных имплантатов коллагеновые волокна содержат больше коллагена типа V.
Эти различия в составе мягких тканей, а также отсутствие периодонтальной связки снижают кровоснабжение окружающих имплантат тканей. Клинически это проявляется более быстрым разрушением опорной кости (по сравнению с естественными зубами) при наличии воспаления из-за таких факторов, как зубной налет и окклюзионная травма. Поэтому тщательный уход за имплантатами особенно важен, учитывая сниженную способность окружающих тканей противостоять поражениям, связанным с налетом. Поддержание здоровья мягких тканей вокруг имплантата может быть столь же важным для его долгосрочного успеха, как и первоначальная остеоинтеграция.
Периимплантит
Образование и состав поддесневого бактериального налета, также называемого оральной биопленкой, на дентальных имплантатах схожи с таковыми на естественных зубах, с незначительными различиями в составе налета и скорости бактериальной адгезии. У беззубых пациентов первоначальное образование налета на имплантатах происходит из микрофлоры слюны, миндалин и языка, а у частично беззубых пациентов патогены пародонта могут обнаруживаться на имплантатах уже через 3 месяца после их установки. Кроме того, в течение 6 месяцев после установки имплантата патогены могут передаваться с оставшихся зубов на имплантаты.
Мукозит, предшественник периимплантита, развивается после накопления бактериальной биопленки на поверхности имплантата, что приводит к воспалительной реакции в прилегающих мягких тканях без потери опорной кости. Как и при заболеваниях пародонта, оптимальный контроль налета и поддерживающая терапия крайне важны для профилактики и лечения периимплантных заболеваний. Хотя мукозит обратим, без лечения он может прогрессировать в периимплантит.
Периимплантит был определен на Всемирном семинаре по классификации заболеваний пародонта и периимплантных состояний в 2017 году как патологическое состояние, связанное с налетом, которое возникает в тканях вокруг дентальных имплантатов и характеризуется воспалением слизистой оболочки и последующей потерей опорной кости. Периимплантит является наиболее частой причиной отказа имплантата после отсутствия остеоинтеграции и, как считается, предваряется мукозитом. Хотя установка имплантатов стала рутинной процедурой для замены утраченных зубов, распространенность периимплантита сохраняется,особенно по мере того, как клиницисты лучше понимают это заболевание и учатся его распознавать. Метаанализ Derks и Tomasi показал, что распространенность мукозита и периимплантита составляет 42,9% и 21,7% соответственно, включая исследования со средним сроком наблюдения от 3,4 до 11 лет. Таким образом, при правильном протоколе ухода мукозит может быть своевременно диагностирован и вылечен во время плановых визитов, пока воспалительное состояние еще обратимо.
Оценка при уходе
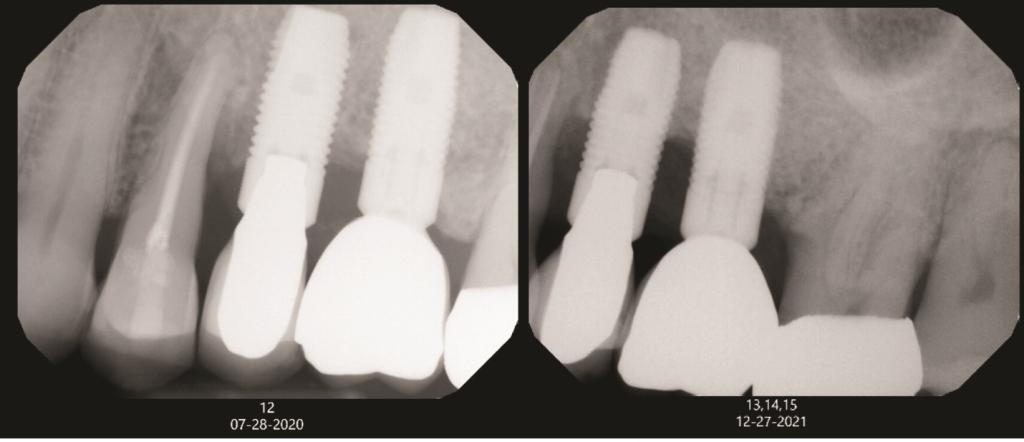
Уход за имплантатами требует персонализации, начиная с оценки мотивации и способности пациента поддерживать хорошую гигиену полости рта до установки имплантата. Соблюдение пациентом рекомендаций крайне важно, а недостаточная гигиена может быть противопоказанием к имплантации. Исследования показывают, что накопление налета вокруг имплантатов может усугубить мукозит уже через 3 месяца.Поэтому, как и при поддерживающей пародонтальной терапии, ухода за имплантатами должен проводиться каждые 3 месяца. Клинические параметры для мониторинга включают глубину зондирования, наличие кровоточивости при зондировании (КПЗ), нагноение, покраснение слизистой, налет, кератинизированную слизистую, стабильность окклюзии/протеза и глубину преддверия. Визиты также должны включать рентгенологическую оценку при необходимости, обзор медицинского анамнеза и демонстрацию/оценку гигиенических привычек пациента. Изменения в медицинском анамнезе, такие как развитие диабета, и/или способность поддерживать гигиену могут повлиять на восприимчивость пациента к периимплантиту (Фото 1).
Фото 1. Слева представлен рентгеновский снимок пациента от июля 2020 года. Всего через 1,5 года, в декабре 2021 года (справа), у пациента наблюдалась значительная потеря кости в области имплантатов №№2.5 и 2.6. В этот период у пациента развился неконтролируемый сахарный диабет. Этот случай подчеркивает, как изменения в медицинском анамнезе, такие как развитие диабета, могут повлиять на опорные структуры вокруг имплантатов.
Во время визитов глубину зондирования вокруг имплантатов следует измерять с силой 0,2 Н, что меньше, чем при зондировании естественных зубов, из-за анатомических различий в ориентации десневых волокон. Хотя изначально это вызывало споры, зондирование вокруг имплантатов не наносит необратимого вреда им или мягким тканям, а заживление мягких тканей ожидается через 5–7 дней. Также важно оценивать качество мягких тканей вокруг имплантатов во время пародонтологического обследования, так как это может быть предрасполагающим фактором к биологическим осложнениям, таким как рецессии и мукозит.
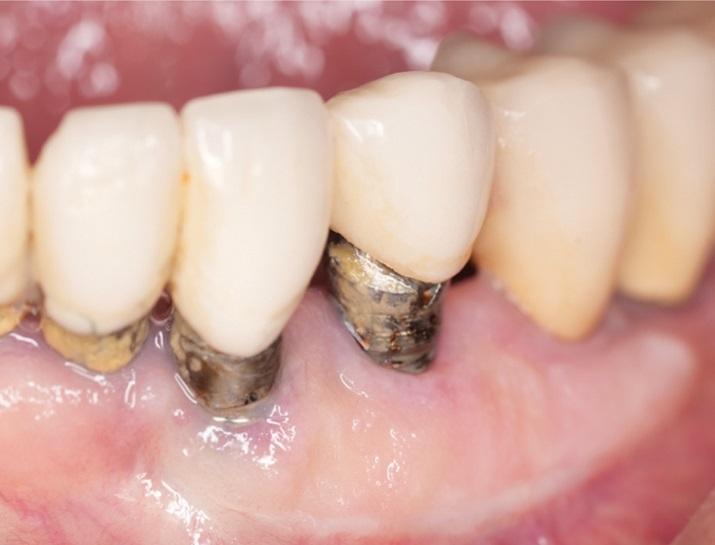
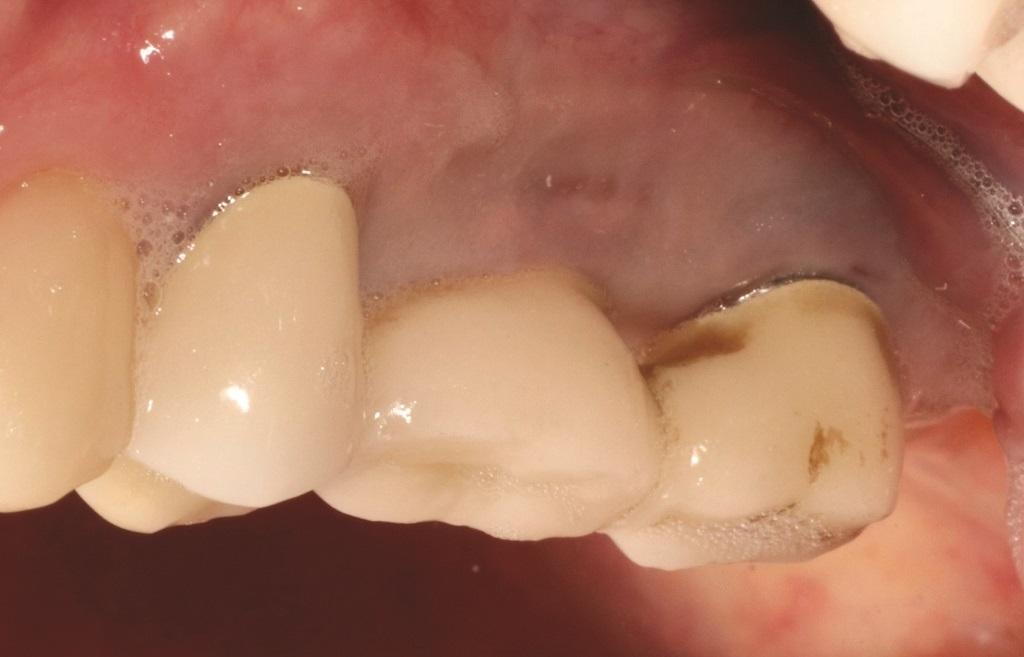
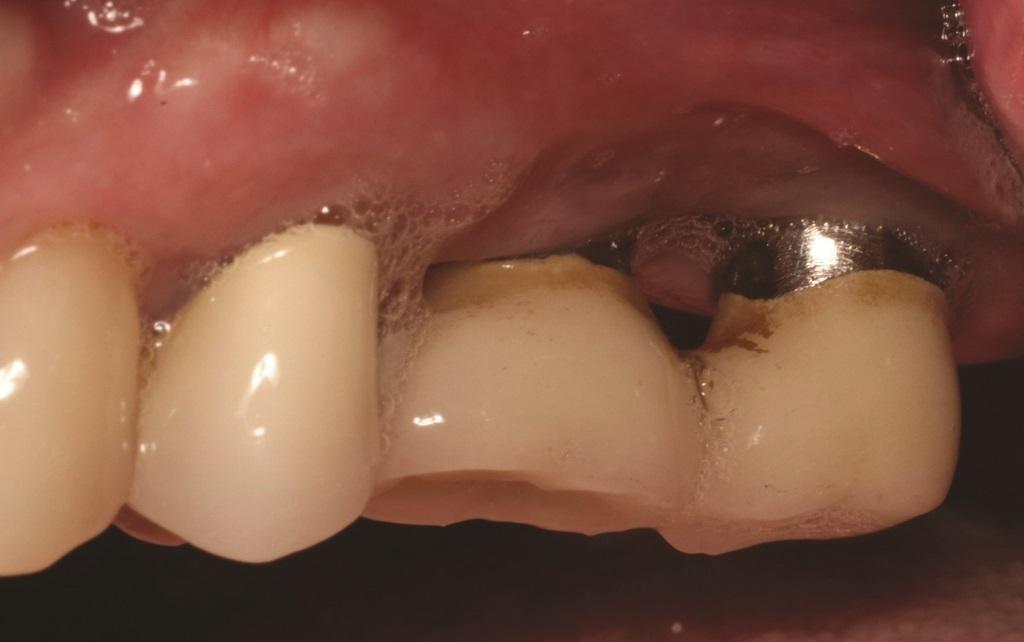
Толщина тканей влияет на начальную потерю краевой кости вокруг имплантатов. Linkevicius и соавт. показали, что при толстом фенотипе потеря кости меньше, чем при тонком. Однако при увеличении тонких тканей аллотрансплантатами потеря кости была сопоставима с толстыми тканями. Поэтому при оценке качества мягких тканей предпочтительнее толстый фенотип, и этот аспект следует оценивать при контрольных посещениях. Кроме того, количество кератинизированной ткани может влиять на долгосрочный прогноз имплантатов. Для естественных зубов считается, что необходимо не менее 2 мм кератинизированной ткани для поддержания здоровья пародонта. Для имплантатов значение кератинизированной ткани менее ясно: одни исследования не выявили связи между ее количеством и потерей кости, а другие показали, что ее наличие значительно снижает рецессии и потерю прикрепления. Дополнительные исследования подтверждают, что полоса кератинизированной ткани более 2 мм ассоциируется с уменьшением КПЗ, налета, рецессий и потери прикрепления, особенно у пациентов без строгого протокола ухода. Это может быть связано с тем, что кератинизированная ткань обеспечивает больший комфорт при домашнем уходе, тогда как тонкая слизистая может вызывать боль при чистке и нежелание соблюдать гигиену (Фото 2). Поэтому во время ухода важно тщательно оценивать качество мягких тканей и при необходимости рекомендовать их аугментацию (Фото 3 и Фото 4).
Фото 2: У пациента наблюдалось воспаление вокруг имплантатов. Пациент испытывал трудности при чистке из-за мелкого преддверия, близкого расположения имплантатов и недостатка кератинизированной ткани.
Фото 3 и Фото 4. Фотографии до (Фото 3) и после (Фото 4) лечения пациента, которому выполнили свободную пересадку десны в области имплантатов №№ 3.4 и 3.3. Обратите внимание на увеличение количества кератинизированной ткани после операции (Фото 4). После операции пациент был переведен на 3-месячный режим поддерживающей терапии и отметил повышение комфорта при домашнем уходе.
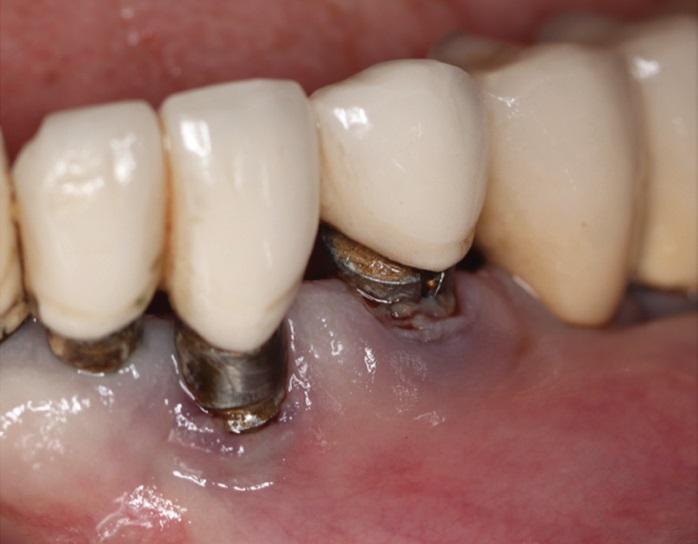
Глубина преддверия значительно влияет на комфорт пациента и доступность имплантатов для домашнего ухода. Она измеряется от края слизистой до точки наибольшей вогнутости слизисто-щечной складки при оттягивании. Исследование Halperin-Sternfeld и соавт. выявило статистически значимое увеличение потери кости и рецессий вокруг имплантатов при глубине преддверия менее 4 мм. Диагностика мелкого преддверия во время визитов и его хирургическая коррекция могут быть необходимы для улучшения долгосрочного прогноза имплантатов.
Качество мягких тканей влияет на восприимчивость имплантатов к воспалению и разрушению. Кроме того, важно оценивать изменения в медицинском анамнезе пациента и его домашнем уходе, что подчеркивает необходимость персонализации каждого визита. Тщательные клинические обследования, включая проверку окклюзии и новые рентгеновские снимки, необходимы для предотвращения протетических осложнений, таких как ослабление/поломка винтов, и раннего выявления периимплантных заболеваний.
Лечение периимплантных заболеваний
Как и при лечении пародонтита и гингивита, терапия периимплантных заболеваний включает нехирургические и хирургические методы.
Резективные и регенеративные хирургические подходы
Хирургическое лечение включает как резективные, так и регенеративные методы. При резективной терапии периимплантита цель заключается в удалении избыточной грануляционной ткани, остановке кратерообразного разрушения кости и апикальном перемещении тканей, что может сочетаться с имплантопластикой для сглаживания резьбы имплантата (Фото 5 и Фото 6). Регенеративная терапия предполагает использование комбинаций костных трансплантатов, мембран и биологических материалов для восстановления утраченных опорных структур.
Фото 5 и Фото 6. Фотографии до (Фото 5) и после (Фото 6) резективной хирургии периимплантита в области имплантатов №№ 2.6 и 2.7. Обратите внимание на улучшенную доступность для чистки после операции, расширившей промежуток (Фото 6). После операции пациент был переведен на 3-месячный режим поддерживающей терапии.
Нехирургическая терапия
Нехирургическая терапия является первой линией защиты от периимплантных заболеваний и включает механические методы удаления биопленки. Механическое удаление налета может проводиться как над десной, так и под ней. Для естественных зубов механическая обработка частично направлена на удаление пораженного цемента, но поверхность имплантата должна оставаться неповрежденной. Для этого используются различные кюреты, каждая со своими преимуществами и недостатками. Стальные кюреты могут повреждать поверхность имплантата из-за своей твердости, поэтому их следует применять с осторожностью. Титановые кюреты имеют схожую с имплантатом твердость и меньше повреждают поверхность, но менее эффективны против зубного камня. Углеродные кюреты мягче имплантата и не повреждают его, но также менее эффективны и могут ломаться. Тефлоновые кюреты обладают схожими свойствами и рекомендуются в сочетании с воздушно-абразивными системами.Пластиковые кюреты, самые хрупкие, неэффективны против камня и могут оставлять частицы пластика в кармане, усугубляя заболевание.
Выбор кюреты может зависеть от конкретного клинического случая, исходя из состояния тканей вокруг имплантата и характера заболевания. При использовании кюрет, способных повредить поверхность имплантата, клиницистам следует учитывать тип применяемого движения. Тянущие движения, которые могут образовывать вертикальные борозды на поверхности имплантата, могут способствовать апикальному распространению эпителия, в отличие от горизонтальных борозд вокруг поверхности имплантата.
Ультразвуковые насадки также применяются для удаления камня и биопленки с поверхности имплантата. Для имплантатов обычно используются насадки с покрытием из полиэтерэтеркетона (ПЭЭК), высокопрочного пластика со стальным сердечником. Как и с кюретами, выбор насадки зависит от случая.
Исследования показывают, что клетки лучше прикрепляются к шероховатым поверхностям имплантатов, чем к гладким, — свойство, известное как "ругофилия". Шероховатость поверхности влияет как на адгезию мягких тканей, так и на бактериальную колонизацию, причем снижение шероховатости уменьшает накопление бактерий. Поэтому уход должен включать оценку шероховатости поверхности.
В качестве альтернативы механическому удалению предлагается воздушно-абразивная обработка, которая очищает имплантат без повреждений. Используются порошки на основе эритрита, бикарбоната натрия и глицина. Хотя клинические исследования не показали превосходства воздушно-абразивной обработки над механической в лечении мукозита, in vitro она демонстрирует высокую эффективность против биопленки. Этот метод может быть полезен во время плановых визитов для удаления поддесневого налета.
Стоматологические лазеры
Лазеры полезны в периимплантной терапии благодаря способности дезинфицировать поверхность без повреждений при правильных настройках. Тип лазера и параметры его работы влияют на клиническую эффективность. Неправильное использование может привести к перегреву имплантата и необратимым изменениям поверхности и тканей.
Эрбиевый лазер на иттрий-алюминиевом гранате (Er:YAG) при соответствующих параметрах, в сочетании с подачей водного спрея для минимизации повышения температуры, может использоваться непосредственно на поверхности имплантата без каких-либо изменений ее структуры. Эрбиевый, хромовый: иттрий-скандий-галлий-гранатовый лазер (Er,Cr:YSGG) имеет сходный коэффициент поглощения с лазером Er:YAG и поэтому также может применяться на поверхности титановoго имплантата с аналогичным эффектом. Преимуществом лазера Er:YAG является его коэффициент поглощения для гидроксиапатита и, соответственно, способность удалять зубные отложения. Schwarz и соавт. сообщили, что при консервативном лечении применение лазера Er:YAG привело к значительным клиническим улучшениям через 6 месяцев после терапии, с достоверно более выраженным снижением КПЗ по сравнению с механической обработкой пластиковыми инструментами и антисептической терапией.
Лазеры на углекислом газе (CO2) могут использоваться для деконтаминации поверхности имплантата, и in vitro-исследования показали, что CO2-лазер не повреждает поверхность имплантата при использовании правильной мощности и настроек. Лазеры на диодах также показали эффективность как дополнение к традиционной обработке при лечении периимплантита, вызывая минимальные изменения температуры поверхности. Необходимы дополнительные in vivo-исследования с более длительным периодом наблюдения и сравнением всех длин волн в семействе диодных лазеров.
Лазерная обработка полезна перед пластикой мягких тканей для дезинфекции поверхности.
Фотодинамическая терапия (ФДТ) — еще один метод дезинфекции, показавший promising результаты в нехирургическом лечении. ФДТ предполагает использование фотосенсибилизатора, активируемого лазером, для уничтожения микроорганизмов. Наибольшая эффективность наблюдается в карманах менее 5 мм, что делает ФДТ отличным дополнением к механической обработке.
По мере расширения базы знаний о лазерной терапии в стоматологии и ее документирования в литературе, будут дальше разрабатываться оптимальные протоколы в отношении типа лазера, мощности и частотных настроек (а также фотосенсибилизаторов при использовании ФДТ), что обеспечит различные подходы к лечению имплантатов с помощью данного метода.
Антимикробные средства
Антимикробные средства используются в качестве дополнения к механической обработке. Миноциклин, тетрациклин и азитромицин показали promising результаты. Хлоргексидин (ХГ) также применялся для предотвращения реколонизации бактерий, но исследование Heitz-Mayfield и соавт. не выявило преимуществ его использования в сочетании с механической обработкой. Более того, ХГ адсорбируется на поверхности имплантата. Kotsakis и соавт. показали, что остаточный ХГ негативно влияет на остеобласты и может нарушать биосовместимость титана, а in vitro исследование Kozlovsky и соавт. выявило большую адсорбцию на шероховатых поверхностях. ХГ также цитотоксичен для фибробластов и может замедлять заживление. Сочетание ХГ с металлическими кюретами может усиливать шероховатость поверхности, повышая адсорбцию ХГ.
Поскольку ХГ не рекомендуется для обработки имплантатов, исследуются альтернативы. Новый растительный экстракт рассматривается как перспективное натуральное решение благодаря избирательной цитотоксичности.Однако необходимы дополнительные исследования его адсорбции на имплантатах и влияния на поддерживающую терапию.
Вывод
Поддерживающая терапия критически важна для успеха и долговечности дентальных имплантатов. Однако периимплантные заболевания неизбежно возникают и требуют лечения. Периимплантный мукозит, обратимое воспалительное состояние, может прогрессировать в периимплантит без лечения, что подчеркивает важность регулярного ухода. Для предотвращения отказа имплантатов необходимо как можно раньше выявлять и лечить заболевания, ограничивая потерю кости. Дальнейшие исследования помогут усовершенствовать протоколы и разработать индивидуальные подходы к уходу для долгосрочной выживаемости имплантатов.
Авторы:
Nathan E. Estrin, DMD, MS
Jon B. Suzuki, DDS, PhD, MBA
Diana Bronstein, DDS, MS
Georgios Romanos, DDS, PhD, Prof Dr med dent
Поддерживающая терапия вокруг имплантатов крайне важна для повышения успешности и долговечности имплантатов с опорой на реставрации. Поскольку анатомия естественных зубов и дентальных имплантатов отличается в плане мягких тканей и кровоснабжения, имплантаты более подвержены воспалительным заболеваниям, таким как мукозит и периимплантит, что подчеркивает важность поддерживающей терапии. Основным этиологическим фактором этих воспалительных реакций является накопление зубного налета, то есть орального биопленки, вокруг краевой области имплантатов. Поэтому особое внимание следует уделять методам удаления отложений, включая использование различных механических инструментов и химиотерапевтических средств. Протоколы ухода за имплантатами включают оценку глубины зондирования, соблюдение пациентом гигиены полости рта и стабильности окружающих имплантат тканей. В данной статье рассматриваются терапевтические подходы и стратегии их совершенствования, а также обосновывается необходимость персонализированных схем ухода за имплантатами для достижения благоприятных долгосрочных результатов.

Несмотря на высокие показатели успешности, о которых сообщают клиницисты, пациенты сталкиваются с рядом проблем, связанных как с имплантатами, так и с протезами. Биологические осложнения включают мукозит, периимплантит, рецессии мягких тканей и воспаление под протезом, а протетические проблемы могут заключаться в ослаблении и/или поломке винтов, а также в истирании и/или сколах облицовки реставрации. Хотя правильное планирование лечения и хирургическое исполнение на этапе установки имплантата могут положительно повлиять на многие из этих факторов, поддерживающая терапия позволяет непрерывно контролировать и оценивать существующие осложнения, предотвращая возникновение новых проблем.
Правильная поддерживающая терапия начинается с тщательной фиксации изменений в медицинском и стоматологическом анамнезе пациента, оценки и обучения домашнему уходу, а также проведения полного пародонтологического обследования, дополненного при необходимости новыми рентгеновскими снимками. Клиническая оценка также должна включать анализ толщины мягких тканей, степени кератинизации и глубины преддверия. Хотя основная стабильность имплантата зависит от его остеоинтеграции, окружающие мягкие ткани формируют барьер, необходимый для долговечности и поддержания имплантата.
Анатомия и физиология
В отличие от естественных зубов, дентальные имплантаты не имеют корневого цемента и периодонтальной связки, необходимых для прикрепления волокон Шарпея. Хотя вокруг имплантатов формируется соединительнотканное прикрепление с помощью гемидесмосом в области десневой манжетки, соседние волокна соединительной ткани идут параллельно поверхности имплантата и не проникают в него. Это приводит к более слабому соединению с десной по сравнению с естественными зубами, где волокна расположены перпендикулярно длинной оси зуба. Кроме того, вокруг имплантатов требуется более длинная биологическая ширина, а соединительная ткань содержит больше коллагена и меньше фибробластов, воспалительных клеток и кровеносных сосудов, что свидетельствует о более медленном обновлении тканей. Кроме того, в здоровых тканях вокруг односоставных имплантатов коллагеновые волокна содержат больше коллагена типа V.
Эти различия в составе мягких тканей, а также отсутствие периодонтальной связки снижают кровоснабжение окружающих имплантат тканей. Клинически это проявляется более быстрым разрушением опорной кости (по сравнению с естественными зубами) при наличии воспаления из-за таких факторов, как зубной налет и окклюзионная травма. Поэтому тщательный уход за имплантатами особенно важен, учитывая сниженную способность окружающих тканей противостоять поражениям, связанным с налетом. Поддержание здоровья мягких тканей вокруг имплантата может быть столь же важным для его долгосрочного успеха, как и первоначальная остеоинтеграция.
Периимплантит
Образование и состав поддесневого бактериального налета, также называемого оральной биопленкой, на дентальных имплантатах схожи с таковыми на естественных зубах, с незначительными различиями в составе налета и скорости бактериальной адгезии. У беззубых пациентов первоначальное образование налета на имплантатах происходит из микрофлоры слюны, миндалин и языка, а у частично беззубых пациентов патогены пародонта могут обнаруживаться на имплантатах уже через 3 месяца после их установки. Кроме того, в течение 6 месяцев после установки имплантата патогены могут передаваться с оставшихся зубов на имплантаты.
Мукозит, предшественник периимплантита, развивается после накопления бактериальной биопленки на поверхности имплантата, что приводит к воспалительной реакции в прилегающих мягких тканях без потери опорной кости. Как и при заболеваниях пародонта, оптимальный контроль налета и поддерживающая терапия крайне важны для профилактики и лечения периимплантных заболеваний. Хотя мукозит обратим, без лечения он может прогрессировать в периимплантит.
Периимплантит был определен на Всемирном семинаре по классификации заболеваний пародонта и периимплантных состояний в 2017 году как патологическое состояние, связанное с налетом, которое возникает в тканях вокруг дентальных имплантатов и характеризуется воспалением слизистой оболочки и последующей потерей опорной кости. Периимплантит является наиболее частой причиной отказа имплантата после отсутствия остеоинтеграции и, как считается, предваряется мукозитом. Хотя установка имплантатов стала рутинной процедурой для замены утраченных зубов, распространенность периимплантита сохраняется,особенно по мере того, как клиницисты лучше понимают это заболевание и учатся его распознавать. Метаанализ Derks и Tomasi показал, что распространенность мукозита и периимплантита составляет 42,9% и 21,7% соответственно, включая исследования со средним сроком наблюдения от 3,4 до 11 лет. Таким образом, при правильном протоколе ухода мукозит может быть своевременно диагностирован и вылечен во время плановых визитов, пока воспалительное состояние еще обратимо.
Оценка при уходе
Уход за имплантатами требует персонализации, начиная с оценки мотивации и способности пациента поддерживать хорошую гигиену полости рта до установки имплантата. Соблюдение пациентом рекомендаций крайне важно, а недостаточная гигиена может быть противопоказанием к имплантации. Исследования показывают, что накопление налета вокруг имплантатов может усугубить мукозит уже через 3 месяца.Поэтому, как и при поддерживающей пародонтальной терапии, ухода за имплантатами должен проводиться каждые 3 месяца. Клинические параметры для мониторинга включают глубину зондирования, наличие кровоточивости при зондировании (КПЗ), нагноение, покраснение слизистой, налет, кератинизированную слизистую, стабильность окклюзии/протеза и глубину преддверия. Визиты также должны включать рентгенологическую оценку при необходимости, обзор медицинского анамнеза и демонстрацию/оценку гигиенических привычек пациента. Изменения в медицинском анамнезе, такие как развитие диабета, и/или способность поддерживать гигиену могут повлиять на восприимчивость пациента к периимплантиту (Фото 1).
Фото 1. Слева представлен рентгеновский снимок пациента от июля 2020 года. Всего через 1,5 года, в декабре 2021 года (справа), у пациента наблюдалась значительная потеря кости в области имплантатов №№2.5 и 2.6. В этот период у пациента развился неконтролируемый сахарный диабет. Этот случай подчеркивает, как изменения в медицинском анамнезе, такие как развитие диабета, могут повлиять на опорные структуры вокруг имплантатов.

Во время визитов глубину зондирования вокруг имплантатов следует измерять с силой 0,2 Н, что меньше, чем при зондировании естественных зубов, из-за анатомических различий в ориентации десневых волокон. Хотя изначально это вызывало споры, зондирование вокруг имплантатов не наносит необратимого вреда им или мягким тканям, а заживление мягких тканей ожидается через 5–7 дней. Также важно оценивать качество мягких тканей вокруг имплантатов во время пародонтологического обследования, так как это может быть предрасполагающим фактором к биологическим осложнениям, таким как рецессии и мукозит.
Толщина тканей влияет на начальную потерю краевой кости вокруг имплантатов. Linkevicius и соавт. показали, что при толстом фенотипе потеря кости меньше, чем при тонком. Однако при увеличении тонких тканей аллотрансплантатами потеря кости была сопоставима с толстыми тканями. Поэтому при оценке качества мягких тканей предпочтительнее толстый фенотип, и этот аспект следует оценивать при контрольных посещениях. Кроме того, количество кератинизированной ткани может влиять на долгосрочный прогноз имплантатов. Для естественных зубов считается, что необходимо не менее 2 мм кератинизированной ткани для поддержания здоровья пародонта. Для имплантатов значение кератинизированной ткани менее ясно: одни исследования не выявили связи между ее количеством и потерей кости, а другие показали, что ее наличие значительно снижает рецессии и потерю прикрепления. Дополнительные исследования подтверждают, что полоса кератинизированной ткани более 2 мм ассоциируется с уменьшением КПЗ, налета, рецессий и потери прикрепления, особенно у пациентов без строгого протокола ухода. Это может быть связано с тем, что кератинизированная ткань обеспечивает больший комфорт при домашнем уходе, тогда как тонкая слизистая может вызывать боль при чистке и нежелание соблюдать гигиену (Фото 2). Поэтому во время ухода важно тщательно оценивать качество мягких тканей и при необходимости рекомендовать их аугментацию (Фото 3 и Фото 4).
Фото 2: У пациента наблюдалось воспаление вокруг имплантатов. Пациент испытывал трудности при чистке из-за мелкого преддверия, близкого расположения имплантатов и недостатка кератинизированной ткани.

Фото 3 и Фото 4. Фотографии до (Фото 3) и после (Фото 4) лечения пациента, которому выполнили свободную пересадку десны в области имплантатов №№ 3.4 и 3.3. Обратите внимание на увеличение количества кератинизированной ткани после операции (Фото 4). После операции пациент был переведен на 3-месячный режим поддерживающей терапии и отметил повышение комфорта при домашнем уходе.


Глубина преддверия значительно влияет на комфорт пациента и доступность имплантатов для домашнего ухода. Она измеряется от края слизистой до точки наибольшей вогнутости слизисто-щечной складки при оттягивании. Исследование Halperin-Sternfeld и соавт. выявило статистически значимое увеличение потери кости и рецессий вокруг имплантатов при глубине преддверия менее 4 мм. Диагностика мелкого преддверия во время визитов и его хирургическая коррекция могут быть необходимы для улучшения долгосрочного прогноза имплантатов.
Качество мягких тканей влияет на восприимчивость имплантатов к воспалению и разрушению. Кроме того, важно оценивать изменения в медицинском анамнезе пациента и его домашнем уходе, что подчеркивает необходимость персонализации каждого визита. Тщательные клинические обследования, включая проверку окклюзии и новые рентгеновские снимки, необходимы для предотвращения протетических осложнений, таких как ослабление/поломка винтов, и раннего выявления периимплантных заболеваний.
Лечение периимплантных заболеваний
Как и при лечении пародонтита и гингивита, терапия периимплантных заболеваний включает нехирургические и хирургические методы.
Резективные и регенеративные хирургические подходы
Хирургическое лечение включает как резективные, так и регенеративные методы. При резективной терапии периимплантита цель заключается в удалении избыточной грануляционной ткани, остановке кратерообразного разрушения кости и апикальном перемещении тканей, что может сочетаться с имплантопластикой для сглаживания резьбы имплантата (Фото 5 и Фото 6). Регенеративная терапия предполагает использование комбинаций костных трансплантатов, мембран и биологических материалов для восстановления утраченных опорных структур.
Фото 5 и Фото 6. Фотографии до (Фото 5) и после (Фото 6) резективной хирургии периимплантита в области имплантатов №№ 2.6 и 2.7. Обратите внимание на улучшенную доступность для чистки после операции, расширившей промежуток (Фото 6). После операции пациент был переведен на 3-месячный режим поддерживающей терапии.


Нехирургическая терапия
Нехирургическая терапия является первой линией защиты от периимплантных заболеваний и включает механические методы удаления биопленки. Механическое удаление налета может проводиться как над десной, так и под ней. Для естественных зубов механическая обработка частично направлена на удаление пораженного цемента, но поверхность имплантата должна оставаться неповрежденной. Для этого используются различные кюреты, каждая со своими преимуществами и недостатками. Стальные кюреты могут повреждать поверхность имплантата из-за своей твердости, поэтому их следует применять с осторожностью. Титановые кюреты имеют схожую с имплантатом твердость и меньше повреждают поверхность, но менее эффективны против зубного камня. Углеродные кюреты мягче имплантата и не повреждают его, но также менее эффективны и могут ломаться. Тефлоновые кюреты обладают схожими свойствами и рекомендуются в сочетании с воздушно-абразивными системами.Пластиковые кюреты, самые хрупкие, неэффективны против камня и могут оставлять частицы пластика в кармане, усугубляя заболевание.
Выбор кюреты может зависеть от конкретного клинического случая, исходя из состояния тканей вокруг имплантата и характера заболевания. При использовании кюрет, способных повредить поверхность имплантата, клиницистам следует учитывать тип применяемого движения. Тянущие движения, которые могут образовывать вертикальные борозды на поверхности имплантата, могут способствовать апикальному распространению эпителия, в отличие от горизонтальных борозд вокруг поверхности имплантата.
Ультразвуковые насадки также применяются для удаления камня и биопленки с поверхности имплантата. Для имплантатов обычно используются насадки с покрытием из полиэтерэтеркетона (ПЭЭК), высокопрочного пластика со стальным сердечником. Как и с кюретами, выбор насадки зависит от случая.
Исследования показывают, что клетки лучше прикрепляются к шероховатым поверхностям имплантатов, чем к гладким, — свойство, известное как "ругофилия". Шероховатость поверхности влияет как на адгезию мягких тканей, так и на бактериальную колонизацию, причем снижение шероховатости уменьшает накопление бактерий. Поэтому уход должен включать оценку шероховатости поверхности.
В качестве альтернативы механическому удалению предлагается воздушно-абразивная обработка, которая очищает имплантат без повреждений. Используются порошки на основе эритрита, бикарбоната натрия и глицина. Хотя клинические исследования не показали превосходства воздушно-абразивной обработки над механической в лечении мукозита, in vitro она демонстрирует высокую эффективность против биопленки. Этот метод может быть полезен во время плановых визитов для удаления поддесневого налета.
Стоматологические лазеры
Лазеры полезны в периимплантной терапии благодаря способности дезинфицировать поверхность без повреждений при правильных настройках. Тип лазера и параметры его работы влияют на клиническую эффективность. Неправильное использование может привести к перегреву имплантата и необратимым изменениям поверхности и тканей.
Эрбиевый лазер на иттрий-алюминиевом гранате (Er:YAG) при соответствующих параметрах, в сочетании с подачей водного спрея для минимизации повышения температуры, может использоваться непосредственно на поверхности имплантата без каких-либо изменений ее структуры. Эрбиевый, хромовый: иттрий-скандий-галлий-гранатовый лазер (Er,Cr:YSGG) имеет сходный коэффициент поглощения с лазером Er:YAG и поэтому также может применяться на поверхности титановoго имплантата с аналогичным эффектом. Преимуществом лазера Er:YAG является его коэффициент поглощения для гидроксиапатита и, соответственно, способность удалять зубные отложения. Schwarz и соавт. сообщили, что при консервативном лечении применение лазера Er:YAG привело к значительным клиническим улучшениям через 6 месяцев после терапии, с достоверно более выраженным снижением КПЗ по сравнению с механической обработкой пластиковыми инструментами и антисептической терапией.
Лазеры на углекислом газе (CO2) могут использоваться для деконтаминации поверхности имплантата, и in vitro-исследования показали, что CO2-лазер не повреждает поверхность имплантата при использовании правильной мощности и настроек. Лазеры на диодах также показали эффективность как дополнение к традиционной обработке при лечении периимплантита, вызывая минимальные изменения температуры поверхности. Необходимы дополнительные in vivo-исследования с более длительным периодом наблюдения и сравнением всех длин волн в семействе диодных лазеров.
Лазерная обработка полезна перед пластикой мягких тканей для дезинфекции поверхности.
Фотодинамическая терапия (ФДТ) — еще один метод дезинфекции, показавший promising результаты в нехирургическом лечении. ФДТ предполагает использование фотосенсибилизатора, активируемого лазером, для уничтожения микроорганизмов. Наибольшая эффективность наблюдается в карманах менее 5 мм, что делает ФДТ отличным дополнением к механической обработке.
По мере расширения базы знаний о лазерной терапии в стоматологии и ее документирования в литературе, будут дальше разрабатываться оптимальные протоколы в отношении типа лазера, мощности и частотных настроек (а также фотосенсибилизаторов при использовании ФДТ), что обеспечит различные подходы к лечению имплантатов с помощью данного метода.
Антимикробные средства
Антимикробные средства используются в качестве дополнения к механической обработке. Миноциклин, тетрациклин и азитромицин показали promising результаты. Хлоргексидин (ХГ) также применялся для предотвращения реколонизации бактерий, но исследование Heitz-Mayfield и соавт. не выявило преимуществ его использования в сочетании с механической обработкой. Более того, ХГ адсорбируется на поверхности имплантата. Kotsakis и соавт. показали, что остаточный ХГ негативно влияет на остеобласты и может нарушать биосовместимость титана, а in vitro исследование Kozlovsky и соавт. выявило большую адсорбцию на шероховатых поверхностях. ХГ также цитотоксичен для фибробластов и может замедлять заживление. Сочетание ХГ с металлическими кюретами может усиливать шероховатость поверхности, повышая адсорбцию ХГ.
Поскольку ХГ не рекомендуется для обработки имплантатов, исследуются альтернативы. Новый растительный экстракт рассматривается как перспективное натуральное решение благодаря избирательной цитотоксичности.Однако необходимы дополнительные исследования его адсорбции на имплантатах и влияния на поддерживающую терапию.
Вывод
Поддерживающая терапия критически важна для успеха и долговечности дентальных имплантатов. Однако периимплантные заболевания неизбежно возникают и требуют лечения. Периимплантный мукозит, обратимое воспалительное состояние, может прогрессировать в периимплантит без лечения, что подчеркивает важность регулярного ухода. Для предотвращения отказа имплантатов необходимо как можно раньше выявлять и лечить заболевания, ограничивая потерю кости. Дальнейшие исследования помогут усовершенствовать протоколы и разработать индивидуальные подходы к уходу для долгосрочной выживаемости имплантатов.
Авторы:
Nathan E. Estrin, DMD, MS
Jon B. Suzuki, DDS, PhD, MBA
Diana Bronstein, DDS, MS
Georgios Romanos, DDS, PhD, Prof Dr med dent































































































































































0 комментариев