В качестве цементов в ортодонтии используют различные материалы, но в данной статье основное внимание будет уделено стеклоиономерным цементам. К преимуществам СИЦ относят: низкую растворимость, способность выделять фтор и хорошие адгезивные характеристики. Также СИЦ позволяют пропускать фтор из аппликаций, наносимых местно на ткани зуба, действуя при этом как пролонгированные фтор-агенты. При смешивании СИЦ следует применять особую технику.

Из-за различных химических компонентов и разного рабочего времени все СИЦ разделены на обычные, модифицированные и композитные. Обычные и модифицированные СИЦ хорошо фиксируются на металлической поверхности, но в тоже время легко снимаются с эмали, что делает их особенно выгодными в ортодонтической практике. Данные материалы представляют собой гибрид композитного и стекло-иономерного материалов. Эти цементы обычно фасуют в специальные капсулы, а процесс постановки основан на реакции с кислотой.
Биосовместимость представляет собой способность материалов при правильном применении не наносить токсического, аллергического, канцерогенного действия. Следует сказать, что данных по биосовместимости СИЦ в ортодонтической практике все еще не имеется.
Данные по токсичности на генный аппарат, включая биосовместимость, доступны в общей сфере стоматологии, они получены из-за особой важности и влияния на канцерогенез. Исследование включало оценку генетических повреждений, восстановительной способности ДНК, метафазные хромосомные аберрации, обмен сестринскими хроматидами. Тест ДНК-комет (щелочной вариант) был проведен как быстрая, простая и надежная техника выявления повреждений ДНК в клетках млекопитающих, вызванных материалами в стоматологической практике.
Тест на цитотоксичность подразумевает быструю и стандартизированную оценку возможного вредного и токсического влияния материала на компоненты клетки. Исследование с трипановым синим может быть использовано для выявления цитотоксичности путем окрашивания мертвых клеток в голубой цвет и ядер живых клеток в желтый.
Цель данного исследования: выявить вызывают ли отобранные три стеклоиономерных цемента, применяемых в ортодонтии, поломки ДНК в фибробластах мышей (тест ДНК-комет). Для определения цитотоксичности применена окраска с трипановым синим.
Материалы и методы.
Культура клеток.
Мышиные фибробласты (3Т3-L1) получены из American Type Culture Collection и культивированы при температуре 37% и влажном воздухе, содержащем 5% СО2 и 95% О2. Для роста культуры была использована питательная среда Игла в модификации Дульбекко (Invitrogen), содержащая 25 ммоль/л глюкозы, 1 ммоль/л пирувата, 4,02 ммоль/л 1-аланил-глютамина и 10% телячьей сыворотки (Sigma, USA).
Культуру клеток из третьего пассажа отделили с помощью 0,15% трипсина (Invitrogen Corporation) в течение 5 минут. Далее добавлено 2 мл полной среды и клетки подвергнуты центрифугированию при 1000 об/мин. в течение 5 минут. Взвесь клеток была посчитана с помощью камеры Ньюбауэра и распределена в 96-луночном планшете (Corning) с плотностью 1 x 104 клеток на лунку (с концентрацией 1 x 106 / мл).
Все исследования проводились согласно нормам Этического Комитета Университета Сан-Пауло, Бразилия.
Испытание.
Протестированы следующие стекло-иономерные цементы: Vidrion C (SS White, USA - Lot 070709); Band-Lok ( Reliance Orthodontic Products Inc., Itasca, IL, USA - Lot Paste A 0802185/ Paste B 0802202) и OptiBand (Ormco Co, Orange, CA, USA-Lot 507180/507190). Состав цементов : (a) Vidrion C : (порошок) натрия фторсиликат, кальций, алюминий и полиакриловая кислота; (жидкость) тартаровая кислота и дистиллированная кислота; (b) OptiBand: мономер эфир метакрилат, инертный минеральный наполнитель, кварц, активаторы, консервант, краситель; (с) Band-Lok: гидроксиметилметакрилат, кварц инертный минеральный наполнитель и активаторы.
Порошки и пасты выше указанных СИЦ приготовлены в повышающейся конечной концентрации от 10 до 1000 мг/мл, а жидкость в разведении от 0,1 до 10%. В отрицательном контроле для обработки клеток использован DMSO (диметилсульфоксид), а в положительном контроле MMS (метилметасульфанат 10 мг/мл, Sigma Aldrich, USA). После 1 часа инкубации при 37 С клетки центрифугированы при 1000 об/мин в течение 5 минут, дважды промыты раствором и опущены в свежеприготовленный раствор. Процедура обработки для каждой отдельной выборки была проведена трижды.
Оценка цитотоксичности.
Оценка жизнеспособности клеток мышиных фибробластов производилась с помощью трипанового синего, которым окрашивали клетки после обработки материалами. Взвесь клеток смешивалась с 10 мкл 0,05% красителя с дистиллированной водой в течение 5 минут, а затем наносилась на предметной стекло и осматривалась в микроскоп. Нежизнеспособные клетки окрашивались в синий цвет. При подсчете определено около 200 окрашенных клеток.
Оценка генотоксичности
Около 1 x 104 клеток были добавлены к 120 мкл 0,5% легкоплавкой агарозы при 37С. Затем смесь размещена на предметном стекле с 1,5% агарозой. После быстрого затвердевания агарозы в холодильной камере, покровное стекло было снято и слои материала были опущены в лизирующий раствор (2,5 M NaCl, 100 mM EDTA. 10mM буфер HCl, pH 10, 1% саркозинат натрия с Triton X-100 и 10% DMSO) на 1 час. Затем слои материала опущены на 20 минут в щелочной буфер (pH>13) и подвергнуты электрофорезу в течение 20 минут при 25 В (0,86 В/см) и 300 мА. После электрофореза культура нейтрализована 0,4 М Tris-HCl (pH 7,5), фиксирована этанолом и оставлена на хранение при комнатной температуре до анализа. Для предотвращения разрешительного влияния на ДНК ультрафиолетового излучения, все этапы проводились при уменьшенном освещении.
50 случайно захваченных комет (25 клеток из каждого слоя) были обследованы опытным специалистом путем проведения слепого анализа. Осмотр проводился при 400x увеличении, используя флюоресцентный микроскоп (Olympus, Optical Cp. Ltd, Tokyo, Japan), соединенный с черно-белой камерой анализирующей системы (Comet Assay II, Perceptive Instruments, Haverhill, UK), предварительно калиброванной согласно инструкции производителя. Компьютеризированная система получила изображения, произвела подсчет для каждой клетки, определила клеточные компоненты комет и показала результаты по данным параметрам. Неповрежденные клетки с интактным ядром не имеют «хвоста», а поврежденные выглядят в виде "кометы". "Хвост" указывает на повреждение ДНК, а его длина соответствует объему данных повреждений. Среднее значение "хвостового момента" было принято как показатель повреждения ДНК данного образца.
Статистические методы
Параметры, полученные из теста ДНК-комет и теста на жизнеспособность клеток, были оценены с помощью критерия Краскела-Уолиса и теста Dunn, а также программного обеспечения SigmaStat версии 1.0 (Jadel Scientific, USA). P<0.05 принималось как статистически значимое.
Результаты
В отрицательной контрольной группы жизнеспособных клеток было более 90%. В положительном контроле MMS вызвал высокий уровень миграции ДНК и высокую жизнеспособность (87%). Цитотоксичность компонентов СИЦ зависела от их концентрации. Статистически значимая разница (P<0.05) цитотоксичности была замечена и у порошка, и у жидкости Vidrion C в исследуемых концентрациях. Исключение составила лишь группа, в которой использовалась наименьшая концентрация порошка. OptiBand показал схожие результаты с гибелью клеток при наивысших концентрациях. Band-Lok также способен индуцировать цитотоксичность при наивысших концентрациях.
Тест ДНК-комет был использован для оценки повреждений ДНК in vitro в мышиных фибробластах. Поломки в нити ДНК наблюдались в виде «хвостового момента» в 50 кометах на образец. Выяснено, что Viridon C (порошок) не способен вызывать генные повреждения даже при высоких концентрациях материала. В то время как Band-Lok и OptiBand влияют на большое число повреждений ДНК.
Обсуждение
Цель данного исследования выявить цитотоксичность и генотоксичность ортодонтических цементов в исследовании in vitro на мышиных фибробластах. Для определения параметров использовался тест ДНК-комет и окраска трипановым синим. СИЦ были выбраны как самые часто используемые материалы в ортодонтической практике. Vidrion C является обычным цементом, а BandLok и OptiBand модифицированными СИЦ. До настоящего момента подобных оценок еще не проводилось.
Фото 1: Изображение "комет" в мышиных фибробластах, обработанных ортодонтическим цементом. Окраска Syber green, x40.
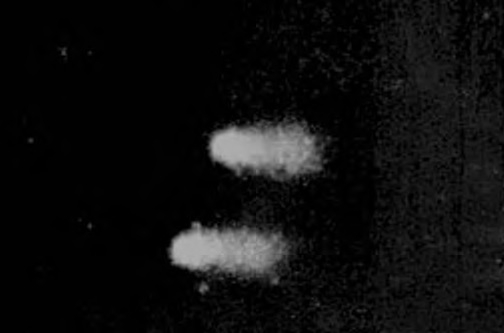
In vitro исследования являются достаточно простыми, недорогими, предоставляют большое количество важной информации, проводятся при контролируемых условиях и могут выявлять механизмы токсичного влияния на клетки. Исследования клеточных культур обычно проводят для оценки генотоксичности. Наш выбор клеточного материала (мышиных фибробластов) позволил исключить возрастные, метаболические и гормональные факторы, а также получить достаточно точные сведения по генотоксичному потенциалу стоматологических материалов.
Также необходимо поставить акцент на том, что в данном исследовании порошок и жидкость материалов использовались отдельно. Это было сделано для того, чтобы получить более точные сведения: какой именно компонент смеси может являться генотоксичным и цитотоксичным.
В исследовании применялся трипановый синий, так как данная окраска рекомендована специалистами ДНК-комет теста, как надежный способ выявить цитотоксический потенциал химических соединений в исследованиях, затрагивающих так же выявление генотоксичности. Окраска трипановым синим показала, что все цементы в наивысших концентрациях проявляют сильнейший цитотоксический эффект, а со снижением концентрации снижается и токсичность материалов.Virdion C проявил невероятно сильную токсичность на мышиные фибробласты. Также удалось выяснить, что главной целью приложения для токсинов являлась мембрана, которая при контакте повреждалась достаточно быстро.
Исследования, проведенные ранее нашей группой, показали высокую цитотоксичность модифицированных СИЦ in vitro. Кроме того данные материалы проявили ингибирующее действие на рост и дифференциацию остеобластов. В исследовании in vitro СИЦ обладали также низкой биосовместимостью, так как в опыте Vitrebond отмечался коагуляционный некроз и воспалительный инфильтрат. Говоря в целом, можно утверждать, что СИЦ приводят к гибели клеток. Дальнейшее исследования цитотоксичности, основанные на оценке МТТ и белковом синтезе, будут весьма полезными для выявления ранних токсических эффектов материалов особенно в низких концентрациях.
Цитотоксичные материалы вызывают стойкие поломки клеточных структур, которые значительно повышают количество дефектов и в ДНК. Мы рекомендуем не учитывать тест ДНК- комет на образцах, пострадавших более чем на 30% от цитотоксичности. При таком подходе, генотоксичность оценивается отдельно и независимо от цитотоксичности, не искажая результаты. Более того, "кометы" без четко оформленных "головок", т.е. кометы, ДНК которых практически полностью мигрировала в "хвост" под действием электрофореза, были также исключены посредством графического анализа. Исключение данных изображений в виде "облаков" происходило из-за предположения, что эти клетки являлись уже погибшими после цитотоксичного влияния СИЦ, а не массивного повреждения ДНК.
Параметры "комет" оценивались с помощью компьютерного анализа, измеряя как длину ДНК миграции, так и интенсивность "хвоста". Данный метод лучше остальных подтвердил наличие большого количества дефектов в ДНК. Статистическая оценка показала особенно высокую генотоксичность Band-Lok и OptiBand. Также отрицательное влияние на клетки было обнаружено и при применении всех разведений порошка и жидкости Vidrion C. Полученные результаты подтвердили предыдущие исследования.
Следует упомянуть, что повреждение структуры ДНК не может говорить о мутагенном влиянии на наследственный материал.
Подводя итог, можно заявить, что некоторые стекло-иономерные цементы оказывают цитотоксический и генотоксический эффекты, особенно при применении этих материалов в высоких концентрациях.
Авторы:
Fernanda Angelieri, кафедра ортодонтии, Sao Paulo Methodist University, Sao Bernardo do Campo
Renata P. Joias, кафедра ортодонтии, Sao Paulo Methodist University, Sao Bernardo do Campo
Eduardo Bresciani, кафедра восстановительной стоматологии, UNESP, Sao Jose dos Campos, Brazil
Juliana Noguti, кафедра бионаук, Federal University of Sao Paulo, UNIFESP, Santos, SP
Daniel A. Ribeiro, кафедра бионаук, Federal University of Sao Paulo, UNIFESP, Santos, SP
В качестве цементов в ортодонтии используют различные материалы, но в данной статье основное внимание будет уделено стеклоиономерным цементам. К преимуществам СИЦ относят: низкую растворимость, способность выделять фтор и хорошие адгезивные характеристики. Также СИЦ позволяют пропускать фтор из аппликаций, наносимых местно на ткани зуба, действуя при этом как пролонгированные фтор-агенты. При смешивании СИЦ следует применять особую технику.

Из-за различных химических компонентов и разного рабочего времени все СИЦ разделены на обычные, модифицированные и композитные. Обычные и модифицированные СИЦ хорошо фиксируются на металлической поверхности, но в тоже время легко снимаются с эмали, что делает их особенно выгодными в ортодонтической практике. Данные материалы представляют собой гибрид композитного и стекло-иономерного материалов. Эти цементы обычно фасуют в специальные капсулы, а процесс постановки основан на реакции с кислотой.
Биосовместимость представляет собой способность материалов при правильном применении не наносить токсического, аллергического, канцерогенного действия. Следует сказать, что данных по биосовместимости СИЦ в ортодонтической практике все еще не имеется.
Данные по токсичности на генный аппарат, включая биосовместимость, доступны в общей сфере стоматологии, они получены из-за особой важности и влияния на канцерогенез. Исследование включало оценку генетических повреждений, восстановительной способности ДНК, метафазные хромосомные аберрации, обмен сестринскими хроматидами. Тест ДНК-комет (щелочной вариант) был проведен как быстрая, простая и надежная техника выявления повреждений ДНК в клетках млекопитающих, вызванных материалами в стоматологической практике.
Тест на цитотоксичность подразумевает быструю и стандартизированную оценку возможного вредного и токсического влияния материала на компоненты клетки. Исследование с трипановым синим может быть использовано для выявления цитотоксичности путем окрашивания мертвых клеток в голубой цвет и ядер живых клеток в желтый.
Цель данного исследования: выявить вызывают ли отобранные три стеклоиономерных цемента, применяемых в ортодонтии, поломки ДНК в фибробластах мышей (тест ДНК-комет). Для определения цитотоксичности применена окраска с трипановым синим.
Материалы и методы.
Культура клеток.
Мышиные фибробласты (3Т3-L1) получены из American Type Culture Collection и культивированы при температуре 37% и влажном воздухе, содержащем 5% СО2 и 95% О2. Для роста культуры была использована питательная среда Игла в модификации Дульбекко (Invitrogen), содержащая 25 ммоль/л глюкозы, 1 ммоль/л пирувата, 4,02 ммоль/л 1-аланил-глютамина и 10% телячьей сыворотки (Sigma, USA).
Культуру клеток из третьего пассажа отделили с помощью 0,15% трипсина (Invitrogen Corporation) в течение 5 минут. Далее добавлено 2 мл полной среды и клетки подвергнуты центрифугированию при 1000 об/мин. в течение 5 минут. Взвесь клеток была посчитана с помощью камеры Ньюбауэра и распределена в 96-луночном планшете (Corning) с плотностью 1 x 104 клеток на лунку (с концентрацией 1 x 106 / мл).
Все исследования проводились согласно нормам Этического Комитета Университета Сан-Пауло, Бразилия.
Испытание.
Протестированы следующие стекло-иономерные цементы: Vidrion C (SS White, USA - Lot 070709); Band-Lok ( Reliance Orthodontic Products Inc., Itasca, IL, USA - Lot Paste A 0802185/ Paste B 0802202) и OptiBand (Ormco Co, Orange, CA, USA-Lot 507180/507190). Состав цементов : (a) Vidrion C : (порошок) натрия фторсиликат, кальций, алюминий и полиакриловая кислота; (жидкость) тартаровая кислота и дистиллированная кислота; (b) OptiBand: мономер эфир метакрилат, инертный минеральный наполнитель, кварц, активаторы, консервант, краситель; (с) Band-Lok: гидроксиметилметакрилат, кварц инертный минеральный наполнитель и активаторы.
Порошки и пасты выше указанных СИЦ приготовлены в повышающейся конечной концентрации от 10 до 1000 мг/мл, а жидкость в разведении от 0,1 до 10%. В отрицательном контроле для обработки клеток использован DMSO (диметилсульфоксид), а в положительном контроле MMS (метилметасульфанат 10 мг/мл, Sigma Aldrich, USA). После 1 часа инкубации при 37 С клетки центрифугированы при 1000 об/мин в течение 5 минут, дважды промыты раствором и опущены в свежеприготовленный раствор. Процедура обработки для каждой отдельной выборки была проведена трижды.
Оценка цитотоксичности.
Оценка жизнеспособности клеток мышиных фибробластов производилась с помощью трипанового синего, которым окрашивали клетки после обработки материалами. Взвесь клеток смешивалась с 10 мкл 0,05% красителя с дистиллированной водой в течение 5 минут, а затем наносилась на предметной стекло и осматривалась в микроскоп. Нежизнеспособные клетки окрашивались в синий цвет. При подсчете определено около 200 окрашенных клеток.
Оценка генотоксичности
Около 1 x 104 клеток были добавлены к 120 мкл 0,5% легкоплавкой агарозы при 37С. Затем смесь размещена на предметном стекле с 1,5% агарозой. После быстрого затвердевания агарозы в холодильной камере, покровное стекло было снято и слои материала были опущены в лизирующий раствор (2,5 M NaCl, 100 mM EDTA. 10mM буфер HCl, pH 10, 1% саркозинат натрия с Triton X-100 и 10% DMSO) на 1 час. Затем слои материала опущены на 20 минут в щелочной буфер (pH>13) и подвергнуты электрофорезу в течение 20 минут при 25 В (0,86 В/см) и 300 мА. После электрофореза культура нейтрализована 0,4 М Tris-HCl (pH 7,5), фиксирована этанолом и оставлена на хранение при комнатной температуре до анализа. Для предотвращения разрешительного влияния на ДНК ультрафиолетового излучения, все этапы проводились при уменьшенном освещении.
50 случайно захваченных комет (25 клеток из каждого слоя) были обследованы опытным специалистом путем проведения слепого анализа. Осмотр проводился при 400x увеличении, используя флюоресцентный микроскоп (Olympus, Optical Cp. Ltd, Tokyo, Japan), соединенный с черно-белой камерой анализирующей системы (Comet Assay II, Perceptive Instruments, Haverhill, UK), предварительно калиброванной согласно инструкции производителя. Компьютеризированная система получила изображения, произвела подсчет для каждой клетки, определила клеточные компоненты комет и показала результаты по данным параметрам. Неповрежденные клетки с интактным ядром не имеют «хвоста», а поврежденные выглядят в виде "кометы". "Хвост" указывает на повреждение ДНК, а его длина соответствует объему данных повреждений. Среднее значение "хвостового момента" было принято как показатель повреждения ДНК данного образца.
Статистические методы
Параметры, полученные из теста ДНК-комет и теста на жизнеспособность клеток, были оценены с помощью критерия Краскела-Уолиса и теста Dunn, а также программного обеспечения SigmaStat версии 1.0 (Jadel Scientific, USA). P<0.05 принималось как статистически значимое.
Результаты
В отрицательной контрольной группы жизнеспособных клеток было более 90%. В положительном контроле MMS вызвал высокий уровень миграции ДНК и высокую жизнеспособность (87%). Цитотоксичность компонентов СИЦ зависела от их концентрации. Статистически значимая разница (P<0.05) цитотоксичности была замечена и у порошка, и у жидкости Vidrion C в исследуемых концентрациях. Исключение составила лишь группа, в которой использовалась наименьшая концентрация порошка. OptiBand показал схожие результаты с гибелью клеток при наивысших концентрациях. Band-Lok также способен индуцировать цитотоксичность при наивысших концентрациях.
Тест ДНК-комет был использован для оценки повреждений ДНК in vitro в мышиных фибробластах. Поломки в нити ДНК наблюдались в виде «хвостового момента» в 50 кометах на образец. Выяснено, что Viridon C (порошок) не способен вызывать генные повреждения даже при высоких концентрациях материала. В то время как Band-Lok и OptiBand влияют на большое число повреждений ДНК.
Обсуждение
Цель данного исследования выявить цитотоксичность и генотоксичность ортодонтических цементов в исследовании in vitro на мышиных фибробластах. Для определения параметров использовался тест ДНК-комет и окраска трипановым синим. СИЦ были выбраны как самые часто используемые материалы в ортодонтической практике. Vidrion C является обычным цементом, а BandLok и OptiBand модифицированными СИЦ. До настоящего момента подобных оценок еще не проводилось.
Фото 1: Изображение "комет" в мышиных фибробластах, обработанных ортодонтическим цементом. Окраска Syber green, x40.

In vitro исследования являются достаточно простыми, недорогими, предоставляют большое количество важной информации, проводятся при контролируемых условиях и могут выявлять механизмы токсичного влияния на клетки. Исследования клеточных культур обычно проводят для оценки генотоксичности. Наш выбор клеточного материала (мышиных фибробластов) позволил исключить возрастные, метаболические и гормональные факторы, а также получить достаточно точные сведения по генотоксичному потенциалу стоматологических материалов.
Также необходимо поставить акцент на том, что в данном исследовании порошок и жидкость материалов использовались отдельно. Это было сделано для того, чтобы получить более точные сведения: какой именно компонент смеси может являться генотоксичным и цитотоксичным.
В исследовании применялся трипановый синий, так как данная окраска рекомендована специалистами ДНК-комет теста, как надежный способ выявить цитотоксический потенциал химических соединений в исследованиях, затрагивающих так же выявление генотоксичности. Окраска трипановым синим показала, что все цементы в наивысших концентрациях проявляют сильнейший цитотоксический эффект, а со снижением концентрации снижается и токсичность материалов.Virdion C проявил невероятно сильную токсичность на мышиные фибробласты. Также удалось выяснить, что главной целью приложения для токсинов являлась мембрана, которая при контакте повреждалась достаточно быстро.
Исследования, проведенные ранее нашей группой, показали высокую цитотоксичность модифицированных СИЦ in vitro. Кроме того данные материалы проявили ингибирующее действие на рост и дифференциацию остеобластов. В исследовании in vitro СИЦ обладали также низкой биосовместимостью, так как в опыте Vitrebond отмечался коагуляционный некроз и воспалительный инфильтрат. Говоря в целом, можно утверждать, что СИЦ приводят к гибели клеток. Дальнейшее исследования цитотоксичности, основанные на оценке МТТ и белковом синтезе, будут весьма полезными для выявления ранних токсических эффектов материалов особенно в низких концентрациях.
Цитотоксичные материалы вызывают стойкие поломки клеточных структур, которые значительно повышают количество дефектов и в ДНК. Мы рекомендуем не учитывать тест ДНК- комет на образцах, пострадавших более чем на 30% от цитотоксичности. При таком подходе, генотоксичность оценивается отдельно и независимо от цитотоксичности, не искажая результаты. Более того, "кометы" без четко оформленных "головок", т.е. кометы, ДНК которых практически полностью мигрировала в "хвост" под действием электрофореза, были также исключены посредством графического анализа. Исключение данных изображений в виде "облаков" происходило из-за предположения, что эти клетки являлись уже погибшими после цитотоксичного влияния СИЦ, а не массивного повреждения ДНК.
Параметры "комет" оценивались с помощью компьютерного анализа, измеряя как длину ДНК миграции, так и интенсивность "хвоста". Данный метод лучше остальных подтвердил наличие большого количества дефектов в ДНК. Статистическая оценка показала особенно высокую генотоксичность Band-Lok и OptiBand. Также отрицательное влияние на клетки было обнаружено и при применении всех разведений порошка и жидкости Vidrion C. Полученные результаты подтвердили предыдущие исследования.
Следует упомянуть, что повреждение структуры ДНК не может говорить о мутагенном влиянии на наследственный материал.
Подводя итог, можно заявить, что некоторые стекло-иономерные цементы оказывают цитотоксический и генотоксический эффекты, особенно при применении этих материалов в высоких концентрациях.
Авторы:
Fernanda Angelieri, кафедра ортодонтии, Sao Paulo Methodist University, Sao Bernardo do Campo
Renata P. Joias, кафедра ортодонтии, Sao Paulo Methodist University, Sao Bernardo do Campo
Eduardo Bresciani, кафедра восстановительной стоматологии, UNESP, Sao Jose dos Campos, Brazil
Juliana Noguti, кафедра бионаук, Federal University of Sao Paulo, UNIFESP, Santos, SP
Daniel A. Ribeiro, кафедра бионаук, Federal University of Sao Paulo, UNIFESP, Santos, SP





























































































































































0 комментариев