Кариес в раннем детском возрасте – заболевание у младенцев и дошкольников, характеризующееся глубокими кариозными поражениями, способное повлиять на здоровье зубов и организма ребенка на протяжении жизни. В ряде случаев степень кариеса настолько велика, что единственным способом лечения становится хирургическое вмешательство стоматолога.
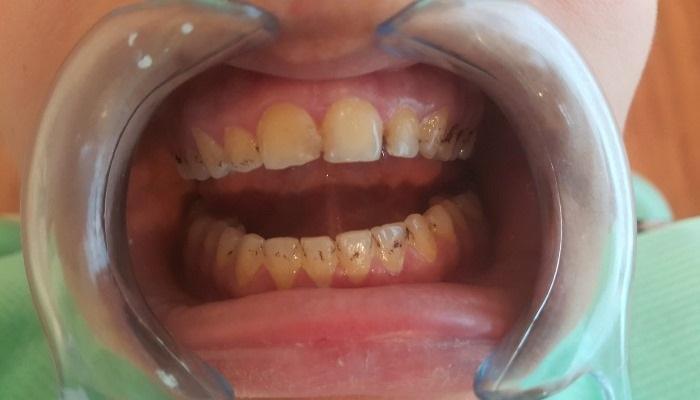
«Современные терапевтические методы лечения кариеса в раннем детском возрасте характеризуются невысокой эффективностью. В научных работах сообщается, что заболевания, связанные с биопленками, вызваны деятельностью разных патогенов, в том числе и бактериальных, и грибковых. Поэтому лечение, направленное на уничтожение только одного типа микроорганизмов, окажется нерезультативным. Мне кажется, что данная работа подвигнет ученых к поиску альтернативного способа уничтожения полимикробной биопленки, который будет содержать компоненты, действующие как на грибки, так и на бактерии», - говорит преподаватель факультета Ортодонтии и кафедры Педиатрической стоматологии в Стоматологической школе университета Пенсильвании Хйюн (Майкл) Коо.
Исследование проводил д.н. Донгуеоп Ким совместно с М. Коо. Кроме того, в работе приняли участие коллеги из университета Тель-Авива и университета Висконсин-Мэдисон.
В течение нескольких лет исследователи проводили анализ состава зубного налета у детей с кариесом и обнаружили, что биопленка содержит грибок Candida albicans. Данный вид грибка обычно населяет поверхность слизистой оболочки. Также в налете обнаружили бактерию Streptococcus mutans – одного из известных возбудителей кариеса.
Проводя эксперимент в лаборатории М. Коо, обнаружили, что бактерии Streptococcus mutans производят энзим GtfB, связывающий их с грибком. При попадании сахара в ротовую полость, на поверхности грибка образуется липкий полимерный матрикс, благодаря чему грибок надежно прицепляется к поверхности зуба, где начинает взаимодействовать с бактериями. Вместе эти микроорганизмы продолжают активную жизнедеятельность, приводя к тяжелым формам кариеса. Это процесс был продемонстрирован на мышиной модели.
Открыв данный процесс, М. Коо и Д. Ким решили предпринять двунаправленный подход для разрушения взаимоусиливающей связи между бактериями и грибком, приводящей к росту биопленок. «Первоначально, мы обратили внимание на стандартные подходы, используемые в стоматологии для лечения и профилактики либо грибковых, либо бактериальных инфекций».
В итоге для борьбы с грибком был выбран препарат флуконазол, а в качестве антисептика с антибактериальными свойствами выбрали повидон-йод. При использовании каждого препарата в отдельности на биопленках, выращенных на зубоподобном материале в лаборатории, удалить налет удалось только частично. Это доказало, что применение только одного препарата неэффективно для удаления полимикробных биопленок. Однако при комбинации двух препаратов, результаты оказались более обнадеживающими.
«С помощью такого подхода удалось полностью устранить грибковую инфекцию, как в эксперименте на искусственной биопленке, выращенной в лабораторных условиях, так и в условиях in vivo на животной модели», - говорит М.Коо. При этом полностью избавиться от бактериальной активности этим способом не удалось.
Чтобы объяснить, почему комбинированный подход оказался эффективен в отношении грибка C. Albicans, при этом существенно не повлиял на популяцию бактерий, исследователи изучили снимки, выполненные с помощью микроскопа с высоким разрешением. На снимках видны биопленки под воздействием разных комбинаций препаратов. Ученые наблюдали, что при нанесении только флуконазола или без добавления препаратов на поверхность пленки, грибок обильно покрывался липким матриксом, который, вероятно, выступал в качестве защитного слоя от действия противогрибкового препарата. Однако при добавлении повидон-йода, слой защитного матрикса значительно уменьшался, и грибок становился подвержен действию флуконазола.
«Мы решили, что это интересное наблюдение. И стали изучать другие исследования на данную тему. Обнаружили, что медикаменты с содержанием йода могут подавлять активность энзима GtfB. Проведя ряд экспериментов, мы наблюдали, что повидон-йод способен значительно угнетать производство липкого матрикса. Оказалось, что препарат в 100 раз сильнее действует, как разрушитель матрикса, образуемого грибками, чем как антибактериальное средство», - говорит М. Коо.
Так ученые поняли, что выделяемый грибком матрикс служит в качестве защитного слоя, не пропускающего флуконазол к месту назначения для уничтожения клеток грибка. Чтобы проверить, как уничтожение матрикса повлияет на способность препарата проникать к клеткам грибка, исследователи обратились в университет Тель-Авива. В лаборатории университета флуконазол окрасили флуоресцентным веществом, чтобы проследить его путь сквозь матрикс.
Далее выполнили замедленную микросъемку процесса, на которой было показано, как флуконазол застревает в матриксе, и большой объем препарата не достигает клеток грибка. Это было подтверждено количественно, после непосредственного подсчета молекул флуконазола, меченных радиоактивным изотопом, оставшихся в матриксе. И напротив, при введении повидона-йода матрикс разрушался и флуконазол быстро продвигался сквозь него к клеткам грибка, что также было показано на другой серии снимков.
Исследователи проверили три разных подхода для уничтожения матрикса, либо напрямую разрушая его структуру, либо используя бактерии, действующие на энзим GtfB. В результате обнаружили, что противогрибковые способности флуконазола могут быть полностью восстановлены, что подтверждает роль бактериального матрикса в усилении защиты грибка от противогрибковых препаратов.
Грибки сами по себе обладают механизмами защиты от медикаментов, но защитный слой матрикса только усиливает их живучесть.
Авторы работы надеются, что на основе исследования могут быть разработаны новые подходы к лечению бактериально-грибковых инфекций, вызывающих кариес в раннем детском возрасте и, вероятно, другие заболевания. На данный момент исследователи стараются задействовать нанотехнологии для создания направленных методик уничтожения матрикса, а также грибка и бактерий в составе биопленок.
Кариес в раннем детском возрасте – заболевание у младенцев и дошкольников, характеризующееся глубокими кариозными поражениями, способное повлиять на здоровье зубов и организма ребенка на протяжении жизни. В ряде случаев степень кариеса настолько велика, что единственным способом лечения становится хирургическое вмешательство стоматолога.

«Современные терапевтические методы лечения кариеса в раннем детском возрасте характеризуются невысокой эффективностью. В научных работах сообщается, что заболевания, связанные с биопленками, вызваны деятельностью разных патогенов, в том числе и бактериальных, и грибковых. Поэтому лечение, направленное на уничтожение только одного типа микроорганизмов, окажется нерезультативным. Мне кажется, что данная работа подвигнет ученых к поиску альтернативного способа уничтожения полимикробной биопленки, который будет содержать компоненты, действующие как на грибки, так и на бактерии», - говорит преподаватель факультета Ортодонтии и кафедры Педиатрической стоматологии в Стоматологической школе университета Пенсильвании Хйюн (Майкл) Коо.
Исследование проводил д.н. Донгуеоп Ким совместно с М. Коо. Кроме того, в работе приняли участие коллеги из университета Тель-Авива и университета Висконсин-Мэдисон.
В течение нескольких лет исследователи проводили анализ состава зубного налета у детей с кариесом и обнаружили, что биопленка содержит грибок Candida albicans. Данный вид грибка обычно населяет поверхность слизистой оболочки. Также в налете обнаружили бактерию Streptococcus mutans – одного из известных возбудителей кариеса.
Проводя эксперимент в лаборатории М. Коо, обнаружили, что бактерии Streptococcus mutans производят энзим GtfB, связывающий их с грибком. При попадании сахара в ротовую полость, на поверхности грибка образуется липкий полимерный матрикс, благодаря чему грибок надежно прицепляется к поверхности зуба, где начинает взаимодействовать с бактериями. Вместе эти микроорганизмы продолжают активную жизнедеятельность, приводя к тяжелым формам кариеса. Это процесс был продемонстрирован на мышиной модели.
Открыв данный процесс, М. Коо и Д. Ким решили предпринять двунаправленный подход для разрушения взаимоусиливающей связи между бактериями и грибком, приводящей к росту биопленок. «Первоначально, мы обратили внимание на стандартные подходы, используемые в стоматологии для лечения и профилактики либо грибковых, либо бактериальных инфекций».
В итоге для борьбы с грибком был выбран препарат флуконазол, а в качестве антисептика с антибактериальными свойствами выбрали повидон-йод. При использовании каждого препарата в отдельности на биопленках, выращенных на зубоподобном материале в лаборатории, удалить налет удалось только частично. Это доказало, что применение только одного препарата неэффективно для удаления полимикробных биопленок. Однако при комбинации двух препаратов, результаты оказались более обнадеживающими.
«С помощью такого подхода удалось полностью устранить грибковую инфекцию, как в эксперименте на искусственной биопленке, выращенной в лабораторных условиях, так и в условиях in vivo на животной модели», - говорит М.Коо. При этом полностью избавиться от бактериальной активности этим способом не удалось.
Чтобы объяснить, почему комбинированный подход оказался эффективен в отношении грибка C. Albicans, при этом существенно не повлиял на популяцию бактерий, исследователи изучили снимки, выполненные с помощью микроскопа с высоким разрешением. На снимках видны биопленки под воздействием разных комбинаций препаратов. Ученые наблюдали, что при нанесении только флуконазола или без добавления препаратов на поверхность пленки, грибок обильно покрывался липким матриксом, который, вероятно, выступал в качестве защитного слоя от действия противогрибкового препарата. Однако при добавлении повидон-йода, слой защитного матрикса значительно уменьшался, и грибок становился подвержен действию флуконазола.
«Мы решили, что это интересное наблюдение. И стали изучать другие исследования на данную тему. Обнаружили, что медикаменты с содержанием йода могут подавлять активность энзима GtfB. Проведя ряд экспериментов, мы наблюдали, что повидон-йод способен значительно угнетать производство липкого матрикса. Оказалось, что препарат в 100 раз сильнее действует, как разрушитель матрикса, образуемого грибками, чем как антибактериальное средство», - говорит М. Коо.
Так ученые поняли, что выделяемый грибком матрикс служит в качестве защитного слоя, не пропускающего флуконазол к месту назначения для уничтожения клеток грибка. Чтобы проверить, как уничтожение матрикса повлияет на способность препарата проникать к клеткам грибка, исследователи обратились в университет Тель-Авива. В лаборатории университета флуконазол окрасили флуоресцентным веществом, чтобы проследить его путь сквозь матрикс.
Далее выполнили замедленную микросъемку процесса, на которой было показано, как флуконазол застревает в матриксе, и большой объем препарата не достигает клеток грибка. Это было подтверждено количественно, после непосредственного подсчета молекул флуконазола, меченных радиоактивным изотопом, оставшихся в матриксе. И напротив, при введении повидона-йода матрикс разрушался и флуконазол быстро продвигался сквозь него к клеткам грибка, что также было показано на другой серии снимков.
Исследователи проверили три разных подхода для уничтожения матрикса, либо напрямую разрушая его структуру, либо используя бактерии, действующие на энзим GtfB. В результате обнаружили, что противогрибковые способности флуконазола могут быть полностью восстановлены, что подтверждает роль бактериального матрикса в усилении защиты грибка от противогрибковых препаратов.
Грибки сами по себе обладают механизмами защиты от медикаментов, но защитный слой матрикса только усиливает их живучесть.
Авторы работы надеются, что на основе исследования могут быть разработаны новые подходы к лечению бактериально-грибковых инфекций, вызывающих кариес в раннем детском возрасте и, вероятно, другие заболевания. На данный момент исследователи стараются задействовать нанотехнологии для создания направленных методик уничтожения матрикса, а также грибка и бактерий в составе биопленок.































































































































































0 комментариев