Периимплантит — это воспалительное состояние, опосредованное биопленкой, связанное с прогрессирующей потерей опорных тканей и представляющее значительную проблему для клиницистов во всем мире. Поскольку нехирургическая терапия обладает ограниченной эффективностью, для лечения этого заболевания часто требуется хирургическое вмешательство. В данной статье рассматриваются факторы, связанные с оператором, при лечении периимплантита, и представлен поэтапный подход к восьми ключевым аспектам успешного регенеративного/репаративного лечения дефектов при периимплантите. Эти ключевые аспекты направлены на оптимизацию клинических результатов для различных потребностей пациентов и анатомии дефектов. Они включают оценку опыта оператора, анализ рисков и дизайн имплантационной реставрации, а также нехирургические и хирургические методы лечения, такие как использование биологических материалов и их производных, послеоперационный протокол и индивидуальную программу пародонтального поддерживающего лечения. Соблюдение этих восьми ключевых аспектов позволяет клиницистам достичь успешных долгосрочных результатов при регенеративном лечении дефектов периимплантита.
Хирургия периимплантита с отслаиванием лоскута направлена на обеспечение доступа к поверхности имплантата для удаления мягких и твердых отложений биопленки и остатков цемента, что способствует заживлению и снижает дальнейшее прогрессирование заболевания. Реконструктивные методы направлены на регенерацию костного дефекта и достижение реоссинтеграции при закрытии патологического периимплантационного кармана. Лечение периимплантационных дефектов в основном зависит от понимания морфологии дефекта и других связанных с ним топографических характеристик.
Инструменты оценки риска и клинические контрольные списки полезны для предотвращения нежелательных осложнений. Некоторые из авторов данной статьи ранее описывали контрольный список из 10 ключевых аспектов для немедленной установки имплантата в эстетических зонах, а также контрольный список из семи ключевых аспектов для лечения внутрикостных пародонтальных дефектов. Все процедуры имплантации связаны с биологическим ответом организма («ответ хозяина»), микробиологической средой («микробиология») и факторами, связанными с оператором («человеческий фактор»). В данной статье рассматривается этот процесс и представлены восемь ключевых аспектов регенеративного лечения периимплантитных дефектов. Каждый ключевой аспект может быть связан с одной или несколькими из этих трех категорий.
Ниже приведены восемь ключевых моментов реконструктивной терапии внутрикостных дефектов, связанных с периимплантитом.
- Предоперационная оценка: учитываются факторы хирурга, пациента, состояние имплантата и конфигурация дефекта; проводится PIDRA-анализ.
- Нехирургическая терапия: направлена на изменение био-пленки, но ограниченно эффективна в удалении налета и камня.
- Хирургическая подготовка: определение дефекта для выбора резективного или регенеративного подхода; учитывается тип коронки (погруженная, непогруженная, с формирователем десны).
Хирургические этапы:
- Создание доступа: формируются слизисто-надкостничные лоскуты, уточняется конфигурация дефекта, возможна пластика мягких тканей.
- Деконтаминация поверхности имплантата: механическими, химическими, электролитическими или комбинированными методами.
- Работа с супракрестальной частью: при оголении шероховатой поверхности имплантата выполняется имплантопластика.
- Реконструкция: применяется регенерация тканей с костными трансплантатами, мембранами и биологическими агентами (например, rhPDGF-BB, EMD).
Поддержание:
- Регулярная поддерживающая терапия: каждые 2–3 недели первые 3 месяца, затем каждые 3–4 месяца; включает полировку и контроль налета.
Восемь ключевых аспектов регенеративного лечения дефектов периимплантита
Ключевой аспект № 1: Факторы оператора и пациента, состояние имплантата и периимплантационная конфигурация (человеческий фактор)
Использование контрольного списка позволяет воспользоваться коллективным опытом его разработчиков, обеспечивая последовательные, эффективные и стандартизированные протоколы лечения. Интересно, что в различных отраслях, включая медицину и стоматологию, растет внимание к «человеческому фактору» как источнику ошибок, включая лечение периимплантита. Опыт и навыки хирурга, а также стрессовые факторы окружающей среды играют критическую роль в успехе этих процедур. Методы, аналогичные тем, что используются в авиационных контрольных списках и ситуационной осведомленности, могут помочь решить проблемы человеческого фактора и улучшить клинические результаты.
При выполнении Ключевого аспекта № 1 рекомендуется провести полное пародонтальное и окклюзионное обследование, а также рентгенологическую оценку (включая внутриротовые рентгенограммы и/или конусно-лучевую компьютерную томографию), а также оценить положение имплантата и протеза, так как эти факторы могут способствовать прогрессированию периимплантита. Помимо медицинского и стоматологического анамнеза, пародонтальное, окклюзионное и рентгенологическое обследования анализируются и обсуждаются с пациентом во время предварительной консультации «колено к колену и глаза в глаза». На основе ранее опубликованных исследований и рекомендаций по лечению в данной статье представлен инструмент оценки риска дефектов периимплантита (PIDRA), который помогает клиницистам выявить влияющие факторы для достижения успешных результатов при выполнении регенеративных процедур. PIDRA обеспечивает предсказуемую и стандартизированную коммуникацию с пациентом и между специалистами независимо от уровня риска.
Система оценки риска дефекта при периимплантите (PIDRA). Она делит факторы на три категории — низкий, средний и высокий риск — в зависимости от характеристик оператора, пациента, имплантата и периимплантатных тканей.
- Факторы оператора: опыт хирурга, уровень стресса, использование чек-листа.
- Факторы пациента: общее здоровье, курение, контроль налета, наличие пародонтита, приверженность поддерживающей терапии.
- Факторы имплантата: очищаемость протеза, тип фиксации (винтовая/цементная), состояние коронки.
- Конфигурация тканей: наличие или отсутствие рецессии мягких тканей, толщина и ширина кератинизированной десны, доступ для очистки резьбы имплантата, морфология дефекта, выраженность резорбции кости.
- При низком риске — хороший прогноз: опытный хирург, здоровый пациент без пародонтита, некурящий, хороший контроль налета, винтовая фиксация, достаточная слизистая и кость.
- При среднем риске — отдельные факторы осложняют лечение (например, легкое курение, частично очищаемый протез, тонкая слизистая, дефект III класса).
- При высоком риске — прогноз хуже: малоопытный хирург, тяжелое общее состояние пациента, курение >10 сигарет/день, плохой контроль налета, история пародонтита, цементная фиксация, рецессия мягких тканей, дефицит слизистой, потеря >50% кости.
Перед началом любой терапии периимплантита необходимо рассмотреть возможность корректировки или замены протеза для оптимизации результатов лечения. Поэтому обсуждение с пациентом необходимости этого подготовительного этапа, а также сроков и стоимости является важным перед любым нехирургическим или хирургическим вмешательством.
Ключевой аспект № 2: Нехирургическая терапия (человеческий фактор)
PIDRA предполагает, что пациент с периимплантационным дефектом имеет здоровый пародонт и соблюдает хорошую гигиену полости рта. Изначально рекомендуются нехирургические (бескровные) вмешательства для изменения экосистемы биопленки и оценки их эффективности. Однако нехирургические методы лечения периимплантита демонстрируют ограниченный успех. Поэтому повторная оценка через период не менее 6 недель после нехирургического лечения необходима для подтверждения разрешения заболевания (т.е. глубина кармана менее 6 мм без обильного кровотечения при зондировании и отсутствие прогрессирующей потери костной ткани). Если эти критерии не соблюдены, рекомендуется хирургическое лечение на основе профиля риска PIDRA. Следует рассмотреть возможность направления к более опытному стоматологу общего профиля или специалисту.
Ключевой аспект № 3: Хирургическая подготовка (ответ организма-хозяина, человеческий фактор)
Для регенерации периимплантита предложены три подхода:
- Погружной: удалить коронку имплантата, установить заглушку, добиться первичного закрытия области с трансплантатом и обеспечить беспрерывное заживление раны.
- Непогружной: оставить коронку на месте и лечить дефект аналогично процедурам регенерации естественных зубов.
- Формирователь десны: установить формирователь десны для обеспечения трансмукозального заживления; протез затем устанавливается после полного заживления хирургической области.
Погружной подход имеет три основных недостатка. Во-первых, невозможность восстановить имплантат сразу после операции, особенно в эстетической зоне, что может привести к коллапсу лоскута. Во-вторых, коронки в таких случаях не всегда могут быть извлечены, что увеличивает затраты и время на изготовление новой коронки. В-третьих, коронально смещенный лоскут, используемый для первичного закрытия, приведет к смещению мукогингивального соединения, уменьшению глубины преддверия и недостаточному количеству буккальной кератинизированной слизистой. Это особенно важно в области моляров.
Хотя удаление супраструктур имплантата требует дополнительных этапов и затрат, оно обеспечивает лучший визуальный доступ к поверхности имплантата (т.е. впадинам и резьбе) и внутрикостному дефекту для детоксикации и размещения регенеративных материалов. Боковые участки, особенно моляры, сложнее лечить без прямого визуального доступа. Это говорит о том, что удаление протеза с погружным заживлением может создать более благоприятные условия для регенерации кости.
Хотя авторы настоятельно рекомендуют антибиотикопрофилактику с использованием 2 г амоксициллина за 1 час до операции, доказательства эффективности любого антибиотического протокола для успеха реконструктивной терапии периимплантита ограничены.
Ключевой аспект № 4: Хирургический доступ (ответ организма-хозяина, человеческий фактор)
В день хирургической процедуры может быть использована Nd:YAG-лазерная процедура для лечения периимплантита (LAPIP) с целью стерилизации подслизистого патологического кармана, воздействия на глубину дефекта и прилегающие воспаленные мягкие ткани перед поднятием лоскута. Затем выполняется маргинальный внутренний скос с сохранением сосочков для доступа, который проводится после полного отслоения буккального и лингвального лоскутов, распространяющихся на половину или полную длину зуба с обеих сторон костного дефекта. Оператор должен подтвердить тип визуализированного дефекта, чтобы определить оптимальный хирургический подход. Периимплантационные дефекты могут быть классифицированы по морфологии и степени тяжести следующим образом:
- Класс I: внутрикостные дефекты, подразделяемые на: Ia: буккальная рецессия; Ib: двух- или трехстенный дефект; Ic: циркулярный дефект.
- Класс II: супракрестальные/горизонтальные дефекты.
- Класс III: комбинированные дефекты, подразделяемые на: IIIa: буккальная рецессия + супракрестальная потеря кости; IIIb: двух- или трехстенный дефект + супракрестальная потеря кости; IIIc: циркулярный дефект + супракрестальная потеря кости. Диагностика внутрикостных дефектов необходима для принятия клинических решений по лечению.
Внутрикостные дефекты лучше всего лечить регенеративными методами, а супракрестальные периимплантационные дефекты — резективной терапией. Около 25% периимплантационных дефектов имеют комбинированную (внутрикостную и супракрестальную) конфигурацию. Два исследования способствовали классификации периимплантационных дефектов по их морфологии и степени тяжести (классы I–III). Наиболее распространенная конфигурация дефекта — Ib (двух- или трехстенный дефект с отсутствием буккальной костной стенки). Дефекты Ia (буккальная рецессия), Ib и IIIb (двух- или трехстенный дефект + супракрестальная потеря кости) составляют примерно 86% всех дефектов.
Случаи класса Ib могут быть связаны с имплантатами, установленными за пределами костного ложа. В случаях, когда первичное закрытие раны может быть невозможным, рекомендуется комбинированный терапевтический подход. Этот подход включает закрытие кармана с помощью резективных методов на буккальной стороне и использование реконструктивных процедур на межзубной стороне.
Увеличение объема мягких тканей с помощью соединительнотканного трансплантата может быть необходимо в случаях с тонким пародонтальным фенотипом (менее 2 мм толщины ткани), недостаточной шириной кератинизированной ткани или участками сокращения ткани, что часто наблюдается в эстетической зоне. Свободные эпителизированные десневые трансплантаты или альтернативы мягких тканей могут быть использованы не ранее чем через 4 месяца после реконструктивной терапии в случаях с недостаточной зоной (менее 2 мм ширины) или толщиной прикрепленной кератинизированной десны. Тканевые трансплантаты также значительно снижают или устраняют чувствительность десен, которая может возникать во время гигиенических процедур.
Ключевой аспект № 5: Деконтаминация поверхности имплантата (микробиология, человеческий фактор)
Удаление биопленки с поверхности имплантата является важным условием успешного результата. Методы деконтаминации включают механические способы, такие как титановые щетки, кюреты, системы воздушно-абразивной обработки, ультразвуковые насадки и имплантопластику; химические агенты, включая перекись водорода/лимонную кислоту, местный тетрациклин, 24% этилендиаминтетрауксусную кислоту (ЭДТА) и хлоргексидин; электрохимическую очистку; и лазерную энергию. Ни один из методов не признан превосходящим другие.
Комбинированная стратегия может быть наиболее эффективной. Авторы отдают предпочтение системам воздушно-абразивной обработки (глицин или эритрит, с размером частиц, зависящим от конкретного продукта), так как они позволяют очистить все аспекты поверхности имплантата, вызывая минимальные повреждения и выделение титановых частиц.
Ключевой аспект № 6: Ограничения реконструктивной терапии — супракрестальный компонент и области вне костного ложа (ответ организма-хозяина, человеческий фактор)
При лечении комбинированного внутрикостного дефекта опыт клинициста становится особенно важным для выбора наиболее подходящего и предсказуемого метода лечения для пациента. Часть поверхности имплантата, находящаяся в полости рта и выходящая из периимплантационного кармана, подвержена долгосрочному риску, если шероховатая поверхность или резьба остаются обнаженными. Такая обнаженная шероховатая поверхность значительно более подвержена реконтаминации и реколонизации, чем гладкие поверхности имплантатов. Поэтому необходимо рассмотреть возможность проведения имплантопластики для модификации шероховатой поверхности корональнее внутрикостного дефекта, где можно ожидать некоторого восстановления. Это следует выполнить перед костной пластикой с использованием карбидных футбольных боров с 12 лезвиями под обильным орошением стерильной водой. Имплантопластика преобразует шероховатую поверхность имплантата в гладкую, аналогичную поверхности имплантата на уровне ткани, что способствует прикреплению мягких тканей и заживлению. Однако влияние выделения титановых частиц в ткани до конца не изучено.
Ключевой аспект № 7: Потенциал реконструкции (человеческий фактор)
«Репаративный потенциал» относится к внутрикостному компоненту в пределах альвеолярного костного ложа. При наличии большего количества стенок (три-четыре), как при лечении внутрикостных дефектов вокруг зубов, прогноз для регенерации значительно лучше, чем при дефектах с меньшим количеством стенок (одна-две). Фактически, дефект с одной стенкой может не подходить для реконструктивной терапии.
Регенерация тканей зависит от трех ключевых компонентов: клеток, каркасов (например, костных трансплантатов) и сигнальных молекул (например, факторов роста). Для успешной регенерации тканей необходимы васкуляризация, стабильность раны и время. Дефекты периимплантита связаны со значительной потерей кости и снижением кровоснабжения и количества клеток. На основе текущих данных реконструкция костного дефекта должна выполняться с использованием ксенотрансплантатов или аллотрансплантатов.
Поскольку стабильность раны имеет ключевое значение, барьерные мембраны могут быть использованы для поддержания трансплантата в частично ограниченных дефектах (класс Ib). В случае подхода с формирователем десны (Ключевой аспект № 3) мембрана может быть обрезана по технике «пончо» и стабилизирована формирователем десны, что в сочетании с аллотрансплантатами и ксенотрансплантатами показало переменный успех. Напротив, в узких круговых дефектах (классы Ia, IIIa) использование барьерной мембраны может не значительно улучшить результаты по сравнению с отсутствием мембраны.
В отличие от естественных зубов, дентальные имплантаты не имеют окружающей периодонтальной связки (ПС), необходимой для регенерации; поэтому добавление факторов роста к костному трансплантату может компенсировать отсутствие клеток ПС и способствовать более быстрому заживлению кости. Рекомбинантный человеческий тромбоцитарный фактор роста-BB (rhPDGF-BB) использовался с различными костными заменителями, такими как минерализованный лиофилизированный костный аллотрансплантат (FDBA) или деминерализованный бычий костный минерал (DBBM). В настоящее время использование rhPDGF-BB в регенеративных процедурах при периимплантите считается использованием «не по назначению» и недоступно во многих странах. Эмалевый матриксный дериват (EMD) также изучался для хирургического лечения периимплантита. Alberti и соавт. предположили, что EMD может улучшить контакт кости и имплантата. В целом, имеются лишь скромные качественные и количественные данные об использовании EMD для лечения периимплантита.
Наконец, критическим фактором для каждой успешной регенеративной процедуры является обеспечение первичного закрытия хирургической области без натяжения. Для этого выполняются разрезы с освобождением надкостницы. Рекомендуется использовать нерезорбируемые швы из высокоплотного политетрафторэтилена (d-PTFE) или медленно резорбируемые швы, которые следует оставлять на месте не менее 4 недель, если они не ослабляются раньше.
Ключевой аспект № 8: Поддерживающий уход (ответ организма-хозяина, микробиология, человеческий фактор)
Послеоперационный протокол может варьироваться по сложности и подходу в разных клиниках. Во время послеоперационных визитов клиническая команда должна использовать контрольные списки для правильного ухода за хирургическими пациентами, а пациент должен понимать, что эти визиты так же важны для успеха, как и сама процедура. Поддержание среды, свободной от зубного налета, крайне важно для минимизации риска повторного инфицирования после операции. Профессиональная гигиена должна быть начата в первые 2–3 недели, а использование резиновых чашечек или воздушного полировщика для удаления налета — через 4–6 недель. После снятия швов через 2–4 недели рекомендуется проводить контроль налета и полировку каждые 2–3 недели в течение первых 3 месяцев.
При лечении пациентов с периимплантитом необходимо учитывать следующие аспекты: наличие конкретного протокола пародонтального поддерживающего лечения (или поддерживающей пародонтальной терапии [ППТ]), адекватное выделенное время для визита по поводу ППТ, обучение пациента, включая использование и обновление пародонтального индекса риска (ПИР) на каждом визите.
Последующие визиты должны проводиться каждые 3–4 месяца. Использование воздушного полировщика рекомендуется во время фазы пародонтального/периимплантационного поддерживающего лечения. Хотя доказательства относительно идеальной частоты поддерживающего лечения периимплантита ограничены, рекомендуется планировать визиты каждые 3 месяца, особенно в течение первого года. В дальнейшем интервалы между визитами могут быть адаптированы в соответствии с профилем риска пациента. Недавнее исследование Leone и соавт. показало, что вероятность развития периимплантита в пять раз выше у не соблюдающих рекомендации пациентов по сравнению с теми, кто придерживается регулярного поддерживающего лечения. Кроме того, интервалы поддерживающей терапии реже двух раз в год могут быть неэффективными для предотвращения периимплантита.
Клинический случай
В следующем клиническом случае описано лечение кругового внутрикостного дефекта с буккальной рецессией (дефект класса Ib-Ic), диагностированного клинически. В 2007 году 40-летняя женщина, не курящая (ASA 1), с отличным пародонтальным здоровьем, обратилась к пародонтологу для замены отсутствующего нижнего премоляра (зуб № 3.5), который был удален за 6 месяцев до этого. Был установлен имплантат с конической реставрацией и поверхностью SLActive® (4,1 мм × 10 мм) с использованием индивидуального хирургического шаблона. Через 3 месяца был установлен абатмент длиной 3 мм с затяжкой до 35 Нсм, после чего была зафиксирована окончательная металлокерамическая коронка с использованием композитного цемента. Послеоперационный уход осуществлялся исключительно реставрационным стоматологом, так как пациентка имела отличное пародонтальное здоровье с ПИР 3.
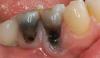
Через 5 лет после установки имплантата на участке зуба 3.5 были обнаружены круговые карманы глубиной 6–8 мм с обильным кровотечением при зондировании (Фото 1). Ширина кератинизированной слизистой составляла 4 мм на буккальной и лингвальной сторонах, с толстым гингивальным фенотипом. Четырехстенный внутрикостный дефект был диагностирован как циркулярный внутрикостный периимплантационный дефект класса 1c с углом дефекта менее 40% на мезиальной и дистальной рентгенограммах (Фото 2). Также был диагностирован периимплантит, связанный с резцовым цементом. Пациентка предпочла сохранить существующую хорошо подогнанную коронку из-за финансовых соображений. По шкале PIDRA пациентка была отнесена к группе низкого-среднего риска.
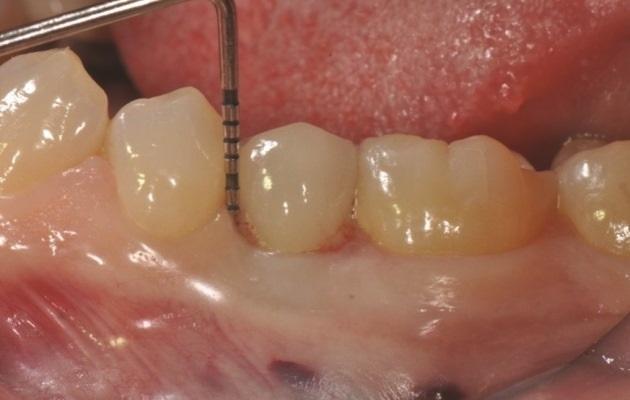
Фото 1: У пациентки обнаружена глубина зондирования 6–8 мм на участке зуба №3.5 и кровоточивость при зондировании.
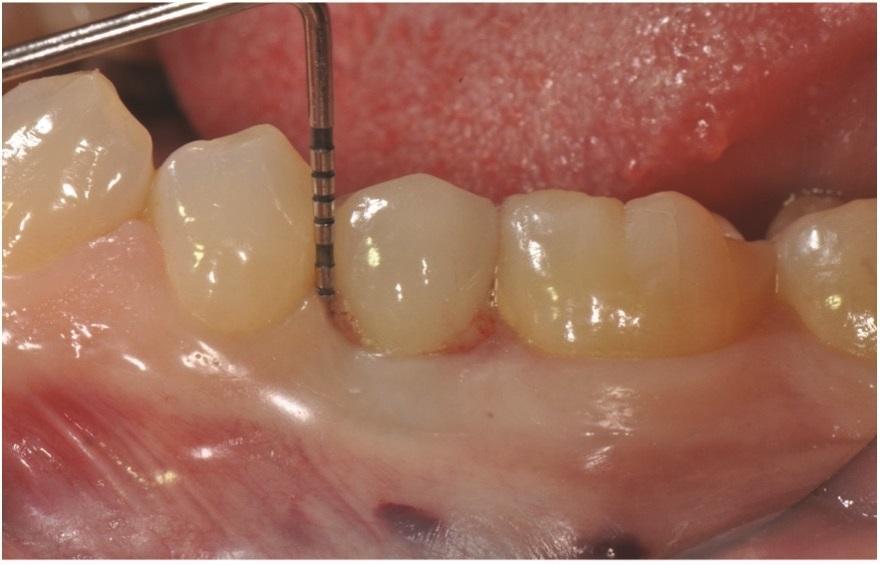
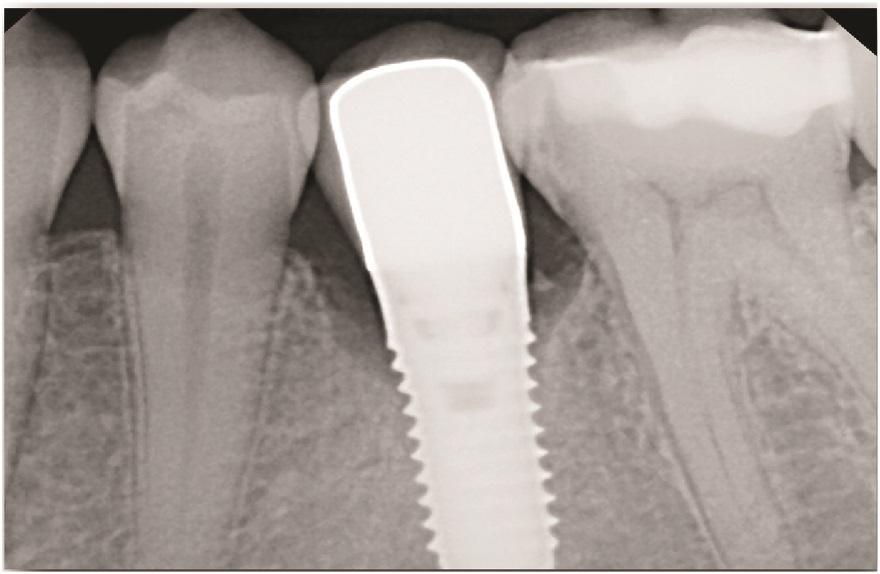
Фото 2: Рентгенограмма области имплантата до лечения показала угол дефекта менее 40%.
Пример применения системы PIDRA к конкретному клиническому случаю.
Она показывает распределение факторов риска пациента, оператора, имплантата и тканей вокруг имплантата по трем категориям:
Низкий риск (зеленый): опытный хирург, использование чек-листа, низкий стресс, здоровый пациент без пародонтита, некурящий, хороший контроль налета (≤15%), комплаентность к поддерживающей терапии, винтовая фиксация протеза, коронка удовлетворительная, слизистая достаточной толщины и ширины, нет рецессии, дефект класса I, костная убыль <50%, возможна очистка резьбы.
Средний риск (желтый): легкое курение (≤10 сиг/день), контроль налета 16–24%, неполная очищаемость протеза, цементная фиксация на цинке, необходимость коррекции коронки, тонкая слизистая при достаточной ширине, дефект III класса.
Высокий риск (красный): ограниченный опыт хирурга, высокий стресс, отказ от чек-листа, тяжелое общее состояние, курение >10 сиг/день, плохой контроль налета (≥25%), пародонтит в анамнезе, плохая комплаентность, неочищаемый протез, цементная фиксация на смоле, неудовлетворительная коронка, рецессия мягких тканей, узкая или отсутствующая кератинизированная слизистая, невозможность очистки резьбы, дефект класса II, выраженная убыль кости >50%.
Данные демонстрируют, как совокупность факторов пациента и клинической ситуации формирует общий уровень риска периимплантита для данного случая.
Была использована минимально инвазивная техника сохранения сосочков (для облегчения закрытия лоскута) с буккальным и лингвальным доступом для визуализации внутрикостного дефекта. Хирургические цели включали удаление всей поддесневой патологической биопленки и остатков цемента, а также направленную костную регенерацию дефекта. В данном случае клиническим ожиданием для четырехстенного дефекта было достижение заполнения кости до уровня межзубной высоты кости соседних зубов.
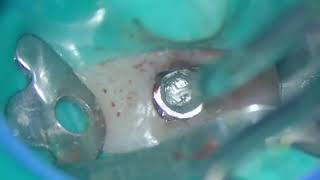
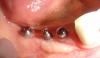
Для тщательной очистки внутрикостного дефекта использовались кюреты с маленькими наконечниками и ультразвук, при этом поверхность имплантата не затрагивалась (Фото 3 и Фото 4). Впадины и резьба поверхности были аккуратно очищены с помощью воздушного полировщика (бикарбонат натрия) в течение 1 минуты, после чего участок был промыт стерильной водой в течение 1 минуты. После высушивания воздухом была нанесена ЭДТА на 1 минуту, затем снова промывание стерильной водой в течение 1 минуты, и предыдущие этапы были повторены. Костный трансплантат FDBA был замочен в стерильной воде, высушен марлей 2×2 и пропитан rhPDGF-BB (Фото 5). Трансплантат был плотно уложен в дефект с небольшим избытком над гребнем (Фото 6). Коллагеновая мембрана была разделена пополам и пропитана rhPDGF-BB. Затем коллагеновые мембраны были адаптированы на буккальной и лингвальной сторонах с небольшим перекрытием в межзубных промежутках для удержания трансплантата (Фото 7). Лоскуты были пассивно смещены коронально и в межзубных промежутках с использованием нерезорбируемых 6-0 полипропиленовых швов (Фото 8).
Фото 3: После удаления грануляционной ткани был виден дефект.
Фото 4: Интраоперационная хирургическая оценка периимплантационного дефекта показала область после очистки.
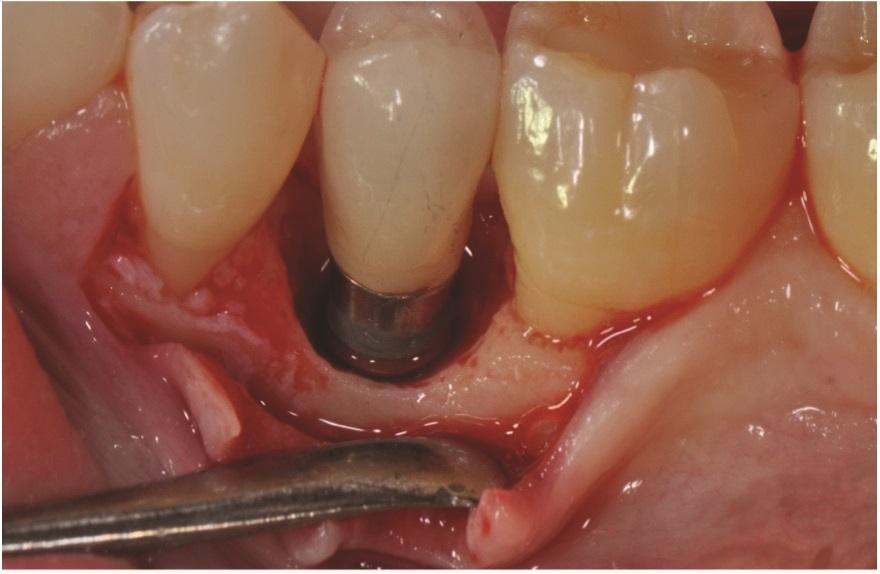
Фото 5: FDBA, пропитанный rhPDGF-BB, в стерильной чашке в начале операции.
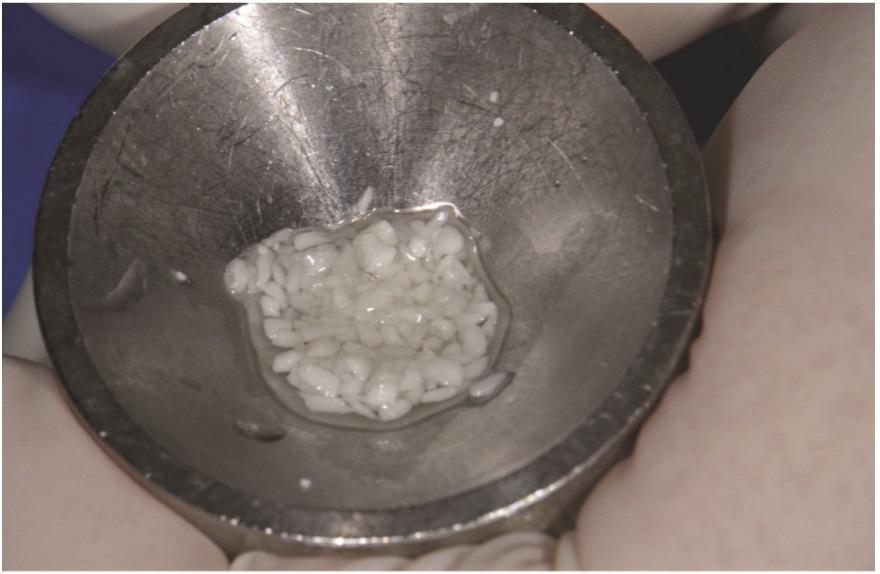
Фото 6: Трансплантационный материал был помещен и утрамбован в дефект и над гребнем.
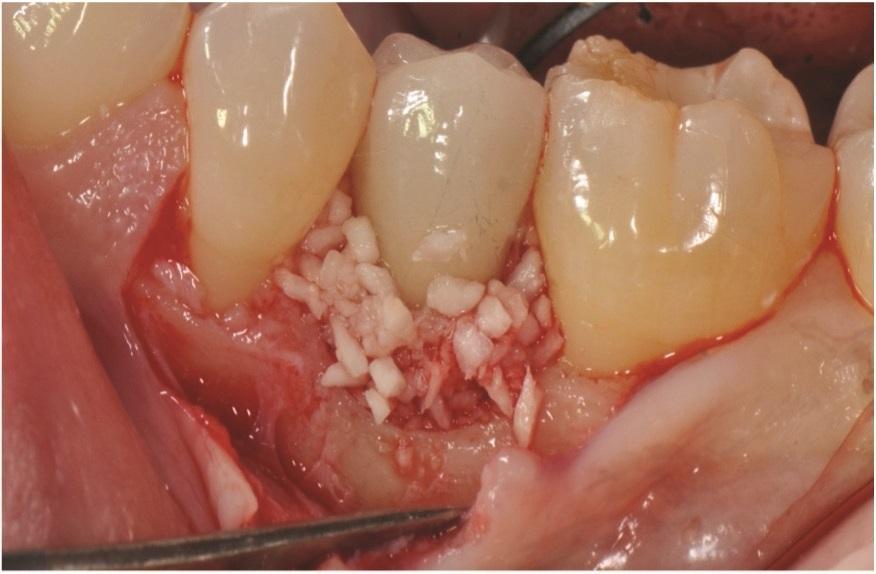
Фото 7: Коллагеновая мембрана, гидратированная rhPDGF-BB, была размещена над дефектами с межзубными расширениями.
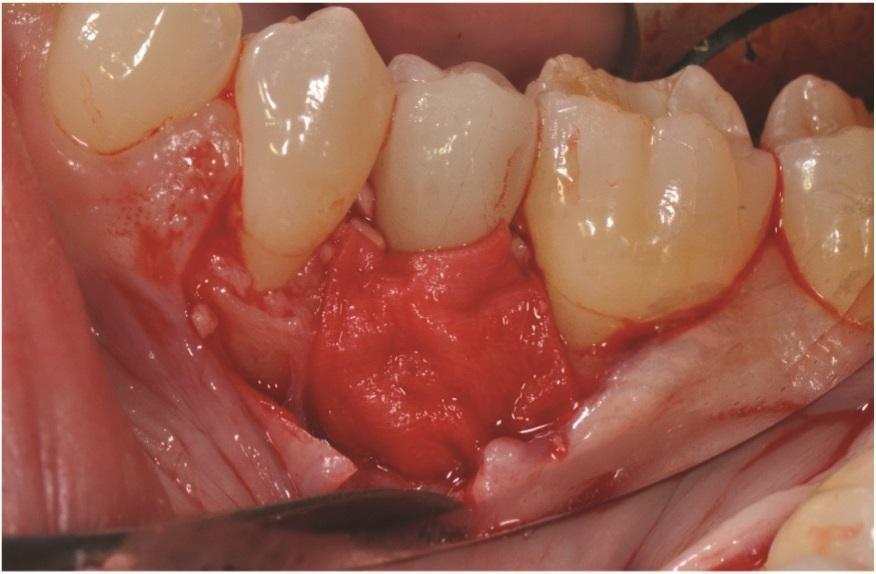
Фото 8: Лоскуты были ушиты с использованием нерезорбируемых 6-0 полипропиленовых швов после коронального смещения.
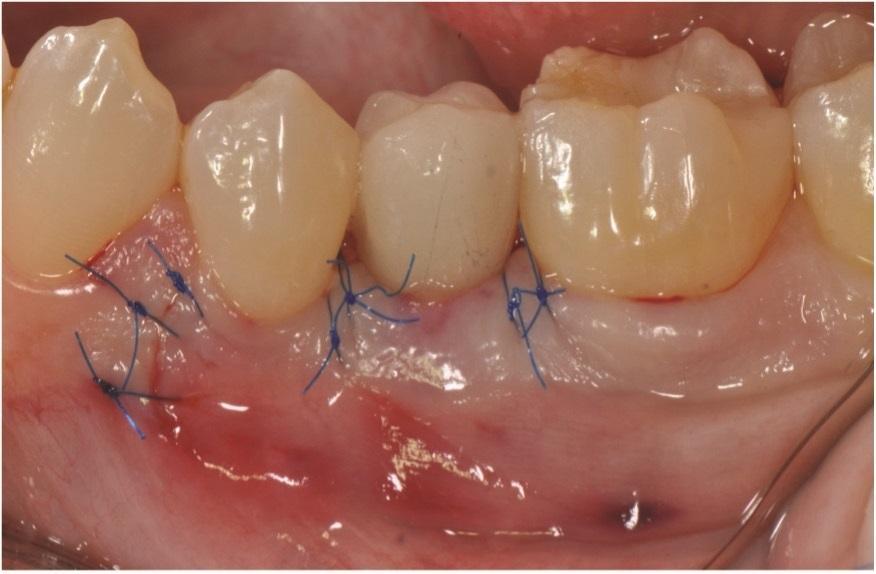
Была выполнена послеоперационная внутриротовая рентгенограмма (Фото 9). Послеоперационные визиты проводились с интервалом в 2–3 недели. Пациентке было рекомендовано использовать хлоргексидин в течение 2 недель, после чего перейти на мягкую зубную щетку с двумя рядами щетинок и межзубную чистку нитью. Использование межзубных ершиков началось после снятия швов через 4 недели. Через 2 месяца заживление было отличным (Фото 10); через 9 месяцев наблюдалось полное восстановление межзубных сосочков, а рентгенологически подтверждено заполнение внутрикостного дефекта (Фото 11 и Фото 12). Через 1 год поддерживающие визиты проводились гигиенистом терапевтического кабинета.
Фото 9: Немедленная послеоперационная рентгенограмма.
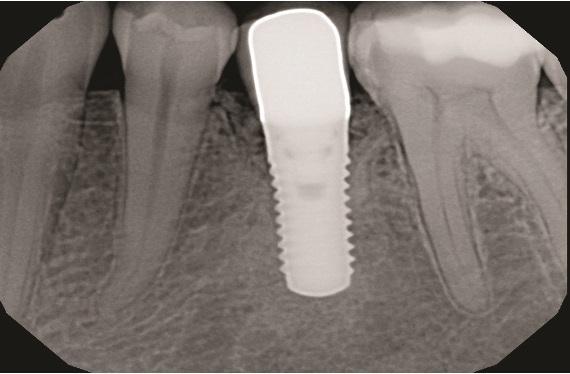
Фото 10: Клиническая картина через 2 месяца после операции.
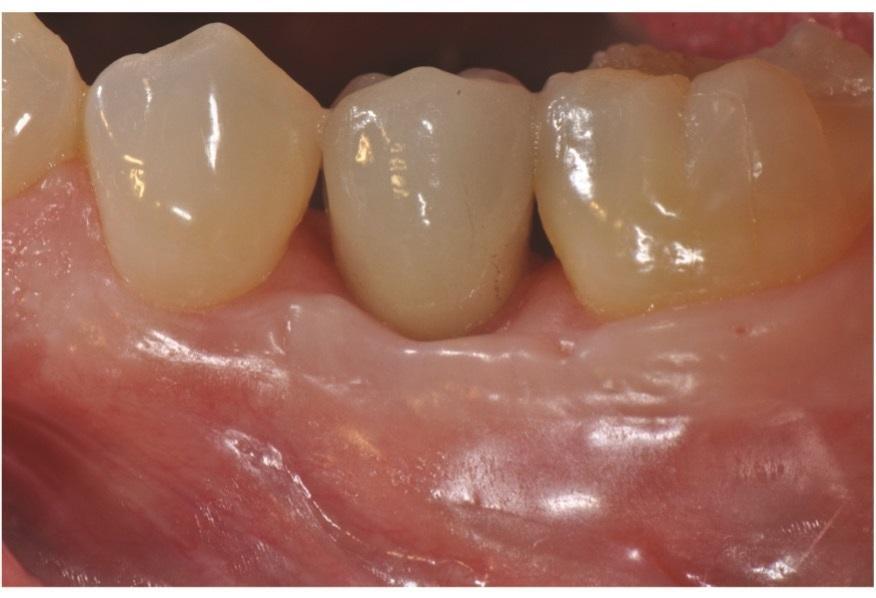
Фото 11: Рентгенограмма через 9 месяцев после операции, показывающая заполнение внутрикостного дефекта.
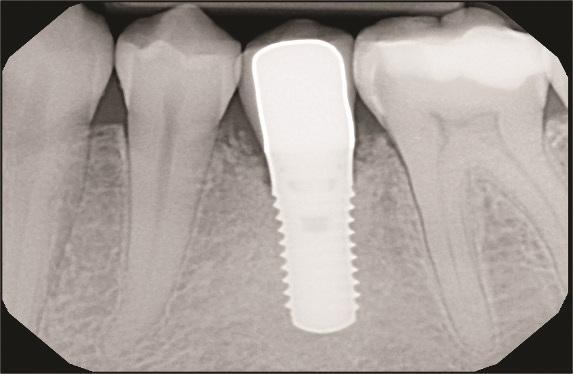
Фото 12: Клиническая картина через 9 месяцев после операции, демонстрирующая полную регенерацию и межзубные сосочки.
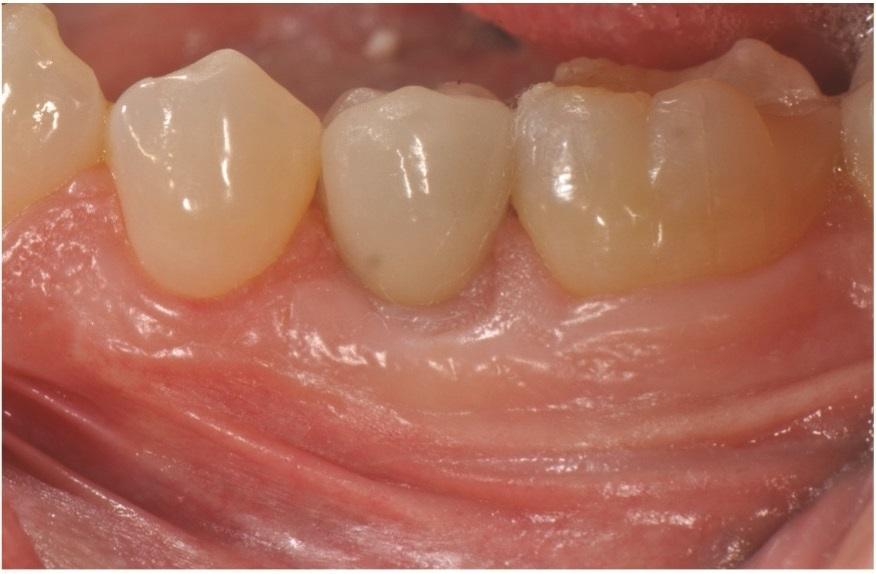
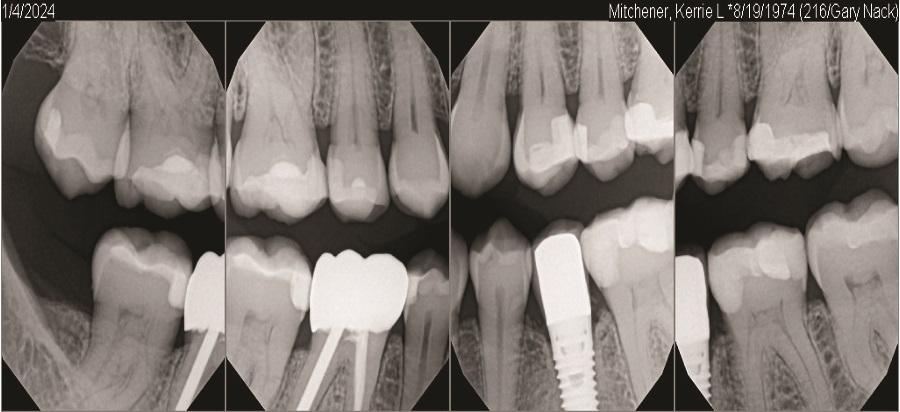
Контрольные визиты через 6 и 11 лет (Фото 13–Фото 15) подтвердили стабильные долгосрочные результаты регенерации мягких и твердых тканей, а также заживление кости.
Фото 13: Рентгенограмма через 6 лет после операции.
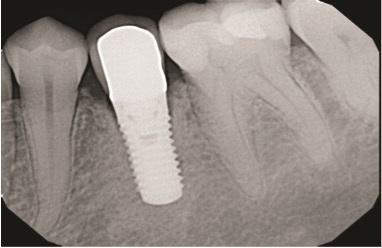
Фото 14: Клиническая картина через 6 лет после операции, показывающая стабильные результаты.
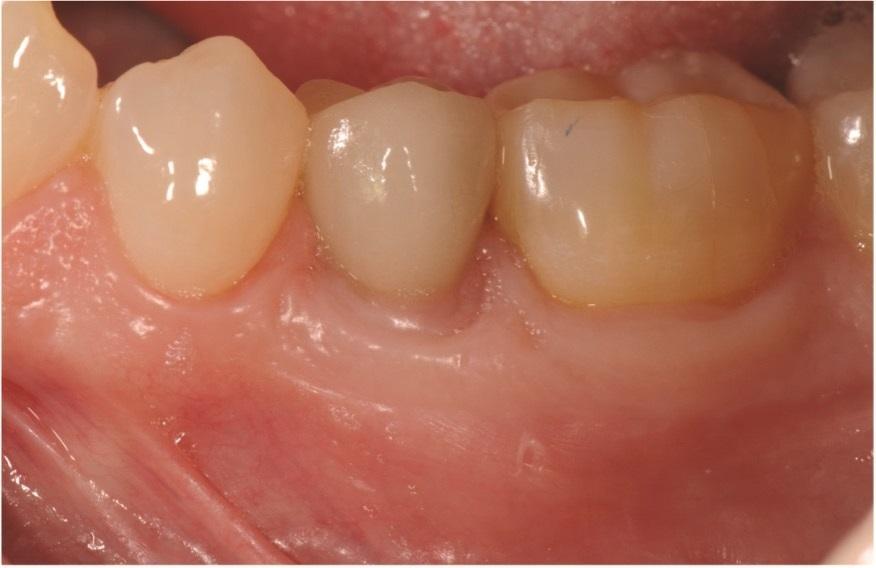
Фото 15: Серия прикусных рентгенограмм через 11 лет после операции, демонстрирующая стабильный уровень кости.
Вывод
Поражения, связанные с периимплантитом, могут быть классифицированы на человеческие факторы, ответ хозяина и локальные микробиологические факторы. Эти факторы интегрированы в инструмент оценки риска дефектов периимплантита (PIDRA) для определения потенциального уровня сложности, риска и успеха, связанного с лечением имплантата с периимплантитом. Внедрение контрольного списка восьми ключевых аспектов для лечения внутрикостных дефектов периимплантита способствует более стандартизированным и предсказуемым результатам лечения, а также снижению частоты осложнений.
Авторы:
Robert A. Levine, DDS
Alberto Monje, DDS, MS, PhD
Muhammad H.A. Saleh, BDS, MSD, MS
Debora R. Dias, DDS, MSc
Khushboo Kalani, DDS, MS
Harold M. Pinsky, DDS
Jeffrey Ganeles, DMD
Franck Renouard, DDS
Maurício G. Araújo, DDS, MSc, PhD
Периимплантит — это воспалительное состояние, опосредованное биопленкой, связанное с прогрессирующей потерей опорных тканей и представляющее значительную проблему для клиницистов во всем мире. Поскольку нехирургическая терапия обладает ограниченной эффективностью, для лечения этого заболевания часто требуется хирургическое вмешательство. В данной статье рассматриваются факторы, связанные с оператором, при лечении периимплантита, и представлен поэтапный подход к восьми ключевым аспектам успешного регенеративного/репаративного лечения дефектов при периимплантите. Эти ключевые аспекты направлены на оптимизацию клинических результатов для различных потребностей пациентов и анатомии дефектов. Они включают оценку опыта оператора, анализ рисков и дизайн имплантационной реставрации, а также нехирургические и хирургические методы лечения, такие как использование биологических материалов и их производных, послеоперационный протокол и индивидуальную программу пародонтального поддерживающего лечения. Соблюдение этих восьми ключевых аспектов позволяет клиницистам достичь успешных долгосрочных результатов при регенеративном лечении дефектов периимплантита.

Хирургия периимплантита с отслаиванием лоскута направлена на обеспечение доступа к поверхности имплантата для удаления мягких и твердых отложений биопленки и остатков цемента, что способствует заживлению и снижает дальнейшее прогрессирование заболевания. Реконструктивные методы направлены на регенерацию костного дефекта и достижение реоссинтеграции при закрытии патологического периимплантационного кармана. Лечение периимплантационных дефектов в основном зависит от понимания морфологии дефекта и других связанных с ним топографических характеристик.
Инструменты оценки риска и клинические контрольные списки полезны для предотвращения нежелательных осложнений. Некоторые из авторов данной статьи ранее описывали контрольный список из 10 ключевых аспектов для немедленной установки имплантата в эстетических зонах, а также контрольный список из семи ключевых аспектов для лечения внутрикостных пародонтальных дефектов. Все процедуры имплантации связаны с биологическим ответом организма («ответ хозяина»), микробиологической средой («микробиология») и факторами, связанными с оператором («человеческий фактор»). В данной статье рассматривается этот процесс и представлены восемь ключевых аспектов регенеративного лечения периимплантитных дефектов. Каждый ключевой аспект может быть связан с одной или несколькими из этих трех категорий.
Ниже приведены восемь ключевых моментов реконструктивной терапии внутрикостных дефектов, связанных с периимплантитом.
- Предоперационная оценка: учитываются факторы хирурга, пациента, состояние имплантата и конфигурация дефекта; проводится PIDRA-анализ.
- Нехирургическая терапия: направлена на изменение био-пленки, но ограниченно эффективна в удалении налета и камня.
- Хирургическая подготовка: определение дефекта для выбора резективного или регенеративного подхода; учитывается тип коронки (погруженная, непогруженная, с формирователем десны).
Хирургические этапы:
- Создание доступа: формируются слизисто-надкостничные лоскуты, уточняется конфигурация дефекта, возможна пластика мягких тканей.
- Деконтаминация поверхности имплантата: механическими, химическими, электролитическими или комбинированными методами.
- Работа с супракрестальной частью: при оголении шероховатой поверхности имплантата выполняется имплантопластика.
- Реконструкция: применяется регенерация тканей с костными трансплантатами, мембранами и биологическими агентами (например, rhPDGF-BB, EMD).
Поддержание:
- Регулярная поддерживающая терапия: каждые 2–3 недели первые 3 месяца, затем каждые 3–4 месяца; включает полировку и контроль налета.
Восемь ключевых аспектов регенеративного лечения дефектов периимплантита
Ключевой аспект № 1: Факторы оператора и пациента, состояние имплантата и периимплантационная конфигурация (человеческий фактор)
Использование контрольного списка позволяет воспользоваться коллективным опытом его разработчиков, обеспечивая последовательные, эффективные и стандартизированные протоколы лечения. Интересно, что в различных отраслях, включая медицину и стоматологию, растет внимание к «человеческому фактору» как источнику ошибок, включая лечение периимплантита. Опыт и навыки хирурга, а также стрессовые факторы окружающей среды играют критическую роль в успехе этих процедур. Методы, аналогичные тем, что используются в авиационных контрольных списках и ситуационной осведомленности, могут помочь решить проблемы человеческого фактора и улучшить клинические результаты.
При выполнении Ключевого аспекта № 1 рекомендуется провести полное пародонтальное и окклюзионное обследование, а также рентгенологическую оценку (включая внутриротовые рентгенограммы и/или конусно-лучевую компьютерную томографию), а также оценить положение имплантата и протеза, так как эти факторы могут способствовать прогрессированию периимплантита. Помимо медицинского и стоматологического анамнеза, пародонтальное, окклюзионное и рентгенологическое обследования анализируются и обсуждаются с пациентом во время предварительной консультации «колено к колену и глаза в глаза». На основе ранее опубликованных исследований и рекомендаций по лечению в данной статье представлен инструмент оценки риска дефектов периимплантита (PIDRA), который помогает клиницистам выявить влияющие факторы для достижения успешных результатов при выполнении регенеративных процедур. PIDRA обеспечивает предсказуемую и стандартизированную коммуникацию с пациентом и между специалистами независимо от уровня риска.
Система оценки риска дефекта при периимплантите (PIDRA). Она делит факторы на три категории — низкий, средний и высокий риск — в зависимости от характеристик оператора, пациента, имплантата и периимплантатных тканей.
- Факторы оператора: опыт хирурга, уровень стресса, использование чек-листа.
- Факторы пациента: общее здоровье, курение, контроль налета, наличие пародонтита, приверженность поддерживающей терапии.
- Факторы имплантата: очищаемость протеза, тип фиксации (винтовая/цементная), состояние коронки.
- Конфигурация тканей: наличие или отсутствие рецессии мягких тканей, толщина и ширина кератинизированной десны, доступ для очистки резьбы имплантата, морфология дефекта, выраженность резорбции кости.
- При низком риске — хороший прогноз: опытный хирург, здоровый пациент без пародонтита, некурящий, хороший контроль налета, винтовая фиксация, достаточная слизистая и кость.
- При среднем риске — отдельные факторы осложняют лечение (например, легкое курение, частично очищаемый протез, тонкая слизистая, дефект III класса).
- При высоком риске — прогноз хуже: малоопытный хирург, тяжелое общее состояние пациента, курение >10 сигарет/день, плохой контроль налета, история пародонтита, цементная фиксация, рецессия мягких тканей, дефицит слизистой, потеря >50% кости.
Перед началом любой терапии периимплантита необходимо рассмотреть возможность корректировки или замены протеза для оптимизации результатов лечения. Поэтому обсуждение с пациентом необходимости этого подготовительного этапа, а также сроков и стоимости является важным перед любым нехирургическим или хирургическим вмешательством.
Ключевой аспект № 2: Нехирургическая терапия (человеческий фактор)
PIDRA предполагает, что пациент с периимплантационным дефектом имеет здоровый пародонт и соблюдает хорошую гигиену полости рта. Изначально рекомендуются нехирургические (бескровные) вмешательства для изменения экосистемы биопленки и оценки их эффективности. Однако нехирургические методы лечения периимплантита демонстрируют ограниченный успех. Поэтому повторная оценка через период не менее 6 недель после нехирургического лечения необходима для подтверждения разрешения заболевания (т.е. глубина кармана менее 6 мм без обильного кровотечения при зондировании и отсутствие прогрессирующей потери костной ткани). Если эти критерии не соблюдены, рекомендуется хирургическое лечение на основе профиля риска PIDRA. Следует рассмотреть возможность направления к более опытному стоматологу общего профиля или специалисту.
Ключевой аспект № 3: Хирургическая подготовка (ответ организма-хозяина, человеческий фактор)
Для регенерации периимплантита предложены три подхода:
- Погружной: удалить коронку имплантата, установить заглушку, добиться первичного закрытия области с трансплантатом и обеспечить беспрерывное заживление раны.
- Непогружной: оставить коронку на месте и лечить дефект аналогично процедурам регенерации естественных зубов.
- Формирователь десны: установить формирователь десны для обеспечения трансмукозального заживления; протез затем устанавливается после полного заживления хирургической области.
Погружной подход имеет три основных недостатка. Во-первых, невозможность восстановить имплантат сразу после операции, особенно в эстетической зоне, что может привести к коллапсу лоскута. Во-вторых, коронки в таких случаях не всегда могут быть извлечены, что увеличивает затраты и время на изготовление новой коронки. В-третьих, коронально смещенный лоскут, используемый для первичного закрытия, приведет к смещению мукогингивального соединения, уменьшению глубины преддверия и недостаточному количеству буккальной кератинизированной слизистой. Это особенно важно в области моляров.
Хотя удаление супраструктур имплантата требует дополнительных этапов и затрат, оно обеспечивает лучший визуальный доступ к поверхности имплантата (т.е. впадинам и резьбе) и внутрикостному дефекту для детоксикации и размещения регенеративных материалов. Боковые участки, особенно моляры, сложнее лечить без прямого визуального доступа. Это говорит о том, что удаление протеза с погружным заживлением может создать более благоприятные условия для регенерации кости.
Хотя авторы настоятельно рекомендуют антибиотикопрофилактику с использованием 2 г амоксициллина за 1 час до операции, доказательства эффективности любого антибиотического протокола для успеха реконструктивной терапии периимплантита ограничены.
Ключевой аспект № 4: Хирургический доступ (ответ организма-хозяина, человеческий фактор)
В день хирургической процедуры может быть использована Nd:YAG-лазерная процедура для лечения периимплантита (LAPIP) с целью стерилизации подслизистого патологического кармана, воздействия на глубину дефекта и прилегающие воспаленные мягкие ткани перед поднятием лоскута. Затем выполняется маргинальный внутренний скос с сохранением сосочков для доступа, который проводится после полного отслоения буккального и лингвального лоскутов, распространяющихся на половину или полную длину зуба с обеих сторон костного дефекта. Оператор должен подтвердить тип визуализированного дефекта, чтобы определить оптимальный хирургический подход. Периимплантационные дефекты могут быть классифицированы по морфологии и степени тяжести следующим образом:
- Класс I: внутрикостные дефекты, подразделяемые на: Ia: буккальная рецессия; Ib: двух- или трехстенный дефект; Ic: циркулярный дефект.
- Класс II: супракрестальные/горизонтальные дефекты.
- Класс III: комбинированные дефекты, подразделяемые на: IIIa: буккальная рецессия + супракрестальная потеря кости; IIIb: двух- или трехстенный дефект + супракрестальная потеря кости; IIIc: циркулярный дефект + супракрестальная потеря кости. Диагностика внутрикостных дефектов необходима для принятия клинических решений по лечению.
Внутрикостные дефекты лучше всего лечить регенеративными методами, а супракрестальные периимплантационные дефекты — резективной терапией. Около 25% периимплантационных дефектов имеют комбинированную (внутрикостную и супракрестальную) конфигурацию. Два исследования способствовали классификации периимплантационных дефектов по их морфологии и степени тяжести (классы I–III). Наиболее распространенная конфигурация дефекта — Ib (двух- или трехстенный дефект с отсутствием буккальной костной стенки). Дефекты Ia (буккальная рецессия), Ib и IIIb (двух- или трехстенный дефект + супракрестальная потеря кости) составляют примерно 86% всех дефектов.
Случаи класса Ib могут быть связаны с имплантатами, установленными за пределами костного ложа. В случаях, когда первичное закрытие раны может быть невозможным, рекомендуется комбинированный терапевтический подход. Этот подход включает закрытие кармана с помощью резективных методов на буккальной стороне и использование реконструктивных процедур на межзубной стороне.
Увеличение объема мягких тканей с помощью соединительнотканного трансплантата может быть необходимо в случаях с тонким пародонтальным фенотипом (менее 2 мм толщины ткани), недостаточной шириной кератинизированной ткани или участками сокращения ткани, что часто наблюдается в эстетической зоне. Свободные эпителизированные десневые трансплантаты или альтернативы мягких тканей могут быть использованы не ранее чем через 4 месяца после реконструктивной терапии в случаях с недостаточной зоной (менее 2 мм ширины) или толщиной прикрепленной кератинизированной десны. Тканевые трансплантаты также значительно снижают или устраняют чувствительность десен, которая может возникать во время гигиенических процедур.
Ключевой аспект № 5: Деконтаминация поверхности имплантата (микробиология, человеческий фактор)
Удаление биопленки с поверхности имплантата является важным условием успешного результата. Методы деконтаминации включают механические способы, такие как титановые щетки, кюреты, системы воздушно-абразивной обработки, ультразвуковые насадки и имплантопластику; химические агенты, включая перекись водорода/лимонную кислоту, местный тетрациклин, 24% этилендиаминтетрауксусную кислоту (ЭДТА) и хлоргексидин; электрохимическую очистку; и лазерную энергию. Ни один из методов не признан превосходящим другие.
Комбинированная стратегия может быть наиболее эффективной. Авторы отдают предпочтение системам воздушно-абразивной обработки (глицин или эритрит, с размером частиц, зависящим от конкретного продукта), так как они позволяют очистить все аспекты поверхности имплантата, вызывая минимальные повреждения и выделение титановых частиц.
Ключевой аспект № 6: Ограничения реконструктивной терапии — супракрестальный компонент и области вне костного ложа (ответ организма-хозяина, человеческий фактор)
При лечении комбинированного внутрикостного дефекта опыт клинициста становится особенно важным для выбора наиболее подходящего и предсказуемого метода лечения для пациента. Часть поверхности имплантата, находящаяся в полости рта и выходящая из периимплантационного кармана, подвержена долгосрочному риску, если шероховатая поверхность или резьба остаются обнаженными. Такая обнаженная шероховатая поверхность значительно более подвержена реконтаминации и реколонизации, чем гладкие поверхности имплантатов. Поэтому необходимо рассмотреть возможность проведения имплантопластики для модификации шероховатой поверхности корональнее внутрикостного дефекта, где можно ожидать некоторого восстановления. Это следует выполнить перед костной пластикой с использованием карбидных футбольных боров с 12 лезвиями под обильным орошением стерильной водой. Имплантопластика преобразует шероховатую поверхность имплантата в гладкую, аналогичную поверхности имплантата на уровне ткани, что способствует прикреплению мягких тканей и заживлению. Однако влияние выделения титановых частиц в ткани до конца не изучено.
Ключевой аспект № 7: Потенциал реконструкции (человеческий фактор)
«Репаративный потенциал» относится к внутрикостному компоненту в пределах альвеолярного костного ложа. При наличии большего количества стенок (три-четыре), как при лечении внутрикостных дефектов вокруг зубов, прогноз для регенерации значительно лучше, чем при дефектах с меньшим количеством стенок (одна-две). Фактически, дефект с одной стенкой может не подходить для реконструктивной терапии.
Регенерация тканей зависит от трех ключевых компонентов: клеток, каркасов (например, костных трансплантатов) и сигнальных молекул (например, факторов роста). Для успешной регенерации тканей необходимы васкуляризация, стабильность раны и время. Дефекты периимплантита связаны со значительной потерей кости и снижением кровоснабжения и количества клеток. На основе текущих данных реконструкция костного дефекта должна выполняться с использованием ксенотрансплантатов или аллотрансплантатов.
Поскольку стабильность раны имеет ключевое значение, барьерные мембраны могут быть использованы для поддержания трансплантата в частично ограниченных дефектах (класс Ib). В случае подхода с формирователем десны (Ключевой аспект № 3) мембрана может быть обрезана по технике «пончо» и стабилизирована формирователем десны, что в сочетании с аллотрансплантатами и ксенотрансплантатами показало переменный успех. Напротив, в узких круговых дефектах (классы Ia, IIIa) использование барьерной мембраны может не значительно улучшить результаты по сравнению с отсутствием мембраны.
В отличие от естественных зубов, дентальные имплантаты не имеют окружающей периодонтальной связки (ПС), необходимой для регенерации; поэтому добавление факторов роста к костному трансплантату может компенсировать отсутствие клеток ПС и способствовать более быстрому заживлению кости. Рекомбинантный человеческий тромбоцитарный фактор роста-BB (rhPDGF-BB) использовался с различными костными заменителями, такими как минерализованный лиофилизированный костный аллотрансплантат (FDBA) или деминерализованный бычий костный минерал (DBBM). В настоящее время использование rhPDGF-BB в регенеративных процедурах при периимплантите считается использованием «не по назначению» и недоступно во многих странах. Эмалевый матриксный дериват (EMD) также изучался для хирургического лечения периимплантита. Alberti и соавт. предположили, что EMD может улучшить контакт кости и имплантата. В целом, имеются лишь скромные качественные и количественные данные об использовании EMD для лечения периимплантита.
Наконец, критическим фактором для каждой успешной регенеративной процедуры является обеспечение первичного закрытия хирургической области без натяжения. Для этого выполняются разрезы с освобождением надкостницы. Рекомендуется использовать нерезорбируемые швы из высокоплотного политетрафторэтилена (d-PTFE) или медленно резорбируемые швы, которые следует оставлять на месте не менее 4 недель, если они не ослабляются раньше.
Ключевой аспект № 8: Поддерживающий уход (ответ организма-хозяина, микробиология, человеческий фактор)
Послеоперационный протокол может варьироваться по сложности и подходу в разных клиниках. Во время послеоперационных визитов клиническая команда должна использовать контрольные списки для правильного ухода за хирургическими пациентами, а пациент должен понимать, что эти визиты так же важны для успеха, как и сама процедура. Поддержание среды, свободной от зубного налета, крайне важно для минимизации риска повторного инфицирования после операции. Профессиональная гигиена должна быть начата в первые 2–3 недели, а использование резиновых чашечек или воздушного полировщика для удаления налета — через 4–6 недель. После снятия швов через 2–4 недели рекомендуется проводить контроль налета и полировку каждые 2–3 недели в течение первых 3 месяцев.
При лечении пациентов с периимплантитом необходимо учитывать следующие аспекты: наличие конкретного протокола пародонтального поддерживающего лечения (или поддерживающей пародонтальной терапии [ППТ]), адекватное выделенное время для визита по поводу ППТ, обучение пациента, включая использование и обновление пародонтального индекса риска (ПИР) на каждом визите.
Последующие визиты должны проводиться каждые 3–4 месяца. Использование воздушного полировщика рекомендуется во время фазы пародонтального/периимплантационного поддерживающего лечения. Хотя доказательства относительно идеальной частоты поддерживающего лечения периимплантита ограничены, рекомендуется планировать визиты каждые 3 месяца, особенно в течение первого года. В дальнейшем интервалы между визитами могут быть адаптированы в соответствии с профилем риска пациента. Недавнее исследование Leone и соавт. показало, что вероятность развития периимплантита в пять раз выше у не соблюдающих рекомендации пациентов по сравнению с теми, кто придерживается регулярного поддерживающего лечения. Кроме того, интервалы поддерживающей терапии реже двух раз в год могут быть неэффективными для предотвращения периимплантита.
Клинический случай
В следующем клиническом случае описано лечение кругового внутрикостного дефекта с буккальной рецессией (дефект класса Ib-Ic), диагностированного клинически. В 2007 году 40-летняя женщина, не курящая (ASA 1), с отличным пародонтальным здоровьем, обратилась к пародонтологу для замены отсутствующего нижнего премоляра (зуб № 3.5), который был удален за 6 месяцев до этого. Был установлен имплантат с конической реставрацией и поверхностью SLActive® (4,1 мм × 10 мм) с использованием индивидуального хирургического шаблона. Через 3 месяца был установлен абатмент длиной 3 мм с затяжкой до 35 Нсм, после чего была зафиксирована окончательная металлокерамическая коронка с использованием композитного цемента. Послеоперационный уход осуществлялся исключительно реставрационным стоматологом, так как пациентка имела отличное пародонтальное здоровье с ПИР 3.
Через 5 лет после установки имплантата на участке зуба 3.5 были обнаружены круговые карманы глубиной 6–8 мм с обильным кровотечением при зондировании (Фото 1). Ширина кератинизированной слизистой составляла 4 мм на буккальной и лингвальной сторонах, с толстым гингивальным фенотипом. Четырехстенный внутрикостный дефект был диагностирован как циркулярный внутрикостный периимплантационный дефект класса 1c с углом дефекта менее 40% на мезиальной и дистальной рентгенограммах (Фото 2). Также был диагностирован периимплантит, связанный с резцовым цементом. Пациентка предпочла сохранить существующую хорошо подогнанную коронку из-за финансовых соображений. По шкале PIDRA пациентка была отнесена к группе низкого-среднего риска.
Фото 1: У пациентки обнаружена глубина зондирования 6–8 мм на участке зуба №3.5 и кровоточивость при зондировании.

Фото 2: Рентгенограмма области имплантата до лечения показала угол дефекта менее 40%.

Пример применения системы PIDRA к конкретному клиническому случаю.
Она показывает распределение факторов риска пациента, оператора, имплантата и тканей вокруг имплантата по трем категориям:
Низкий риск (зеленый): опытный хирург, использование чек-листа, низкий стресс, здоровый пациент без пародонтита, некурящий, хороший контроль налета (≤15%), комплаентность к поддерживающей терапии, винтовая фиксация протеза, коронка удовлетворительная, слизистая достаточной толщины и ширины, нет рецессии, дефект класса I, костная убыль <50%, возможна очистка резьбы.
Средний риск (желтый): легкое курение (≤10 сиг/день), контроль налета 16–24%, неполная очищаемость протеза, цементная фиксация на цинке, необходимость коррекции коронки, тонкая слизистая при достаточной ширине, дефект III класса.
Высокий риск (красный): ограниченный опыт хирурга, высокий стресс, отказ от чек-листа, тяжелое общее состояние, курение >10 сиг/день, плохой контроль налета (≥25%), пародонтит в анамнезе, плохая комплаентность, неочищаемый протез, цементная фиксация на смоле, неудовлетворительная коронка, рецессия мягких тканей, узкая или отсутствующая кератинизированная слизистая, невозможность очистки резьбы, дефект класса II, выраженная убыль кости >50%.
Данные демонстрируют, как совокупность факторов пациента и клинической ситуации формирует общий уровень риска периимплантита для данного случая.
Была использована минимально инвазивная техника сохранения сосочков (для облегчения закрытия лоскута) с буккальным и лингвальным доступом для визуализации внутрикостного дефекта. Хирургические цели включали удаление всей поддесневой патологической биопленки и остатков цемента, а также направленную костную регенерацию дефекта. В данном случае клиническим ожиданием для четырехстенного дефекта было достижение заполнения кости до уровня межзубной высоты кости соседних зубов.
Для тщательной очистки внутрикостного дефекта использовались кюреты с маленькими наконечниками и ультразвук, при этом поверхность имплантата не затрагивалась (Фото 3 и Фото 4). Впадины и резьба поверхности были аккуратно очищены с помощью воздушного полировщика (бикарбонат натрия) в течение 1 минуты, после чего участок был промыт стерильной водой в течение 1 минуты. После высушивания воздухом была нанесена ЭДТА на 1 минуту, затем снова промывание стерильной водой в течение 1 минуты, и предыдущие этапы были повторены. Костный трансплантат FDBA был замочен в стерильной воде, высушен марлей 2×2 и пропитан rhPDGF-BB (Фото 5). Трансплантат был плотно уложен в дефект с небольшим избытком над гребнем (Фото 6). Коллагеновая мембрана была разделена пополам и пропитана rhPDGF-BB. Затем коллагеновые мембраны были адаптированы на буккальной и лингвальной сторонах с небольшим перекрытием в межзубных промежутках для удержания трансплантата (Фото 7). Лоскуты были пассивно смещены коронально и в межзубных промежутках с использованием нерезорбируемых 6-0 полипропиленовых швов (Фото 8).
Фото 3: После удаления грануляционной ткани был виден дефект.

Фото 4: Интраоперационная хирургическая оценка периимплантационного дефекта показала область после очистки.

Фото 5: FDBA, пропитанный rhPDGF-BB, в стерильной чашке в начале операции.

Фото 6: Трансплантационный материал был помещен и утрамбован в дефект и над гребнем.

Фото 7: Коллагеновая мембрана, гидратированная rhPDGF-BB, была размещена над дефектами с межзубными расширениями.

Фото 8: Лоскуты были ушиты с использованием нерезорбируемых 6-0 полипропиленовых швов после коронального смещения.

Была выполнена послеоперационная внутриротовая рентгенограмма (Фото 9). Послеоперационные визиты проводились с интервалом в 2–3 недели. Пациентке было рекомендовано использовать хлоргексидин в течение 2 недель, после чего перейти на мягкую зубную щетку с двумя рядами щетинок и межзубную чистку нитью. Использование межзубных ершиков началось после снятия швов через 4 недели. Через 2 месяца заживление было отличным (Фото 10); через 9 месяцев наблюдалось полное восстановление межзубных сосочков, а рентгенологически подтверждено заполнение внутрикостного дефекта (Фото 11 и Фото 12). Через 1 год поддерживающие визиты проводились гигиенистом терапевтического кабинета.
Фото 9: Немедленная послеоперационная рентгенограмма.

Фото 10: Клиническая картина через 2 месяца после операции.

Фото 11: Рентгенограмма через 9 месяцев после операции, показывающая заполнение внутрикостного дефекта.

Фото 12: Клиническая картина через 9 месяцев после операции, демонстрирующая полную регенерацию и межзубные сосочки.

Контрольные визиты через 6 и 11 лет (Фото 13–Фото 15) подтвердили стабильные долгосрочные результаты регенерации мягких и твердых тканей, а также заживление кости.
Фото 13: Рентгенограмма через 6 лет после операции.

Фото 14: Клиническая картина через 6 лет после операции, показывающая стабильные результаты.

Фото 15: Серия прикусных рентгенограмм через 11 лет после операции, демонстрирующая стабильный уровень кости.

Вывод
Поражения, связанные с периимплантитом, могут быть классифицированы на человеческие факторы, ответ хозяина и локальные микробиологические факторы. Эти факторы интегрированы в инструмент оценки риска дефектов периимплантита (PIDRA) для определения потенциального уровня сложности, риска и успеха, связанного с лечением имплантата с периимплантитом. Внедрение контрольного списка восьми ключевых аспектов для лечения внутрикостных дефектов периимплантита способствует более стандартизированным и предсказуемым результатам лечения, а также снижению частоты осложнений.
Авторы:
Robert A. Levine, DDS
Alberto Monje, DDS, MS, PhD
Muhammad H.A. Saleh, BDS, MSD, MS
Debora R. Dias, DDS, MSc
Khushboo Kalani, DDS, MS
Harold M. Pinsky, DDS
Jeffrey Ganeles, DMD
Franck Renouard, DDS
Maurício G. Araújo, DDS, MSc, PhD




























































































































































0 комментариев