Концентраты тромбоцитов значительно продвинулись в области использования в качестве биологических добавок для хирургических ран. В настоящее время основное внимание уделяется концентратам тромбоцитов второго поколения, которые являются полностью аутологичными без каких-либо внешних добавок. В отличие от других концентратов тромбоцитов, жидкий или инъекционный фибрин, обогащенный тромбоцитами (i-PRF), является единственным, который получают в жидкой форме. Это свойство расширяет горизонты его применения практически в любой области медицины, включая множество вариантов применения в стоматологии. За последние несколько лет в исследователи предложили различные варианты получения i-PRF, такие как изменение в протоколе получения концентрата путем изменения времени центрифугирования, силы g и других факторов. Жидкая или инъекционная форма PRF также допускает другие модификации, такие как добавление различных биоматериалов в конечный продукт. В этой статье рассматриваются текущие фактические данные и достижения в отношении получения жидкого фибрина i-PRF и потенциалов для будущего применения данного препарата.

Первое опубликованное сообщение о концентрате тромбоцитов поступило от компании Matras в 1970 году. За этим последовало производство первых аутологичных клеев из фибрина, которые в конечном итоге заставили исследователей продолжить путь к разработке обогащенной тромбоцитами плазмы (PRP).
Последующая разработка обогащенного тромбоцитами фибрина без добавок (PRF) была анонсирована Choukroun (Чукрун) и коллегами в 2001 году, исследователями было объявлено о появлении концентратов тромбоцитов "второго поколения". С тех пор было проведено множество исследований и предложено несколько новых модификаций концентратов тромбоцитов. Данные варианты препаратов имеют множество различий, прежде всего в способах из приготовления, формах, в которых выходит готовый материал и области их применения.
Наиболее часто используемыми концентратами тромбоцитов второго поколения являются L-PRF (фибрин, богатый лейкоцитами и тромбоцитами) и A-PRF (усовершенствованный фибрин, богатый тромбоцитами). L-PRF был первым предложенным высоко-скоростным концентратом тромбоцитов; A-PRF, препарат, основанный на концепции медленной скорости центрифугирования, был введен позже. Оба концентрата широко используются в стоматологии для таких задач, как пластика синуса ( синус лифтинг), закрытие рецессий и лечение внутрикостных дефектов или дефектов в области фуркации корней зубов. Их использование обусловлено присущим им высоким содержанием различных факторов роста, таких как фактор роста эндотелия сосудов (VEGF), трансформирующий фактор роста-β1 (TGF-β1) и фактор роста, полученный из тромбоцитов (PDGF). Оба этих концентрата, однако, получают в предварительно желированной форме, что делает их непригодными для инъекций или смешивания с биоматериалами. Дальнейшая модификация первоначального протокола привела к разработке жидкого PRF. Он получается за 3 минуты, что предшествует коагуляции, но является достаточным временем для разделения компонентов. Поскольку коагуляция является активным процессом, после сбора жидкого PRF существует короткое окно возможностей (около 5 минут), в течение которого жидкость может быть либо введена, либо смешана с костными трансплантатами или другими биоматериалами до того, как она коагулирует. Эта универсальность жидкости, или PRF для инъекций (i-PRF), привела к росту популярности и расширению спектра применения препарата. В данном обзоре представлена обновленная информация о протоколах, биологическом профиле и будущих возможных областях применения жидкого PRF или i-PRF.
Жидкие концентраты тромбоцитов второго поколения
Оригинальный протокол создания обогащенного тромбоцитами фибрина привел к образованию предварительно свернувшегося, готового к использованию геля. В отличие от PRP первого поколения, который был получен в жидкой форме и мог быть смешан с костными трансплантатами, процесс коагуляции в обычном PRF уже был завершен. Это привело к двум основным недостаткам: его нельзя было вводить и нельзя было смешивать с каким-либо биоматериалом, таким как костный трансплантат, перед коагуляцией. Были предприняты попытки смешать обычную PRF с костными трансплантатами путем изготовления кусочков сгустков PRF и смешивания их с костными трансплантатами. Однако это было просто физическое смешивание, ничего подобного не достигалось путем смешивания костного трансплантата с PRP, затем его активации и инкапсуляции трансплантата в PRP. Для преодоления этих ограничений был предложен протокол использования жидкостной PRF/жидкий фибриноген который предполагал сбор отдельных компонентов крови, содержащих тромбоциты и фибриноген перед началом процесса коагуляции (от 3 до 8 минут - это нормальное время до начала коагуляции).
Первые сообщения в литературе об этом виде жидкого концентрата были сделаны Sohn (Сон) и коллегами за которыми последовали публикации от Mourão (Мурао) и коллег в 2015. Было предложено центрифугировать свежую кровь в течение двух минут при 3300 оборотах в минуту (об/мин) в пластиковых пробирках без покрытия, в которых отсутствуют обычные активаторы сгустков, такие как диоксид кремния. Данные исследователи описали агглютинацию концентрата с костным трансплантатом и отметили, что его можно использовать как есть или смешивать с биоматериалами и что он является отличной аутогенной альтернативой PRP. Принцип получения жидкого концентрата основан на двух ключевых факторах. Во-первых, используемая трубка представляет собой обычную пластиковую трубку без каких-либо покрытий. Обычная трубка для получения PRF представляет собой пластиковую трубку со стеклянным покрытием, содержащую диоксид кремния, который действует как активатор коагуляции, и, следовательно, продукт получается в свернувшемся виде. Обычные трубки с пластиковым покрытием по своей природе гидрофобны и не содержат активатора коагуляции, что способствует сохранению концентрата в жидкой форме. Вторым фактором является короткое время центрифугирования - от 2 до 4 минут. Это делается для того, чтобы концентраты извлекались в жидком виде до начала процесса коагуляции, который обычно происходит спустя 3-8 минут от начала процесса. Этого времени достаточно для разделения компонентов крови по их весу и размеру. Более тяжелые и крупные компоненты, такие как эритроциты (RBC) (размером от 6 до 8 микрон), оседают на дне пробирки и, следовательно, исключаются из концентрата, в то время как более легкие и мелкие компоненты, такие как тромбоциты (размером от 2 до 3 микрон) и лейкоциты перемещаются к верхней части трубки - пробирки. Верхняя фракция массы, находящаяся вблизи от эритроцитов затем отсасывается и используется в виде жидкостной формы PRF.
Влияние протоколов центрифугирования на производство жидкого фибрина i-PRF
Первоначальный протокол центрифугирования i-PRF был высокоскоростным и кратковременным, при этом скорость центрифуги составляла около 3000 оборотов в минуту. Затем в 2017 году Choukroun (Чукрун), Miron (Мирон) и коллеги в соответствии со своей "концепцией низкой скорости", предложили модифицированный протокол, в котором скорость центрифугирования была снижена до 700 оборотов в минуту в течение 3 минут, после чего верхнюю часть пробирки, имеющую желтое содержимое, отсасывали и переводили в жидкую форму. Они предположили, что более низкая скорость увеличивает количество жизнеспособных клеток в концентрате и может усиливать, и продлевать его биологическую активность, обеспечивая при этом достаточную силу и время для эффективного разделения клеточных компонентов. Одновременно Wend (Венд) с коллегами провели подробное исследование, в котором оценивалось влияние различных скоростей и времени центрифугирования на конечный продукт сыворотки крови. Они изучили влияние протоколов с низкой (700 об/ мин), средней (1400 об / мин) и высокой скоростью (2800 об / мин), все в течение 3 минут, и заметили, что снижение относительной центробежной силы привело к увеличению количества тромбоцитов и лейкоцитов в сыворотке и, следовательно, обеспечило большую биологическую активность с точки зрения высвобождения различных факторов роста, таких как VEGF, PDGF и эпидермальный фактор роста (EGF).
Однако в 2020 году Miron( Мирон) и его коллеги представили новый вариант концентрата клеток PRF, или C-PRF, протокол их получения включает в себя центрифугирование цельной крови в пластиковых пробирках без покрытия с использованием высоко-скоростного протокола получения L-PRF, т.е. 2700 оборотов в минуту в течение 12 минут. Согласно их данным, это изменение приводит к большему разделению компонентов крови, и, также было отмечено, что большинство клеток располагаются непосредственно рядом со слоем эритроцитов в охристой оболочке, а верхняя часть пробирки состоит только из плазмы, бедной тромбоцитами. Количество лейкоцитов в охристой оболочке было увеличено примерно на 500-750%, а тромбоцитов - примерно в 15 раз по сравнению с трехкратной концентрацией данных компонентов при первоначальном протоколе получения жидкого фибрина i-PRF при 700 оборотах в минуту по сравнению с его содержанием в цельной крови. Авторы пришли к выводу, что селективный сбор охристой оболочки непосредственно рядом со слоем эритроцитов приводил к образованию более обогащенного по клеточному составу i-PRF при использовании высоких скоростей.
Когда были изучены различные протоколы, которые включали протоколы центрифугирования по 5 минут, 8 минут и 12 минут при 3000 об/мин, был сделан вывод, что 5-минутный протокол был неэффективен для достижения оптимальной концентрации клеток, 8-минутный протокол был удовлетворительным, и дальнейшее центрифугирование в течение 12 минут не дало никакого дополнительного эффекта. Кроме того, наблюдалось гораздо более высокое высвобождение компонентов PDGF-AA, TGF-β1 и EGF и более высокая миграция и пролиферация клеток фибробластов десны наряду с повышенной продукцией мРНК для коллагена I типа по сравнению с обычным протоколом получения i-PRF.
Обоснование, которое Miron (Мирон) и коллеги привели, для таких противоречивых результатов из своих предыдущих исследований, в которых говорилось, что низкоскоростные протоколы имеют преимущество в производстве большего количества клеток, главным образом заключалось в том, что в более ранних исследованиях оценивался препарат i-PRF из верхней части пробирки, который включал плазму с низким содержанием тромбоцитов и, возможно, разбавлял сам i-PRF и/или наиболее богатая клетками часть плазмы клеток оставалась не востребованной в пробирке, так как находилась вдали от верхней части трубки, непосредственно рядом с участком эритроцитов. В конце концов, они пришли к выводу, что когда была изучена охристая оболочка рядом с эритроцитами, стало совершенно ясно, что высокоскоростной протокол обладает превосходной способностью продуцировать клетки с высокой биологической активностью.
В литературе существует неопределенность в отношении терминологии, которая должна применяться для данного вида жидкого концентрата тромбоцитов второго поколения. Кроме того, были опубликованы незначительные модификации одних и тех же протоколов под разными названиями. Необходимо решить этот вопрос, чтобы обеспечить стандартизацию в различных научных исследованиях. Методика получения i-PRF все еще находится в зачаточном состоянии, и ожидается, что в течение следующих нескольких лет дальнейшие исследования однозначно укажут на превосходство одного протокола получения продукта над другим.
Модификации первоначального протокола получения жидкого фибрина i-PRF
Было предложено несколько оригинальных модификаций первоначального протокола производства i-PRF. Они включают изменения скорости центрифугирования, количества времени центрифугирования, места аспирации, смешивания с другими биоматериалами для повышения насыщенности клеточным составом готового продукта, а также для получения композитных трансплантатов и увеличения времени их деградации in vivo.
Желтая и красная части жидкого фибрина i-PRF
Обычно желтую часть порции жидкости i-PRF отсасывают и используют. Однако нет четких указаний относительно того, какую часть i-PRF следует аспирировать или куда именно следует поместить кончик иглы шприца для аспирации. В соответствии со стандартным протоколом производства i-PRF, т.е. при 700 оборотах в минуту в течение 3 минут, в зависимости от уровня сбора i-PRF концентрат классифицировался либо как желтый i-PRF, или как красный i-PRF (фото 1 - 2). Wang (Ванг) с коллегами сообщили, что сбор верхнего слоя i-PRF, выше места соединения с охристой оболочкой, привел к получению желтой фракции i-PRF. Thanasrisuebwong (Танасрисуэбвонг) коллегами, тем временем, собрали порцию i-PRF из желтой зоны и места соединения с охристой оболочкой, в результате чего был получен красный препарат i-PRF. При сравнении красного и желтого препаратов i-PRF было замечено, что красный i-PRF содержал больше клеток и фактора роста, производного тромбоцитов; однако желтая часть i-PRF демонстрировала более высокое содержание фибрина, что способствует свертываемости крови благодаря содержанию угловых клеток- α и твердости самого сгустка. Когда были оценены и сравнены эффекты красного и желтого i-PRF на воздействие на стволовые клетки периодонтальной связки человека, был сделан вывод, что красный i-PRF лучше мобилизует стволовые клетки и обеспечивает превосходную миграцию и пролиферацию стволовых клеток периодонтальной связки человека. Эти улучшенные биологические свойства должны приводить к улучшению начального заживления ран и, таким образом, могут быть более эффективными в сочетании использованием с костных трансплантатов для целей регенерации тканей.
Фото 1. Компоненты, образовавшиеся после центрифугирования свежей крови в течение 3-5 минут в пластиковой пробирке без покрытия (i-PRF = PRF для инъекций, RBC = эритроциты)
(обозначения на фото: бедная тромбоцитами плазма; Желтый компонент i-PRF; Красный компонент i-PRF; основная масса крови, состоящая из эритроцитов;).
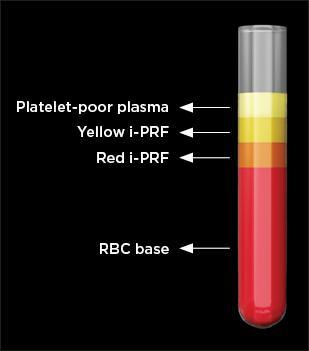
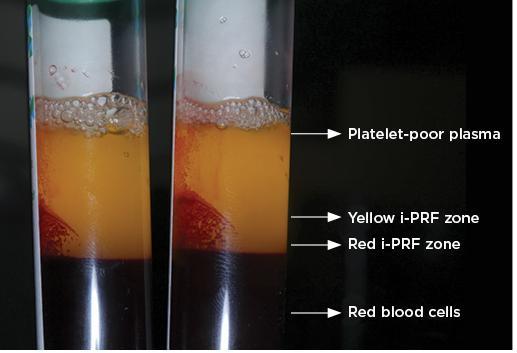
Фото 2. Варианты i-PRF: красный i-PRF и желтый i-PRF. (Обозначения на фото: Бедная тромбоцитами плазма; Зона желтой фракции i-PRF; Зона красной i-PRF; Красные клетки крови;).
Концентрированный обогащенный тромбоцитами фибрин PRF
Как отмечалось ранее, Miron (Мирон) и коллеги в 2020 году предложили концепцию использования концентрированного PRF, или C-PRF, где цельная кровь центрифугируется в обычных пластиковых пробирках без покрытия с использованием протокола L-PRF, т.е. при 2700 оборотах в минуту в течение 12 минут. Это приводит к большему разделению компонентов крови, и, при этом, большинство клеток в слое охристой оболочки объемом от 0,3 мл до 0,5 мл располагались непосредственно рядом со слоем эритроцитов. В C-PRF желтая часть занимает более 50% пробирки по сравнению с около 1-2 мл (примерно, от 10% до 20%) в i-PRF. В C-PRF количество лейкоцитов было увеличено примерно на 500-750%, а тромбоцитов - примерно в 15 раз больше, чем в крови, по сравнению с трехкратной концентрацией тромбоцитов по первоначальному протоколу i-PRF.
Альбуминовая часть жидкого фибрина PRF
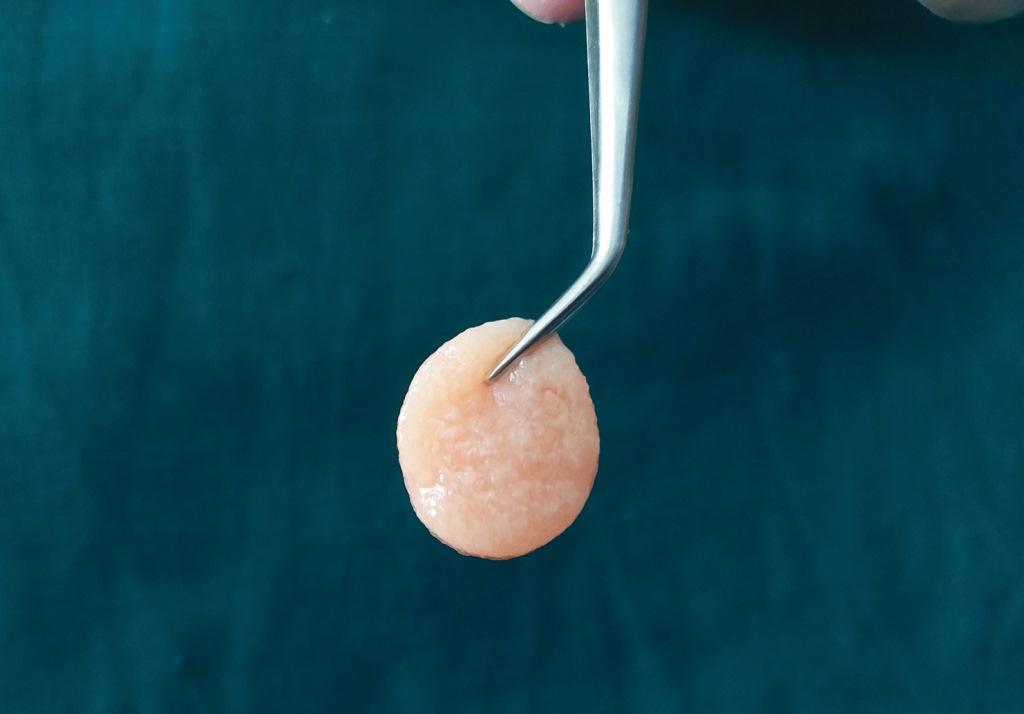
Одним из основных ограничений обычного PRF является его короткий срок годности in vivo, этот материал можно использовать- около 10 дней. Чтобы противостоять этому, новый альбумин PRF был недавно представлен Fujioka-Kobayashi (Фудзиока-Кобаяши) и коллегами. Это была модификация аналогичного протокола, известного как альбумин концентрированный фактор роста, который имел срок службы in vivo от 4 до 6 месяцев, однако был полностью лишен клеток. Протокол производства PRF альбумина включает центрифугирование 10 мл крови при 700 g в течение 8 минут с последующим нагреванием верхней части плазмы, бедной тромбоцитами, в течение 10 минут при 75°C и охлаждением ее до комнатной температуры для получения денатурированного альбуминового геля. Затем его смешивают с охристой частью плазмы (i-PRF), используя систему фиксации Luer (Люэра) "самка-самка" (фото 3). Таким образом, простая стадия термической обработки PRF способна отдалить процесс разложения PRF примерно до 4 недель.
Фото 3. Альбуминовая часть сыворотки фибрина богатого тромбоцитами PRF (денатурированный альбумин с i-PRF) является вариантом i-PRF.
При ультраструктурном исследовании было обнаружено, что этот препарат содержит жизнеспособные клетки, распределенные по всему его матриксу. Fujioka-Kobayashi (Фудзиока-Кобаяши) и коллеги изучали высвобождение факторов роста в течение 10 дней и наблюдали медленное и постепенное высвобождение PDGF-AA/BB и TGF-β1. Gheno (Гено) и коллеги изучали биосовместимость и свойства расширенного процесса денатурации клеток, по сравнению с L-PRF препаратами отметили, что PRF альбуминовая сыворотка останется стабильной по объему в течение 21 дней по сравнению с 7 днями для L-PRF сывороткой. Этот препарат по существу сочетает в себе длительный срок службы денатурированного PRF фибрина in vivo с насыщенностью клетками и биологической активностью обычного PRF фибрина и может быть использован для направленной регенерации костей или тканей. Необходимы дальнейшие исследования, оценивающие его свойство к окклюзии клеток и другие свойства, чтобы убедиться в его эффективности в различных клинических сценариях.
Добавление биоматериалов
Основное преимущество i-PRF по сравнению с другими концентратами тромбоцитов второго поколения, такими как A-PRF и L-PRF, заключается в том, что он коагулирует после получения, что позволяет врачам смешивать биоматериалы, которые попадают в фибриновый матрикс. Смешивание i-PRF с костными трансплантатами, определенными лекарственными препаратами и другими биоматериалами было изучено и представляет собой нишу, имеющую огромный потенциал для исследований и клинического применения.
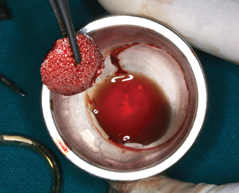
Костные трансплантаты – Когда Mourão (Мурао) и коллеги в 2015 году описали жидкую тромбоцитарную массу PRF, они продемонстрировали ее полимеризацию, в том числе с помощью костных трансплантатов. Материалы для костного трансплантата по-прежнему остаются наиболее распространенным компонентом любого композитного трансплантата, используемого в сочетании с i-PRF. Несколько форм жидких клейких материалов на основе фибрина PRF, таких как аутологичный фибриновый клей (2700 об / мин в течение 2 минут), концентрированный фактор роста (ускоряется в течение 30 секунд; центрифугируется при 2700 об / мин в течение 2 минут, 2400 об / мин в течение 4 минут, 2700 об / мин в течение 4 минут и 3000 об / мин в течение 3 минут; замедляется в течение 36 секунд до полной остановки стандартный i-PRF (700 оборотов в минуту в течение 3 минут) смешивали с различными трансплантатами для создания композитных клеящихся материалов подходящих для целей подсадки тканей, при их дефиците. В общем, как только была получена жидкая форма тромбоцитарной массы обогащенной фибрином PRF ее начали смешивать с гранулами материала для подсадки кости и оставляли для полимеризации. Полученная ткань трансплантата представляет собой трехмерную полимеризованную матрицу, в которой частицы трансплантата заключены в фибриновый матрикс. Данный материал назван липкой костью или липким гелем (фото 4 - 5).
Фото 4 - 5. Липкая кость (i-PRF с костным трансплантатом) - это еще один вариант i-PRF.
Другой препарат костного трансплантата с PRF известен как PRF-блок. Это комбинация A/L-PRF с костным трансплантатом и i-PRF. В этом препарате PRF и i-PRF смешиваются в соотношении 50:50 с костным трансплантатом. Он действует как биологически активный каркас, который не только способствует миграции клеток-предшественников остеопротеина, но и способствует высвобождению факторов роста. Эти композитные трансплантаты обладают хорошими эксплуатационными свойствами и дополнительным преимуществом в виде увеличенного объема и используются для устранения апикальных дефектов, внутрикостных дефектов, а также увеличения объема кости и альвеолярного гребня.
Antibiotics-Miron и Zhang (Антибиотикс-Мирон и Чжан) в обзоре впервые указали на потенциал применения i-PRF при смешивании его с антибиотиками и последующего действия в качестве системы непрерывной доставки лекарств. В пилотном исследовании Rafiee (Рафии) и коллеги оценивалась комбинация различных противомикробных препаратов, включая метронидазол, ципрофлоксацин и миноциклин, с i-PRF путем погружения материала в лекарство и его интеграции с ним. Они пришли к выводу, что погружение было более эффективным методом и что высвобождение препарата наблюдалось в виде всплеска в течение 24 часов, после чего медленное высвобождение наблюдалось еще в течение 14 дней.
Концепция горизонтального центрифугирования
В 2019 году Miron ( Мирон) и коллеги предложили новый протокол центрифугирования, получивший название "концепция щадящего центрифугирования", при котором пробирку помещали в горизонтальное положение для центрифугирования. Наблюдалось превосходное разделение клеток и меньшее повреждение клеток благодаря меньшему трению по сравнению с обычным центрифугированием. Авторы назвали его био-PRF и пришли к выводу, что он приводит к самой высокой концентрации тромбоцитов и лейкоцитов в полученном материале.
Текущие данные, касающиеся применения жидкого фибрина i-PRF
С момента создания i-PRF в 2015 году было проведено множество исследований in vitro, на животных и клинических исследований с использованием базовых и других модифицированных протоколов. В следующих разделах приводится краткое изложение текущей литературы (таблица 1).
Так, при применении жидкого фибрина в области периодонтальной связки, исследователи обнаружили увеличение миграции клеток, пролиферации и минерализации. При смешивании с человеческими остеобластами, также наблюдается увеличение процесса миграции клеток, пролиферации, продукции щелочной фосфатазы ALP и минерализации клеток, повышается уровень глюкозы-BMP-2 и остеонектина. Со стороны фибробластов десны наблюдается также большая миграция клеток и усиленная выработка коллагена.
Макрофаги и дендритные клетки реагируют молниеносным уменьшением воспалительного процесса. Клетки макрофагов уменьшают выработку остеокластов.
Фибробласты дермы реагируют выработкой факторов роста и фибронектина. Клетки эндотелия начинают выстраивать структуры, напоминающие микрососуды. Наблюдается стойкий антимикробный эффект при применении клеток плазмы для лечения заболеваний пародонта и эффект воздействия на саму микробиоту полости рта, который заключается в том, что значительно уменьшается количество стрептококков во рту. Нужно отметить, что ученые проводили исследования на мышах и кроликах вводя им i-PRF сыворотки для восстановления утерянного объема костной ткани во время различных воспалительных процессов и отмечали при этом значительное замедление воспаления после использования препарата и образование новой костной ткани. Исследователи отмечали значительное улучшение клинически при применении сыворотки i-PRF в комбинации при лечении различных дефектов десны, рецессий, утолщения биотипа самой десны. Врачи-стоматологи ортодонты наблюдали ускорение процесса движения зубов при использовании препаратов i-PRF во время ортодонтического лечения. Также препараты жидкого фибрина применяли при лечении таких заболевания как эрозивный плоский лишай и Алопеция и наблюдали улучшение роста волос, уменьшение болевых ощущений у пациентов и уменьшение размеров самих эрозий во рту, при ринопластике доктора отмечали хорошее восстановление хряща и заживление самих послеоперационных ран.
Воздействие на различные типы клеток
Исследование, в котором оценивалось биологическое воздействие жидких PRF и PRP сывороток на клетки пародонта человека, продемонстрировало, что i-PRF усиливает миграцию клеток, пролиферацию и минерализацию по сравнению с PRP. Кроме того, i-PRF снижал продукцию воспалительной мРНК, индуцированную бактериальным липополисахаридом. Это подчеркивает положительное влияние i-PRF на процесс заживления ран, а также его свойство стимулировать иммунные реакции. Другое сравнительное исследование in vitro, проведенное на первичных остеобластах человека, которые частично были соединены с концентратом i-PRF, а другая часть была помещена в инкубационную камеру без добавления i-PRF, показало, что клеточные линии, инкубированные с i-PRF, продемонстрировали повышенную клеточную пролиферацию и миграцию, продукцию щелочной фосфатазы (ALP), продукцию костного морфогенетического белка-2 (BMP-2) и продукцию остеокальцина. Данный факт напрямую демонстрирует потенциал использования i-PRF для получения более быстрой и превосходной регенерации костной ткани. В сочетании с аллогенными или ксеногенными костными трансплантатами i-PRF продемонстрировал повышенную продукцию BMP-2, ALP и остеонектина на остеобластах человека, что указывает на то, что смешивание i-PRF с костными трансплантатами повышает биологическую активность полученного композитного материала.
Модель культивирования in vitro для индустрии инженерии костной ткани с целью изучения процесса улучшенного ангиогенеза была создана для оценки влияния i-PRF на эндотелиальные клетки роста и первичные остеобласты после 7 дней комплексного культивирования.
Исследование показало формирование микрососудоподобных структур, демонстрирующих улучшение процесса ангиогенеза. Другое исследование было проведено для изучения биологического воздействия i-PRF на стволовые клетки пульпы зуба человека. Был сделан вывод, что 5% i-PRF усиливают миграцию и пролиферацию клеток, мРНК коллагена I типа альфа 1, сиалопротеина дентина и белков дентинного матрикса, что указывает на потенциал i-PRF для применения материала во время проведения различных эндодонтических процедур.
Было проведено сравнительное исследование in vitro с использованием i-PRF и PRP на стволовых клетках десны на поверхности титановых имплантатов; было отмечено, что применение i-PRF препарата индуцировало более высокую миграцию клеток, а также во время применения препарата было отмечено повышение уровней продукции мРНК PDGF, TGF-β, коллагена I типа и фибронектина по сравнению с PRP фибриновой сывороткой. Данный факт демонстрирует, что покрытие i-PRF материалом поверхности имплантатов может способствовать превосходной локализованной реакции со стороны мягких тканей. Другое сравнительное исследование, проведенное для подтверждения эффектов применения препаратов i-PRF и PRP на стимуляцию, миграцию, пролиферацию и синтез коллагена фибробластов кожи, показало повышенную миграцию клеток, пролиферацию, продукцию мРНК PDGF для TGF-β и фибронектина с группами клеток, культивируемых с i-PRF. Исследование по изучению противовоспалительных эффектов i-PRF обогащённого фибрина на макрофаги и дендритные клетки показало, что i-PRF фибрин снижает продукцию провоспалительных клеток фенотипа M1 макрофагов и активирует дендритные клетки вокруг зоны распространения инфекции, а также продемонстрировало ингибирование toll-подобного рецептора-4 (TLR-4) и p-P65. Аналогичное исследование было проведено на макрофагоподобных клетках для изучения воспалительной реакции i-PRF и остеокластогенеза путем местного применения i-PRF фибрина. Обнаружено активирование процесса экспрессии интерлейкина-6 (IL-6) и циклооксигеназы-2, и выявлено, что i-PRF снижает экспрессию генов-маркеров остеокластов тартрат-устойчивой кислой фосфатазы (TRAP) и катепсина К.
Антимикробный эффект
Было проведено сравнительное исследование для оценки антимикробной эффективности PRP, PRF и i-PRF препаратов фибрина путем анализа минимальной ингибирующей концентрации, максимальной бактерицидной концентрации и ингибирования биопленки. Исследование показало, что все три концентрата тромбоцитов обладают антибактериальным действием; однако i-PRF был более активным, поскольку была обнаружена широкая зона ингибирования в отношении Porphyromonas gingivalis и Aggregatibacter actinomycetemcomitans. Аналогичное исследование было проведено с использованием i-PRF тромбоцитарной массы для оценки антимикробного потенциала и возможности блокирования процесса образования биопленки в отношении изолятов стафилококка для орального применения путем микродилюции бульона в минимальной ингибирующей концентрации. I-PRF препарат продемонстрировал антимикробную эффективность против золотистого стафилококка и стафилококка эпидермального. Данные исследования демонстрируют, что i-PRF тромбоцитарная масса может быть использована для профилактики инфекции в местах хирургического вмешательства.
Исследования на животных
Экспериментальное исследование на животных было проведено на 24 крысах-альбиносах Вистар, которым вводили i-PRF препарат плазмы на первый, третий и седьмой дни либо изолированно, либо совместно с процедурой снятия зубных отложений, ткани оценивали гистопатологически и иммуногистохимически. Поддесневая инъекция i-PRF массы показала отличные результаты по части уменьшения потери объема костной ткани, модуляции воспалительного процесса и воздействии на цитокины. Было проведено сравнительное исследование с использованием PRP и i-PRF препаратов плазмы крови при модуляции воспалительного процесса и воздействии на цитокины. Установлено, что препараты усиливают пролиферацию хондроцитов и уровни мРНК SOX9, коллагена II типа и аггрекана.
Было проведено исследование для сравнения остеоиндуктивной и остеопромоторной вариабельности между различными деминерализованными костными аллотрансплантатами. Двадцать семь самцов крыс линии Вистар были пролечены с целью уменьшения дефектов бедренной кости и внутримышечных вен. Гистологический анализ через 2, 4 и 8 недель после имплантации, окрашивание гематоксилином и эозином, сафранином-О, TRAP и остеопонином. В ходе исследования был сделан вывод о значительном снижении воспалительного фенотипа M1 макрофагов и активировании дендритных клеток, вместе ингибированием TLR-4 и p-P65 на участке пути NF-κB.
Клиническое подтверждение при использовании у человека
Было проведено рандомизированное контролируемое исследование, чтобы определить, улучшит ли трансплантат соединительной ткани (CTG) в сочетании с применением i-PRF и коронарным лоскутом(CAF) закрытие оголенной части корней при лечении рецессии десны I или II класса по Миллеру по сравнению с применением CTG и KAF по отдельности. Соединительную ткань CTG собирали и хранили в сыворотке i-PRF в течение 15 минут, затем препарат покрывали слоем полимеризованного i-PRF фибрина. Через 6 месяцев после операции полное покрытие корней было получено в 88% участков, обработанных i-PRF фибрином. В ходе исследования был сделан вывод, что использование i-PRF с CAF привело к значительному увеличению образования ороговевшей ткани и уменьшению глубины рецессии, что авторы приписали к превосходному ангиогенезу и резистентности, обеспеченным i-PRF. Было проведено другое исследование для изучения потенциального влияния i-PRF фибрина при проведении операции закрытия корня свободной частью десневого трансплантата (FGG). Сорок пациентов были случайным образом разделены на две группы; пациенты в контрольной группе подвергались только процедуре FGG, в то время как пациентам в экспериментальной группе приживлялся лоскут FGG совместно с инъекцией i-PRF в качестве средства для биомодификации поверхности корня (FGG + i-PRF). Полученную толщину покрывного слоя слизистой в области корня зуба сравнивали через 3 месяца, и было показано, что группе получившей инъекцию i-PRF толщина полученного покрывного слоя слизистой была значительно лучше.
Была опубликована серия случаев применения CAF в сочетании с липкой костью и коллагеновой мембраной, покрытой i-PRF фибрином для лечения одиночных рецессий десны на верхней челюсти. Пациентам с изолированной рецессией I или II класса по Миллеру, а в эстетической зоне верхней челюсти проводилось лечение с использованием липкой кости (i-PRF + лиофилизированный костный аллотрансплантат [FDBA]) с коллагеновой мембраной, покрытой i-PRF, и CAF. Клинические параметры, включая глубину зондирования, ширину ороговевшей десны, толщину десны и глубину рецессии, регистрировались в исходном состоянии и через 6 месяцев после операции. Исследование показало, что использование липкой кости (i-PRF + FDBA) и коллагеновой мембраны, покрытой i-PRF, приводят к значительному увеличению ширины и толщины десны, а также к увеличению толщины кости.
В изолированном исследовании полости рта оценивалось изменение биотипа десен после введения i-PRF сыворотки Десять соматически здоровых пациентов с тонким биотипом получали лечение инъекцией i-PRF. Статистически значимое улучшение толщины десен наблюдалось через 1 месяц после проведения четырех инъекций при помощи микро игл . В сравнительном исследовании 36 пациентов, нуждающихся в пересадке надкостничного лоскута (FGG) изучалось влияние применения i-PRF инъекций на заживление ран в области неба Заживление ран с помощью теста на перекись водорода и визуальной аналоговой шкалы боли оценивали на третий, седьмой и 14-й дни и через один месяц. Группы пациентов, у которых применялся i-PRF препарат, продемонстрировали улучшенную эпителизацию и заживление ран, уменьшение послеоперационного кровотечения и превосходные эстетические результаты.
В пилотном исследовании, в котором оценивалось образование новой кости после увеличения объема дна Гайморовой пазухи коллагеновыми пробками, пропитанными i-PRF фибрином, спустя 6 месяцев после вмешательства было отмечено значительное образование новой кости как на мезиальной, так и на дистальной поверхностях имплантатов в данной области. Это указывает на положительную роль, которую может играть применение препаратов в имплантологии. В рандомизированном контролируемом исследовании оценивалась эффективность i-PRF фибрина для ускорения передвижения клыков и изучались уровни матриксной металлопротеиназы-8 (MMP-8), IL-1β, RANKL и остеопротегерина в жидкости десневой щели во время ортодонтического лечения и процесса перемещения зуба. Двадцать пациентов с нарушением прикуса 2-го класса II подкласса были включены в исследование изолированно полости рта с применением i-PRF фибрина и без него. Значительное увеличение скорости перемещения зубов и стимуляция уровней цитокинов продемонстрировали преимущества i-PRF, показав тем самым потенциал применения данного препарата в ортодонтии.
Было проведено рандомизированное контролируемое исследование для оценки эффективности использования i-PRF фибрина при лечении эрозивной формы плоского лишая. В данном исследовании изолированно полости рта одну сторону слизистой обрабатывали при помощи введения инъекции i-PRF фибрина, а другую - ацетатом метилпреднизолона в течение четырех сеансов с интервалом в 15 дней. Было обнаружено, что инъекция i-PRF на участок пораженной слизистой уменьшает боль и размер поражения и повышает удовлетворенность пациента, аналогично кортикостероидам. В недавнем отчете о применении i-PRF фибрина при лечении плазмоклеточного мукозита у пациента, который был не восприимчив к терапии кортикостероидами, инфильтрации выполнялись один раз в неделю в течение 2 месяцев. В течении этого времени полностью исчезла боль и клинически уменьшилось воспаление, полного разрешения болезни не наблюдалось.
Другое рандомизированное контролируемое исследование было проведено при лечении дорсальных нарушений с помощью ринопластики. Сорок пациентов были случайным образом разделены на две группы: с применением i-PRF фибрина и без него. I-PRF препарат смешивали с нарезанным кубиками хрящом (получался липкий хрящ). В группе получившей i-PRF препарат было обнаружено уменьшение потери толщины хряща и повышение жизнеспособности хряща. В отчете о клиническом случае, посвященном влиянию i-PRF фибрина на лечение алопеции, пациентам было проведено четыре курса инъекций i-PRF препарата с перерывами в 15 дней. Хотя легкие кровоподтеки наблюдались в течение 3 дней, после инъекции наблюдалось значительное улучшение роста волос, что объяснялось высоким регенеративным потенциалом и наличием стволовых клеток в препарате. Еще одно рандомизированное контролируемое исследование было проведено для оценки преимуществ применения i-PRF жидкого фибрина у пациентов с жалобами на боль и подозрением на наличие дисфункции нижне-челюстного сустава (ВНЧС). Тридцать три пациента были случайным образом отобраны с дисфункцией ВНЧС, и значительное уменьшение боли наблюдалось через 8 недель, 3 месяца, 6 месяцев и 12 месяцев. Таким образом, в исследовании был сделан вывод о том, что i-PRF жидкий фибрин оказывает длительное обезболивающее действие при лечении болезненных нарушений ВНЧС и что он будет хорошо подходить пациентам с IV / V стадией болезни Уилкса (от промежуточной до поздней стадии). Другое исследование возможности применения i-PRF фибрина включало в себя способ омоложения нижней трети лица при помощи инъекций препарата, продемонстрировало хорошие результаты, также как и при лечении алопеции с помощью инъекций i-PRF жидкого фибрина.
Наконец, была опубликована серия примеров воздействия i-PRF препарата на дерматологические заболевания, включая упомянутую алопецию и увеличение периорбитальной области. Исследование показало, что i-PRF жидкий фибрин обладает превосходным эффектом стимулировать заживление ран и благоприятными свойствами высвобождения фактора роста, которые помогают в лечении андрогенной алопеции и при омоложении периорбитальной области, а также в качестве временного наполнителя (филлера).
Обсуждение и клиническое применение
Основное различие между концентратами тромбоцитов первого и второго поколения заключается в том, что последние являются полностью аутологичными и не содержат добавок, таких как хлорид кальция и бычий тромбин, которые необходимы для производства PRP. Введенный в стоматологию в 1994 году, PRP широко использовался для различных областей в клинической практике; однако препарат получил большее распространение в медицинском мире, где он использовался для лечения различных заболеваний, таких как остеоартрит, острое повреждение мышц, восстановление вращательной манжеты, регенерация тканей, ревизия рубцов, омоложение кожи, алопеция, и многое другое. Обычно используется PRP препарат содержащий в себе 97% тромбоцитов, которые действуют как богатые источники PDGF, инсулиноподобного фактора роста, VEGF, ангиогенного фактора, получаемого из тромбоцитов, и TGF-β, а также фибронектина и витронектина, которые высвобождаются при активации препарата. В процессе внедрения данных препаратов в стоматологию, концентраты тромбоцитов второго поколения были быстро приняты из-за их простоты приготовления, превосходной биологической активности и их полностью аутологичной природы. Однако большая часть применения подобных PRP тромбоцитарных масс использовалась в медицине для лечения алопеции или тендинита, и была обусловленна возможностью использовать препараты в форме инъекций и, таким образом, обычные PRF тромбоцитарные массы использовались не так широко. Однако ситуация меняется в связи с недавним появлением жидкого концентрата тромбоцитов второго поколения, полностью свободного от добавок. Основываясь на клиническом опыте авторов, i-PRF преарат в настоящее время используется гораздо чаще, чем его аналоги, такие как A-PRF и L-PRF, для различных областей применения как в медицине, так и в стоматологии.
Ограничением применения технологии PRP тромбоцитарной массы является ее внезапная полимеризация при добавлении активаторов, таких как бычий тромбин и хлорид кальция; это в отличие от полимеризации, достигаемой с помощью i-PRF фибрина, который не содержит добавок и, следовательно, он физиологичен. Данный эффект в первую очередь проявляется в продолжительности биологического действия; известно, что PRP масса высвобождает 90% содержащегося в себе фактора роста в течение первых 24 часов, PRF масса обладает способностью длительного и медленного высвобождения компонентов до 7-10 дней. Данное свойство может быть полезным при продлении биологическое действие in vivo и может привести к превосходным результатам. Также превосходное биологическое воздействие жидкого PRF можно объяснить его трехмерной фибриновой сетью, включающей тромбоциты, лейкоциты, коллаген I типа, остеокальцин и различные факторы роста. Эти факторы роста медленно высвобождаются в течение 10 дней и способствуют усиленной миграции клеток, пролиферации и экспрессии мРНК TGF-β, PDGF, коллагена I типа и остеокальцина в различные типы клеток, включая остеобласты, хондробласты и пульпозные клетки.
Несколько желаемых свойств i-PRF фибрина побудили использовать его в стоматологии, где он показал многообещающие результаты. Решение таких задач как лечение рецессии десны I и II классов по Миллеру, улучшение биотипа десны, перевязка и заживление ран в области неба, пластика дна синуса с одновременной установкой имплантата или без нее, увеличение скорости ортодонтического перемещения зубов, омоложение нижней трети лица и лечение заболеваний ВНЧС, эрозивного красного плоского лишая полости рта и плазмоклеточного мукозита, среди многих других (фото 6 - 10). Дальнейшие клинические исследования могут открыть еще несколько областей применения, там где ранее применяли PRP препараты, например лечение переломов зубов в области фуркации или внутрикостных дефектов в сочетании с костными трансплантатами и покрытием поверхности имплантатов. Данные о типах клеток, таких как периодонтальная связка и фибробласты десны, остеобласты и хондроциты, по активности, такой как пролиферация и дифференцировка, также указывают на потенциал применения для целей косметической, стоматологической и оральной регенерации. Другим направлением использования i-PRF является применение препарата в сочетании с добавлением его к различным биоматериалам. При смешивании с костными трансплантатами он образует податливую массу, похожую на блок, которая обладает превосходными свойствами по сравнению с обычными материалами в виде частиц и гранул. Кроме того, добавление антибиотиков может позволить использовать его для местной доставки лекарств непосредственно на стоматологическом приеме или в качестве покрытия для имплантатов для достижения оптимальных клинических результатов.
Фото 6. Клиническое применение i-PRF: закрытие операционного поля в области неба, повязка с i-PRF фибрином и A-PRF.
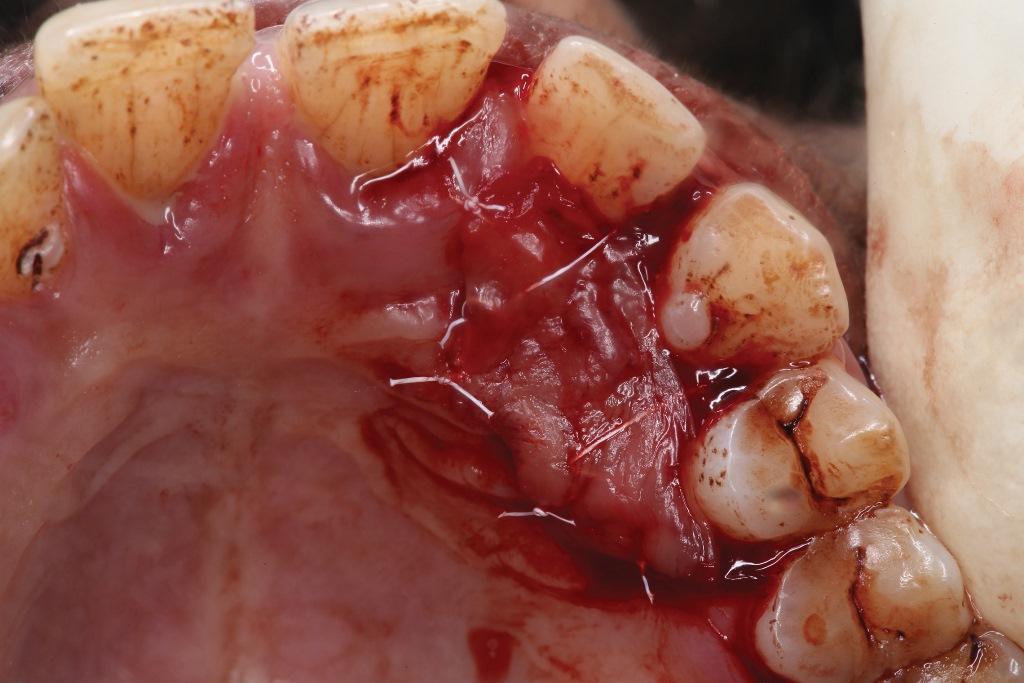
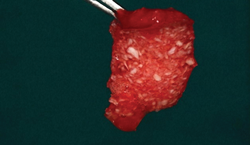
Фото 7. Клиническое применение i-PRF: липкая кость для сохранения формы и объема лунки в области удаленного зуба.
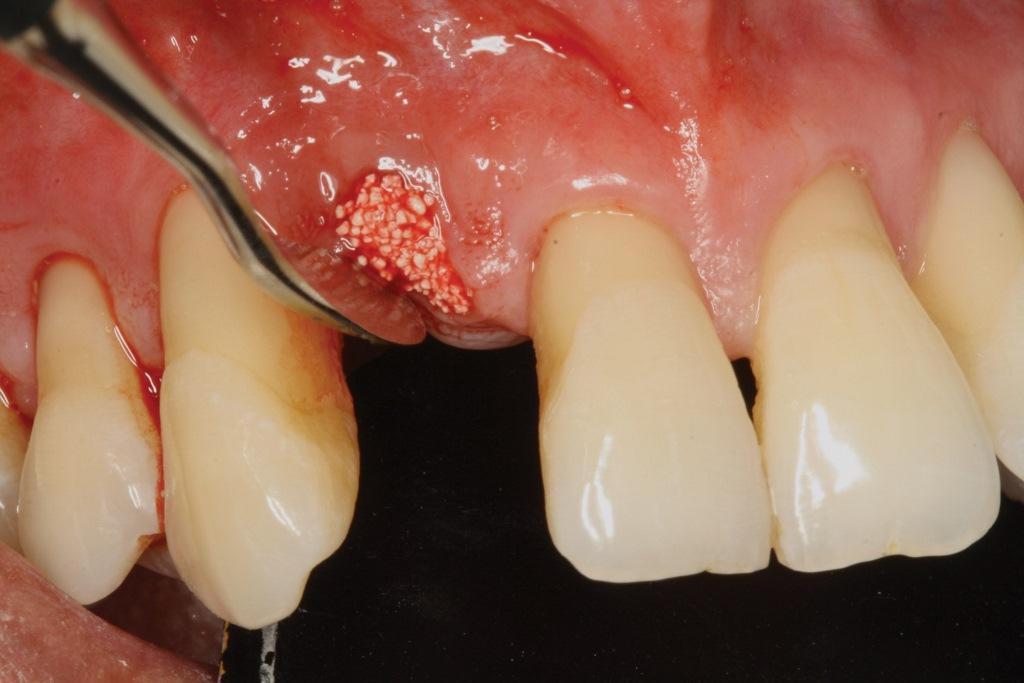
Фото 8. Клиническое применение i-PRF: костный блок смешан с препаратом жидкого PRF с целью увеличения объема альвеолярного гребня.
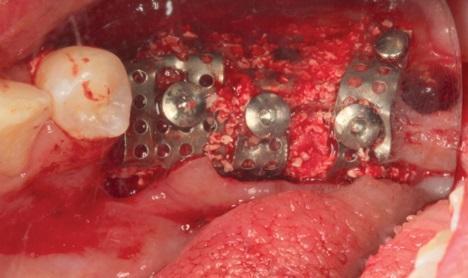
Фото 9. Клиническое применение i-PRF: липкая кость для восполнения дефекта в области корня зуба.
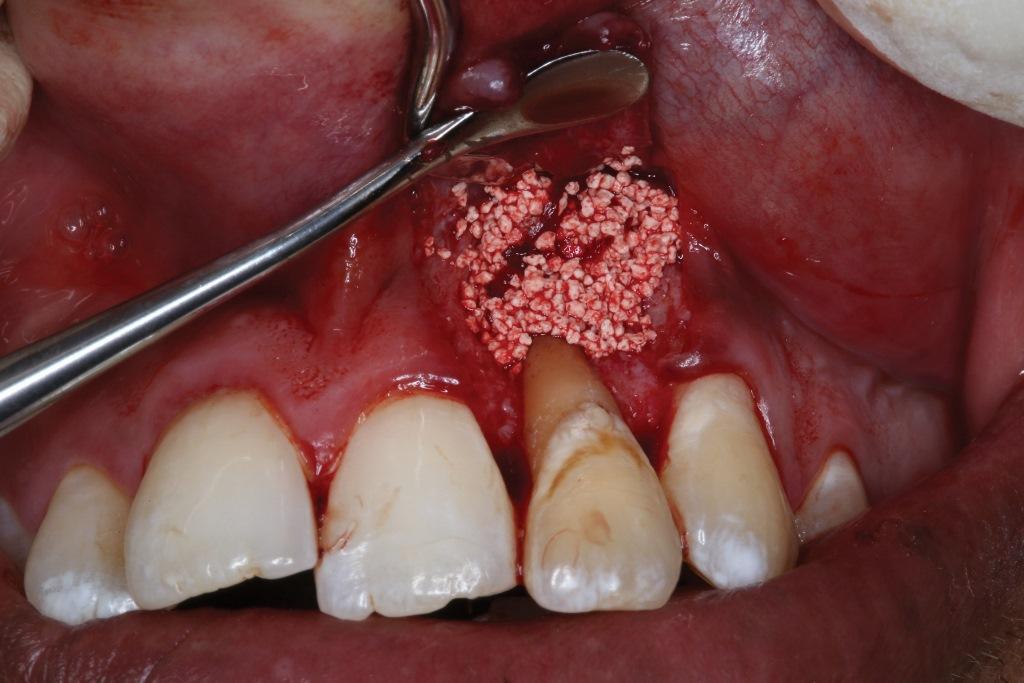
Фото 10. Клиническое применение i-PRF: красная фракция i-PRF используется для покрытия поверхности имплантата.
Ограничения в использовании i-PRF препаратов включают в себя тот факт, что его получают в небольших количествах, и врач-стоматолог ограничен по времени, так как препарат активен очень кратковременный промежуток времени, что может быть затруднительно для проведения определенных манипуляций. Однако полученных количеств обычно достаточно для большинства стоматологических процедур, а короткое время активности препарата можно учесть при планировании времени проведения определённой манипуляции в кресле.
Исследование жидкого PRF фибрина находится в зачаточном состоянии, поскольку впервые оно было описано всего около 8 лет назад. Его особенностью является жидкая форма, которая позволяет манипулировать им таким образом, чтобы определенные лекарства или биоматериалы могли быть добавлены к его жидкой субстанции и включены в его полимеризованную матрицу. В настоящее время наиболее широко используемый протокол получения вещества составляет центрифугирование при 700 оборотах минуту в течение 3 минут.
Заключение
Жидкий или инъекционный PRF фибрин - это многообещающий материал из концентрата тромбоцитов, который демонстрирует огромный потенциал. Будущие исследования и модификации могут проложить путь к его более широкому всеобщему признанию и применению как в медицине, так и в стоматологии.
Авторы:
Rucha Shah, MDS
Raison Thomas, MDS
M.G. Triveni, MDS
Baron Tarun Kumar, MDS
Концентраты тромбоцитов значительно продвинулись в области использования в качестве биологических добавок для хирургических ран. В настоящее время основное внимание уделяется концентратам тромбоцитов второго поколения, которые являются полностью аутологичными без каких-либо внешних добавок. В отличие от других концентратов тромбоцитов, жидкий или инъекционный фибрин, обогащенный тромбоцитами (i-PRF), является единственным, который получают в жидкой форме. Это свойство расширяет горизонты его применения практически в любой области медицины, включая множество вариантов применения в стоматологии. За последние несколько лет в исследователи предложили различные варианты получения i-PRF, такие как изменение в протоколе получения концентрата путем изменения времени центрифугирования, силы g и других факторов. Жидкая или инъекционная форма PRF также допускает другие модификации, такие как добавление различных биоматериалов в конечный продукт. В этой статье рассматриваются текущие фактические данные и достижения в отношении получения жидкого фибрина i-PRF и потенциалов для будущего применения данного препарата.

Первое опубликованное сообщение о концентрате тромбоцитов поступило от компании Matras в 1970 году. За этим последовало производство первых аутологичных клеев из фибрина, которые в конечном итоге заставили исследователей продолжить путь к разработке обогащенной тромбоцитами плазмы (PRP).
Последующая разработка обогащенного тромбоцитами фибрина без добавок (PRF) была анонсирована Choukroun (Чукрун) и коллегами в 2001 году, исследователями было объявлено о появлении концентратов тромбоцитов "второго поколения". С тех пор было проведено множество исследований и предложено несколько новых модификаций концентратов тромбоцитов. Данные варианты препаратов имеют множество различий, прежде всего в способах из приготовления, формах, в которых выходит готовый материал и области их применения.
Наиболее часто используемыми концентратами тромбоцитов второго поколения являются L-PRF (фибрин, богатый лейкоцитами и тромбоцитами) и A-PRF (усовершенствованный фибрин, богатый тромбоцитами). L-PRF был первым предложенным высоко-скоростным концентратом тромбоцитов; A-PRF, препарат, основанный на концепции медленной скорости центрифугирования, был введен позже. Оба концентрата широко используются в стоматологии для таких задач, как пластика синуса ( синус лифтинг), закрытие рецессий и лечение внутрикостных дефектов или дефектов в области фуркации корней зубов. Их использование обусловлено присущим им высоким содержанием различных факторов роста, таких как фактор роста эндотелия сосудов (VEGF), трансформирующий фактор роста-β1 (TGF-β1) и фактор роста, полученный из тромбоцитов (PDGF). Оба этих концентрата, однако, получают в предварительно желированной форме, что делает их непригодными для инъекций или смешивания с биоматериалами. Дальнейшая модификация первоначального протокола привела к разработке жидкого PRF. Он получается за 3 минуты, что предшествует коагуляции, но является достаточным временем для разделения компонентов. Поскольку коагуляция является активным процессом, после сбора жидкого PRF существует короткое окно возможностей (около 5 минут), в течение которого жидкость может быть либо введена, либо смешана с костными трансплантатами или другими биоматериалами до того, как она коагулирует. Эта универсальность жидкости, или PRF для инъекций (i-PRF), привела к росту популярности и расширению спектра применения препарата. В данном обзоре представлена обновленная информация о протоколах, биологическом профиле и будущих возможных областях применения жидкого PRF или i-PRF.
Жидкие концентраты тромбоцитов второго поколения
Оригинальный протокол создания обогащенного тромбоцитами фибрина привел к образованию предварительно свернувшегося, готового к использованию геля. В отличие от PRP первого поколения, который был получен в жидкой форме и мог быть смешан с костными трансплантатами, процесс коагуляции в обычном PRF уже был завершен. Это привело к двум основным недостаткам: его нельзя было вводить и нельзя было смешивать с каким-либо биоматериалом, таким как костный трансплантат, перед коагуляцией. Были предприняты попытки смешать обычную PRF с костными трансплантатами путем изготовления кусочков сгустков PRF и смешивания их с костными трансплантатами. Однако это было просто физическое смешивание, ничего подобного не достигалось путем смешивания костного трансплантата с PRP, затем его активации и инкапсуляции трансплантата в PRP. Для преодоления этих ограничений был предложен протокол использования жидкостной PRF/жидкий фибриноген который предполагал сбор отдельных компонентов крови, содержащих тромбоциты и фибриноген перед началом процесса коагуляции (от 3 до 8 минут - это нормальное время до начала коагуляции).
Первые сообщения в литературе об этом виде жидкого концентрата были сделаны Sohn (Сон) и коллегами за которыми последовали публикации от Mourão (Мурао) и коллег в 2015. Было предложено центрифугировать свежую кровь в течение двух минут при 3300 оборотах в минуту (об/мин) в пластиковых пробирках без покрытия, в которых отсутствуют обычные активаторы сгустков, такие как диоксид кремния. Данные исследователи описали агглютинацию концентрата с костным трансплантатом и отметили, что его можно использовать как есть или смешивать с биоматериалами и что он является отличной аутогенной альтернативой PRP. Принцип получения жидкого концентрата основан на двух ключевых факторах. Во-первых, используемая трубка представляет собой обычную пластиковую трубку без каких-либо покрытий. Обычная трубка для получения PRF представляет собой пластиковую трубку со стеклянным покрытием, содержащую диоксид кремния, который действует как активатор коагуляции, и, следовательно, продукт получается в свернувшемся виде. Обычные трубки с пластиковым покрытием по своей природе гидрофобны и не содержат активатора коагуляции, что способствует сохранению концентрата в жидкой форме. Вторым фактором является короткое время центрифугирования - от 2 до 4 минут. Это делается для того, чтобы концентраты извлекались в жидком виде до начала процесса коагуляции, который обычно происходит спустя 3-8 минут от начала процесса. Этого времени достаточно для разделения компонентов крови по их весу и размеру. Более тяжелые и крупные компоненты, такие как эритроциты (RBC) (размером от 6 до 8 микрон), оседают на дне пробирки и, следовательно, исключаются из концентрата, в то время как более легкие и мелкие компоненты, такие как тромбоциты (размером от 2 до 3 микрон) и лейкоциты перемещаются к верхней части трубки - пробирки. Верхняя фракция массы, находящаяся вблизи от эритроцитов затем отсасывается и используется в виде жидкостной формы PRF.
Влияние протоколов центрифугирования на производство жидкого фибрина i-PRF
Первоначальный протокол центрифугирования i-PRF был высокоскоростным и кратковременным, при этом скорость центрифуги составляла около 3000 оборотов в минуту. Затем в 2017 году Choukroun (Чукрун), Miron (Мирон) и коллеги в соответствии со своей "концепцией низкой скорости", предложили модифицированный протокол, в котором скорость центрифугирования была снижена до 700 оборотов в минуту в течение 3 минут, после чего верхнюю часть пробирки, имеющую желтое содержимое, отсасывали и переводили в жидкую форму. Они предположили, что более низкая скорость увеличивает количество жизнеспособных клеток в концентрате и может усиливать, и продлевать его биологическую активность, обеспечивая при этом достаточную силу и время для эффективного разделения клеточных компонентов. Одновременно Wend (Венд) с коллегами провели подробное исследование, в котором оценивалось влияние различных скоростей и времени центрифугирования на конечный продукт сыворотки крови. Они изучили влияние протоколов с низкой (700 об/ мин), средней (1400 об / мин) и высокой скоростью (2800 об / мин), все в течение 3 минут, и заметили, что снижение относительной центробежной силы привело к увеличению количества тромбоцитов и лейкоцитов в сыворотке и, следовательно, обеспечило большую биологическую активность с точки зрения высвобождения различных факторов роста, таких как VEGF, PDGF и эпидермальный фактор роста (EGF).
Однако в 2020 году Miron( Мирон) и его коллеги представили новый вариант концентрата клеток PRF, или C-PRF, протокол их получения включает в себя центрифугирование цельной крови в пластиковых пробирках без покрытия с использованием высоко-скоростного протокола получения L-PRF, т.е. 2700 оборотов в минуту в течение 12 минут. Согласно их данным, это изменение приводит к большему разделению компонентов крови, и, также было отмечено, что большинство клеток располагаются непосредственно рядом со слоем эритроцитов в охристой оболочке, а верхняя часть пробирки состоит только из плазмы, бедной тромбоцитами. Количество лейкоцитов в охристой оболочке было увеличено примерно на 500-750%, а тромбоцитов - примерно в 15 раз по сравнению с трехкратной концентрацией данных компонентов при первоначальном протоколе получения жидкого фибрина i-PRF при 700 оборотах в минуту по сравнению с его содержанием в цельной крови. Авторы пришли к выводу, что селективный сбор охристой оболочки непосредственно рядом со слоем эритроцитов приводил к образованию более обогащенного по клеточному составу i-PRF при использовании высоких скоростей.
Когда были изучены различные протоколы, которые включали протоколы центрифугирования по 5 минут, 8 минут и 12 минут при 3000 об/мин, был сделан вывод, что 5-минутный протокол был неэффективен для достижения оптимальной концентрации клеток, 8-минутный протокол был удовлетворительным, и дальнейшее центрифугирование в течение 12 минут не дало никакого дополнительного эффекта. Кроме того, наблюдалось гораздо более высокое высвобождение компонентов PDGF-AA, TGF-β1 и EGF и более высокая миграция и пролиферация клеток фибробластов десны наряду с повышенной продукцией мРНК для коллагена I типа по сравнению с обычным протоколом получения i-PRF.
Обоснование, которое Miron (Мирон) и коллеги привели, для таких противоречивых результатов из своих предыдущих исследований, в которых говорилось, что низкоскоростные протоколы имеют преимущество в производстве большего количества клеток, главным образом заключалось в том, что в более ранних исследованиях оценивался препарат i-PRF из верхней части пробирки, который включал плазму с низким содержанием тромбоцитов и, возможно, разбавлял сам i-PRF и/или наиболее богатая клетками часть плазмы клеток оставалась не востребованной в пробирке, так как находилась вдали от верхней части трубки, непосредственно рядом с участком эритроцитов. В конце концов, они пришли к выводу, что когда была изучена охристая оболочка рядом с эритроцитами, стало совершенно ясно, что высокоскоростной протокол обладает превосходной способностью продуцировать клетки с высокой биологической активностью.
В литературе существует неопределенность в отношении терминологии, которая должна применяться для данного вида жидкого концентрата тромбоцитов второго поколения. Кроме того, были опубликованы незначительные модификации одних и тех же протоколов под разными названиями. Необходимо решить этот вопрос, чтобы обеспечить стандартизацию в различных научных исследованиях. Методика получения i-PRF все еще находится в зачаточном состоянии, и ожидается, что в течение следующих нескольких лет дальнейшие исследования однозначно укажут на превосходство одного протокола получения продукта над другим.
Модификации первоначального протокола получения жидкого фибрина i-PRF
Было предложено несколько оригинальных модификаций первоначального протокола производства i-PRF. Они включают изменения скорости центрифугирования, количества времени центрифугирования, места аспирации, смешивания с другими биоматериалами для повышения насыщенности клеточным составом готового продукта, а также для получения композитных трансплантатов и увеличения времени их деградации in vivo.
Желтая и красная части жидкого фибрина i-PRF
Обычно желтую часть порции жидкости i-PRF отсасывают и используют. Однако нет четких указаний относительно того, какую часть i-PRF следует аспирировать или куда именно следует поместить кончик иглы шприца для аспирации. В соответствии со стандартным протоколом производства i-PRF, т.е. при 700 оборотах в минуту в течение 3 минут, в зависимости от уровня сбора i-PRF концентрат классифицировался либо как желтый i-PRF, или как красный i-PRF (фото 1 - 2). Wang (Ванг) с коллегами сообщили, что сбор верхнего слоя i-PRF, выше места соединения с охристой оболочкой, привел к получению желтой фракции i-PRF. Thanasrisuebwong (Танасрисуэбвонг) коллегами, тем временем, собрали порцию i-PRF из желтой зоны и места соединения с охристой оболочкой, в результате чего был получен красный препарат i-PRF. При сравнении красного и желтого препаратов i-PRF было замечено, что красный i-PRF содержал больше клеток и фактора роста, производного тромбоцитов; однако желтая часть i-PRF демонстрировала более высокое содержание фибрина, что способствует свертываемости крови благодаря содержанию угловых клеток- α и твердости самого сгустка. Когда были оценены и сравнены эффекты красного и желтого i-PRF на воздействие на стволовые клетки периодонтальной связки человека, был сделан вывод, что красный i-PRF лучше мобилизует стволовые клетки и обеспечивает превосходную миграцию и пролиферацию стволовых клеток периодонтальной связки человека. Эти улучшенные биологические свойства должны приводить к улучшению начального заживления ран и, таким образом, могут быть более эффективными в сочетании использованием с костных трансплантатов для целей регенерации тканей.
Фото 1. Компоненты, образовавшиеся после центрифугирования свежей крови в течение 3-5 минут в пластиковой пробирке без покрытия (i-PRF = PRF для инъекций, RBC = эритроциты)
(обозначения на фото: бедная тромбоцитами плазма; Желтый компонент i-PRF; Красный компонент i-PRF; основная масса крови, состоящая из эритроцитов;).

Фото 2. Варианты i-PRF: красный i-PRF и желтый i-PRF. (Обозначения на фото: Бедная тромбоцитами плазма; Зона желтой фракции i-PRF; Зона красной i-PRF; Красные клетки крови;).

Концентрированный обогащенный тромбоцитами фибрин PRF
Как отмечалось ранее, Miron (Мирон) и коллеги в 2020 году предложили концепцию использования концентрированного PRF, или C-PRF, где цельная кровь центрифугируется в обычных пластиковых пробирках без покрытия с использованием протокола L-PRF, т.е. при 2700 оборотах в минуту в течение 12 минут. Это приводит к большему разделению компонентов крови, и, при этом, большинство клеток в слое охристой оболочки объемом от 0,3 мл до 0,5 мл располагались непосредственно рядом со слоем эритроцитов. В C-PRF желтая часть занимает более 50% пробирки по сравнению с около 1-2 мл (примерно, от 10% до 20%) в i-PRF. В C-PRF количество лейкоцитов было увеличено примерно на 500-750%, а тромбоцитов - примерно в 15 раз больше, чем в крови, по сравнению с трехкратной концентрацией тромбоцитов по первоначальному протоколу i-PRF.
Альбуминовая часть жидкого фибрина PRF
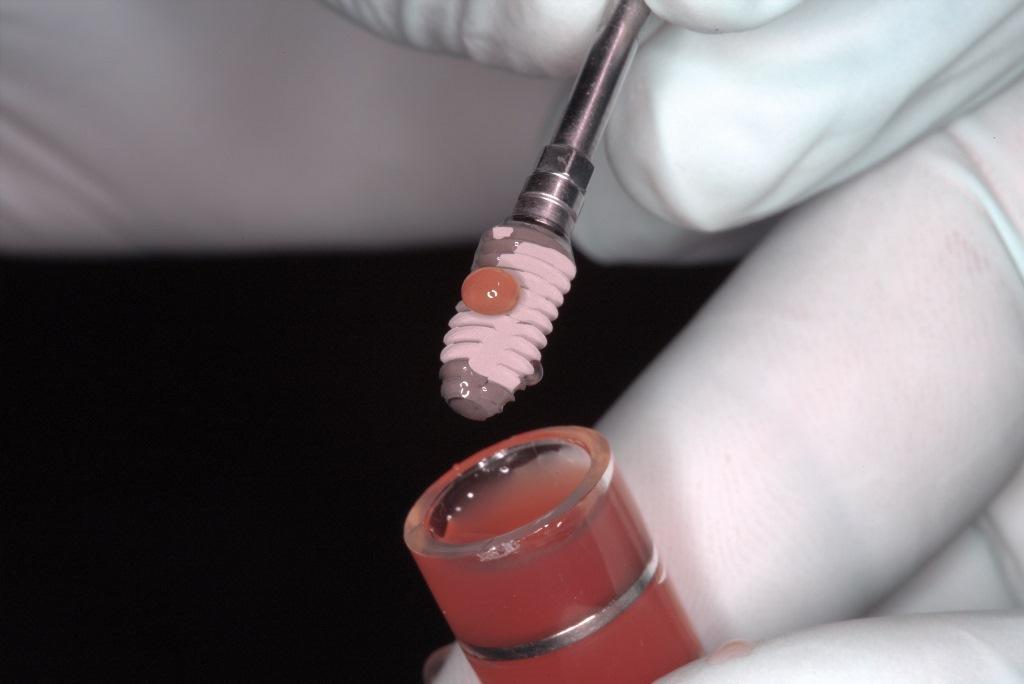
Одним из основных ограничений обычного PRF является его короткий срок годности in vivo, этот материал можно использовать- около 10 дней. Чтобы противостоять этому, новый альбумин PRF был недавно представлен Fujioka-Kobayashi (Фудзиока-Кобаяши) и коллегами. Это была модификация аналогичного протокола, известного как альбумин концентрированный фактор роста, который имел срок службы in vivo от 4 до 6 месяцев, однако был полностью лишен клеток. Протокол производства PRF альбумина включает центрифугирование 10 мл крови при 700 g в течение 8 минут с последующим нагреванием верхней части плазмы, бедной тромбоцитами, в течение 10 минут при 75°C и охлаждением ее до комнатной температуры для получения денатурированного альбуминового геля. Затем его смешивают с охристой частью плазмы (i-PRF), используя систему фиксации Luer (Люэра) "самка-самка" (фото 3). Таким образом, простая стадия термической обработки PRF способна отдалить процесс разложения PRF примерно до 4 недель.
Фото 3. Альбуминовая часть сыворотки фибрина богатого тромбоцитами PRF (денатурированный альбумин с i-PRF) является вариантом i-PRF.

При ультраструктурном исследовании было обнаружено, что этот препарат содержит жизнеспособные клетки, распределенные по всему его матриксу. Fujioka-Kobayashi (Фудзиока-Кобаяши) и коллеги изучали высвобождение факторов роста в течение 10 дней и наблюдали медленное и постепенное высвобождение PDGF-AA/BB и TGF-β1. Gheno (Гено) и коллеги изучали биосовместимость и свойства расширенного процесса денатурации клеток, по сравнению с L-PRF препаратами отметили, что PRF альбуминовая сыворотка останется стабильной по объему в течение 21 дней по сравнению с 7 днями для L-PRF сывороткой. Этот препарат по существу сочетает в себе длительный срок службы денатурированного PRF фибрина in vivo с насыщенностью клетками и биологической активностью обычного PRF фибрина и может быть использован для направленной регенерации костей или тканей. Необходимы дальнейшие исследования, оценивающие его свойство к окклюзии клеток и другие свойства, чтобы убедиться в его эффективности в различных клинических сценариях.
Добавление биоматериалов
Основное преимущество i-PRF по сравнению с другими концентратами тромбоцитов второго поколения, такими как A-PRF и L-PRF, заключается в том, что он коагулирует после получения, что позволяет врачам смешивать биоматериалы, которые попадают в фибриновый матрикс. Смешивание i-PRF с костными трансплантатами, определенными лекарственными препаратами и другими биоматериалами было изучено и представляет собой нишу, имеющую огромный потенциал для исследований и клинического применения.
Костные трансплантаты – Когда Mourão (Мурао) и коллеги в 2015 году описали жидкую тромбоцитарную массу PRF, они продемонстрировали ее полимеризацию, в том числе с помощью костных трансплантатов. Материалы для костного трансплантата по-прежнему остаются наиболее распространенным компонентом любого композитного трансплантата, используемого в сочетании с i-PRF. Несколько форм жидких клейких материалов на основе фибрина PRF, таких как аутологичный фибриновый клей (2700 об / мин в течение 2 минут), концентрированный фактор роста (ускоряется в течение 30 секунд; центрифугируется при 2700 об / мин в течение 2 минут, 2400 об / мин в течение 4 минут, 2700 об / мин в течение 4 минут и 3000 об / мин в течение 3 минут; замедляется в течение 36 секунд до полной остановки стандартный i-PRF (700 оборотов в минуту в течение 3 минут) смешивали с различными трансплантатами для создания композитных клеящихся материалов подходящих для целей подсадки тканей, при их дефиците. В общем, как только была получена жидкая форма тромбоцитарной массы обогащенной фибрином PRF ее начали смешивать с гранулами материала для подсадки кости и оставляли для полимеризации. Полученная ткань трансплантата представляет собой трехмерную полимеризованную матрицу, в которой частицы трансплантата заключены в фибриновый матрикс. Данный материал назван липкой костью или липким гелем (фото 4 - 5).
Фото 4 - 5. Липкая кость (i-PRF с костным трансплантатом) - это еще один вариант i-PRF.


Другой препарат костного трансплантата с PRF известен как PRF-блок. Это комбинация A/L-PRF с костным трансплантатом и i-PRF. В этом препарате PRF и i-PRF смешиваются в соотношении 50:50 с костным трансплантатом. Он действует как биологически активный каркас, который не только способствует миграции клеток-предшественников остеопротеина, но и способствует высвобождению факторов роста. Эти композитные трансплантаты обладают хорошими эксплуатационными свойствами и дополнительным преимуществом в виде увеличенного объема и используются для устранения апикальных дефектов, внутрикостных дефектов, а также увеличения объема кости и альвеолярного гребня.
Antibiotics-Miron и Zhang (Антибиотикс-Мирон и Чжан) в обзоре впервые указали на потенциал применения i-PRF при смешивании его с антибиотиками и последующего действия в качестве системы непрерывной доставки лекарств. В пилотном исследовании Rafiee (Рафии) и коллеги оценивалась комбинация различных противомикробных препаратов, включая метронидазол, ципрофлоксацин и миноциклин, с i-PRF путем погружения материала в лекарство и его интеграции с ним. Они пришли к выводу, что погружение было более эффективным методом и что высвобождение препарата наблюдалось в виде всплеска в течение 24 часов, после чего медленное высвобождение наблюдалось еще в течение 14 дней.
Концепция горизонтального центрифугирования
В 2019 году Miron ( Мирон) и коллеги предложили новый протокол центрифугирования, получивший название "концепция щадящего центрифугирования", при котором пробирку помещали в горизонтальное положение для центрифугирования. Наблюдалось превосходное разделение клеток и меньшее повреждение клеток благодаря меньшему трению по сравнению с обычным центрифугированием. Авторы назвали его био-PRF и пришли к выводу, что он приводит к самой высокой концентрации тромбоцитов и лейкоцитов в полученном материале.
Текущие данные, касающиеся применения жидкого фибрина i-PRF
С момента создания i-PRF в 2015 году было проведено множество исследований in vitro, на животных и клинических исследований с использованием базовых и других модифицированных протоколов. В следующих разделах приводится краткое изложение текущей литературы (таблица 1).
Так, при применении жидкого фибрина в области периодонтальной связки, исследователи обнаружили увеличение миграции клеток, пролиферации и минерализации. При смешивании с человеческими остеобластами, также наблюдается увеличение процесса миграции клеток, пролиферации, продукции щелочной фосфатазы ALP и минерализации клеток, повышается уровень глюкозы-BMP-2 и остеонектина. Со стороны фибробластов десны наблюдается также большая миграция клеток и усиленная выработка коллагена.
Макрофаги и дендритные клетки реагируют молниеносным уменьшением воспалительного процесса. Клетки макрофагов уменьшают выработку остеокластов.
Фибробласты дермы реагируют выработкой факторов роста и фибронектина. Клетки эндотелия начинают выстраивать структуры, напоминающие микрососуды. Наблюдается стойкий антимикробный эффект при применении клеток плазмы для лечения заболеваний пародонта и эффект воздействия на саму микробиоту полости рта, который заключается в том, что значительно уменьшается количество стрептококков во рту. Нужно отметить, что ученые проводили исследования на мышах и кроликах вводя им i-PRF сыворотки для восстановления утерянного объема костной ткани во время различных воспалительных процессов и отмечали при этом значительное замедление воспаления после использования препарата и образование новой костной ткани. Исследователи отмечали значительное улучшение клинически при применении сыворотки i-PRF в комбинации при лечении различных дефектов десны, рецессий, утолщения биотипа самой десны. Врачи-стоматологи ортодонты наблюдали ускорение процесса движения зубов при использовании препаратов i-PRF во время ортодонтического лечения. Также препараты жидкого фибрина применяли при лечении таких заболевания как эрозивный плоский лишай и Алопеция и наблюдали улучшение роста волос, уменьшение болевых ощущений у пациентов и уменьшение размеров самих эрозий во рту, при ринопластике доктора отмечали хорошее восстановление хряща и заживление самих послеоперационных ран.
Воздействие на различные типы клеток
Исследование, в котором оценивалось биологическое воздействие жидких PRF и PRP сывороток на клетки пародонта человека, продемонстрировало, что i-PRF усиливает миграцию клеток, пролиферацию и минерализацию по сравнению с PRP. Кроме того, i-PRF снижал продукцию воспалительной мРНК, индуцированную бактериальным липополисахаридом. Это подчеркивает положительное влияние i-PRF на процесс заживления ран, а также его свойство стимулировать иммунные реакции. Другое сравнительное исследование in vitro, проведенное на первичных остеобластах человека, которые частично были соединены с концентратом i-PRF, а другая часть была помещена в инкубационную камеру без добавления i-PRF, показало, что клеточные линии, инкубированные с i-PRF, продемонстрировали повышенную клеточную пролиферацию и миграцию, продукцию щелочной фосфатазы (ALP), продукцию костного морфогенетического белка-2 (BMP-2) и продукцию остеокальцина. Данный факт напрямую демонстрирует потенциал использования i-PRF для получения более быстрой и превосходной регенерации костной ткани. В сочетании с аллогенными или ксеногенными костными трансплантатами i-PRF продемонстрировал повышенную продукцию BMP-2, ALP и остеонектина на остеобластах человека, что указывает на то, что смешивание i-PRF с костными трансплантатами повышает биологическую активность полученного композитного материала.
Модель культивирования in vitro для индустрии инженерии костной ткани с целью изучения процесса улучшенного ангиогенеза была создана для оценки влияния i-PRF на эндотелиальные клетки роста и первичные остеобласты после 7 дней комплексного культивирования.
Исследование показало формирование микрососудоподобных структур, демонстрирующих улучшение процесса ангиогенеза. Другое исследование было проведено для изучения биологического воздействия i-PRF на стволовые клетки пульпы зуба человека. Был сделан вывод, что 5% i-PRF усиливают миграцию и пролиферацию клеток, мРНК коллагена I типа альфа 1, сиалопротеина дентина и белков дентинного матрикса, что указывает на потенциал i-PRF для применения материала во время проведения различных эндодонтических процедур.
Было проведено сравнительное исследование in vitro с использованием i-PRF и PRP на стволовых клетках десны на поверхности титановых имплантатов; было отмечено, что применение i-PRF препарата индуцировало более высокую миграцию клеток, а также во время применения препарата было отмечено повышение уровней продукции мРНК PDGF, TGF-β, коллагена I типа и фибронектина по сравнению с PRP фибриновой сывороткой. Данный факт демонстрирует, что покрытие i-PRF материалом поверхности имплантатов может способствовать превосходной локализованной реакции со стороны мягких тканей. Другое сравнительное исследование, проведенное для подтверждения эффектов применения препаратов i-PRF и PRP на стимуляцию, миграцию, пролиферацию и синтез коллагена фибробластов кожи, показало повышенную миграцию клеток, пролиферацию, продукцию мРНК PDGF для TGF-β и фибронектина с группами клеток, культивируемых с i-PRF. Исследование по изучению противовоспалительных эффектов i-PRF обогащённого фибрина на макрофаги и дендритные клетки показало, что i-PRF фибрин снижает продукцию провоспалительных клеток фенотипа M1 макрофагов и активирует дендритные клетки вокруг зоны распространения инфекции, а также продемонстрировало ингибирование toll-подобного рецептора-4 (TLR-4) и p-P65. Аналогичное исследование было проведено на макрофагоподобных клетках для изучения воспалительной реакции i-PRF и остеокластогенеза путем местного применения i-PRF фибрина. Обнаружено активирование процесса экспрессии интерлейкина-6 (IL-6) и циклооксигеназы-2, и выявлено, что i-PRF снижает экспрессию генов-маркеров остеокластов тартрат-устойчивой кислой фосфатазы (TRAP) и катепсина К.
Антимикробный эффект
Было проведено сравнительное исследование для оценки антимикробной эффективности PRP, PRF и i-PRF препаратов фибрина путем анализа минимальной ингибирующей концентрации, максимальной бактерицидной концентрации и ингибирования биопленки. Исследование показало, что все три концентрата тромбоцитов обладают антибактериальным действием; однако i-PRF был более активным, поскольку была обнаружена широкая зона ингибирования в отношении Porphyromonas gingivalis и Aggregatibacter actinomycetemcomitans. Аналогичное исследование было проведено с использованием i-PRF тромбоцитарной массы для оценки антимикробного потенциала и возможности блокирования процесса образования биопленки в отношении изолятов стафилококка для орального применения путем микродилюции бульона в минимальной ингибирующей концентрации. I-PRF препарат продемонстрировал антимикробную эффективность против золотистого стафилококка и стафилококка эпидермального. Данные исследования демонстрируют, что i-PRF тромбоцитарная масса может быть использована для профилактики инфекции в местах хирургического вмешательства.
Исследования на животных
Экспериментальное исследование на животных было проведено на 24 крысах-альбиносах Вистар, которым вводили i-PRF препарат плазмы на первый, третий и седьмой дни либо изолированно, либо совместно с процедурой снятия зубных отложений, ткани оценивали гистопатологически и иммуногистохимически. Поддесневая инъекция i-PRF массы показала отличные результаты по части уменьшения потери объема костной ткани, модуляции воспалительного процесса и воздействии на цитокины. Было проведено сравнительное исследование с использованием PRP и i-PRF препаратов плазмы крови при модуляции воспалительного процесса и воздействии на цитокины. Установлено, что препараты усиливают пролиферацию хондроцитов и уровни мРНК SOX9, коллагена II типа и аггрекана.
Было проведено исследование для сравнения остеоиндуктивной и остеопромоторной вариабельности между различными деминерализованными костными аллотрансплантатами. Двадцать семь самцов крыс линии Вистар были пролечены с целью уменьшения дефектов бедренной кости и внутримышечных вен. Гистологический анализ через 2, 4 и 8 недель после имплантации, окрашивание гематоксилином и эозином, сафранином-О, TRAP и остеопонином. В ходе исследования был сделан вывод о значительном снижении воспалительного фенотипа M1 макрофагов и активировании дендритных клеток, вместе ингибированием TLR-4 и p-P65 на участке пути NF-κB.
Клиническое подтверждение при использовании у человека
Было проведено рандомизированное контролируемое исследование, чтобы определить, улучшит ли трансплантат соединительной ткани (CTG) в сочетании с применением i-PRF и коронарным лоскутом(CAF) закрытие оголенной части корней при лечении рецессии десны I или II класса по Миллеру по сравнению с применением CTG и KAF по отдельности. Соединительную ткань CTG собирали и хранили в сыворотке i-PRF в течение 15 минут, затем препарат покрывали слоем полимеризованного i-PRF фибрина. Через 6 месяцев после операции полное покрытие корней было получено в 88% участков, обработанных i-PRF фибрином. В ходе исследования был сделан вывод, что использование i-PRF с CAF привело к значительному увеличению образования ороговевшей ткани и уменьшению глубины рецессии, что авторы приписали к превосходному ангиогенезу и резистентности, обеспеченным i-PRF. Было проведено другое исследование для изучения потенциального влияния i-PRF фибрина при проведении операции закрытия корня свободной частью десневого трансплантата (FGG). Сорок пациентов были случайным образом разделены на две группы; пациенты в контрольной группе подвергались только процедуре FGG, в то время как пациентам в экспериментальной группе приживлялся лоскут FGG совместно с инъекцией i-PRF в качестве средства для биомодификации поверхности корня (FGG + i-PRF). Полученную толщину покрывного слоя слизистой в области корня зуба сравнивали через 3 месяца, и было показано, что группе получившей инъекцию i-PRF толщина полученного покрывного слоя слизистой была значительно лучше.
Была опубликована серия случаев применения CAF в сочетании с липкой костью и коллагеновой мембраной, покрытой i-PRF фибрином для лечения одиночных рецессий десны на верхней челюсти. Пациентам с изолированной рецессией I или II класса по Миллеру, а в эстетической зоне верхней челюсти проводилось лечение с использованием липкой кости (i-PRF + лиофилизированный костный аллотрансплантат [FDBA]) с коллагеновой мембраной, покрытой i-PRF, и CAF. Клинические параметры, включая глубину зондирования, ширину ороговевшей десны, толщину десны и глубину рецессии, регистрировались в исходном состоянии и через 6 месяцев после операции. Исследование показало, что использование липкой кости (i-PRF + FDBA) и коллагеновой мембраны, покрытой i-PRF, приводят к значительному увеличению ширины и толщины десны, а также к увеличению толщины кости.
В изолированном исследовании полости рта оценивалось изменение биотипа десен после введения i-PRF сыворотки Десять соматически здоровых пациентов с тонким биотипом получали лечение инъекцией i-PRF. Статистически значимое улучшение толщины десен наблюдалось через 1 месяц после проведения четырех инъекций при помощи микро игл . В сравнительном исследовании 36 пациентов, нуждающихся в пересадке надкостничного лоскута (FGG) изучалось влияние применения i-PRF инъекций на заживление ран в области неба Заживление ран с помощью теста на перекись водорода и визуальной аналоговой шкалы боли оценивали на третий, седьмой и 14-й дни и через один месяц. Группы пациентов, у которых применялся i-PRF препарат, продемонстрировали улучшенную эпителизацию и заживление ран, уменьшение послеоперационного кровотечения и превосходные эстетические результаты.
В пилотном исследовании, в котором оценивалось образование новой кости после увеличения объема дна Гайморовой пазухи коллагеновыми пробками, пропитанными i-PRF фибрином, спустя 6 месяцев после вмешательства было отмечено значительное образование новой кости как на мезиальной, так и на дистальной поверхностях имплантатов в данной области. Это указывает на положительную роль, которую может играть применение препаратов в имплантологии. В рандомизированном контролируемом исследовании оценивалась эффективность i-PRF фибрина для ускорения передвижения клыков и изучались уровни матриксной металлопротеиназы-8 (MMP-8), IL-1β, RANKL и остеопротегерина в жидкости десневой щели во время ортодонтического лечения и процесса перемещения зуба. Двадцать пациентов с нарушением прикуса 2-го класса II подкласса были включены в исследование изолированно полости рта с применением i-PRF фибрина и без него. Значительное увеличение скорости перемещения зубов и стимуляция уровней цитокинов продемонстрировали преимущества i-PRF, показав тем самым потенциал применения данного препарата в ортодонтии.
Было проведено рандомизированное контролируемое исследование для оценки эффективности использования i-PRF фибрина при лечении эрозивной формы плоского лишая. В данном исследовании изолированно полости рта одну сторону слизистой обрабатывали при помощи введения инъекции i-PRF фибрина, а другую - ацетатом метилпреднизолона в течение четырех сеансов с интервалом в 15 дней. Было обнаружено, что инъекция i-PRF на участок пораженной слизистой уменьшает боль и размер поражения и повышает удовлетворенность пациента, аналогично кортикостероидам. В недавнем отчете о применении i-PRF фибрина при лечении плазмоклеточного мукозита у пациента, который был не восприимчив к терапии кортикостероидами, инфильтрации выполнялись один раз в неделю в течение 2 месяцев. В течении этого времени полностью исчезла боль и клинически уменьшилось воспаление, полного разрешения болезни не наблюдалось.
Другое рандомизированное контролируемое исследование было проведено при лечении дорсальных нарушений с помощью ринопластики. Сорок пациентов были случайным образом разделены на две группы: с применением i-PRF фибрина и без него. I-PRF препарат смешивали с нарезанным кубиками хрящом (получался липкий хрящ). В группе получившей i-PRF препарат было обнаружено уменьшение потери толщины хряща и повышение жизнеспособности хряща. В отчете о клиническом случае, посвященном влиянию i-PRF фибрина на лечение алопеции, пациентам было проведено четыре курса инъекций i-PRF препарата с перерывами в 15 дней. Хотя легкие кровоподтеки наблюдались в течение 3 дней, после инъекции наблюдалось значительное улучшение роста волос, что объяснялось высоким регенеративным потенциалом и наличием стволовых клеток в препарате. Еще одно рандомизированное контролируемое исследование было проведено для оценки преимуществ применения i-PRF жидкого фибрина у пациентов с жалобами на боль и подозрением на наличие дисфункции нижне-челюстного сустава (ВНЧС). Тридцать три пациента были случайным образом отобраны с дисфункцией ВНЧС, и значительное уменьшение боли наблюдалось через 8 недель, 3 месяца, 6 месяцев и 12 месяцев. Таким образом, в исследовании был сделан вывод о том, что i-PRF жидкий фибрин оказывает длительное обезболивающее действие при лечении болезненных нарушений ВНЧС и что он будет хорошо подходить пациентам с IV / V стадией болезни Уилкса (от промежуточной до поздней стадии). Другое исследование возможности применения i-PRF фибрина включало в себя способ омоложения нижней трети лица при помощи инъекций препарата, продемонстрировало хорошие результаты, также как и при лечении алопеции с помощью инъекций i-PRF жидкого фибрина.
Наконец, была опубликована серия примеров воздействия i-PRF препарата на дерматологические заболевания, включая упомянутую алопецию и увеличение периорбитальной области. Исследование показало, что i-PRF жидкий фибрин обладает превосходным эффектом стимулировать заживление ран и благоприятными свойствами высвобождения фактора роста, которые помогают в лечении андрогенной алопеции и при омоложении периорбитальной области, а также в качестве временного наполнителя (филлера).
Обсуждение и клиническое применение
Основное различие между концентратами тромбоцитов первого и второго поколения заключается в том, что последние являются полностью аутологичными и не содержат добавок, таких как хлорид кальция и бычий тромбин, которые необходимы для производства PRP. Введенный в стоматологию в 1994 году, PRP широко использовался для различных областей в клинической практике; однако препарат получил большее распространение в медицинском мире, где он использовался для лечения различных заболеваний, таких как остеоартрит, острое повреждение мышц, восстановление вращательной манжеты, регенерация тканей, ревизия рубцов, омоложение кожи, алопеция, и многое другое. Обычно используется PRP препарат содержащий в себе 97% тромбоцитов, которые действуют как богатые источники PDGF, инсулиноподобного фактора роста, VEGF, ангиогенного фактора, получаемого из тромбоцитов, и TGF-β, а также фибронектина и витронектина, которые высвобождаются при активации препарата. В процессе внедрения данных препаратов в стоматологию, концентраты тромбоцитов второго поколения были быстро приняты из-за их простоты приготовления, превосходной биологической активности и их полностью аутологичной природы. Однако большая часть применения подобных PRP тромбоцитарных масс использовалась в медицине для лечения алопеции или тендинита, и была обусловленна возможностью использовать препараты в форме инъекций и, таким образом, обычные PRF тромбоцитарные массы использовались не так широко. Однако ситуация меняется в связи с недавним появлением жидкого концентрата тромбоцитов второго поколения, полностью свободного от добавок. Основываясь на клиническом опыте авторов, i-PRF преарат в настоящее время используется гораздо чаще, чем его аналоги, такие как A-PRF и L-PRF, для различных областей применения как в медицине, так и в стоматологии.
Ограничением применения технологии PRP тромбоцитарной массы является ее внезапная полимеризация при добавлении активаторов, таких как бычий тромбин и хлорид кальция; это в отличие от полимеризации, достигаемой с помощью i-PRF фибрина, который не содержит добавок и, следовательно, он физиологичен. Данный эффект в первую очередь проявляется в продолжительности биологического действия; известно, что PRP масса высвобождает 90% содержащегося в себе фактора роста в течение первых 24 часов, PRF масса обладает способностью длительного и медленного высвобождения компонентов до 7-10 дней. Данное свойство может быть полезным при продлении биологическое действие in vivo и может привести к превосходным результатам. Также превосходное биологическое воздействие жидкого PRF можно объяснить его трехмерной фибриновой сетью, включающей тромбоциты, лейкоциты, коллаген I типа, остеокальцин и различные факторы роста. Эти факторы роста медленно высвобождаются в течение 10 дней и способствуют усиленной миграции клеток, пролиферации и экспрессии мРНК TGF-β, PDGF, коллагена I типа и остеокальцина в различные типы клеток, включая остеобласты, хондробласты и пульпозные клетки.
Несколько желаемых свойств i-PRF фибрина побудили использовать его в стоматологии, где он показал многообещающие результаты. Решение таких задач как лечение рецессии десны I и II классов по Миллеру, улучшение биотипа десны, перевязка и заживление ран в области неба, пластика дна синуса с одновременной установкой имплантата или без нее, увеличение скорости ортодонтического перемещения зубов, омоложение нижней трети лица и лечение заболеваний ВНЧС, эрозивного красного плоского лишая полости рта и плазмоклеточного мукозита, среди многих других (фото 6 - 10). Дальнейшие клинические исследования могут открыть еще несколько областей применения, там где ранее применяли PRP препараты, например лечение переломов зубов в области фуркации или внутрикостных дефектов в сочетании с костными трансплантатами и покрытием поверхности имплантатов. Данные о типах клеток, таких как периодонтальная связка и фибробласты десны, остеобласты и хондроциты, по активности, такой как пролиферация и дифференцировка, также указывают на потенциал применения для целей косметической, стоматологической и оральной регенерации. Другим направлением использования i-PRF является применение препарата в сочетании с добавлением его к различным биоматериалам. При смешивании с костными трансплантатами он образует податливую массу, похожую на блок, которая обладает превосходными свойствами по сравнению с обычными материалами в виде частиц и гранул. Кроме того, добавление антибиотиков может позволить использовать его для местной доставки лекарств непосредственно на стоматологическом приеме или в качестве покрытия для имплантатов для достижения оптимальных клинических результатов.
Фото 6. Клиническое применение i-PRF: закрытие операционного поля в области неба, повязка с i-PRF фибрином и A-PRF.

Фото 7. Клиническое применение i-PRF: липкая кость для сохранения формы и объема лунки в области удаленного зуба.

Фото 8. Клиническое применение i-PRF: костный блок смешан с препаратом жидкого PRF с целью увеличения объема альвеолярного гребня.

Фото 9. Клиническое применение i-PRF: липкая кость для восполнения дефекта в области корня зуба.

Фото 10. Клиническое применение i-PRF: красная фракция i-PRF используется для покрытия поверхности имплантата.

Ограничения в использовании i-PRF препаратов включают в себя тот факт, что его получают в небольших количествах, и врач-стоматолог ограничен по времени, так как препарат активен очень кратковременный промежуток времени, что может быть затруднительно для проведения определенных манипуляций. Однако полученных количеств обычно достаточно для большинства стоматологических процедур, а короткое время активности препарата можно учесть при планировании времени проведения определённой манипуляции в кресле.
Исследование жидкого PRF фибрина находится в зачаточном состоянии, поскольку впервые оно было описано всего около 8 лет назад. Его особенностью является жидкая форма, которая позволяет манипулировать им таким образом, чтобы определенные лекарства или биоматериалы могли быть добавлены к его жидкой субстанции и включены в его полимеризованную матрицу. В настоящее время наиболее широко используемый протокол получения вещества составляет центрифугирование при 700 оборотах минуту в течение 3 минут.
Заключение
Жидкий или инъекционный PRF фибрин - это многообещающий материал из концентрата тромбоцитов, который демонстрирует огромный потенциал. Будущие исследования и модификации могут проложить путь к его более широкому всеобщему признанию и применению как в медицине, так и в стоматологии.
Авторы:
Rucha Shah, MDS
Raison Thomas, MDS
M.G. Triveni, MDS
Baron Tarun Kumar, MDS
































































































































































0 комментариев