Остеоинтегрированные имплантаты для протезирования беззубых челюстей имеют высокий процент успеха в тех случаях, когда соблюдаются определенные условия. Стабильность имплантатов играет критическую роль для успеха результата лечения, особенно в случаях применения коротких имплантатов и при имплантации в мягкую костную ткань, когда имеется повышенный риск неудач. Согласно оригинальным протоколам имплантации первичная стабильность имплантатов обеспечивалась за счет формирования и ремоделирования новой кости, названных остеоинтеграцией, которые происходили на начальных этапах периода заживления, в течение которого имплантат оставался ненагруженным, чтобы обеспечить беспрепятственное формирование новой кости на его поверхности. Процесс остеоинтеграции повышает жесткость костной ткани вокруг имплантата, а костное сцепление с поверхностью имплантата предотвращает микроподвижность имплантата и формирование фиброзной рубцовой ткани при его нагрузке. Разработка новых поверхностей имплантатов и новых клинических технологий позволила значительно уменьшить продолжительность начального периода заживления вплоть до немедленной/ранней нагрузки имплантатов, обладающих высокой первичной стабильностью. Однако, успех техники немедленной/ранней нагрузки зависит от способности врача определить степень первичной стабильности имплантата и изменение его стабильности в ходе формирования и ремоделирования новой костной ткани.
Клиническая оценка первичной стабильности имплантатов часто основана на сопротивлении имплантата в процессе его установки в костную ткань. Чувство «хорошей» стабильности может усиливаться при наличии резкой остановки в процессе введения имплантата. Конусные имплантаты, повторяющие форму корня зуба, благодаря своей геометрии дают ощущение полной остановки имплантата в процессе его вкручивания в костную ткань, что может дать ошибочное впечатление о высокой стабильности имплантата. Для оценки первичной стабильности имплантатов также могут использоваться перкуссионные тесты. Перкуссионный тест состоит в постукивании ручкой стоматологического зеркала по имплантату. Звонкий звук при постукивании считается показателем хорошей стабильности или остеоинтеграции. Однако, такие тесты скорее всего дают больше информации о перкуссионном инструменте, чем о самом имплантате, и не являются достоверными. Иногда для оценки первичной стабильности имплантатов используют значения инсерционного торка, а также обратного или развинчивающего торка в процессе подсоединения абатмента. Считается, что имплантаты, которые вращаются при приложении определенного торка, подлежат удалению. Однако, поверхность имплантатов в процессе остеоинтеграции может разрушится под действием торковой нагрузки. Кроме того, после того, как исследования на животных продемонстрировали повторную интеграцию подвижных имплантатов, техника обратного торка для оценки стабильности имплантатов оказалась несостоятельной. Другие техники, такие как Periotest и частотно-резонансный анализ, стремятся обеспечить объективную оценку стабильности имплантатов и остеоинтеграции, при этом не являясь инвазивными и не повреждая соединение имплантата с костью. Техника частотно-резонансного анализа широко используется в экспериментальных и клинических исследованиях последних 10 лет. Целью данной обзорной статьи является представить современные знания о технике частотно-резонансного анализа и обсудить клиническую пользу частотно-резонансных показателей.
Что такое стабильность имплантатов?
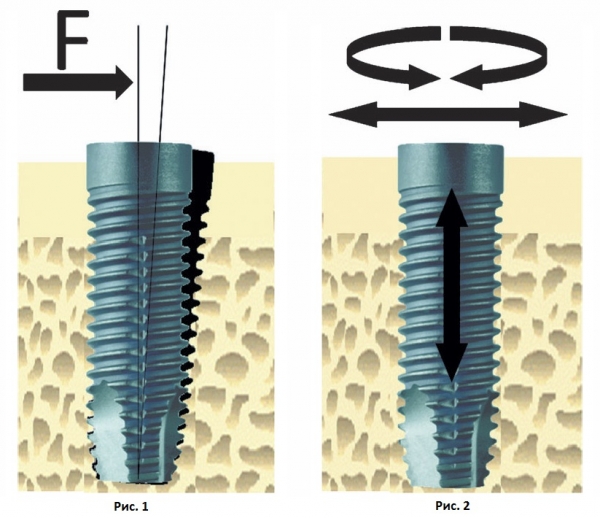
Стабильность имплантатов можно определить как отсутствие клинической подвижности, что также является определением остеоинтеграции. Достижение и сохранение стабильности имплантатов является условием успешного клинического результата имплантации. Тем не менее, клинически стабильные имплантаты также обладают микро-подвижностью при их нагрузке. Например, при приложении латеральной нагрузки (изгиб) на остеоинтегрированный имплантат, имплантат смещается, но возвращается в исходное положение сразу же после устранения нагрузки (Рис. 1). Таким образом, стабильный имплантат может иметь разную степень стабильности (т.е. разную степень смещения или устойчивости к нагрузке) в зависимости от факторов, связанных с качеством костной ткани, хирургической техникой и дизайном имплантата. В процессе клинического функционирования нагрузка прилагается в аксиальном, латеральном и ротационном направлениях (Рис. 2). Более того, аксиальная нагрузка может быть интрузионной и экструзионной, а латеральная нагрузка может быть приложена практически в любом из направлений в радиусе 360о вокруг имплантата. Ротационная нагрузка может быть по часовой стрелке и против. Поэтому результат оценки стабильности имплантата во многом зависит от метода оценки и от вида прилагаемой силы.
Рис. 1 Схематичное изображение, показывающее смещение имплантата после приложения латеральной нагрузки. F – сила.
Рис. 2 Схематичное изображение, показывающее разные направления нагрузки, действующей на имплантат в процессе его функционирования в полости рта.
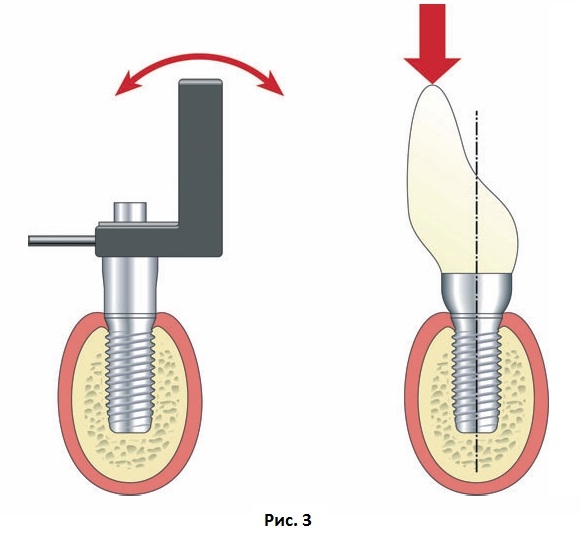
Измерение стабильности имплантатов методом частотно-резонансного анализа обычно включает приложение сгибающей нагрузки, которая симулирует клиническую нагрузку и дает информацию о прочности соединения имплантата с костной тканью (Рис. 3). Измерения стабильности имплантатов также могут включать применение сдвигающей силы, например, как при тесте обратного торка, которая также позволяет оценить прочность соединения имплантат-кость, однако, может быть потенциально деструктивной. Недавно установленный имплантат может обладать высокой степенью латеральной стабильности, но в то же время может легко выкручиваться при приложении обратного торка, когда костная ткань еще не сформирована и не создано соединение с поверхностью имплантата. Латеральная стабильность имплантатов также увеличивается по мере формирования и ремоделирования новой костной ткани. Поскольку большинство имплантатов будут соединены с каркасом, тесты с применением обратного торка имеют меньшее значение, чем оценка латеральной стабильности.
Измерение стабильности имплантатов методом частотно-резонансного анализа обычно включает приложение сгибающей нагрузки, которая симулирует клиническую нагрузку и дает информацию о прочности соединения имплантата с костной тканью (Рис. 3).
Рис. 3 Схематичное изображение, демонстрирующее принципы частотно-резонансного анализа. К датчику прилагают микроскопическую сгибающую силу для измерения резонансной частоты. Сгибающая сила – это наиболее распространенный вид нагрузки, действующей на дентальный имплантат.
Измерения стабильности имплантатов также могут включать применение сдвигающей силы, например, как при тесте обратного торка, которая также позволяет оценить прочность соединения имплантат-кость, однако, может быть потенциально деструктивной. Недавно установленный имплантат может обладать высокой степенью латеральной стабильности, но в то же время может легко выкручиваться при приложении обратного торка, когда костная ткань еще не сформирована и не создано соединение с поверхностью имплантата. Латеральная стабильность имплантатов также увеличивается по мере формирования и ремоделирования новой костной ткани. Поскольку большинство имплантатов будут соединены с каркасом, тесты с применением обратного торка имеют меньшее значение, чем оценка латеральной стабильности.
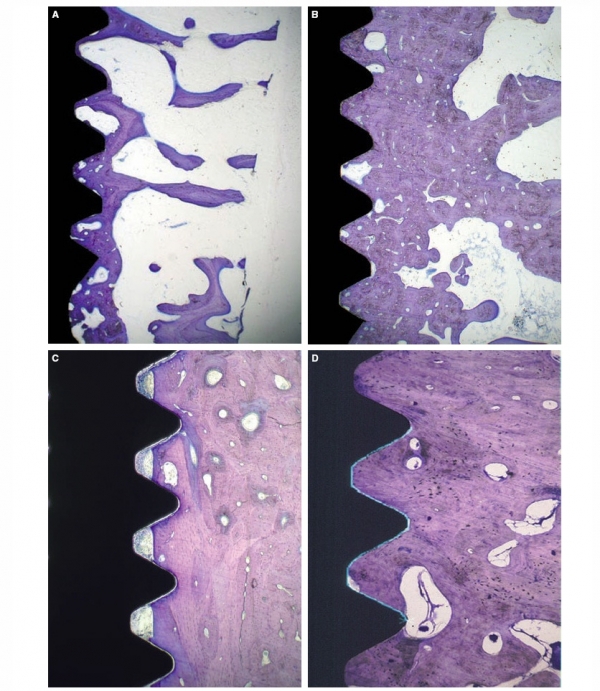
Определяющими факторами стабильности имплантата являются механические свойства костной ткани в области имплантации и насколько хорошо имплантат «внедрен» в эту кость. Механические свойства костной ткани определяются ее составом и могут улучшаться в процессе заживления, поскольку в этот период происходит трансформация трабекулярной кости вблизи имплантата в плотную кортикальную кость (Рис. 4A-D).
Рис. 4 (А) Имплантат, установленный в мягкую трабекулярную кость. (В) Со временем трабекулярная кость трансформируется в более кортикальную структуру, что приводит к повышению прочности соединения имплантата с костью. (С) Имплантат, установленный в плотную кортикальную кость. (D) C течением времени плотность костной ткани существенно не изменяется. Пустоты на границе соединения имплантата с костью были заполнены костной тканью.
Прочность соединения имплантата с костью также зависит от хирургической техники постановки имплантата и от типа самого имплантата. Например, применение последней фрезы меньшего диаметра или использование имплантата большего диаметра или конусной формы способствует более плотному прямому контакту резьбы имплантата с окружающей костной тканью. Кроме того, процесс заживления позволяет повысить прочность соединения имплантата с костью за счет формирования костных мостиков между поверхностью имплантата и окружающей костной тканью.
Частотно-резонансный анализ
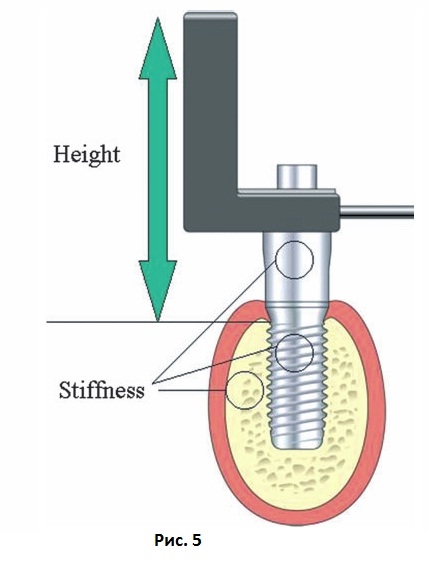
Метод частотно-резонансного анализа оценивает первую резонансную частоту небольшого датчика, прикрепленного к имплантату или абатменту. Резонансная частота зависит от трех основных факторов: во-первых, от типа самого датчика; во-вторых, от жесткости имплантата и прочности его соединения с тканями и окружающей костью; и в-третьих, от общей эффективной длины системы над уровнем маргинальной костной ткани (Рис. 5).
Рис. 5 Схема, иллюстрирующая принципы частотно-резонансного анализа. На результат анализа оказывают влияние жесткость датчика, прочность соединения имплантата с костью, а также эффективная длина имплантата над уровнем альвеолярного гребня (высота).
Эффективная длина включает длину датчика, которая является фиксированной, длину абатмента, которая может варьировать в определенном интервале, и расстояние между вершиной имплантата и уровнем костной ткани. Частотно-резонансный анализ – это тест на изгиб комплекса имплантат-кость, при котором датчик действует на имплантат с чрезвычайно небольшой сгибающей силой. Сгибающая сила оказывает фиксированную латеральную нагрузку на имплантат и измеряется его смещение, таким образом симулируя клиническую нагрузку, хотя и в намного уменьшенной величине.
Частотно-резонансный датчик первого поколения был разработан как простая смещенная консольная балка, которая прикручивалась к имплантату или к абатменту (Рис. 6).
Рис. 6 Схема, иллюстрирующая строение датчика частотно-резонансного анализа.
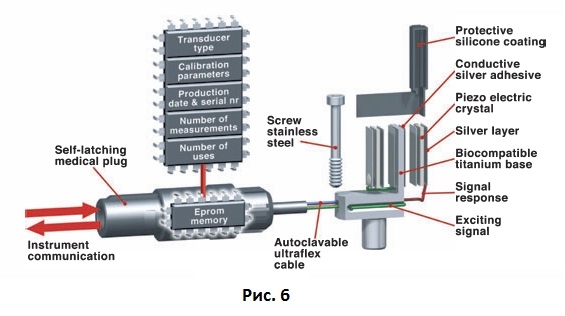
Датчик реагировал на колебания выше определенной частоты. Регистрировался первый изгибный резонанс. Датчик был изготовлен из нержавеющей стали или коммерчески чистого титана и состоял из небольшой смещенной консольной балки с двумя подсоединенными пьезокерамическими элементами (Рис. 7А). Балка начинала вибрировать за счет возбуждения одного из пьезокерамических элементов синусоидным сигналом различной частоты. Сигнал генерировался частотным анализатором, который программировался с помощью персонального компьютера (Рис. 7В).
Рис. 7 (А) Датчик системы частотно-резонансного анализа первого поколения. (В) Оборудование первого поколения, включающее персональный компьютер, осциллограф и анализатор частотного ответа.

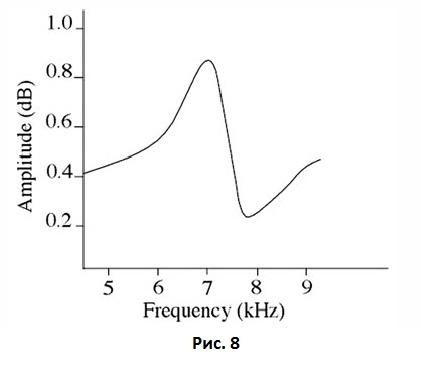
Второй пьезокерамический элемент измерял ответную реакцию балки на колебание и генерируемый сигнал усиливался с помощью электрометрического усилителя сравнением с оригинальным сигналом с помощью анализатора частотного ответа. Возбуждающий сигнал представлял собой синусоидное колебание с частотой в пределах от 5 до 15 кГц и пиком амплитуды 1 В. При первом резонансе датчика отмечалось существенное увеличение амплитуды и изменение фазы принимаемого сигнала. Это можно представить графически в виде частотно-амплитудной диаграммы Бодэ (Рис. 8).
Рис. 8 График частоты-амплитуды частотно-резонансного анализа. Резонансная частота определяется на пике графика.
К недостаткам этой системы частотно-резонансного анализа первого поколения относят большое количество проводов, крупные размеры и большой вес оборудования, высокую стоимость, а также время развертки частотного анализатора. Развертка по частоте 5-15 кГц с шагом 100 Гц и точностью развертки в 25 точек вокруг резонансного пика обычно занимало более 1 минуты. Поэтому было принято решение разработать специальный частотный анализатор (Рис. 9). Ключевыми параметрами этого прибора были скорость, легкость и портативность, полная безопасность для пациента и легкость программирования и скачивания данных. Эти требования были выполнены в ходе разработки специального частотного анализатора, который использовал стандартный медицинский прибор электропитания. Прибор был соединен с персональным компьютером через серийный порт. Компьютер использовался как для программирования развертки по частоте и частотных пределов, так и для сбора и хранения данных на жестком диске.
Рис. 9 Анализатор частотного ответа второго поколения.

Одним из основных недостатков приборов для частотно-резонансного анализа как первого, так и второго поколения, было то, что каждый датчик имел собственную основную резонансную частоту. Поэтому для сравнения показателей разных датчиков необходимо было проводить их калибровку. Невозможно было интерпретировать результаты частотно-резонансного анализа в клинике, например, при сравнении стабильности имплантата у одного и того же пациента с течением времени. Кроме того, система анализатора ответа и персональный компьютер были слишком тяжелыми и не простыми в использовании.
Приборы для частотно-резонансного анализа третьего поколения должны были иметь небольшие размеры, питание от батареек и обеспечивать быстрые и простые измерения с возможностью интерпретации непосредственно у кресла пациента (Рис. 10). Новая система частотно-резонансного анализа (Ostell™, Ostell AB, Gothenburg, Швеция) состоит из анализатора частотного ответа, работающего на батарейках, и датчика нового поколения, предварительно калиброванного на заводе производителя. Получаемые в результате измерения представляют собой отдельный параметр – коэффициент стабильности имплантата. Коэффициент стабильности имплантата определяется по резонансной частоте и может находиться в интервале от 1 (самая низкая стабильность) до 100 (самая высокая стабильность). Датчики выпускаются для различных систем имплантатов и абатментов (Рис. 11 и 12), что делает все показатели частотно-резонансного анализа сравнимыми друг с другом вне зависимости от типа имплантата или абатмента. Кроме того, результаты анализа могут передаваться на персональный компьютер для дальнейшего анализа и хранения через серийный кабель или инфракрасный порт.
Рис. 10 Аппарат для частотно-резонансного анализа третьего поколения, первый из коммерческих аппаратов (Osstell).

Рис. 11 Алюминиевые блоки с различной резонансной частотой, используемые для калибровки датчиков третьего поколения для измерения единиц коэффициента стабильности имплантата (ISQ).

Рис. 12 Клиническое применение датчика Osstell.
Наиболее последние версии аппаратов для частотно-резонансного анализа представляют собой беспроводные системы, в которых металлический стержень (штифт) прикрепляется к имплантату с помощью винтового соединения (Osstell Mentor, Osstell AB) (Рис. 13). К верхней части штифта прикреплен небольшой магнит, который возбуждается магнитными импульсами, передаваемыми от ручного компьютера. Штифт вибрирует в двух направлениях, которые примерно перпендикулярны друг другу. Вибрация происходит в направлении, которое дает наибольшую резонансную частоту (первый режим) и в направлении, которое дает наименьшую резонансную частоту (второй режим). Таким образом получают два значения коэффициента стабильности имплантата, одно высокое и одно низкое (Рис. 14). Например, имплантат с обнаженной с вестибулярной поверхности резьбой может иметь одно низкое значение коэффициента стабильности, отражающее отсутствие костной ткани в вестибуло-оральном направлении, и одно высокое значение, отражающее хорошую костную поддержку в мезио-дистальном направлении.
Рис. 13 Клиническое применение аппаратов Smartpeg и Mentor, систем для частотно-резонансного анализа четвертого поколения.
Рис. 14 В некоторых системах имплантатов аппарат Mentor дает одно низкое и одно высокое значение коэффициента стабильности, отражая самый высокий и самый низкий показатели стабильности имплантата.

Факторы, оказывающие влияние на показатели частотно-резонансного анализа
Жесткость соединения имплантата с костью
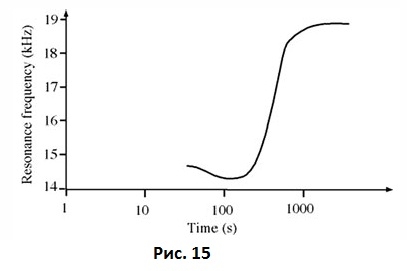
В исследованиях in vitro сложно воспроизвести изменения механических свойств и жесткости, происходящие в костной ткани в процессе ремоделирования и заживления. Полимеризация пластмассы является достаточно простой и воспроизводимой моделью, хотя и не полностью сопоставимой с костью, с помощью которой можно проводить оценку поведения датчиков частотно-резонансного анализа в соотношении с изменяемой жесткостью системы кость-имплантат. По мере полимеризации пластмассы, когда она переходит из жидкого или гелиевого состояния в твердое, отмечается существенное повышение ее жесткости. Было проведено измерение с определенным временным интервалом частотного ответа системы датчик-имплантат, помещенной в различные пластмассы (Рис. 15).
Рис. 15 Изменение резонансной частоты со временем у имплантата, установленного в пластмассу в процессе ее твердения.
Ранние клинические исследования показали наличие взаимосвязи между плотностью костной ткани и первичной стабильностью имплантата. Friberg и соавт. связывали сопротивление имплантата при введении в костную ткань (т.е. плотность костной ткани) с первичной стабильностью имплантатов, установленных на верхней челюсти (Рис. 16). Измерения, проведенные во время фиксации абатмента (через 6-8 месяцев после имплантации) и через 1 год после имплантации, показали, что все имплантаты, вне зависимости от их первичной стабильности, со временем достигали приблизительно одинакового уровня стабильности. Andersson и соавт. исследовали 102 имплантата Neos и обнаружили обратное соотношение между торком при установке имплантата (плотностью костной ткани) и изменениями стабильности имплантата в течение 12 месяцев. Они также установили взаимосвязь между качеством костной ткани, измеренной согласно методике Lekholm и Zarb, и первичной стабильностью имплантата. Имплантаты, внедренные в мягкую кость, с низким уровнем первичной стабильности показали существенное увеличение стабильности с течением времени по сравнению с имплантатами, установленными в плотную костную ткань (Рис. 17).
Рис. 16 Резонансная частота имплантатов, установленных на верхней челюсти в костную ткань различной плотности.
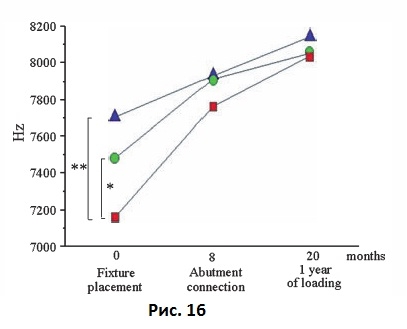
Рис. 17 Значения коэффициента стабильности имплантата для 102 имплантатов, установленных в костную ткань различной плотности, отслеженных с момента имплантации до фиксации абатмента и через год после имплантации. ISQ – коэффициент стабильности имплантата.
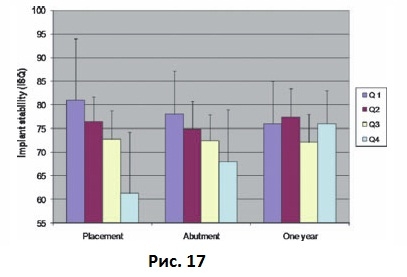
У имплантатов, внедренных в кость типа 1 и типа 2, напротив, отмечалось некоторое снижение стабильности, возможно, в результате ремоделирования маргинальной кости, однако, все имплантаты достигали схожего уровня стабильности через год после установки. Подобные данные были получены и другими исследователями. Данные показали, что жесткость соединения имплантат-кость выше в плотной костной ткани, чем в мягкой. Кроме того, было установлено, что процесс заживления и ремоделирования мягкой трабекулярной кости приводит к увеличению жесткости костной ткани вокруг имплантата.
Техника частотно-резонансного анализа также применялась в исследованиях на животных для изучения процесса заживления нормальной костной ткани, костной ткани после подсадки и постмембранной костной ткани. У кроликов резонансная частота увеличивалась со временем как функция от повышения жесткости системы в результате формирования и ремоделирования новой костной ткани. Однако, при очень высокой первичной стабильности имплантатов, как, например, на нижней челюсти у собак, существенных изменений жесткости соединения имплантат-кость не отмечается. Результаты исследования in vitro на человеческой кости выявили наличие линейной связи показателей частотно-резонансного анализа с инсерционным торком, а также с единицами Hounsfield, оцененными по срезам компьютерной томографии, что еще раз доказывает способность частотно-резонансного анализа к измерению механических свойств костной ткани. В эксперименте in vitro Ito и соавт. использовали три винта для стабилизации имплантата на четырех разных уровнях. Резонансная частота уменьшалась при отвинчивании винтов, установленных в коронковой части имплантата, и не изменялась при отвинчивании винтов, установленных в апикальной части. Это позволяет предположить, что маргинальная область является наиболее критичной для результатов частотно-резонансного анализа. Результаты исследования Ito и соавт. также продемонстрировали, что длина имплантата может не оказывать существенного влияния на показатели частотно-резонансного анализа. Это было подтверждено клиническими исследованиями и исследованиями in vitro.
С помощью техники Osstell было определено, что имплантаты, установленные на верхней челюсти, имеют более высокую стабильность по сравнению с имплантатами, установленными на нижней челюсти. Кроме того, как уже отмечалось выше, некоторые исследователи, хотя и не все, отмечают взаимосвязь между качеством костной ткани и значением коэффициента стабильности имплантата. Основываясь на данных частотно-резонансного анализа 905 последовательных винтовых имплантатов, Ostman и соавт. заключили, что первичная стабильность имплантатов зависит от челюсти, на которой проводят имплантацию, плотности костной ткани, пола, диаметра имплантата и его положения в зубном ряду (фронтальный или боковой отдел). Интересно отметить, что Ostman и соавт . наблюдали снижение стабильности имплантатов по мере увеличения их длины. Miyamoto и соавт. получили схожие данные. Это можно объяснить тем, что некоторые длинные имплантаты имеют уменьшенный диаметр (негативная толерантность) в коронковой части для снижения нагревания в результате трения и облегчения процесса установки. Однако, Bischof и соавт. установили, что положение имплантата, его длина, диаметр и вертикальное положение не отражались на значении коэффициента стабильности 106 имплантатов, установленных на верхней и нижней челюсти. Zix и соавт. изучали имплантацию на верхней челюсти и отметили более высокую стабильность имплантатов у мужчин, чем у женщин.
Исследования, проведенные на одноэтапных имплантатах с немедленной нагрузкой, показали первоначальное снижение первичной стабильности, которая увеличивалась через 3 месяца после имплантации. Первоначальное снижение стабильности имплантатов возможно связано с началом процессов заживления и ремоделирования, которые включают резорбцию костной ткани, а следовательно и временное ослабление кости. Кроме того, это может быть связано с дополнительной нагрузкой имплантатов в этот период времени. Однако, недавнее исследование, проведенное с использованием конусных имплантатов по протоколу немедленной нагрузки, не выявило начального снижения стабильности имплантатов. Напротив, показатели частотно-резонансного анализа увеличивались с момента имплантации до 1 года после нагрузки. Форма и структура поверхности имплантата могут оказывать влияние на его стабильность в начальном периоде заживления. Например, Rompen и соавт. в исследовании на собаках показали, что имплантаты с модифицированной поверхностью сохраняли свою стабильность, в то время как стабильность фрезерованных имплантатов снижалась на начальном этапе периода заживления. Glauser и соавт. сравнивали фрезерованные и окисленные имплантаты, установленные по протоколу немедленной нагрузки, и обнаружили более выраженное снижение стабильности фрезерованных имплантатов в течение первых трех месяцев после нагрузки.
Гистометрическая взаимосвязь
Большинство исследований не выявили взаимосвязи между степенью контакта имплантат-кость и показателями частотно-резонансного анализа. Это может быть связано с природой теста, поскольку степень контакта с костной тканью не обязательно отражает жесткость окружающей кости. В современной дентальной имплантологии, использующей имплантаты с умеренно грубой поверхностью, имплантаты обычно покрываются тонким слоем кости, что, возможно, не имеет значения для биомеханической фиксации имплантатов. Большинство исследователей не подтверждают влияния грубой или гладкой поверхности имплантатов на их стабильность, хотя, как уже отмечалось выше, некоторые исследователи установили различную стабильность имплантатов с различным типом поверхности.
Myiamoto и соавт. наблюдали сильную положительную корреляцию между толщиной кортикальной кости, оцененной по данным компьютерной томографии, и начальными значениями коэффициента стабильности 225 имплантатов, установленных на верхней и на нижней челюсти. Nkenke и соавт. и Gedrange и соавт. также отметили положительную корреляцию между высотой крестальной кортикальной кости и значениями коэффициента стабильности имплантатов в исследованиях на трупах.
Расстояние до первого контакта с костью/атрофия маргинальной кости
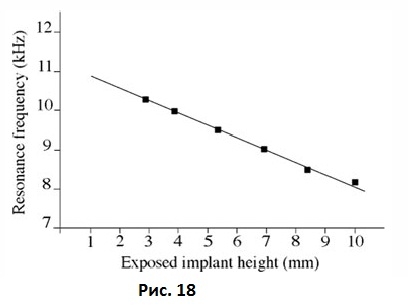
Соотношение между длиной абатмента имплантата и показателями частотно-резонансного анализа изучались в различных экспериментальных моделях. Meredith и соавт. измеряли частотный ответ датчика, прикрепленного к имплантату в алюминиевом блоке, используя абатменты разной длины (Рис. 18).
Рис. 18 Взаимосвязь между резонансной частотой и эффективной длиной имплантата над альвеолярным гребнем.
В исследовании по изучению резорбции костной ткани вокруг имплантатов, проведенном на собаках, Sennerby и соавт. не обнаружили взаимосвязи между потерей костной ткани, выявляемой рентгенологически, и резонансной частотой. Следует отметить, что в этом исследовании маргинальная резорбция костной ткани начиналась после заживления и интеграции имплантатов.
Meredith и соавт. изучали 52 имплантата, установленных на верхней челюсти, через как минимум 5 лет после нагрузки, и установили достоверную положительную связь между эффективной длиной имплантатов (длина абатмента + атрофия костной ткани) и резонансной частотой. В данном исследовании стабильность имплантатов через 5 лет после нагрузки существенно не изменилась. Результаты исследования, изучавшего одноэтапную технику имплантации на нижней челюсти, выявили небольшое, но достоверное снижение стабильности имплантатов через 15 недель после их установки, что возможно было связано с потерей маргинальной кости и увеличением длины имплантата над уровнем альвеолярного гребня.
Turkylmaz и соавт. установили негативную корреляцию между повышенной атрофией маргинальной кости вокруг имплантатов на нижней челюсти и снижением стабильности имплантата в течение первых 6 месяцев после операции. Однако, этой взаимосвязи обнаружено не было между 6 и 12 месяцами после имплантации. Авторы предположили, что эффект атрофии костной ткани компенсировался повышением жесткости соединения имплантат-кость в результате формирования и ремоделирования костной ткани. Однако, Fischer и соавт. не обнаружили взаимосвязи между потерей маргинальной кости и показателями частотно-резонансного анализа в течение 1 года после имплантации. Продолжающийся процесс заживления может нейтрализовать и маскировать эффект атрофии маргинальной кости. Однако, через 3 и 5 лет после имплантации, когда процесс заживления уже должен считаться завершенным, та же группа исследователей обнаружила сильную положительную корреляцию между резорбцией маргинальной кости и низкими значениями коэффициента стабильности имплантатов. Это согласуется с данными Meredith и соавт., которые предположили, что изменение стабильности имплантатов через 5 лет после установки может быть связано с изменением высоты маргинальной кости.
Turkylmaz и соавт. обнаружили отрицательную корреляцию между высотой имплантата над альвеолярным гребнем и значениями коэффициента стабильности имплантатов, установленных непосредственно после удаления зубов. Авторы предложили проводить наблюдения за периодом заживления имплантатов, установленных непосредственно после удаления зубов, с помощью техники частотно-резонансного анализа.
Ориентация датчика частотно-резонансного анализа
Ориентация датчика оказывает влияние на показатели частотно-резонансного анализа. Veltri и соавт. и Fischer и соавт. обнаружили, что значения коэффициента стабильности имплантата повышались примерно на 10 единиц при расположении датчика параллельно, а не перпендикулярно альвеолярному гребню. Вполне вероятно, что комплекс имплантат-кость имеет разную степень жесткости при различных направлениях нагрузки. Низкие значения коэффициента стабильности имплантата, полученные в вестибуло-оральном направлении, свидетельствуют о том, что в этом направлении костная ткань тоньше, чем в мезио-дистальном направлении. Согласно инструкции производителя, новый беспроводной прибор для частотно-резонансного анализа (Mentor, Osstell AB) измеряет самую высокую и самую низку резонансную частоту в тех случаях, когда отмечаются различия более чем в 3 единицы. Это может объяснить наблюдаемые различия в показателях стабильности между новыми и старыми техниками частотно-резонансного анализа. Valderrama и соавт. установили, что две техники частотно-резонансного анализа могут давать различия в показателях до 10 единиц коэффициента стабильности. При этом наиболее высокие показали стабильности получают в мезио-дистальном направлении с помощью беспроводной техники, а наиболее низкие показатели – в вестибуло-оральном направлении с помощью старой техники. Особая ориентация старого датчика частотно-резонансного анализа может быть причиной разных показателей прибора. На рис. 19 представлены результаты измерений стабильности в 12 различных направлениях с помощью старой техники частотно-резонансного анализа и датчика, зависящего от направления ориентации. Измерения с помощью новой техники частотно-резонансного анализа, как показано на Рис. 19, дают два разных показателя: наиболее высокое и наиболее низкое значение коэффициента стабильности.
Рис. 19 Показатели частотно-резонансного анализа имплантата в 12 направлениях с помощью прибора Osstell. Красный и желтый круги показывают результаты одного измерения с помощью нового беспроводного аппарата Mentor™. Очевидно, что показатели стабильности имплантатов варьируют в зависимости от направления приложения нагрузки. Новая техника частотно-резонансного анализа определяет самый высокий и самый низкий показатели стабильности имплантата.
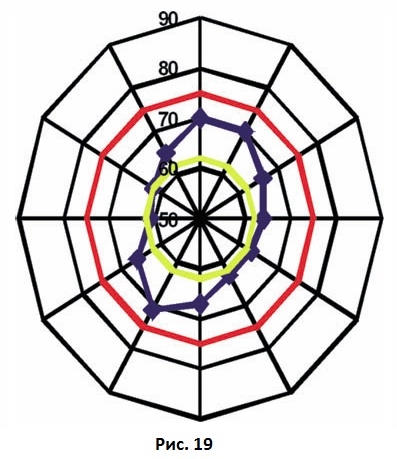
Таким образом, необходимо учитывать, что показатели частотно-резонансного анализа могут варьировать в зависимости от направления, в котором проводятся измерения.
Применение техники частотно-резонансного анализа для прогноза потери имплантата
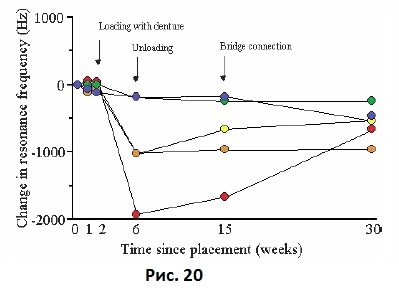
Friberg и соавт. в 1999 провели оценку с помощью частотно-резонансного анализа 75 одноэтапных имплантата, установленных на беззубой нижней челюсти. У одного имплантата было отмечено уменьшение стабильности в период со 2 по 15 неделю и наблюдалась клиническая подвижность имплантата. У второго пациента у трех из пяти имплантатов отмечалось выраженное уменьшение стабильности в период со 2 по 6 неделю, в то время, когда имплантат был нагружен временным протезом после перебазировки. После того, как пациента попросили не носить временный протез, стабильность двух имплантатов увеличилась, а одного имплантата – сохранилась на том же уровне (Рис. 20).
Рис. 20 Стабильность имплантатов у одного и того же пациента с пятью непогруженными имплантатами на нижней челюсти. У трех имплантатов отмечалось выраженное снижение стабильности, которая, тем не менее, была восстановлена после разгрузки имплантатов, когда пациент прекратил использовать съемный протез.
Та же исследовательская группа изучала стабильность 56 имплантатов на верхней челюсти у 9 пациентов и установила, что у всех, кроме двух выпавших имплантатов, в период от установки до фиксации абатмента отмечалось повышение стабильности. Данные свидетельствуют о том, что со временем происходит повышение жесткости соединения имплантата с костью, за исключением неудачных имплантатов, инкапсулированных в мягких тканях.
Glauser и соавт., изучая немедленную нагрузку имплантатов, оценивал стабильность 81 имплантата с помощью техники частотно-резонансного анализа с момента установки и до 1 года после нагрузки. В течение периода наблюдения (1 год) в общей сложности выпали 9 имплантатов. Все имплантаты имели высокие показатели первичной стабильности (коэффициент стабильности около 70), однако, имплантаты, которые впоследствии выпали, показывали прогрессивное снижение стабильности. Через 1 месяц после имплантации среднее значение коэффициента стабильности у имплантатов, которые в дальнейшем претерпели неудачу, составил 52, что достоверно ниже, чем в группе успешных имплантатов, средний коэффициент стабильности которых составил 68. Кроме того, было отмечено, что при значении коэффициента стабильности в пределах 49-58 риск неудач составляет 18,2%. Чем нижнее коэффициент стабильности имплантата через 1 месяц после немедленной нагрузки, тем выше риск неудачного результата. Некоторые из имплантатов в категории риска были «спасены», устранив нагрузку на период заживления. Тем не менее, следует учитывать, что Glauser и соавт. в своем исследовании оценивали показатели частотно-резонансного анализа ретроспективно и не имели возможности клинической коррекции. В исследовании, проведенном на имплантатах, установленных непосредственно после удаления и по протоколу немедленной/ранней нагрузки, Vanden Boagerde и соавт. (58) продемонстрировали возможность предотвращения выпадения имплантата на основании показателей частотно-резонансного анализа. У этого имплантата было отмечено выраженное снижение стабильности от 67 ISQ до 53 ISQ в течение первых шести недель. Имплантат был разгружен, после чего произошло восстановление стабильности до 72 ISQ в течение 6 месяцев.
Sjostrom и соавт. выявили низкую первичную стабильность (коэффициент стабильности 54.6) у 17 имплантатов, которые выпали в течение первого года после нагрузки, по сравнению с 195 имплантатами, которые были успешно установлены на верхней челюсти после подсадки костной ткани (коэффициент стабильности 62.0). Nedir и соавт. сравнивали имплантаты, установленные по протоколу немедленной нагрузки, с имплантатами, нагруженными через 3 месяца заживления, и заключили, что техника частотно-резонансного анализа не позволяет точно выявить подвижные имплантаты. В то же время, стабильность имплантатов может быть достоверно определена в тех случаях, когда коэффициент стабильности больше 47. Одним из возможных объяснений неспособности выявления некоторых подвижных имплантатов может быть природа частотно-резонансного анализа, которая измеряет стабильность в зависимости от жесткости системы. Клинически подвижные имплантаты имеют чрезвычайно низкую жесткость, что не дает системе частотно-резонансного анализа определить первую резонансную частоту, в результате чего коэффициент стабильности оказывается очень высоким, поскольку определяется по второй резонансной частоте.
Huwiler и соавт. оценивали стабильность 17 имплантатов с помощью техники частотно-резонансного анализа в течение 12 месяцев после операции. Один имплантат выпал, и его коэффициент стабильности снизился от 68 до 45. Поскольку подвижность имплантата наблюдается при низких значениях коэффициента стабильности, авторы заключили, что частотно-резонансный анализ нельзя использовать для прогноза выпадения имплантатов.
Fischer и соавт. изучали стабильность 53 имплантатов в течение 1 года после операции. Имплантаты были нагружены одиночными коронками (n = 16) или частичными мостовидными протезами (n = 16) на верхней челюсти непосредственно после или через 16 дней после операции. Среднее значение первичной стабильности имплантатов составило 63.3. Один выпавший имплантат имел коэффициент стабильности 56, что является пятым самым низким значением из всех 56 имплантатов.
Fischer проводил частотно-резонансный анализ у 24 пациентов с 139 имплантатами на верхней челюсти через 3 и 5 лет после операции. Четыре имплантата были потеряны в период от 3 до 5 лет. На 3 году выпавшие имплантаты имели более низкий коэффициент стабильности по сравнению со средним коэффициентом стабильности в исследуемой группе (44, 53, 54 и 54; средний коэффициент 57.7). Оценка риска выпадения имплантатов показала, что значения коэффициента стабильности ниже 44, 53 и 54 были связаны с риском выпадения 100%, 6,7% и 9,5% соответственно. Ни один из 97 имплантатов с коэффициентом стабильности выше 54 не выпал в период исследования с 3 до 5 лет.
Возможное клиническое применение
Техника частотно-резонансного анализа потенциально может предоставить важную информацию о состоянии соединения имплантат-кость на любом этапе лечения. Вопрос в том, как максимально воспользоваться информацией, полученной при каждом отдельном частотно-резонансном измерении в клинической практике. К настоящему времени имеется недостаточно исследований, четко документирующих клинические преимущества терапевтических решений, принятых на основании данных частотно-резонансного анализа. Очевидно, что основной задачей дентальной имплантации является предотвращение выпадения имплантатов. Хотя процесс выпадения имплантатов, установленных по двухэтапному протоколу, достаточно низкий, имплантаты с немедленной нагрузкой или после подсадки костной ткани имеют более высокий риск неудач. Кроме того, имплантация все больше проводится недостаточно опытными врачами, которые сталкиваются с различными осложнениями в процессе своего обучения. Поскольку выпадение имплантатов часто связано с биомеханическими факторами, оценка стабильности имплантатов может существенно снизить риск неудач. Исследования продемонстрировали, что высокие показатели частотно-резонансного анализа свидетельствуют об успехе имплантации с невысоким риском неудачи в будущем. Низкие или снижающиеся показатели стабильности, напротив, говорят о повышенном риске осложнений, хотя и четкий порог значений частотно-резонансного анализа еще предстоит определить.
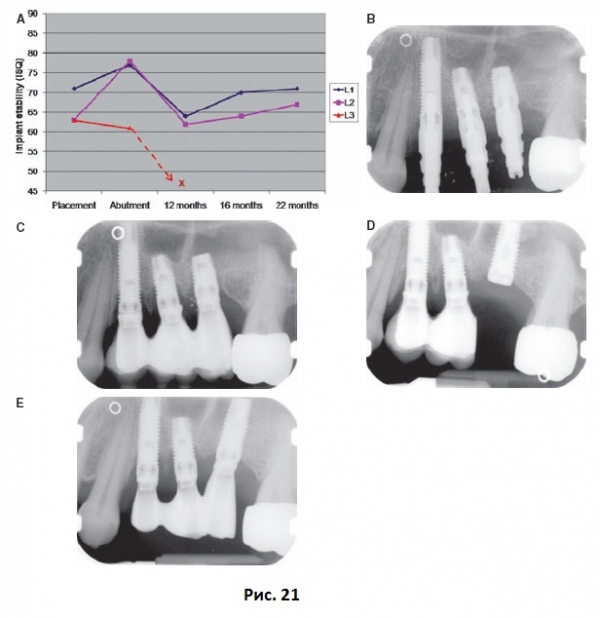
Кажется, что имплантаты любой системы со временем достигают схожего уровня стабильности, что для имплантатов типа Branemark выражается в коэффициенте стабильности 65-75, а для имплантатов типа Straumann – 55-65. Обоснованно предположить, что такой уровень стабильности в любой период после имплантации будет указывать на безопасную стабильность. Коэффициент стабильности ниже 55 для имплантатов Branemark и ниже 45 для имплантатов Straumann должен рассматриваться как тревожный знак, который говорит о том, что необходимо принять меры для повышения стабильности имплантата. Первичную стабильность можно повысить за счет модификации хирургической техники или выбора более широкого, длинного или конусного имплантата. Например, применение более тонких фрез и более широкого и конусного имплантата позволяет повысить первичную стабильность. В настоящее время отмечается тенденция к уменьшению продолжительности периода заживления даже для двухэтапных протоколов имплантации, что может привести к неадекватному заживлению имплантатов, установленных в мягкую костную ткань. Увеличение продолжительности периода заживления после имплантации является простым способом повышения стабильности имплантата. Низкие показатели коэффициента стабильности имплантата после нагрузки могут говорить о дезинтеграции соединения имплантат-кость и риске выпадения имплантата (Рис. 21).
Рис. 21 (А) Показатели частотно-резонансного анализа от момента имплантации до 22 месяцев после нагрузки. ISQ - коэффициент стабильности имплантата. (В) Из трех имплантатов, установленных в боковом участке на верхней челюсти, у имплантатов L1 и L2 отмечалось повышение стабильности, в то время как у имплантата L3 повышения стабильности не наблюдалось. (С) На первом контрольном посещении через год после имплантации имплантат в области первого моляра был клинически подвижен, а в области двух других имплантатов отмечалась выраженная резорбция маргинальной кости по причине неадекватной установки, мягкой костной ткани и чрезмерной нагрузки имплантата. У этих двух имплантатов наблюдалось значительное снижение коэффициента стабильности вследствие атрофии маргинальной кости и дезинтеграции. (D) Мостовидный протез был укорочен и нагрузка на имплантаты была уменьшена. Был установлен новый имплантат в сочетании с мембранной подсадкой костной ткани. Стабильность имплантата увеличилась. (Е) Новый окончательный протез, включающий новый имплантат. Отмечается повышение стабильности имплантатов L1 и L2, несмотря на то, что некоторая атрофия маргинальной кости сохраняется.
В таких случаях рекомендуется снять протезную конструкцию для определения стабильности самого имплантата. Заживление имплантата в течение дополнительных 6 недель без нагрузки является достаточным временем для восстановления стабильности имплантата. Снижение коэффициента стабильности имплантата также может быть результатом резорбции маргинальной кости, поэтому необходимо проводить рентгенологическое исследование для оценки состояния пародонта. Для имплантатов типа Branemark снижение коэффициента стабильности на 10 единиц от 75 до 65 не так угрожающе, как снижение от 60 до 50. Производители отмечают, что следует ожидать снижения стабильности имплантатов в пределах трех единиц. При периимплантите стабильность имплантата может оставаться высокой, однако в этих случаях будущее имплантата находится под угрозой из-за прогрессирующей и нелеченной потере маргинальной кости. Суммируя все вышесказанное, техника частотно-резонансного анализа может использоваться для оценки стабильности имплантатов при контрольных посещениях. Только при выявлении низкой или снижающейся стабильности имплантата следует проводить рентгенологическое исследование. Одним из недостатков такого подхода является то, что для проведения частотно-резонансных измерений необходимо снимать протезные конструкции.
Техника частотно-резонансного анализа может быть полезной для оценки имплантатов, установленных по протоколу немедленной нагрузки, на различных этапах лечения. Например, определенные значения коэффициента стабильности могут быть использованы как критерии исключения из протокола немедленной нагрузки. Ostman и соавт. отмечают низкий процент выпадения имплантатов в тех случаях, когда одним из критерием включения в протокол немедленной нагрузки имплантатов, установленных на беззубой верхней челюсти и в боковых участках на нижней челюсти, был коэффициент стабильности 60. Авторы данного исследования считают технику частотно-резонансного анализа полезной для принятия решения о том, когда следует заменять временный немедленный протез на постоянный протез. Значения коэффициента стабильности выше 65 указывают на благоприятный ответ на немедленную нагрузку, в то время как низкие значения коэффициента стабильности свидетельствуют о перегрузки имплантата и о риске его выпадения. В этих случаях перед фиксацией постоянного протеза рекомендуется разгрузка имплантата и, возможно, установка дополнительных имплантатов.
И наконец, частотно-резонансный анализ может служить важным инструментом для документирования клинического результата имплантации. Это может быть особенно важно с медико-легальной точки зрения. Также, имплантологам, которым направляют пациентов для установки имплантатов с последующим протезированием у лечащего врача, техника частотно-резонансного анализа может помочь убедить врача, направившего пациента, и самого пациента в достаточной стабильности имплантата перед тем, как отправить его на протезирование. Другими словами, техника частотно-резонансного анализа может служить своеобразным отпечатком пальцев для установленных имплантатов.
Заключение
Техника частотно-резонансного анализа может предоставить врачу важную информацию о состоянии области соединения имплантат-кость на любом этапе лечения или при контрольных посещениях. Частотно-резонансный анализ оценивает стабильность имплантатов как функцию от жесткости соединения имплантат-кость, которая зависит от таких факторов, как плотность костной ткани, сроки заживления и высота имплантата над уровнем альвеолярного гребня. Исследования показали, что имплантаты с высокими значениями коэффициента стабильности на контрольных посещениях являются успешно интегрированными, в то время как низкие и снижающиеся показатели стабильности могут быть признаком неудачи имплантации и/или потери уровня маргинальной кости.
Авторы: Lars Sennerby и Neil Meredith
Остеоинтегрированные имплантаты для протезирования беззубых челюстей имеют высокий процент успеха в тех случаях, когда соблюдаются определенные условия. Стабильность имплантатов играет критическую роль для успеха результата лечения, особенно в случаях применения коротких имплантатов и при имплантации в мягкую костную ткань, когда имеется повышенный риск неудач. Согласно оригинальным протоколам имплантации первичная стабильность имплантатов обеспечивалась за счет формирования и ремоделирования новой кости, названных остеоинтеграцией, которые происходили на начальных этапах периода заживления, в течение которого имплантат оставался ненагруженным, чтобы обеспечить беспрепятственное формирование новой кости на его поверхности. Процесс остеоинтеграции повышает жесткость костной ткани вокруг имплантата, а костное сцепление с поверхностью имплантата предотвращает микроподвижность имплантата и формирование фиброзной рубцовой ткани при его нагрузке. Разработка новых поверхностей имплантатов и новых клинических технологий позволила значительно уменьшить продолжительность начального периода заживления вплоть до немедленной/ранней нагрузки имплантатов, обладающих высокой первичной стабильностью. Однако, успех техники немедленной/ранней нагрузки зависит от способности врача определить степень первичной стабильности имплантата и изменение его стабильности в ходе формирования и ремоделирования новой костной ткани.
Клиническая оценка первичной стабильности имплантатов часто основана на сопротивлении имплантата в процессе его установки в костную ткань. Чувство «хорошей» стабильности может усиливаться при наличии резкой остановки в процессе введения имплантата. Конусные имплантаты, повторяющие форму корня зуба, благодаря своей геометрии дают ощущение полной остановки имплантата в процессе его вкручивания в костную ткань, что может дать ошибочное впечатление о высокой стабильности имплантата. Для оценки первичной стабильности имплантатов также могут использоваться перкуссионные тесты. Перкуссионный тест состоит в постукивании ручкой стоматологического зеркала по имплантату. Звонкий звук при постукивании считается показателем хорошей стабильности или остеоинтеграции. Однако, такие тесты скорее всего дают больше информации о перкуссионном инструменте, чем о самом имплантате, и не являются достоверными. Иногда для оценки первичной стабильности имплантатов используют значения инсерционного торка, а также обратного или развинчивающего торка в процессе подсоединения абатмента. Считается, что имплантаты, которые вращаются при приложении определенного торка, подлежат удалению. Однако, поверхность имплантатов в процессе остеоинтеграции может разрушится под действием торковой нагрузки. Кроме того, после того, как исследования на животных продемонстрировали повторную интеграцию подвижных имплантатов, техника обратного торка для оценки стабильности имплантатов оказалась несостоятельной. Другие техники, такие как Periotest и частотно-резонансный анализ, стремятся обеспечить объективную оценку стабильности имплантатов и остеоинтеграции, при этом не являясь инвазивными и не повреждая соединение имплантата с костью. Техника частотно-резонансного анализа широко используется в экспериментальных и клинических исследованиях последних 10 лет. Целью данной обзорной статьи является представить современные знания о технике частотно-резонансного анализа и обсудить клиническую пользу частотно-резонансных показателей.
Что такое стабильность имплантатов?
Стабильность имплантатов можно определить как отсутствие клинической подвижности, что также является определением остеоинтеграции. Достижение и сохранение стабильности имплантатов является условием успешного клинического результата имплантации. Тем не менее, клинически стабильные имплантаты также обладают микро-подвижностью при их нагрузке. Например, при приложении латеральной нагрузки (изгиб) на остеоинтегрированный имплантат, имплантат смещается, но возвращается в исходное положение сразу же после устранения нагрузки (Рис. 1). Таким образом, стабильный имплантат может иметь разную степень стабильности (т.е. разную степень смещения или устойчивости к нагрузке) в зависимости от факторов, связанных с качеством костной ткани, хирургической техникой и дизайном имплантата. В процессе клинического функционирования нагрузка прилагается в аксиальном, латеральном и ротационном направлениях (Рис. 2). Более того, аксиальная нагрузка может быть интрузионной и экструзионной, а латеральная нагрузка может быть приложена практически в любом из направлений в радиусе 360о вокруг имплантата. Ротационная нагрузка может быть по часовой стрелке и против. Поэтому результат оценки стабильности имплантата во многом зависит от метода оценки и от вида прилагаемой силы.
Рис. 1 Схематичное изображение, показывающее смещение имплантата после приложения латеральной нагрузки. F – сила.
Рис. 2 Схематичное изображение, показывающее разные направления нагрузки, действующей на имплантат в процессе его функционирования в полости рта.

Измерение стабильности имплантатов методом частотно-резонансного анализа обычно включает приложение сгибающей нагрузки, которая симулирует клиническую нагрузку и дает информацию о прочности соединения имплантата с костной тканью (Рис. 3). Измерения стабильности имплантатов также могут включать применение сдвигающей силы, например, как при тесте обратного торка, которая также позволяет оценить прочность соединения имплантат-кость, однако, может быть потенциально деструктивной. Недавно установленный имплантат может обладать высокой степенью латеральной стабильности, но в то же время может легко выкручиваться при приложении обратного торка, когда костная ткань еще не сформирована и не создано соединение с поверхностью имплантата. Латеральная стабильность имплантатов также увеличивается по мере формирования и ремоделирования новой костной ткани. Поскольку большинство имплантатов будут соединены с каркасом, тесты с применением обратного торка имеют меньшее значение, чем оценка латеральной стабильности.
Измерение стабильности имплантатов методом частотно-резонансного анализа обычно включает приложение сгибающей нагрузки, которая симулирует клиническую нагрузку и дает информацию о прочности соединения имплантата с костной тканью (Рис. 3).
Рис. 3 Схематичное изображение, демонстрирующее принципы частотно-резонансного анализа. К датчику прилагают микроскопическую сгибающую силу для измерения резонансной частоты. Сгибающая сила – это наиболее распространенный вид нагрузки, действующей на дентальный имплантат.

Измерения стабильности имплантатов также могут включать применение сдвигающей силы, например, как при тесте обратного торка, которая также позволяет оценить прочность соединения имплантат-кость, однако, может быть потенциально деструктивной. Недавно установленный имплантат может обладать высокой степенью латеральной стабильности, но в то же время может легко выкручиваться при приложении обратного торка, когда костная ткань еще не сформирована и не создано соединение с поверхностью имплантата. Латеральная стабильность имплантатов также увеличивается по мере формирования и ремоделирования новой костной ткани. Поскольку большинство имплантатов будут соединены с каркасом, тесты с применением обратного торка имеют меньшее значение, чем оценка латеральной стабильности.
Определяющими факторами стабильности имплантата являются механические свойства костной ткани в области имплантации и насколько хорошо имплантат «внедрен» в эту кость. Механические свойства костной ткани определяются ее составом и могут улучшаться в процессе заживления, поскольку в этот период происходит трансформация трабекулярной кости вблизи имплантата в плотную кортикальную кость (Рис. 4A-D).
Рис. 4 (А) Имплантат, установленный в мягкую трабекулярную кость. (В) Со временем трабекулярная кость трансформируется в более кортикальную структуру, что приводит к повышению прочности соединения имплантата с костью. (С) Имплантат, установленный в плотную кортикальную кость. (D) C течением времени плотность костной ткани существенно не изменяется. Пустоты на границе соединения имплантата с костью были заполнены костной тканью.

Прочность соединения имплантата с костью также зависит от хирургической техники постановки имплантата и от типа самого имплантата. Например, применение последней фрезы меньшего диаметра или использование имплантата большего диаметра или конусной формы способствует более плотному прямому контакту резьбы имплантата с окружающей костной тканью. Кроме того, процесс заживления позволяет повысить прочность соединения имплантата с костью за счет формирования костных мостиков между поверхностью имплантата и окружающей костной тканью.
Частотно-резонансный анализ
Метод частотно-резонансного анализа оценивает первую резонансную частоту небольшого датчика, прикрепленного к имплантату или абатменту. Резонансная частота зависит от трех основных факторов: во-первых, от типа самого датчика; во-вторых, от жесткости имплантата и прочности его соединения с тканями и окружающей костью; и в-третьих, от общей эффективной длины системы над уровнем маргинальной костной ткани (Рис. 5).
Рис. 5 Схема, иллюстрирующая принципы частотно-резонансного анализа. На результат анализа оказывают влияние жесткость датчика, прочность соединения имплантата с костью, а также эффективная длина имплантата над уровнем альвеолярного гребня (высота).

Эффективная длина включает длину датчика, которая является фиксированной, длину абатмента, которая может варьировать в определенном интервале, и расстояние между вершиной имплантата и уровнем костной ткани. Частотно-резонансный анализ – это тест на изгиб комплекса имплантат-кость, при котором датчик действует на имплантат с чрезвычайно небольшой сгибающей силой. Сгибающая сила оказывает фиксированную латеральную нагрузку на имплантат и измеряется его смещение, таким образом симулируя клиническую нагрузку, хотя и в намного уменьшенной величине.
Частотно-резонансный датчик первого поколения был разработан как простая смещенная консольная балка, которая прикручивалась к имплантату или к абатменту (Рис. 6).
Рис. 6 Схема, иллюстрирующая строение датчика частотно-резонансного анализа.

Датчик реагировал на колебания выше определенной частоты. Регистрировался первый изгибный резонанс. Датчик был изготовлен из нержавеющей стали или коммерчески чистого титана и состоял из небольшой смещенной консольной балки с двумя подсоединенными пьезокерамическими элементами (Рис. 7А). Балка начинала вибрировать за счет возбуждения одного из пьезокерамических элементов синусоидным сигналом различной частоты. Сигнал генерировался частотным анализатором, который программировался с помощью персонального компьютера (Рис. 7В).
Рис. 7 (А) Датчик системы частотно-резонансного анализа первого поколения. (В) Оборудование первого поколения, включающее персональный компьютер, осциллограф и анализатор частотного ответа.

Второй пьезокерамический элемент измерял ответную реакцию балки на колебание и генерируемый сигнал усиливался с помощью электрометрического усилителя сравнением с оригинальным сигналом с помощью анализатора частотного ответа. Возбуждающий сигнал представлял собой синусоидное колебание с частотой в пределах от 5 до 15 кГц и пиком амплитуды 1 В. При первом резонансе датчика отмечалось существенное увеличение амплитуды и изменение фазы принимаемого сигнала. Это можно представить графически в виде частотно-амплитудной диаграммы Бодэ (Рис. 8).
Рис. 8 График частоты-амплитуды частотно-резонансного анализа. Резонансная частота определяется на пике графика.

К недостаткам этой системы частотно-резонансного анализа первого поколения относят большое количество проводов, крупные размеры и большой вес оборудования, высокую стоимость, а также время развертки частотного анализатора. Развертка по частоте 5-15 кГц с шагом 100 Гц и точностью развертки в 25 точек вокруг резонансного пика обычно занимало более 1 минуты. Поэтому было принято решение разработать специальный частотный анализатор (Рис. 9). Ключевыми параметрами этого прибора были скорость, легкость и портативность, полная безопасность для пациента и легкость программирования и скачивания данных. Эти требования были выполнены в ходе разработки специального частотного анализатора, который использовал стандартный медицинский прибор электропитания. Прибор был соединен с персональным компьютером через серийный порт. Компьютер использовался как для программирования развертки по частоте и частотных пределов, так и для сбора и хранения данных на жестком диске.
Рис. 9 Анализатор частотного ответа второго поколения.

Одним из основных недостатков приборов для частотно-резонансного анализа как первого, так и второго поколения, было то, что каждый датчик имел собственную основную резонансную частоту. Поэтому для сравнения показателей разных датчиков необходимо было проводить их калибровку. Невозможно было интерпретировать результаты частотно-резонансного анализа в клинике, например, при сравнении стабильности имплантата у одного и того же пациента с течением времени. Кроме того, система анализатора ответа и персональный компьютер были слишком тяжелыми и не простыми в использовании.
Приборы для частотно-резонансного анализа третьего поколения должны были иметь небольшие размеры, питание от батареек и обеспечивать быстрые и простые измерения с возможностью интерпретации непосредственно у кресла пациента (Рис. 10). Новая система частотно-резонансного анализа (Ostell™, Ostell AB, Gothenburg, Швеция) состоит из анализатора частотного ответа, работающего на батарейках, и датчика нового поколения, предварительно калиброванного на заводе производителя. Получаемые в результате измерения представляют собой отдельный параметр – коэффициент стабильности имплантата. Коэффициент стабильности имплантата определяется по резонансной частоте и может находиться в интервале от 1 (самая низкая стабильность) до 100 (самая высокая стабильность). Датчики выпускаются для различных систем имплантатов и абатментов (Рис. 11 и 12), что делает все показатели частотно-резонансного анализа сравнимыми друг с другом вне зависимости от типа имплантата или абатмента. Кроме того, результаты анализа могут передаваться на персональный компьютер для дальнейшего анализа и хранения через серийный кабель или инфракрасный порт.
Рис. 10 Аппарат для частотно-резонансного анализа третьего поколения, первый из коммерческих аппаратов (Osstell).

Рис. 11 Алюминиевые блоки с различной резонансной частотой, используемые для калибровки датчиков третьего поколения для измерения единиц коэффициента стабильности имплантата (ISQ).

Рис. 12 Клиническое применение датчика Osstell.

Наиболее последние версии аппаратов для частотно-резонансного анализа представляют собой беспроводные системы, в которых металлический стержень (штифт) прикрепляется к имплантату с помощью винтового соединения (Osstell Mentor, Osstell AB) (Рис. 13). К верхней части штифта прикреплен небольшой магнит, который возбуждается магнитными импульсами, передаваемыми от ручного компьютера. Штифт вибрирует в двух направлениях, которые примерно перпендикулярны друг другу. Вибрация происходит в направлении, которое дает наибольшую резонансную частоту (первый режим) и в направлении, которое дает наименьшую резонансную частоту (второй режим). Таким образом получают два значения коэффициента стабильности имплантата, одно высокое и одно низкое (Рис. 14). Например, имплантат с обнаженной с вестибулярной поверхности резьбой может иметь одно низкое значение коэффициента стабильности, отражающее отсутствие костной ткани в вестибуло-оральном направлении, и одно высокое значение, отражающее хорошую костную поддержку в мезио-дистальном направлении.
Рис. 13 Клиническое применение аппаратов Smartpeg и Mentor, систем для частотно-резонансного анализа четвертого поколения.

Рис. 14 В некоторых системах имплантатов аппарат Mentor дает одно низкое и одно высокое значение коэффициента стабильности, отражая самый высокий и самый низкий показатели стабильности имплантата.

Факторы, оказывающие влияние на показатели частотно-резонансного анализа
Жесткость соединения имплантата с костью
В исследованиях in vitro сложно воспроизвести изменения механических свойств и жесткости, происходящие в костной ткани в процессе ремоделирования и заживления. Полимеризация пластмассы является достаточно простой и воспроизводимой моделью, хотя и не полностью сопоставимой с костью, с помощью которой можно проводить оценку поведения датчиков частотно-резонансного анализа в соотношении с изменяемой жесткостью системы кость-имплантат. По мере полимеризации пластмассы, когда она переходит из жидкого или гелиевого состояния в твердое, отмечается существенное повышение ее жесткости. Было проведено измерение с определенным временным интервалом частотного ответа системы датчик-имплантат, помещенной в различные пластмассы (Рис. 15).
Рис. 15 Изменение резонансной частоты со временем у имплантата, установленного в пластмассу в процессе ее твердения.

Ранние клинические исследования показали наличие взаимосвязи между плотностью костной ткани и первичной стабильностью имплантата. Friberg и соавт. связывали сопротивление имплантата при введении в костную ткань (т.е. плотность костной ткани) с первичной стабильностью имплантатов, установленных на верхней челюсти (Рис. 16). Измерения, проведенные во время фиксации абатмента (через 6-8 месяцев после имплантации) и через 1 год после имплантации, показали, что все имплантаты, вне зависимости от их первичной стабильности, со временем достигали приблизительно одинакового уровня стабильности. Andersson и соавт. исследовали 102 имплантата Neos и обнаружили обратное соотношение между торком при установке имплантата (плотностью костной ткани) и изменениями стабильности имплантата в течение 12 месяцев. Они также установили взаимосвязь между качеством костной ткани, измеренной согласно методике Lekholm и Zarb, и первичной стабильностью имплантата. Имплантаты, внедренные в мягкую кость, с низким уровнем первичной стабильности показали существенное увеличение стабильности с течением времени по сравнению с имплантатами, установленными в плотную костную ткань (Рис. 17).
Рис. 16 Резонансная частота имплантатов, установленных на верхней челюсти в костную ткань различной плотности.

Рис. 17 Значения коэффициента стабильности имплантата для 102 имплантатов, установленных в костную ткань различной плотности, отслеженных с момента имплантации до фиксации абатмента и через год после имплантации. ISQ – коэффициент стабильности имплантата.

У имплантатов, внедренных в кость типа 1 и типа 2, напротив, отмечалось некоторое снижение стабильности, возможно, в результате ремоделирования маргинальной кости, однако, все имплантаты достигали схожего уровня стабильности через год после установки. Подобные данные были получены и другими исследователями. Данные показали, что жесткость соединения имплантат-кость выше в плотной костной ткани, чем в мягкой. Кроме того, было установлено, что процесс заживления и ремоделирования мягкой трабекулярной кости приводит к увеличению жесткости костной ткани вокруг имплантата.
Техника частотно-резонансного анализа также применялась в исследованиях на животных для изучения процесса заживления нормальной костной ткани, костной ткани после подсадки и постмембранной костной ткани. У кроликов резонансная частота увеличивалась со временем как функция от повышения жесткости системы в результате формирования и ремоделирования новой костной ткани. Однако, при очень высокой первичной стабильности имплантатов, как, например, на нижней челюсти у собак, существенных изменений жесткости соединения имплантат-кость не отмечается. Результаты исследования in vitro на человеческой кости выявили наличие линейной связи показателей частотно-резонансного анализа с инсерционным торком, а также с единицами Hounsfield, оцененными по срезам компьютерной томографии, что еще раз доказывает способность частотно-резонансного анализа к измерению механических свойств костной ткани. В эксперименте in vitro Ito и соавт. использовали три винта для стабилизации имплантата на четырех разных уровнях. Резонансная частота уменьшалась при отвинчивании винтов, установленных в коронковой части имплантата, и не изменялась при отвинчивании винтов, установленных в апикальной части. Это позволяет предположить, что маргинальная область является наиболее критичной для результатов частотно-резонансного анализа. Результаты исследования Ito и соавт. также продемонстрировали, что длина имплантата может не оказывать существенного влияния на показатели частотно-резонансного анализа. Это было подтверждено клиническими исследованиями и исследованиями in vitro.
С помощью техники Osstell было определено, что имплантаты, установленные на верхней челюсти, имеют более высокую стабильность по сравнению с имплантатами, установленными на нижней челюсти. Кроме того, как уже отмечалось выше, некоторые исследователи, хотя и не все, отмечают взаимосвязь между качеством костной ткани и значением коэффициента стабильности имплантата. Основываясь на данных частотно-резонансного анализа 905 последовательных винтовых имплантатов, Ostman и соавт. заключили, что первичная стабильность имплантатов зависит от челюсти, на которой проводят имплантацию, плотности костной ткани, пола, диаметра имплантата и его положения в зубном ряду (фронтальный или боковой отдел). Интересно отметить, что Ostman и соавт . наблюдали снижение стабильности имплантатов по мере увеличения их длины. Miyamoto и соавт. получили схожие данные. Это можно объяснить тем, что некоторые длинные имплантаты имеют уменьшенный диаметр (негативная толерантность) в коронковой части для снижения нагревания в результате трения и облегчения процесса установки. Однако, Bischof и соавт. установили, что положение имплантата, его длина, диаметр и вертикальное положение не отражались на значении коэффициента стабильности 106 имплантатов, установленных на верхней и нижней челюсти. Zix и соавт. изучали имплантацию на верхней челюсти и отметили более высокую стабильность имплантатов у мужчин, чем у женщин.
Исследования, проведенные на одноэтапных имплантатах с немедленной нагрузкой, показали первоначальное снижение первичной стабильности, которая увеличивалась через 3 месяца после имплантации. Первоначальное снижение стабильности имплантатов возможно связано с началом процессов заживления и ремоделирования, которые включают резорбцию костной ткани, а следовательно и временное ослабление кости. Кроме того, это может быть связано с дополнительной нагрузкой имплантатов в этот период времени. Однако, недавнее исследование, проведенное с использованием конусных имплантатов по протоколу немедленной нагрузки, не выявило начального снижения стабильности имплантатов. Напротив, показатели частотно-резонансного анализа увеличивались с момента имплантации до 1 года после нагрузки. Форма и структура поверхности имплантата могут оказывать влияние на его стабильность в начальном периоде заживления. Например, Rompen и соавт. в исследовании на собаках показали, что имплантаты с модифицированной поверхностью сохраняли свою стабильность, в то время как стабильность фрезерованных имплантатов снижалась на начальном этапе периода заживления. Glauser и соавт. сравнивали фрезерованные и окисленные имплантаты, установленные по протоколу немедленной нагрузки, и обнаружили более выраженное снижение стабильности фрезерованных имплантатов в течение первых трех месяцев после нагрузки.
Гистометрическая взаимосвязь
Большинство исследований не выявили взаимосвязи между степенью контакта имплантат-кость и показателями частотно-резонансного анализа. Это может быть связано с природой теста, поскольку степень контакта с костной тканью не обязательно отражает жесткость окружающей кости. В современной дентальной имплантологии, использующей имплантаты с умеренно грубой поверхностью, имплантаты обычно покрываются тонким слоем кости, что, возможно, не имеет значения для биомеханической фиксации имплантатов. Большинство исследователей не подтверждают влияния грубой или гладкой поверхности имплантатов на их стабильность, хотя, как уже отмечалось выше, некоторые исследователи установили различную стабильность имплантатов с различным типом поверхности.
Myiamoto и соавт. наблюдали сильную положительную корреляцию между толщиной кортикальной кости, оцененной по данным компьютерной томографии, и начальными значениями коэффициента стабильности 225 имплантатов, установленных на верхней и на нижней челюсти. Nkenke и соавт. и Gedrange и соавт. также отметили положительную корреляцию между высотой крестальной кортикальной кости и значениями коэффициента стабильности имплантатов в исследованиях на трупах.
Расстояние до первого контакта с костью/атрофия маргинальной кости
Соотношение между длиной абатмента имплантата и показателями частотно-резонансного анализа изучались в различных экспериментальных моделях. Meredith и соавт. измеряли частотный ответ датчика, прикрепленного к имплантату в алюминиевом блоке, используя абатменты разной длины (Рис. 18).
Рис. 18 Взаимосвязь между резонансной частотой и эффективной длиной имплантата над альвеолярным гребнем.

В исследовании по изучению резорбции костной ткани вокруг имплантатов, проведенном на собаках, Sennerby и соавт. не обнаружили взаимосвязи между потерей костной ткани, выявляемой рентгенологически, и резонансной частотой. Следует отметить, что в этом исследовании маргинальная резорбция костной ткани начиналась после заживления и интеграции имплантатов.
Meredith и соавт. изучали 52 имплантата, установленных на верхней челюсти, через как минимум 5 лет после нагрузки, и установили достоверную положительную связь между эффективной длиной имплантатов (длина абатмента + атрофия костной ткани) и резонансной частотой. В данном исследовании стабильность имплантатов через 5 лет после нагрузки существенно не изменилась. Результаты исследования, изучавшего одноэтапную технику имплантации на нижней челюсти, выявили небольшое, но достоверное снижение стабильности имплантатов через 15 недель после их установки, что возможно было связано с потерей маргинальной кости и увеличением длины имплантата над уровнем альвеолярного гребня.
Turkylmaz и соавт. установили негативную корреляцию между повышенной атрофией маргинальной кости вокруг имплантатов на нижней челюсти и снижением стабильности имплантата в течение первых 6 месяцев после операции. Однако, этой взаимосвязи обнаружено не было между 6 и 12 месяцами после имплантации. Авторы предположили, что эффект атрофии костной ткани компенсировался повышением жесткости соединения имплантат-кость в результате формирования и ремоделирования костной ткани. Однако, Fischer и соавт. не обнаружили взаимосвязи между потерей маргинальной кости и показателями частотно-резонансного анализа в течение 1 года после имплантации. Продолжающийся процесс заживления может нейтрализовать и маскировать эффект атрофии маргинальной кости. Однако, через 3 и 5 лет после имплантации, когда процесс заживления уже должен считаться завершенным, та же группа исследователей обнаружила сильную положительную корреляцию между резорбцией маргинальной кости и низкими значениями коэффициента стабильности имплантатов. Это согласуется с данными Meredith и соавт., которые предположили, что изменение стабильности имплантатов через 5 лет после установки может быть связано с изменением высоты маргинальной кости.
Turkylmaz и соавт. обнаружили отрицательную корреляцию между высотой имплантата над альвеолярным гребнем и значениями коэффициента стабильности имплантатов, установленных непосредственно после удаления зубов. Авторы предложили проводить наблюдения за периодом заживления имплантатов, установленных непосредственно после удаления зубов, с помощью техники частотно-резонансного анализа.
Ориентация датчика частотно-резонансного анализа
Ориентация датчика оказывает влияние на показатели частотно-резонансного анализа. Veltri и соавт. и Fischer и соавт. обнаружили, что значения коэффициента стабильности имплантата повышались примерно на 10 единиц при расположении датчика параллельно, а не перпендикулярно альвеолярному гребню. Вполне вероятно, что комплекс имплантат-кость имеет разную степень жесткости при различных направлениях нагрузки. Низкие значения коэффициента стабильности имплантата, полученные в вестибуло-оральном направлении, свидетельствуют о том, что в этом направлении костная ткань тоньше, чем в мезио-дистальном направлении. Согласно инструкции производителя, новый беспроводной прибор для частотно-резонансного анализа (Mentor, Osstell AB) измеряет самую высокую и самую низку резонансную частоту в тех случаях, когда отмечаются различия более чем в 3 единицы. Это может объяснить наблюдаемые различия в показателях стабильности между новыми и старыми техниками частотно-резонансного анализа. Valderrama и соавт. установили, что две техники частотно-резонансного анализа могут давать различия в показателях до 10 единиц коэффициента стабильности. При этом наиболее высокие показали стабильности получают в мезио-дистальном направлении с помощью беспроводной техники, а наиболее низкие показатели – в вестибуло-оральном направлении с помощью старой техники. Особая ориентация старого датчика частотно-резонансного анализа может быть причиной разных показателей прибора. На рис. 19 представлены результаты измерений стабильности в 12 различных направлениях с помощью старой техники частотно-резонансного анализа и датчика, зависящего от направления ориентации. Измерения с помощью новой техники частотно-резонансного анализа, как показано на Рис. 19, дают два разных показателя: наиболее высокое и наиболее низкое значение коэффициента стабильности.
Рис. 19 Показатели частотно-резонансного анализа имплантата в 12 направлениях с помощью прибора Osstell. Красный и желтый круги показывают результаты одного измерения с помощью нового беспроводного аппарата Mentor™. Очевидно, что показатели стабильности имплантатов варьируют в зависимости от направления приложения нагрузки. Новая техника частотно-резонансного анализа определяет самый высокий и самый низкий показатели стабильности имплантата.

Таким образом, необходимо учитывать, что показатели частотно-резонансного анализа могут варьировать в зависимости от направления, в котором проводятся измерения.
Применение техники частотно-резонансного анализа для прогноза потери имплантата
Friberg и соавт. в 1999 провели оценку с помощью частотно-резонансного анализа 75 одноэтапных имплантата, установленных на беззубой нижней челюсти. У одного имплантата было отмечено уменьшение стабильности в период со 2 по 15 неделю и наблюдалась клиническая подвижность имплантата. У второго пациента у трех из пяти имплантатов отмечалось выраженное уменьшение стабильности в период со 2 по 6 неделю, в то время, когда имплантат был нагружен временным протезом после перебазировки. После того, как пациента попросили не носить временный протез, стабильность двух имплантатов увеличилась, а одного имплантата – сохранилась на том же уровне (Рис. 20).
Рис. 20 Стабильность имплантатов у одного и того же пациента с пятью непогруженными имплантатами на нижней челюсти. У трех имплантатов отмечалось выраженное снижение стабильности, которая, тем не менее, была восстановлена после разгрузки имплантатов, когда пациент прекратил использовать съемный протез.

Та же исследовательская группа изучала стабильность 56 имплантатов на верхней челюсти у 9 пациентов и установила, что у всех, кроме двух выпавших имплантатов, в период от установки до фиксации абатмента отмечалось повышение стабильности. Данные свидетельствуют о том, что со временем происходит повышение жесткости соединения имплантата с костью, за исключением неудачных имплантатов, инкапсулированных в мягких тканях.
Glauser и соавт., изучая немедленную нагрузку имплантатов, оценивал стабильность 81 имплантата с помощью техники частотно-резонансного анализа с момента установки и до 1 года после нагрузки. В течение периода наблюдения (1 год) в общей сложности выпали 9 имплантатов. Все имплантаты имели высокие показатели первичной стабильности (коэффициент стабильности около 70), однако, имплантаты, которые впоследствии выпали, показывали прогрессивное снижение стабильности. Через 1 месяц после имплантации среднее значение коэффициента стабильности у имплантатов, которые в дальнейшем претерпели неудачу, составил 52, что достоверно ниже, чем в группе успешных имплантатов, средний коэффициент стабильности которых составил 68. Кроме того, было отмечено, что при значении коэффициента стабильности в пределах 49-58 риск неудач составляет 18,2%. Чем нижнее коэффициент стабильности имплантата через 1 месяц после немедленной нагрузки, тем выше риск неудачного результата. Некоторые из имплантатов в категории риска были «спасены», устранив нагрузку на период заживления. Тем не менее, следует учитывать, что Glauser и соавт. в своем исследовании оценивали показатели частотно-резонансного анализа ретроспективно и не имели возможности клинической коррекции. В исследовании, проведенном на имплантатах, установленных непосредственно после удаления и по протоколу немедленной/ранней нагрузки, Vanden Boagerde и соавт. (58) продемонстрировали возможность предотвращения выпадения имплантата на основании показателей частотно-резонансного анализа. У этого имплантата было отмечено выраженное снижение стабильности от 67 ISQ до 53 ISQ в течение первых шести недель. Имплантат был разгружен, после чего произошло восстановление стабильности до 72 ISQ в течение 6 месяцев.
Sjostrom и соавт. выявили низкую первичную стабильность (коэффициент стабильности 54.6) у 17 имплантатов, которые выпали в течение первого года после нагрузки, по сравнению с 195 имплантатами, которые были успешно установлены на верхней челюсти после подсадки костной ткани (коэффициент стабильности 62.0). Nedir и соавт. сравнивали имплантаты, установленные по протоколу немедленной нагрузки, с имплантатами, нагруженными через 3 месяца заживления, и заключили, что техника частотно-резонансного анализа не позволяет точно выявить подвижные имплантаты. В то же время, стабильность имплантатов может быть достоверно определена в тех случаях, когда коэффициент стабильности больше 47. Одним из возможных объяснений неспособности выявления некоторых подвижных имплантатов может быть природа частотно-резонансного анализа, которая измеряет стабильность в зависимости от жесткости системы. Клинически подвижные имплантаты имеют чрезвычайно низкую жесткость, что не дает системе частотно-резонансного анализа определить первую резонансную частоту, в результате чего коэффициент стабильности оказывается очень высоким, поскольку определяется по второй резонансной частоте.
Huwiler и соавт. оценивали стабильность 17 имплантатов с помощью техники частотно-резонансного анализа в течение 12 месяцев после операции. Один имплантат выпал, и его коэффициент стабильности снизился от 68 до 45. Поскольку подвижность имплантата наблюдается при низких значениях коэффициента стабильности, авторы заключили, что частотно-резонансный анализ нельзя использовать для прогноза выпадения имплантатов.
Fischer и соавт. изучали стабильность 53 имплантатов в течение 1 года после операции. Имплантаты были нагружены одиночными коронками (n = 16) или частичными мостовидными протезами (n = 16) на верхней челюсти непосредственно после или через 16 дней после операции. Среднее значение первичной стабильности имплантатов составило 63.3. Один выпавший имплантат имел коэффициент стабильности 56, что является пятым самым низким значением из всех 56 имплантатов.
Fischer проводил частотно-резонансный анализ у 24 пациентов с 139 имплантатами на верхней челюсти через 3 и 5 лет после операции. Четыре имплантата были потеряны в период от 3 до 5 лет. На 3 году выпавшие имплантаты имели более низкий коэффициент стабильности по сравнению со средним коэффициентом стабильности в исследуемой группе (44, 53, 54 и 54; средний коэффициент 57.7). Оценка риска выпадения имплантатов показала, что значения коэффициента стабильности ниже 44, 53 и 54 были связаны с риском выпадения 100%, 6,7% и 9,5% соответственно. Ни один из 97 имплантатов с коэффициентом стабильности выше 54 не выпал в период исследования с 3 до 5 лет.
Возможное клиническое применение
Техника частотно-резонансного анализа потенциально может предоставить важную информацию о состоянии соединения имплантат-кость на любом этапе лечения. Вопрос в том, как максимально воспользоваться информацией, полученной при каждом отдельном частотно-резонансном измерении в клинической практике. К настоящему времени имеется недостаточно исследований, четко документирующих клинические преимущества терапевтических решений, принятых на основании данных частотно-резонансного анализа. Очевидно, что основной задачей дентальной имплантации является предотвращение выпадения имплантатов. Хотя процесс выпадения имплантатов, установленных по двухэтапному протоколу, достаточно низкий, имплантаты с немедленной нагрузкой или после подсадки костной ткани имеют более высокий риск неудач. Кроме того, имплантация все больше проводится недостаточно опытными врачами, которые сталкиваются с различными осложнениями в процессе своего обучения. Поскольку выпадение имплантатов часто связано с биомеханическими факторами, оценка стабильности имплантатов может существенно снизить риск неудач. Исследования продемонстрировали, что высокие показатели частотно-резонансного анализа свидетельствуют об успехе имплантации с невысоким риском неудачи в будущем. Низкие или снижающиеся показатели стабильности, напротив, говорят о повышенном риске осложнений, хотя и четкий порог значений частотно-резонансного анализа еще предстоит определить.
Кажется, что имплантаты любой системы со временем достигают схожего уровня стабильности, что для имплантатов типа Branemark выражается в коэффициенте стабильности 65-75, а для имплантатов типа Straumann – 55-65. Обоснованно предположить, что такой уровень стабильности в любой период после имплантации будет указывать на безопасную стабильность. Коэффициент стабильности ниже 55 для имплантатов Branemark и ниже 45 для имплантатов Straumann должен рассматриваться как тревожный знак, который говорит о том, что необходимо принять меры для повышения стабильности имплантата. Первичную стабильность можно повысить за счет модификации хирургической техники или выбора более широкого, длинного или конусного имплантата. Например, применение более тонких фрез и более широкого и конусного имплантата позволяет повысить первичную стабильность. В настоящее время отмечается тенденция к уменьшению продолжительности периода заживления даже для двухэтапных протоколов имплантации, что может привести к неадекватному заживлению имплантатов, установленных в мягкую костную ткань. Увеличение продолжительности периода заживления после имплантации является простым способом повышения стабильности имплантата. Низкие показатели коэффициента стабильности имплантата после нагрузки могут говорить о дезинтеграции соединения имплантат-кость и риске выпадения имплантата (Рис. 21).
Рис. 21 (А) Показатели частотно-резонансного анализа от момента имплантации до 22 месяцев после нагрузки. ISQ - коэффициент стабильности имплантата. (В) Из трех имплантатов, установленных в боковом участке на верхней челюсти, у имплантатов L1 и L2 отмечалось повышение стабильности, в то время как у имплантата L3 повышения стабильности не наблюдалось. (С) На первом контрольном посещении через год после имплантации имплантат в области первого моляра был клинически подвижен, а в области двух других имплантатов отмечалась выраженная резорбция маргинальной кости по причине неадекватной установки, мягкой костной ткани и чрезмерной нагрузки имплантата. У этих двух имплантатов наблюдалось значительное снижение коэффициента стабильности вследствие атрофии маргинальной кости и дезинтеграции. (D) Мостовидный протез был укорочен и нагрузка на имплантаты была уменьшена. Был установлен новый имплантат в сочетании с мембранной подсадкой костной ткани. Стабильность имплантата увеличилась. (Е) Новый окончательный протез, включающий новый имплантат. Отмечается повышение стабильности имплантатов L1 и L2, несмотря на то, что некоторая атрофия маргинальной кости сохраняется.

В таких случаях рекомендуется снять протезную конструкцию для определения стабильности самого имплантата. Заживление имплантата в течение дополнительных 6 недель без нагрузки является достаточным временем для восстановления стабильности имплантата. Снижение коэффициента стабильности имплантата также может быть результатом резорбции маргинальной кости, поэтому необходимо проводить рентгенологическое исследование для оценки состояния пародонта. Для имплантатов типа Branemark снижение коэффициента стабильности на 10 единиц от 75 до 65 не так угрожающе, как снижение от 60 до 50. Производители отмечают, что следует ожидать снижения стабильности имплантатов в пределах трех единиц. При периимплантите стабильность имплантата может оставаться высокой, однако в этих случаях будущее имплантата находится под угрозой из-за прогрессирующей и нелеченной потере маргинальной кости. Суммируя все вышесказанное, техника частотно-резонансного анализа может использоваться для оценки стабильности имплантатов при контрольных посещениях. Только при выявлении низкой или снижающейся стабильности имплантата следует проводить рентгенологическое исследование. Одним из недостатков такого подхода является то, что для проведения частотно-резонансных измерений необходимо снимать протезные конструкции.
Техника частотно-резонансного анализа может быть полезной для оценки имплантатов, установленных по протоколу немедленной нагрузки, на различных этапах лечения. Например, определенные значения коэффициента стабильности могут быть использованы как критерии исключения из протокола немедленной нагрузки. Ostman и соавт. отмечают низкий процент выпадения имплантатов в тех случаях, когда одним из критерием включения в протокол немедленной нагрузки имплантатов, установленных на беззубой верхней челюсти и в боковых участках на нижней челюсти, был коэффициент стабильности 60. Авторы данного исследования считают технику частотно-резонансного анализа полезной для принятия решения о том, когда следует заменять временный немедленный протез на постоянный протез. Значения коэффициента стабильности выше 65 указывают на благоприятный ответ на немедленную нагрузку, в то время как низкие значения коэффициента стабильности свидетельствуют о перегрузки имплантата и о риске его выпадения. В этих случаях перед фиксацией постоянного протеза рекомендуется разгрузка имплантата и, возможно, установка дополнительных имплантатов.
И наконец, частотно-резонансный анализ может служить важным инструментом для документирования клинического результата имплантации. Это может быть особенно важно с медико-легальной точки зрения. Также, имплантологам, которым направляют пациентов для установки имплантатов с последующим протезированием у лечащего врача, техника частотно-резонансного анализа может помочь убедить врача, направившего пациента, и самого пациента в достаточной стабильности имплантата перед тем, как отправить его на протезирование. Другими словами, техника частотно-резонансного анализа может служить своеобразным отпечатком пальцев для установленных имплантатов.
Заключение
Техника частотно-резонансного анализа может предоставить врачу важную информацию о состоянии области соединения имплантат-кость на любом этапе лечения или при контрольных посещениях. Частотно-резонансный анализ оценивает стабильность имплантатов как функцию от жесткости соединения имплантат-кость, которая зависит от таких факторов, как плотность костной ткани, сроки заживления и высота имплантата над уровнем альвеолярного гребня. Исследования показали, что имплантаты с высокими значениями коэффициента стабильности на контрольных посещениях являются успешно интегрированными, в то время как низкие и снижающиеся показатели стабильности могут быть признаком неудачи имплантации и/или потери уровня маргинальной кости.
Авторы: Lars Sennerby и Neil Meredith
































































































































































0 комментариев