С момента внедрения биологического принципа остеоинтеграции и начала широкого использования современных имплантатов, было представлено уже множество фактов, которые свидетельствуют о высоких показателях выживания имплантатов в долгосрочной перспективе (от 82% до 99%). Хотя показатели успешности имплантатов также являются достаточно высокими, но важно понимать, что даже удачно интегрированный имплантат все же поддается риску влияния факторов, которые могут спровоцировать его потерю.
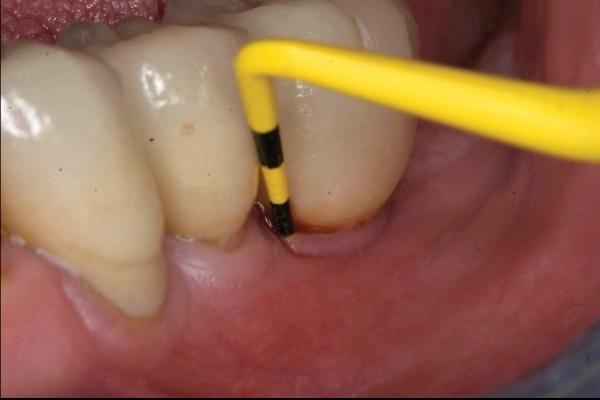
Учитывая изменение взглядов на диагностику периимплантита, сложно было определить объективный уровень его распространения, который варьировал от 28 до 56% при учете патологии у пациентов, и в диапазоне 12-40% при регистрации патологии вокруг имплантатов. В недавнем систематическом обзоре сообщалось, что средняя распространенность периимплантита составляет 22%, что положительно коррелирует с временем функционирования внутрикостной опоры и отрицательно взаимосвязано с прогрессией редукции периимплантатной костной ткани. Следовательно, в зависимости от показателей данных двух критериев будут меняться и показатели распространенности патологии. Однако установлено, что примерно четверть пациентов и, вероятно, одна пятая часть установленных имплантатов подвергаются действию периимплантитной патологии через 5-10 лет после установки интраоссальных титановых конструкций, что подчеркивает важность разработки направления профилактики потенциальных осложнений, связанных с неуспешностью имплантатов.
Эффективные профилактические меры должны быть направлены на причину заболевания и контроль установленных факторов риска. В случае периимплантита основным этиологическим фактором является влияние бактериальной биопленки, которая прикрепляется к поверхности имплантата и провоцирует развитие воспалительной реакции. Фактически присутствие налета является основным показателем риска развития пери-мукозита. Аналогичным образом, наличие зубного налета с сопутствующим кровотечением на зондирование в более чем 30% участков было ассоциировано с увеличением риска развития истинного периимплантита. Плохая гигиена полости рта, курение и наличие пародонтита в анамнезе в настоящее время рассматриваются как основные факторы риска, связанные с периимплантитом; следовательно, именно на них должно быть нацелено действие различных профилактических мероприятий. Другие возможные факторы включают параметры шероховатости поверхности, количество кератинизированной ткани и наличие остаточного цемента, которые также положительно коррелировали с развитием пери-имплантата, хотя данные относительно их влияния ограничены только кросс-секционными исследованиями.
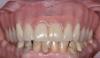
Первым шагом в профилактической стратегии периимплантита является его адекватная диагностика и объективная оценка состояния окружающих твердых и мягких тканей. Для этой цели используют методы пародонтального зондирования и рентгенологического исследования. Данный подход к диагностике после фиксации супраконструкция является базовым, и полученные в ходе его реализации показатели составляют отправную точку для оценки дальнейших изменений в периимпланттаной области (фото 1 - 2). Хотя зондирование периимплантатной области является менее диагностически значимым, чем пародонтальное зондирование, но наличие кровотечения при таковом напрямую свидетельствует о наличие воспаления окружающих тканей. Значительное углубление кармана во время зондирования является непрямым доказательством редукции костной ткани и аргументирует потребность проведения дополнительной рентгенографической диагностики (фото 3 - 5).
Фото 1. Измерение глубины карманов.
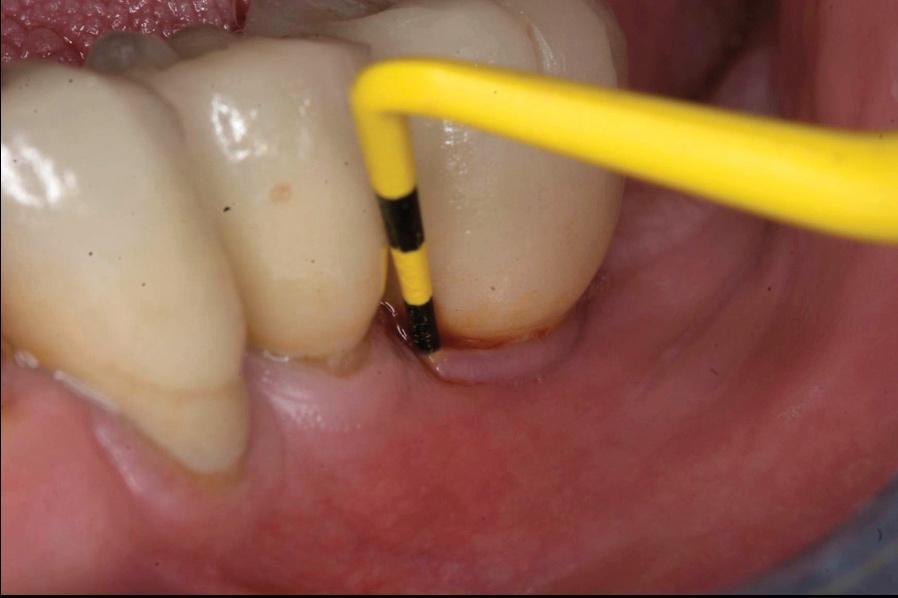
Фото 2. Перипакальные рентгенограммы.
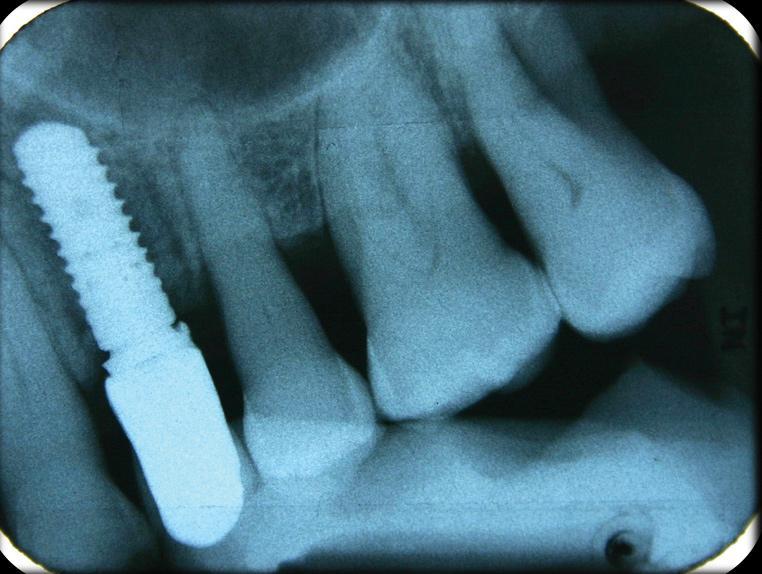
Фото 3. Перимукозит.
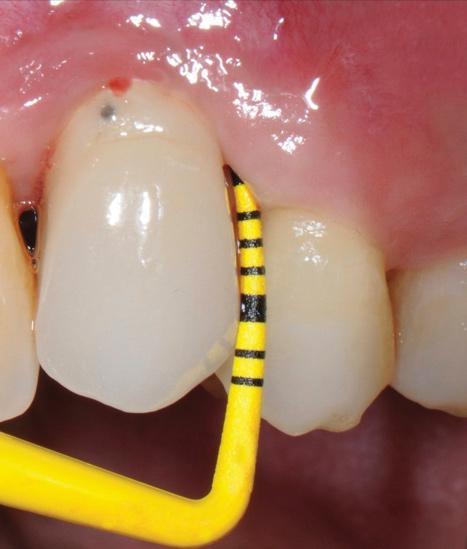
Фото 4. Кровотечение при зондировании.
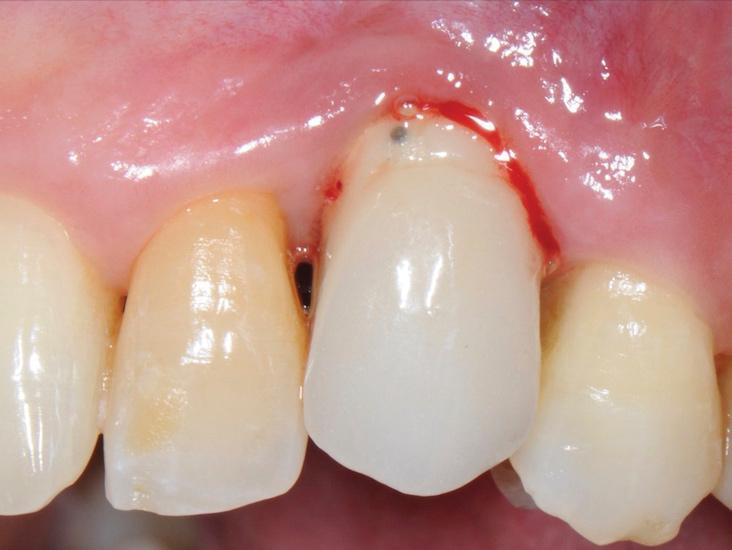
Фото 5. Потеря костной ткани на рентгенограмме.
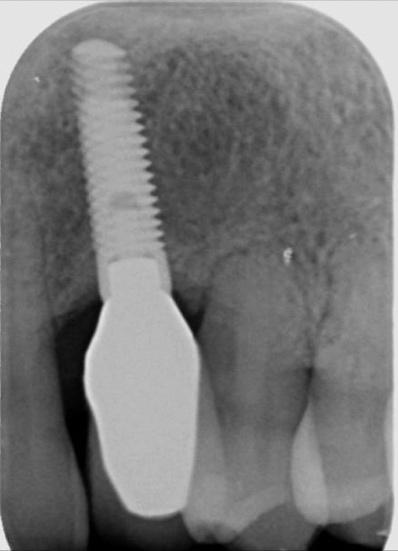
Современное понимание процессов перехода мукозита в периимплантит до сих пор остаётся недостаточно изученным, поскольку аспекты иммунологической деструкции костной ткани и нарушения остеоинтеграции сами по себе не в полной мере понятны. В проспективном 5-летнем исследовании с участием 80 пациентов, у которых отмечался перимукозит на начальной стадии диагностики, и которые не принимали участие ни в каких профилактических программах, было доказано, что при подобных условиях риск развития периимплантита увеличивается в 20 раз по сравнению с теми больными, которым проводилась систематическая гигиеническая очистка. Таким образом, лечение перимукозита следует рассматривать как первичный этап профилактики периимплантита, и основную превентивную стратегию снижения риска развития периимплантационных осложнений.
Профилактика перимукозита
Профилактические мероприятия должны назначаться пациенту сразу же после установки окончательных супраконструкций, а основная цель таковых должна быть направлена на контроль формирования зубного налета как в домашних, так и в клинических условиях с учетом профиля риска каждого отдельного пациента. Эффективность гигиенических мероприятий в основном зависит от фактора обеспечения простоты доступа ершиков и щеточек в необходимую область вмешательства. Данный фактор в основном определяется спецификой конструкции самого протеза (фото 6 - 8). Поэтому супраконструкция должна обеспечивать не только надлежащую функциональную реабилитацию, но и соответствующие условия для поддержания определённого уровня гигиены. Недавний систематический обзор эффективности проведения самостоятельной гигиенической очистки периимплантатной области непосредственно пациентами подтвердил несколько высшие показатели при использовании электрических зубных щеток по сравнению с ручными.
Фото 6. Выполнение гигиенических манипуляций.
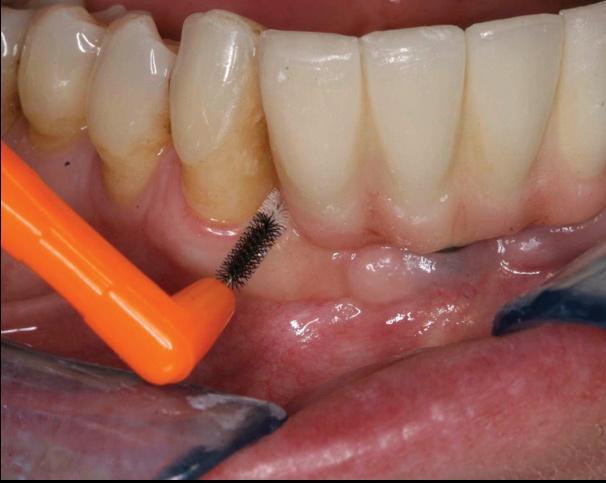
Фото 7. Выполнение гигиенических манипуляций.
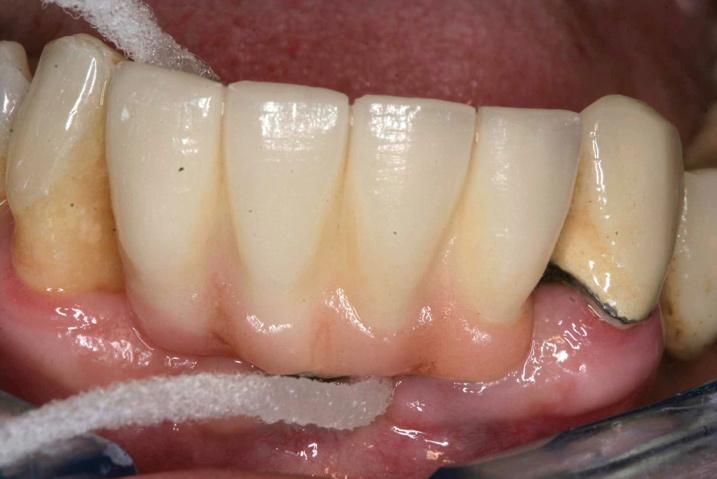
Фото 8. Выполнение гигиенических манипуляций.
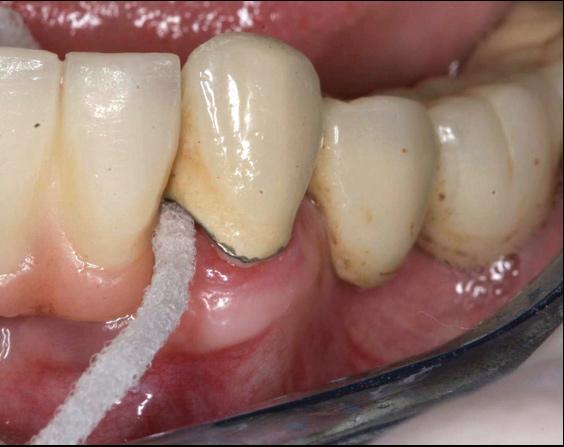
Лечение перимукозита
Для достижения эффективных результатов лечения перимукозита, в первую, очередь нужно добиться ограничения воспаления слизистой оболочки, которое клинически будет проявляться отсутствием кровотечения при зондировании. В свою очередь, для разрешения самого воспаления нужно устранить действие основного этиологического фактора – аккумуляции биопленки на поверхности имплантата.
В недавних систематических обзорах проводилась оценка эффективности профессиональных подходов к удалению бактериального налета посредством одной или нескольких процедур. На основе семи исследований, соответствующих критериям включения, авторы сравнивали эффективность механического удаления биопленки с использованием ультразвуковых и ручных инструментов изолированно или в сочетании с одним из трех дополнительных методов: 1) воздухо-абразивной обработкой; 2) применением антисептического средства (геля фосфорной кислоты, хлоргексидина диглюконат, озона или перекиси водорода) и 3) адъювантной антибиотикотерапии (локальное применение тетрациклина хлоргексидина или системный прием азитромицина).
Несмотря на первоначальные результаты, которые указывали на несколько большую эффективность применения дополнительных средств обработки поверхности имплантата, в конце концов, окончательные результаты оказались не столь контрастирующими между собой. Без надлежащей поддержки определенного уровня гигиены самим пациентом, использованием различных механических методов очистки поверхности имплантата с или без применения дополнительных средств, не обеспечивается долгосрочной гарантии относительно разрешения периимплантитной патологии. Кроме того, проводилась систематическая оценка эффективности контроля уровня гигиены самим пациентом с использованием различных механических или химических методов. Наилучшие результаты были определены при механическом удалении зубного налета посредством щетки в сочетании с дополнительным использованием принципов механической дезинфекции, которые включают ополаскивание/орошение полости рта антисептическими растворами (хлоргексидин) или же применение геля хлоргексидина. Наиболее эффективным оказались протоколы с применением электрических/ультразвуковых зубных щеток, паст с доказанным антибактериальным действием, и растворов хлоргексидина или эссенциальных эфирных масел. Однако единственного протокола для выполнения пациентом соответствующих манипуляций пока что не разработано, а назначения тех или иных алгоритмов должно рассматриваться с точки зрения возможной их адаптации для пациента с учетом специфики дизайна имеющейся супраконструкции. Значительное внимание врач должен уделить именно обучению пациентов определенным методам поддержки гигиены полости рта, и их дальнейшей мотивации. Кроме того, необходимо обеспечить доступность конкретных руководств для самих врачей-стоматологов относительно специфики диагностики поражения тканей в периимплантатной области, которые бы включали описание определенных техник регистрации и удаления зубного налета с поверхностей имплантата, абатмента и протезных конструкций. Вполне логично, что чистота самой реставрации с опорой на имплантате напрямую влияет на уровень риска развития периимплантита. Когортное исследование с участием 23 пациентов показало, что в случае 74% имплантатов они характеризовались недостаточным доступом для проведения определенных гигиенических мероприятий, а в 48% имплантатов с уже присутствующим периимплантитом таковые вообще никогда очищались. Неадекватно сформированные конструкции протезов, или же таковые с нависающим краем следует рассматривать как ятрогенные факторы риска развития периимплантита. Аналогично на развитие данной патологии могут влиять неадекватно спозиционированные имплантаты, наличие излишков оттискного материала или фиксирующего цемента, которые способствуют накоплению бактериального налета на поверхности имплантата. Коррекция или устранение этих факторов (например, замена или модификация дизайна протеза) является важной составляющей комплексного лечения периимплантатного мукозита (фото 9 – 11).
Фото 9. Аккумуляция зубного налета и воспаление слизистой оболочки.
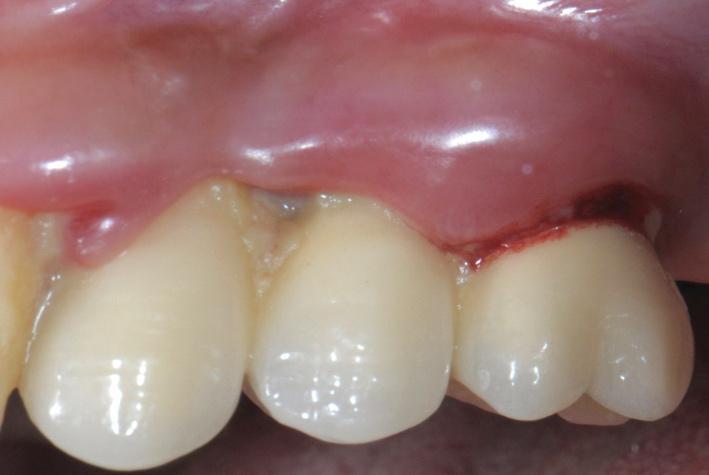
Фото 10. Травматическое поражение тканей.
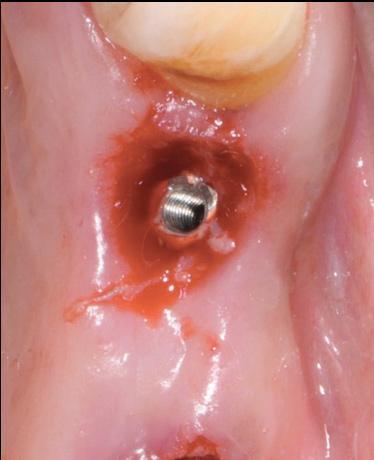
Фото 11. Модификация дизайна протеза для обеспечения надлежащих условий для проведения гигиенических манипуляций.
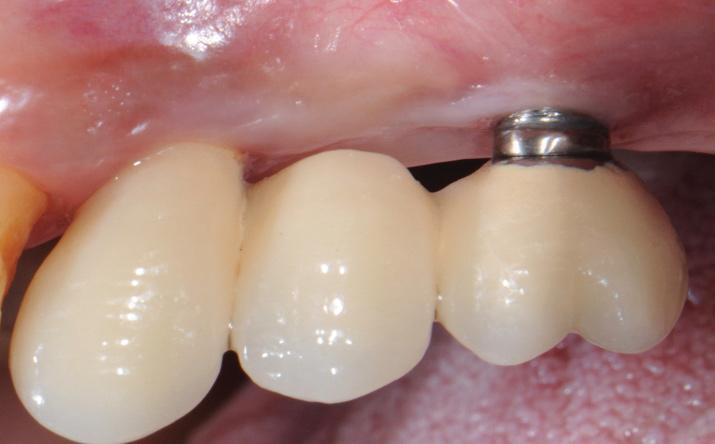
Лечение периимплантита
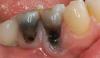
Лечение периимпланита должно проходить по принципам, аналогичным лечению пародонтита – посредством удаления биопленки на поверхности имплантата или абатмента с использованием различных механических, физических и химических механизмов (фото 12 - 15).
Фото 12. Аккумуляция зубного налета и воспаление слизистой оболочки.
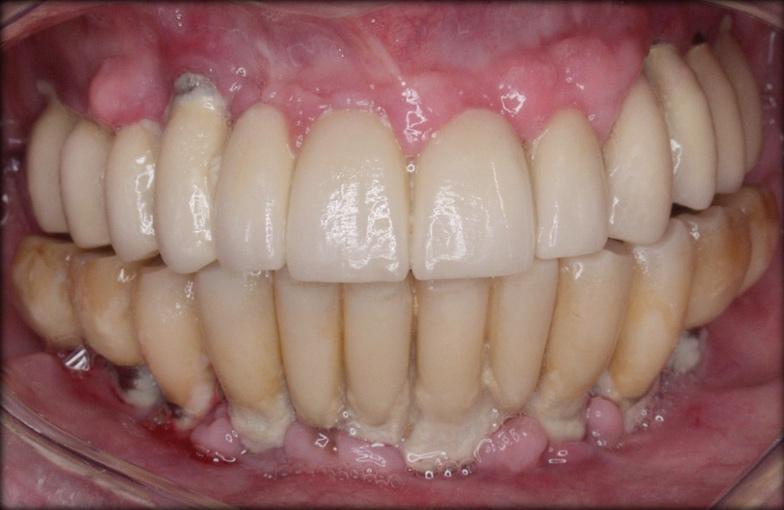
Фото 13. Потеря костной ткани в области имплантатов, установленных на нижней челюсти.
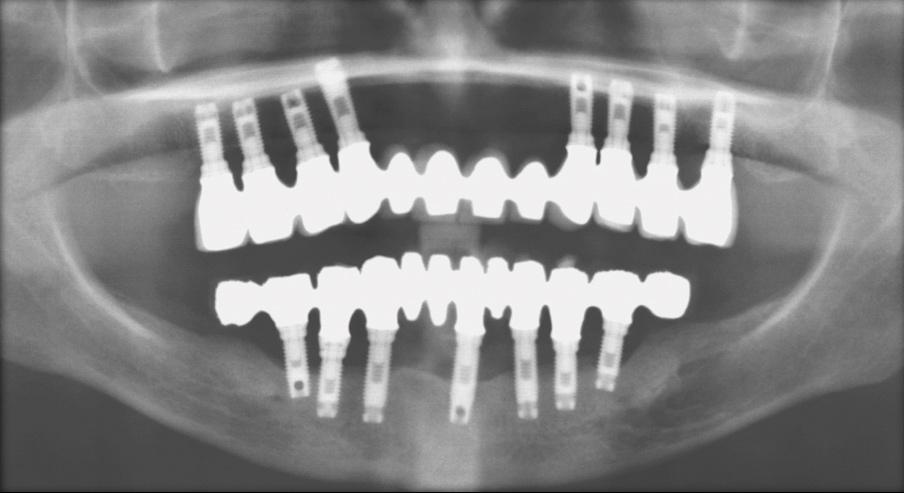
Фото 14. Вид после удаления протеза.
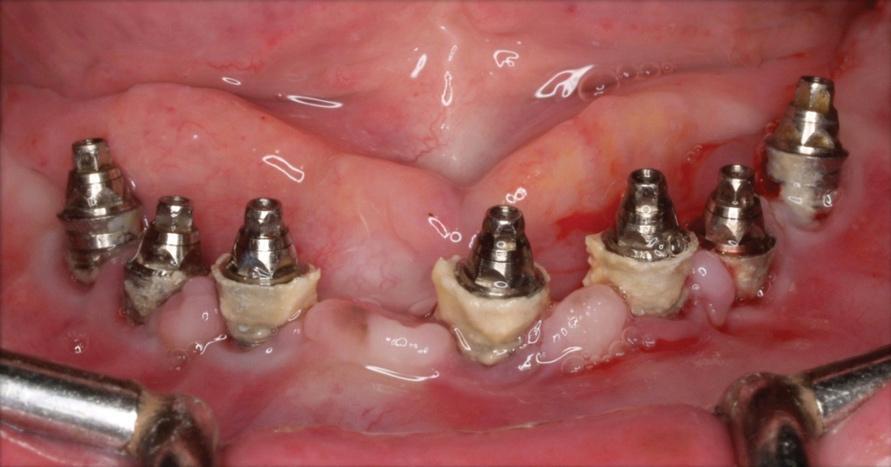
Фото 15. Сепарация лоскута для очистки области поражения.
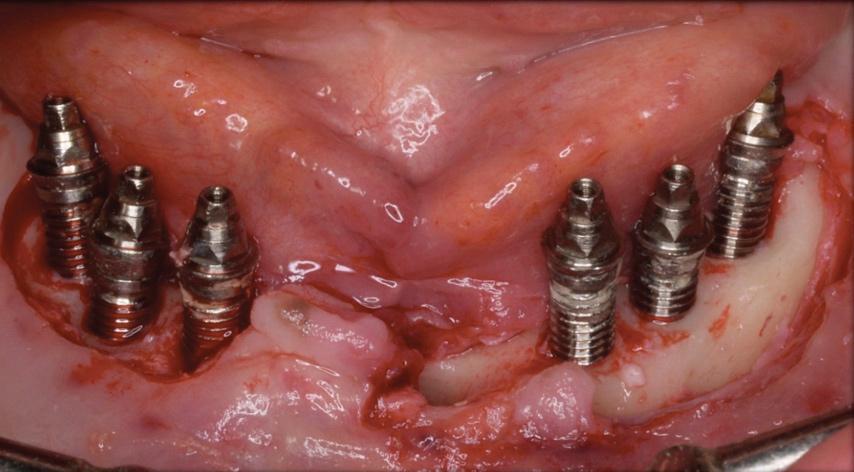
В общем, использование различных протоколов, сочетающих методы, направленные на обеззараживание поверхности имплантата (например, механические или посредством лазеров) и контроль инфекционного процесса заражения (например, посредством антисептиков и антибиотиков), демонстрируют достаточно успешные клинические результаты (среднее снижение глубины зондирования до 1,2 мм и среднее уменьшение кровотечения при зондировании около 50%), хоть и не обеспечивают полного разрешения заболевания. В настоящее время не существует конкретного нехирургического протокола лечения, который бы обеспечивал достаточную эффективность лечения периимплантита, а те клинические улучшения, которые все же наблюдались, не являлись достаточными для полного разрешения патологии. Таким образом, стандартом в ходе терапии периимплантитных осложнений является хирургическое вмешательство. С другой стороны, имеются лишь ограниченные данные о долгосрочной эффективности хирургического лечения периимплантита. Такая дилемма связана с тем, что любой хирургический подход и его имплементация, в первую очередь, зависит от цели лечения. Когда цель терапии состоит в обеспечении доступа к области поражения и устранении воспалительного компонента, то в таких случаях оперативный метод с сепарацией лоскута является методом выбора. Анализ серии клинических случаев с обеспечением мониторинга результатов на протяжении 5 лет и использованием вышеупомянутого принципа хирургического вмешательства определил, что такой подход обеспечивает поддержку адекватного состояния периимплантатных тканей у 79% пациентов через год после операции (отсутствие кармана ≥ 5 мм и признаков кровотечения при зондировании) и у 63% через 5 лет. Данные результаты также подчеркивают значимость поддержки адекватной гигиены полости рта после операции, и необходимость обеспечения надлежащего длительного мониторинга за пациентом для профилактики вторичной периимплантитной инфекции. Использование системных антибиотиков в качестве адъювантной терапии продемонстрировало значительные улучшения в ходе проведения рандомизированных клинических испытаний. Ключевыми критериями, которые обеспечивают стабильность периимплантатных тканей после лечения периимплантита, является поддержка адекватного уровня гигиены, периодическое выполнения профессиональной гигиенической чистки, наличие «очищаемых» конструкций с опорой на имплантаты, и наличие мелких периимплантатных карманов с отсутствием кровотечения при зондировании. Положительные результаты лечения были продемонстрированы в ходе 5-летнего мониторинга пациентов, терапия которых проводилась посредством подхода с апикальным смещением лоскута. Дальнейшее прогрессирование заболевания было диагностировано только у 13% очищенных имплантатов у четырех пациентов (15%). Наличие карманов по всей окружности интраоссальных конструкций, очевидно, квалифицировалось как достаточно влиятельный фактор, определяющий возможности для дальнейшего прогрессирования болезни. Аналогичные результаты были получены и в другом исследовании с участием 74 пациентов и анализом 187 имплантатов, пораженных периимплантатной патологией. Для оценки влияния различных потенциально прогностических показателей на первичный результат (неудача лечения периимплантита через 12 месяцев) были выполнены многоуровневые одновариантные и множественные логистические регрессионные анализы. Курение, показатели средний потери костной ткани на исходном периоде наблюдения и наличие бактериального налета оказались наиболее влиятельными в патогенезе периимплантита, и прогнозе эффективности его лечения.
Коррекция всех вышеперечисленных факторов имеет первостепенное значение для достижения необходимых клинических результатов. Спорным вопросом в имплантологии до сих пор остается связь между параметром шероховатости поверхности имплантата и прогрессированием периимплантита, а также эффективностью его лечения. Как было доказано ранее, более шероховатые поверхности способствуют большему накоплению налета, нежели гладкие. Учитывая данный факт, некоторые авторы предложили проводить сглаживание и полировку открытой поверхности имплантата при хирургическом лечении периимплантита (так именуемую имплантопластику) – таким образом, удается не только удалить контаминированную поверхность, но и уменьшить риск дальнейшей колонизации имплантата разными видами бактерий (фото 16 - 19).
Фото 16. Деконтаминация поверхности имплантатов.
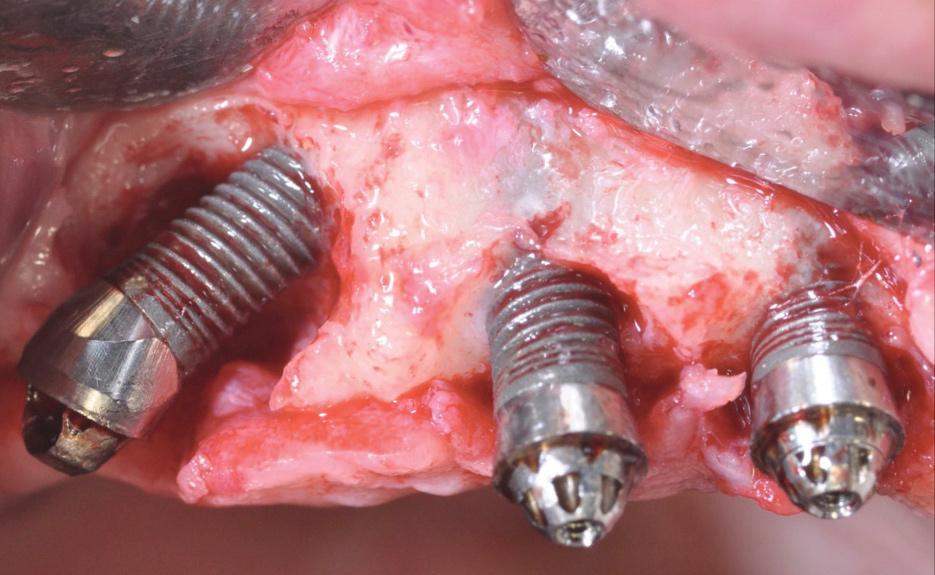
Фото 17. Имплантопластика.
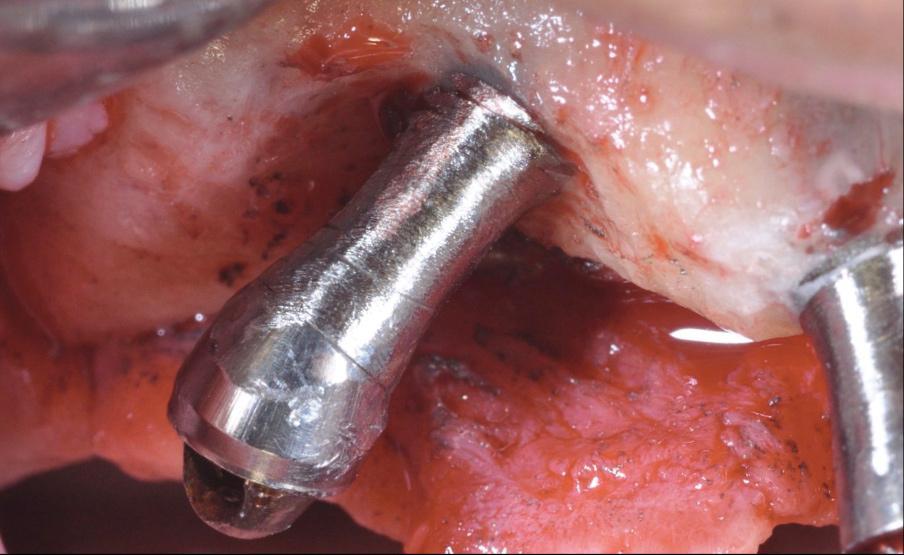
Фото 18. Вид через 1 год.
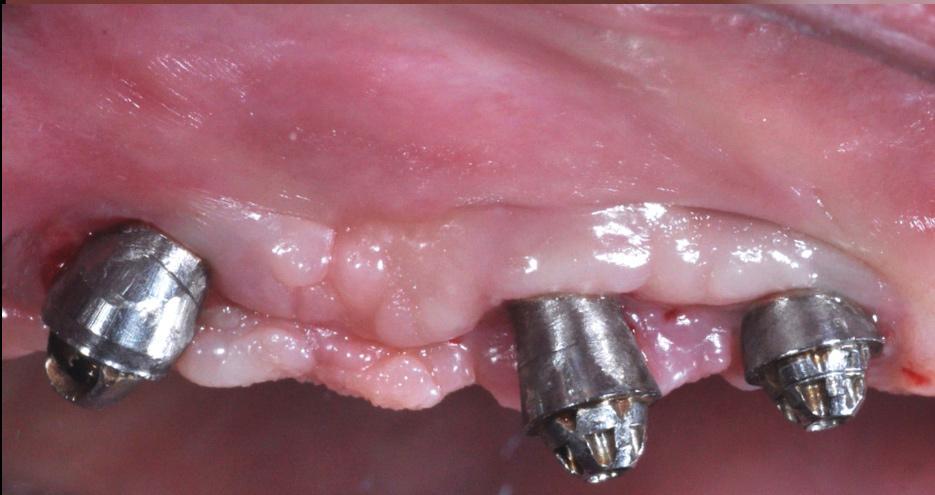
Фото 19. Вид через 3 года.

Клиническое исследование, сравнивающее эффективность имплантопластики со стандартными хирургическими подходами лечения, продемонстрировало значительное улучшенные параметров разрешения патологии и ретенции соответствующего уровня костной ткани в течение 3 лет после лечения. Однако, с другой стороны, устранение поверхности имплантата вызывает его структурное повреждение и ятрогенную контаминацию окружающих тканей. Недавние исследования in vitro подтвердили, что имплантопластика, хоть и является технически сложной и трудоёмкой манипуляцией, но, очевидно, никак не влияет на параметры резистентности имплантологической конструкции, что было доказано результатами анализа имплантата стандартного диаметра с внешним соединением. И хотя цель лечения периимплантита должна сводится на самом деле к обеспечению регенерации и реконструкции потери костной ткани в ходе патологии (фото 20 - 25), но подобного результата можно добиться лишь при комбинированном использовании замещающих костных трансплантатов и барьерных мембран, и то – конкретно по показаниям с учётом специфики анатомической конфигурации дефектов.
Фото 20. Визуализация трехстеночного дефекта после очистки имплантатов.

Фото 21. Визуализация трехстеночного дефекта после очистки имплантатов.
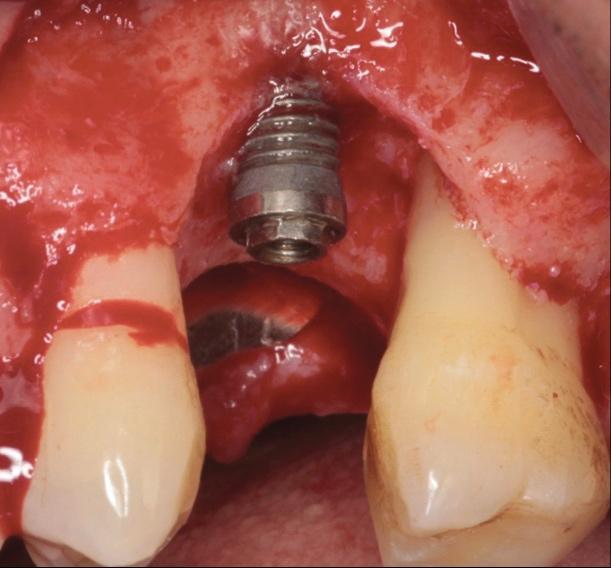
Фото 22. Аугментация области дефекта.
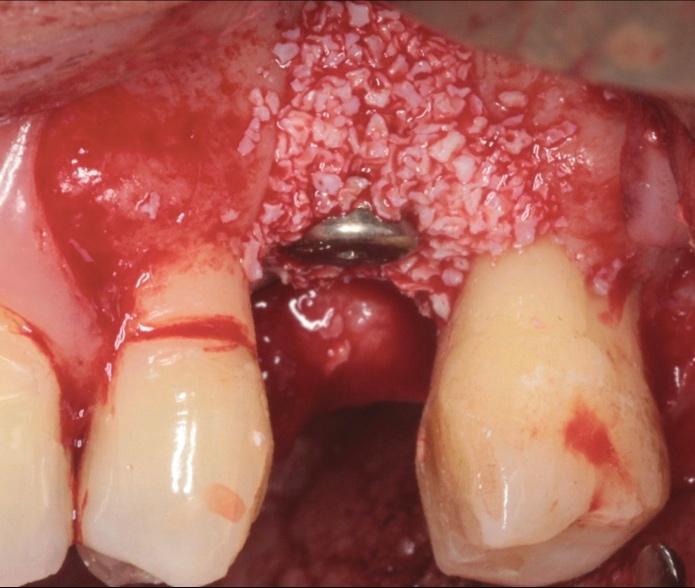
Фото 23. Ушивание области дефекта после покрытия мембраной.

Фото 24. Вид дефекта до лечения.
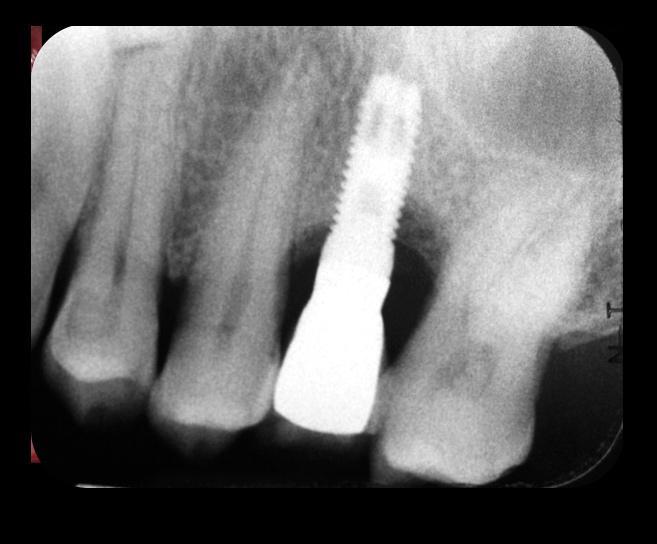
Фото 25. Вид дефекта после лечения.
Выводы
Ключевые подходы к профилактике развития периимплантита состоят из комбинации определенных субъективных и локально-значимых аспектов: информирования и обучения пациентов, обеспечения доступа для адекватной очистки супра- и инфраконструкции, поддержки адекватного уровня гигиены. Диагностика патологии базируется на регистрации определенных параметров глубины зондирования, рентген-контроля и определения уровня кровотечения при зондировании. Пациенты должны быть проинформированы о потребности периодического контроля и проведения профессиональных гигиенических мероприятий. При диагностике периимплантатного мукозита следует обеспечить его лечение с применением механических и химических методов удаления зубного налета. Хорошо известно, что перимукозит является предшественником периимплантита; следовательно, соответствующее лечение мукозита представляет собой первичную профилактику периимплантита. В случаях диагностики периимплантита необходимо как можно скорее обеспечить его эффективную терапию, обеспечивая тщательную деконтаминацию поверхности имплантата и реализацию строгого протокола контроля накопления бактериальной пленки, а также регулярную очистку титанового интерфейса.
Авторы:
Mariano Sanz, MD, DDS, DrMed, DrHC
Myroslav Solonko, DDS
Fernando Luengo, DDS
С момента внедрения биологического принципа остеоинтеграции и начала широкого использования современных имплантатов, было представлено уже множество фактов, которые свидетельствуют о высоких показателях выживания имплантатов в долгосрочной перспективе (от 82% до 99%). Хотя показатели успешности имплантатов также являются достаточно высокими, но важно понимать, что даже удачно интегрированный имплантат все же поддается риску влияния факторов, которые могут спровоцировать его потерю.

Учитывая изменение взглядов на диагностику периимплантита, сложно было определить объективный уровень его распространения, который варьировал от 28 до 56% при учете патологии у пациентов, и в диапазоне 12-40% при регистрации патологии вокруг имплантатов. В недавнем систематическом обзоре сообщалось, что средняя распространенность периимплантита составляет 22%, что положительно коррелирует с временем функционирования внутрикостной опоры и отрицательно взаимосвязано с прогрессией редукции периимплантатной костной ткани. Следовательно, в зависимости от показателей данных двух критериев будут меняться и показатели распространенности патологии. Однако установлено, что примерно четверть пациентов и, вероятно, одна пятая часть установленных имплантатов подвергаются действию периимплантитной патологии через 5-10 лет после установки интраоссальных титановых конструкций, что подчеркивает важность разработки направления профилактики потенциальных осложнений, связанных с неуспешностью имплантатов.
Эффективные профилактические меры должны быть направлены на причину заболевания и контроль установленных факторов риска. В случае периимплантита основным этиологическим фактором является влияние бактериальной биопленки, которая прикрепляется к поверхности имплантата и провоцирует развитие воспалительной реакции. Фактически присутствие налета является основным показателем риска развития пери-мукозита. Аналогичным образом, наличие зубного налета с сопутствующим кровотечением на зондирование в более чем 30% участков было ассоциировано с увеличением риска развития истинного периимплантита. Плохая гигиена полости рта, курение и наличие пародонтита в анамнезе в настоящее время рассматриваются как основные факторы риска, связанные с периимплантитом; следовательно, именно на них должно быть нацелено действие различных профилактических мероприятий. Другие возможные факторы включают параметры шероховатости поверхности, количество кератинизированной ткани и наличие остаточного цемента, которые также положительно коррелировали с развитием пери-имплантата, хотя данные относительно их влияния ограничены только кросс-секционными исследованиями.
Первым шагом в профилактической стратегии периимплантита является его адекватная диагностика и объективная оценка состояния окружающих твердых и мягких тканей. Для этой цели используют методы пародонтального зондирования и рентгенологического исследования. Данный подход к диагностике после фиксации супраконструкция является базовым, и полученные в ходе его реализации показатели составляют отправную точку для оценки дальнейших изменений в периимпланттаной области (фото 1 - 2). Хотя зондирование периимплантатной области является менее диагностически значимым, чем пародонтальное зондирование, но наличие кровотечения при таковом напрямую свидетельствует о наличие воспаления окружающих тканей. Значительное углубление кармана во время зондирования является непрямым доказательством редукции костной ткани и аргументирует потребность проведения дополнительной рентгенографической диагностики (фото 3 - 5).
Фото 1. Измерение глубины карманов.

Фото 2. Перипакальные рентгенограммы.

Фото 3. Перимукозит.

Фото 4. Кровотечение при зондировании.

Фото 5. Потеря костной ткани на рентгенограмме.

Современное понимание процессов перехода мукозита в периимплантит до сих пор остаётся недостаточно изученным, поскольку аспекты иммунологической деструкции костной ткани и нарушения остеоинтеграции сами по себе не в полной мере понятны. В проспективном 5-летнем исследовании с участием 80 пациентов, у которых отмечался перимукозит на начальной стадии диагностики, и которые не принимали участие ни в каких профилактических программах, было доказано, что при подобных условиях риск развития периимплантита увеличивается в 20 раз по сравнению с теми больными, которым проводилась систематическая гигиеническая очистка. Таким образом, лечение перимукозита следует рассматривать как первичный этап профилактики периимплантита, и основную превентивную стратегию снижения риска развития периимплантационных осложнений.
Профилактика перимукозита
Профилактические мероприятия должны назначаться пациенту сразу же после установки окончательных супраконструкций, а основная цель таковых должна быть направлена на контроль формирования зубного налета как в домашних, так и в клинических условиях с учетом профиля риска каждого отдельного пациента. Эффективность гигиенических мероприятий в основном зависит от фактора обеспечения простоты доступа ершиков и щеточек в необходимую область вмешательства. Данный фактор в основном определяется спецификой конструкции самого протеза (фото 6 - 8). Поэтому супраконструкция должна обеспечивать не только надлежащую функциональную реабилитацию, но и соответствующие условия для поддержания определённого уровня гигиены. Недавний систематический обзор эффективности проведения самостоятельной гигиенической очистки периимплантатной области непосредственно пациентами подтвердил несколько высшие показатели при использовании электрических зубных щеток по сравнению с ручными.
Фото 6. Выполнение гигиенических манипуляций.

Фото 7. Выполнение гигиенических манипуляций.

Фото 8. Выполнение гигиенических манипуляций.

Лечение перимукозита
Для достижения эффективных результатов лечения перимукозита, в первую, очередь нужно добиться ограничения воспаления слизистой оболочки, которое клинически будет проявляться отсутствием кровотечения при зондировании. В свою очередь, для разрешения самого воспаления нужно устранить действие основного этиологического фактора – аккумуляции биопленки на поверхности имплантата.
В недавних систематических обзорах проводилась оценка эффективности профессиональных подходов к удалению бактериального налета посредством одной или нескольких процедур. На основе семи исследований, соответствующих критериям включения, авторы сравнивали эффективность механического удаления биопленки с использованием ультразвуковых и ручных инструментов изолированно или в сочетании с одним из трех дополнительных методов: 1) воздухо-абразивной обработкой; 2) применением антисептического средства (геля фосфорной кислоты, хлоргексидина диглюконат, озона или перекиси водорода) и 3) адъювантной антибиотикотерапии (локальное применение тетрациклина хлоргексидина или системный прием азитромицина).
Несмотря на первоначальные результаты, которые указывали на несколько большую эффективность применения дополнительных средств обработки поверхности имплантата, в конце концов, окончательные результаты оказались не столь контрастирующими между собой. Без надлежащей поддержки определенного уровня гигиены самим пациентом, использованием различных механических методов очистки поверхности имплантата с или без применения дополнительных средств, не обеспечивается долгосрочной гарантии относительно разрешения периимплантитной патологии. Кроме того, проводилась систематическая оценка эффективности контроля уровня гигиены самим пациентом с использованием различных механических или химических методов. Наилучшие результаты были определены при механическом удалении зубного налета посредством щетки в сочетании с дополнительным использованием принципов механической дезинфекции, которые включают ополаскивание/орошение полости рта антисептическими растворами (хлоргексидин) или же применение геля хлоргексидина. Наиболее эффективным оказались протоколы с применением электрических/ультразвуковых зубных щеток, паст с доказанным антибактериальным действием, и растворов хлоргексидина или эссенциальных эфирных масел. Однако единственного протокола для выполнения пациентом соответствующих манипуляций пока что не разработано, а назначения тех или иных алгоритмов должно рассматриваться с точки зрения возможной их адаптации для пациента с учетом специфики дизайна имеющейся супраконструкции. Значительное внимание врач должен уделить именно обучению пациентов определенным методам поддержки гигиены полости рта, и их дальнейшей мотивации. Кроме того, необходимо обеспечить доступность конкретных руководств для самих врачей-стоматологов относительно специфики диагностики поражения тканей в периимплантатной области, которые бы включали описание определенных техник регистрации и удаления зубного налета с поверхностей имплантата, абатмента и протезных конструкций. Вполне логично, что чистота самой реставрации с опорой на имплантате напрямую влияет на уровень риска развития периимплантита. Когортное исследование с участием 23 пациентов показало, что в случае 74% имплантатов они характеризовались недостаточным доступом для проведения определенных гигиенических мероприятий, а в 48% имплантатов с уже присутствующим периимплантитом таковые вообще никогда очищались. Неадекватно сформированные конструкции протезов, или же таковые с нависающим краем следует рассматривать как ятрогенные факторы риска развития периимплантита. Аналогично на развитие данной патологии могут влиять неадекватно спозиционированные имплантаты, наличие излишков оттискного материала или фиксирующего цемента, которые способствуют накоплению бактериального налета на поверхности имплантата. Коррекция или устранение этих факторов (например, замена или модификация дизайна протеза) является важной составляющей комплексного лечения периимплантатного мукозита (фото 9 – 11).
Фото 9. Аккумуляция зубного налета и воспаление слизистой оболочки.

Фото 10. Травматическое поражение тканей.

Фото 11. Модификация дизайна протеза для обеспечения надлежащих условий для проведения гигиенических манипуляций.

Лечение периимплантита
Лечение периимпланита должно проходить по принципам, аналогичным лечению пародонтита – посредством удаления биопленки на поверхности имплантата или абатмента с использованием различных механических, физических и химических механизмов (фото 12 - 15).
Фото 12. Аккумуляция зубного налета и воспаление слизистой оболочки.

Фото 13. Потеря костной ткани в области имплантатов, установленных на нижней челюсти.

Фото 14. Вид после удаления протеза.

Фото 15. Сепарация лоскута для очистки области поражения.

В общем, использование различных протоколов, сочетающих методы, направленные на обеззараживание поверхности имплантата (например, механические или посредством лазеров) и контроль инфекционного процесса заражения (например, посредством антисептиков и антибиотиков), демонстрируют достаточно успешные клинические результаты (среднее снижение глубины зондирования до 1,2 мм и среднее уменьшение кровотечения при зондировании около 50%), хоть и не обеспечивают полного разрешения заболевания. В настоящее время не существует конкретного нехирургического протокола лечения, который бы обеспечивал достаточную эффективность лечения периимплантита, а те клинические улучшения, которые все же наблюдались, не являлись достаточными для полного разрешения патологии. Таким образом, стандартом в ходе терапии периимплантитных осложнений является хирургическое вмешательство. С другой стороны, имеются лишь ограниченные данные о долгосрочной эффективности хирургического лечения периимплантита. Такая дилемма связана с тем, что любой хирургический подход и его имплементация, в первую очередь, зависит от цели лечения. Когда цель терапии состоит в обеспечении доступа к области поражения и устранении воспалительного компонента, то в таких случаях оперативный метод с сепарацией лоскута является методом выбора. Анализ серии клинических случаев с обеспечением мониторинга результатов на протяжении 5 лет и использованием вышеупомянутого принципа хирургического вмешательства определил, что такой подход обеспечивает поддержку адекватного состояния периимплантатных тканей у 79% пациентов через год после операции (отсутствие кармана ≥ 5 мм и признаков кровотечения при зондировании) и у 63% через 5 лет. Данные результаты также подчеркивают значимость поддержки адекватной гигиены полости рта после операции, и необходимость обеспечения надлежащего длительного мониторинга за пациентом для профилактики вторичной периимплантитной инфекции. Использование системных антибиотиков в качестве адъювантной терапии продемонстрировало значительные улучшения в ходе проведения рандомизированных клинических испытаний. Ключевыми критериями, которые обеспечивают стабильность периимплантатных тканей после лечения периимплантита, является поддержка адекватного уровня гигиены, периодическое выполнения профессиональной гигиенической чистки, наличие «очищаемых» конструкций с опорой на имплантаты, и наличие мелких периимплантатных карманов с отсутствием кровотечения при зондировании. Положительные результаты лечения были продемонстрированы в ходе 5-летнего мониторинга пациентов, терапия которых проводилась посредством подхода с апикальным смещением лоскута. Дальнейшее прогрессирование заболевания было диагностировано только у 13% очищенных имплантатов у четырех пациентов (15%). Наличие карманов по всей окружности интраоссальных конструкций, очевидно, квалифицировалось как достаточно влиятельный фактор, определяющий возможности для дальнейшего прогрессирования болезни. Аналогичные результаты были получены и в другом исследовании с участием 74 пациентов и анализом 187 имплантатов, пораженных периимплантатной патологией. Для оценки влияния различных потенциально прогностических показателей на первичный результат (неудача лечения периимплантита через 12 месяцев) были выполнены многоуровневые одновариантные и множественные логистические регрессионные анализы. Курение, показатели средний потери костной ткани на исходном периоде наблюдения и наличие бактериального налета оказались наиболее влиятельными в патогенезе периимплантита, и прогнозе эффективности его лечения.
Коррекция всех вышеперечисленных факторов имеет первостепенное значение для достижения необходимых клинических результатов. Спорным вопросом в имплантологии до сих пор остается связь между параметром шероховатости поверхности имплантата и прогрессированием периимплантита, а также эффективностью его лечения. Как было доказано ранее, более шероховатые поверхности способствуют большему накоплению налета, нежели гладкие. Учитывая данный факт, некоторые авторы предложили проводить сглаживание и полировку открытой поверхности имплантата при хирургическом лечении периимплантита (так именуемую имплантопластику) – таким образом, удается не только удалить контаминированную поверхность, но и уменьшить риск дальнейшей колонизации имплантата разными видами бактерий (фото 16 - 19).
Фото 16. Деконтаминация поверхности имплантатов.

Фото 17. Имплантопластика.

Фото 18. Вид через 1 год.

Фото 19. Вид через 3 года.

Клиническое исследование, сравнивающее эффективность имплантопластики со стандартными хирургическими подходами лечения, продемонстрировало значительное улучшенные параметров разрешения патологии и ретенции соответствующего уровня костной ткани в течение 3 лет после лечения. Однако, с другой стороны, устранение поверхности имплантата вызывает его структурное повреждение и ятрогенную контаминацию окружающих тканей. Недавние исследования in vitro подтвердили, что имплантопластика, хоть и является технически сложной и трудоёмкой манипуляцией, но, очевидно, никак не влияет на параметры резистентности имплантологической конструкции, что было доказано результатами анализа имплантата стандартного диаметра с внешним соединением. И хотя цель лечения периимплантита должна сводится на самом деле к обеспечению регенерации и реконструкции потери костной ткани в ходе патологии (фото 20 - 25), но подобного результата можно добиться лишь при комбинированном использовании замещающих костных трансплантатов и барьерных мембран, и то – конкретно по показаниям с учётом специфики анатомической конфигурации дефектов.
Фото 20. Визуализация трехстеночного дефекта после очистки имплантатов.

Фото 21. Визуализация трехстеночного дефекта после очистки имплантатов.

Фото 22. Аугментация области дефекта.

Фото 23. Ушивание области дефекта после покрытия мембраной.

Фото 24. Вид дефекта до лечения.

Фото 25. Вид дефекта после лечения.

Выводы
Ключевые подходы к профилактике развития периимплантита состоят из комбинации определенных субъективных и локально-значимых аспектов: информирования и обучения пациентов, обеспечения доступа для адекватной очистки супра- и инфраконструкции, поддержки адекватного уровня гигиены. Диагностика патологии базируется на регистрации определенных параметров глубины зондирования, рентген-контроля и определения уровня кровотечения при зондировании. Пациенты должны быть проинформированы о потребности периодического контроля и проведения профессиональных гигиенических мероприятий. При диагностике периимплантатного мукозита следует обеспечить его лечение с применением механических и химических методов удаления зубного налета. Хорошо известно, что перимукозит является предшественником периимплантита; следовательно, соответствующее лечение мукозита представляет собой первичную профилактику периимплантита. В случаях диагностики периимплантита необходимо как можно скорее обеспечить его эффективную терапию, обеспечивая тщательную деконтаминацию поверхности имплантата и реализацию строгого протокола контроля накопления бактериальной пленки, а также регулярную очистку титанового интерфейса.
Авторы:
Mariano Sanz, MD, DDS, DrMed, DrHC
Myroslav Solonko, DDS
Fernando Luengo, DDS






























































































































































0 комментариев