Остеоциты и мезенхимальные клетки кости (МКК) играют ключевую роль в процессе костного ремоделирования. По своей функции остеоциты являются клетками, которые являются чувствительными к механическим стимулам, и которые принимают участие в формировании костной ткани наряду с остеобластами и остеокластами. При этом остеобласты развиваются из мезенхимальных клеток и отвечают за синтез костного матрикса, а остеокласты дифференцируют из многоядерных клеток моноцитарно-макрофагальной линии. Мезенхимальные, или как еще их называют выстилающие клетки костной ткани отвечают за формирование костной ткани на новых костных поверхностях, и характеризуются плоскостной внешней архитектурой.

Нагрузка и резорбция костной ткани
Остеоциты и МКК вместе формируют рабочую коммуникационную систему, которая принимает участие в регулировании механорецептивной функции. Остеоциты, «чувствуя» небольшое увеличение со стороны поступающих механически индуцированных сигналов (которые формируются при нагрузке на участок костной ткани), сигнализируют МКК о необходимости увеличения образования кости и ингибирования процесса ее резорбции. И наоборот, при дефиците необходимой механической нагрузки, в кости наблюдается феномен отсутствия необходимого функционального напряжения, что, в свою очередь, провоцирует потерю костной ткани. В случаях чрезмерного уровня приложенной нагрузки или при микроразрушениях структуры кости отмечается более выраженный апоптоз остеоцитов. Как правило, данный феномен наблюдается вблизи поверхности кортикального слоя, на который действует высокое механическое напряжение, поскольку именно данная часть кости является более чувствительной к механическим перенагрузкам по сравнению с трабекулярной составляющей. Понимание данной теории является крайне важным для клинической практики, учитывая, что процесс остеоконденсанции (остеоденсификация, уплотнения костной ткани) предусматривает развитие крайне высоких напряжений именно в кортикальном слое, что, в свою очередь, может спровоцировать апоптоз остеоцитов и последующую потерю костной ткани.
Ремоделирование кости вокруг дентальных имплантатов
После установки дентальных имплантатов вскоре вокруг них начинает развиваться имунно-воспалительная реакция, предусматривающая реализацию ангиогенных и остеогенных процессов. Элементы данной реакции зависят от характеристик поверхности самого имплантатов (топографии, химической составляющей и структуры материала), которые могут способствовать или же ингибировать адсорбцию соответствующих белков. Тромбин и фибриноген, адсорбируясь на поверхности внутрикостной опоры, играют ключевую роль в достижении гомеостаза периимплантатной области, после чего выделение соответствующих цитокинов и факторов роста стимулирует депозицию коллагенового матрикса вокруг слоя титана оксида, находящегося на поверхности винта. Все это в конце концов приводит к формированию новой костной ткани (обычно происходит на протяжении 5 дней). В течение 8-12 недель пластинчатая кость инициирует развитие такого феномена как биологическая стабильность, что также именуется остеоинтеграцией.
Впоследствии, как и в случае естественного зубного ряда, имплантаты подвергаются ремоделированию мягких и твердых тканей с формированием параметра биологической ширины на уровне 3,5 мм. Многие исследования при этом указывают на то, что наличие микрозазора между двумя компонентами имплантологической системы провоцирует более выраженную потерю костной ткани. Интерфейс соединения между абатментом и имплантатом характеризуется наличием микропространства в диапазоне от 10 до 50 микрон, что приводит к развитию эффекта помпы. Под действием последнего интерфейс соединения контаминируется жидкостью полости рта, содержащей как грамположительные, так и грамотрицательные бактерии. Именно из-за этого внутреннее соединение в структуре имплантологической системы является более предпочтительным, чем внешнее. Кроме того, особый интерес представляет собой принцип переключения платформ, который позволяет корригировать параметры биологической ширины.
Значительное количество исследований было посвящено аспектам оптимизации дизайна имплантата для улучшения его стабильности и/или качества остеоинтеграции, а также для минимизации уровня потери маргинальной костной ткани. Однако при этом совсем мало внимания уделялось возможностям оптимизации самой области имплантации в процессе выполнения остеотомии. В данной статье мы рассмотрим аспекты влияния исходной плотности костной ткани на первичную стабильность имплантата, а также хирургические концепции приема остеоконденсации как метода, позволяющего улучшить первичную стабильность имплантата путем уплотнения доступной аутогенной костной ткани.
Влияние исходного качества кости на параметры остеоинтеграции и торка имплантата
Торк имплантата (ТИ) в диапазоне от 25 Нсм до 45 Нсм рассматривается как идеальное значение в ходе его установки для профилактики развития микродвижений внутрикостной конструкции, которые могут привести к формированию фиброзной капсулы вокруг опоры. При этом, однако, слишком высокие показатели ТИ были ассоциированы с критическим давлением на костную ткань, что может привести к развитию микропереломов и некрозу костной ткани. На изучаемых животных моделях уже неоднократно было доказано, что высокие показатели ТИ провоцируют комплексное микроразрушение кости и запускают процесс комплексного ремоделирования. Следует заметить, что резорбция кортикальной костной ткани развивается более часто, чем трабекулярной, что может быть связано с ее низкой васкуляризацией. Данные результаты исследования полностью коррелируют с теми, что были получены в ходе изучения влияния показателей торка больше 50 Н*см на костную ткань челюстей у человека: в таких условиях отмечается более выраженная потеря периимплантатной костной ткани еще на ранних стадиях ее заживления. Недавно проведенный комплексный анализ также позволил обнаружить, что «недопрепарирование» участка остеотомии для достижения более высоких показателей исходного торка провоцирует апоптоз двойного слоя остеоцитов по сравнению с ситуациями, в которых исходный ТИ был значительно ниже.
Таким образом, можно резюмировать, что дефицит первичной стабильности имплантата в целом может компрометировать процесс остеоинтеграции, однако слишком высокие показатели ТИ негативно влияют на поддержку необходимого уровня периимплантатной костной ткани. Не менее важным фактором, который влияет на исход установки имплантата, является исходная плотность альвеолярной кости и ее связь с показателями первичной стабильности. В своих ранних работах Misch классифицировал все возможные варианты альвеолярного костного гребня на 4 типа. Согласно этой классификации, более плотная костная ткань локализируется в переднем участке нижней челюсти, в то время как наиболее пористая – в дистальных участках верхней челюсти. Логично, что чем больший слой кортикальной кости, тем более сильную поддержку имплантата она обеспечивает, что, в свою очередь, позволяет достичь более высоких показателей первичной стабильности. Однако, кортикальная составляющая кости также характеризуется и меньшим уровнем васкуляризации, что, в свою очередь, снижает ее ангиогенный потенциал и снижает возможности для миграции остеогенных клеток в область имплантации. В конечном счете, все это может привести к более выраженной потере уровня костной ткани в периимплантатной области.
Simons и соавторы провели исследование, в котором изучили влияние исходного соотношения кортикальной и губчатой костной ткани на характер потери кости в периимплантатной области. Они обнаружили, что при наличии 50-60% губчатой кости удаётся минимизировать раннюю редукцию уровня периимплантатного костного гребня до 0,6-0,7 мм, в то же время превалирование кортикальной кости в области имплантации провоцирует убыль уровня окружающего костного гребня до 1,5 мм. По этой причине при выраженно толстом слое кортикальной кости исходные параметры ТИ все же лучше минимизировать. Также для того, чтобы свести показатели редукции костного гребня к минимальным, авторы рекомендуют проводить конденсацию участка остеотомии при наличии толстой кортикальной пластинки, таким образом, обеспечивая редукцию исходных параметров торка.
Таким образом, можно резюмировать, что кортикальная кость характеризуется наличием определенных недостатков по сравнению с трабекулярной, что выражается в ограниченном кровоснабжении и сниженном количестве присутствующих остеопрогениторных клеток. Кроме того, кортикальная кость также характеризуется повышенной чувствительностью к высоким напряжениям, иными словами – она является более механически чувствительной. Исходя из этого, становиться понятным почему апоптоз остеоцитов более часто регистрируется именно в области кортикального слоя в случаях микроразрушений кости и действия на нее высоких функциональных напряжений. Понимая влияние данных факторов, врач должен учитывать исходное состояние качества костной ткани в области остеотомии, для того чтобы обеспечить профилактику потенциально возможных имплантат-ассоциированных осложнений.
Немедленная имплантация с достижением высоких и низких показателей торка
Ряд клинических исследований долгое время изучали гипотезу о том, что более высокие показатели первичной стабильности ассоциированы с лучшими параметрами остеоинтеграции. В случаях немедленной имплантации достижение высоких параметров торка, превышающих 32 Нсм, является обязательным. При этом показатели торка, превышающие 50 Нсм при немедленной установке имплантатов, провоцировали более выраженную потерю костного гребня, особенно с вестибулярной стороны, а также развитие рецессий в области имплантации. При экстремально высоком торке (более 70 Нсм) потеря окружающей костной ткани была клинически выраженной и часто негативно влияла на конечный исход реабилитации. С другой стороны, слишком низкие показатели торка также были связаны с повышением частоты неудач после установки внутрикостных титановых опор. Таким образом, полученные результаты указывают на наличие прямой связи между исходными показателями торка и уровнем потери периимплантатной костной ткани.
Процедура конденсации костной ткани с помощью остеотомической техники, позволяющая улучшить первичную стабильность имплантатов и костное заживление в области вмешательства, была впервые описана Summers уже около 20 лет назад. Büchter и Stavropoulos, однако, отметили, что к данной технике следует относится с огромной осторожностью, поскольку данный подход при неадекватном использовании может привести к развитию микропереломов в структуре костной ткани, окружающей имплантат. На протяжении многих лет исследователи старались сгруппировать все возможные варианты реализации техники остеоконденсации в определенные практические рекомендации. Так, например, появилась концепция установки имплантата более широкого диаметра, чем последнее используемое остеотомическое сверло, что позволяет повысить исходные показатели торка. В подобных случаях врачам удаётся добиться адекватной вторичной стабильности и плотного контакта имплантата с окружающей костью, хотя сам процесс заживления кости происходил более медленно, учитывая развитие очагов микронекроза. Другие исследователи показали, что установка имплантатов с торком равным 0, позволяет добиться таких же успешных отдаленных результатов через 4 месяца, как и при установке имплантатов с торком в 30 Нсм или 70 Нсм. Учитывая разнообразность, полученных в ходе разных исследований данных, можно только резюмировать, что роль высоких показателей ТИ на уровень резорбции костной ткани в периимплантатной области остается не до конца изученной.
Остеоконденсация
Биомеханическая стабильность имплантатов обычно зависит от нескольких факторов. Во-первых, от макро- и микродизайна самих интраоссальных конструкций, а также от качества и количества костной ткани в области вмешательства – все эти факторы непосредственно влияют на первичную стабильность имплантатов (фото 1).
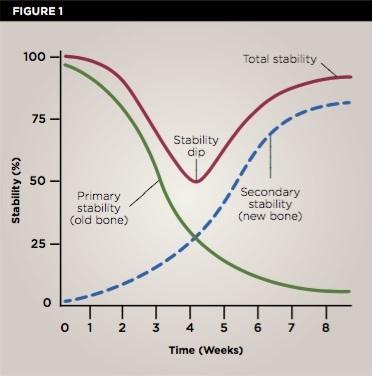
Фото 1. Классическая диаграмма графиков стабильности имплантатов. Самые высокие показатели первичной стабильности регистрируются на первой неделе после установки имплантатов, далее на 4 неделе отмечается снижение стабильности, после чего начинает развиваться механизм вторичной стабильности. Многие клиницисты стараются оптимизировать показатели стабильности в особенно критический период 4 недель за счет модификации протоколов установки имплантатов, их поверхностей, изменения макро- и микродизайна.
Протоколы, направленные на повышение параметров первичной стабильности имплантатов, предусматривают возможную реализацию следующих принципов:
- Контроль «недопрепарирования» участка остеотомии;
- Выбор необходимого типа имплантата с учетом его микро- и макротекстуры;
- Использование более длинных имплантатов, которые обеспечивают повышение показателей их контакта с костной тканью;
- Остеоконденсация имплантологического ложа.
Костная ткань человека характеризуется способностью поглощать энергию, то есть она является гибкой, но при этом она также может изменять свою форму в процессе деформации без сколов или переломов. Также кость может противостоять компрессии, несколько расширяясь под ее действием и удлиняясь во время напряжения.
Традиционно перед установкой имплантатов проводиться препарирование костной ткани. В ходе вращения сверла вектор сопротивления «нарезки» постоянно меняется, что приводит к тому, что направление сверла может несколько изменяется от предварительно запланированной позиции (фото 2-4).
Фото 2. В определенных случаях процедура классической остеотомии может привести к потере костной ткани в периимплантатной области, что чревато дальнейшим обнажением витков интраоссальной опоры.
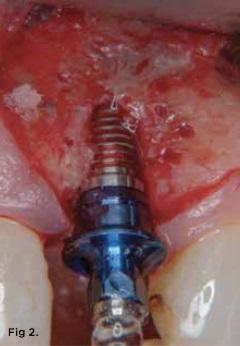
Фото 3. В определенных случаях процедура классической остеотомии может привести к потере костной ткани в периимплантатной области, что чревато дальнейшим обнажением витков интраоссальной опоры.
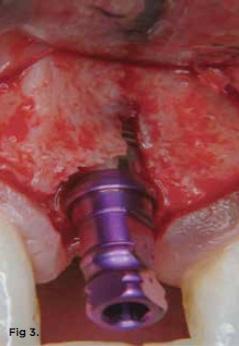
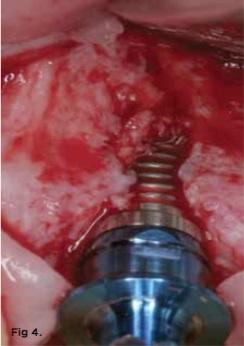
Фото 4. В определенных случаях процедура классической остеотомии может привести к потере костной ткани в периимплантатной области, что чревато дальнейшим обнажением витков интраоссальной опоры.
Поскольку свежая гидратированная губчатая кость является пластичным материалом, она обладает хорошей способностью к пластической деформации. Остеоконденсация первично представляет собой процесс своеобразной «полировки» кости, в ходе которой происходит ее перераспределение по поверхности остеотомического участка посредством пластической деформации. Ротация боров для остеоконденсации происходит против часовой стрелки, что заставляет их скользить по поверхности костной ткани, провоцируя развитие низкопластичной деформации. При этом сила компрессии заметно меньше, чем предельная прочность кости. Боры для остеоконденсации сконструированы таким образом, что вместо того, чтобы удалять кость, они обеспечивают ее уплотнение, таким образом, не редуцируя исходный объем, повышая исходную плотность и позволяя добиться лучшей степени контакта с имплантатом. Все это также оптимизирует процесс костного заживления. Кроме того, конденсация кости провоцирует развитие определенных напряжений, которые, в свою очередь, повышают остеогенную активность. Остеоконденсация способствует тому, что врачу удается достичь как более высоких показателей ТИ, так и более высоких показателей коэффициента стабильности имплантатов (КСИ).
Сверла для остеоконденсации также оснащены датчиком реального времени, который показывает, стоит ли хирургу увеличить или ослабить усилие в зависимости от исходной плотности костной ткани. Ввиду своего движения против часовой стрелки, боры для остеоконденсации не режут, а наоборот – уплотняют кость со скоростью движения 800-1200 оборотов в минуту (фото 5). Логично, что для того, чтобы не перегреть кость, врач должен обеспечить надлежащий уровень ирригации. Движения боров против часовой стрелки индуцируют развитие компрессионных волн во внешнем направлении, а поскольку бор окружен костной тканью – то именно в ее структуре. Это и называется уплотнение аутографта, или остеоконденсация. Грубо говоря, ошурки костной ткани перераспределяются по канавкам бора и вдавливаются в трабекулярные стенки имплантологического ложа. Таким образом повышается плотность костной ткани в периферических участках остеотомии.
Фото 5. Бор для проведения остеоконденсации, который, в отличие от классических сверл, не режет костную ткань, но уплотняет ее во внешнем направлении. Данные инструменты позволяют провести пластическую деформацию костной ткани, не провоцируя ее экскавацию.

Trisi и коллеги, изучая методики остеоконденсации на животных моделях, установили, что последняя позволяет добиться повышения параметров контакта имплантата с окружающей костью даже при установке титановых опор в участки с низким качеством кости. Таким образом, по мнению авторов, удается повысить стабильность имплантатов, снижая параметры их микродвижений. Huwais и Meyer также сообщили, что уплотнение аутографта в периферических участках остеотомии позволяет добиться лучшей первичной стабильности имплантата (фото 6). При этом авторы указали на то, что для реализации данного подхода требуется наличие достаточного объема костной ткани определённого исходного уровня плотности (фото 6).
Фото 6. Результаты доклинических исследований. В верхнем ряду: вид участков стандартной остеотомии, экстракционного препарирования и остеоконденсации. В нижнем ряду: результаты микрокомпьютерной томографии, на которых можно увидеть, как отличается качество костной ткани по периферии имплантологического ложа во всех трех случаях.
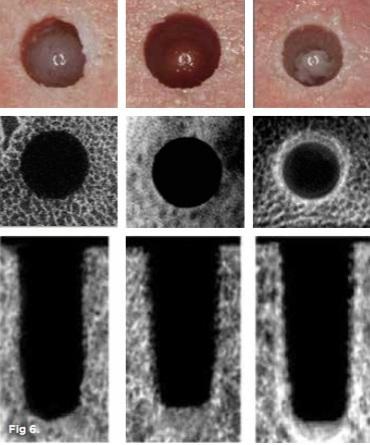
При этом исследователям не удалось зарегистрировать каких-то значительных повышений в температуре при реализации остеокондесанции, которые могли бы спровоцировать ятрогенную травму костной ткани. Наоборот, полученные результаты свидетельствуют об оптимизации процесса костного заживления за счет наличия своей же кости по периферии остеотомии, но только лучшего качества.
Таким образом, предварительно проведенные исследования на животных позволили резюмировать несколько ключевых моментов остеоконденсации. Данная процедура позволяет увеличить минеральную плотность костной ткани в периферических участках остеотомии, таким образом, повышая первичную стабильность имплантатов и параметры их торка при установке. С точки зрения клинической безопасности, манипуляция остеоконденсации также приемлема в качестве процедуры классической остеотомии при условии адекватного контроля скорости сверла и обеспечения надлежащей ирригации. Уплотнение имплантационного ложа позволяет распределить имеющуюся костную ткань во всех направлениях с повышением параметров ее качества на всю глубину, особенно в области дна лунки. Все это повышает качество контакта костной ткани с поверхностью имплантата в среднем в три раза по сравнению с обычной процедурой препарирования области вмешательства.
Выводы
Остеоконденсация позволяет сохранить необходимый объем костной ткани за счет двух подходов: посредством компрессии губчатой кости в ходе ее вязкоупругой и пластической деформации, а также за счет уплотнения частиц аутографта по всей длине и глубине остеотомии. Разные подходы к конденсации аутотрансплантата используются врачами на протяжении уже более 20 лет в разных отраслях медицины (например, в ортопедической хирургии для улучшения стабильности протеза при замене тазобедренного сустава). Концепция остеоконденсации отличается от принципов классической остеотомии тем, что она не предполагает удаления кости, а наоборот обеспечивает улучшение параметров качества кости за счет ее перераспределения по периферии имплантологического ложа.
Авторы: Michael A. Pikos, DDS; and Richard J. Miron, DDS, PhD
Остеоциты и мезенхимальные клетки кости (МКК) играют ключевую роль в процессе костного ремоделирования. По своей функции остеоциты являются клетками, которые являются чувствительными к механическим стимулам, и которые принимают участие в формировании костной ткани наряду с остеобластами и остеокластами. При этом остеобласты развиваются из мезенхимальных клеток и отвечают за синтез костного матрикса, а остеокласты дифференцируют из многоядерных клеток моноцитарно-макрофагальной линии. Мезенхимальные, или как еще их называют выстилающие клетки костной ткани отвечают за формирование костной ткани на новых костных поверхностях, и характеризуются плоскостной внешней архитектурой.

Нагрузка и резорбция костной ткани
Остеоциты и МКК вместе формируют рабочую коммуникационную систему, которая принимает участие в регулировании механорецептивной функции. Остеоциты, «чувствуя» небольшое увеличение со стороны поступающих механически индуцированных сигналов (которые формируются при нагрузке на участок костной ткани), сигнализируют МКК о необходимости увеличения образования кости и ингибирования процесса ее резорбции. И наоборот, при дефиците необходимой механической нагрузки, в кости наблюдается феномен отсутствия необходимого функционального напряжения, что, в свою очередь, провоцирует потерю костной ткани. В случаях чрезмерного уровня приложенной нагрузки или при микроразрушениях структуры кости отмечается более выраженный апоптоз остеоцитов. Как правило, данный феномен наблюдается вблизи поверхности кортикального слоя, на который действует высокое механическое напряжение, поскольку именно данная часть кости является более чувствительной к механическим перенагрузкам по сравнению с трабекулярной составляющей. Понимание данной теории является крайне важным для клинической практики, учитывая, что процесс остеоконденсанции (остеоденсификация, уплотнения костной ткани) предусматривает развитие крайне высоких напряжений именно в кортикальном слое, что, в свою очередь, может спровоцировать апоптоз остеоцитов и последующую потерю костной ткани.
Ремоделирование кости вокруг дентальных имплантатов
После установки дентальных имплантатов вскоре вокруг них начинает развиваться имунно-воспалительная реакция, предусматривающая реализацию ангиогенных и остеогенных процессов. Элементы данной реакции зависят от характеристик поверхности самого имплантатов (топографии, химической составляющей и структуры материала), которые могут способствовать или же ингибировать адсорбцию соответствующих белков. Тромбин и фибриноген, адсорбируясь на поверхности внутрикостной опоры, играют ключевую роль в достижении гомеостаза периимплантатной области, после чего выделение соответствующих цитокинов и факторов роста стимулирует депозицию коллагенового матрикса вокруг слоя титана оксида, находящегося на поверхности винта. Все это в конце концов приводит к формированию новой костной ткани (обычно происходит на протяжении 5 дней). В течение 8-12 недель пластинчатая кость инициирует развитие такого феномена как биологическая стабильность, что также именуется остеоинтеграцией.
Впоследствии, как и в случае естественного зубного ряда, имплантаты подвергаются ремоделированию мягких и твердых тканей с формированием параметра биологической ширины на уровне 3,5 мм. Многие исследования при этом указывают на то, что наличие микрозазора между двумя компонентами имплантологической системы провоцирует более выраженную потерю костной ткани. Интерфейс соединения между абатментом и имплантатом характеризуется наличием микропространства в диапазоне от 10 до 50 микрон, что приводит к развитию эффекта помпы. Под действием последнего интерфейс соединения контаминируется жидкостью полости рта, содержащей как грамположительные, так и грамотрицательные бактерии. Именно из-за этого внутреннее соединение в структуре имплантологической системы является более предпочтительным, чем внешнее. Кроме того, особый интерес представляет собой принцип переключения платформ, который позволяет корригировать параметры биологической ширины.
Значительное количество исследований было посвящено аспектам оптимизации дизайна имплантата для улучшения его стабильности и/или качества остеоинтеграции, а также для минимизации уровня потери маргинальной костной ткани. Однако при этом совсем мало внимания уделялось возможностям оптимизации самой области имплантации в процессе выполнения остеотомии. В данной статье мы рассмотрим аспекты влияния исходной плотности костной ткани на первичную стабильность имплантата, а также хирургические концепции приема остеоконденсации как метода, позволяющего улучшить первичную стабильность имплантата путем уплотнения доступной аутогенной костной ткани.
Влияние исходного качества кости на параметры остеоинтеграции и торка имплантата
Торк имплантата (ТИ) в диапазоне от 25 Нсм до 45 Нсм рассматривается как идеальное значение в ходе его установки для профилактики развития микродвижений внутрикостной конструкции, которые могут привести к формированию фиброзной капсулы вокруг опоры. При этом, однако, слишком высокие показатели ТИ были ассоциированы с критическим давлением на костную ткань, что может привести к развитию микропереломов и некрозу костной ткани. На изучаемых животных моделях уже неоднократно было доказано, что высокие показатели ТИ провоцируют комплексное микроразрушение кости и запускают процесс комплексного ремоделирования. Следует заметить, что резорбция кортикальной костной ткани развивается более часто, чем трабекулярной, что может быть связано с ее низкой васкуляризацией. Данные результаты исследования полностью коррелируют с теми, что были получены в ходе изучения влияния показателей торка больше 50 Н*см на костную ткань челюстей у человека: в таких условиях отмечается более выраженная потеря периимплантатной костной ткани еще на ранних стадиях ее заживления. Недавно проведенный комплексный анализ также позволил обнаружить, что «недопрепарирование» участка остеотомии для достижения более высоких показателей исходного торка провоцирует апоптоз двойного слоя остеоцитов по сравнению с ситуациями, в которых исходный ТИ был значительно ниже.
Таким образом, можно резюмировать, что дефицит первичной стабильности имплантата в целом может компрометировать процесс остеоинтеграции, однако слишком высокие показатели ТИ негативно влияют на поддержку необходимого уровня периимплантатной костной ткани. Не менее важным фактором, который влияет на исход установки имплантата, является исходная плотность альвеолярной кости и ее связь с показателями первичной стабильности. В своих ранних работах Misch классифицировал все возможные варианты альвеолярного костного гребня на 4 типа. Согласно этой классификации, более плотная костная ткань локализируется в переднем участке нижней челюсти, в то время как наиболее пористая – в дистальных участках верхней челюсти. Логично, что чем больший слой кортикальной кости, тем более сильную поддержку имплантата она обеспечивает, что, в свою очередь, позволяет достичь более высоких показателей первичной стабильности. Однако, кортикальная составляющая кости также характеризуется и меньшим уровнем васкуляризации, что, в свою очередь, снижает ее ангиогенный потенциал и снижает возможности для миграции остеогенных клеток в область имплантации. В конечном счете, все это может привести к более выраженной потере уровня костной ткани в периимплантатной области.
Simons и соавторы провели исследование, в котором изучили влияние исходного соотношения кортикальной и губчатой костной ткани на характер потери кости в периимплантатной области. Они обнаружили, что при наличии 50-60% губчатой кости удаётся минимизировать раннюю редукцию уровня периимплантатного костного гребня до 0,6-0,7 мм, в то же время превалирование кортикальной кости в области имплантации провоцирует убыль уровня окружающего костного гребня до 1,5 мм. По этой причине при выраженно толстом слое кортикальной кости исходные параметры ТИ все же лучше минимизировать. Также для того, чтобы свести показатели редукции костного гребня к минимальным, авторы рекомендуют проводить конденсацию участка остеотомии при наличии толстой кортикальной пластинки, таким образом, обеспечивая редукцию исходных параметров торка.
Таким образом, можно резюмировать, что кортикальная кость характеризуется наличием определенных недостатков по сравнению с трабекулярной, что выражается в ограниченном кровоснабжении и сниженном количестве присутствующих остеопрогениторных клеток. Кроме того, кортикальная кость также характеризуется повышенной чувствительностью к высоким напряжениям, иными словами – она является более механически чувствительной. Исходя из этого, становиться понятным почему апоптоз остеоцитов более часто регистрируется именно в области кортикального слоя в случаях микроразрушений кости и действия на нее высоких функциональных напряжений. Понимая влияние данных факторов, врач должен учитывать исходное состояние качества костной ткани в области остеотомии, для того чтобы обеспечить профилактику потенциально возможных имплантат-ассоциированных осложнений.
Немедленная имплантация с достижением высоких и низких показателей торка
Ряд клинических исследований долгое время изучали гипотезу о том, что более высокие показатели первичной стабильности ассоциированы с лучшими параметрами остеоинтеграции. В случаях немедленной имплантации достижение высоких параметров торка, превышающих 32 Нсм, является обязательным. При этом показатели торка, превышающие 50 Нсм при немедленной установке имплантатов, провоцировали более выраженную потерю костного гребня, особенно с вестибулярной стороны, а также развитие рецессий в области имплантации. При экстремально высоком торке (более 70 Нсм) потеря окружающей костной ткани была клинически выраженной и часто негативно влияла на конечный исход реабилитации. С другой стороны, слишком низкие показатели торка также были связаны с повышением частоты неудач после установки внутрикостных титановых опор. Таким образом, полученные результаты указывают на наличие прямой связи между исходными показателями торка и уровнем потери периимплантатной костной ткани.
Процедура конденсации костной ткани с помощью остеотомической техники, позволяющая улучшить первичную стабильность имплантатов и костное заживление в области вмешательства, была впервые описана Summers уже около 20 лет назад. Büchter и Stavropoulos, однако, отметили, что к данной технике следует относится с огромной осторожностью, поскольку данный подход при неадекватном использовании может привести к развитию микропереломов в структуре костной ткани, окружающей имплантат. На протяжении многих лет исследователи старались сгруппировать все возможные варианты реализации техники остеоконденсации в определенные практические рекомендации. Так, например, появилась концепция установки имплантата более широкого диаметра, чем последнее используемое остеотомическое сверло, что позволяет повысить исходные показатели торка. В подобных случаях врачам удаётся добиться адекватной вторичной стабильности и плотного контакта имплантата с окружающей костью, хотя сам процесс заживления кости происходил более медленно, учитывая развитие очагов микронекроза. Другие исследователи показали, что установка имплантатов с торком равным 0, позволяет добиться таких же успешных отдаленных результатов через 4 месяца, как и при установке имплантатов с торком в 30 Нсм или 70 Нсм. Учитывая разнообразность, полученных в ходе разных исследований данных, можно только резюмировать, что роль высоких показателей ТИ на уровень резорбции костной ткани в периимплантатной области остается не до конца изученной.
Остеоконденсация
Биомеханическая стабильность имплантатов обычно зависит от нескольких факторов. Во-первых, от макро- и микродизайна самих интраоссальных конструкций, а также от качества и количества костной ткани в области вмешательства – все эти факторы непосредственно влияют на первичную стабильность имплантатов (фото 1).
Фото 1. Классическая диаграмма графиков стабильности имплантатов. Самые высокие показатели первичной стабильности регистрируются на первой неделе после установки имплантатов, далее на 4 неделе отмечается снижение стабильности, после чего начинает развиваться механизм вторичной стабильности. Многие клиницисты стараются оптимизировать показатели стабильности в особенно критический период 4 недель за счет модификации протоколов установки имплантатов, их поверхностей, изменения макро- и микродизайна.

Протоколы, направленные на повышение параметров первичной стабильности имплантатов, предусматривают возможную реализацию следующих принципов:
- Контроль «недопрепарирования» участка остеотомии;
- Выбор необходимого типа имплантата с учетом его микро- и макротекстуры;
- Использование более длинных имплантатов, которые обеспечивают повышение показателей их контакта с костной тканью;
- Остеоконденсация имплантологического ложа.
Костная ткань человека характеризуется способностью поглощать энергию, то есть она является гибкой, но при этом она также может изменять свою форму в процессе деформации без сколов или переломов. Также кость может противостоять компрессии, несколько расширяясь под ее действием и удлиняясь во время напряжения.
Традиционно перед установкой имплантатов проводиться препарирование костной ткани. В ходе вращения сверла вектор сопротивления «нарезки» постоянно меняется, что приводит к тому, что направление сверла может несколько изменяется от предварительно запланированной позиции (фото 2-4).
Фото 2. В определенных случаях процедура классической остеотомии может привести к потере костной ткани в периимплантатной области, что чревато дальнейшим обнажением витков интраоссальной опоры.

Фото 3. В определенных случаях процедура классической остеотомии может привести к потере костной ткани в периимплантатной области, что чревато дальнейшим обнажением витков интраоссальной опоры.

Фото 4. В определенных случаях процедура классической остеотомии может привести к потере костной ткани в периимплантатной области, что чревато дальнейшим обнажением витков интраоссальной опоры.

Поскольку свежая гидратированная губчатая кость является пластичным материалом, она обладает хорошей способностью к пластической деформации. Остеоконденсация первично представляет собой процесс своеобразной «полировки» кости, в ходе которой происходит ее перераспределение по поверхности остеотомического участка посредством пластической деформации. Ротация боров для остеоконденсации происходит против часовой стрелки, что заставляет их скользить по поверхности костной ткани, провоцируя развитие низкопластичной деформации. При этом сила компрессии заметно меньше, чем предельная прочность кости. Боры для остеоконденсации сконструированы таким образом, что вместо того, чтобы удалять кость, они обеспечивают ее уплотнение, таким образом, не редуцируя исходный объем, повышая исходную плотность и позволяя добиться лучшей степени контакта с имплантатом. Все это также оптимизирует процесс костного заживления. Кроме того, конденсация кости провоцирует развитие определенных напряжений, которые, в свою очередь, повышают остеогенную активность. Остеоконденсация способствует тому, что врачу удается достичь как более высоких показателей ТИ, так и более высоких показателей коэффициента стабильности имплантатов (КСИ).
Сверла для остеоконденсации также оснащены датчиком реального времени, который показывает, стоит ли хирургу увеличить или ослабить усилие в зависимости от исходной плотности костной ткани. Ввиду своего движения против часовой стрелки, боры для остеоконденсации не режут, а наоборот – уплотняют кость со скоростью движения 800-1200 оборотов в минуту (фото 5). Логично, что для того, чтобы не перегреть кость, врач должен обеспечить надлежащий уровень ирригации. Движения боров против часовой стрелки индуцируют развитие компрессионных волн во внешнем направлении, а поскольку бор окружен костной тканью – то именно в ее структуре. Это и называется уплотнение аутографта, или остеоконденсация. Грубо говоря, ошурки костной ткани перераспределяются по канавкам бора и вдавливаются в трабекулярные стенки имплантологического ложа. Таким образом повышается плотность костной ткани в периферических участках остеотомии.
Фото 5. Бор для проведения остеоконденсации, который, в отличие от классических сверл, не режет костную ткань, но уплотняет ее во внешнем направлении. Данные инструменты позволяют провести пластическую деформацию костной ткани, не провоцируя ее экскавацию.

Trisi и коллеги, изучая методики остеоконденсации на животных моделях, установили, что последняя позволяет добиться повышения параметров контакта имплантата с окружающей костью даже при установке титановых опор в участки с низким качеством кости. Таким образом, по мнению авторов, удается повысить стабильность имплантатов, снижая параметры их микродвижений. Huwais и Meyer также сообщили, что уплотнение аутографта в периферических участках остеотомии позволяет добиться лучшей первичной стабильности имплантата (фото 6). При этом авторы указали на то, что для реализации данного подхода требуется наличие достаточного объема костной ткани определённого исходного уровня плотности (фото 6).
Фото 6. Результаты доклинических исследований. В верхнем ряду: вид участков стандартной остеотомии, экстракционного препарирования и остеоконденсации. В нижнем ряду: результаты микрокомпьютерной томографии, на которых можно увидеть, как отличается качество костной ткани по периферии имплантологического ложа во всех трех случаях.

При этом исследователям не удалось зарегистрировать каких-то значительных повышений в температуре при реализации остеокондесанции, которые могли бы спровоцировать ятрогенную травму костной ткани. Наоборот, полученные результаты свидетельствуют об оптимизации процесса костного заживления за счет наличия своей же кости по периферии остеотомии, но только лучшего качества.
Таким образом, предварительно проведенные исследования на животных позволили резюмировать несколько ключевых моментов остеоконденсации. Данная процедура позволяет увеличить минеральную плотность костной ткани в периферических участках остеотомии, таким образом, повышая первичную стабильность имплантатов и параметры их торка при установке. С точки зрения клинической безопасности, манипуляция остеоконденсации также приемлема в качестве процедуры классической остеотомии при условии адекватного контроля скорости сверла и обеспечения надлежащей ирригации. Уплотнение имплантационного ложа позволяет распределить имеющуюся костную ткань во всех направлениях с повышением параметров ее качества на всю глубину, особенно в области дна лунки. Все это повышает качество контакта костной ткани с поверхностью имплантата в среднем в три раза по сравнению с обычной процедурой препарирования области вмешательства.
Выводы
Остеоконденсация позволяет сохранить необходимый объем костной ткани за счет двух подходов: посредством компрессии губчатой кости в ходе ее вязкоупругой и пластической деформации, а также за счет уплотнения частиц аутографта по всей длине и глубине остеотомии. Разные подходы к конденсации аутотрансплантата используются врачами на протяжении уже более 20 лет в разных отраслях медицины (например, в ортопедической хирургии для улучшения стабильности протеза при замене тазобедренного сустава). Концепция остеоконденсации отличается от принципов классической остеотомии тем, что она не предполагает удаления кости, а наоборот обеспечивает улучшение параметров качества кости за счет ее перераспределения по периферии имплантологического ложа.
Авторы: Michael A. Pikos, DDS; and Richard J. Miron, DDS, PhD































































































































































0 комментариев