В теле человека насчитывается свыше 200 разных типов клеток, образующих ткани и органы, которые выполняют все задачи, связанные с поддержанием жизнеспособности системы, включая задачу воспроизводства. Размер популяций клеток в здоровых тканях взрослого человека – результат тонкого равновесия процессов пролиферации клеток, их дифференцировки и гибели. При повреждении ткани пролиферация клеток позволяет устранить нанесенный ущерб. Для этого покоящиеся (спящие) клетки ткани переходят в состояние пролиферативных, либо стволовые клетки активируются и дифференцируются в клетки такого типа, который необходим для восстановления поврежденной ткани. Исследования стволовых клеток направлены на выяснение механизмов поддержания и восстановления тканей, а также – на выделение значительного числа типов клеток из эмбрионов.
Давно замечено, что ткани могут формироваться за счет самых разных дифференцированных клеток и что элементы крови, кожи и выстилки желудка, дифференцированные клетки отличаются коротким временем полужизни и неспособностью к самостоятельному обновлению. Это наблюдение позволило предположить, что некоторые ткани могут существовать за счет стволовых клеток, т.е. клеток со способностью к саморепликации и генерации дочерних клеток, которые могут дифференцироваться. Такие стволовые клетки взрослых, или региональные стволовые клетки, производят только те клеточные линии, которые соответствуют конкретной ткани (рис. 1).
Рис. 1. Стволовая клетка подвергается саморепликации или дифференцировке.
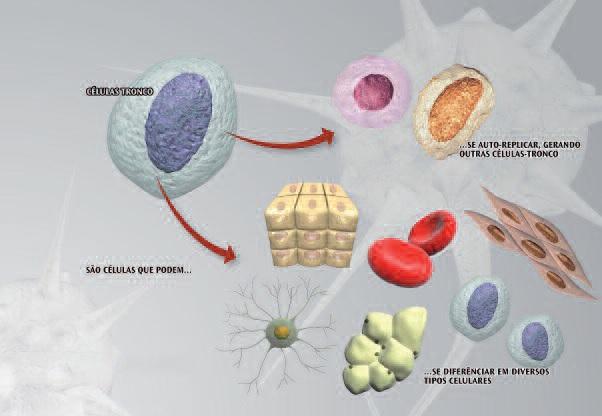
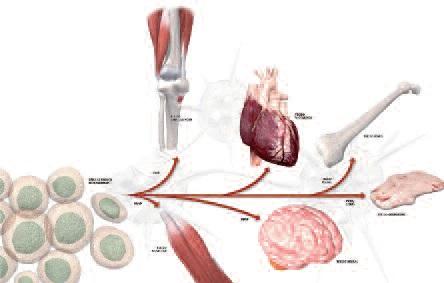
Стволовые клетки можно не только выделить из взрослых и эмбриональных тканей; их также можно сохранять в культурах в качестве недифференцированных клеток. Эмбриональные стволовые клетки способны производить все дифференцированные клетки взрослого организма. Таким образом, их потенциал можно расширить за пределы обычной мезодермальной клеточной линии до дифференцировки в печеночные, почечные, мышечные, кожные, сердечные и нервные клетки (рис. 2).
Рис. 2. Источником разных тканей являются мезенхимальные стволовые клетки.
Понимание потенциала стволовых клеток ознаменовало новую эру – регенеративной медицины. Появилась возможность регенерации тканей и органов, которые в противном случае были бы утрачены. Поскольку использование эмбриональных стволовых клеток вызывает очевидные этические вопросы, большинство научных исследований посвящено применению региональных стволовых клеток. Стволовые клетки взрослых не отличаются такой универсальностью, как эмбриональные: считаются мультипотентными, т.е. способными дифференцироваться только в клетки/ткани определенных типов, тогда как эмбриональные стволовые клетки – в любые клетки и/или ткани. Научные исследования позволили установить, что некоторые ткани, например нервная, регенерируются с большим трудом, тогда как костная ткань и кровь лучше поддаются лечению стволовыми клетками.
Объектом пристального внимания исследователей стала пульпа временных зубов: ее тщательное изучение в качестве потенциального источника стволовых клеток дало многообещающие результаты. Однако регенерация зуба целиком представляет очень сложный процесс, который, несмотря на некоторые успехи, достигнутые с использованием животных моделей, пока еще невозможно воспроизвести и применять клинически. Совершенно иначе дело обстоит с регенерацией костной ткани челюсти; научно-доказательная база вполне достаточна для клинического применения этого метода. В настоящее время региональные стволовые клетки получают помимо других тканей из костного мозга и жира.
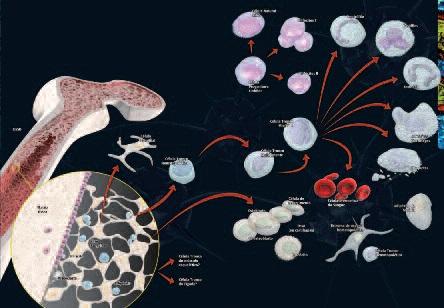
Костный мозг является кроветворной тканью, т.е. он способен производить все клетки крови. В 1950-х годах нобелевский лауреат доктор E.Donnall Thomas продемонстрировал жизнеспособность трансплантированного костного мозга у пациентов с лейкемией. Тогда этот метод позволил спасти множество людей, страдающих иммунологическими заболеваниями и болезнями кроветворной системы. Однако костный мозг содержит не только гематопоэтические стволовые клетки (дифференцируются в эритроциты, лейкоциты, тромбоциты и т.п.), но и мезенхимальные стволовые клетки (становятся, например, костной, мышечной и жировой тканью; рис. 3).
Рис. 3. Разнообразие типов клеток, присутствующих в костном мозге.
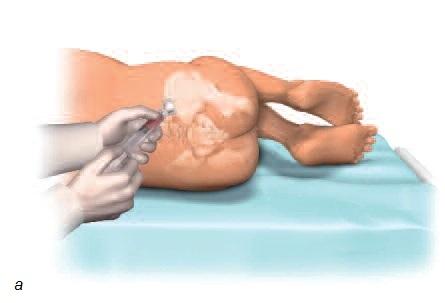
Взятие костного мозга проводят под местной анестезией с помощью иглы из подвздошной (тазовой) кости. Хотя для проведения процедуры необходима соответствующая квалификация, сама процедура не считается чрезмерно инвазивной или сложной. Процедура также не связана с существенным интра- или послеоперационным дискомфортом (рис. 4).
Рис. 4. а – область пункции для взятия костного мозга из подвздошной кости; б – игла внутри костного мозга.
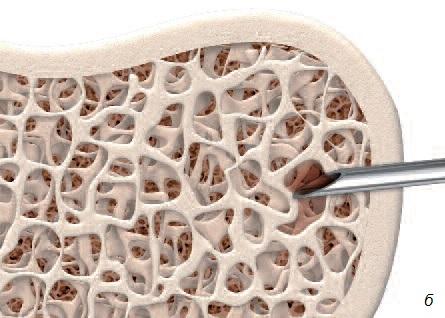
Реконструкция кости в стоматологии (равно как в ортопедии и онкологии) представляет сложную задачу, поскольку устранение костных дефектов, вызванных травмой, инфекциями, опухолями или удалением зубов, требует трансплантации кости. Недостаточный объем кости челюсти может стать препятствием для установки имплантатов, т.е. негативно отразится на качестве жизни пациентов. Для восполнения объема кости трансплантат обычно берут в области подбородка или угла нижней челюсти. Для исправления очень обширных дефектов может понадобиться костная ткань черепа, ноги или таза. В отличие от процедуры взятия костного мозга операции, связанные с получением костных трансплантатов, зачастую сопровождаются сильным дискомфортом, а иногда – неустранимыми послеоперационными остаточными явлениями (рис. 5).
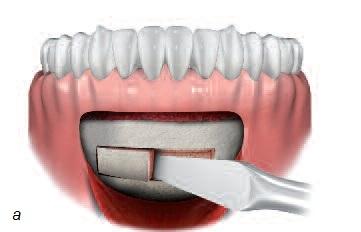
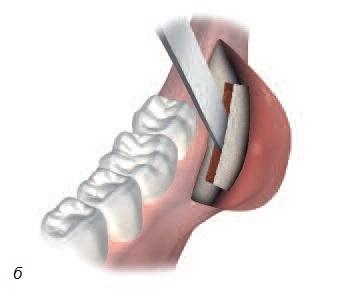
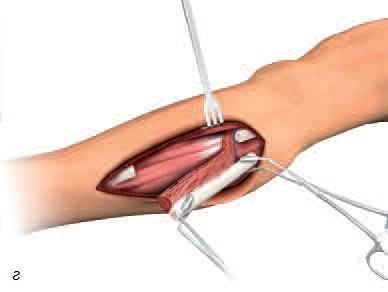
Рис. 5. а – получение костного трансплантата из подбородка; б – получение костного трансплантата из области угла челюсти; в – получение костного трансплантата из свода черепа; г – получение костного трансплантата из ноги (большой или малой берцовой кости); д – костный трансплантат из подвздошной (тазовой) кости.

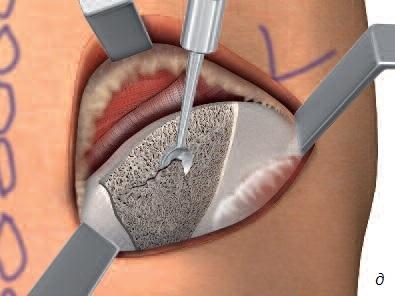
Проблемы, связанные с костной трансплантацией, подтолкнули к использованию заменителей (синтетические материалы и донорская костная ткань человеческого или животного происхождения). Тем не менее такие материалы демонстрируют худшие результаты по сравнению с аутотрансплантатами (кость самого пациента), поскольку не содержат аутологичных белков. Ввиду этого новая концепция, подразумевающая использование заменителя костного материала в сочетании со стволовыми клетками самого пациента при восполнении критичных костных дефектов, получила признание в качестве современного подхода к лечению. Приходя на смену костной трансплантации (со всеми присущими ей недостатками), этот новый метод позволяет использовать стволовые клетки самого пациента в сочетании с минерализованными материалами и исключает необходимость в хирургическом получении костной ткани.
До недавнего времени не было проведено ни одного исследования, посвященного сравнению разных методов применения стволовых клеток костного мозга для реконструкции кости. Ниже дано резюме исследования, проведенного нашей группой, в рамках которого критичные костные дефекты, искусственно созданные у кроликов, затем устранялись с помощью 4 основных методов лечения стволовыми клетками с целью сравнения их эффективности с точки зрения заживления кости.
Применяли:
- свежий костный мозг (без обработки);
- концентрат стволовых клеток костного мозга;
- культуру стволовых клеток костного мозга;
- культуру жировых стволовых клеток (рис. 6, 7).
Рис. 6. Искусственно вызванный критичный костный дефект свода черепа кролика.
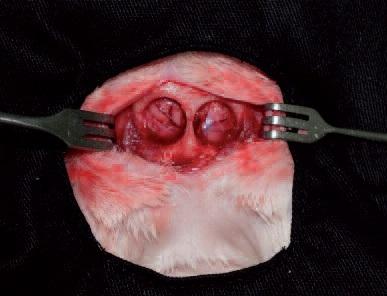
Рис. 7. Первичная культура мезенхимальных стволовых клеток костного мозга через 21 день культивирования.

Пятая группа животных была контрольной, ни один метод лечения стволовыми клетками в ней не применялся. Наилучшие результаты с точки зрения регенерации кости были получены при использовании концентрата и культуры стволовых клеток костного мозга. Контрольная группа продемонстрировала наихудшие результаты. Сделали вывод, что стволовые клетки костного мозга лучше подходят для реконструкции кости, чем стволовые клетки, выделенные из жировой ткани, и что простой концентрат стволовых клеток (его приготовление занимает несколько часов) позволяет получить результаты, сопоставимые с результатами применения сложной культуры стволовых клеток (ее выращивание занимает в среднем от 3 до 4 нед; рис. 8).
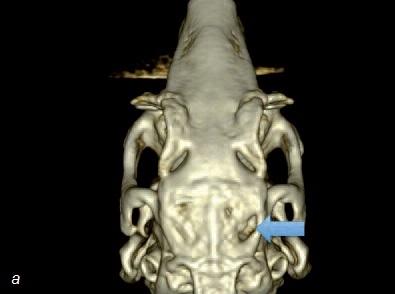
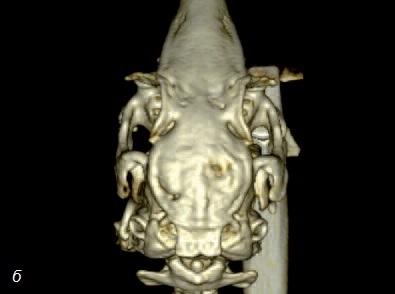
Рис. 8. а – компьютерная томограмма черепа кролика после трансплантации заменителя кости без стволовых клеток (область трансплантации отмечена голубой стрелкой). Обратите внимание на то, что костный дефект сохранился; б – компьютерная томограмма черепа кролика после трансплантации заменителя кости со стволовыми клетками. Обратите внимание на практически полное заживление костного дефекта.
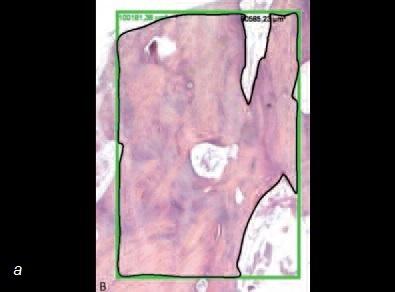
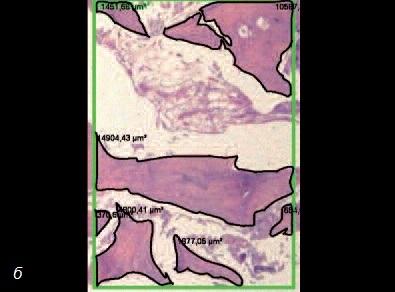
Сходные исследования, проведенные с привлечением пациентов, подтверждают, что стволовые клетки костного мозга улучшают заживление костных дефектов, вызванных травмой, удалением зубов или новообразований. Гистологические изображения демонстрируют возможности заменителей кости в сочетании со стволовыми клетками при реконструкции кости (рис. 9). Очевидно, что уровень минерализованной кости существенно выше там, где были применены стволовые клетки (рис. 10).
Рис. 9. Костный аллотрансплантат с концентратом костного мозга.

Рис. 10. а – гистологический срез участка после пересадки аллотрансплантата в сочетании с костным мозгом. Обратите внимание на наличие существенного объема минерализованной ткани; б – гистологический срез участка после пересадки аллотрансплантата без костного мозга. Обратите внимание на наличие значительно меньшего объема минерализованной ткани.
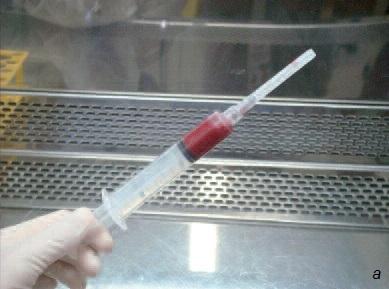
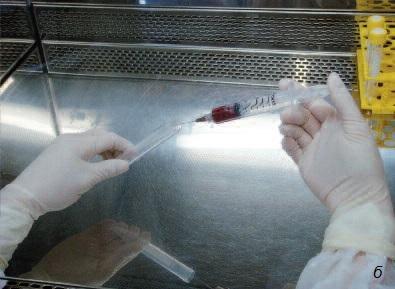
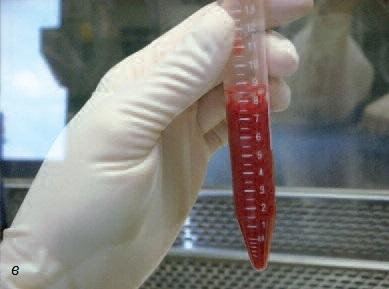
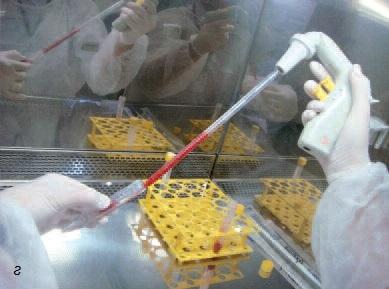
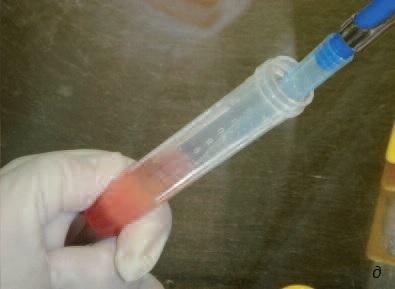
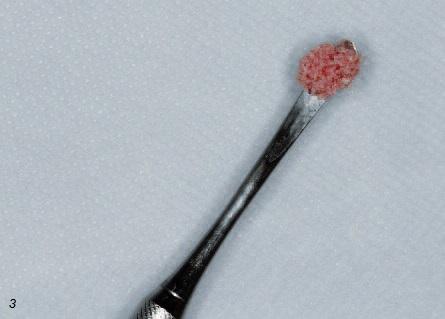
Хотя этот метод очень близок клиническому применению, назначать подобную процедуру следует с большой осторожностью. Для ее проведения нужна соответствующая квалификация хирурга и сотрудников лаборатории, а также доступность необходимых ресурсов (на рис. 11 фотографии, сделанные во время манипуляций со стволовыми клетками костного мозга в лаборатории Стоматологической школы им. св. Леопольда Мандича в Бразилии).
Рис. 11. а – костный мозг; б – костный мозг перемещают в пробирку в стерильных условиях (в ламинарном потоке); в – гомогенизация костного мозга в буферном растворе (в ламинарном потоке); г – костный мозг соединяют с фиколлом (для фракционирования клеток); д – с помощью пипетки отбирают промежуточный слой, содержащий мононуклеары (стволовые клетки); е – второй цикл центрифугирования.


Автор: Андрэ Антонио Пелегрине, Бразилия
В теле человека насчитывается свыше 200 разных типов клеток, образующих ткани и органы, которые выполняют все задачи, связанные с поддержанием жизнеспособности системы, включая задачу воспроизводства. Размер популяций клеток в здоровых тканях взрослого человека – результат тонкого равновесия процессов пролиферации клеток, их дифференцировки и гибели. При повреждении ткани пролиферация клеток позволяет устранить нанесенный ущерб. Для этого покоящиеся (спящие) клетки ткани переходят в состояние пролиферативных, либо стволовые клетки активируются и дифференцируются в клетки такого типа, который необходим для восстановления поврежденной ткани. Исследования стволовых клеток направлены на выяснение механизмов поддержания и восстановления тканей, а также – на выделение значительного числа типов клеток из эмбрионов.
Давно замечено, что ткани могут формироваться за счет самых разных дифференцированных клеток и что элементы крови, кожи и выстилки желудка, дифференцированные клетки отличаются коротким временем полужизни и неспособностью к самостоятельному обновлению. Это наблюдение позволило предположить, что некоторые ткани могут существовать за счет стволовых клеток, т.е. клеток со способностью к саморепликации и генерации дочерних клеток, которые могут дифференцироваться. Такие стволовые клетки взрослых, или региональные стволовые клетки, производят только те клеточные линии, которые соответствуют конкретной ткани (рис. 1).
Рис. 1. Стволовая клетка подвергается саморепликации или дифференцировке.

Стволовые клетки можно не только выделить из взрослых и эмбриональных тканей; их также можно сохранять в культурах в качестве недифференцированных клеток. Эмбриональные стволовые клетки способны производить все дифференцированные клетки взрослого организма. Таким образом, их потенциал можно расширить за пределы обычной мезодермальной клеточной линии до дифференцировки в печеночные, почечные, мышечные, кожные, сердечные и нервные клетки (рис. 2).
Рис. 2. Источником разных тканей являются мезенхимальные стволовые клетки.

Понимание потенциала стволовых клеток ознаменовало новую эру – регенеративной медицины. Появилась возможность регенерации тканей и органов, которые в противном случае были бы утрачены. Поскольку использование эмбриональных стволовых клеток вызывает очевидные этические вопросы, большинство научных исследований посвящено применению региональных стволовых клеток. Стволовые клетки взрослых не отличаются такой универсальностью, как эмбриональные: считаются мультипотентными, т.е. способными дифференцироваться только в клетки/ткани определенных типов, тогда как эмбриональные стволовые клетки – в любые клетки и/или ткани. Научные исследования позволили установить, что некоторые ткани, например нервная, регенерируются с большим трудом, тогда как костная ткань и кровь лучше поддаются лечению стволовыми клетками.
Объектом пристального внимания исследователей стала пульпа временных зубов: ее тщательное изучение в качестве потенциального источника стволовых клеток дало многообещающие результаты. Однако регенерация зуба целиком представляет очень сложный процесс, который, несмотря на некоторые успехи, достигнутые с использованием животных моделей, пока еще невозможно воспроизвести и применять клинически. Совершенно иначе дело обстоит с регенерацией костной ткани челюсти; научно-доказательная база вполне достаточна для клинического применения этого метода. В настоящее время региональные стволовые клетки получают помимо других тканей из костного мозга и жира.
Костный мозг является кроветворной тканью, т.е. он способен производить все клетки крови. В 1950-х годах нобелевский лауреат доктор E.Donnall Thomas продемонстрировал жизнеспособность трансплантированного костного мозга у пациентов с лейкемией. Тогда этот метод позволил спасти множество людей, страдающих иммунологическими заболеваниями и болезнями кроветворной системы. Однако костный мозг содержит не только гематопоэтические стволовые клетки (дифференцируются в эритроциты, лейкоциты, тромбоциты и т.п.), но и мезенхимальные стволовые клетки (становятся, например, костной, мышечной и жировой тканью; рис. 3).
Рис. 3. Разнообразие типов клеток, присутствующих в костном мозге.

Взятие костного мозга проводят под местной анестезией с помощью иглы из подвздошной (тазовой) кости. Хотя для проведения процедуры необходима соответствующая квалификация, сама процедура не считается чрезмерно инвазивной или сложной. Процедура также не связана с существенным интра- или послеоперационным дискомфортом (рис. 4).
Рис. 4. а – область пункции для взятия костного мозга из подвздошной кости; б – игла внутри костного мозга.


Реконструкция кости в стоматологии (равно как в ортопедии и онкологии) представляет сложную задачу, поскольку устранение костных дефектов, вызванных травмой, инфекциями, опухолями или удалением зубов, требует трансплантации кости. Недостаточный объем кости челюсти может стать препятствием для установки имплантатов, т.е. негативно отразится на качестве жизни пациентов. Для восполнения объема кости трансплантат обычно берут в области подбородка или угла нижней челюсти. Для исправления очень обширных дефектов может понадобиться костная ткань черепа, ноги или таза. В отличие от процедуры взятия костного мозга операции, связанные с получением костных трансплантатов, зачастую сопровождаются сильным дискомфортом, а иногда – неустранимыми послеоперационными остаточными явлениями (рис. 5).
Рис. 5. а – получение костного трансплантата из подбородка; б – получение костного трансплантата из области угла челюсти; в – получение костного трансплантата из свода черепа; г – получение костного трансплантата из ноги (большой или малой берцовой кости); д – костный трансплантат из подвздошной (тазовой) кости.





Проблемы, связанные с костной трансплантацией, подтолкнули к использованию заменителей (синтетические материалы и донорская костная ткань человеческого или животного происхождения). Тем не менее такие материалы демонстрируют худшие результаты по сравнению с аутотрансплантатами (кость самого пациента), поскольку не содержат аутологичных белков. Ввиду этого новая концепция, подразумевающая использование заменителя костного материала в сочетании со стволовыми клетками самого пациента при восполнении критичных костных дефектов, получила признание в качестве современного подхода к лечению. Приходя на смену костной трансплантации (со всеми присущими ей недостатками), этот новый метод позволяет использовать стволовые клетки самого пациента в сочетании с минерализованными материалами и исключает необходимость в хирургическом получении костной ткани.
До недавнего времени не было проведено ни одного исследования, посвященного сравнению разных методов применения стволовых клеток костного мозга для реконструкции кости. Ниже дано резюме исследования, проведенного нашей группой, в рамках которого критичные костные дефекты, искусственно созданные у кроликов, затем устранялись с помощью 4 основных методов лечения стволовыми клетками с целью сравнения их эффективности с точки зрения заживления кости.
Применяли:
- свежий костный мозг (без обработки);
- концентрат стволовых клеток костного мозга;
- культуру стволовых клеток костного мозга;
- культуру жировых стволовых клеток (рис. 6, 7).
Рис. 6. Искусственно вызванный критичный костный дефект свода черепа кролика.

Рис. 7. Первичная культура мезенхимальных стволовых клеток костного мозга через 21 день культивирования.

Пятая группа животных была контрольной, ни один метод лечения стволовыми клетками в ней не применялся. Наилучшие результаты с точки зрения регенерации кости были получены при использовании концентрата и культуры стволовых клеток костного мозга. Контрольная группа продемонстрировала наихудшие результаты. Сделали вывод, что стволовые клетки костного мозга лучше подходят для реконструкции кости, чем стволовые клетки, выделенные из жировой ткани, и что простой концентрат стволовых клеток (его приготовление занимает несколько часов) позволяет получить результаты, сопоставимые с результатами применения сложной культуры стволовых клеток (ее выращивание занимает в среднем от 3 до 4 нед; рис. 8).
Рис. 8. а – компьютерная томограмма черепа кролика после трансплантации заменителя кости без стволовых клеток (область трансплантации отмечена голубой стрелкой). Обратите внимание на то, что костный дефект сохранился; б – компьютерная томограмма черепа кролика после трансплантации заменителя кости со стволовыми клетками. Обратите внимание на практически полное заживление костного дефекта.


Сходные исследования, проведенные с привлечением пациентов, подтверждают, что стволовые клетки костного мозга улучшают заживление костных дефектов, вызванных травмой, удалением зубов или новообразований. Гистологические изображения демонстрируют возможности заменителей кости в сочетании со стволовыми клетками при реконструкции кости (рис. 9). Очевидно, что уровень минерализованной кости существенно выше там, где были применены стволовые клетки (рис. 10).
Рис. 9. Костный аллотрансплантат с концентратом костного мозга.

Рис. 10. а – гистологический срез участка после пересадки аллотрансплантата в сочетании с костным мозгом. Обратите внимание на наличие существенного объема минерализованной ткани; б – гистологический срез участка после пересадки аллотрансплантата без костного мозга. Обратите внимание на наличие значительно меньшего объема минерализованной ткани.


Хотя этот метод очень близок клиническому применению, назначать подобную процедуру следует с большой осторожностью. Для ее проведения нужна соответствующая квалификация хирурга и сотрудников лаборатории, а также доступность необходимых ресурсов (на рис. 11 фотографии, сделанные во время манипуляций со стволовыми клетками костного мозга в лаборатории Стоматологической школы им. св. Леопольда Мандича в Бразилии).
Рис. 11. а – костный мозг; б – костный мозг перемещают в пробирку в стерильных условиях (в ламинарном потоке); в – гомогенизация костного мозга в буферном растворе (в ламинарном потоке); г – костный мозг соединяют с фиколлом (для фракционирования клеток); д – с помощью пипетки отбирают промежуточный слой, содержащий мононуклеары (стволовые клетки); е – второй цикл центрифугирования.








Автор: Андрэ Антонио Пелегрине, Бразилия
































































































































































0 комментариев