Имплантопластика — это метод обработки дентальных имплантатов, которые не справляются со своей функцией из-за периимплантита. Традиционно имплантопластика используется в сочетании с резекционным подходом или как средство сглаживания той части зубного имплантата, которая находится над костью, чтобы способствовать поддержанию гигиены полости рта. В результате этой процедуры поверхность пострадавшего дентального имплантата легче очищается при проведении профилактических манипуляций и создается поверхность для прилегания как мягких, так и твердых тканей, что потенциально делает ее оптимальной методикой для лечения периимплантита. В данной статье представлены два случая, демонстрирующие использование имплантопластики для деконтаминации поверхности дентального имплантата как над, так и под костным гребнем в попытке возобновить остеоинтеграцию несостоятельного имплантата.
Несмотря на то, что для лечения периимплантита было предложено множество методов, не существует единого мнения о наилучшем подходе к этой проблеме. Обзор литературы показывает, что для устранения периимплантита традиционно используются противоинфекционные подходы, при этом усилия направлены на удаление дисбиотической бактериальной биопленки. Нехирургические методы обычно оказываются неэффективными, скорее всего, из-за невозможности получить доступ и должным образом провести деконтаминацию поверхности имплантата. Также были предложены подходы с открытыми лоскутами, как с различными вариантами деконтаминации поверхности и регенеративными протоколами, так и без них. Хотя некоторые из этих подходов к хирургическому доступу были успешными, достижение благоприятного результата осложняется по нескольким причинам. Доступ может быть затруднен из-за глубины некоторых поражений и узости внутрикостного компонента, что затрудняет возможность надлежащей очистки/деконтаминации всей поверхности имплантата. Таким образом, управление сложной микрогеометрией многих из этих шероховатых поверхностей практически невозможно. Поверхности многих имплантатов расположены за пределами внутрикостного дефекта, выходящего за пределы буккальной или язычной части кости. Это может быть частично связано с расположением имплантата при его установке или, возможно, обусловлено продолжающимся черепно-лицевым ростом и развитием. В таких случаях использование регенеративного или только лоскутного метода без модификации поверхности может не остановить развитие патологии и привести к обнажению резьбы и шероховатой поверхности имплантата.
Резекционные подходы — это еще один метод, используемый для лечения периимплантита. Среди лечащих врачей распространено мнение, что инструменты, используемые для очистки внешней поверхности дентального имплантата, неадекватны, поскольку они не могут очистить ее от налета, зубного камня и эндотоксинов, и нет исследований, в которых бы подробно рассматривалась эффективность удаления налета с поверхности такими инструментами (например, скалерами). Чтобы лучше выполнить эту задачу, можно использовать высокоскоростные наконечники для удаления внешней затронутой поверхности, оставляя имплантат в состоянии, которое более приближено к микрошероховатости оригинального обработанного имплантата. Romeo и коллеги одними из первых сообщили об успехе имплантопластики, а 3-летнее наблюдение подтвердило, что она помогает остановить развитие периимплантита. Имплантопластика поверхности проводилась в сочетании с резекционной терапией, и не было никаких признаков внутрикостного поражения во время лечения или после него. Schwarz et al. выступают за использование имплантопластики, но только для супракрестального компонента, как части комплексного ухода за дентальным имплантатом. Целью имплантопластики является достижение высокополированной поверхности, которая ограничит прилипание зубного налета и поможет облегчить соблюдение гигиены полости рта пациента. Этот алгоритм также включает в себя пересадку мягких тканей и регенеративную терапию. Любой внутрикостный компонент устанавливаемого имплантата подвергается механической детоксикации поверхности, которая может включать использование кюрет, ультразвуковых инструментов, титановых или никель-титановых щеток или воздушно-абразивных устройств. После удаления видимого зубного камня и биопленки проводится химическая детоксикация с помощью лимонной кислоты, перекиси водорода или этилендиаминтетрауксусной кислоты (ЭДТА).
Esteves Lima et al. недавно провели исчерпывающий систематический обзор литературы и мета-анализ по использованию имплантопластики и пришли к выводу, что существуют некоторые доказательства, позволяющие рекомендовать ее в качестве потенциального метода лечения периимплантита. Учитывая сложную морфологию многих очагов периимплантита, существует необходимость в комбинированном подходе, при котором выполняется как резекция, так и регенерация. Поскольку имплантопластика может обеспечить результат, при котором пораженную поверхность дентального имплантата легче очистить с помощью профилактических манипуляций, а также обеспечить поверхность для прикрепления мягких и твердых тканей, эта процедура может быть оптимальным методом лечения периимплантита. Поверхность дентального имплантата в субкрестальной части должна быть тщательно деконтаминирована и иметь матовую поверхность без чрезмерной гладкости, так как высокополированная поверхность менее желательна для контакта кости с имплантатом.
Ниже представлены случаи имплантопластики с использованием 12- и 30-гранных твердосплавных боров хирургической длины для деконтаминации и сглаживания как супра-, так и субкрестальной части поверхности дентального имплантата. Подтверждением того, что это может быть отличным методом для деконтаминации субкрестальной поверхности, служат рентгенографические и повторные данные, свидетельствующие о благоприятном приросте костной ткани через 12 месяцев и 10 месяцев соответственно.
Описание клинических случаев
Клинический случай 1
Женщина, 56 лет, была направлена на лечение по поводу дентального имплантата на месте правого клыка верхней челюсти 1.3. Диагноз: умеренный периимплантит подкатегории А (фото 1). Имплантат был установлен 3 года назад, заживление прошло без осложнений, но во время недавнего профилактического приема были отмечены нагноение и глубина кармана до 8 мм. В анамнезе пациентки был гипотиреоз, по поводу которого она принимала левотироксин, и аллергия на сульфоновые препараты. У нее была высокая линия улыбки, а дентальный имплантат был шириной 3 мм с анодированной поверхностью.
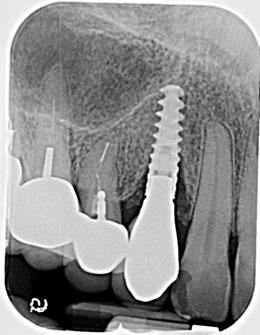
Фото 1: Предварительная рентгенограмма имплантата, правый клык верхней челюсти. Потеря костной ткани была отмечена с мезиальной и дистальной сторон.
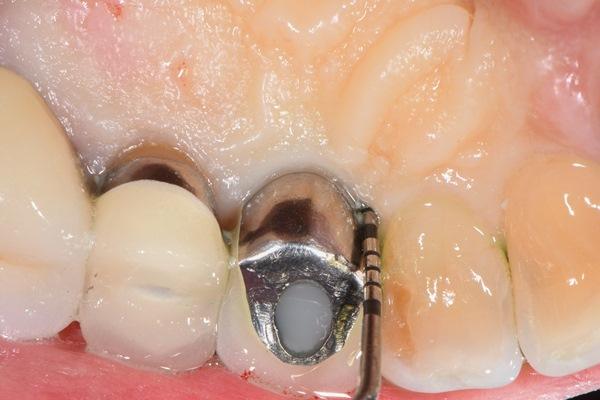
Автор (PSR) проводил первоначальное лечение с помощью иттрий-алюминиевого гранатового лазера, легированного неодимом (Nd:YAG). Однако к 6 месяцам это лечение не принесло улучшений, так как сохранялась глубина 8 мм с кровоточивостью (фото 2).
Фото 2: Предоперационный снимок имплантата с небной стороны, показывающий глубину зондирования 8 мм.
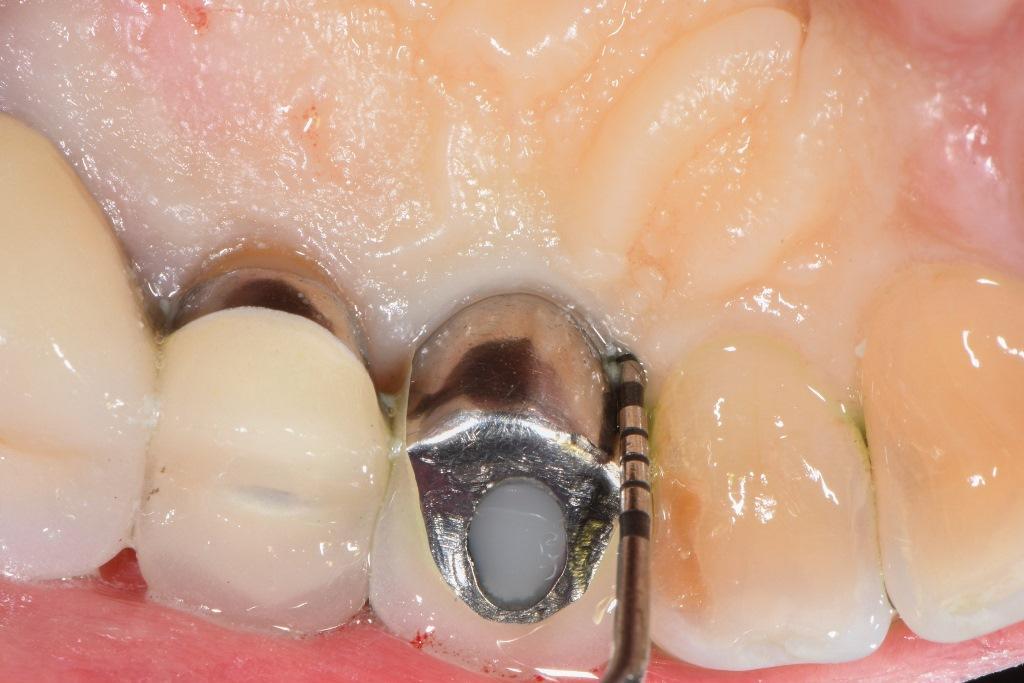
Был запланирован хирургический подход, включающий имплантопластику и направленную костную регенерацию. После проведения местной анестезии полнослойные лоскуты были подняты с использованием конвертного лоскута на буккальной стороне и треугольного лоскута на небе, чтобы обнажить дефекты. Удаление гранулематозной ткани позволило визуализировать узкое круговой очаг поражения на лицевой стороне (фото 3) и одно-двухстенный комбинированный дефект на небной стороне (фото 4). Сначала поверхность обрабатывалась 50%-ным раствором лимонной кислоты в течение 30 секунд, после чего тщательно промывалась стерильным физраствором. После этого была проведена имплантопластика с использованием 30-гранного бора хирургической длины. Поскольку имплантат был очень узким, добиться матовой поверхности было невозможно, поэтому целью было уменьшить резьбу и слегка удалить внешнюю поверхность имплантата, чтобы обнажить свежий титан (фото 5 и фото 6). Модифицированную поверхность снова обрабатывали лимонной кислотой и промывали стерильным физраствором.
Фото 3: На лицевой стороне имплантата был визуализирован узкий трехстенный внутрикостный дефект.
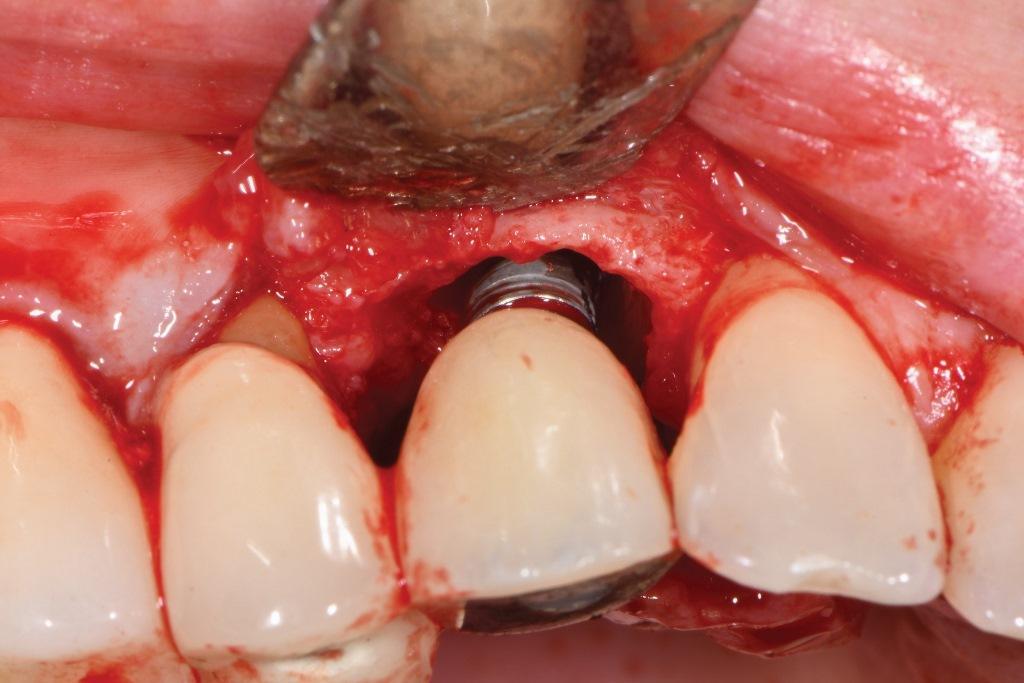
Фото 4: Двустенные костные поражения визуализировались с мезио- и дистопалатальной сторон. Черные следы на поверхности имплантата появились в результате предыдущей лазерной обработки.
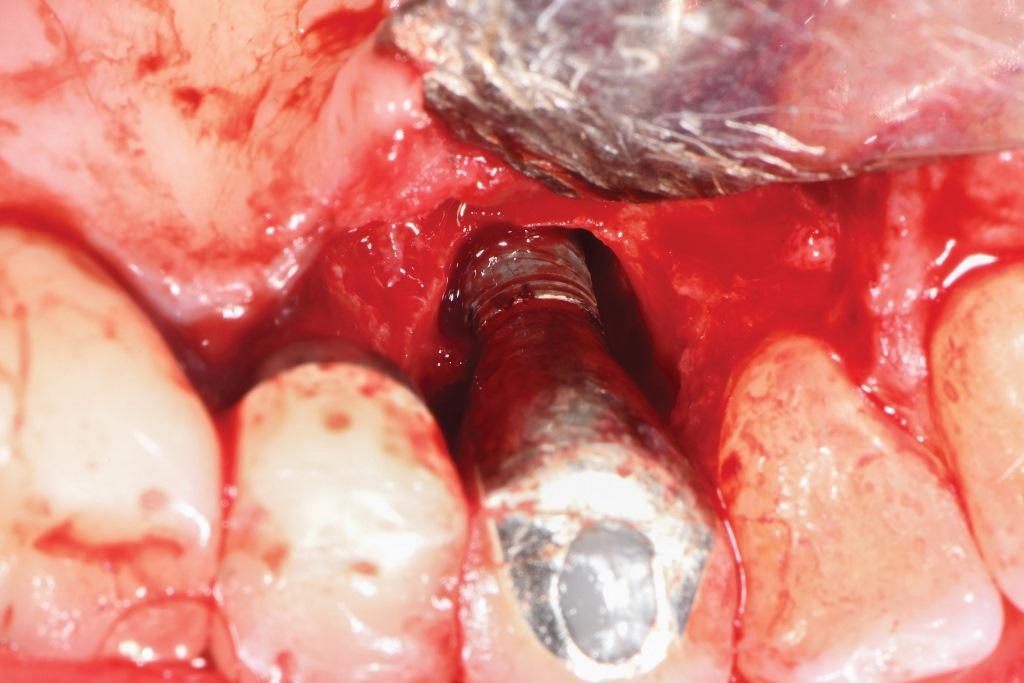
Фото 5: После проведения имплантопластики: вид со щечной стороны.
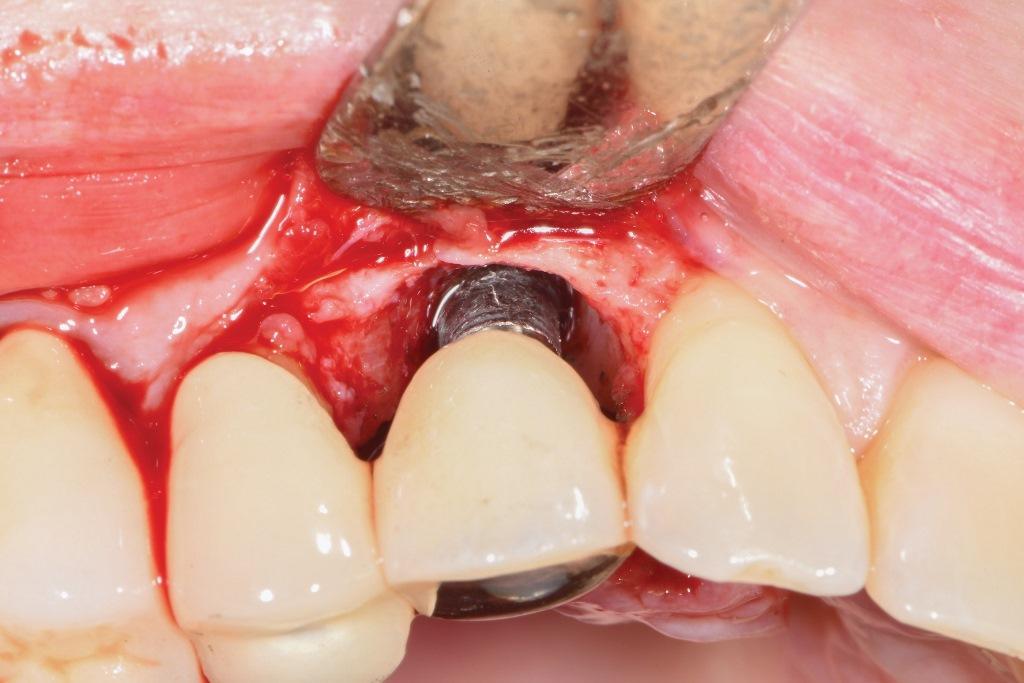
Фото 6: После проведения имлантопластики — уменьшение резьбы и модификация поверхности: вид с небной стороны.
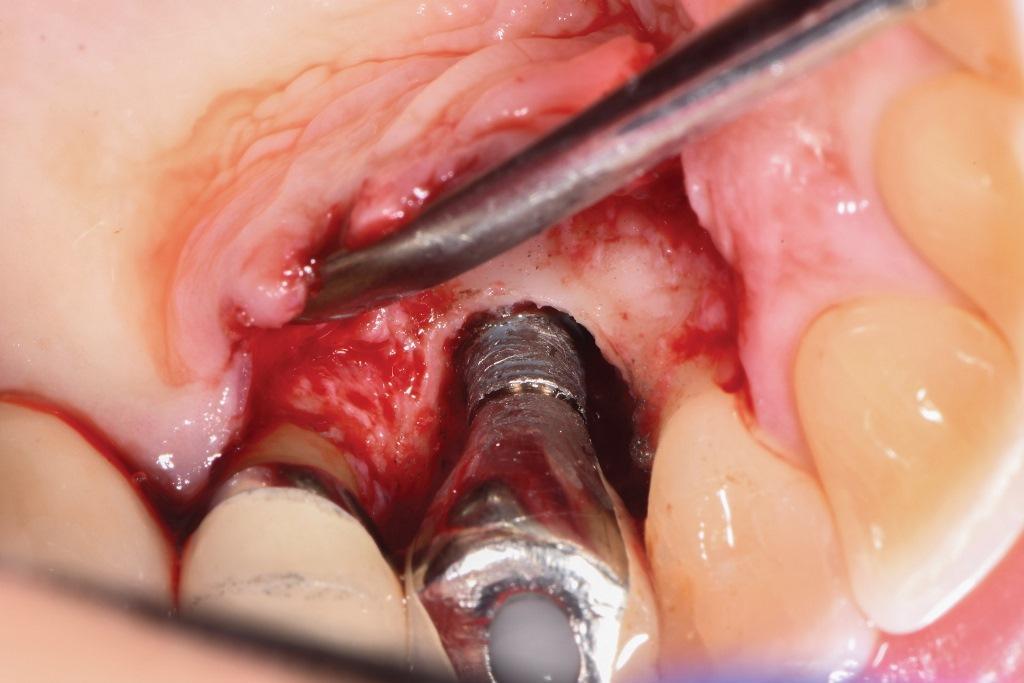
В дефект был помещен композитный аллотрансплантат, содержащий криоконсервированные деминерализованные лиофилизированные костные волокна со стружкой губчатой кости, содержащей мезенхимальные стволовые клетки (фото 7). Он был покрыт человеческой обезвоженной деэпителизированной мембраной амниона и хориона. Лоскуты были репозиционированы и зафиксированы швами из политетрафторэтилена (ПТФЭ) 5-0 с использованием прерывистой техники наложения швов.
Фото 7: Трансплантат, состоящий из деминерализованных лиофилизированных волокон и криоконсервированной минерализованной кости со стволовыми клетками, был установлен после протирания поверхности лимонной кислотой и промывания стерильным физраствором. Перед ушиванием лоскута трансплантат был покрыт мембраной амниона и хориона.
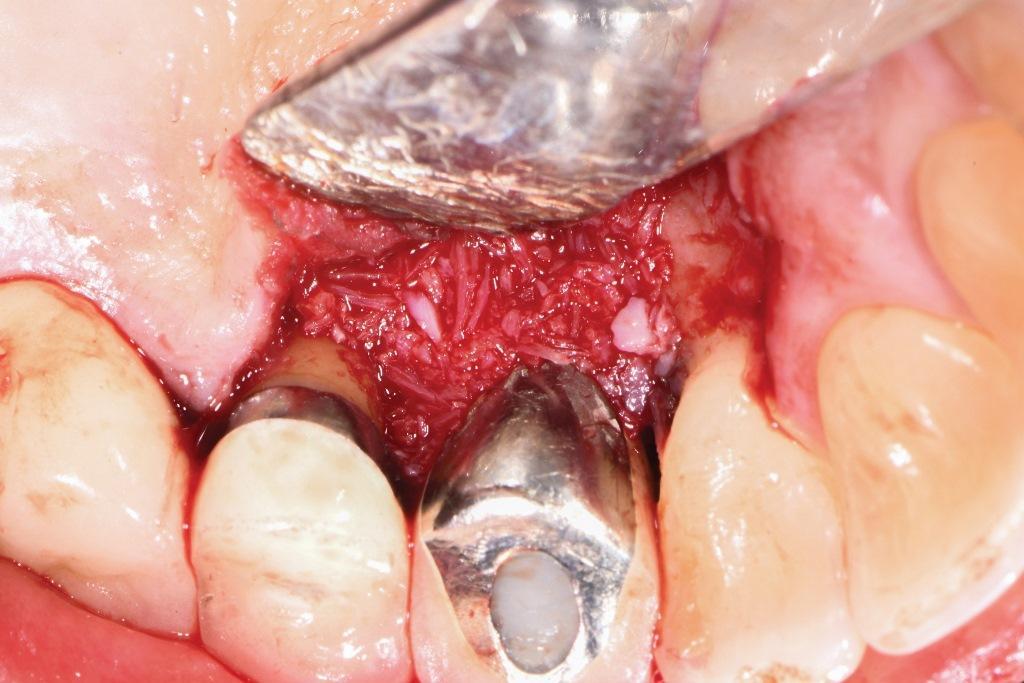
В целях инфекционного контроля пациентке назначили амоксициллин на первую неделю и посоветовали полоскать рот феноловым ополаскивателем в течение первых 3 месяцев. Пациентке было предписано воздержаться от механических усилий при проведении гигиены полости рта в течение первого месяца. В течение первого года она находилась под строгим послеоперационным наблюдением. Клинический осмотр через 1 год после операции выявил глубину зондирования снизилась с 8-9 мм на мезиальной и дистальной частях с небной стороны до 4 мм, без кровоточивости (фото 8), а периапикальная рентгенограмма показала благоприятный прирост костной ткани (фото 9).
Фото 8: Клиническая картина через 1 год после операции: вид со щечной стороны. Глубина зондирования теперь составляла 3 мм, без кровоточивости.
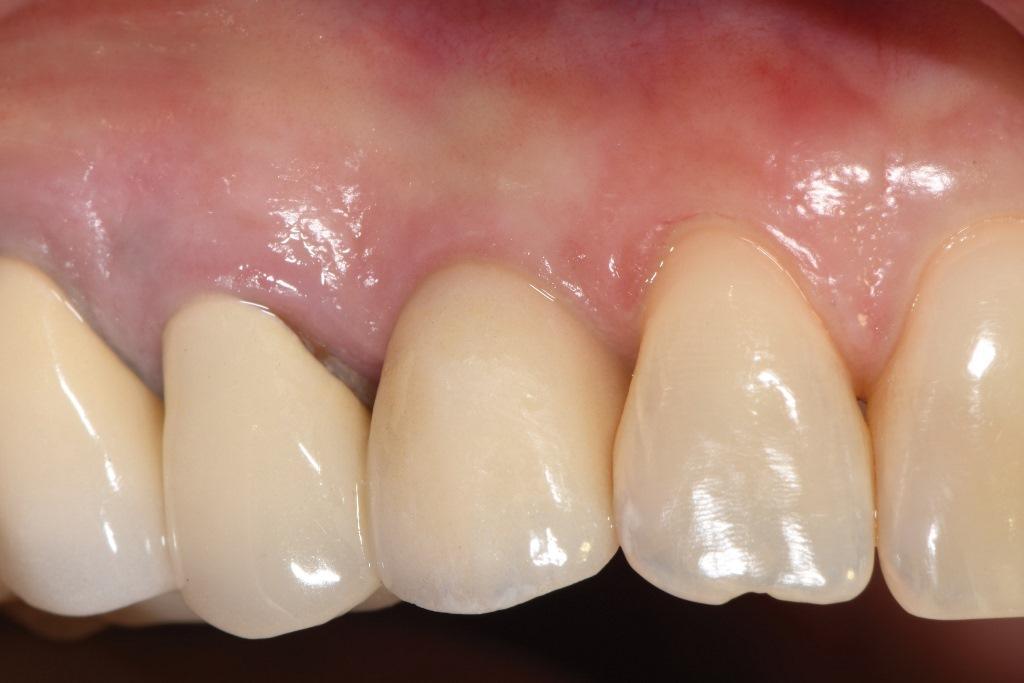
Фото 9: Рентгенограмма, сделанная через 1 год после операции, свидетельствует о благоприятном приросте костной ткани, достигнутом благодаря устранению внутрикостных поражений.
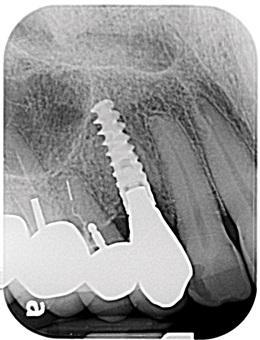
Клинический случай 2
Мужчина, 66 лет, был направлен на обследование и лечение по поводу дентального имплантата на месте правого первого моляра нижней челюсти 4.6, который был установлен и протезирован 9 лет назад. Стоматолог пациента отметил потерю костной ткани в области имплантата во время недавнего профилактического приема, проводимого раз в полгода. В анамнезе пациента была гипертония, по поводу которой он принимал лозартан и амлодопин, и повышенный уровень холестерина, по поводу которого он принимал розувастатин.
На основании клинического и рентгенографического обследования пациенту был поставлен диагноз умеренного периимплантита подкатегории А (фото 10 и фото 11). Глубина кармана у этого имплантата составляла до 9 мм. Был запланирован хирургический подход, включающий имплантопластику и направленную костную регенерацию.
Фото 10: Клиническая картина гнойного экссудата из дентального имплантата и воспаления десны.
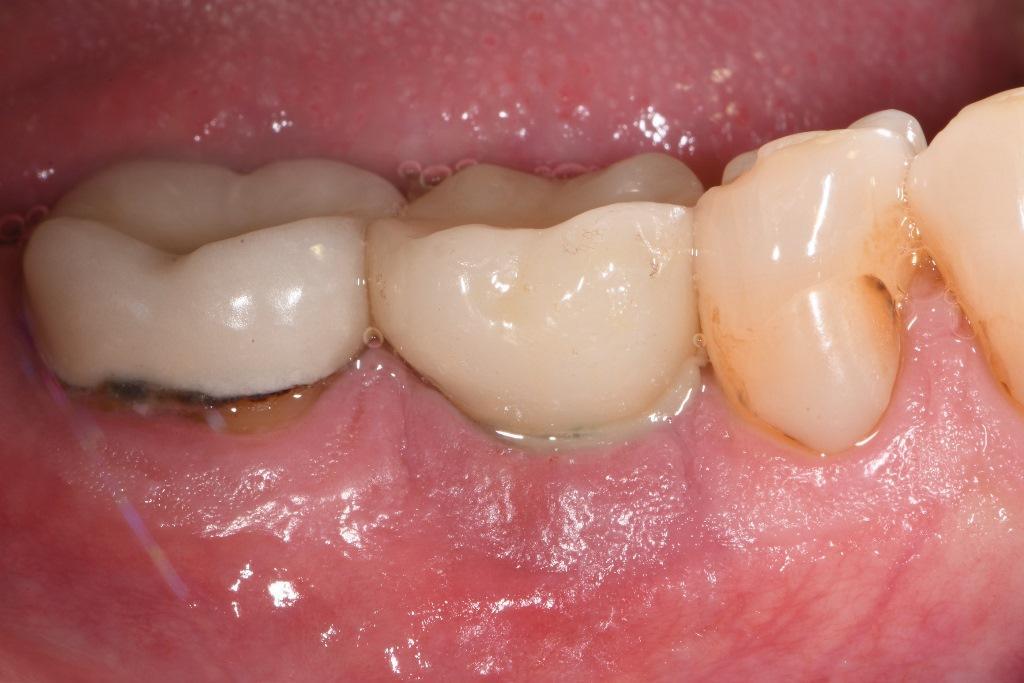
Фото 11: Рентгенограмма до лечения, демонстрирующая потерю костной ткани на правом первом моляре нижней челюсти.
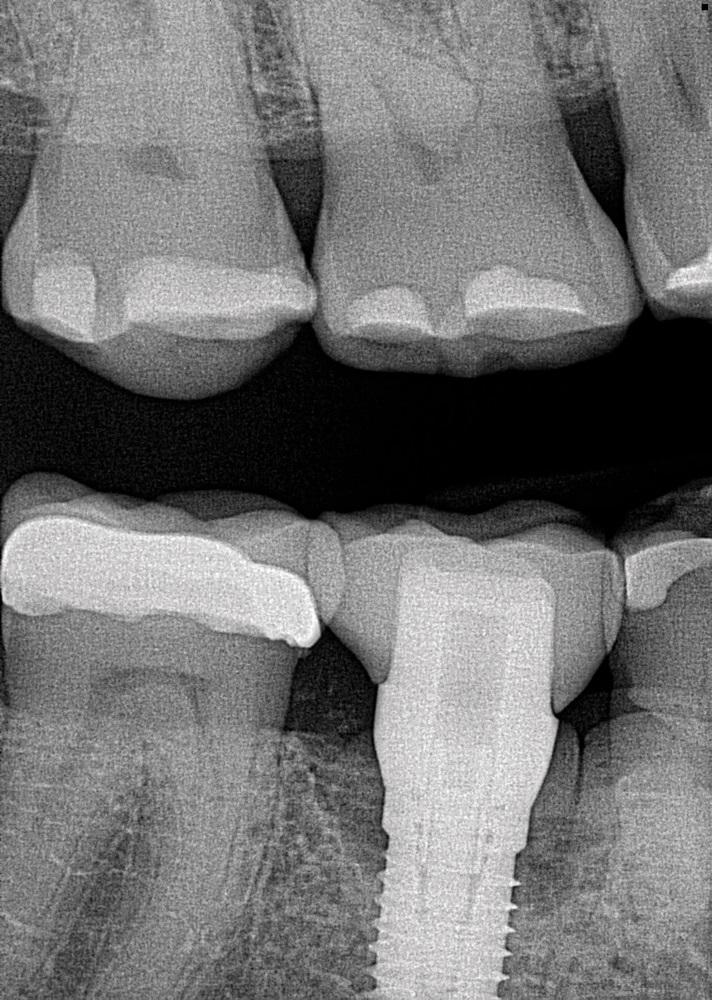
После проведения местной анестезии лоскуты полной толщины были откинуты от буккальной и язычной сторон зуба 4.3 до дистобуккальной и язычной сторон зуба 4.7. Удаление гранулематозной ткани с места установки имплантата позволило выявить комбинированное поражение с двумя стенками на дистальной стороне и двумя-тремя стенками на мезиальной стороне с круговой конфигурацией на язычной стороне (фото 12). Сначала поверхность обрабатывалась 50%-ным раствором лимонной кислоты в течение 30 секунд, после чего прижигалась ватными палочками и тщательно промывалась стерильным физраствором. После этого была проведена имплантопластика с использованием 12-гранных, а затем 30-гранных финиров хирургической длины, которые обеспечили доступ к основанию дефекта. Поскольку коронка была зафиксирована на цементе, что затрудняло доступ к ней, матовой поверхности добиться не удалось; поэтому целью было уменьшить резьбу и удалить внешнюю затронутую поверхность, чтобы обнажить свежий титан (фото 13). На этом этапе имплантат снова протирали лимонной кислотой и промывали стерильным физраствором.
Фото 12: Очаг поражения был выявлен при отражении лоскута. Трех- или двухстенный очаг поражения на мезиальной стороне заворачивался к язычной, а на дистальной стороне имелся двухстенный очаг поражения, который также распространялся на язычную сторону в виде углубления.
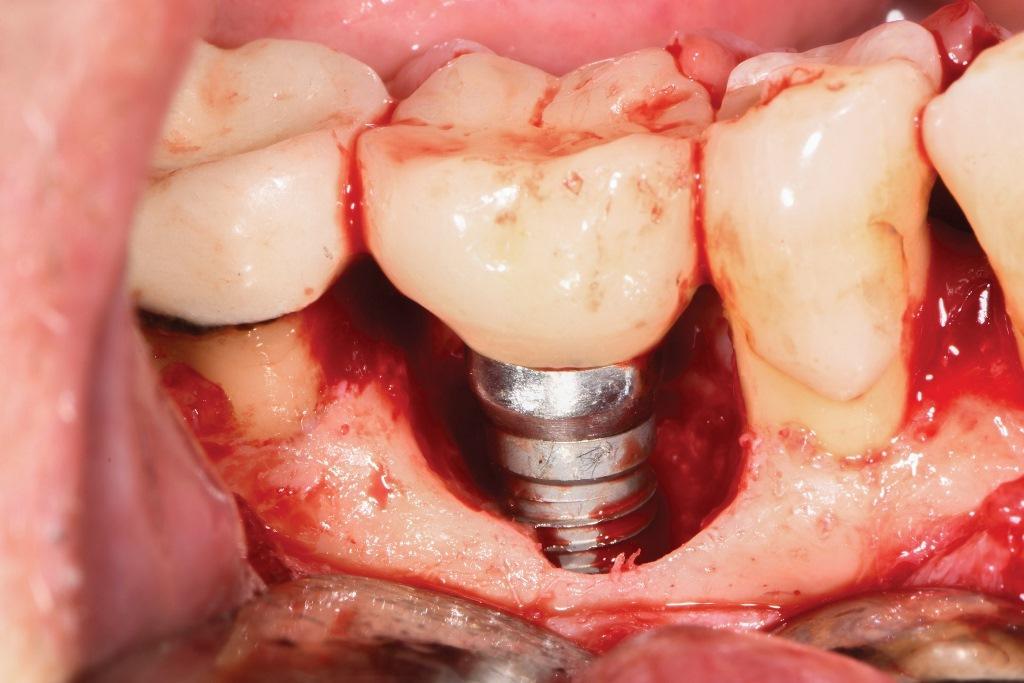
Фото 13: Имплантопластика завершена. Кровотечение с дистальной стороны заслонило один виток резьбы, который невозможно было подвергнуть процедуре. Перед установкой поверхность протирали лимонной кислотой.
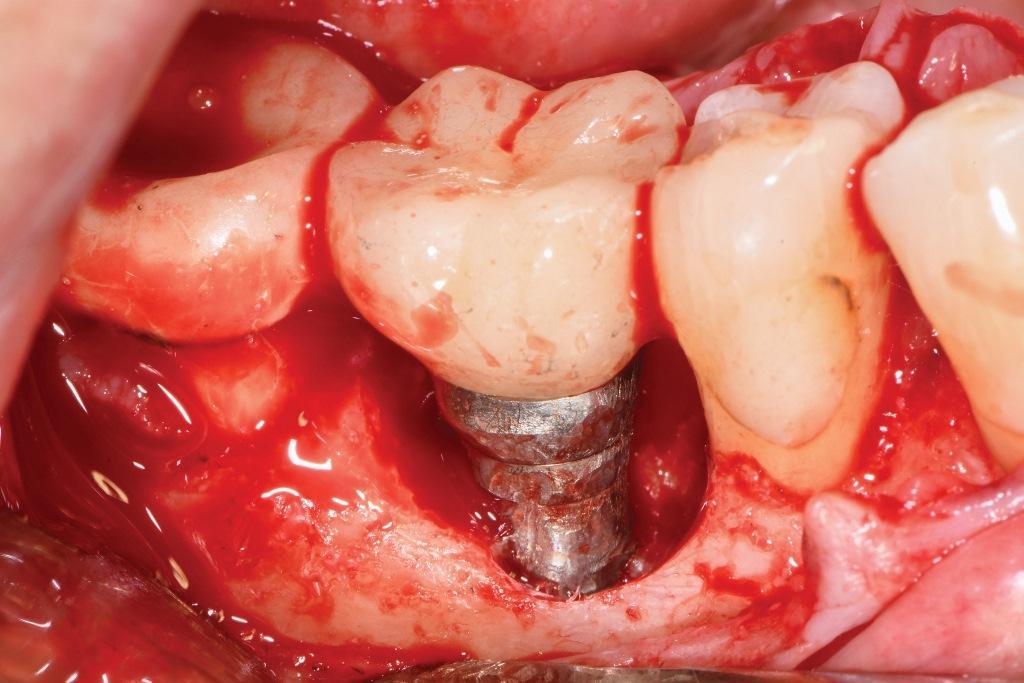
Как и в первом случае, в дефект был помещен композитный аллотрансплантат, содержащий криоконсервированные деминерализованные лиофилизированные костные волокна со стружкой губчатой кости, содержащей мезенхимальные стволовые клетки (фото 14). Он был покрыт мембраной амниона и хориона. Лоскуты были репозиционированы и зафиксированы швами из ПТФЭ 5-0 с использованием прерывистой техники наложения швов.
Фото 14: В место установки был помещен трансплантат, состоящий из деминерализованных сублимированных волокон и криоконсервированной минерализованной костной ткани со стволовыми клетками. Перед ушиванием лоскута трансплантат был покрыт мембраной амниона и хориона.
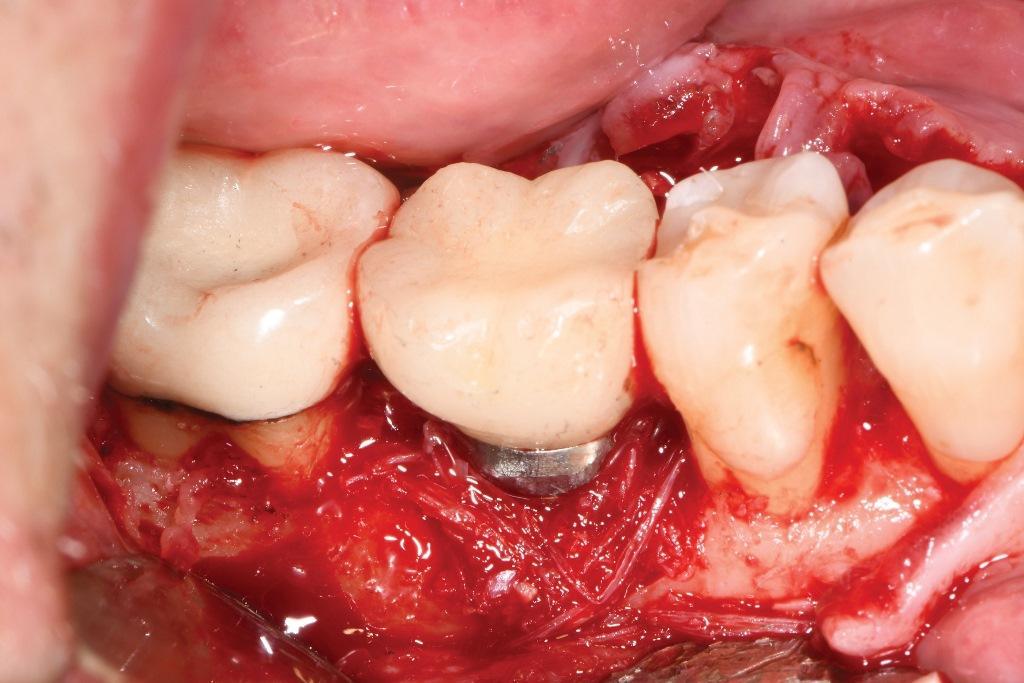
В целях инфекционного контроля пациенту назначили амоксициллин на первую неделю и предписали полоскать рот феноловым ополаскивателем в течение первых 3 месяцев. Пациенту было предписано воздержаться от механических усилий при проведении гигиены полости рта в течение первого месяца. В течение первых 10 месяцев он находился под строгим послеоперационным наблюдением.
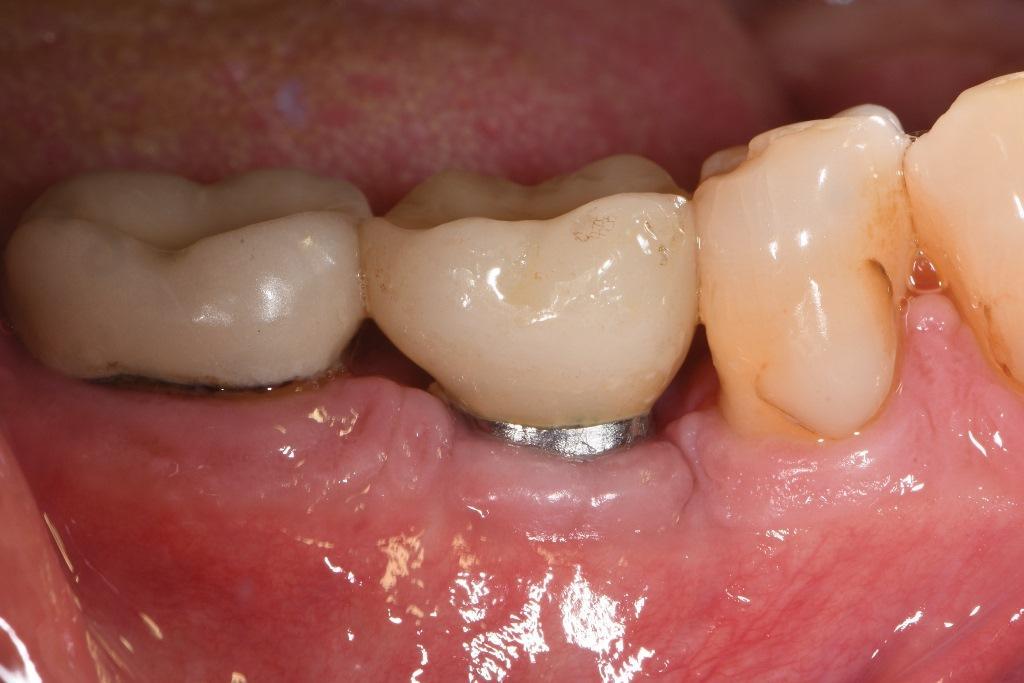
Через 10 месяцев (фото 15) было решено изменить фенотип путем размещения бесклеточного дермального матрикса (БДМ) для увеличения толщины мягких тканей. При раскрытии участка можно было визуализировать костное замещение, произошедшее на мезиальной внутрикостной стороне (фото 16), и там, где было неполное удаление резьбы на дистальной стороне, эта область была слегка изменена с помощью боров для имплантопластики. Аллотрансплантат БДМ был помещен и зафиксирован хромированным кетгутовым шовным материалом 5-0 с использованием прерывистой техники наложения шва (фото 17), а лоскуты были зафиксированы ПТФЭ 5-0. Через 15 месяцев после операции глубина зондирования составляла до 4 мм, кровоточивость отсутствовала, а фенотип изменился в лучшую сторону (фото 18).
Фото 15: Заживление через 10 месяцев после операции. Хотя сейчас ткань десны стала тоньше, чем до операции, она выглядела более здоровой.
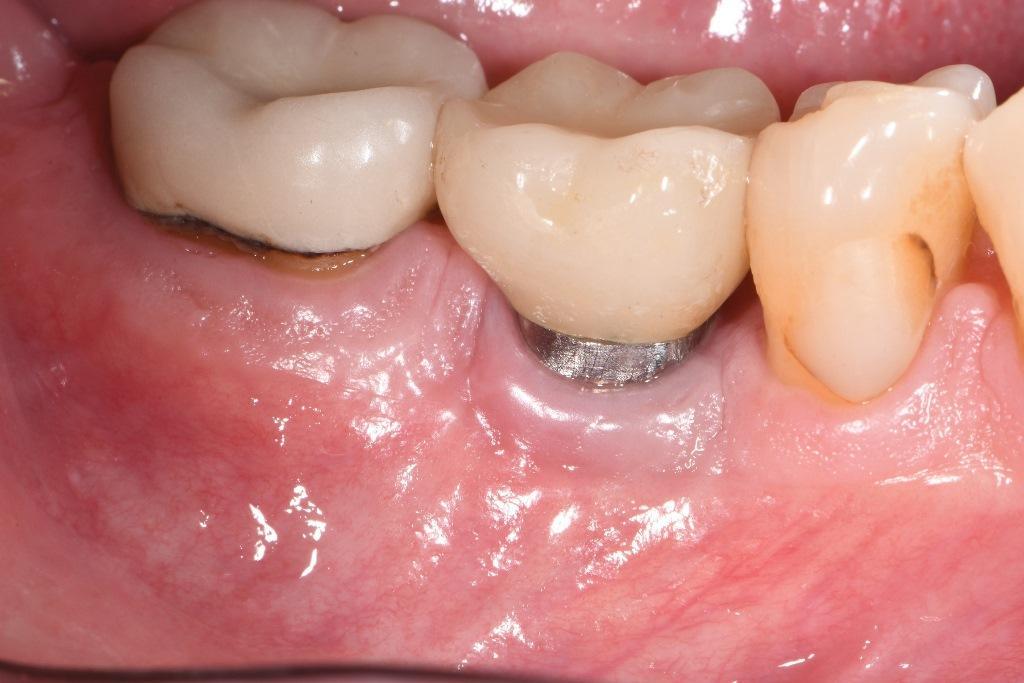
Фото 16: Участок был открыт для размещения бесклеточного дермального трансплантата для улучшения фенотипа. Обратите внимание на заполнение твердыми тканями мезиальной стороны очага поражения, которая распространялась на язычную. Один виток резьбы рядом с костью с дистальной стороны был удален с помощью имплантопластики.
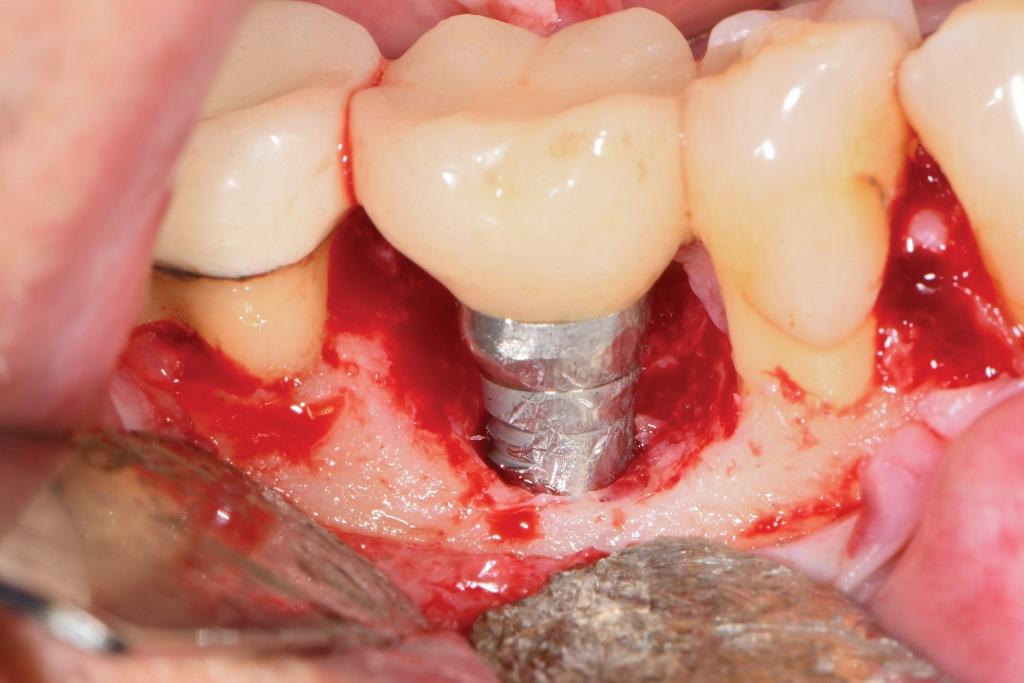
Фото 17: Бесклеточную дерму закрепляли хромированным кетгутовым шовным материалом 5-0.
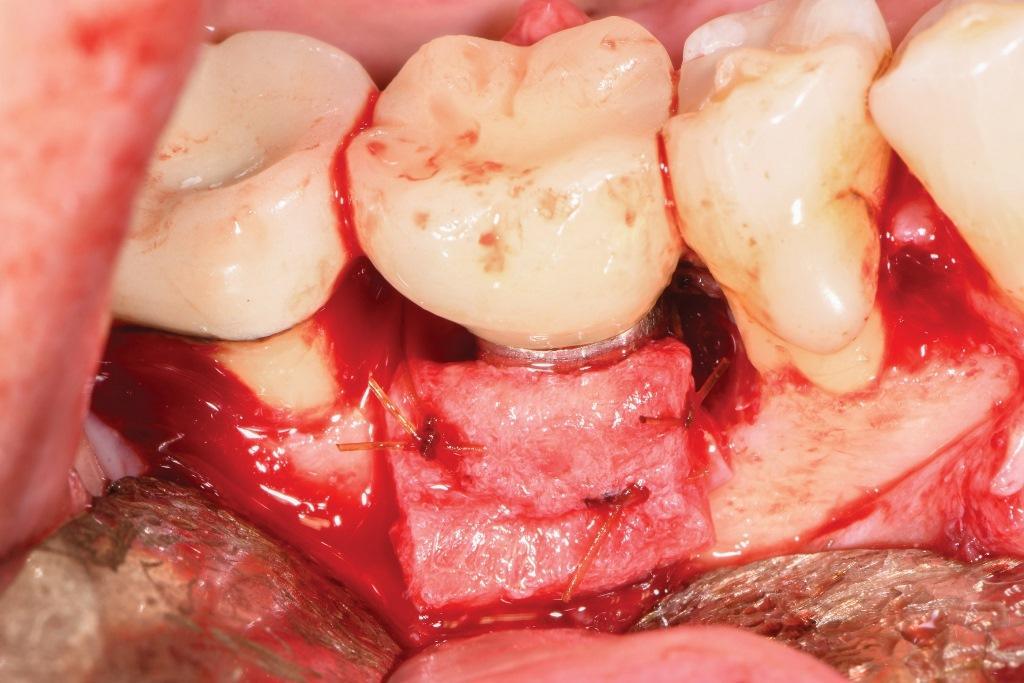
Фото 18: Через 15 месяцев после операции: вид со щечной стороны. Здоровье места установки было восстановлено: глубина зондирования в основном составляла 4 мм, кровоточивость отсутствовала. Произошла некоторая рецессия десны с интерпроксимальной и вестибулярной сторон.
Обсуждение
Два представленных клинических случая демонстрируют успех, которого можно достичь с помощью имплантопластики для деконтаминации всей поверхности дентального имплантата. Отличие этого подхода от предыдущих заключается в том, что модификация поверхности, использованная в этих случаях в попытке достичь повторной остеоинтеграции, распространялась на всю глубину внутрикостных поражений пациентов. Несколько статей в литературе с гистологическими данными показывают, что регенерация может быть достижимым результатом для имплантатов, подвергшихся воздействию периимплантита. Хотя в этих трех случаях использовались различные протоколы обработки поверхности, их объединяло то, что супраструктура/коронка удалялась, чтобы получить доступ для очистки всех сторон поверхности. Однако удаление супраструктуры/коронки не всегда возможно, так как некоторые коронки зафиксированы на цементе, и если их удалить, то потребуется замена. Преимущество более длинных боров длиной 30 мм из набора боров, использованных в данном случае, заключается в том, что они обеспечивают лучший доступ благодаря разнообразию форм, достигая даже субкрестальных частей дефекта, что невозможно при наличии коронок, которые нельзя удалить. Хотя это и не мешает добиться абсолютно матового покрытия поверхности имплантата, тот факт, что резьба и внешняя часть уменьшаются/удаляются, облегчает деконтаминацию.
El Chaar et al. использовали сканирующую электронную микроскопию для оценки различных химиотерапевтических и механических методов деконтаминации поверхности инфицированных дентальных имплантатов, удаленных у людей. Они отметили, что химические вещества не помогли удалить биологические остатки. Воздушная абразия частицами, лазер и титановая щетка удалили часть биологических остатков, а имплантопластика обеспечила полное удаление биологических остатков. В исследовании Htet et al. на собаках породы бигль с периимплантитом, вызванным лигатурой, сравнивались различные методы, используемые для обеззараживания поверхностей дентальных имплантатов с анодированной поверхностью. Авторы оценили результаты клинических, рентгенологических, гистологических исследований и гистоморфометрии и обнаружили, что использование бора и комбинированного использования бора и лимонной кислоты позволяет достичь результатов, которые эквивалентны, если не лучше, чем при использовании других методов деконтаминации поверхности.
Используя чрезвычайно сложную восьмиэтапную методологию деконтаминации поверхности перед костной пластикой, Froum et al. продемонстрировали успешные клинические результаты регенерации при наблюдении от 2 до 10 лет32, хотя небольшая группа пациентов в группе пролеченных пациентов в серии случаев потребовала повторного обследования для сохранения их дентальных имплантатов, и несколько имплантатов были потеряны. Несмотря на способность этого восьмиэтапного алгоритма обеспечить успешную деконтаминацию in vitro, для улучшения предсказуемости деконтаминации может потребоваться агрессивный физический подход, как отметили в своей статье El Chaar et al. Некоторые из неоптимальных результатов в исследовании Froum et al., возможно, были получены из-за трудности доступа к поверхности имплантата, особенно в очагах поражения костной ткани с более узкой морфологией или там, где было бы чрезвычайно трудно достичь и модифицировать более апикальную протяженность дефектов.
Разрушение при периимплантите приводит к образованию костных дефектов с самой разнообразной морфологией. Многие из этих очагов поражения содержат внутрикостный компонент с множеством стенок, что позволяет рассматривать регенеративный подход как часть лечения. Chan и коллеги провели систематический обзор и мета-анализ различных хирургических подходов к лечению периимплантита, включая доступ через лоскут и кюретаж, хирургическую резекцию, применение материалов для костной пластики и направленную костную регенерацию. В рамках систематического обзора авторы пришли к выводу, что применение трансплантационных материалов и барьерных мембран привело к большему уменьшению глубины зондирования и увеличению объема костной ткани на рентгенограммах. Однако они отметили, что для подтверждения этого утверждения не хватает высококачественных сравнительных исследований. Имплантопластика может быть использована для достижения поверхности без бактериального загрязнения как в супра-, так и в субкрестальном компонентах дефекта при периимплантите и, таким образом, обеспечить единый способ обработки всей поверхности имплантата. Это позволяет хирургу использовать регенеративный подход к субкрестальной области, даже при самых узких дефектах, не прибегая при этом к резекционному лечению, которое может привести к тому, что тело имплантата окажется более подверженным воздействию окружающей среды в полости рта. Финишные боры, используемые в данных клинических случаях, эффективны для удаления/уменьшения резьбы имплантата и создания более матовой поверхности имплантата, которая не является слишком гладкой, что желательно, поскольку сильно отполированная поверхность конца менее подходит для контакта кости с имплантатом. Удаление коронки имплантата обеспечивает оптимальный доступ для удаления резьбы и сглаживания поверхности (фото 19) и позволяет проводить заживление в закрытой среде. Использование боров с большей хирургической длиной и разнообразными формами обеспечивает более широкий доступ ко всем сторонам тела имплантата по сравнению с тем, что обычно было доступно в прошлом. Более того, использование как 12-, так и 30-гранных боров является целесообразным, учитывая, что имплантаты из титана класса 5 могут потребовать меньшего количества граней для уменьшения внешней поверхности имплантата, а 30-гранные боры могут помочь избежать чрезмерного уменьшения имплантатов узкого диаметра, как это наблюдается в Клиническом случае 1.
Фото 19: Сравнение дентального имплантата до (слева) и после (справа) имплантопластики. Возможность снять коронку и установить формирователь десны позволила улучшить доступ для достижения поверхности основания дефекта при периимплантите, по структуре схожей с механически обработанной.
Как и любая другая методика, имплантопластика имеет потенциальные недостатки. Во-первых, целенаправленное удаление титановой поверхности и резьбы для деконтаминации имплантата может представлять риск его будущего разрушения. Costa-Berenguer et al. рассмотрели возможность разрушения после имплантопластики с помощью испытаний на стойкость к механическому разрушению in vitro для дентальных имплантатов стандартного диаметра с внешним шестигранником, изготовленных из титана 4-го класса. Они отметили, что, несмотря на техническую сложность и трудоемкость, имплантопластика, по-видимому, не приводит к значительному изменению сопротивления разрушению этих дентальных имплантатов из-за усталости. Кроме того, в отличие от ранних дентальных имплантатов, которые изготавливались из коммерчески чистого титана марки 1, современные имплантаты изготавливаются из титана марок 3, 4 и 5 или сплава титана и диоксида циркония, которые более твердые и менее подвержены разрушению. Тем не менее, для имплантатов более узкого диаметра, как это было в Клиническом случае 1, лечащий врач может рассмотреть возможность минимального уменьшения поверхности имплантата, что может означать уменьшение резьбы до более плоского рельефа, а не ее удаление, и только легкий кюретаж поверхности, а не придание ей матовости. Химиотерапия, например, применение лимонной кислоты, может быть рассмотрена в сочетании с имплантопластикой, особенно в области регенерации, поскольку более агрессивная имплантопластика не проводится при использовании имплантата более узкого диаметра.
Еще одной проблемой при имплантопластике является возможность дисперсии титановых гранул в процессе сглаживания. Исследования показали связь между частицами титана и разрушением дентальных имплантатов. Эта дисперсия может быть вызвана не только такими факторами, как микродвижение абатмента, но и возникать в любое время на протяжении всего процесса, в том числе при установке дентального имплантата. Необходимо обеспечить удаление как можно большего количества образовавшихся твердых частиц; один из способов сделать это — слегка провести бором для имплантопластики по поверхности кости с обильным орошением.
Заключение
В этой статье продемонстрировано использование имплантопластики в качестве средства деконтаминации поверхности дентального имплантата под гребнем кости в дополнение к ее историческому применению супракрестально при проведении регенеративной терапии. Цель в двух представленных случаях состояла в том, чтобы создать поверхность, которая была бы свободна от загрязнений, что обеспечило бы повторную остеоинтеграцию, а также улучшило возможность очищения как пациентом, так и коллегами-стоматологами. Насколько известно авторам, это первый случай в литературе, когда имплантопластика была использована подобным образом и продемонстрировала потенциальную регенеративную эффективность. Необходимы дальнейшие исследования, чтобы определить применимость этой методики к более широкой когорте пациентов, обслуживаемых большим числом лечащих врачей.
Авторы:
Paul S. Rosen, DMD, MS
Dennis P. Tarnow, DDS
Имплантопластика — это метод обработки дентальных имплантатов, которые не справляются со своей функцией из-за периимплантита. Традиционно имплантопластика используется в сочетании с резекционным подходом или как средство сглаживания той части зубного имплантата, которая находится над костью, чтобы способствовать поддержанию гигиены полости рта. В результате этой процедуры поверхность пострадавшего дентального имплантата легче очищается при проведении профилактических манипуляций и создается поверхность для прилегания как мягких, так и твердых тканей, что потенциально делает ее оптимальной методикой для лечения периимплантита. В данной статье представлены два случая, демонстрирующие использование имплантопластики для деконтаминации поверхности дентального имплантата как над, так и под костным гребнем в попытке возобновить остеоинтеграцию несостоятельного имплантата.

Несмотря на то, что для лечения периимплантита было предложено множество методов, не существует единого мнения о наилучшем подходе к этой проблеме. Обзор литературы показывает, что для устранения периимплантита традиционно используются противоинфекционные подходы, при этом усилия направлены на удаление дисбиотической бактериальной биопленки. Нехирургические методы обычно оказываются неэффективными, скорее всего, из-за невозможности получить доступ и должным образом провести деконтаминацию поверхности имплантата. Также были предложены подходы с открытыми лоскутами, как с различными вариантами деконтаминации поверхности и регенеративными протоколами, так и без них. Хотя некоторые из этих подходов к хирургическому доступу были успешными, достижение благоприятного результата осложняется по нескольким причинам. Доступ может быть затруднен из-за глубины некоторых поражений и узости внутрикостного компонента, что затрудняет возможность надлежащей очистки/деконтаминации всей поверхности имплантата. Таким образом, управление сложной микрогеометрией многих из этих шероховатых поверхностей практически невозможно. Поверхности многих имплантатов расположены за пределами внутрикостного дефекта, выходящего за пределы буккальной или язычной части кости. Это может быть частично связано с расположением имплантата при его установке или, возможно, обусловлено продолжающимся черепно-лицевым ростом и развитием. В таких случаях использование регенеративного или только лоскутного метода без модификации поверхности может не остановить развитие патологии и привести к обнажению резьбы и шероховатой поверхности имплантата.
Резекционные подходы — это еще один метод, используемый для лечения периимплантита. Среди лечащих врачей распространено мнение, что инструменты, используемые для очистки внешней поверхности дентального имплантата, неадекватны, поскольку они не могут очистить ее от налета, зубного камня и эндотоксинов, и нет исследований, в которых бы подробно рассматривалась эффективность удаления налета с поверхности такими инструментами (например, скалерами). Чтобы лучше выполнить эту задачу, можно использовать высокоскоростные наконечники для удаления внешней затронутой поверхности, оставляя имплантат в состоянии, которое более приближено к микрошероховатости оригинального обработанного имплантата. Romeo и коллеги одними из первых сообщили об успехе имплантопластики, а 3-летнее наблюдение подтвердило, что она помогает остановить развитие периимплантита. Имплантопластика поверхности проводилась в сочетании с резекционной терапией, и не было никаких признаков внутрикостного поражения во время лечения или после него. Schwarz et al. выступают за использование имплантопластики, но только для супракрестального компонента, как части комплексного ухода за дентальным имплантатом. Целью имплантопластики является достижение высокополированной поверхности, которая ограничит прилипание зубного налета и поможет облегчить соблюдение гигиены полости рта пациента. Этот алгоритм также включает в себя пересадку мягких тканей и регенеративную терапию. Любой внутрикостный компонент устанавливаемого имплантата подвергается механической детоксикации поверхности, которая может включать использование кюрет, ультразвуковых инструментов, титановых или никель-титановых щеток или воздушно-абразивных устройств. После удаления видимого зубного камня и биопленки проводится химическая детоксикация с помощью лимонной кислоты, перекиси водорода или этилендиаминтетрауксусной кислоты (ЭДТА).
Esteves Lima et al. недавно провели исчерпывающий систематический обзор литературы и мета-анализ по использованию имплантопластики и пришли к выводу, что существуют некоторые доказательства, позволяющие рекомендовать ее в качестве потенциального метода лечения периимплантита. Учитывая сложную морфологию многих очагов периимплантита, существует необходимость в комбинированном подходе, при котором выполняется как резекция, так и регенерация. Поскольку имплантопластика может обеспечить результат, при котором пораженную поверхность дентального имплантата легче очистить с помощью профилактических манипуляций, а также обеспечить поверхность для прикрепления мягких и твердых тканей, эта процедура может быть оптимальным методом лечения периимплантита. Поверхность дентального имплантата в субкрестальной части должна быть тщательно деконтаминирована и иметь матовую поверхность без чрезмерной гладкости, так как высокополированная поверхность менее желательна для контакта кости с имплантатом.
Ниже представлены случаи имплантопластики с использованием 12- и 30-гранных твердосплавных боров хирургической длины для деконтаминации и сглаживания как супра-, так и субкрестальной части поверхности дентального имплантата. Подтверждением того, что это может быть отличным методом для деконтаминации субкрестальной поверхности, служат рентгенографические и повторные данные, свидетельствующие о благоприятном приросте костной ткани через 12 месяцев и 10 месяцев соответственно.
Описание клинических случаев
Клинический случай 1
Женщина, 56 лет, была направлена на лечение по поводу дентального имплантата на месте правого клыка верхней челюсти 1.3. Диагноз: умеренный периимплантит подкатегории А (фото 1). Имплантат был установлен 3 года назад, заживление прошло без осложнений, но во время недавнего профилактического приема были отмечены нагноение и глубина кармана до 8 мм. В анамнезе пациентки был гипотиреоз, по поводу которого она принимала левотироксин, и аллергия на сульфоновые препараты. У нее была высокая линия улыбки, а дентальный имплантат был шириной 3 мм с анодированной поверхностью.
Фото 1: Предварительная рентгенограмма имплантата, правый клык верхней челюсти. Потеря костной ткани была отмечена с мезиальной и дистальной сторон.

Автор (PSR) проводил первоначальное лечение с помощью иттрий-алюминиевого гранатового лазера, легированного неодимом (Nd:YAG). Однако к 6 месяцам это лечение не принесло улучшений, так как сохранялась глубина 8 мм с кровоточивостью (фото 2).
Фото 2: Предоперационный снимок имплантата с небной стороны, показывающий глубину зондирования 8 мм.

Был запланирован хирургический подход, включающий имплантопластику и направленную костную регенерацию. После проведения местной анестезии полнослойные лоскуты были подняты с использованием конвертного лоскута на буккальной стороне и треугольного лоскута на небе, чтобы обнажить дефекты. Удаление гранулематозной ткани позволило визуализировать узкое круговой очаг поражения на лицевой стороне (фото 3) и одно-двухстенный комбинированный дефект на небной стороне (фото 4). Сначала поверхность обрабатывалась 50%-ным раствором лимонной кислоты в течение 30 секунд, после чего тщательно промывалась стерильным физраствором. После этого была проведена имплантопластика с использованием 30-гранного бора хирургической длины. Поскольку имплантат был очень узким, добиться матовой поверхности было невозможно, поэтому целью было уменьшить резьбу и слегка удалить внешнюю поверхность имплантата, чтобы обнажить свежий титан (фото 5 и фото 6). Модифицированную поверхность снова обрабатывали лимонной кислотой и промывали стерильным физраствором.
Фото 3: На лицевой стороне имплантата был визуализирован узкий трехстенный внутрикостный дефект.

Фото 4: Двустенные костные поражения визуализировались с мезио- и дистопалатальной сторон. Черные следы на поверхности имплантата появились в результате предыдущей лазерной обработки.

Фото 5: После проведения имплантопластики: вид со щечной стороны.

Фото 6: После проведения имлантопластики — уменьшение резьбы и модификация поверхности: вид с небной стороны.

В дефект был помещен композитный аллотрансплантат, содержащий криоконсервированные деминерализованные лиофилизированные костные волокна со стружкой губчатой кости, содержащей мезенхимальные стволовые клетки (фото 7). Он был покрыт человеческой обезвоженной деэпителизированной мембраной амниона и хориона. Лоскуты были репозиционированы и зафиксированы швами из политетрафторэтилена (ПТФЭ) 5-0 с использованием прерывистой техники наложения швов.
Фото 7: Трансплантат, состоящий из деминерализованных лиофилизированных волокон и криоконсервированной минерализованной кости со стволовыми клетками, был установлен после протирания поверхности лимонной кислотой и промывания стерильным физраствором. Перед ушиванием лоскута трансплантат был покрыт мембраной амниона и хориона.

В целях инфекционного контроля пациентке назначили амоксициллин на первую неделю и посоветовали полоскать рот феноловым ополаскивателем в течение первых 3 месяцев. Пациентке было предписано воздержаться от механических усилий при проведении гигиены полости рта в течение первого месяца. В течение первого года она находилась под строгим послеоперационным наблюдением. Клинический осмотр через 1 год после операции выявил глубину зондирования снизилась с 8-9 мм на мезиальной и дистальной частях с небной стороны до 4 мм, без кровоточивости (фото 8), а периапикальная рентгенограмма показала благоприятный прирост костной ткани (фото 9).
Фото 8: Клиническая картина через 1 год после операции: вид со щечной стороны. Глубина зондирования теперь составляла 3 мм, без кровоточивости.

Фото 9: Рентгенограмма, сделанная через 1 год после операции, свидетельствует о благоприятном приросте костной ткани, достигнутом благодаря устранению внутрикостных поражений.

Клинический случай 2
Мужчина, 66 лет, был направлен на обследование и лечение по поводу дентального имплантата на месте правого первого моляра нижней челюсти 4.6, который был установлен и протезирован 9 лет назад. Стоматолог пациента отметил потерю костной ткани в области имплантата во время недавнего профилактического приема, проводимого раз в полгода. В анамнезе пациента была гипертония, по поводу которой он принимал лозартан и амлодопин, и повышенный уровень холестерина, по поводу которого он принимал розувастатин.
На основании клинического и рентгенографического обследования пациенту был поставлен диагноз умеренного периимплантита подкатегории А (фото 10 и фото 11). Глубина кармана у этого имплантата составляла до 9 мм. Был запланирован хирургический подход, включающий имплантопластику и направленную костную регенерацию.
Фото 10: Клиническая картина гнойного экссудата из дентального имплантата и воспаления десны.

Фото 11: Рентгенограмма до лечения, демонстрирующая потерю костной ткани на правом первом моляре нижней челюсти.

После проведения местной анестезии лоскуты полной толщины были откинуты от буккальной и язычной сторон зуба 4.3 до дистобуккальной и язычной сторон зуба 4.7. Удаление гранулематозной ткани с места установки имплантата позволило выявить комбинированное поражение с двумя стенками на дистальной стороне и двумя-тремя стенками на мезиальной стороне с круговой конфигурацией на язычной стороне (фото 12). Сначала поверхность обрабатывалась 50%-ным раствором лимонной кислоты в течение 30 секунд, после чего прижигалась ватными палочками и тщательно промывалась стерильным физраствором. После этого была проведена имплантопластика с использованием 12-гранных, а затем 30-гранных финиров хирургической длины, которые обеспечили доступ к основанию дефекта. Поскольку коронка была зафиксирована на цементе, что затрудняло доступ к ней, матовой поверхности добиться не удалось; поэтому целью было уменьшить резьбу и удалить внешнюю затронутую поверхность, чтобы обнажить свежий титан (фото 13). На этом этапе имплантат снова протирали лимонной кислотой и промывали стерильным физраствором.
Фото 12: Очаг поражения был выявлен при отражении лоскута. Трех- или двухстенный очаг поражения на мезиальной стороне заворачивался к язычной, а на дистальной стороне имелся двухстенный очаг поражения, который также распространялся на язычную сторону в виде углубления.

Фото 13: Имплантопластика завершена. Кровотечение с дистальной стороны заслонило один виток резьбы, который невозможно было подвергнуть процедуре. Перед установкой поверхность протирали лимонной кислотой.

Как и в первом случае, в дефект был помещен композитный аллотрансплантат, содержащий криоконсервированные деминерализованные лиофилизированные костные волокна со стружкой губчатой кости, содержащей мезенхимальные стволовые клетки (фото 14). Он был покрыт мембраной амниона и хориона. Лоскуты были репозиционированы и зафиксированы швами из ПТФЭ 5-0 с использованием прерывистой техники наложения швов.
Фото 14: В место установки был помещен трансплантат, состоящий из деминерализованных сублимированных волокон и криоконсервированной минерализованной костной ткани со стволовыми клетками. Перед ушиванием лоскута трансплантат был покрыт мембраной амниона и хориона.

В целях инфекционного контроля пациенту назначили амоксициллин на первую неделю и предписали полоскать рот феноловым ополаскивателем в течение первых 3 месяцев. Пациенту было предписано воздержаться от механических усилий при проведении гигиены полости рта в течение первого месяца. В течение первых 10 месяцев он находился под строгим послеоперационным наблюдением.
Через 10 месяцев (фото 15) было решено изменить фенотип путем размещения бесклеточного дермального матрикса (БДМ) для увеличения толщины мягких тканей. При раскрытии участка можно было визуализировать костное замещение, произошедшее на мезиальной внутрикостной стороне (фото 16), и там, где было неполное удаление резьбы на дистальной стороне, эта область была слегка изменена с помощью боров для имплантопластики. Аллотрансплантат БДМ был помещен и зафиксирован хромированным кетгутовым шовным материалом 5-0 с использованием прерывистой техники наложения шва (фото 17), а лоскуты были зафиксированы ПТФЭ 5-0. Через 15 месяцев после операции глубина зондирования составляла до 4 мм, кровоточивость отсутствовала, а фенотип изменился в лучшую сторону (фото 18).
Фото 15: Заживление через 10 месяцев после операции. Хотя сейчас ткань десны стала тоньше, чем до операции, она выглядела более здоровой.

Фото 16: Участок был открыт для размещения бесклеточного дермального трансплантата для улучшения фенотипа. Обратите внимание на заполнение твердыми тканями мезиальной стороны очага поражения, которая распространялась на язычную. Один виток резьбы рядом с костью с дистальной стороны был удален с помощью имплантопластики.

Фото 17: Бесклеточную дерму закрепляли хромированным кетгутовым шовным материалом 5-0.

Фото 18: Через 15 месяцев после операции: вид со щечной стороны. Здоровье места установки было восстановлено: глубина зондирования в основном составляла 4 мм, кровоточивость отсутствовала. Произошла некоторая рецессия десны с интерпроксимальной и вестибулярной сторон.

Обсуждение
Два представленных клинических случая демонстрируют успех, которого можно достичь с помощью имплантопластики для деконтаминации всей поверхности дентального имплантата. Отличие этого подхода от предыдущих заключается в том, что модификация поверхности, использованная в этих случаях в попытке достичь повторной остеоинтеграции, распространялась на всю глубину внутрикостных поражений пациентов. Несколько статей в литературе с гистологическими данными показывают, что регенерация может быть достижимым результатом для имплантатов, подвергшихся воздействию периимплантита. Хотя в этих трех случаях использовались различные протоколы обработки поверхности, их объединяло то, что супраструктура/коронка удалялась, чтобы получить доступ для очистки всех сторон поверхности. Однако удаление супраструктуры/коронки не всегда возможно, так как некоторые коронки зафиксированы на цементе, и если их удалить, то потребуется замена. Преимущество более длинных боров длиной 30 мм из набора боров, использованных в данном случае, заключается в том, что они обеспечивают лучший доступ благодаря разнообразию форм, достигая даже субкрестальных частей дефекта, что невозможно при наличии коронок, которые нельзя удалить. Хотя это и не мешает добиться абсолютно матового покрытия поверхности имплантата, тот факт, что резьба и внешняя часть уменьшаются/удаляются, облегчает деконтаминацию.
El Chaar et al. использовали сканирующую электронную микроскопию для оценки различных химиотерапевтических и механических методов деконтаминации поверхности инфицированных дентальных имплантатов, удаленных у людей. Они отметили, что химические вещества не помогли удалить биологические остатки. Воздушная абразия частицами, лазер и титановая щетка удалили часть биологических остатков, а имплантопластика обеспечила полное удаление биологических остатков. В исследовании Htet et al. на собаках породы бигль с периимплантитом, вызванным лигатурой, сравнивались различные методы, используемые для обеззараживания поверхностей дентальных имплантатов с анодированной поверхностью. Авторы оценили результаты клинических, рентгенологических, гистологических исследований и гистоморфометрии и обнаружили, что использование бора и комбинированного использования бора и лимонной кислоты позволяет достичь результатов, которые эквивалентны, если не лучше, чем при использовании других методов деконтаминации поверхности.
Используя чрезвычайно сложную восьмиэтапную методологию деконтаминации поверхности перед костной пластикой, Froum et al. продемонстрировали успешные клинические результаты регенерации при наблюдении от 2 до 10 лет32, хотя небольшая группа пациентов в группе пролеченных пациентов в серии случаев потребовала повторного обследования для сохранения их дентальных имплантатов, и несколько имплантатов были потеряны. Несмотря на способность этого восьмиэтапного алгоритма обеспечить успешную деконтаминацию in vitro, для улучшения предсказуемости деконтаминации может потребоваться агрессивный физический подход, как отметили в своей статье El Chaar et al. Некоторые из неоптимальных результатов в исследовании Froum et al., возможно, были получены из-за трудности доступа к поверхности имплантата, особенно в очагах поражения костной ткани с более узкой морфологией или там, где было бы чрезвычайно трудно достичь и модифицировать более апикальную протяженность дефектов.
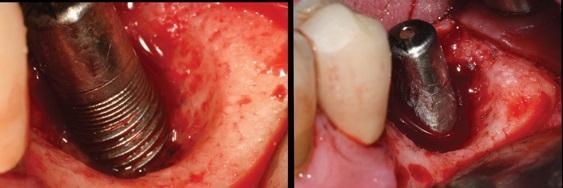
Разрушение при периимплантите приводит к образованию костных дефектов с самой разнообразной морфологией. Многие из этих очагов поражения содержат внутрикостный компонент с множеством стенок, что позволяет рассматривать регенеративный подход как часть лечения. Chan и коллеги провели систематический обзор и мета-анализ различных хирургических подходов к лечению периимплантита, включая доступ через лоскут и кюретаж, хирургическую резекцию, применение материалов для костной пластики и направленную костную регенерацию. В рамках систематического обзора авторы пришли к выводу, что применение трансплантационных материалов и барьерных мембран привело к большему уменьшению глубины зондирования и увеличению объема костной ткани на рентгенограммах. Однако они отметили, что для подтверждения этого утверждения не хватает высококачественных сравнительных исследований. Имплантопластика может быть использована для достижения поверхности без бактериального загрязнения как в супра-, так и в субкрестальном компонентах дефекта при периимплантите и, таким образом, обеспечить единый способ обработки всей поверхности имплантата. Это позволяет хирургу использовать регенеративный подход к субкрестальной области, даже при самых узких дефектах, не прибегая при этом к резекционному лечению, которое может привести к тому, что тело имплантата окажется более подверженным воздействию окружающей среды в полости рта. Финишные боры, используемые в данных клинических случаях, эффективны для удаления/уменьшения резьбы имплантата и создания более матовой поверхности имплантата, которая не является слишком гладкой, что желательно, поскольку сильно отполированная поверхность конца менее подходит для контакта кости с имплантатом. Удаление коронки имплантата обеспечивает оптимальный доступ для удаления резьбы и сглаживания поверхности (фото 19) и позволяет проводить заживление в закрытой среде. Использование боров с большей хирургической длиной и разнообразными формами обеспечивает более широкий доступ ко всем сторонам тела имплантата по сравнению с тем, что обычно было доступно в прошлом. Более того, использование как 12-, так и 30-гранных боров является целесообразным, учитывая, что имплантаты из титана класса 5 могут потребовать меньшего количества граней для уменьшения внешней поверхности имплантата, а 30-гранные боры могут помочь избежать чрезмерного уменьшения имплантатов узкого диаметра, как это наблюдается в Клиническом случае 1.
Фото 19: Сравнение дентального имплантата до (слева) и после (справа) имплантопластики. Возможность снять коронку и установить формирователь десны позволила улучшить доступ для достижения поверхности основания дефекта при периимплантите, по структуре схожей с механически обработанной.

Как и любая другая методика, имплантопластика имеет потенциальные недостатки. Во-первых, целенаправленное удаление титановой поверхности и резьбы для деконтаминации имплантата может представлять риск его будущего разрушения. Costa-Berenguer et al. рассмотрели возможность разрушения после имплантопластики с помощью испытаний на стойкость к механическому разрушению in vitro для дентальных имплантатов стандартного диаметра с внешним шестигранником, изготовленных из титана 4-го класса. Они отметили, что, несмотря на техническую сложность и трудоемкость, имплантопластика, по-видимому, не приводит к значительному изменению сопротивления разрушению этих дентальных имплантатов из-за усталости. Кроме того, в отличие от ранних дентальных имплантатов, которые изготавливались из коммерчески чистого титана марки 1, современные имплантаты изготавливаются из титана марок 3, 4 и 5 или сплава титана и диоксида циркония, которые более твердые и менее подвержены разрушению. Тем не менее, для имплантатов более узкого диаметра, как это было в Клиническом случае 1, лечащий врач может рассмотреть возможность минимального уменьшения поверхности имплантата, что может означать уменьшение резьбы до более плоского рельефа, а не ее удаление, и только легкий кюретаж поверхности, а не придание ей матовости. Химиотерапия, например, применение лимонной кислоты, может быть рассмотрена в сочетании с имплантопластикой, особенно в области регенерации, поскольку более агрессивная имплантопластика не проводится при использовании имплантата более узкого диаметра.
Еще одной проблемой при имплантопластике является возможность дисперсии титановых гранул в процессе сглаживания. Исследования показали связь между частицами титана и разрушением дентальных имплантатов. Эта дисперсия может быть вызвана не только такими факторами, как микродвижение абатмента, но и возникать в любое время на протяжении всего процесса, в том числе при установке дентального имплантата. Необходимо обеспечить удаление как можно большего количества образовавшихся твердых частиц; один из способов сделать это — слегка провести бором для имплантопластики по поверхности кости с обильным орошением.
Заключение
В этой статье продемонстрировано использование имплантопластики в качестве средства деконтаминации поверхности дентального имплантата под гребнем кости в дополнение к ее историческому применению супракрестально при проведении регенеративной терапии. Цель в двух представленных случаях состояла в том, чтобы создать поверхность, которая была бы свободна от загрязнений, что обеспечило бы повторную остеоинтеграцию, а также улучшило возможность очищения как пациентом, так и коллегами-стоматологами. Насколько известно авторам, это первый случай в литературе, когда имплантопластика была использована подобным образом и продемонстрировала потенциальную регенеративную эффективность. Необходимы дальнейшие исследования, чтобы определить применимость этой методики к более широкой когорте пациентов, обслуживаемых большим числом лечащих врачей.
Авторы:
Paul S. Rosen, DMD, MS
Dennis P. Tarnow, DDS





























































































































































0 комментариев