Специалисты-имплантологи часто сталкиваются с наличием узкого альвеолярного гребня, что затрудняет или делает невозможным установку имплантата и требует модификации гребня, позволяющей использовать имплантаты. При выборе метода расширения гребня в боковом отделе зубных рядов необходимо учитывать множество различных факторов. В идеале, методика должна способствовать достижению цели увеличения ширины гребня при одновременном уменьшении воспаления и послеоперационной боли у пациента. В этом исследовании пациентов лечили для увеличения объема и ширины альвеолярного гребня в боковых отделах с использованием костного цемента на основе сульфата кальция по протоколу, который не требует установки мембраны во время трансплантации. Этот малоинвазивный, относительно экономичный хирургический метод направлен на улучшение послеоперационного комфорта для пациентов, позволяя при этом расширить границы альвеолярного гребня в боковых отделах.
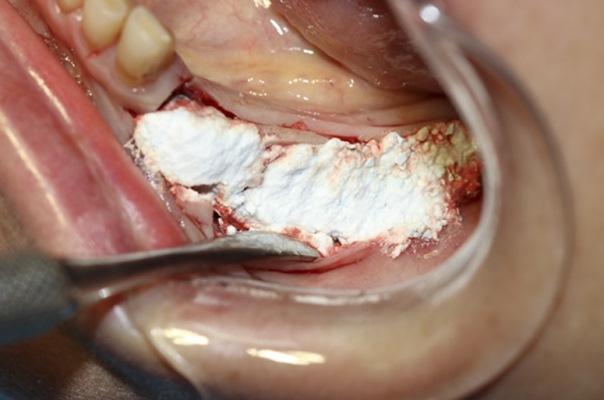
Увеличение объема альвеолярного гребня становится необходимым, особенно когда установка имплантатов входит в план лечения для восполнения отсутствующих зубов. Для увеличения ширины гребня были разработаны и рекомендованы различные методы, которые обычно называют направленной регенерацией кости. Эти методы были широко описаны в литературе и был документирован предсказуемый клинический результат при лечении узких альвеолярных альвеолярных гребней. Однако применение данных методов сопряжено со сложными хирургическими процедурами с длительными фазами заживления и риском обнажения мембраны в течение начального периода заживления, наряду с возможной последующей потерей части или всей кости, костного материала для трансплантата и/или обнажения нитей имплантатов непосредственно в месте соединения муфты имплантата с коронкой. Использование мембраны, является необходимым дополнением к многим остеопластическим материалам, что в свою очередь увеличивает затраты на лечение, связанные с выбором мембраны и ее фиксацией с применением дополнительной аппаратуры, такой как винты и специальные кнопки.
Использование аутогенных блоков внутриротового или внеротового происхождения также является альтернативой частичным костным трансплантатам аутогенного, аллотрансплантата, ксенотрансплантата или синтетического происхождения при увеличении объема узкого альвеолярного гребня. Тем не менее, этот метод имеет несколько серьезных недостатков, включая риск осложнений в донорском участке и частоту возникновения болезненности или парестезии при заборе ткани из области ветви нижней челюсти. Периоды заживления могут быть более длительными, чем при использовании частичных-порционных трансплантатов. Это приводит к значительно более высокой стоимости лечения, связанной с более сложным вмешательством а также с более длительной продолжительностью операции и необходимыми дополнительными материалами для ее осуществления.
Расщепление гребня - это альтернатива, которая не всегда выполнима, когда ширина гребня очень узкая или состоит только из кортикальной кости без губчатой кости между щечным и язычным пластами. Если операция выполнена неправильно, это может привести к значительному повреждению остаточного объема альвеолярного гребня.
Как упоминалось ранее, материалы для костного трансплантата в виде частиц могут включать аутотрансплантат (аутогенную кость от того же пациента), аллотрансплантат (человеческую кость от другого человека), ксенотрансплантат (материалы из разных видов млекопитающих) или аллопласт (синтетические материалы). Все они, по сообщениям, использовались в течение длительного времени, и у каждого из них есть преимущества и потенциальные проблемы, опираясь на прочитанную и изученную литературу
Сульфат кальция используется в ортопедической хирургии; это материал предпочтения для травматической аугментации кости из-за его остеокондуктивных, бактериостатических свойств. Он полностью рассасывается, со временем заменяясь костью-хозяином, что позволяет поддерживать пространство, пока происходит миграция остеобластов хозяина и ангиогенез. В ортопедической хирургии сообщалось, что использование сульфата кальция для лечения дефицита костной ткани показало, что надкостница не проникает в материал трансплантата.
Bond Apatite (Augma Biomaterials Ltd) представляет собой костный цемент, состоящий на две трети из двухфазного сульфата кальция и на одну треть из синтетических кристаллов гидроксиапатита различных размеров от 90 микрон до 1 мм. Внутриротовой материал имеет форму цемента, который образует компактный твердый блок, который прикрепляется к лежащей в основе кости хозяина. Гистологически ангиогенез стимулируется для превращения 90% трансплантата в кость пациента. Кроме того, он не позволяет эпителиальным клеткам в вышележащих мягких тканях проникать в трансплантат, поскольку он образуется во время фаз заживления и созревания. Тем не менее, он позволяет мягкой ткани пролиферировать по поверхности., закрывая любой незначительный зазор на линии разреза и сводя на нет необходимость в мембране для покрытия любого незначительного открытого материала трансплантата.
Протокол Bond Apatite имеет три клинических последствия: лоскут должен быть полнотканным, чтобы надкостница соприкасалась с материалом трансплантата; лоскут должен быть закрыт, растянут и устойчив к нижележащему материалу трансплантата, а закрытие лоскута может допускать зазор от 2 мм до 3 мм между лоскутом и материалом трансплантата. края лоскута на разрезе без ущерба для предполагаемого результата; и, таким образом, этот костно-цементный материал не требует какой-либо покрывающей мембраны, что позволяет проводить минимально инвазивную операцию. Для поднятия лоскута требуется только лоскут полной толщины, достаточный для визуализации подлежащего восполнению дефицита костной ткани. Применение Bond Apatite при процедуре увеличения объема альвеолярного гребня демонстрирует очень хорошие клинические результаты и может рассматриваться как альтернатива другим доступным материалам для трансплантации. Кроме того, простой хирургический протокол способствует быстрому заживлению при отсутствии воспалительной реакции, а послеоперационные осложнения, такие как боль или гематомы, сводятся к минимуму. Затраты на лечение также снижаются в результате отсутствия необходимости использования мембраны или фиксирующих ее дополнительных аппаратов, таких как минивинты или кнопки.
Обзор исследования
Пятьдесят два пациента, нуждавшиеся в увеличении объема альвеолярного гребня в боковых отделах зубных рядов, со стороны щеки и языка, получили лечение с применением костного цемента на основе сульфата кальция (Bond Apatite) в соответствии с протоколами проведения данных манипуляций.
Через четыре или более месяцев (в зависимости от ограничений, связанных с COVID-19) после аугментации имплантаты были установлены в ранее подготовленные области зубного ряда. В исследуемой группе в области шести латеральных резцов имелась не достаточная ширина альвеолярного гребня после первоначальной установки трансплантата и заживления, что по данным конусно-лучевой компьютерной томографии (КЛКТ), потребовало повторной установки трансплантата во время установки имплантата. Период динамического наблюдения перед основным этапом ортопедического лечения (минимум 4 месяца) был обязательным для всех пациентов основной группы, и было отмечено, что все имплантаты в основной группе остеоинтегрировались.
Хирургические манипуляции начали с назначения антибиотика моксициллина в дозе 500 мг каждые 8 часов, начиная за 1 день до операции и продолжая в течение 5 дней после операции. Три таблетки дексаметазона по 2 мг были даны за 30 минут до операции, чтобы свести к минимуму послеоперационный отек и связанную с ним боль от воспаления, вызванного отслоением лоскута.
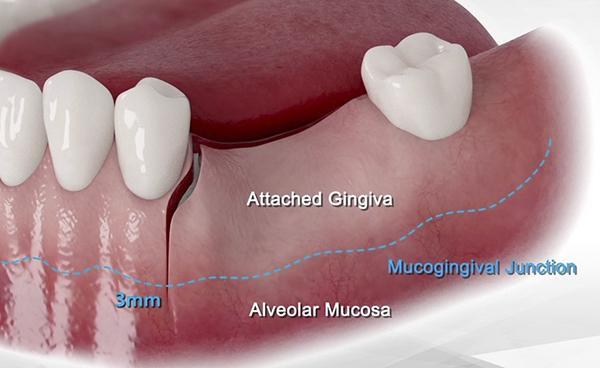
Пациентам было проведено введение местных анестезирующих средств (артикаин 4%, с 1/100 000 адреналина). Был сделан крестообразный разрез вместе с вертикальным высвобождающим разрезом, который простирался на 3 мм апикально до слизисто-десневой линии так, чтобы высвобождающий разрез находился по меньшей мере в 10 мм от места, которое будет подвергнуто пересадке. Иллюстрация данного типа разреза показана на (фото 1). Полнотканный лоскут был приподнят, чтобы адекватно визуализировать весь дефект, который был запланирован для пересадки. Лоскут был удлинен апикально до границы мукогингивальной линии, чтобы обеспечить возможность замены лоскута на ткань с пересаживаемой области для осуществления закрытия разреза.
Фото 1. Продемонстрирован рекомендуемый крестообразный разрез с последующим высвобождающим вертикальным разрезом, проходящим апикально до слизисто-десневой линии.
Учитывая биологические и физические свойства связующего апатита, не рекомендуется использовать лоскут частичной толщины. Этот метод основан на том, чтобы не производить высвобождение надкостницы в апикальной области. Чтобы сохранить целостность надкостницы, лоскут удлиняют мезиодистально вместо его расслоения для улучшения первичного закрытия.
Корональный 3 мм лоскут, расположенный апикально к слизисто-десневому соединению, растягивается для достижения большего объема покрытия операционного поля поверх уже установленного сульфата кальция. После того, как лоскут поднят и обработан, можно визуализировать и подготовить зону-реципиента. Кортикальная пластинка в месте дефекта теперь перфорируется через равные промежутки времени примерно через каждые 5 мм хирургическим бором или пьезохирургическим наконечником для соединения клеток хозяина и кровоснабжения трансплантата, который будет помещен в нужное место. Это позволяет полноценно запустить процессы остеогенеза и ангиогенеза, облегчая превращение материала трансплантата в новую ткань кости-хозяина в течение периода заживления.
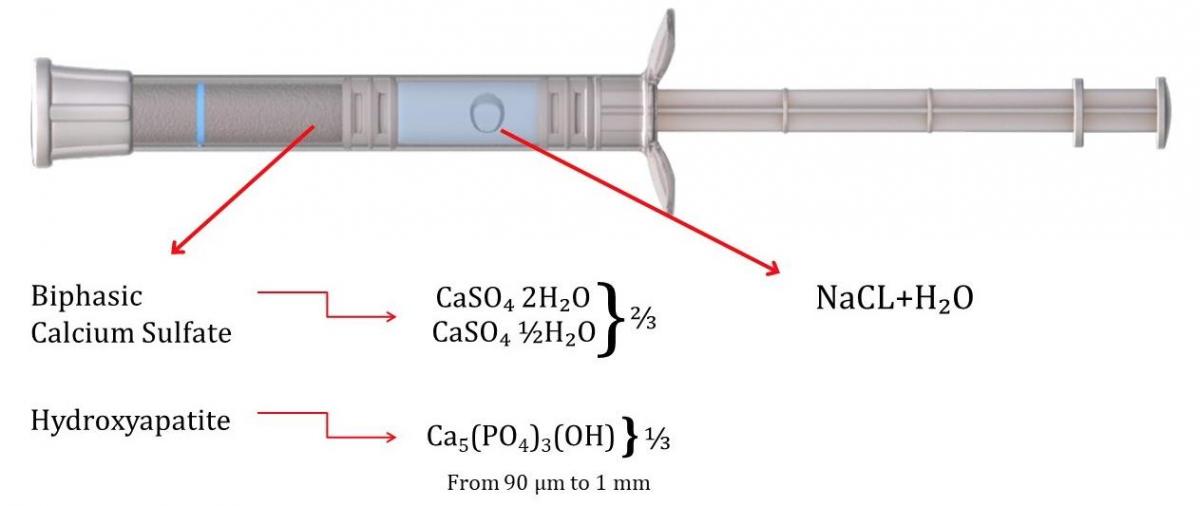
Bond Apatite поставляется в шприце с двумя отделениями, содержащем порошок (двухфазный сульфат кальция и кристаллы гидроксиапатита) в одном отделении и 9%-ный раствор хлорида натрия (NaCl) во втором отделении (фото 2). Чтобы активировать материал, стержень шприца продвигается вперед до тех пор, пока первый поршень не достигнет синей линии, отмеченной на тюбике шприца, так что жидкость смешивается с порошком, образуя влажный костный цемент. Торцевую крышку снимают со шприца, и материал вводят в костный дефект, подлежащий пересадке. Чтобы материал мог выйти из шприца, шприц должен быть наклонен примерно на 45 градусов относительно плоскости дефекта кости. Если держать его перпендикулярно поверхности участка, материал для трансплантации не будет выдавливаться из шприца. Для кристаллизации и затвердевания материала требуется около 3 минут. Материал необходимо поместить в дефект до затвердевания, в противном случае адгезия к кости-хозяину не произойдет.
Фото 2. Представлен шприц с материалом Bond Apatite содержащий в себе материал для осуществления трансплантации (сухой порошок) и жидкость, для формирования смеси, которая затвердеет в зоне трансплантации.
После того, как материал трансплантата помещен в зону реципиента, сухую стерильную марлю прижимают к поверхности в течение 3-4 секунд с помощью пальца, чтобы удалить остатки жидкости и прижать материал к кости реципиента. За этим следует дополнительное уплотнение марли периостальным элеватором течение 3-4 секунд. Материал должен быть хорошо утрамбован на месте трансплантации. После смешивания костного материала рабочее время до его застывания. составляет 2 минуты. Хирург должен без колебаний поместить материал для трансплантата в нужное место, во избежание преждевременного связывания тканей между собой. Не рекомендуется с усилием заполнять требуемую зону материалом так как это может привести к разрушению затвердевающих частиц. Процесс можно проводить несколько раз и заполнять последовательно несколько слоев нужной области при наличии крупных/ глубоких дефектов, для которых необходимо использование более одного шприца материала.
Затем лоскут перемещают над участком и накладывают шов по мезиальному краю от крестообразного разреза. Затем швы накладывают на дистальный край операционного поля, а затем на среднюю часть разреза, чтобы зафиксировать лоскут на месте. После этого наложение швов продолжается путем наложения дополнительных швов по мере необходимости либо для достижения первичного закрытия, либо для оставления минимального зазора до 2-3 мм по линии разреза. После чего идет наложение шва на вертикальный высвобождающий разрез. Авторы рекомендуют использовать шовный материал, срок службы которого составляет от 14 до 21 дня, прежде чем он потеряет свою целостность, чтобы обеспечить достаточное натяжение перед разрывом шва. Полигликолевая кислота, полиглекапрон или съемный шовный материал, такой как пролен или политетрафторэтилен, отвечают этим требованиям.
При использовании данной техники в сочетании с биосовместимостью материала костного цемента воспалительные процессы в результате проведенной процедуры в основном минимальны, и пациентам обычно не требуются наркотические обезболивающие средства на начальном этапе заживления. После операции пациентам, участвовавшим в данном исследовании было рекомендовано принимать ацетаминофен, две таблетки / капсулы по 500 мг (общая доза 1000 мг) каждые 6 часов, по мере необходимости для купирования болевых ощущений.
Через 4 месяца после операции, что должно быть достаточным промежутком времени для преобразования материала трансплантата, повторное вскрытие участка должно позволить оценить раннюю кость хозяина с некоторыми примесями кристаллов гидроксиапатита. Гистологически часть сульфата кальция полностью рассасывается и заменяется созревающей костью хозяина; крупные кристаллы гидроксиапатита (10% от исходного материала трансплантата) остаются, а кристаллы среднего размера рассасываются.
У 46 из 52 пациентов, участвовавших в исследовании, была разрешена установка имплантатов через 4 или более месяцев после латерального увеличения запланированных мест имплантации. В остальных шести случаях объем полученной кости и ширина альвеолярного гребня были недостаточными для размещения имплантата, что потребовало пересадки ткани с дополнительной порцией Bond Apatite и периодом заживления перед установкой имплантата.
Подробные сведения о пациентах, принявших участие в проводимом исследовании:
Пациент 1 была женщина 42 лет, зона вмешательства в ее случае была в боковых отделах нижней челюсти, операция по пересадке тканного трансплантата была осуществлена в январе 2020 года, имплантаты ей были установлены в июле 2020 года, дополнительных процедур по пересадке тканей не потребовалось.
Пациент 2 была женщина 71 года, зона вмешательства затрагивала передний отдел верхней челюсти, процедура трансплантации тканей была проведена в июле 2018 года, имплантаты установили в январе 2020 года, дополнительных процедур по пересадке тканей не потребовалось.
Пациент 3 была также женщина 71 года, зона вмешательства также затрагивала передний отдел верхней челюсти, процедура трансплантации тканей была проведена в июле 2018 года, имплантация состоялась в январе 2019 года, без каких либо дополнительных манипуляций.
Пациент 4 также женщина 65 лет, зона проведения операции находилась в переднем отделе нижней челюсти, трансплантация тканей была проведена в июле 2017 года, последующая имплантация была выполнена в октябре 2017, дополнительных вмешательств не потребовалось.
Пациент 5 женщина 55 лет, операция по трансплантации тканей была проведена в боковых отделах нижней челюсти, трансплантация тканей была выполнена в июле 2017 года, имплантация проводилась в декабре 2017.
Пациент 6 была женщина 72 лет, зона проведения операции затрагивала боковые отделы верхней челюсти, оперативное вмешательство было проведено в декабре 2019 года, имплантация осуществлена в марте 2020 года, в данном потребовалась повторно провести трансплантацию ткани перед имплантацией.
Еще в пяти случаях пациентам потребовалась повторная процедура трансплантации тканей перед имплантацией, а именно женщине 70 лет у которой планировалась процедура имплантации в боковых отделах верхней челюсти. Женщине 69 лет, зона проведения операции затрагивала боковые отделы верхней челюсти. Женщине 22 лет, была проведена процедура трансплантации тканей в переднем отделе верхней челюсти, операция по трансплантации была проведена в декабре 2020 года, постановка имплантатов в июне 2021. У женщины 71 года также возникла необходимость в повторном проведении процедуры трансплантации в боковых отделах верхней челюсти и еще одному мужчине 36 лет повторно проводили процедуру пересадки ткани трансплантата в боковом отделе верхней челюсти при подготовке к имплантации. В остальных случаях операция прошла успешно и не требовала дополнительных вмешательств для осуществления имплантации.
Примеры клинических случаев
Один участок
58-летний мужчина обратился в клинику с жалобами на отсутствие правого первого премоляра верхней челюсти, который не смог развиться в подростковом возрасте и желанием восполнить данный дефект зубного ряда.
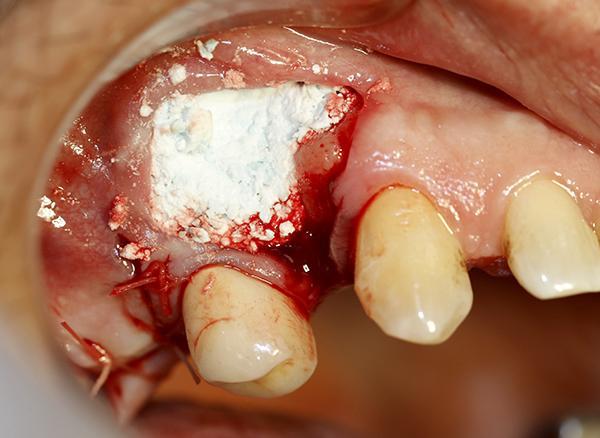
Для оценки наличия костной ткани в данной области было выполнено КЛКТ исследование (фото 3). Со стороны щеки альвеолярный гребень имел значительный дефицит тканей по ширине, что препятствовало установке имплантата на всю его длину; в противном случае раскрытие данной области привело бы расхождению между длиной имплантата в апикальной его трети и шириной костной ткани. Был откинут лоскут в данной области и дефект визуализирован. Для установки имплантата была произведена остеотомия, и имплантат был помещен в кость (фото 4). Материал Bond Apatite был смешан в шприце и введен в область дефекта со стороны щеки, после чего его полностью уплотнили в нужной области (фото 5).
Фото 3. Поперечные срезы КЛКТ, демонстрирующие недостаточную ширину альвеолярного гребня в месте первого премоляра справа, что указывает на резорбцию кости после удаления в прошлом.
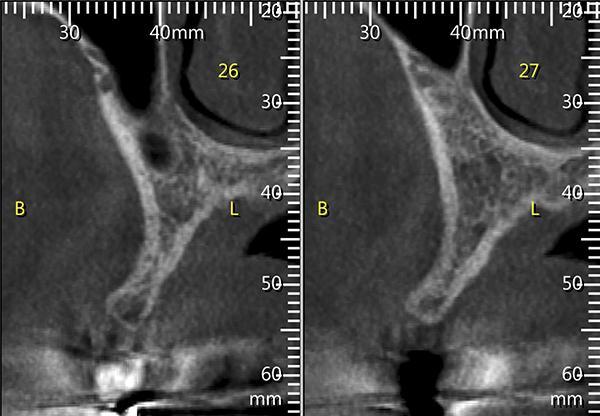
Фото 4. Установка имплантата в области отсутствующего премоляра справа, видна вогнутость части альвеолярного гребня в месте установки со стороны щеки, расположенная апикально по отношению к верхней трети альвеолярного гребня.
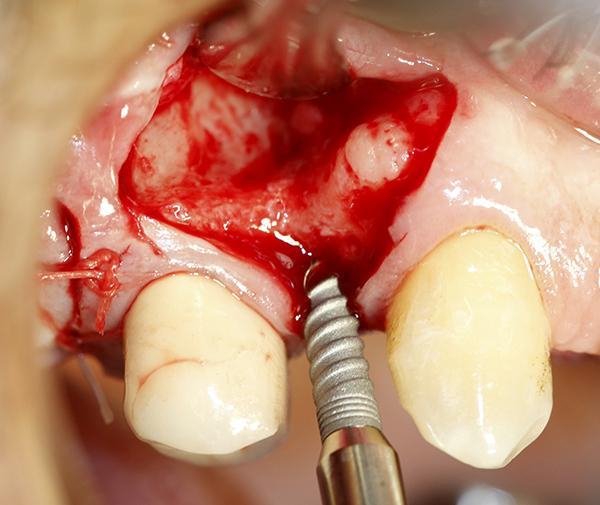
Фото 5. Полость в альвеолярном гребне со стороны щеки заполнена материалом Bond Apatite, для восстановления целостности данной области без необходимости использования покрывающей мембраны.
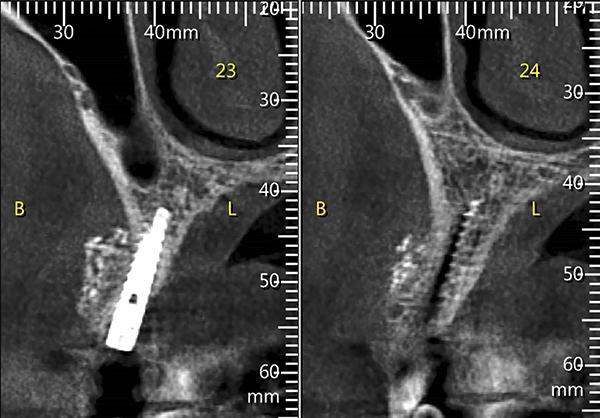
Через четыре месяца после пересадки и немедленной установки имплантата КЛКТ исследование подтвердило заполнение дефекта со стороны щеки, который был восстановлен материалом цемента и установленный имплантат полностью вошел в образованную кость (фото 6).
Фото 6. Продемонстрированы срезы КЛКТ исследования через 4 месяца после операции, визуализируется костная мозоль образованная, путем замены материала костного цемента из сульфата кальция на новую кость хозяина.
Несколько участков для восполнения
Пациентка 66 лет обратилась с намерением заменить полный съемный протез на не съемную конструкцию для восстановления зубной дуги с опорой на имплантаты. Осмотр выявил значительный дефект лица в области центральных и боковых резцов на верхней челюсти и толщину альвеолярного гребня с острие ножа, что препятствовало имплантации в данной области. Это было подтверждено при отделении лоскута (фото 7). Материал Bond Apatite был смешан и помещен в область дефекта вестибулярно (фото 8) и хорошо утрамбован, затем область была была закрыта мягко-тканным лоскутом и ушита.
Фото 7. Во время поднятия лоскута очевидна недостаточность ширины альвеолярного гребня в области отсутствующих центральных и боковых резцов верхней челюсти с двух сторон, что препятствовало установке имплантата и расслоению данного участка альвеолярного гребня.
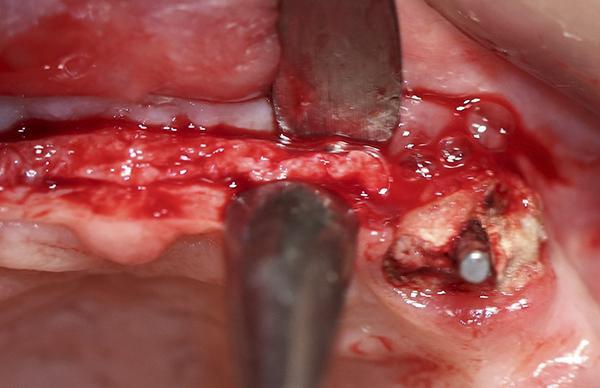
Фото 8. Продемонстрирован момент заполнения материалом Bond Apatite области дефекта со стороны щеки, чтобы создать достаточную толщину альвеолярного гребня для дальнейшей установки имплантата после заживления ткани трансплантата.
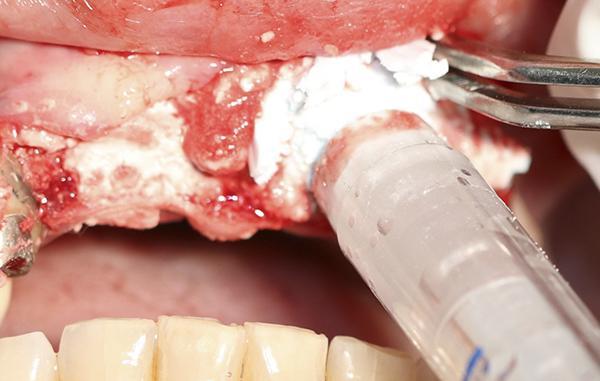
После 4 месяцев периода заживления трансплантата зона интереса была повторно раскрыта для оценки толщины альвеолярного гребня и возможности дальнейшей установки имплантата (фото 9). Рентгенограмма была сделана после установки имплантата в запланированном месте (фото 10).
Фото 9. После 4 месяцев заживления и созревания костной ткани в области трансплантата при поднятии лоскута выявлено увеличение ширины альвеолярного гребня, что позволило установить имплантат.
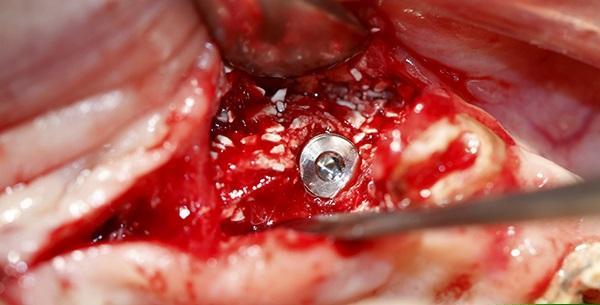
Фото 10. Рентгенограмма после установки имплантата в зоне трансплантации тканей во фронтальном отделе верхней челюсти.
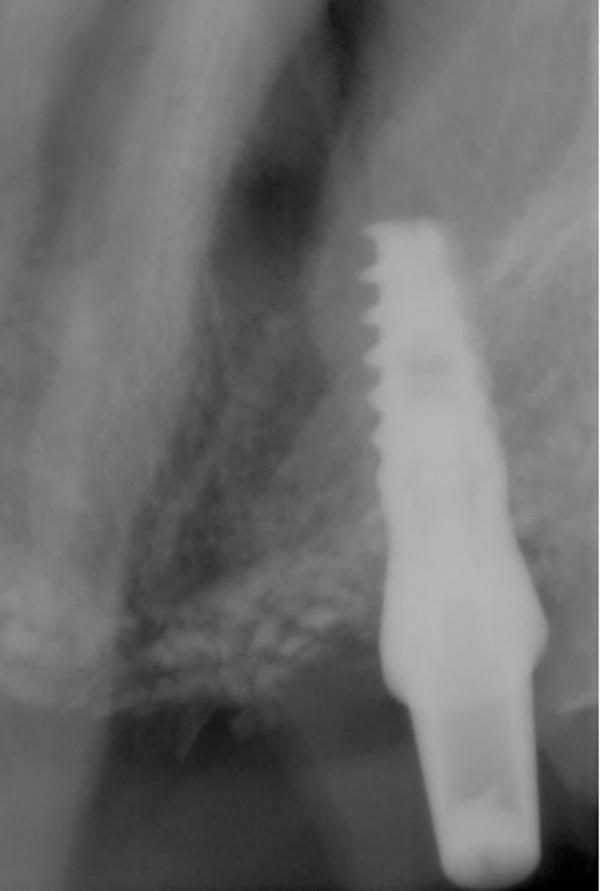
Боковые отделы нижней челюсти
69-летняя пациентка обратилась с просьбой об имплантации для восстановления отсутствующих зубов в боковом отделе нижней челюсти слева, которые были удалены несколько лет назад. Было выполнено КЛКТ исследование и проанализированы поперечные срезы при планировании установки имплантатов. Адекватная ширина альвеолярного гребня была отмечена около передней границы ментального отверстия, но по дистальной границе ширина была недостаточной (фото 11). Область была раскрыта хирургически и и два имплантата были установлены мезиально к ментальному отверстию. Хирургический бор использовался для перфорации боковой части гребня дистальнее ментального отверстия, чтобы создать точки кровотечения (фото 12). Материал Bond Apatite смешали и поместили поверх ранее перфорированной кости и покрывая только что установленные имплантататы (фото 13).
Фото 11. Продемонстрированы поперечные срезы КЛКТ боковых отделов нижней челюсти демонстрирующие объем альвелярного гребня с острие ножа в запланированных местах имплантации.
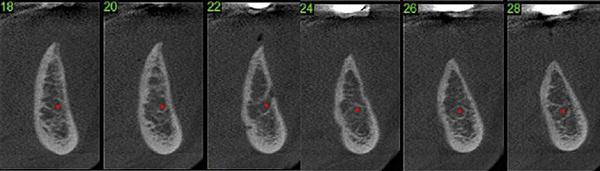
Фото 12. Кортикальная пластина была перфорирована там, где будет размещен трансплантат, чтобы расширить альвеолярный гребень в боковом отделе при подготовке к имплантации.
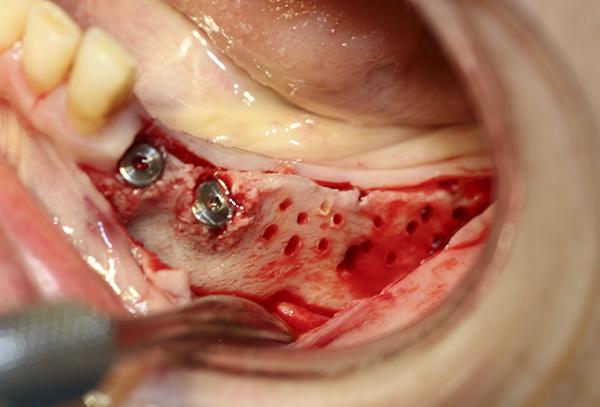
Фото 13. Материал из костного цемента на основе сульфата кальция был помещен поверх перфорированного альвеолярного гребня в боковом отделе, с целью увеличения его ширины для последующей установки имплантатов.
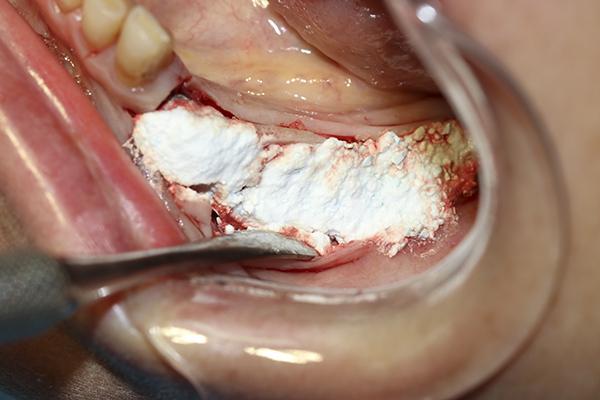
После 4 месяцев периода заживления, чтобы оценить возможность новой кости созреть и полноценно сформироваться было проведено повторное КЛКТ исследование. На поперечных срезах визуализировалось увеличение ширины альвеолярного гребня области, дистальнее от ментального отверстия, что позволяло осуществить установку имплантатов (фото 14). Область была обнажена и подготовлена к остеотомии, затем были установлены имплантаты (фото 15).
Фото 14. Продемонстрированы поперечные срезы КЛКТ через 4 месяца после операции, на них четко видно увеличение ширины альвеолярного гребня, что позволяет установить имплантаты.
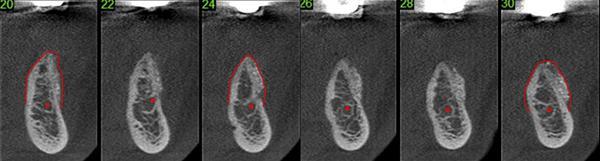
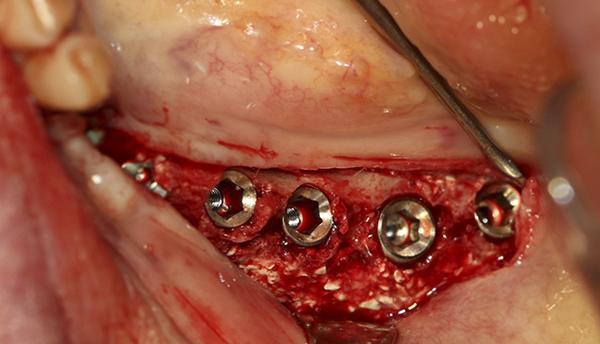
Фото 15. По истечении 4-х месячного периода заживления области трансплантации и созревания кости имплантаты были установлены в успокоившуюся зону проведенной ранее трансплантации.
Обсуждение
Недостаточная ширина гребня для размещения имплантата и обеспечения возможности охвата имплантата костью является распространенным явлением, связанным с резорбцией с течением времени после удаления или с заболеваниями пародонта, связанными с присутствующим или недавно удаленным зубом. Костная пластика становится необходимой для изменения оставшегося объема альвеолярного гребня, что бы подготовить его к установке имплантата. Как уже обсуждалось, в литературе были представлены различные материалы для костных трансплантатов, все с плюсами и минусами, связанными с их использованием. Эти материалы требуют первичного закрытия вышележащего лоскута для предотвращения инфекции и потери материала трансплантата; кроме того, размещение мембраны, рассасывающейся или не рассасывающейся, имеет решающее значение для успеха лечения. При использовании мембраны увеличиваются затраты на лечение, связанные с самой мембраной, а также с фиксирующей ее аппаратурой, такой как винты или кнопки, необходимыми для обеспечения стабильности мембраны в месте операции. Кроме того, необходимость в мембране требует дополнительных хирургических навыков и более длительного времени приема для проведения лечения. Кроме того, для обеспечения закрытия без натяжения при таких процедурах требуется большее высвобождение ткани трансплантата.
В идеале, размещенный материал трансплантата должен со временем превращаться в кость хозяина, действуя как распорка и каркас, который позволяет клеткам-хозяевам создавать внутри него кость, одновременно стимулируя ангиогенез, в результате чего получается "живая" активная кость, которая может интегрироваться в имплантаты, размещенные внутри нее после заживления. Различные костные материалы для трансплантации имеют разную скорость резорбции. Когда трансплантат для замены кости рассасывается слишком быстро, объем теряется, поскольку твердая ткань хозяина не может достаточно быстро заменить трансплантат. Когда резорбция происходит слишком медленно, время лечения удлиняется, в особенности период покоя перед непосредственной установкой имплантатов.
Таким образом, материал должен сохранять требуемый объем заполняемого пространства в течение периода времени, который позволяет организму пациента заменить его на новую образовавшуюся кость, соответственно.
Рассасываемость - еще одна проблема, имеющая решающее значение для материала трансплантата. Полностью ли рассасывается материал трансплантата или остаются его части? Сколько осталось, и может ли это повлиять на интеграцию, уменьшая контакт кости с имплантатом, помещенным в нее? Аллотрансплантаты и аутогенная кость частично или полностью рассасываются в течение определенного периода времени. Скорость основана на плотности частиц, при этом кортикальная кость прослужит дольше, чем губчатая. Сообщалось, что ксенотрансплантаты, такие как бычья кость, не рассасываются, и частицы остаются заключенными в соединительную ткань и кость хозяина. Синтетические материалы, в зависимости от их состава, либо полностью рассасываются (сульфат кальция), либо частично рассасываются (биостекло), либо остаются нетронутыми в течение длительного времени (гидроксиапатит).
контактом кости с имплантатом, который может варьироваться в зависимости от множества факторов, таких как микро- и макроповерхность имплантата и тип кости, которая окружает имплантат после костного заживления и интеграции. Преобразование материала трансплантата в кость-хозяина имеет решающее значение для долгосрочного поддержания кости вокруг имплантата. Проблемы с заживлением вокруг области трансплантата и/или зоны имплантации в непосредственной близости от гнезда могут привести к воспалению и потере костной ткани.
Что касается хирургического подхода, хирург не всегда может предсказуемо и безопасно полностью отслоить лоскут, чтобы закрыть место от проведенной трансплантации тканей, ввиду анатомических или других особенностей организма. Риски проведения данной манипуляции включают сильное кровотечение и рассечение ментального нерва или другой иннервирующей структуры во время выполнения надкостничного разреза. В этих случаях доступно несколько вариантов решения. Ronda и Stacchi обсуждали сложную конфигурацию самих трансплантатов, во избежание повреждения критических анатомических структур во время отслоения лоскутов. Они использовали технику "расчесывания" после надреза надкостничного слоя, что бы помочь высвободить ткани для дальнейшего коронарного закрытия области. Одна из проблем данного метода заключается в том, что при увеличении силы кровотечения это отрицательно сказывается на способности хирурга видеть более мелкие кровеносные сосуды или нервы, которые могут быть случайно перерезаны острым скальпелем. Кроме того, иссечение надкостницы может вызвать дальнеейшее формирование рубцовой ткани, что может в свою очередь привести к деформации лоскута во время периода заживления.
Во время процедуры, описанной здесь, основание надкостничной ткани не отделяется от остальной ткани надкостницы Напротив, примерно на расстоянии 3 мм от верхушки слизисто-десневого соединения надкостничная ткань растягивается в венечном направлении. В данной области мышечный слой минимален, поэтому слизистая оболочка будет минимально оттягиваться назад в апикальном направлении. Как описали Payne и Cobb, если какая-либо часть материала трансплантата осталась не покрыта тканью, то у организма есть способность к эпителизации поверх области раны. Кроме того, может произойти еще одно интересное возможное явление. Если небольшое натяжение остается в области ткани надкостницы во время какой-либо фазы процесса заживления, это может вызвать самопроизвольный остеогенез. Zakaria с коллегами провел исследование в 2012 году, используя специально разработанный процесс периостальной дистракции, чтобы проверить свою гипотезу. Основываясь на результатах аналогичных исследований, показавших, что внутренний слой надкостницы является источником костных клеток, ученые доказали что постоянное растяжение этой ткани в течение 6 недель помогло сформировать значительный объем кости при использовании кролика в качестве модели эксперимента.
Увеличение объема мягких тканей и альвеолярного гребня у людей с помощью туннельного подхода хорошо освящено. Lee описал 60 клинических случаев увеличения ширины альвеолярного гребня с последующим наблюдением до 30 месяцев. Его методика не предполагает использования барьерных мембран или высвобождающих разрезов для надкостничных лоскутов, чтобы сохранить целостность этой ткани. Используя инструменты особого дизайна и специфическую комбинацию материалов для трансплантации в комбинации с факторами роста, его исследование подтвердило увеличение вертикальной высоты альвеолярного гребня. Результаты были проанализированы на основе сравнения данных срезов трехмерных КЛКТ исследований и гистологических данных в совокупности с прилагаемой клинической документацией для апробации данной методики. Данные манипуляции основаны на выводах сделанных коллегой Rapp, том, что добавление тканей родной надкостницы равен нулю, когда она источена в результате травмы или других процессов. Как и в методике, пр меняемой Lee, процесс, описанный в данной статье, предназначен для растяжения тканей лоскута при осуществлении манипуляции по трансплантации, а не надреза надкостницы с максимальным сохранением ее биологической целостности.
Заключение
Практикующий врач часто сталкивается с ситуацией наличия узкого альвеолярного гребня у пациента, что затрудняет или делает невозможным установку имплантата и требует модификации гребня, чтобы для осуществления последующей имплантации. Многие факторы влияют на выбор техники, используемой для увеличения ширины альвеолярного гребня в боковом отделе зубных рядов. Следует отдавать предпочтение относительно простой технике, которая может способствовать увеличению ширины гребня при одновременном уменьшении воспалительной и послеоперационной боли у пациента. Представленная здесь хирургическая методика, в которой используется материал костного цемента на основе сульфата кальция Bond Apatite при лечении пациентов с малой шириной альвеолярного гребня, представляет собой инновационный, простой и минимально инвазивный хирургический подход, связанный со свойствами самого материала. Послеоперационные боли или воспалительные реакции минимальны во время процесса заживления, которое происходит быстрее благодаря консервативному хирургическому подходу. Данное исследование продемонстрировало, что использование представленной техники и материала позволяют увеличить объем альвеолярного гребня с 2 мм до 6 мм.
Использование материала для трансплантации на основе сульфата кальция, такого как тот, который использовался в этом исследовании, имеет клинические преимущества, когда требуется увеличить ширину альвеолярного гребня в боковых отделах зубных рядов с целью обеспечения условий для последующей имплантации, по сравнению с другими костными материалами для трансплантации. После заживления 90% материала трансплантата превращается в костную ткань в течение 4-6 месяцев в зависимости от объема размещенного костного апатита по сравнению с другими костными материалами для трансплантации. После заживления 90% материала трансплантата превращается в костную ткань в течение 4-6 месяцев в зависимости от объема размещенного костного апатита. Таким образом, происходит регенерация кости, а не срастание поврежденной кости.
Кроме того, исключается использование коллагеновой мембраны и фиксирующих винтов / кнопок, гвоздей, что помогает снизить стоимость процедуры и делает ее более доступной для большего числа пациентов, желающих установить имплантат в области утраченных зубов на верхней и нижней челюсти. Данный метод относительно прост в исполнении и имеет меньше потенциальных осложнений, чем другие процедуры увеличения гребня высоты альвеолярного гребня.
Авторы:
David Baranes, DDS
Gregori M. Kurtzman, DDS
Robert A. Horowitz, DDS
Специалисты-имплантологи часто сталкиваются с наличием узкого альвеолярного гребня, что затрудняет или делает невозможным установку имплантата и требует модификации гребня, позволяющей использовать имплантаты. При выборе метода расширения гребня в боковом отделе зубных рядов необходимо учитывать множество различных факторов. В идеале, методика должна способствовать достижению цели увеличения ширины гребня при одновременном уменьшении воспаления и послеоперационной боли у пациента. В этом исследовании пациентов лечили для увеличения объема и ширины альвеолярного гребня в боковых отделах с использованием костного цемента на основе сульфата кальция по протоколу, который не требует установки мембраны во время трансплантации. Этот малоинвазивный, относительно экономичный хирургический метод направлен на улучшение послеоперационного комфорта для пациентов, позволяя при этом расширить границы альвеолярного гребня в боковых отделах.

Увеличение объема альвеолярного гребня становится необходимым, особенно когда установка имплантатов входит в план лечения для восполнения отсутствующих зубов. Для увеличения ширины гребня были разработаны и рекомендованы различные методы, которые обычно называют направленной регенерацией кости. Эти методы были широко описаны в литературе и был документирован предсказуемый клинический результат при лечении узких альвеолярных альвеолярных гребней. Однако применение данных методов сопряжено со сложными хирургическими процедурами с длительными фазами заживления и риском обнажения мембраны в течение начального периода заживления, наряду с возможной последующей потерей части или всей кости, костного материала для трансплантата и/или обнажения нитей имплантатов непосредственно в месте соединения муфты имплантата с коронкой. Использование мембраны, является необходимым дополнением к многим остеопластическим материалам, что в свою очередь увеличивает затраты на лечение, связанные с выбором мембраны и ее фиксацией с применением дополнительной аппаратуры, такой как винты и специальные кнопки.
Использование аутогенных блоков внутриротового или внеротового происхождения также является альтернативой частичным костным трансплантатам аутогенного, аллотрансплантата, ксенотрансплантата или синтетического происхождения при увеличении объема узкого альвеолярного гребня. Тем не менее, этот метод имеет несколько серьезных недостатков, включая риск осложнений в донорском участке и частоту возникновения болезненности или парестезии при заборе ткани из области ветви нижней челюсти. Периоды заживления могут быть более длительными, чем при использовании частичных-порционных трансплантатов. Это приводит к значительно более высокой стоимости лечения, связанной с более сложным вмешательством а также с более длительной продолжительностью операции и необходимыми дополнительными материалами для ее осуществления.
Расщепление гребня - это альтернатива, которая не всегда выполнима, когда ширина гребня очень узкая или состоит только из кортикальной кости без губчатой кости между щечным и язычным пластами. Если операция выполнена неправильно, это может привести к значительному повреждению остаточного объема альвеолярного гребня.
Как упоминалось ранее, материалы для костного трансплантата в виде частиц могут включать аутотрансплантат (аутогенную кость от того же пациента), аллотрансплантат (человеческую кость от другого человека), ксенотрансплантат (материалы из разных видов млекопитающих) или аллопласт (синтетические материалы). Все они, по сообщениям, использовались в течение длительного времени, и у каждого из них есть преимущества и потенциальные проблемы, опираясь на прочитанную и изученную литературу
Сульфат кальция используется в ортопедической хирургии; это материал предпочтения для травматической аугментации кости из-за его остеокондуктивных, бактериостатических свойств. Он полностью рассасывается, со временем заменяясь костью-хозяином, что позволяет поддерживать пространство, пока происходит миграция остеобластов хозяина и ангиогенез. В ортопедической хирургии сообщалось, что использование сульфата кальция для лечения дефицита костной ткани показало, что надкостница не проникает в материал трансплантата.
Bond Apatite (Augma Biomaterials Ltd) представляет собой костный цемент, состоящий на две трети из двухфазного сульфата кальция и на одну треть из синтетических кристаллов гидроксиапатита различных размеров от 90 микрон до 1 мм. Внутриротовой материал имеет форму цемента, который образует компактный твердый блок, который прикрепляется к лежащей в основе кости хозяина. Гистологически ангиогенез стимулируется для превращения 90% трансплантата в кость пациента. Кроме того, он не позволяет эпителиальным клеткам в вышележащих мягких тканях проникать в трансплантат, поскольку он образуется во время фаз заживления и созревания. Тем не менее, он позволяет мягкой ткани пролиферировать по поверхности., закрывая любой незначительный зазор на линии разреза и сводя на нет необходимость в мембране для покрытия любого незначительного открытого материала трансплантата.
Протокол Bond Apatite имеет три клинических последствия: лоскут должен быть полнотканным, чтобы надкостница соприкасалась с материалом трансплантата; лоскут должен быть закрыт, растянут и устойчив к нижележащему материалу трансплантата, а закрытие лоскута может допускать зазор от 2 мм до 3 мм между лоскутом и материалом трансплантата. края лоскута на разрезе без ущерба для предполагаемого результата; и, таким образом, этот костно-цементный материал не требует какой-либо покрывающей мембраны, что позволяет проводить минимально инвазивную операцию. Для поднятия лоскута требуется только лоскут полной толщины, достаточный для визуализации подлежащего восполнению дефицита костной ткани. Применение Bond Apatite при процедуре увеличения объема альвеолярного гребня демонстрирует очень хорошие клинические результаты и может рассматриваться как альтернатива другим доступным материалам для трансплантации. Кроме того, простой хирургический протокол способствует быстрому заживлению при отсутствии воспалительной реакции, а послеоперационные осложнения, такие как боль или гематомы, сводятся к минимуму. Затраты на лечение также снижаются в результате отсутствия необходимости использования мембраны или фиксирующих ее дополнительных аппаратов, таких как минивинты или кнопки.
Обзор исследования
Пятьдесят два пациента, нуждавшиеся в увеличении объема альвеолярного гребня в боковых отделах зубных рядов, со стороны щеки и языка, получили лечение с применением костного цемента на основе сульфата кальция (Bond Apatite) в соответствии с протоколами проведения данных манипуляций.
Через четыре или более месяцев (в зависимости от ограничений, связанных с COVID-19) после аугментации имплантаты были установлены в ранее подготовленные области зубного ряда. В исследуемой группе в области шести латеральных резцов имелась не достаточная ширина альвеолярного гребня после первоначальной установки трансплантата и заживления, что по данным конусно-лучевой компьютерной томографии (КЛКТ), потребовало повторной установки трансплантата во время установки имплантата. Период динамического наблюдения перед основным этапом ортопедического лечения (минимум 4 месяца) был обязательным для всех пациентов основной группы, и было отмечено, что все имплантаты в основной группе остеоинтегрировались.
Хирургические манипуляции начали с назначения антибиотика моксициллина в дозе 500 мг каждые 8 часов, начиная за 1 день до операции и продолжая в течение 5 дней после операции. Три таблетки дексаметазона по 2 мг были даны за 30 минут до операции, чтобы свести к минимуму послеоперационный отек и связанную с ним боль от воспаления, вызванного отслоением лоскута.
Пациентам было проведено введение местных анестезирующих средств (артикаин 4%, с 1/100 000 адреналина). Был сделан крестообразный разрез вместе с вертикальным высвобождающим разрезом, который простирался на 3 мм апикально до слизисто-десневой линии так, чтобы высвобождающий разрез находился по меньшей мере в 10 мм от места, которое будет подвергнуто пересадке. Иллюстрация данного типа разреза показана на (фото 1). Полнотканный лоскут был приподнят, чтобы адекватно визуализировать весь дефект, который был запланирован для пересадки. Лоскут был удлинен апикально до границы мукогингивальной линии, чтобы обеспечить возможность замены лоскута на ткань с пересаживаемой области для осуществления закрытия разреза.
Фото 1. Продемонстрирован рекомендуемый крестообразный разрез с последующим высвобождающим вертикальным разрезом, проходящим апикально до слизисто-десневой линии.

Учитывая биологические и физические свойства связующего апатита, не рекомендуется использовать лоскут частичной толщины. Этот метод основан на том, чтобы не производить высвобождение надкостницы в апикальной области. Чтобы сохранить целостность надкостницы, лоскут удлиняют мезиодистально вместо его расслоения для улучшения первичного закрытия.
Корональный 3 мм лоскут, расположенный апикально к слизисто-десневому соединению, растягивается для достижения большего объема покрытия операционного поля поверх уже установленного сульфата кальция. После того, как лоскут поднят и обработан, можно визуализировать и подготовить зону-реципиента. Кортикальная пластинка в месте дефекта теперь перфорируется через равные промежутки времени примерно через каждые 5 мм хирургическим бором или пьезохирургическим наконечником для соединения клеток хозяина и кровоснабжения трансплантата, который будет помещен в нужное место. Это позволяет полноценно запустить процессы остеогенеза и ангиогенеза, облегчая превращение материала трансплантата в новую ткань кости-хозяина в течение периода заживления.
Bond Apatite поставляется в шприце с двумя отделениями, содержащем порошок (двухфазный сульфат кальция и кристаллы гидроксиапатита) в одном отделении и 9%-ный раствор хлорида натрия (NaCl) во втором отделении (фото 2). Чтобы активировать материал, стержень шприца продвигается вперед до тех пор, пока первый поршень не достигнет синей линии, отмеченной на тюбике шприца, так что жидкость смешивается с порошком, образуя влажный костный цемент. Торцевую крышку снимают со шприца, и материал вводят в костный дефект, подлежащий пересадке. Чтобы материал мог выйти из шприца, шприц должен быть наклонен примерно на 45 градусов относительно плоскости дефекта кости. Если держать его перпендикулярно поверхности участка, материал для трансплантации не будет выдавливаться из шприца. Для кристаллизации и затвердевания материала требуется около 3 минут. Материал необходимо поместить в дефект до затвердевания, в противном случае адгезия к кости-хозяину не произойдет.
Фото 2. Представлен шприц с материалом Bond Apatite содержащий в себе материал для осуществления трансплантации (сухой порошок) и жидкость, для формирования смеси, которая затвердеет в зоне трансплантации.

После того, как материал трансплантата помещен в зону реципиента, сухую стерильную марлю прижимают к поверхности в течение 3-4 секунд с помощью пальца, чтобы удалить остатки жидкости и прижать материал к кости реципиента. За этим следует дополнительное уплотнение марли периостальным элеватором течение 3-4 секунд. Материал должен быть хорошо утрамбован на месте трансплантации. После смешивания костного материала рабочее время до его застывания. составляет 2 минуты. Хирург должен без колебаний поместить материал для трансплантата в нужное место, во избежание преждевременного связывания тканей между собой. Не рекомендуется с усилием заполнять требуемую зону материалом так как это может привести к разрушению затвердевающих частиц. Процесс можно проводить несколько раз и заполнять последовательно несколько слоев нужной области при наличии крупных/ глубоких дефектов, для которых необходимо использование более одного шприца материала.
Затем лоскут перемещают над участком и накладывают шов по мезиальному краю от крестообразного разреза. Затем швы накладывают на дистальный край операционного поля, а затем на среднюю часть разреза, чтобы зафиксировать лоскут на месте. После этого наложение швов продолжается путем наложения дополнительных швов по мере необходимости либо для достижения первичного закрытия, либо для оставления минимального зазора до 2-3 мм по линии разреза. После чего идет наложение шва на вертикальный высвобождающий разрез. Авторы рекомендуют использовать шовный материал, срок службы которого составляет от 14 до 21 дня, прежде чем он потеряет свою целостность, чтобы обеспечить достаточное натяжение перед разрывом шва. Полигликолевая кислота, полиглекапрон или съемный шовный материал, такой как пролен или политетрафторэтилен, отвечают этим требованиям.
При использовании данной техники в сочетании с биосовместимостью материала костного цемента воспалительные процессы в результате проведенной процедуры в основном минимальны, и пациентам обычно не требуются наркотические обезболивающие средства на начальном этапе заживления. После операции пациентам, участвовавшим в данном исследовании было рекомендовано принимать ацетаминофен, две таблетки / капсулы по 500 мг (общая доза 1000 мг) каждые 6 часов, по мере необходимости для купирования болевых ощущений.
Через 4 месяца после операции, что должно быть достаточным промежутком времени для преобразования материала трансплантата, повторное вскрытие участка должно позволить оценить раннюю кость хозяина с некоторыми примесями кристаллов гидроксиапатита. Гистологически часть сульфата кальция полностью рассасывается и заменяется созревающей костью хозяина; крупные кристаллы гидроксиапатита (10% от исходного материала трансплантата) остаются, а кристаллы среднего размера рассасываются.
У 46 из 52 пациентов, участвовавших в исследовании, была разрешена установка имплантатов через 4 или более месяцев после латерального увеличения запланированных мест имплантации. В остальных шести случаях объем полученной кости и ширина альвеолярного гребня были недостаточными для размещения имплантата, что потребовало пересадки ткани с дополнительной порцией Bond Apatite и периодом заживления перед установкой имплантата.
Подробные сведения о пациентах, принявших участие в проводимом исследовании:
Пациент 1 была женщина 42 лет, зона вмешательства в ее случае была в боковых отделах нижней челюсти, операция по пересадке тканного трансплантата была осуществлена в январе 2020 года, имплантаты ей были установлены в июле 2020 года, дополнительных процедур по пересадке тканей не потребовалось.
Пациент 2 была женщина 71 года, зона вмешательства затрагивала передний отдел верхней челюсти, процедура трансплантации тканей была проведена в июле 2018 года, имплантаты установили в январе 2020 года, дополнительных процедур по пересадке тканей не потребовалось.
Пациент 3 была также женщина 71 года, зона вмешательства также затрагивала передний отдел верхней челюсти, процедура трансплантации тканей была проведена в июле 2018 года, имплантация состоялась в январе 2019 года, без каких либо дополнительных манипуляций.
Пациент 4 также женщина 65 лет, зона проведения операции находилась в переднем отделе нижней челюсти, трансплантация тканей была проведена в июле 2017 года, последующая имплантация была выполнена в октябре 2017, дополнительных вмешательств не потребовалось.
Пациент 5 женщина 55 лет, операция по трансплантации тканей была проведена в боковых отделах нижней челюсти, трансплантация тканей была выполнена в июле 2017 года, имплантация проводилась в декабре 2017.
Пациент 6 была женщина 72 лет, зона проведения операции затрагивала боковые отделы верхней челюсти, оперативное вмешательство было проведено в декабре 2019 года, имплантация осуществлена в марте 2020 года, в данном потребовалась повторно провести трансплантацию ткани перед имплантацией.
Еще в пяти случаях пациентам потребовалась повторная процедура трансплантации тканей перед имплантацией, а именно женщине 70 лет у которой планировалась процедура имплантации в боковых отделах верхней челюсти. Женщине 69 лет, зона проведения операции затрагивала боковые отделы верхней челюсти. Женщине 22 лет, была проведена процедура трансплантации тканей в переднем отделе верхней челюсти, операция по трансплантации была проведена в декабре 2020 года, постановка имплантатов в июне 2021. У женщины 71 года также возникла необходимость в повторном проведении процедуры трансплантации в боковых отделах верхней челюсти и еще одному мужчине 36 лет повторно проводили процедуру пересадки ткани трансплантата в боковом отделе верхней челюсти при подготовке к имплантации. В остальных случаях операция прошла успешно и не требовала дополнительных вмешательств для осуществления имплантации.
Примеры клинических случаев
Один участок
58-летний мужчина обратился в клинику с жалобами на отсутствие правого первого премоляра верхней челюсти, который не смог развиться в подростковом возрасте и желанием восполнить данный дефект зубного ряда.
Для оценки наличия костной ткани в данной области было выполнено КЛКТ исследование (фото 3). Со стороны щеки альвеолярный гребень имел значительный дефицит тканей по ширине, что препятствовало установке имплантата на всю его длину; в противном случае раскрытие данной области привело бы расхождению между длиной имплантата в апикальной его трети и шириной костной ткани. Был откинут лоскут в данной области и дефект визуализирован. Для установки имплантата была произведена остеотомия, и имплантат был помещен в кость (фото 4). Материал Bond Apatite был смешан в шприце и введен в область дефекта со стороны щеки, после чего его полностью уплотнили в нужной области (фото 5).
Фото 3. Поперечные срезы КЛКТ, демонстрирующие недостаточную ширину альвеолярного гребня в месте первого премоляра справа, что указывает на резорбцию кости после удаления в прошлом.

Фото 4. Установка имплантата в области отсутствующего премоляра справа, видна вогнутость части альвеолярного гребня в месте установки со стороны щеки, расположенная апикально по отношению к верхней трети альвеолярного гребня.

Фото 5. Полость в альвеолярном гребне со стороны щеки заполнена материалом Bond Apatite, для восстановления целостности данной области без необходимости использования покрывающей мембраны.

Через четыре месяца после пересадки и немедленной установки имплантата КЛКТ исследование подтвердило заполнение дефекта со стороны щеки, который был восстановлен материалом цемента и установленный имплантат полностью вошел в образованную кость (фото 6).
Фото 6. Продемонстрированы срезы КЛКТ исследования через 4 месяца после операции, визуализируется костная мозоль образованная, путем замены материала костного цемента из сульфата кальция на новую кость хозяина.

Несколько участков для восполнения
Пациентка 66 лет обратилась с намерением заменить полный съемный протез на не съемную конструкцию для восстановления зубной дуги с опорой на имплантаты. Осмотр выявил значительный дефект лица в области центральных и боковых резцов на верхней челюсти и толщину альвеолярного гребня с острие ножа, что препятствовало имплантации в данной области. Это было подтверждено при отделении лоскута (фото 7). Материал Bond Apatite был смешан и помещен в область дефекта вестибулярно (фото 8) и хорошо утрамбован, затем область была была закрыта мягко-тканным лоскутом и ушита.
Фото 7. Во время поднятия лоскута очевидна недостаточность ширины альвеолярного гребня в области отсутствующих центральных и боковых резцов верхней челюсти с двух сторон, что препятствовало установке имплантата и расслоению данного участка альвеолярного гребня.

Фото 8. Продемонстрирован момент заполнения материалом Bond Apatite области дефекта со стороны щеки, чтобы создать достаточную толщину альвеолярного гребня для дальнейшей установки имплантата после заживления ткани трансплантата.

После 4 месяцев периода заживления трансплантата зона интереса была повторно раскрыта для оценки толщины альвеолярного гребня и возможности дальнейшей установки имплантата (фото 9). Рентгенограмма была сделана после установки имплантата в запланированном месте (фото 10).
Фото 9. После 4 месяцев заживления и созревания костной ткани в области трансплантата при поднятии лоскута выявлено увеличение ширины альвеолярного гребня, что позволило установить имплантат.

Фото 10. Рентгенограмма после установки имплантата в зоне трансплантации тканей во фронтальном отделе верхней челюсти.

Боковые отделы нижней челюсти
69-летняя пациентка обратилась с просьбой об имплантации для восстановления отсутствующих зубов в боковом отделе нижней челюсти слева, которые были удалены несколько лет назад. Было выполнено КЛКТ исследование и проанализированы поперечные срезы при планировании установки имплантатов. Адекватная ширина альвеолярного гребня была отмечена около передней границы ментального отверстия, но по дистальной границе ширина была недостаточной (фото 11). Область была раскрыта хирургически и и два имплантата были установлены мезиально к ментальному отверстию. Хирургический бор использовался для перфорации боковой части гребня дистальнее ментального отверстия, чтобы создать точки кровотечения (фото 12). Материал Bond Apatite смешали и поместили поверх ранее перфорированной кости и покрывая только что установленные имплантататы (фото 13).
Фото 11. Продемонстрированы поперечные срезы КЛКТ боковых отделов нижней челюсти демонстрирующие объем альвелярного гребня с острие ножа в запланированных местах имплантации.

Фото 12. Кортикальная пластина была перфорирована там, где будет размещен трансплантат, чтобы расширить альвеолярный гребень в боковом отделе при подготовке к имплантации.

Фото 13. Материал из костного цемента на основе сульфата кальция был помещен поверх перфорированного альвеолярного гребня в боковом отделе, с целью увеличения его ширины для последующей установки имплантатов.

После 4 месяцев периода заживления, чтобы оценить возможность новой кости созреть и полноценно сформироваться было проведено повторное КЛКТ исследование. На поперечных срезах визуализировалось увеличение ширины альвеолярного гребня области, дистальнее от ментального отверстия, что позволяло осуществить установку имплантатов (фото 14). Область была обнажена и подготовлена к остеотомии, затем были установлены имплантаты (фото 15).
Фото 14. Продемонстрированы поперечные срезы КЛКТ через 4 месяца после операции, на них четко видно увеличение ширины альвеолярного гребня, что позволяет установить имплантаты.

Фото 15. По истечении 4-х месячного периода заживления области трансплантации и созревания кости имплантаты были установлены в успокоившуюся зону проведенной ранее трансплантации.

Обсуждение
Недостаточная ширина гребня для размещения имплантата и обеспечения возможности охвата имплантата костью является распространенным явлением, связанным с резорбцией с течением времени после удаления или с заболеваниями пародонта, связанными с присутствующим или недавно удаленным зубом. Костная пластика становится необходимой для изменения оставшегося объема альвеолярного гребня, что бы подготовить его к установке имплантата. Как уже обсуждалось, в литературе были представлены различные материалы для костных трансплантатов, все с плюсами и минусами, связанными с их использованием. Эти материалы требуют первичного закрытия вышележащего лоскута для предотвращения инфекции и потери материала трансплантата; кроме того, размещение мембраны, рассасывающейся или не рассасывающейся, имеет решающее значение для успеха лечения. При использовании мембраны увеличиваются затраты на лечение, связанные с самой мембраной, а также с фиксирующей ее аппаратурой, такой как винты или кнопки, необходимыми для обеспечения стабильности мембраны в месте операции. Кроме того, необходимость в мембране требует дополнительных хирургических навыков и более длительного времени приема для проведения лечения. Кроме того, для обеспечения закрытия без натяжения при таких процедурах требуется большее высвобождение ткани трансплантата.
В идеале, размещенный материал трансплантата должен со временем превращаться в кость хозяина, действуя как распорка и каркас, который позволяет клеткам-хозяевам создавать внутри него кость, одновременно стимулируя ангиогенез, в результате чего получается "живая" активная кость, которая может интегрироваться в имплантаты, размещенные внутри нее после заживления. Различные костные материалы для трансплантации имеют разную скорость резорбции. Когда трансплантат для замены кости рассасывается слишком быстро, объем теряется, поскольку твердая ткань хозяина не может достаточно быстро заменить трансплантат. Когда резорбция происходит слишком медленно, время лечения удлиняется, в особенности период покоя перед непосредственной установкой имплантатов.
Таким образом, материал должен сохранять требуемый объем заполняемого пространства в течение периода времени, который позволяет организму пациента заменить его на новую образовавшуюся кость, соответственно.
Рассасываемость - еще одна проблема, имеющая решающее значение для материала трансплантата. Полностью ли рассасывается материал трансплантата или остаются его части? Сколько осталось, и может ли это повлиять на интеграцию, уменьшая контакт кости с имплантатом, помещенным в нее? Аллотрансплантаты и аутогенная кость частично или полностью рассасываются в течение определенного периода времени. Скорость основана на плотности частиц, при этом кортикальная кость прослужит дольше, чем губчатая. Сообщалось, что ксенотрансплантаты, такие как бычья кость, не рассасываются, и частицы остаются заключенными в соединительную ткань и кость хозяина. Синтетические материалы, в зависимости от их состава, либо полностью рассасываются (сульфат кальция), либо частично рассасываются (биостекло), либо остаются нетронутыми в течение длительного времени (гидроксиапатит).
контактом кости с имплантатом, который может варьироваться в зависимости от множества факторов, таких как микро- и макроповерхность имплантата и тип кости, которая окружает имплантат после костного заживления и интеграции. Преобразование материала трансплантата в кость-хозяина имеет решающее значение для долгосрочного поддержания кости вокруг имплантата. Проблемы с заживлением вокруг области трансплантата и/или зоны имплантации в непосредственной близости от гнезда могут привести к воспалению и потере костной ткани.
Что касается хирургического подхода, хирург не всегда может предсказуемо и безопасно полностью отслоить лоскут, чтобы закрыть место от проведенной трансплантации тканей, ввиду анатомических или других особенностей организма. Риски проведения данной манипуляции включают сильное кровотечение и рассечение ментального нерва или другой иннервирующей структуры во время выполнения надкостничного разреза. В этих случаях доступно несколько вариантов решения. Ronda и Stacchi обсуждали сложную конфигурацию самих трансплантатов, во избежание повреждения критических анатомических структур во время отслоения лоскутов. Они использовали технику "расчесывания" после надреза надкостничного слоя, что бы помочь высвободить ткани для дальнейшего коронарного закрытия области. Одна из проблем данного метода заключается в том, что при увеличении силы кровотечения это отрицательно сказывается на способности хирурга видеть более мелкие кровеносные сосуды или нервы, которые могут быть случайно перерезаны острым скальпелем. Кроме того, иссечение надкостницы может вызвать дальнеейшее формирование рубцовой ткани, что может в свою очередь привести к деформации лоскута во время периода заживления.
Во время процедуры, описанной здесь, основание надкостничной ткани не отделяется от остальной ткани надкостницы Напротив, примерно на расстоянии 3 мм от верхушки слизисто-десневого соединения надкостничная ткань растягивается в венечном направлении. В данной области мышечный слой минимален, поэтому слизистая оболочка будет минимально оттягиваться назад в апикальном направлении. Как описали Payne и Cobb, если какая-либо часть материала трансплантата осталась не покрыта тканью, то у организма есть способность к эпителизации поверх области раны. Кроме того, может произойти еще одно интересное возможное явление. Если небольшое натяжение остается в области ткани надкостницы во время какой-либо фазы процесса заживления, это может вызвать самопроизвольный остеогенез. Zakaria с коллегами провел исследование в 2012 году, используя специально разработанный процесс периостальной дистракции, чтобы проверить свою гипотезу. Основываясь на результатах аналогичных исследований, показавших, что внутренний слой надкостницы является источником костных клеток, ученые доказали что постоянное растяжение этой ткани в течение 6 недель помогло сформировать значительный объем кости при использовании кролика в качестве модели эксперимента.
Увеличение объема мягких тканей и альвеолярного гребня у людей с помощью туннельного подхода хорошо освящено. Lee описал 60 клинических случаев увеличения ширины альвеолярного гребня с последующим наблюдением до 30 месяцев. Его методика не предполагает использования барьерных мембран или высвобождающих разрезов для надкостничных лоскутов, чтобы сохранить целостность этой ткани. Используя инструменты особого дизайна и специфическую комбинацию материалов для трансплантации в комбинации с факторами роста, его исследование подтвердило увеличение вертикальной высоты альвеолярного гребня. Результаты были проанализированы на основе сравнения данных срезов трехмерных КЛКТ исследований и гистологических данных в совокупности с прилагаемой клинической документацией для апробации данной методики. Данные манипуляции основаны на выводах сделанных коллегой Rapp, том, что добавление тканей родной надкостницы равен нулю, когда она источена в результате травмы или других процессов. Как и в методике, пр меняемой Lee, процесс, описанный в данной статье, предназначен для растяжения тканей лоскута при осуществлении манипуляции по трансплантации, а не надреза надкостницы с максимальным сохранением ее биологической целостности.
Заключение
Практикующий врач часто сталкивается с ситуацией наличия узкого альвеолярного гребня у пациента, что затрудняет или делает невозможным установку имплантата и требует модификации гребня, чтобы для осуществления последующей имплантации. Многие факторы влияют на выбор техники, используемой для увеличения ширины альвеолярного гребня в боковом отделе зубных рядов. Следует отдавать предпочтение относительно простой технике, которая может способствовать увеличению ширины гребня при одновременном уменьшении воспалительной и послеоперационной боли у пациента. Представленная здесь хирургическая методика, в которой используется материал костного цемента на основе сульфата кальция Bond Apatite при лечении пациентов с малой шириной альвеолярного гребня, представляет собой инновационный, простой и минимально инвазивный хирургический подход, связанный со свойствами самого материала. Послеоперационные боли или воспалительные реакции минимальны во время процесса заживления, которое происходит быстрее благодаря консервативному хирургическому подходу. Данное исследование продемонстрировало, что использование представленной техники и материала позволяют увеличить объем альвеолярного гребня с 2 мм до 6 мм.
Использование материала для трансплантации на основе сульфата кальция, такого как тот, который использовался в этом исследовании, имеет клинические преимущества, когда требуется увеличить ширину альвеолярного гребня в боковых отделах зубных рядов с целью обеспечения условий для последующей имплантации, по сравнению с другими костными материалами для трансплантации. После заживления 90% материала трансплантата превращается в костную ткань в течение 4-6 месяцев в зависимости от объема размещенного костного апатита по сравнению с другими костными материалами для трансплантации. После заживления 90% материала трансплантата превращается в костную ткань в течение 4-6 месяцев в зависимости от объема размещенного костного апатита. Таким образом, происходит регенерация кости, а не срастание поврежденной кости.
Кроме того, исключается использование коллагеновой мембраны и фиксирующих винтов / кнопок, гвоздей, что помогает снизить стоимость процедуры и делает ее более доступной для большего числа пациентов, желающих установить имплантат в области утраченных зубов на верхней и нижней челюсти. Данный метод относительно прост в исполнении и имеет меньше потенциальных осложнений, чем другие процедуры увеличения гребня высоты альвеолярного гребня.
Авторы:
David Baranes, DDS
Gregori M. Kurtzman, DDS
Robert A. Horowitz, DDS





























































































































































0 комментариев