Пародонтальная пластическая хирургия играет весьма важную роль в общей пародонтологической практике. В США как минимум 90% населения в возрасте старше 60 лет характеризуется наличием, по крайней мере, 1-го зуба с 1-милиметровым уровнем рецессии, а у 40% этой же возрастной группы наблюдаются рецессии, превышающие 3 мм. Области рецессии, не подлежащие лечению, значительно ухудшают пародонтологический статус пациента, что, в свою очередь, может привести к ряду смежных стоматологических осложнений.
Для решения проблем, связанных с подобными ограничениями, врачи часто применяют различные заменители аутогенной соединительной ткани по типу аллографта или же ксенографта. Играя роль своеобразного каркаса и позволяя успешно протекать процессу фиброкондукции, данные материалы помогают добиться довольно успешного клинического результата. Дериват эмалевой матрицы (ЭМД), полученный от представителей другого вида, часто используется в качестве «стимулирующего» агента, а комбинирование вместе с коронально-спозиционированным лоскутом способствует так называемой пародонтальной регенерации. При этом эффективность данного подхода является повышенной только по сравнению с изолированным использованием коронально-перемещенного лоскута без каких-либо дополнительных стимулирующих агентов. Доказательств, подтверждающих более успешное использование ЭМД по сравнению с контрольными соединительными или аллотрансплантатными материалами, пока еще не получено, а исследования данного вопроса продолжают активно проводиться.
В последнее десятилетие более часто стали использовать так называемые биологические модификаторы, полученные из крови человека, которые способствуют заживлению ран в области твердых и мягких тканей. Плазма, обогащенная тромбоцитами (Platelet-rich plasma - PRP), относиться к первому поколению подобных биологических агентов. Отсутствие в составе таковой факторов роста твердых тканей и соответствующих физических свойств, а также сложный протокол получения конечного материала и слишком быстрое высвобождение определённых агентов – все это поставило под вопрос эффективность использования PRP в практике челюстно-лицевой хирургии. Результаты использования данного вида плазмы для восстановления мягкотканого покрытия корня и в ходе других процедур в области слизистой также остаются неоднозначными. В 2013 году Choukroun представил факторы роста крови, известные как улучшенный фибрин, обогащенный тромбоцитами (APRF - advanced platelet-rich fibrin). Простота приготовления данного агента (центрифугирование без применения каких-либо антикоагулянтных препаратов), а также наличие в его составе костных морфогенетических белков вывело APRF на лидирующие позиции с точки зрения частоты использования при проведении оперативных вмешательств в челюстно-лицевой области.
Цель данной статьи состоит в том, чтобы обсудить преимущества и возможности клинического применения APRF в пародонтальной пластической хирургии, особенно в случаях восстановления мягкотканного покрытия поверхности корня.
Основы основ: PRF и APRF
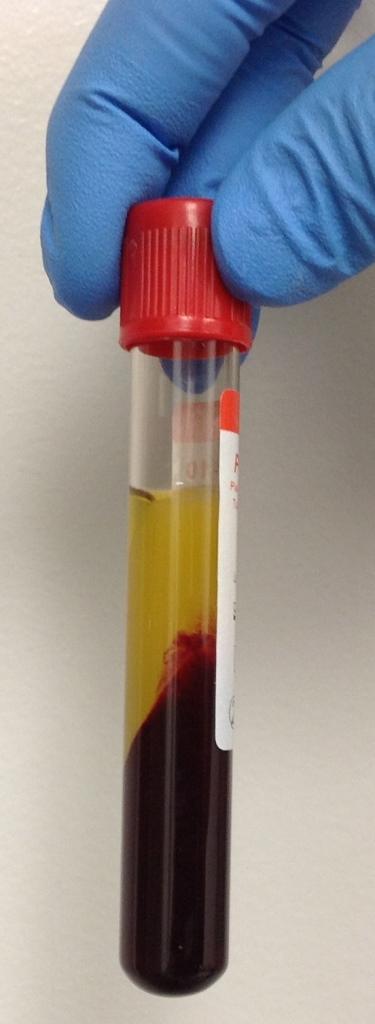
Фибрин, обогащенный тромбоцитами (PRF) представляет собой концентрат тромбоцитов второго поколения, полученный в ходе одиночного центрифугирования без использования антикоагулянтов. Полученный PRF-сгусток является физиологической трехмерной матрицей, насыщенной тромбоцитами и лейкоцитами. Альфа-гранулы, секретируемые тромбоцитами, которые находятся в мембране, выделяют специфические факторы роста, которые способствуют медленной и естественной резорбции самой структуры мембраны (15 дней). Данные факторы включают тромбоцитарный фактор роста (PDGF- platelet-derived growth factor), трансформирующий фактор роста-b (TGF-b-transforming growth factor-b), фактор роста эндотелия сосудов (VEGF- vascular endothelial growth factor), эпидермальный фактор роста (EGF - epidermal growth factor) и инсулиноподобный фактор роста-1 (IGF-1- insulin-like growth factor-1). Получение APRF базируется на аналогичном протоколе, при котором лишь изменяется структура используемой пробирки из пластиковой на стеклянную, что помогает увеличить эффект хелирования (фото 1). Кроме того, в ходе получения APRF уменьшается время и параметры самого центрифугирования (от 2700 об./12 мин. до 1200 об./8 мин.). Изменяя эти параметры, Choukroun и коллеги обнаружили, что полученные таким образом APRF-мембраны содержат увеличенное количество фактора VEGF (ответственного за более быструю неоваскуляризацию области вмешательства), моноцитов (ответственных за высвобождение BMP) и внеклеточный матрикса (фибронектина). Omar и Rocher установили, что моноциты являются критически важным источником аутогенного костного морфогенетического белка-2 (BMP-2) и костного морфогенетического белка-7 (BMP-7), что объясняет улучшенные характеристики APRF по сравнению с PRF.
Фото 1. Сгусток APRF: благодаря более медленному центрифугированию больше клеток могут попасть в структуру сгустка.
Периодонтальное применение PRF / APRF
Исследования in vitro
Tsai и коллеги исследовали биологические эффекты PRF на десневые фибробласты, клетки периодонтальной связки, эпителиальные клетки ротовой полости и остеобласты. В исследуемой культуре была отмечена PRF-стимулированная клеточная пролиферация (с 20% приростом) и повышение скорости пролиферации эпителия (по причине использования TGF-b). Данный результат обосновал перспективную эффективность использования PRF в пародонтологической практике. Не и коллеги провели исследование для определения влияния PRF на параметры клеточной связи, пролиферации и фосфорилирование остеобластов человека. Удалось установить, что PRF позволяет увеличить показатели связи остеобластов, а также их пролиферацию, одновременно повышая при этом уровень ассоциируемого с производством коллагена белка. Такой кумулятивный эффект позитивно влияет на процессы промоции костной регенерации. Результаты, полученные Kang и коллегами, подтверждают целесообразность использования PRF в качестве биологического каркаса и резервуара факторов роста. Экстракт (концентрат) PRF (PRFe) доказательно увеличивает параметры пролиферации, миграции и дифференциации стволовых клеток костного мозга человека в области альвеолярного гребня. Кроме того, трансплантация свежего PRF в череп подопытных мышей улучшала показатели регенерации дефекта критического размера. В исследовании Chang и Zhao было установлено, что активация PRF вызывает экспрессию фосфорилированной внеклеточной сигнально-регулируемой протеинкиназы (p-ERK) и остеопротегерина (OPG), что еще раз указывает на позитивный эффект обогащенного тромбоцитами фибрина для регенерации костной ткани. Кроме того, Huang и коллеги продемонстрировали, что PRF стимулирует пролиферацию и дифференциацию клеток пульпы зуба путем усиления экспрессии OPG и ALP. Более позднее исследование подтвердило повышение уровня экспрессии p-ERK, OPG и ALP после применения PRF, что может быть практически использовано при выполнении различных пародонтальных манипуляций.
В отдельных исследования также был описан опыт использования PRF в качестве регенеративного материала для восстановления периодонтальных дефектов. Chang и Zhao представлити результаты наблюдений за изменениями в структуре внутрикостного дефекта после его реконструкции с помощью PRF. Они установили, что тромбоцитарный концентрат способствует уменьшению размеров пародонтального кармана и увеличению уровня пародонтального прикрепления, при этом одновременно способствуя улучшению параметров плотности костной ткани в области ранее находившегося дефекта. Sharma и Pradeep обнаружили более динамическое уменьшение глубины зондирования и одновременное восстановление пародонтального прикрепления при лечении 3-стеночных костных дефектов с использованием PRF и проведением процедуры открытого кюретажа по сравнению с результатами лечения, в ходе которого проводили только открытый кюретаж дефектных областей. Аналогичные результаты были получены при сравнении этих же подходов вмешательства, но уже в клинических случаях обнажения участков фуркации дистальных зубов. Pradeep, закончив анализ результатов лечения внутрикостных дефектов с использованием PRF и PRP среди пациентов с хроническим пародонтитом, пришел к выводу, что значительных различий между клинической эффективностью применения вышеупомянутых тромбоцитарных концентратов не наблюдалось.
Периодонтальные пластические процедуры
В литературе по этому вопросу наблюдается своеобразный дефицит данных. Aroca и коллеги проводили пародонтологическое лечение 20 пациентов, формируя в ходе вмешательства коронально перемещенный лоскут с и без дополнительного использования PRF. Через 6 месяцев в группе исследования авторы отметили увеличение зоны кератинизированной ткани, но более низкий процент пациентов с полностью восстановленным мягкотканым покрытием области корней. Aleksic и Jankovic в ходе независимых исследований сравнивали трансплантаты соединительной ткани и PRF, используемый в качестве трансплантата, для лечения рецессий 1 и 2-го класса по Миллеру в группе, состоящей из 19 пациентов. Через 6 месяцев между исследуемой и контрольной группами не было обнаружено статистической разницы относительно объема полученного корневого покрытия и увеличения зоны кератинизированной ткани. Параметры комфорта выполнения процедуры и минимизации послеоперационных осложнений были статистически меньше в группе пациентов, в ходе лечения которых использовали PRF, поскольку в таких случаях удавалось избежать необходимости забора аутологичного соединительнотканного трансплантата из области неба. Tunali и Ozdemir провели анализ результатов восстановления рецессий у 20 пациентов, в ходе которого снова-таки использовали соединительнотканный трансплантат и PRF для сравнения. Мониторинг пациентов проводился на протяжении 12 месяцев. Оба метода лечения помогли значительно уменьшить уровень рецессии (соответственно на 76% и 77%) и увеличить уровень клинического прикрепления десен (до 2,90 мм и 3,04 мм соответственно).
Механизм действия
Основной проблемой, которую мы обнаружили в ходе анализа литературы, является сравнение PRF / APRF с трансплантатом из соединительной ткани. Несмотря на то, что эти два материала имеют схожие физические характеристики, специфика работы с таковыми и окончательные результаты их применения значительно отличаются. Соединительнотканный трансплантат, собранный из области неба, характеризуется генетически выраженным свойством к кератинизации. Karring и коллеги описали данную концепцию, используя в качестве исследуемой модели животных. Реципиентная область, таким образом, никак не влияет на качество или количество полученной в результате мягкой ткани. Данный механизм действия и называется фиброгенезом. С другой стороны, модель APRF работает совсем иным путем. Фибрин следует рассматривать еще и как биологическую матрицу: при повышенном количестве VEGF и других факторов роста, APRF будет стимулировать процесс образования новой ткани в реципиентной области. Таким образом, качество данной новосформированной ткани, по большому счету, будет зависеть от успешности процедуры подсадки APRF. Если у больного наблюдается некий остаточный объем кератинизированной ткани, мы с помощью APRF сможем запустить процесс формирования еще большего количества данного типа слизистой. Если же в области вмешательства присутствует только неприкреплённый тип слизистой, то APRF, в свою очередь, будет способствовать увеличению только данного типа ткани. Такой механизм именуется фибропромоцией. Для возникновения фибропромоции необходимы всего 2 условия: сохранение биологической напряженной целостности и объема. При несоблюдении данных условий использование APRF приведет к получению неприемлемого клинического результата.
Сохранение биологической напряженной целостности
Ingber, врач из Гарвардского института медицины, установил, что положительные или отрицательные силы (напряжение и давление), возникающие на поверхности клетки, передаются через комплексы фитомиозиновых филаментов через цитоскелет и, в конце концов, достигают ядра клетки. Следовательно, существует баланс между внеклеточными силами и внутриклеточным потенциалом, при котором все приложенные силы находятся в диапазоне толерантности. Данный диапазон является специфическим как для отдельных групп клеток, так и для органов в целом. Биологическая целостность напряжения помогает перенаправлять приложенные силы и организовывать многомолекулярный ответ на действующий стрессовый фактор во всех системах органов. Когда механические внешние силы, приложенные к поверхности клетки (через механорецепторы на поверхности клетки), выходят за рамки внутриклеточного диапазона толерантности, наблюдаются изменения в цитоскелетной структуре и внутриклеточных биохимических процессах. Одним из клинических трансляционных применений данной концепции является формирование взаимосвязи между напряжением лоскута и неоангиогенезом. Mammoto показал на животных моделях, что растяжение слизистой оболочки мышей уменьшало количество секретируемого VEGF и, таким образом, наблюдалось сосудистое сокращение лоскута. Pini Prato и коллеги подтвердили эту гипотезу, проведя рандомизированное контролируемое клиническое исследование для того, чтобы измерить напряжение коронально спозиционированного лоскута перед наложением швов и сравнить уровни редукции рецессии после коронарного смещения тканей с формированием напряжения и без него. Статистический анализ показал, что минимальное натяжение лоскута (от 0,0 г до 0,4 г) способствовало уменьшению уровня рецессии, в то время как более высокие показатели напряжения (от 4 г до 7 г) не обеспечивали аналогично эффективных результатов. Marx приписывал успех процедуры вертикального увеличения костной ткани именно пассивному позиционированию лоскута без излишнего напряжения, который помогал поддерживать клеточную целостность костного трансплантата.
Объем
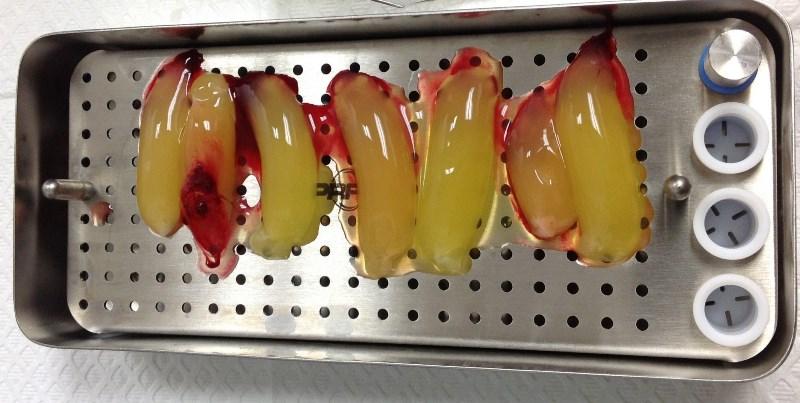
Чтобы количественно оценить любую клинически значимую фибропромоцию, стимулированную APRF, необходимо собрать определенное количество тромбоцитов и определить количество секретируемых факторов роста. Данные факторы роста являются упакованными в плотную и хорошо организованную фибриновую сетку, и в ходе резорбции мембраны будут выделятся «по капле», обеспечивая постоянный и стабильный приток биологических агентов в течение следующих 12-15 дней (скорость резорбции мембран APRF). По этой причине качество и количество мягких тканей, полученных после операции, напрямую связано с количеством привитой фибриновой матрицы. В ходе количественного гистоморфометрического анализа проникновения клеток, проведённого Gahnaati и коллегами, была проведена оценка состава мембран APRF. Шестьдесят восемь процентов структуры APRF-мембран составляют тромбоцитарные факторы роста, при чем полученные лабораторные данные коррелируют с клиническим опытом авторов: таким образом, был сформулирован вывод о том, что для клинического наблюдения за процессом фибропромоции требуется использовать как минимум 3-4 мембраны на каждую пару проблемных зубов (фото 2 - 4).
Фото 2. APRF сгустки перед прессованием: прессование помогает получить гомогенные мембраны, подходящие для клинического использования.
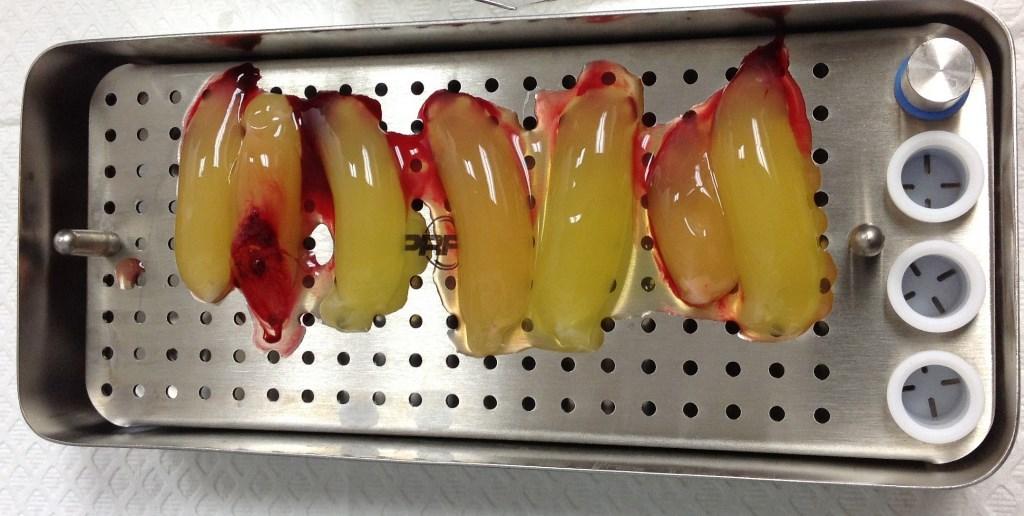
Фото 3. APRF мембраны после прессования.
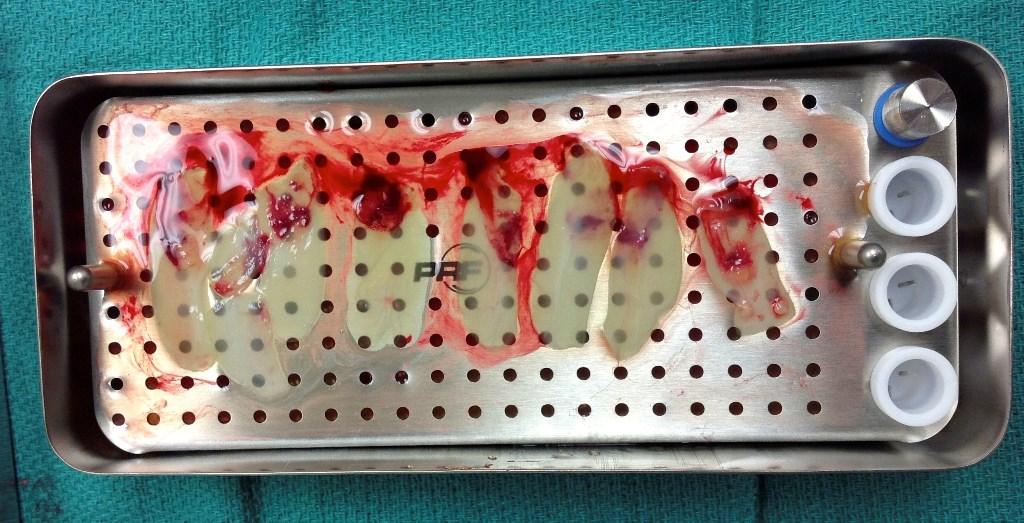
Фото 4. Вид APRF мембраны, готовой для использования: 3-4 мембраны необходимы для достижения клинического эффекта при коррекции мягких тканей.
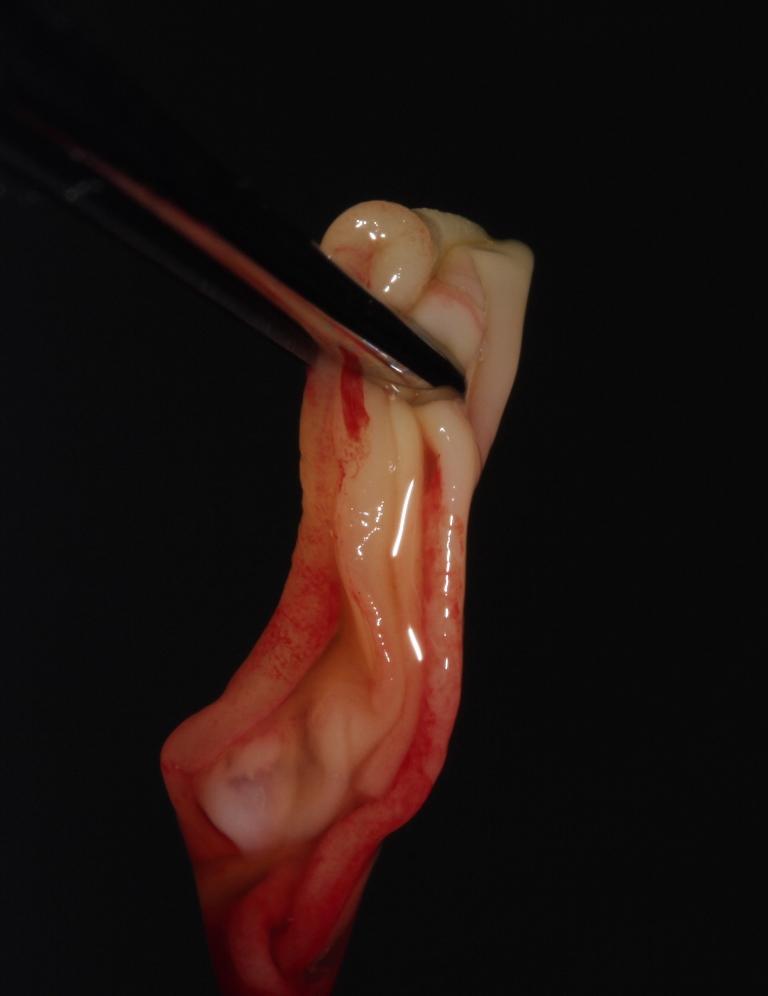
Клинические манипуляции
Предлагаемая хирургическая методика предполагает упрощение техники проведения вестибулярного субпериостального надреза для доступа и усовершенствование туннельной техники вмешательства как таковой.
Разрез
Вертикальный разрез слизистой оболочки позволяет провести полные горизонтальные (мезиодистальные) и апикокорональные надрезы для сепарации полнотканного лоскута, обеспечив при этом пассивное корональное смещение слизисто-десневого комплекса (фото 5 - 6).
Фото 5. Вид до лечения: рецессия 2 класса по Миллеру, связанная с нарушением позиции зуба.
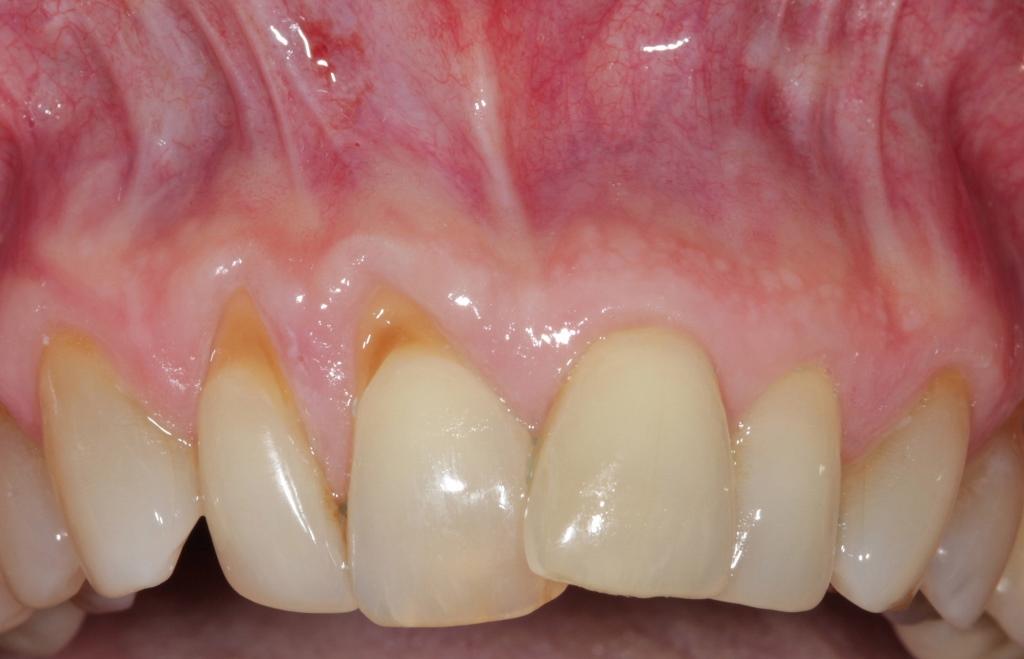
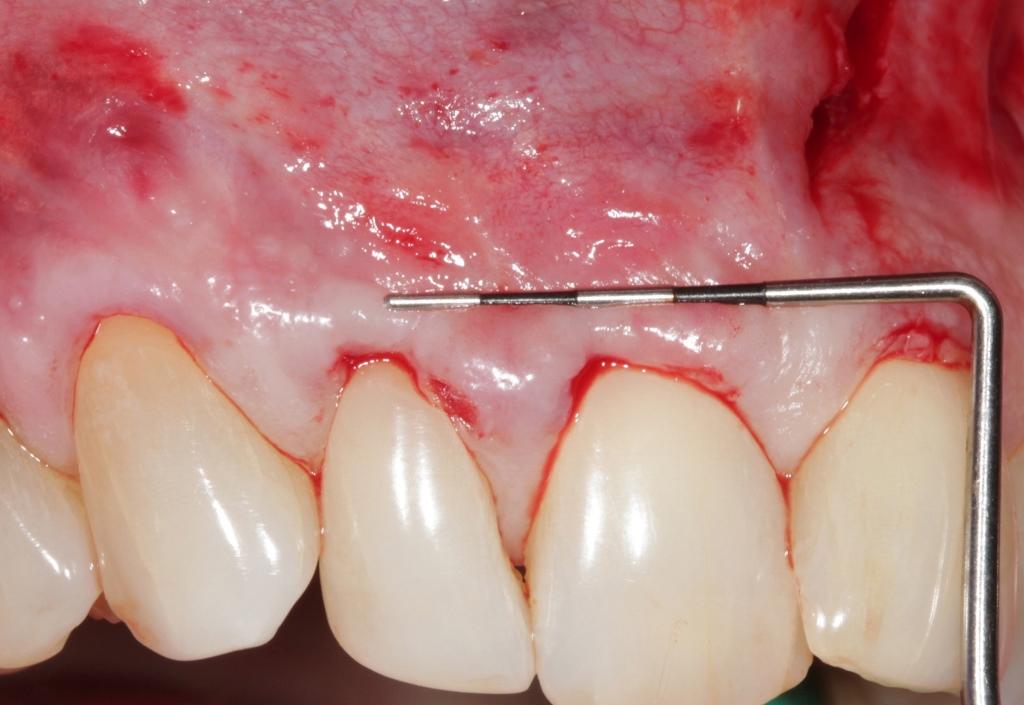
Фото 6. Разрез и послабление лоскута. Вестибулярный субпериостальный разрез позволяет отсепарировать полнотканный лоскут.
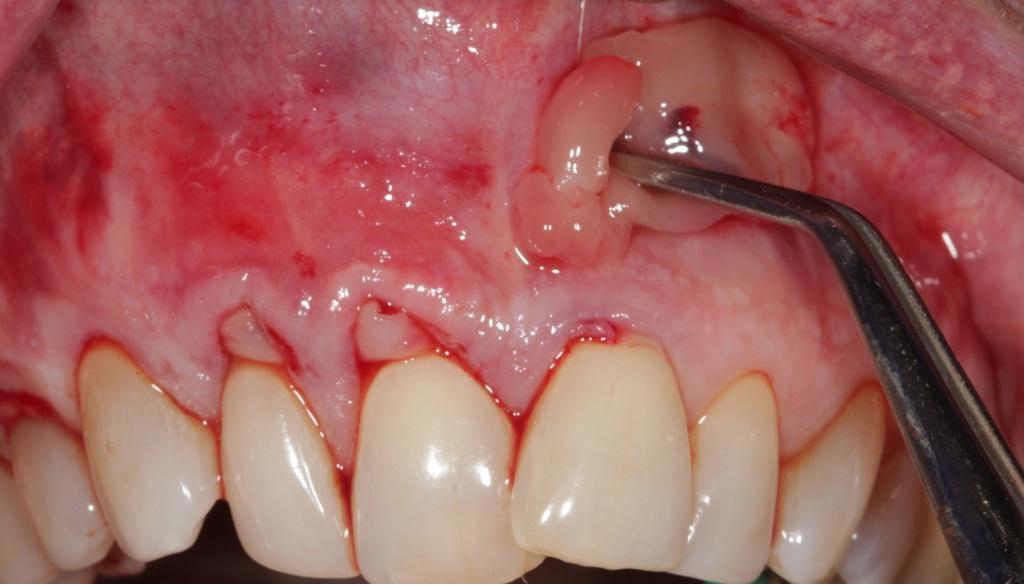
Подготовка корней и деконтаминация
Данные процедуры аналогичны таковым, уже ранее предложенным в протоколах выполнения пародонтальных операций в области мягких тканей ротовой полости. Очистка корня обеспечивает формирование его плоской и гладкой поверхности, позволяя, таким образом, увеличить объем размещаемого APRF и уменьшить общее натяжение лоскута. Деконтаминация области корня проводится посредством 17% этилендиаминтетрауксусной кислоты (ЭДТА) (в ходе двойного нанесения на протяжении 2,5 минут), что помогает элиминировать смазанный слой и улучшить условия для восстановления пародонтального прикрепления.
Объемное наполнение
Для достижения клинически значимого результата клиницисты должны использовать минимум 3-4 мембраны на пару проблемных зубов. «Концепция рюкзака», то есть заполнение тромбоцитарным сгустком от дистальной до мезиальной поверхностей обеспечивает однородную плотность всего объема мембраны APRF (фото 7). Благодаря пассивной позиции лоскута и плотному наполнению сформированного кармана, удается провести ушивание лоскута без излишнего напряжения, что является ключевым принципом биологической напряженной целостности.
Фото 7. Упаковка APRF мембраны.
Ушивание
Апикальные периостальные матрацные швы являются основными для фиксации тканей после выполнения вмешательства. В ходе ушивания важно избежать натяжения швов в области мембраны, а также обеспечить стабилизацию и поддержку тромбоцитарного концентрата (фото 8).
Фото 8. Ушивание посредством периостальных швов ниже слизисто-десневой границы поможет вместить комплекс APRF/лоскут более коронально, и, таким образом, добиться лучшей кератинизации.
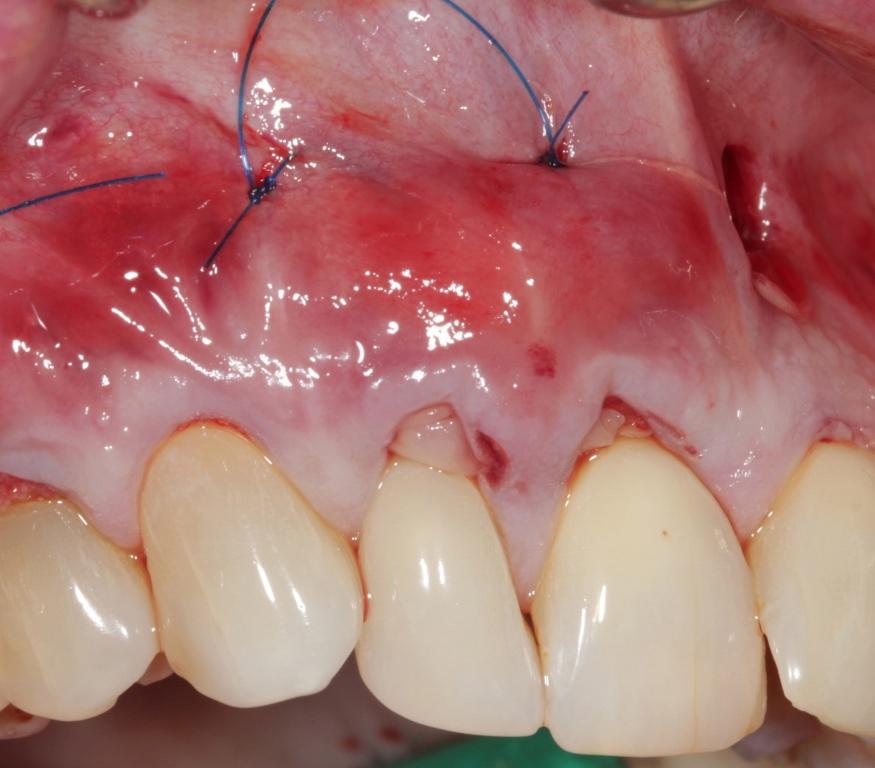
Клиническое увеличение зоны кератинизированных десен зависит от действия сразу нескольких факторов (фото 9-11). Один из них – полное понимание механизма действия и биологического принципа APRF. Второй – точная реализация хирургического протокола вмешательства, при котором необходимо добиться физиологического смещения лоскута и его ушивания без натяжения.
Фото 9. Вид через 2 года после лечения: увеличение объема прикреплённой и кератинизированной слизистой.
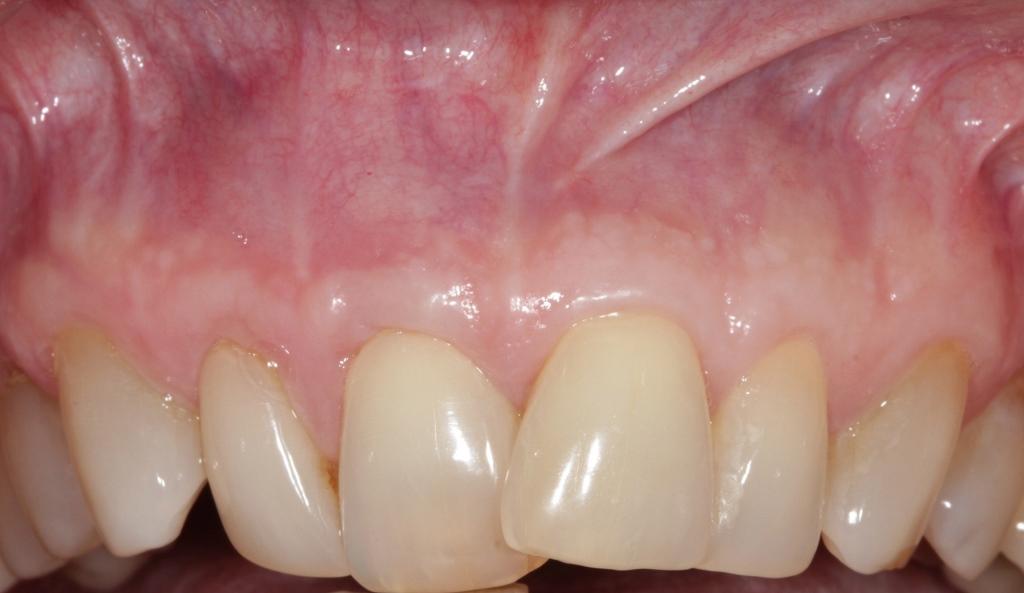
Фото 10. Вид сбоку до лечения.
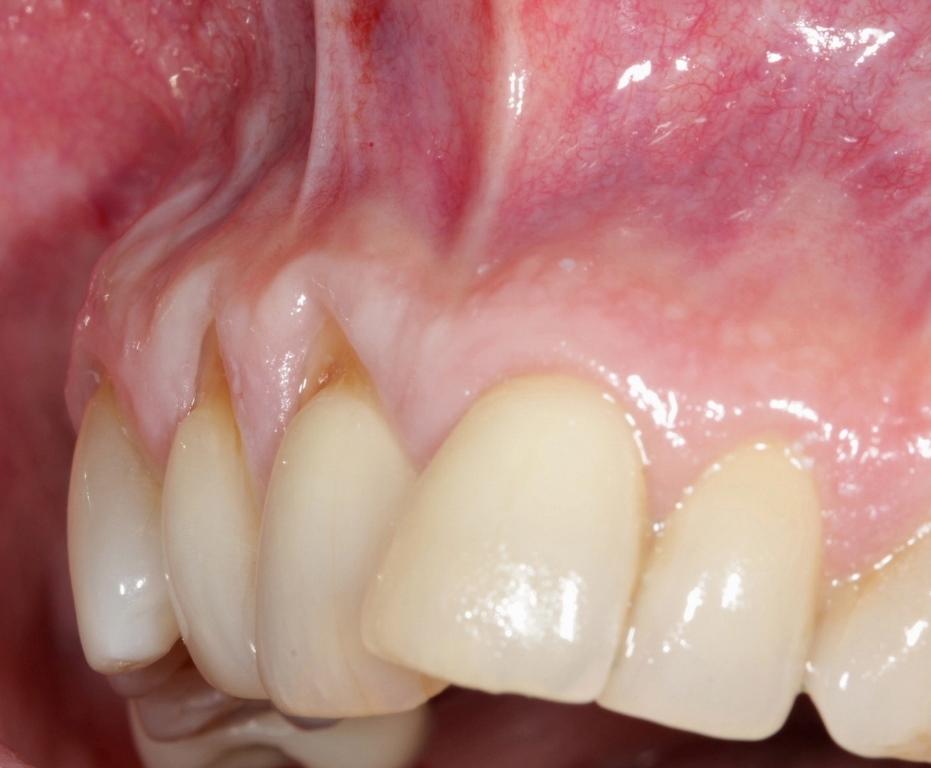
Фото 11. Вид сбоку через 2 года после лечения: увеличение зоны кератинизированной и прикрепленной слизистой с коррекцией деформации высоты и ширины мягких тканей.
Выводы
Концепция промоции восстановления мягких тканей с использованием фибрина при лечении рецессий предполагает активное применение APRF в ходе выполнения пародонтальных процедур; основы данной концепции находятся в рамках установленных принципов заживления ран и клинического влияния на отдельные аспекты данных процессов. Предложенная инновационная модель требует проведения более значимого количества клинических и гистологических исследований для подтверждения эффективности методики, поскольку в данное время для анализа доступны лишь отдаленные 2-летние результаты лечения рецессий вышеописанным методом.
Авторы:
Alexandre-Amir Aalam, DDS
Alina Krivitky Aalam, DDS
Joseph Choukroun, MD
Пародонтальная пластическая хирургия играет весьма важную роль в общей пародонтологической практике. В США как минимум 90% населения в возрасте старше 60 лет характеризуется наличием, по крайней мере, 1-го зуба с 1-милиметровым уровнем рецессии, а у 40% этой же возрастной группы наблюдаются рецессии, превышающие 3 мм. Области рецессии, не подлежащие лечению, значительно ухудшают пародонтологический статус пациента, что, в свою очередь, может привести к ряду смежных стоматологических осложнений.

Для решения проблем, связанных с подобными ограничениями, врачи часто применяют различные заменители аутогенной соединительной ткани по типу аллографта или же ксенографта. Играя роль своеобразного каркаса и позволяя успешно протекать процессу фиброкондукции, данные материалы помогают добиться довольно успешного клинического результата. Дериват эмалевой матрицы (ЭМД), полученный от представителей другого вида, часто используется в качестве «стимулирующего» агента, а комбинирование вместе с коронально-спозиционированным лоскутом способствует так называемой пародонтальной регенерации. При этом эффективность данного подхода является повышенной только по сравнению с изолированным использованием коронально-перемещенного лоскута без каких-либо дополнительных стимулирующих агентов. Доказательств, подтверждающих более успешное использование ЭМД по сравнению с контрольными соединительными или аллотрансплантатными материалами, пока еще не получено, а исследования данного вопроса продолжают активно проводиться.
В последнее десятилетие более часто стали использовать так называемые биологические модификаторы, полученные из крови человека, которые способствуют заживлению ран в области твердых и мягких тканей. Плазма, обогащенная тромбоцитами (Platelet-rich plasma - PRP), относиться к первому поколению подобных биологических агентов. Отсутствие в составе таковой факторов роста твердых тканей и соответствующих физических свойств, а также сложный протокол получения конечного материала и слишком быстрое высвобождение определённых агентов – все это поставило под вопрос эффективность использования PRP в практике челюстно-лицевой хирургии. Результаты использования данного вида плазмы для восстановления мягкотканого покрытия корня и в ходе других процедур в области слизистой также остаются неоднозначными. В 2013 году Choukroun представил факторы роста крови, известные как улучшенный фибрин, обогащенный тромбоцитами (APRF - advanced platelet-rich fibrin). Простота приготовления данного агента (центрифугирование без применения каких-либо антикоагулянтных препаратов), а также наличие в его составе костных морфогенетических белков вывело APRF на лидирующие позиции с точки зрения частоты использования при проведении оперативных вмешательств в челюстно-лицевой области.
Цель данной статьи состоит в том, чтобы обсудить преимущества и возможности клинического применения APRF в пародонтальной пластической хирургии, особенно в случаях восстановления мягкотканного покрытия поверхности корня.
Основы основ: PRF и APRF
Фибрин, обогащенный тромбоцитами (PRF) представляет собой концентрат тромбоцитов второго поколения, полученный в ходе одиночного центрифугирования без использования антикоагулянтов. Полученный PRF-сгусток является физиологической трехмерной матрицей, насыщенной тромбоцитами и лейкоцитами. Альфа-гранулы, секретируемые тромбоцитами, которые находятся в мембране, выделяют специфические факторы роста, которые способствуют медленной и естественной резорбции самой структуры мембраны (15 дней). Данные факторы включают тромбоцитарный фактор роста (PDGF- platelet-derived growth factor), трансформирующий фактор роста-b (TGF-b-transforming growth factor-b), фактор роста эндотелия сосудов (VEGF- vascular endothelial growth factor), эпидермальный фактор роста (EGF - epidermal growth factor) и инсулиноподобный фактор роста-1 (IGF-1- insulin-like growth factor-1). Получение APRF базируется на аналогичном протоколе, при котором лишь изменяется структура используемой пробирки из пластиковой на стеклянную, что помогает увеличить эффект хелирования (фото 1). Кроме того, в ходе получения APRF уменьшается время и параметры самого центрифугирования (от 2700 об./12 мин. до 1200 об./8 мин.). Изменяя эти параметры, Choukroun и коллеги обнаружили, что полученные таким образом APRF-мембраны содержат увеличенное количество фактора VEGF (ответственного за более быструю неоваскуляризацию области вмешательства), моноцитов (ответственных за высвобождение BMP) и внеклеточный матрикса (фибронектина). Omar и Rocher установили, что моноциты являются критически важным источником аутогенного костного морфогенетического белка-2 (BMP-2) и костного морфогенетического белка-7 (BMP-7), что объясняет улучшенные характеристики APRF по сравнению с PRF.
Фото 1. Сгусток APRF: благодаря более медленному центрифугированию больше клеток могут попасть в структуру сгустка.

Периодонтальное применение PRF / APRF
Исследования in vitro
Tsai и коллеги исследовали биологические эффекты PRF на десневые фибробласты, клетки периодонтальной связки, эпителиальные клетки ротовой полости и остеобласты. В исследуемой культуре была отмечена PRF-стимулированная клеточная пролиферация (с 20% приростом) и повышение скорости пролиферации эпителия (по причине использования TGF-b). Данный результат обосновал перспективную эффективность использования PRF в пародонтологической практике. Не и коллеги провели исследование для определения влияния PRF на параметры клеточной связи, пролиферации и фосфорилирование остеобластов человека. Удалось установить, что PRF позволяет увеличить показатели связи остеобластов, а также их пролиферацию, одновременно повышая при этом уровень ассоциируемого с производством коллагена белка. Такой кумулятивный эффект позитивно влияет на процессы промоции костной регенерации. Результаты, полученные Kang и коллегами, подтверждают целесообразность использования PRF в качестве биологического каркаса и резервуара факторов роста. Экстракт (концентрат) PRF (PRFe) доказательно увеличивает параметры пролиферации, миграции и дифференциации стволовых клеток костного мозга человека в области альвеолярного гребня. Кроме того, трансплантация свежего PRF в череп подопытных мышей улучшала показатели регенерации дефекта критического размера. В исследовании Chang и Zhao было установлено, что активация PRF вызывает экспрессию фосфорилированной внеклеточной сигнально-регулируемой протеинкиназы (p-ERK) и остеопротегерина (OPG), что еще раз указывает на позитивный эффект обогащенного тромбоцитами фибрина для регенерации костной ткани. Кроме того, Huang и коллеги продемонстрировали, что PRF стимулирует пролиферацию и дифференциацию клеток пульпы зуба путем усиления экспрессии OPG и ALP. Более позднее исследование подтвердило повышение уровня экспрессии p-ERK, OPG и ALP после применения PRF, что может быть практически использовано при выполнении различных пародонтальных манипуляций.
В отдельных исследования также был описан опыт использования PRF в качестве регенеративного материала для восстановления периодонтальных дефектов. Chang и Zhao представлити результаты наблюдений за изменениями в структуре внутрикостного дефекта после его реконструкции с помощью PRF. Они установили, что тромбоцитарный концентрат способствует уменьшению размеров пародонтального кармана и увеличению уровня пародонтального прикрепления, при этом одновременно способствуя улучшению параметров плотности костной ткани в области ранее находившегося дефекта. Sharma и Pradeep обнаружили более динамическое уменьшение глубины зондирования и одновременное восстановление пародонтального прикрепления при лечении 3-стеночных костных дефектов с использованием PRF и проведением процедуры открытого кюретажа по сравнению с результатами лечения, в ходе которого проводили только открытый кюретаж дефектных областей. Аналогичные результаты были получены при сравнении этих же подходов вмешательства, но уже в клинических случаях обнажения участков фуркации дистальных зубов. Pradeep, закончив анализ результатов лечения внутрикостных дефектов с использованием PRF и PRP среди пациентов с хроническим пародонтитом, пришел к выводу, что значительных различий между клинической эффективностью применения вышеупомянутых тромбоцитарных концентратов не наблюдалось.
Периодонтальные пластические процедуры
В литературе по этому вопросу наблюдается своеобразный дефицит данных. Aroca и коллеги проводили пародонтологическое лечение 20 пациентов, формируя в ходе вмешательства коронально перемещенный лоскут с и без дополнительного использования PRF. Через 6 месяцев в группе исследования авторы отметили увеличение зоны кератинизированной ткани, но более низкий процент пациентов с полностью восстановленным мягкотканым покрытием области корней. Aleksic и Jankovic в ходе независимых исследований сравнивали трансплантаты соединительной ткани и PRF, используемый в качестве трансплантата, для лечения рецессий 1 и 2-го класса по Миллеру в группе, состоящей из 19 пациентов. Через 6 месяцев между исследуемой и контрольной группами не было обнаружено статистической разницы относительно объема полученного корневого покрытия и увеличения зоны кератинизированной ткани. Параметры комфорта выполнения процедуры и минимизации послеоперационных осложнений были статистически меньше в группе пациентов, в ходе лечения которых использовали PRF, поскольку в таких случаях удавалось избежать необходимости забора аутологичного соединительнотканного трансплантата из области неба. Tunali и Ozdemir провели анализ результатов восстановления рецессий у 20 пациентов, в ходе которого снова-таки использовали соединительнотканный трансплантат и PRF для сравнения. Мониторинг пациентов проводился на протяжении 12 месяцев. Оба метода лечения помогли значительно уменьшить уровень рецессии (соответственно на 76% и 77%) и увеличить уровень клинического прикрепления десен (до 2,90 мм и 3,04 мм соответственно).
Механизм действия
Основной проблемой, которую мы обнаружили в ходе анализа литературы, является сравнение PRF / APRF с трансплантатом из соединительной ткани. Несмотря на то, что эти два материала имеют схожие физические характеристики, специфика работы с таковыми и окончательные результаты их применения значительно отличаются. Соединительнотканный трансплантат, собранный из области неба, характеризуется генетически выраженным свойством к кератинизации. Karring и коллеги описали данную концепцию, используя в качестве исследуемой модели животных. Реципиентная область, таким образом, никак не влияет на качество или количество полученной в результате мягкой ткани. Данный механизм действия и называется фиброгенезом. С другой стороны, модель APRF работает совсем иным путем. Фибрин следует рассматривать еще и как биологическую матрицу: при повышенном количестве VEGF и других факторов роста, APRF будет стимулировать процесс образования новой ткани в реципиентной области. Таким образом, качество данной новосформированной ткани, по большому счету, будет зависеть от успешности процедуры подсадки APRF. Если у больного наблюдается некий остаточный объем кератинизированной ткани, мы с помощью APRF сможем запустить процесс формирования еще большего количества данного типа слизистой. Если же в области вмешательства присутствует только неприкреплённый тип слизистой, то APRF, в свою очередь, будет способствовать увеличению только данного типа ткани. Такой механизм именуется фибропромоцией. Для возникновения фибропромоции необходимы всего 2 условия: сохранение биологической напряженной целостности и объема. При несоблюдении данных условий использование APRF приведет к получению неприемлемого клинического результата.
Сохранение биологической напряженной целостности
Ingber, врач из Гарвардского института медицины, установил, что положительные или отрицательные силы (напряжение и давление), возникающие на поверхности клетки, передаются через комплексы фитомиозиновых филаментов через цитоскелет и, в конце концов, достигают ядра клетки. Следовательно, существует баланс между внеклеточными силами и внутриклеточным потенциалом, при котором все приложенные силы находятся в диапазоне толерантности. Данный диапазон является специфическим как для отдельных групп клеток, так и для органов в целом. Биологическая целостность напряжения помогает перенаправлять приложенные силы и организовывать многомолекулярный ответ на действующий стрессовый фактор во всех системах органов. Когда механические внешние силы, приложенные к поверхности клетки (через механорецепторы на поверхности клетки), выходят за рамки внутриклеточного диапазона толерантности, наблюдаются изменения в цитоскелетной структуре и внутриклеточных биохимических процессах. Одним из клинических трансляционных применений данной концепции является формирование взаимосвязи между напряжением лоскута и неоангиогенезом. Mammoto показал на животных моделях, что растяжение слизистой оболочки мышей уменьшало количество секретируемого VEGF и, таким образом, наблюдалось сосудистое сокращение лоскута. Pini Prato и коллеги подтвердили эту гипотезу, проведя рандомизированное контролируемое клиническое исследование для того, чтобы измерить напряжение коронально спозиционированного лоскута перед наложением швов и сравнить уровни редукции рецессии после коронарного смещения тканей с формированием напряжения и без него. Статистический анализ показал, что минимальное натяжение лоскута (от 0,0 г до 0,4 г) способствовало уменьшению уровня рецессии, в то время как более высокие показатели напряжения (от 4 г до 7 г) не обеспечивали аналогично эффективных результатов. Marx приписывал успех процедуры вертикального увеличения костной ткани именно пассивному позиционированию лоскута без излишнего напряжения, который помогал поддерживать клеточную целостность костного трансплантата.
Объем
Чтобы количественно оценить любую клинически значимую фибропромоцию, стимулированную APRF, необходимо собрать определенное количество тромбоцитов и определить количество секретируемых факторов роста. Данные факторы роста являются упакованными в плотную и хорошо организованную фибриновую сетку, и в ходе резорбции мембраны будут выделятся «по капле», обеспечивая постоянный и стабильный приток биологических агентов в течение следующих 12-15 дней (скорость резорбции мембран APRF). По этой причине качество и количество мягких тканей, полученных после операции, напрямую связано с количеством привитой фибриновой матрицы. В ходе количественного гистоморфометрического анализа проникновения клеток, проведённого Gahnaati и коллегами, была проведена оценка состава мембран APRF. Шестьдесят восемь процентов структуры APRF-мембран составляют тромбоцитарные факторы роста, при чем полученные лабораторные данные коррелируют с клиническим опытом авторов: таким образом, был сформулирован вывод о том, что для клинического наблюдения за процессом фибропромоции требуется использовать как минимум 3-4 мембраны на каждую пару проблемных зубов (фото 2 - 4).
Фото 2. APRF сгустки перед прессованием: прессование помогает получить гомогенные мембраны, подходящие для клинического использования.

Фото 3. APRF мембраны после прессования.

Фото 4. Вид APRF мембраны, готовой для использования: 3-4 мембраны необходимы для достижения клинического эффекта при коррекции мягких тканей.

Клинические манипуляции
Предлагаемая хирургическая методика предполагает упрощение техники проведения вестибулярного субпериостального надреза для доступа и усовершенствование туннельной техники вмешательства как таковой.
Разрез
Вертикальный разрез слизистой оболочки позволяет провести полные горизонтальные (мезиодистальные) и апикокорональные надрезы для сепарации полнотканного лоскута, обеспечив при этом пассивное корональное смещение слизисто-десневого комплекса (фото 5 - 6).
Фото 5. Вид до лечения: рецессия 2 класса по Миллеру, связанная с нарушением позиции зуба.

Фото 6. Разрез и послабление лоскута. Вестибулярный субпериостальный разрез позволяет отсепарировать полнотканный лоскут.

Подготовка корней и деконтаминация
Данные процедуры аналогичны таковым, уже ранее предложенным в протоколах выполнения пародонтальных операций в области мягких тканей ротовой полости. Очистка корня обеспечивает формирование его плоской и гладкой поверхности, позволяя, таким образом, увеличить объем размещаемого APRF и уменьшить общее натяжение лоскута. Деконтаминация области корня проводится посредством 17% этилендиаминтетрауксусной кислоты (ЭДТА) (в ходе двойного нанесения на протяжении 2,5 минут), что помогает элиминировать смазанный слой и улучшить условия для восстановления пародонтального прикрепления.
Объемное наполнение
Для достижения клинически значимого результата клиницисты должны использовать минимум 3-4 мембраны на пару проблемных зубов. «Концепция рюкзака», то есть заполнение тромбоцитарным сгустком от дистальной до мезиальной поверхностей обеспечивает однородную плотность всего объема мембраны APRF (фото 7). Благодаря пассивной позиции лоскута и плотному наполнению сформированного кармана, удается провести ушивание лоскута без излишнего напряжения, что является ключевым принципом биологической напряженной целостности.
Фото 7. Упаковка APRF мембраны.

Ушивание
Апикальные периостальные матрацные швы являются основными для фиксации тканей после выполнения вмешательства. В ходе ушивания важно избежать натяжения швов в области мембраны, а также обеспечить стабилизацию и поддержку тромбоцитарного концентрата (фото 8).
Фото 8. Ушивание посредством периостальных швов ниже слизисто-десневой границы поможет вместить комплекс APRF/лоскут более коронально, и, таким образом, добиться лучшей кератинизации.

Клиническое увеличение зоны кератинизированных десен зависит от действия сразу нескольких факторов (фото 9-11). Один из них – полное понимание механизма действия и биологического принципа APRF. Второй – точная реализация хирургического протокола вмешательства, при котором необходимо добиться физиологического смещения лоскута и его ушивания без натяжения.
Фото 9. Вид через 2 года после лечения: увеличение объема прикреплённой и кератинизированной слизистой.

Фото 10. Вид сбоку до лечения.

Фото 11. Вид сбоку через 2 года после лечения: увеличение зоны кератинизированной и прикрепленной слизистой с коррекцией деформации высоты и ширины мягких тканей.

Выводы
Концепция промоции восстановления мягких тканей с использованием фибрина при лечении рецессий предполагает активное применение APRF в ходе выполнения пародонтальных процедур; основы данной концепции находятся в рамках установленных принципов заживления ран и клинического влияния на отдельные аспекты данных процессов. Предложенная инновационная модель требует проведения более значимого количества клинических и гистологических исследований для подтверждения эффективности методики, поскольку в данное время для анализа доступны лишь отдаленные 2-летние результаты лечения рецессий вышеописанным методом.
Авторы:
Alexandre-Amir Aalam, DDS
Alina Krivitky Aalam, DDS
Joseph Choukroun, MD





























































































































































0 комментариев