Несмотря на чувствительность к технике, пародонтальная регенерация представляется эффективной при лечении внутрикостных дефектов; тем не менее, полного успеха достичь бывает трудно. Семь ключевых моментов для успешной регенерации пародонта при внутрикостных дефектах, представленные здесь, включают в себя научно обоснованное планирование лечения и хирургический протокол для достижения предсказуемых результатов. Благодаря пошаговому подходу, семь ключевых моментов дают пародонтологам контрольный список для лечения внутрикостных дефектов и включают протоколы для планирования, хирургического и послеоперационного этапов лечения. В этой статье описывается использование контрольного списка «семь ключевых моментов» для достижения предсказуемых результатов регенерации при краткосрочном и долгосрочном наблюдении. На примере одного клинического случая показано применение этих семи ключевых моментов.
Регенеративные методы лечения могут быть использованы для достижения клинических улучшений, превосходящих результаты лоскутной хирургии. Как правило, регенерационные процедуры преследуют две цели: восстановить значительную часть утраченного опорного аппарата и уменьшить глубину кармана. В идеале, это должно быть достигнуто без значительного усугубления рецессии десны. Примечательно, что различные исследования регенеративных подходов показали большую вариабельность клинических результатов, которые обычно объясняются системными и местными факторами. Интересно, что определенная степень вариабельности клинических результатов, называемая «эффектом центра», может быть следствием различий в контингенте пациентов и/или хирургических навыках лечащего врача, эффективности предыдущей этиотропной терапии и программ поддерживающей пародонтологической помощи.
Многие факторы могут повлиять на предсказуемость процедуры регенерации. Например, курение, количество стенок, входящих в дефект, подвижность зубов, степень готовности пациента к сотрудничеству, а также ширина, глубина и морфология дефекта — все эти факторы коррелировали с результатами применения различных методов регенерации. Несмотря на требовательность к технике, пародонтальная регенерация представляется эффективной при лечении внутрикостных дефектов, глубоких или мелких, широких или узких. Достижение полного успеха при регенерации пародонта является сложной задачей, что, по мнению авторов, может быть связано, главным образом, с неполной оценкой рисков, использованием неадекватных хирургических подходов и материалов, а также недостаточным клиническим опытом.
Использование контрольных списков в клинической практике может помочь лечащим врачам избежать непредвиденных осложнений. Например, авторы предложили контрольный список из 10 ключевых пунктов для немедленной установки имплантатов в эстетических зонах для достижения предсказуемых результатов. Использование контрольных списков, как показывает практика, помогает избежать осложнений в медицинской, стоматологической и хирургической практике. Цель данной статьи — описать семь основных ключевых моментов для проведения регенерации пародонта при внутрикостных дефектах с успешными долгосрочными результатами.
Контрольный список семи ключевых моментов лечения внутрикостных дефектов пародонта
- Оценка риска регенерации пародонта при внутрикостном дефекте: факторы, связанные с пациентом, состояние зубов, морфология дефекта и факторы, связанные с хирургом.
- Хирургическая подготовка: Лечение участков с повышенным кровотечением при зондировании, подвижностью или нуждающихся в проведении эндодонтического лечение; удаление зубного налета и пародонтальная терапия с помощью Nd:YAG-лазера рекомендуются в день операции.
- Хирургический доступ: Минимально инвазивный полнослойный доступ с сохранением сосочкового лоскута.
- Подготовка и кондиционирование корней: Удаление грануляционных тканей, скейлинг и подготовка корней с помощью ручных инструментов/ультразвуковых насадок, нерифленых хирургических фрез или мелкозернистых алмазных боров, а также использование 24% геля, содержащего ЭДТА, для удаления смазанного слоя.
- Комбинированная терапия: Использование костных трансплантатов (ЛКАТ или ДМБК) + биологических препаратов (rhPDGF-BB или ПМЭ) + изготовленного на заказ несшитого коллагена (пропитанного факторами роста) и/или мембраны из амниона и хориона.
- Первичное заживление лоскута: Стабильное заживление лоскута без натяжения достигается с помощью разреза и швов, освобождающих надкостницу; нерезорбируемые/медленно резорбируемые швы 5-0/6-0 накладывают на 4-6 недель.
- Послеоперационный протокол: Строгая поддерживающая пародонтологическая терапия каждые 2-3 недели в течение 3 месяцев (полировка и контроль зубного налета) и долгосрочное наблюдение.
Этот последовательный, научно обоснованный клинический подход может быть использован для построения и реализации стратегии оптимизации клинических исходов у разных пациентов с различными анатомическими дефектами.
ДМБК = депротеинизированный минерал бычьей кости, ЭДТА = этилендиаминтетрауксусная кислота, ПМЭ = производное матрикса эмали, ЛКАТ = лиофилизированный костный аллотрансплантат, Nd. YAG = Легированный неодимом-иттриево-алюминиевый гранат, rhFDGF-BB = рекомбинантный человеческий тромбоцитарный фактор роста-BB
Ключевой момент № 1: Оценка риска регенерации пародонта при внутрикостных дефектах
Успех регенеративных процедур при внутрикостных дефектах обеспечивается комплексным подходом к выбору конкретного случая. Основываясь на предыдущих алгоритмах принятия решений, авторы предлагают оценку риска регенерации пародонта, чтобы помочь лечащим врачам определить факторы, связанные с пациентом, зубом, дефектом и хирургом, которые могут повлиять на вероятность достижения успешного результата при проведении регенеративных процедур. Основываясь на специфических аспектах, отмеченных при оценке риска, лечащий врач должен выбрать оптимальный подход к лечению, включая форму разреза, удлинение лоскута и биоматериалы, учитывая ограничения в каждом конкретном случае. Этот этап очень важен для приведения ожиданий пациента в соответствие с предсказуемостью лечения. Места лечения высокого риска должны быть подробно обсуждены с пациентом.
В представленном случае 56-летний здоровый некурящий пациент мужского пола с диагнозом локализованного пародонтита III стадии, степени B на протяжении 25 лет наблюдался в пародонтологическом кабинете частной практики (RAL). Он хорошо соблюдал правила лечения (количество зубного налета во всей полости рта <20%). Во время пандемии COVID-19 пациент пропустил три визита для проведения поддерживающей пародонтологической терапии (ППТ) в течение года, что привело к разрушению пародонта интерпроксимально между зубами 3.7 и 3.6 (левые второй и первый моляры нижней челюсти соответственно). Во время последнего визита к пародонтологу было отмечено значительное увеличение глубины зондирования до 10 мм с кровотечением (фото 1 - 3). На периапикальной рентгенограмме был обнаружен глубокий, узкий трехстенный внутрикостный дефект в дистальной части зуба 3.6, с вовлечением буккальной фуркации I класса (фото 4). Согласно шкале пародонтального риска (ШПР), ранее известной как индекс пародонтального прогноза Миллера-МакЭнтира, прогноз состояния зубов при первичном осмотре пациента был «хорошим» (оценка = 5), учитывая, что он не знал о своем уровне гемоглобина A1C (HbA1c). Эта оценка побудила пациента к тестированию, и его последующий показатель HbA1c составил <6%, таким образом, его оценка по ШПР снизилась до 3, что было расценено как «отлично», поскольку целевой показатель ШПР для регенеративных процедур составляет <5.
Зуб 3.6 не был подвижным и подвергся эндодонтическому исследованию на жизнеспособность. Анатомия мягких тканей не была нарушена, ширина кератинизированной ткани составляла >2 мм. Хирург был опытным, не испытывал стресса от окружающей среды и использовал контрольные списки. Таким образом, на основании оценки предоперационного риска, пациентка относилась к группе низкого-среднего риска для восстановительного лечения пародонта.
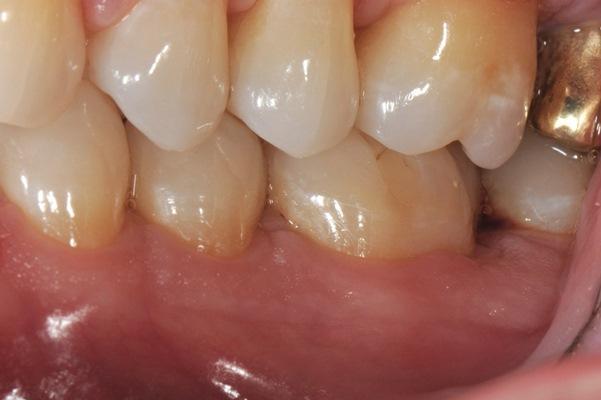
Фото 1: Зуб 3.6 при первичном обследовании, вид с буккальной стороны.
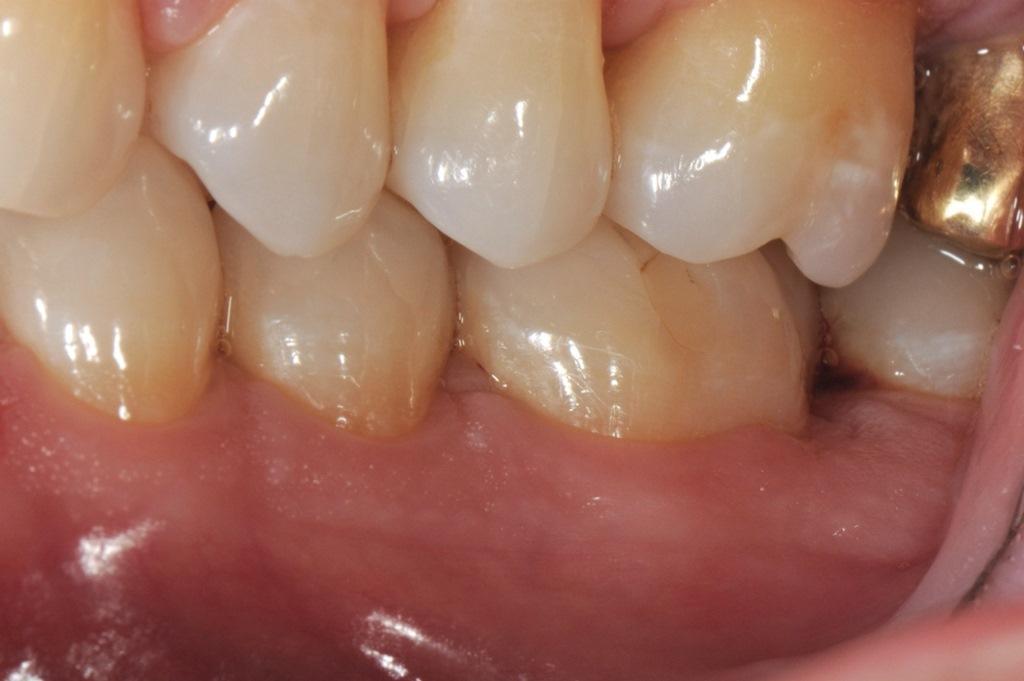
Фото 2: Зуб 3.6 при первичном обследовании, вид с окклюзионной стороны. Обратите внимание на толщину мягких тканей и ширину кератинизированных тканей.
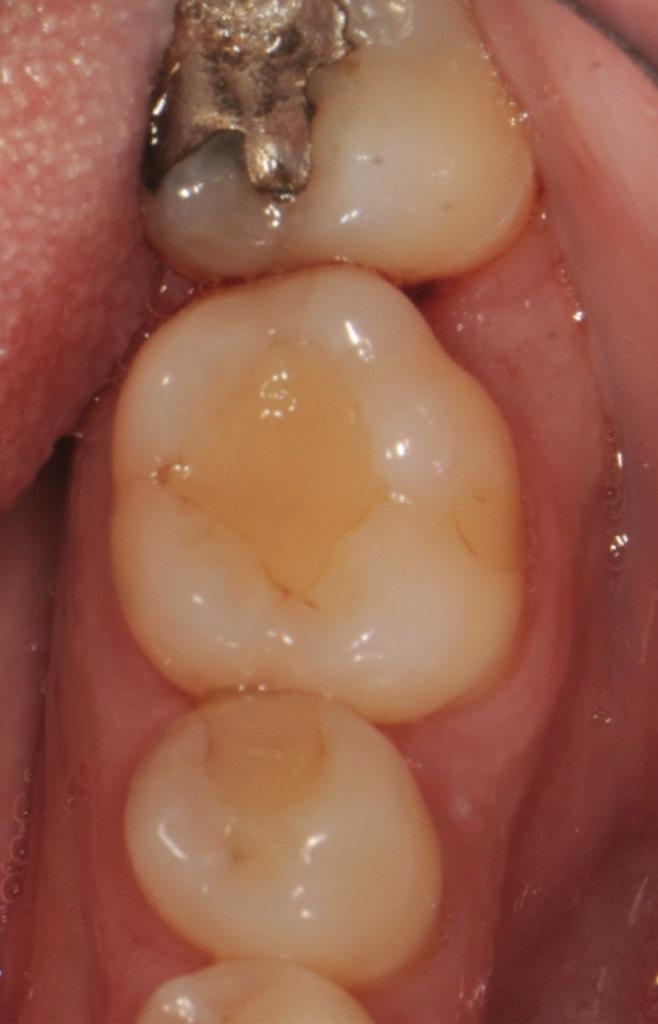
Фото 3: Глубина зондирования 10 мм с дистальной стороны зуба 3.6.
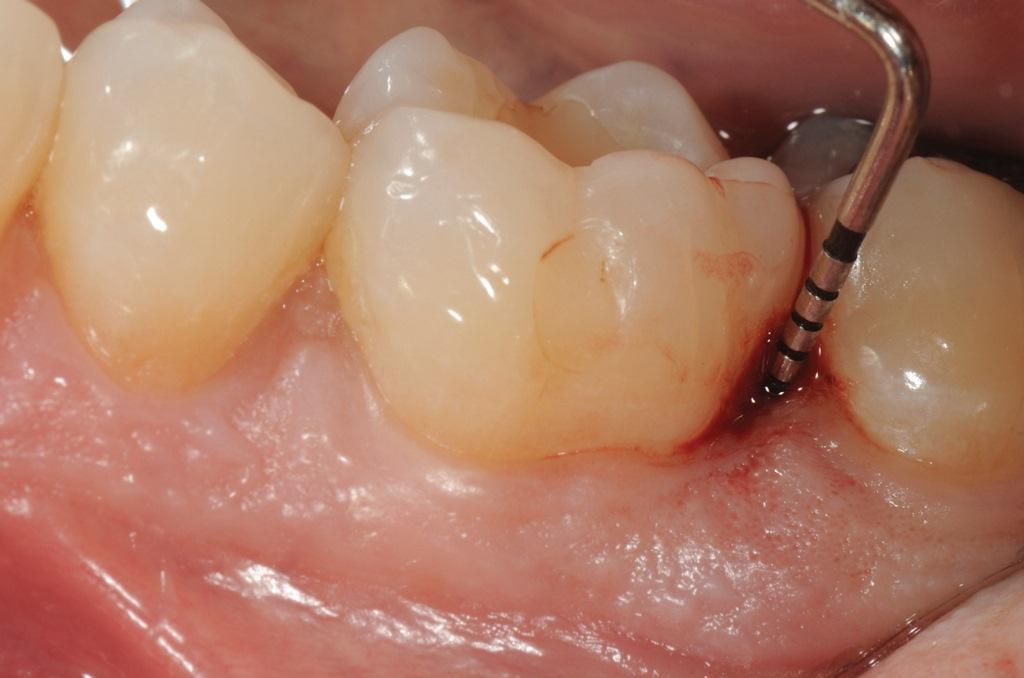
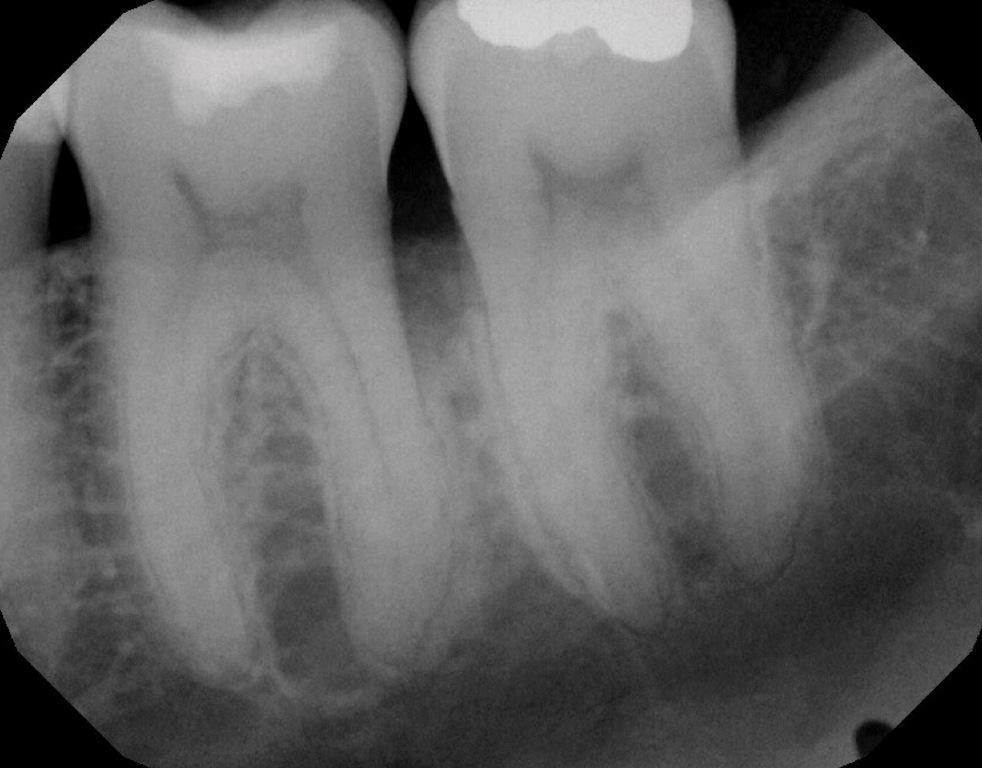
Фото 4: На периапикальной рентгенограмме виден дистальный внутрикостный дефект зуба 3.6.
Ключевой момент №2: Хирургическая подготовка
Перед проведением внутрикостной регенеративной хирургической процедуры участки с кровоточивостью при зондировании требуют проведения обучения по контролю зубного налета, а также проведения скейлинга пародонта во всей полости рта и санации корней. Скейлинг и санацию корней следует проводить только наддесневым способом на участках, подлежащих регенеративному лечению, избегая применения поддесневых инструментов в запланированных местах хирургического вмешательства. С пациентом следует провести оценку и обучение по контролю биопленки. Зубы с подвижностью II или III степени по Миллеру следует шинировать и/или проводить коррекцию окклюзии во всех рабочих, протрузионных и нерабочих движениях до хирургического лечения. Интактные зубы следует сохранить интактными, если дефект периодонта не затрагивает верхушку. Проводимые ранее процедуры лечения корневых каналов должны быть тщательно оценены. Нежизнеспособные зубы должны быть успешно вылечены, а при некачественном лечении корневых каналов следует провести повторное лечение после эндодонтического обследования и ухода.
Оставшийся бактериальный налет вокруг соответствующего зуба должен быть удален в день операции. Дополнительное использование лазерной регенеративной терапии позволяет эффективно стерилизовать поддесневую область кармана на глубину внутрикостного дефекта. Хотя в литературе высказываются противоречивые мнения, можно использовать антибиотики, назначая нагрузочную дозу (2 г амоксициллина) для профилактики послеоперационных инфекций и, таким образом, снижения послеоперационных осложнений.
Ключевой момент №3: Хирургический доступ
При планировании регенеративной процедуры для достижения успешного результата необходимо соблюдать несколько общих требований, включая создание пространства достаточного объема для поддержания кровяного сгустка, а также стабильную, неподвижную защиту мягких тканей обрабатываемой области во избежание бактериального загрязнения. Оптимальная форма лоскута для доступа к внутрикостным дефектам должна обеспечивать заживление первичным натяжением. Стабильность раны достигается за счет правильного обращения с мягкими тканями и стабильности (неподвижности) соседних зубов.
Лоскуты для сохранения сосочков - это широкие, подвижные лоскуты, позволяющие четко визуализировать область дефекта, легко накладывать биоматериалы/барьерные мембраны и пассивно закрывать лоскут, сохраняя межзубные сосочки. Было предложено несколько минимально инвазивных методик с использованием операционных микроскопов и микрохирургических инструментов. Эти методики позволяют минимально приподнять ткани, чтобы уменьшить хирургическую травму и повысить стабильность лоскута. Таким образом, выбор хирургического подхода зависит от морфологии и протяженности дефекта. Хотя минимально инвазивные методы могут обеспечить лучшую стабильность тканей, в некоторых случаях необходим большой лоскут (например, при глубоких дефектах, затрагивающих три или более сторон корня).
В данном случае были выполнены внутрибороздковые надрезы, а затем освобождающий разрез с мезиальной стороны зуба 3.6. Полнослойный лоскут был приподнят с буккальной и язычной сторон (фото 5 и 6) с помощью минимально инвазивного периостального элеватора. Участок был тщательно подготовлен, чтобы избежать загрязнения слюной.
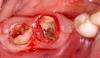
Фото 5: Хирургический доступ и подготовка корня. Лоскуты были подняты после того, как были сделаны внутрибороздковые надрезы, и был выполнен освобождающий разрез с мезиальной стороны зуба 3.6. Грануляционная ткань была удалена.
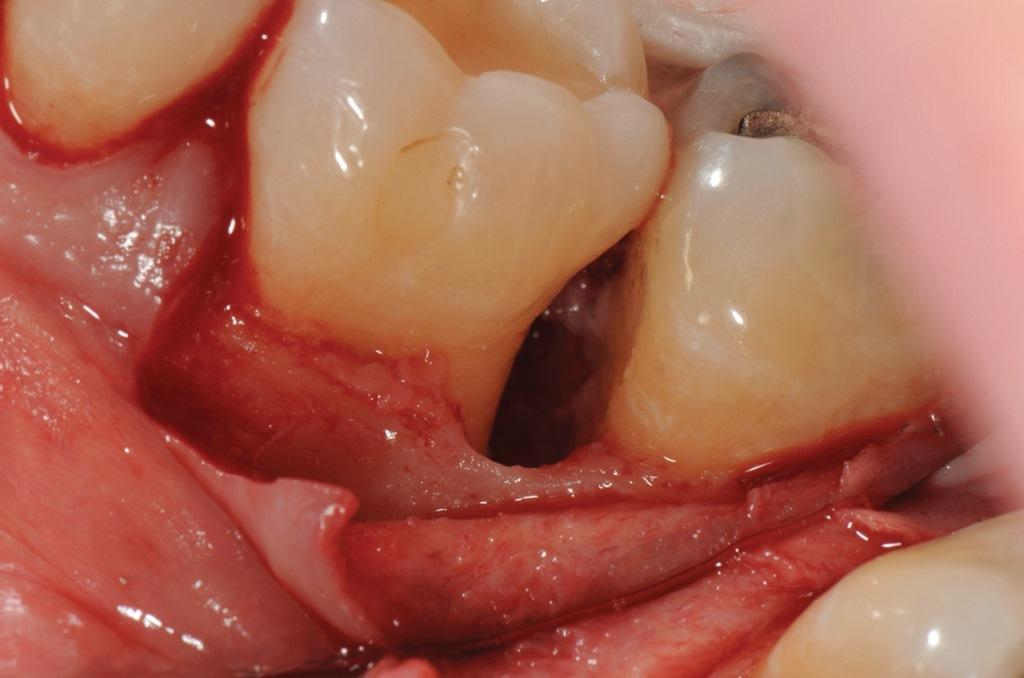
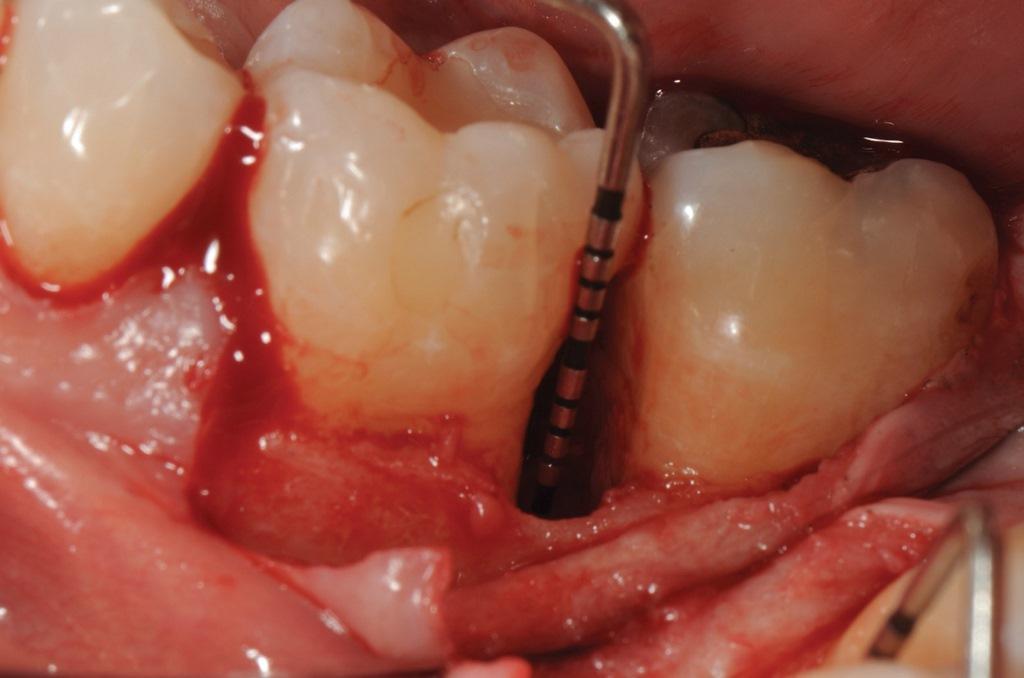
Фото 6. Дистальный внутрикостный дефект глубиной 5 мм у зуба 3.6.
Ключевой момент № 4: Подготовка и обработка корней
Чтобы повысить процент успеха регенеративных процедур, рекомендуется подготовка и модификация корней. После откидывания лоскута первым шагом является удаление грануляционных тканей с помощью ручных, ультразвуковых и/или вращающихся инструментов. Используется высокоскоростной наконечник с хирургической скейлерной фрезой или мелкозернистым алмазным бором для препарирования зубов под обильной ирригацией, и проводится эффективная санация поражения. Тщательное удаление всех твердых и мягких отложений на поверхности корня и любой клинически пораженной поверхности цемента является залогом успеха. Хотя это и спорно, удаление смазанного слоя и обнажение коллагеновых волокон с помощью кондиционеров корней, таких как 24% гель этилендиаминтетрауксусной кислоты (ЭДТА), может повысить адгезию клеток и иметь клинические преимущества, включая улучшенную визуализацию и лучший гемостаз.
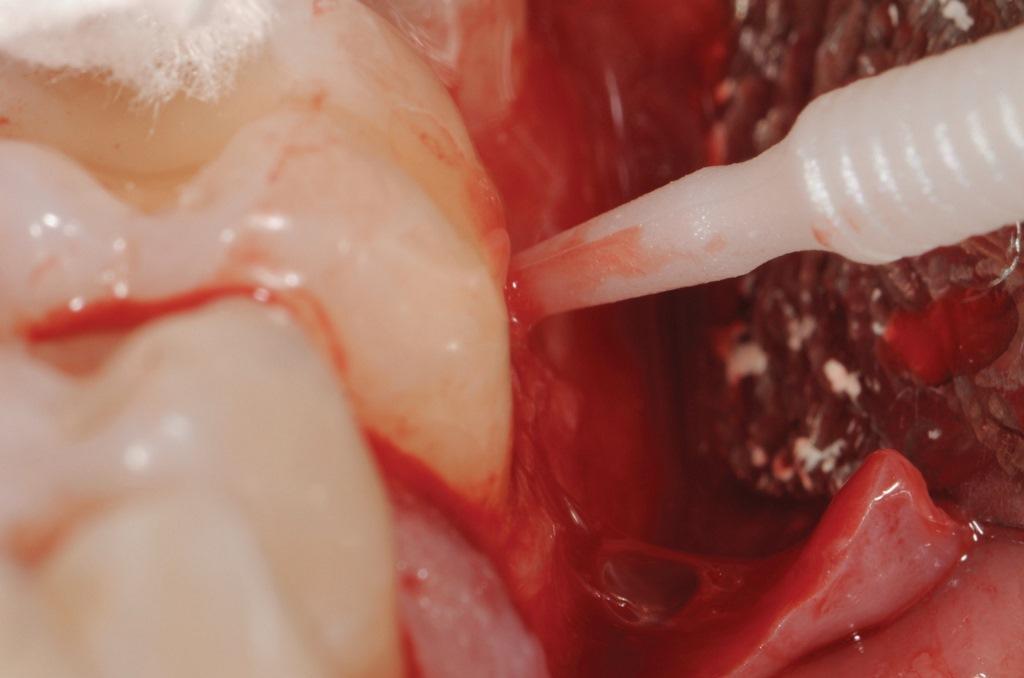
В данном случае корень зуба 3.6 был подготовлен с помощью пьезоэлектрических скейлеров и нерифленых хирургических фрез с целью удаления грануляционных тканей и налета/кальцификатов на поверхности корня. Кондиционирование корней проводилось путем нанесения 24% геля, содержащего ЭДТА, на 2 минуты, после чего проводилось обильное орошение стерильным физраствором (фото 7).
Фото 7: Кондиционирование корней с помощью 24%-ного геля, содержащего ЭДТА.
Ключевой момент № 5: Размещение регенеративных биоматериалов (комбинированная терапия)
Регенерация тканей основывается на трех ключевых компонентах, которые часто называют «триадой регенерации»: клетки, скаффолды (например, костные трансплантаты) и сигнальные молекулы (например, факторы роста). При условии достаточной васкуляризации, стабильности раны и времени эти компоненты играют важнейшую роль в регенерации тканей. Различные систематические обзоры показали, что для лечения остаточных карманов с глубокими (≥3 мм) внутрикостными дефектами следует использовать комбинированные методы лечения, т.е. костные трансплантаты, барьерные мембраны и/или биологические препараты.
Использование биологических препаратов, таких как белки или факторы роста, подкреплено множеством исследований в литературе. Внедрение факторов роста ознаменовало новую эру в регенерации пародонта. Производное матрикса эмали, например, состоит из гетерогенной смеси белков, содержащих амелогенины в качестве основного компонента. Другим хорошо изученным, клинически и гистологически доказанным цитокином для регенерации пародонта является рекомбинантный человеческий тромбоцитарный фактор роста BB (rhPDGF-BB). Было продемонстрировано, что в сочетании с остеокондуктивным скаффолдом этот фактор роста значительно повышает уровень клинического прикрепления, уменьшает рецессию десны, а также улучшает заполнение костной ткани и устранение дефектов по сравнению с положительным контролем. Гистологические исследования на людях продемонстрировали образование новой кости, цемента и периодонтальной связки при использовании rhPDGF-BB с любым типом костного трансплантата, включая минерализованный лиофилизированный костный аллотрансплантат (ЛКАТ), деминерализованный ЛКАТ, трикальцийфосфат или депротеинизированный бычий костный минерал во внутрикостных или фуркационных дефектах. Наконец, недавний систематический обзор показал, что эффективность rhPDGF-BB в сочетании с костными трансплантатами не была связана с какими-либо побочными действиями.
Применение барьерных мембран, удерживающих костный трансплантат, является основополагающим при больших и незакрытых дефектах. Учитывая более высокую послеоперационную заболеваемость и частоту осложнений при использовании нерезорбируемых барьерных мембран, резорбируемые мембраны следует использовать в первую очередь, поскольку они будут сочетаться с костным трансплантатом и действовать как скаффолд. Рекомендуется использовать несшитые коллагеновые мембраны.
В данном случае rhPDGF-BB использовался в сочетании с ЛКАТ и был плотно уложен во внутрикостный дефект (фото 8 и 9). Мембрана из амниона и хориона была подобрана и адаптирована поверх костного дефекта (фото 10 и 11).
Фото 8, 9: Комбинированная терапия, при которой rhPDGF-BB был объединен с ЛКАТ (Фото 8) и помещен в костный дефект (Фото 9).
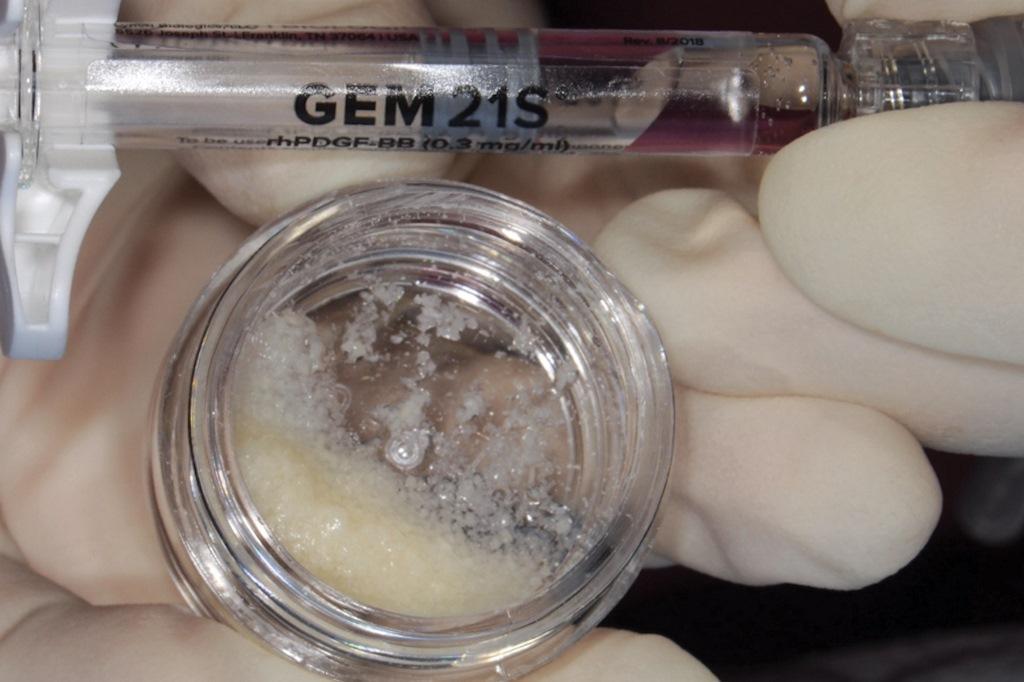
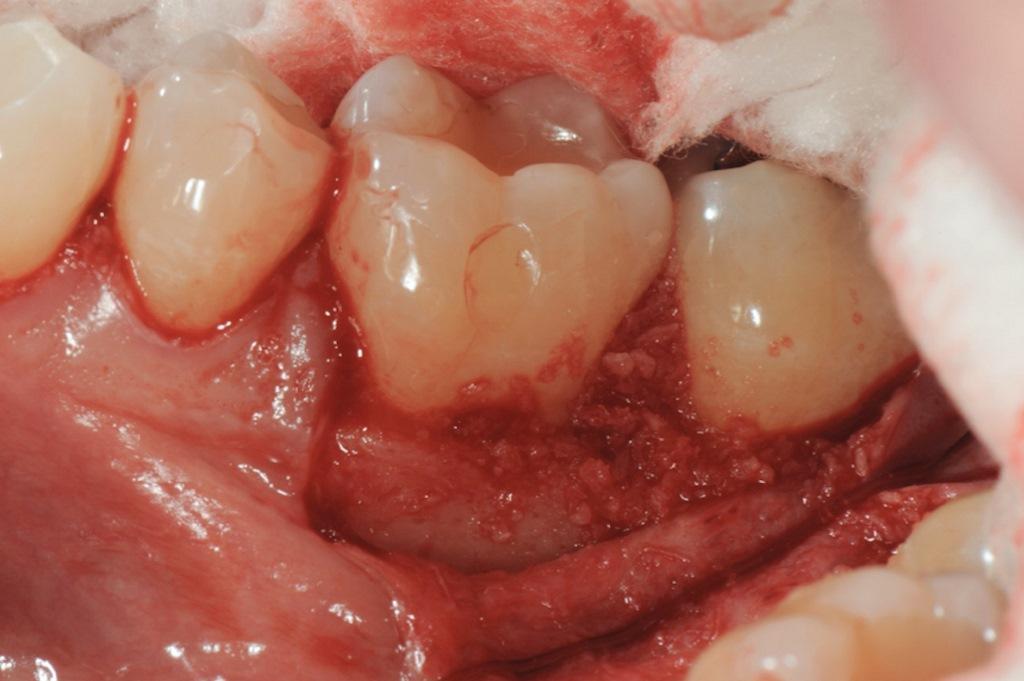
Фото 10, 11: Комбинированная терапия включала использование мембраны из амниона и хориона, которая была изготовлена по индивидуальному заказу (Фото 10) и помещена над интерпроксимальным аспектом костного дефекта (Фото 11).

Ключевой момент № 6: Первичное заживление лоскута
Для успешной регенерации необходимо первичное заживление лоскута без натяжения по всему хирургическому участку. Как уже упоминалось ранее, лоскуты с сохранением сосочков и микрохирургические техники помогают улучшить эстетику, обеспечивая первичное заживление лоскута и увеличивая возможность создания пространства для регенерации в области между зубами. Раскрытие барьерных мембран - самое распространенное осложнение при регенеративных процедурах; таким образом, управление лоскутами играет ключевую роль в предотвращении неудачных исходов.
Еще один фактор, который может позволить обеспечить первичное заживление, — это соблюдение принципов минимальной инвазивности. В недавнем систематическом обзоре было обнаружено, что микрохирургические техники значительно улучшают результаты пародонтологической пластики и послеоперационное восстановление. Поэтому для заживления лоскута без натяжения следует выполнять надрезы, освобождающие надкостницу. Кроме того, из-за широкого сосочка горизонтальные матрасные швы в сочетании с прерывистыми швами позволяют обеспечить лучшую стабильность лоскута. Рекомендуемые типы швов включают нерезорбируемые, из политетрафторэтилена высокой плотности (d-PTFE) или медленно резорбируемые, которые следует оставлять не менее чем на 4 недели, если они не резорбируются, в этом случае их следует снять раньше.
В данном клиническом случае стабильное заживление лоскута без натяжения было достигнуто с помощью разрезов, освобождающих надкостницу, и швов. Медленно рассасывающиеся швы 5-0 были оставлены на 4 недели (фото 12).
Фото 12: Фотография непосредственно после операции. Двойные прерывистые медленно рассасывающиеся швы 5-0 были оставлены на 4 недели. Для заживления освобождающего разреза использовался цианоакрилатный тканевый клей.
Ключевой момент № 7: Послеоперационный протокол
Было показано, что эффективный контроль наддесневой и поддесневой биопленки с помощью механических средств (например, санации ручными инструментами и/или ультразвуковом), воздушно-полировочных приспособлений или других химических средств (например, антисептиков) является главным компонентом успешного восстановительного лечения, особенно в глубоких пародонтальных карманах. Результаты лечения могут сохраняться в течение длительного времени только при регулярном проведении ППТ. В исследованиях по регенеративной терапии, как правило, сообщалось о комплексных механических и антисептических режимах. Хотя продолжительность и частота повторных посещений сильно различались в исследованиях, посвященных регенерации, в целом, рекомендуется проводить повторные посещения два или более раз в месяц в течение первых 3 месяцев. Более того, некоторые исследования предлагают приглашать пациентов на осмотр каждую неделю, по крайней мере, в течение первых месяцев после операции.
В данном случае послеоперационный протокол пациента включал в себя прием анальгетиков и полоскание рта. Контроль зубного налета и полировка проводились каждые 2-3 недели в течение первых 3 месяцев. Затем пациенту были назначены повторные посещения каждые 3 месяца. При наблюдении в течение 1 года можно было наблюдать стабильность мягких и твердых тканей (фото 13 и 14). В соответствии с контрольным списком из семи ключевых пунктов, в данном клиническом случае было продемонстрировано, что правильный выбор тактики ведения с учетом факторов, связанных с пациентом, зубом, дефектом и хирургом, в сочетании с использованием научно обоснованного хирургического протокола, привел к предсказуемым результатам.
Фото 13: Стабильность мягких тканей при наблюдении в течение 1 года.
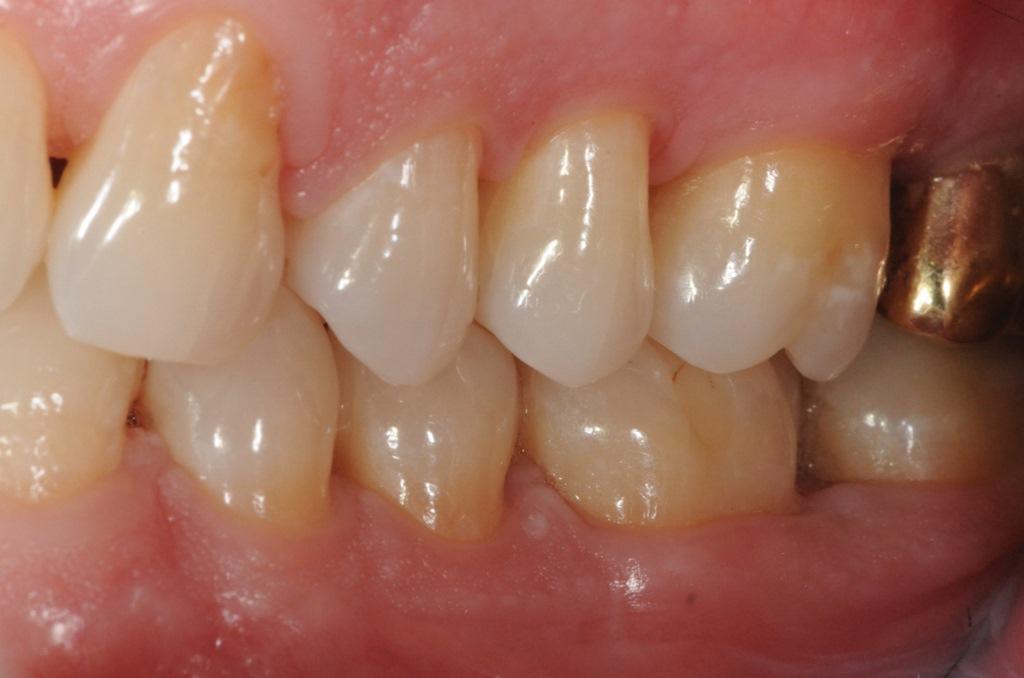
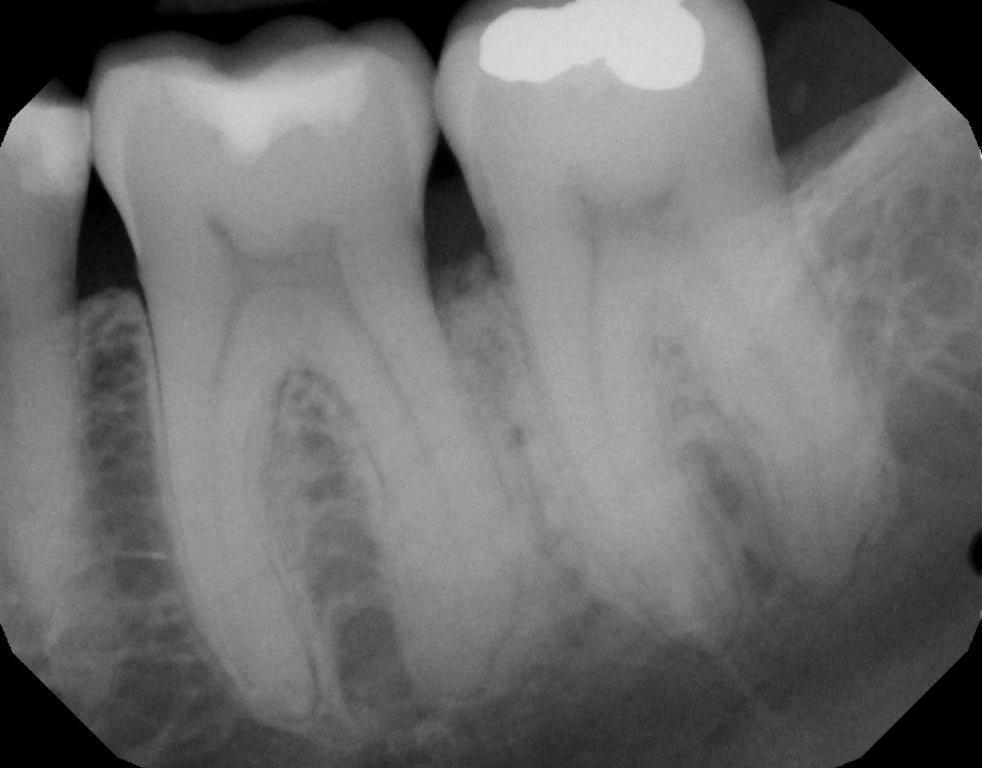
Фото 14: На периапикальной рентгенограмме через 1 год наблюдения видна восстановленная кость.
Заключение
Учитывая увеличение продолжительности жизни и высокую частоту периимплантита, особенно у пациентов с пародонтитом, вмешательства, направленные на сохранение зубов и улучшение их прогноза, такие как регенеративные процедуры, должны проводиться с высокой степенью предсказуемости. Контрольный список "7 ключевых моментов" для успешной регенерации пародонта при внутрикостных дефектах предназначен в качестве руководства для лечащих врачей при планировании лечения и проведении восстановительных процедур. Каждый ключевой момент имеет важное значение для достижения предсказуемого долгосрочного результата.
Авторы:
Robert A. Levine, DDS
Debora Reis Dias, DDS, MSc
Muhammad H.A. Saleh, BDS, MS, MSD
Jeffrey Ganeles, DMD
Maurício G. Araújo, DDS, MSc, PhD
Несмотря на чувствительность к технике, пародонтальная регенерация представляется эффективной при лечении внутрикостных дефектов; тем не менее, полного успеха достичь бывает трудно. Семь ключевых моментов для успешной регенерации пародонта при внутрикостных дефектах, представленные здесь, включают в себя научно обоснованное планирование лечения и хирургический протокол для достижения предсказуемых результатов. Благодаря пошаговому подходу, семь ключевых моментов дают пародонтологам контрольный список для лечения внутрикостных дефектов и включают протоколы для планирования, хирургического и послеоперационного этапов лечения. В этой статье описывается использование контрольного списка «семь ключевых моментов» для достижения предсказуемых результатов регенерации при краткосрочном и долгосрочном наблюдении. На примере одного клинического случая показано применение этих семи ключевых моментов.

Регенеративные методы лечения могут быть использованы для достижения клинических улучшений, превосходящих результаты лоскутной хирургии. Как правило, регенерационные процедуры преследуют две цели: восстановить значительную часть утраченного опорного аппарата и уменьшить глубину кармана. В идеале, это должно быть достигнуто без значительного усугубления рецессии десны. Примечательно, что различные исследования регенеративных подходов показали большую вариабельность клинических результатов, которые обычно объясняются системными и местными факторами. Интересно, что определенная степень вариабельности клинических результатов, называемая «эффектом центра», может быть следствием различий в контингенте пациентов и/или хирургических навыках лечащего врача, эффективности предыдущей этиотропной терапии и программ поддерживающей пародонтологической помощи.
Многие факторы могут повлиять на предсказуемость процедуры регенерации. Например, курение, количество стенок, входящих в дефект, подвижность зубов, степень готовности пациента к сотрудничеству, а также ширина, глубина и морфология дефекта — все эти факторы коррелировали с результатами применения различных методов регенерации. Несмотря на требовательность к технике, пародонтальная регенерация представляется эффективной при лечении внутрикостных дефектов, глубоких или мелких, широких или узких. Достижение полного успеха при регенерации пародонта является сложной задачей, что, по мнению авторов, может быть связано, главным образом, с неполной оценкой рисков, использованием неадекватных хирургических подходов и материалов, а также недостаточным клиническим опытом.
Использование контрольных списков в клинической практике может помочь лечащим врачам избежать непредвиденных осложнений. Например, авторы предложили контрольный список из 10 ключевых пунктов для немедленной установки имплантатов в эстетических зонах для достижения предсказуемых результатов. Использование контрольных списков, как показывает практика, помогает избежать осложнений в медицинской, стоматологической и хирургической практике. Цель данной статьи — описать семь основных ключевых моментов для проведения регенерации пародонта при внутрикостных дефектах с успешными долгосрочными результатами.
Контрольный список семи ключевых моментов лечения внутрикостных дефектов пародонта
- Оценка риска регенерации пародонта при внутрикостном дефекте: факторы, связанные с пациентом, состояние зубов, морфология дефекта и факторы, связанные с хирургом.
- Хирургическая подготовка: Лечение участков с повышенным кровотечением при зондировании, подвижностью или нуждающихся в проведении эндодонтического лечение; удаление зубного налета и пародонтальная терапия с помощью Nd:YAG-лазера рекомендуются в день операции.
- Хирургический доступ: Минимально инвазивный полнослойный доступ с сохранением сосочкового лоскута.
- Подготовка и кондиционирование корней: Удаление грануляционных тканей, скейлинг и подготовка корней с помощью ручных инструментов/ультразвуковых насадок, нерифленых хирургических фрез или мелкозернистых алмазных боров, а также использование 24% геля, содержащего ЭДТА, для удаления смазанного слоя.
- Комбинированная терапия: Использование костных трансплантатов (ЛКАТ или ДМБК) + биологических препаратов (rhPDGF-BB или ПМЭ) + изготовленного на заказ несшитого коллагена (пропитанного факторами роста) и/или мембраны из амниона и хориона.
- Первичное заживление лоскута: Стабильное заживление лоскута без натяжения достигается с помощью разреза и швов, освобождающих надкостницу; нерезорбируемые/медленно резорбируемые швы 5-0/6-0 накладывают на 4-6 недель.
- Послеоперационный протокол: Строгая поддерживающая пародонтологическая терапия каждые 2-3 недели в течение 3 месяцев (полировка и контроль зубного налета) и долгосрочное наблюдение.
Этот последовательный, научно обоснованный клинический подход может быть использован для построения и реализации стратегии оптимизации клинических исходов у разных пациентов с различными анатомическими дефектами.
ДМБК = депротеинизированный минерал бычьей кости, ЭДТА = этилендиаминтетрауксусная кислота, ПМЭ = производное матрикса эмали, ЛКАТ = лиофилизированный костный аллотрансплантат, Nd. YAG = Легированный неодимом-иттриево-алюминиевый гранат, rhFDGF-BB = рекомбинантный человеческий тромбоцитарный фактор роста-BB
Ключевой момент № 1: Оценка риска регенерации пародонта при внутрикостных дефектах
Успех регенеративных процедур при внутрикостных дефектах обеспечивается комплексным подходом к выбору конкретного случая. Основываясь на предыдущих алгоритмах принятия решений, авторы предлагают оценку риска регенерации пародонта, чтобы помочь лечащим врачам определить факторы, связанные с пациентом, зубом, дефектом и хирургом, которые могут повлиять на вероятность достижения успешного результата при проведении регенеративных процедур. Основываясь на специфических аспектах, отмеченных при оценке риска, лечащий врач должен выбрать оптимальный подход к лечению, включая форму разреза, удлинение лоскута и биоматериалы, учитывая ограничения в каждом конкретном случае. Этот этап очень важен для приведения ожиданий пациента в соответствие с предсказуемостью лечения. Места лечения высокого риска должны быть подробно обсуждены с пациентом.
В представленном случае 56-летний здоровый некурящий пациент мужского пола с диагнозом локализованного пародонтита III стадии, степени B на протяжении 25 лет наблюдался в пародонтологическом кабинете частной практики (RAL). Он хорошо соблюдал правила лечения (количество зубного налета во всей полости рта <20%). Во время пандемии COVID-19 пациент пропустил три визита для проведения поддерживающей пародонтологической терапии (ППТ) в течение года, что привело к разрушению пародонта интерпроксимально между зубами 3.7 и 3.6 (левые второй и первый моляры нижней челюсти соответственно). Во время последнего визита к пародонтологу было отмечено значительное увеличение глубины зондирования до 10 мм с кровотечением (фото 1 - 3). На периапикальной рентгенограмме был обнаружен глубокий, узкий трехстенный внутрикостный дефект в дистальной части зуба 3.6, с вовлечением буккальной фуркации I класса (фото 4). Согласно шкале пародонтального риска (ШПР), ранее известной как индекс пародонтального прогноза Миллера-МакЭнтира, прогноз состояния зубов при первичном осмотре пациента был «хорошим» (оценка = 5), учитывая, что он не знал о своем уровне гемоглобина A1C (HbA1c). Эта оценка побудила пациента к тестированию, и его последующий показатель HbA1c составил <6%, таким образом, его оценка по ШПР снизилась до 3, что было расценено как «отлично», поскольку целевой показатель ШПР для регенеративных процедур составляет <5.
Зуб 3.6 не был подвижным и подвергся эндодонтическому исследованию на жизнеспособность. Анатомия мягких тканей не была нарушена, ширина кератинизированной ткани составляла >2 мм. Хирург был опытным, не испытывал стресса от окружающей среды и использовал контрольные списки. Таким образом, на основании оценки предоперационного риска, пациентка относилась к группе низкого-среднего риска для восстановительного лечения пародонта.
Фото 1: Зуб 3.6 при первичном обследовании, вид с буккальной стороны.

Фото 2: Зуб 3.6 при первичном обследовании, вид с окклюзионной стороны. Обратите внимание на толщину мягких тканей и ширину кератинизированных тканей.

Фото 3: Глубина зондирования 10 мм с дистальной стороны зуба 3.6.

Фото 4: На периапикальной рентгенограмме виден дистальный внутрикостный дефект зуба 3.6.

Ключевой момент №2: Хирургическая подготовка
Перед проведением внутрикостной регенеративной хирургической процедуры участки с кровоточивостью при зондировании требуют проведения обучения по контролю зубного налета, а также проведения скейлинга пародонта во всей полости рта и санации корней. Скейлинг и санацию корней следует проводить только наддесневым способом на участках, подлежащих регенеративному лечению, избегая применения поддесневых инструментов в запланированных местах хирургического вмешательства. С пациентом следует провести оценку и обучение по контролю биопленки. Зубы с подвижностью II или III степени по Миллеру следует шинировать и/или проводить коррекцию окклюзии во всех рабочих, протрузионных и нерабочих движениях до хирургического лечения. Интактные зубы следует сохранить интактными, если дефект периодонта не затрагивает верхушку. Проводимые ранее процедуры лечения корневых каналов должны быть тщательно оценены. Нежизнеспособные зубы должны быть успешно вылечены, а при некачественном лечении корневых каналов следует провести повторное лечение после эндодонтического обследования и ухода.
Оставшийся бактериальный налет вокруг соответствующего зуба должен быть удален в день операции. Дополнительное использование лазерной регенеративной терапии позволяет эффективно стерилизовать поддесневую область кармана на глубину внутрикостного дефекта. Хотя в литературе высказываются противоречивые мнения, можно использовать антибиотики, назначая нагрузочную дозу (2 г амоксициллина) для профилактики послеоперационных инфекций и, таким образом, снижения послеоперационных осложнений.
Ключевой момент №3: Хирургический доступ
При планировании регенеративной процедуры для достижения успешного результата необходимо соблюдать несколько общих требований, включая создание пространства достаточного объема для поддержания кровяного сгустка, а также стабильную, неподвижную защиту мягких тканей обрабатываемой области во избежание бактериального загрязнения. Оптимальная форма лоскута для доступа к внутрикостным дефектам должна обеспечивать заживление первичным натяжением. Стабильность раны достигается за счет правильного обращения с мягкими тканями и стабильности (неподвижности) соседних зубов.
Лоскуты для сохранения сосочков - это широкие, подвижные лоскуты, позволяющие четко визуализировать область дефекта, легко накладывать биоматериалы/барьерные мембраны и пассивно закрывать лоскут, сохраняя межзубные сосочки. Было предложено несколько минимально инвазивных методик с использованием операционных микроскопов и микрохирургических инструментов. Эти методики позволяют минимально приподнять ткани, чтобы уменьшить хирургическую травму и повысить стабильность лоскута. Таким образом, выбор хирургического подхода зависит от морфологии и протяженности дефекта. Хотя минимально инвазивные методы могут обеспечить лучшую стабильность тканей, в некоторых случаях необходим большой лоскут (например, при глубоких дефектах, затрагивающих три или более сторон корня).
В данном случае были выполнены внутрибороздковые надрезы, а затем освобождающий разрез с мезиальной стороны зуба 3.6. Полнослойный лоскут был приподнят с буккальной и язычной сторон (фото 5 и 6) с помощью минимально инвазивного периостального элеватора. Участок был тщательно подготовлен, чтобы избежать загрязнения слюной.
Фото 5: Хирургический доступ и подготовка корня. Лоскуты были подняты после того, как были сделаны внутрибороздковые надрезы, и был выполнен освобождающий разрез с мезиальной стороны зуба 3.6. Грануляционная ткань была удалена.

Фото 6. Дистальный внутрикостный дефект глубиной 5 мм у зуба 3.6.

Ключевой момент № 4: Подготовка и обработка корней
Чтобы повысить процент успеха регенеративных процедур, рекомендуется подготовка и модификация корней. После откидывания лоскута первым шагом является удаление грануляционных тканей с помощью ручных, ультразвуковых и/или вращающихся инструментов. Используется высокоскоростной наконечник с хирургической скейлерной фрезой или мелкозернистым алмазным бором для препарирования зубов под обильной ирригацией, и проводится эффективная санация поражения. Тщательное удаление всех твердых и мягких отложений на поверхности корня и любой клинически пораженной поверхности цемента является залогом успеха. Хотя это и спорно, удаление смазанного слоя и обнажение коллагеновых волокон с помощью кондиционеров корней, таких как 24% гель этилендиаминтетрауксусной кислоты (ЭДТА), может повысить адгезию клеток и иметь клинические преимущества, включая улучшенную визуализацию и лучший гемостаз.
В данном случае корень зуба 3.6 был подготовлен с помощью пьезоэлектрических скейлеров и нерифленых хирургических фрез с целью удаления грануляционных тканей и налета/кальцификатов на поверхности корня. Кондиционирование корней проводилось путем нанесения 24% геля, содержащего ЭДТА, на 2 минуты, после чего проводилось обильное орошение стерильным физраствором (фото 7).
Фото 7: Кондиционирование корней с помощью 24%-ного геля, содержащего ЭДТА.

Ключевой момент № 5: Размещение регенеративных биоматериалов (комбинированная терапия)
Регенерация тканей основывается на трех ключевых компонентах, которые часто называют «триадой регенерации»: клетки, скаффолды (например, костные трансплантаты) и сигнальные молекулы (например, факторы роста). При условии достаточной васкуляризации, стабильности раны и времени эти компоненты играют важнейшую роль в регенерации тканей. Различные систематические обзоры показали, что для лечения остаточных карманов с глубокими (≥3 мм) внутрикостными дефектами следует использовать комбинированные методы лечения, т.е. костные трансплантаты, барьерные мембраны и/или биологические препараты.
Использование биологических препаратов, таких как белки или факторы роста, подкреплено множеством исследований в литературе. Внедрение факторов роста ознаменовало новую эру в регенерации пародонта. Производное матрикса эмали, например, состоит из гетерогенной смеси белков, содержащих амелогенины в качестве основного компонента. Другим хорошо изученным, клинически и гистологически доказанным цитокином для регенерации пародонта является рекомбинантный человеческий тромбоцитарный фактор роста BB (rhPDGF-BB). Было продемонстрировано, что в сочетании с остеокондуктивным скаффолдом этот фактор роста значительно повышает уровень клинического прикрепления, уменьшает рецессию десны, а также улучшает заполнение костной ткани и устранение дефектов по сравнению с положительным контролем. Гистологические исследования на людях продемонстрировали образование новой кости, цемента и периодонтальной связки при использовании rhPDGF-BB с любым типом костного трансплантата, включая минерализованный лиофилизированный костный аллотрансплантат (ЛКАТ), деминерализованный ЛКАТ, трикальцийфосфат или депротеинизированный бычий костный минерал во внутрикостных или фуркационных дефектах. Наконец, недавний систематический обзор показал, что эффективность rhPDGF-BB в сочетании с костными трансплантатами не была связана с какими-либо побочными действиями.
Применение барьерных мембран, удерживающих костный трансплантат, является основополагающим при больших и незакрытых дефектах. Учитывая более высокую послеоперационную заболеваемость и частоту осложнений при использовании нерезорбируемых барьерных мембран, резорбируемые мембраны следует использовать в первую очередь, поскольку они будут сочетаться с костным трансплантатом и действовать как скаффолд. Рекомендуется использовать несшитые коллагеновые мембраны.
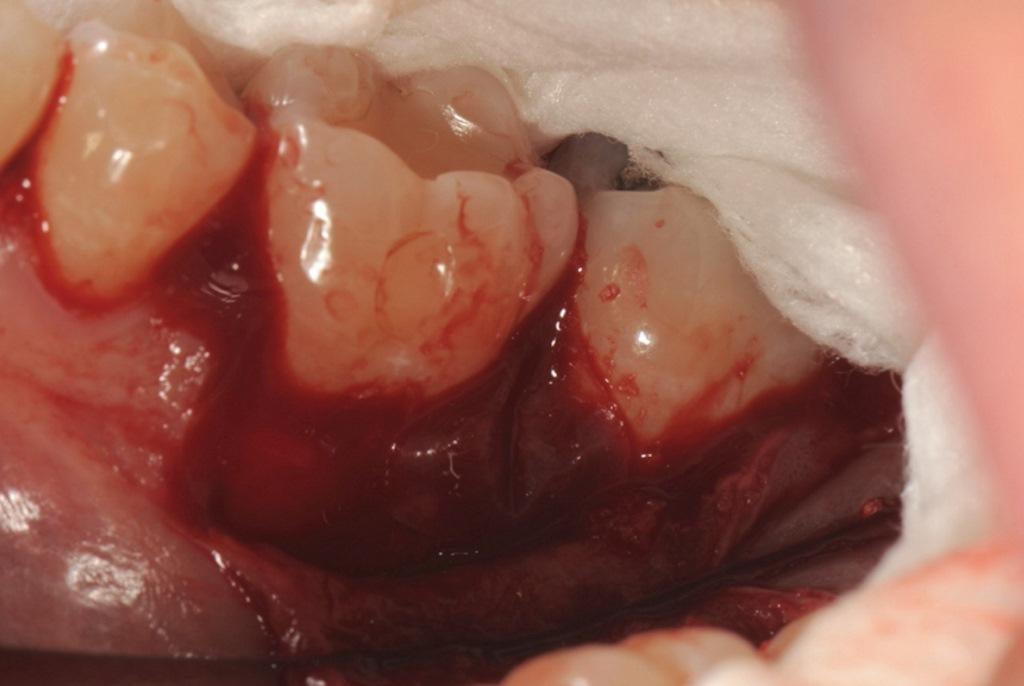
В данном случае rhPDGF-BB использовался в сочетании с ЛКАТ и был плотно уложен во внутрикостный дефект (фото 8 и 9). Мембрана из амниона и хориона была подобрана и адаптирована поверх костного дефекта (фото 10 и 11).
Фото 8, 9: Комбинированная терапия, при которой rhPDGF-BB был объединен с ЛКАТ (Фото 8) и помещен в костный дефект (Фото 9).


Фото 10, 11: Комбинированная терапия включала использование мембраны из амниона и хориона, которая была изготовлена по индивидуальному заказу (Фото 10) и помещена над интерпроксимальным аспектом костного дефекта (Фото 11).


Ключевой момент № 6: Первичное заживление лоскута
Для успешной регенерации необходимо первичное заживление лоскута без натяжения по всему хирургическому участку. Как уже упоминалось ранее, лоскуты с сохранением сосочков и микрохирургические техники помогают улучшить эстетику, обеспечивая первичное заживление лоскута и увеличивая возможность создания пространства для регенерации в области между зубами. Раскрытие барьерных мембран - самое распространенное осложнение при регенеративных процедурах; таким образом, управление лоскутами играет ключевую роль в предотвращении неудачных исходов.
Еще один фактор, который может позволить обеспечить первичное заживление, — это соблюдение принципов минимальной инвазивности. В недавнем систематическом обзоре было обнаружено, что микрохирургические техники значительно улучшают результаты пародонтологической пластики и послеоперационное восстановление. Поэтому для заживления лоскута без натяжения следует выполнять надрезы, освобождающие надкостницу. Кроме того, из-за широкого сосочка горизонтальные матрасные швы в сочетании с прерывистыми швами позволяют обеспечить лучшую стабильность лоскута. Рекомендуемые типы швов включают нерезорбируемые, из политетрафторэтилена высокой плотности (d-PTFE) или медленно резорбируемые, которые следует оставлять не менее чем на 4 недели, если они не резорбируются, в этом случае их следует снять раньше.
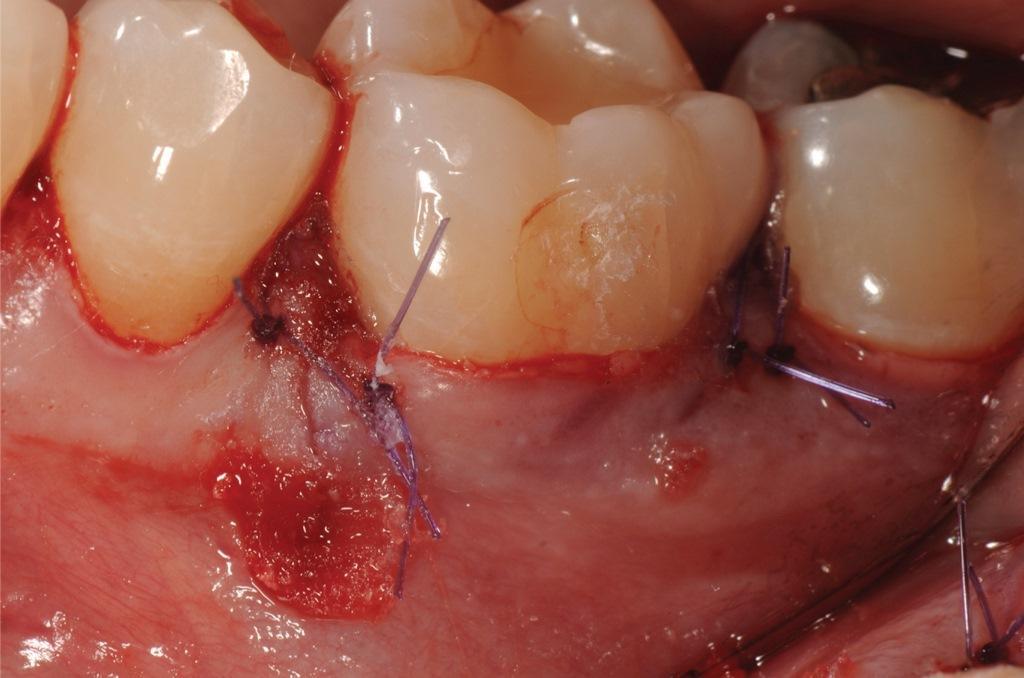
В данном клиническом случае стабильное заживление лоскута без натяжения было достигнуто с помощью разрезов, освобождающих надкостницу, и швов. Медленно рассасывающиеся швы 5-0 были оставлены на 4 недели (фото 12).
Фото 12: Фотография непосредственно после операции. Двойные прерывистые медленно рассасывающиеся швы 5-0 были оставлены на 4 недели. Для заживления освобождающего разреза использовался цианоакрилатный тканевый клей.

Ключевой момент № 7: Послеоперационный протокол
Было показано, что эффективный контроль наддесневой и поддесневой биопленки с помощью механических средств (например, санации ручными инструментами и/или ультразвуковом), воздушно-полировочных приспособлений или других химических средств (например, антисептиков) является главным компонентом успешного восстановительного лечения, особенно в глубоких пародонтальных карманах. Результаты лечения могут сохраняться в течение длительного времени только при регулярном проведении ППТ. В исследованиях по регенеративной терапии, как правило, сообщалось о комплексных механических и антисептических режимах. Хотя продолжительность и частота повторных посещений сильно различались в исследованиях, посвященных регенерации, в целом, рекомендуется проводить повторные посещения два или более раз в месяц в течение первых 3 месяцев. Более того, некоторые исследования предлагают приглашать пациентов на осмотр каждую неделю, по крайней мере, в течение первых месяцев после операции.
В данном случае послеоперационный протокол пациента включал в себя прием анальгетиков и полоскание рта. Контроль зубного налета и полировка проводились каждые 2-3 недели в течение первых 3 месяцев. Затем пациенту были назначены повторные посещения каждые 3 месяца. При наблюдении в течение 1 года можно было наблюдать стабильность мягких и твердых тканей (фото 13 и 14). В соответствии с контрольным списком из семи ключевых пунктов, в данном клиническом случае было продемонстрировано, что правильный выбор тактики ведения с учетом факторов, связанных с пациентом, зубом, дефектом и хирургом, в сочетании с использованием научно обоснованного хирургического протокола, привел к предсказуемым результатам.
Фото 13: Стабильность мягких тканей при наблюдении в течение 1 года.

Фото 14: На периапикальной рентгенограмме через 1 год наблюдения видна восстановленная кость.

Заключение
Учитывая увеличение продолжительности жизни и высокую частоту периимплантита, особенно у пациентов с пародонтитом, вмешательства, направленные на сохранение зубов и улучшение их прогноза, такие как регенеративные процедуры, должны проводиться с высокой степенью предсказуемости. Контрольный список "7 ключевых моментов" для успешной регенерации пародонта при внутрикостных дефектах предназначен в качестве руководства для лечащих врачей при планировании лечения и проведении восстановительных процедур. Каждый ключевой момент имеет важное значение для достижения предсказуемого долгосрочного результата.
Авторы:
Robert A. Levine, DDS
Debora Reis Dias, DDS, MSc
Muhammad H.A. Saleh, BDS, MS, MSD
Jeffrey Ganeles, DMD
Maurício G. Araújo, DDS, MSc, PhD






























































































































































0 комментариев