Оперкулум – это лоскут десневой ткани, который, как правило, находится дистальнее последнего моляра, и утрудняет процесс его прорезывания. В некоторых случаях, оперкулум является причиной болевых ощущений, возникающих вследствие окллюзионного взаимодействия с моляром верхней челюсти (тогда ткань воспаляется и часто изъязвляется вследствие травмы), или же по причине местного воспаления / инфицирования из-за остатков пищи и накопления зубного налета в пространстве между поверхностью зуба и десневым капюшоном.
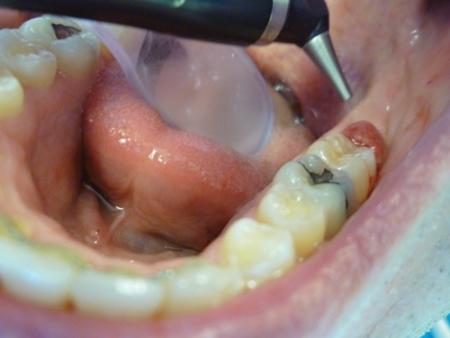
Воспаление мягких тканей, окружающих коронку частично прорезавшегося зуба, называется перикоронитом. Данная патология возникает в зубах, которые или слишком медленно прорезываются, или не прорезываются вообще. В случаях, когда фолликул сообщается с полостью рта, бактериальная контаминация фолликулярного пространства провоцирует процессы инфицирования и воспаления. Принято считать, что патофизиологию подобных изменений потенцируют пищевой налет, который скопляется вблизи оперкулума, и травма зубами-антагонистами. Перикоронарит соответственно может быть острым или хроническим. Острая форма заболевания характеризуется сильной иррадиирущей болью, локализованным отеком перикорональных тканей, гноеотделением или серозным экссудатом (отсюда неприятный привкус во рту), тризмом, региональной лимфаденопатией, болезненным глотанием, гипертермией, а иногда и распространением инфекции в область смежных с проблемным участком тканей. Хроническая форма отличается тупой характерной болью, чувством дискомфорта, часто сопровождается плохим привкусом во рту, при этом острые приступы продолжаются несколько дней, а потом возникают ремиссии продолжительностью несколько недель или даже месяцев. Стресс, беременность и усталость часто связаны с повышенной частотой возникновения перикоронитов. Диагностика подобных нарушений осуществляется на основании симптомов и клинических проявлений.
Лечение
Болезненный и/или воспаленный/инфицированный оперкулум может быть удален посредством оперкулэктомии - путем хирургического иссечения или абляции тканей с помощью широкого спектра методов: с использованием скальпеля, едких веществ, методов радиочастотной хирургии, электрохирургическим путем, прижиганием, посредством СО2-лазера или новых подходов диодной хирургии. Оперкулэктомия также является процедурой профилактического характера, которая помогает избежать возникновения перикоронита. В ортодонтии оперкулэктомия выполняется для того, чтобы облегчить прорезывание моляров (даже при отсутствии болевых ощущений) и/или для получения доступа к зубу с целью шинирования или бондинга. Convissar и Chmura установили, что при удалении тканей десны с помощью лазера, процедуры шинирования и бондинга можно проводить непосредственно после хирургического вмешательства, поскольку действие лазера кроме иссечения одновременно обеспечивает кровоостанавливающий эффект.
Одним из потенциальных недостатков оперкулэктомии является частично временный характер процедуры, поскольку оперкулум может заново вырасти, провоцируя возникновение новых последствий. В таких случаях предпочтительно удалять сам проблемный моляр, вызывающий подобные патологические изменения десневой ткани.
Лазерная хирургия мягких тканей
Самим ценным преимуществом лазера в аспекте хирургии мягких тканей является обеспечение точности манипуляции, а также непосредственный гемостатический эффект. Тем не менее, не все лазеры одинаково эффективны для проведения иссечения тканей или коагуляции. Для того, чтобы понять, как именно действие лазера обеспечивает проведение данных процедур, следует рассмотреть вопрос длины волны, от которой зависит характер взаимодействия пучка лазерного света с мягкими тканями (конкретно поглощение и рассеивание света в толще мягких тканей).
Поглощения и рассеивание пучка лазерного света мягкими тканями
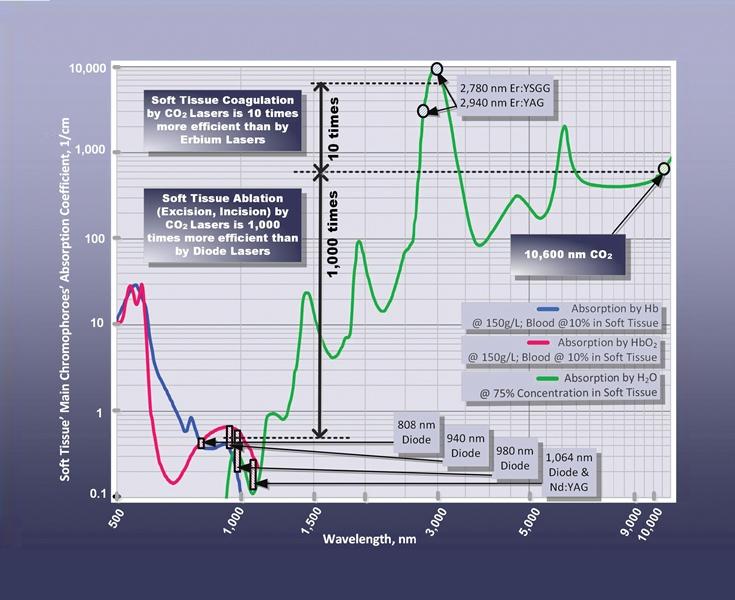
Волны различной длины по-разному взаимодействуют с основными хромофорами, или так называемыми центрами поглощения света, находящимися в мягких тканях (фото 1). Так, абсорбция световых волн оксигемоглобином лучше всего происходит при длине волны 808 нм, а для гемоглобина такие показатели варьируют в диапазоне 808-1064 нм, в то время как абсорбция водой может происходить и при длине волны в 2780 нм и даже в 2940 нм. В большинстве стоматологических лазеров используют три основные группы световых волн: около 1000 нм (диодный и неодимовый лазеры); около 3000 нм (эрбиевые лазеры); и около 10000 нм (лазеры на основе диоксида углерода).
Фото 1. Оптический коэффициент поглощения световых волн различного спектра при разных концентрациях гемоглобина (Hb), оксигемоглобина (HbO2) и меланина.
В случае эрбиевых и углекислотных лазеров рассеивание света их волн в мягких тканях является весьма незначительным. В случаях же с диодными и неодимовыми лазерами рассеивание их пучка света в мягких тканях доминирует над эффектом поглощения, поэтому данные лазеры не годятся для выполнения точной абляции, разреза или иссечения.
Абляция мягких тканей с помощью лазера
Абляция мягких тканей с помощью лазера (как, между прочем, разрез и иссечение) представляет собой процесс испарения внутри- и внеклеточной воды, нагретой лазерным светом в конкретном участке мягких тканей. Вода быстро испаряется из интенсивно нагретых лазером мягких тканей, при этом пары воды также захватывают с собой клеточный пепел и другие побочные продукты быстрого кипения и испарения структуры мягких тканей. Поскольку околоинфракрасные спектры диодного и неодимового лазеров имеют длину волн около 1000 нм, то она является недостаточной для подобных манипуляций: в мягких тканях доминирует процесс рассеивания света, поэтому обеспечить точную и аккуратную абляцию практически невозможно. Благодаря очень сильному поглощению света эрбиевого лазера в среднем инфракрасном диапазоне (около 3000 нм) и инфракрасным параметрам углекислотного лазера (около 10000 нм), данные приборы являются куда более эффективными своих предшественников, обеспечивая нужную пространственную точность лазерной абляции.
Гемостаз и коагуляция мягких тканей с помощью лазера
Процесс коагуляции возникает в мягких тканях при денатурации белка в диапазоне температур 60-100 ° C. Данный процесс значительно уменьшает уровень кровотечения и экссудации лимфатической жидкости на границе участка абляции, иссечения или разреза. Поскольку ток крови осуществляется через систему кровеносных сосудов, диаметр последнего является существенным пространственным параметром, который влияет на эффективность процесса коагуляции. Следует отметить, что благодаря исследованиям трупного материала удалось установить, что диаметр кровеносных сосудов десневой соединительной ткани колеблется в диапазоне от 21 до 40 мкм, а среднее значение составляет приблизительно 31 мкм. При действии температурных факторов, коллаген сжимается, что, в свою очередь, приводит к сужению кровеносных и лимфатических стенок сосудов, в результате которого достигается отменный гемостаз операционной раны.
Для коротких лазерных импульсов глубина фототермальной коагуляции во время абляции мягких тканей лазером пропорциональна глубине поглощения светового пучка (или обратно пропорциональна коэффициенту поглощения).
Для эрбиевого лазера с длиной волны около 3000 нм оптическая глубина поглощения света и соответственно коагуляции значительно меньше, чем диаметр кровеносных сосудов десен, поэтому коагуляция эрбиевым лазером происходит на относительно небольшом пространственном участке, и при этом не удается полностью предотвратить кровотечение из кровеносных сосудов, травмированных во время абляции тканей. Глубина коагуляции может быть увеличена путем увеличения ширины импульса и уменьшения мощности/плотности его потока.
Для диодных и неодимовых лазеров с длиной волны около 1000 нм оптическая глубина поглощения и коагуляции является значительно большей, чем диаметр кровеносных сосудов, поэтому коагуляция происходит на значительном объеме тканей, даже вдали от места абляции.
В случае углекислотного лазера с длиной волны около 10000 нм оптическая глубина поглощения и коагуляции имеет те же размеры, что и диаметр кровеносного сосуда, поэтому коагуляция распространяется как раз настолько глубоко, чтобы оптимально остановить кровотечение из травмированного сосуда. Напомним, что глубина коагуляции может быть увеличена за счет увеличения ширины импульса/скорости, и за счет уменьшения мощности импульса/плотности потока.
Оптимальная длина волны для выполнения хирургических манипуляций на мягких тканях
Светловой луч с длиной волны в 10000 нм ровно в 1000 сильнее проводит процедуру абляции, нежели световой пучок с длиной волны в 1000 нм, и в 10 раз глубже проводит коагуляцию и гомеостаз по сравнению с длиной волны в 3000 нм. Длина волны, приближенная к 10000 нм (например, в углекислотном лазере) обеспечивает одновременно как абляцию мягких тканей, так и коагуляцию, чего практически невозможно добиться с диодными (длина волны около 1000 нм) или эрбиевыми (длина волны около 3000 нм) лазерами.
Хирургия мягких тканей углекислотным лазером
Фототермическое действие СО2-лазера обеспечивает его эффективное использование с целью проведения надрезов, абляции и коагуляции мягких тканей ротовой полости. Основная причина такой эффективности СО2-лазера заключается в том, что он может иссекать и коагулировать ткани одновременно. Лечение воспаленных или гиперпластических поражений полости рта, в том числе и перикоронарита с помощью углекислотного лазера обеспечивает ряд преимуществ по сравнению с обычными методами и применением скальпеля: во-первых, метод является бесконтактным (не провоцирует механической травмы тканей), снижается или совсем отсутствует кровотечение, нет необходимости в наложении швов, а также представляются возможности точного и аккуратного иссечения тканей, а факторы послеоперационных боли и отека сводятся к минимуму. Применение СО2-лазера в области мягких тканей полости рта не ограничено какими-либо противопоказаниями и не чревато побочными последствиями. Гемостатический эффект воздействия углекислотного лазера является крайне полезным в челюстно-лицевой хирургии при лечении пациентов с геморрагическими нарушениями или принимающих антикоагулянты.
Лазерная пульсация и время тепловой релаксации
Применение лазерной энергии в течение продолжительного периода времени может привести к возникновению некроза тканей за счет диффузии тепла от облучаемых тканей и спровоцировать обугливание на границах лазерного разреза. Адекватный пульсирующий момент имеет решающее значение для надлежащего применения лазерной энергии во время абляции и коагуляции мягких тканей. Часть тканей, облучаемая лазером, максимально нагревается при условии, что длительность лазерного импульса намного короче, чем время тепловой релаксации (которая является специфичной для лазерных волн разной волны и типа тканей, на которые проводится воздействие). Оптимальное охлаждение достигается при условии, что временной промежуток между импульсами более продолжительный, чем время тепловой релаксации.
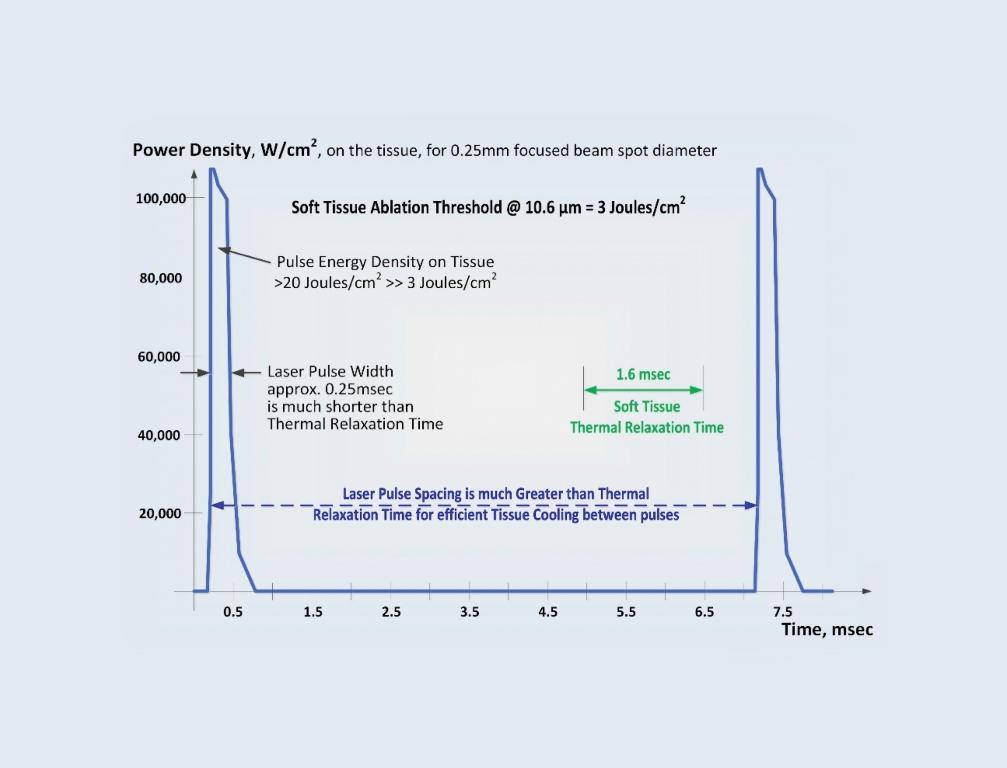
Так называемая СуперПульс-настройка параметров СО2-лазера основана именно на концепции времени тепловой релаксации, описанного выше. Режим СуперПульс обеспечивает проведение абляции без прижигания мягких тканей, а разреза и иссечения – на нужную глубину коагуляции/гемостаза на границах разреза.
Режим СуперПульс (фото 2) обеспечивается очередью коротких лазерных импульсов с очень высокой пиковой мощностью, при этом время между импульсами достаточное, чтоб обеспечить охлаждение тканей в этих перерывах между импульсами. СуперПульс минимизирует количество тепла, поступающего из зоны иссечения/абляции в область смежных здоровых тканей.
Фото 2. График СуперПульс: высокая мощность и длительные периоды релаксации обеспечивают эффективность и безопасность удаления мягких тканей без возникновения термического некроза.
Лазерные насадки
С первых дней применения хирургических углекислотных лазеров в 1970-х и 1980-х годах широкое распространение технологии было ограничено использованием цепной системы доставки луча. Изобретение гибких полых волокон для переноса лазерного луча в конце 1980-х изменило целую парадигму использования СО2-лазера в хирургии. Нынешний дизайн гибкого волокна углекислотного лазера обеспечивает его легкость в использовании, сводя размер прибора до шариковой ручки, а также предоставляя возможность автоклавирования, замены или одноразового использования, легкую переключаемость режимов иссечения с фотокоагуляцией, поверхностной абляции с фотокоагуляцией и просто фотокоагуляции. В общем, существует два типа гибких волокон СО2-лазера относительно структуры наконечников: наконечник-фиксатор и наконечник без насадки-волокна. В наконечнике-фиксаторе используются одноразовые полые сфокусированные насадки, сделанные из высокотемпературноустойчивой алюминий-оксидной керамики с размером режущей точки 250 мкм, что позволяет использовать эти приборы даже для проведения интрасулькулярных пародонтологических разрезов. Автоклавируемые наконечники без насадок очень похожи на скальпель, но без необходимости прямого механического контакта инструмента с поверхностью тканей. Для достижения заданного размера режущей точки нужно обеспечить расстояние от 1 мм до 3 мм между дистальным концом наконечника и тканью в области вмешательства.
Плотность лазерного потока
Важным параметром при использовании СО2-лазера является плотность потока (энергии). Аналогию относительно данного параметра можно описать следующим образом: независимо от того, насколько острым является лезвие, взаимодействия между лезвием и тканью невозможно без механического давления на инструмент, которое инициирует взаимодействие между лезвием и тканью. Для СО2-лазера плотность потока сфокусированного лазерного луча эквивалентна механическому давлению, которое применяется к лезвию: чем больше плотность энергии, тем лучше удаляются мягкие ткани.
Размеры точки лазерного луча и влияние данного параметра при выполнении иссечения и коагуляции тканей
Продолжая аналогию со скальпелем, размеры фокальной точки лазерного луча определяет качество лазерного иссечения в той же мере, как острота стального лезвия скальпеля определяет качество и легкость разреза. Как тупое лезвие не может обеспечить получение качественного разреза, так и слишком большая фокальная точка луча ограничивает возможность оптимального иссечения. Чем меньше (или острее) фокусная точка, тем глубже разрез можно получить с ее помощью. Для быстрого переключения с режима иссечения в режим фотокоагуляции, лазерный луч можно просто немного расфокусировать, переместив наконечник дистальнее от тканей на расстояние от 6 мм до 9 мм, и, таким образом, обеспечив оптимальный гемостаз.
Заживление раны
Превосходный кровоостанавливающий эффект СО2-лазера дает возможность врачу работать в условиях улучшенной видимости операционного поля, а это, следовательно, позволяет более точно и аккуратно провести удаление тканей. Благодаря эффективному гемостазу внутриротовые хирургические раны после лазерной терапии не требуют наложения швов или перевязочного материала и заживают путем вторичного натяжения. Значительное уменьшение эффекта сокращения раны, как и образования рубцов, являются одними из самых важных преимуществ лазерной терапии. В области ран, спровоцированных действием углекислотного лазера, процесс заживления характеризуется более заметной фибробластической пролиферацией с активной продукцией коллагена молодыми фибробластами. По сравнению со скальпированной раной, в области ран, созданных лазером, можно найти лишь небольшое количество миофибробластов, которые отвечают именно за контракцию (сокращение) раны. Через 72 ч после операции, над областью раны формируется фиброзно-серозная мембрана, которая замещает поверхностный слой некротических масс, сформировавшихся в процессе лазерной обработки. Эпителиальное покрытие раны начинает формироваться от периферии к центру уже через 2 недели и является более тонким, а также имеет паракератичный характер в отличии от ран, которые возникают после воздействия скальпеля. Вышеизложенные факты объясняют отличные эстетические результаты лечения углекислотным лазером без возникновения признаков фиброза или рубцеваний, в то время как данные процессы более характерны для ран, спровоцированных скальпелем. Еще одним преимуществом лазера является минимальный послеоперационный отек, который возникает из-за интраоперационного закрытия лимфатических сосудов в области хирургического разреза. Лимфатические сосуды регенерируют примерно в период от 8 до 10 дней после пролиферации капиллярных сосудов.
Снижение контракции раны в сочетании с минимальным повреждением смежных тканей, меньшая степень травматизации, возможность более точного управления глубиной иссечения и превосходный эффект гемостаза обосновывают успешность СО2-лазера как одного из наиболее безопасных и эффективных инструментов в челюстно-лицевой хирургии. Strauss и Deppe, сравнивая результаты лазерной хирурги с результатами после криохирургии и электрохирургии, пришли к выводу, что заживление ран после воздействия СО2-лазера происходит более быстро и менее болезненно.
Углекислотный лазер для оперкулэктомии
Основные преимущества СО2-лазера: отличный послеоперационный гемостаз, снижение послеоперационного отека и превосходное заживление раны в сочетании с пониженным риском рубцевания – именно благодаря данным аспектам углекислотный лазер является наиболее эффективным методом хирургического вмешательства для проведения оперкулэктомии. Для того чтобы достичь наиболее надежного результата, врач всегда должен полагаться на основные физические принципы лазерной хирургии, используя правильные параметры лазера (как в случае с СуперПульсом) и адекватный размер фокусной точки (т.е. диаметром 250 мкм) с возможностью быстрой расфокусировки для повышения коагуляции и гемостаза.
Оперкулэктомия посредством лазерной абляции: выводы из клинического случая
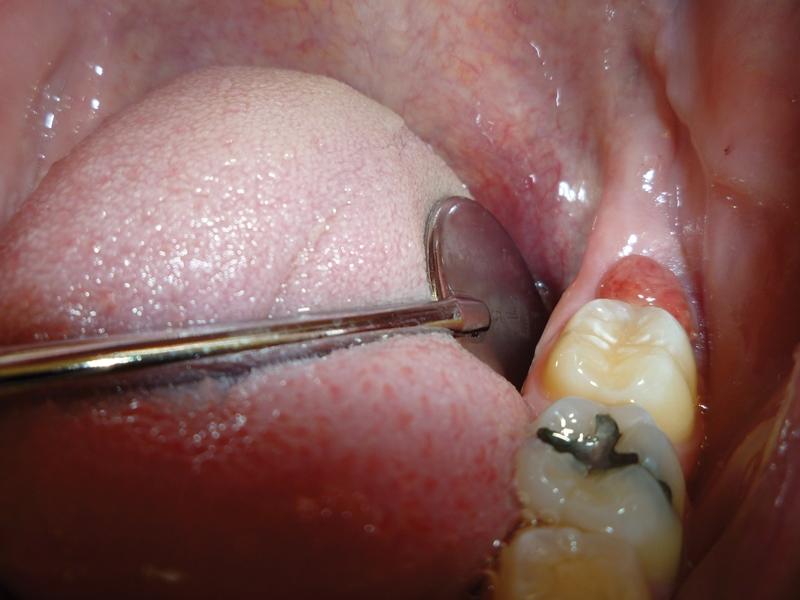
Пациент обратился за помощью по поводу приподнятого, воспаленного и болезненного оперкулума дистальнее второго моляра с левой стороны нижней челюсти (фото 3). Область поражения отличалась покраснением, отечностью, а также легко кровоточила. Пародонтальный карман на дистальной стороне второго моляра был глубже 6 мм, но признаков абсцесса обнаружено не было.
Фото 3. Вид воспаленного оперкулума до вмешательства.
Диагностика и план лечения
Изначально вмешательство проводилось с помощью скальпеля. Через 24 часа пациент вернулся в клинику с сильной болью и признаками гранулематозного поражения. Был поставлен диагноз «хронический перикоронарит». Было принято решение удалить воспаленную перикорональную ткань посредством углекислотной лазерной абляции.
Хирургическое лазерное оборудование и настройки
Для вмешательства был использован гибкий волоконный углекислотный лазер с двумя различными автоклавируемыми типами наконечников: угловой наконечник без насадки с диаметром режущей точки 0,25 мм и угловой наконечник с фиксатором со стерильной, одноразовой, конической керамической пародонтальной насадкой с режущей точкой 0,25 мм в диаметре.
Для абляции воспаленной ткани лазер был установлен на 4 Вт в режиме СуперПульс. Повторяющиеся импульсы генерировались каждых 25 миллисекунд с частотой 29 Гц. Наконечник без насадки был использован на расстоянии от 3 до 5 мм от поверхности мягких тканей.
Для обеззараживания борозды лазер был установлен на 2 Вт в режиме СуперПульс с повторением импульса каждые 15 мс и частотой повторения 20 Гц. Наконечник-фиксатор был использован с пародонтальной насадкой, которую удерживали на 1 мм дистальнее и апроксимальнее от основания кармана и параллельно поверхности зуба. Через наконечник под постоянным напором также подавался поток воздуха.
Лазерная хирургия СО2 лазером
Сначала провели инфильтрационную анестезию в области вмешательства с использованием 2% лидокаина (1: 100,000), при этом использовали 30 размер иглы. Угловой наконечник СО2-лазера удерживался перпендикулярно необходимой области обработки (фото 4), и в такой позиции проводили процедуру абляции (фото 5).
Фото 4. Наклон наконечника СО2-лазера удерживался строго перпендикулярно к области вмешательства.
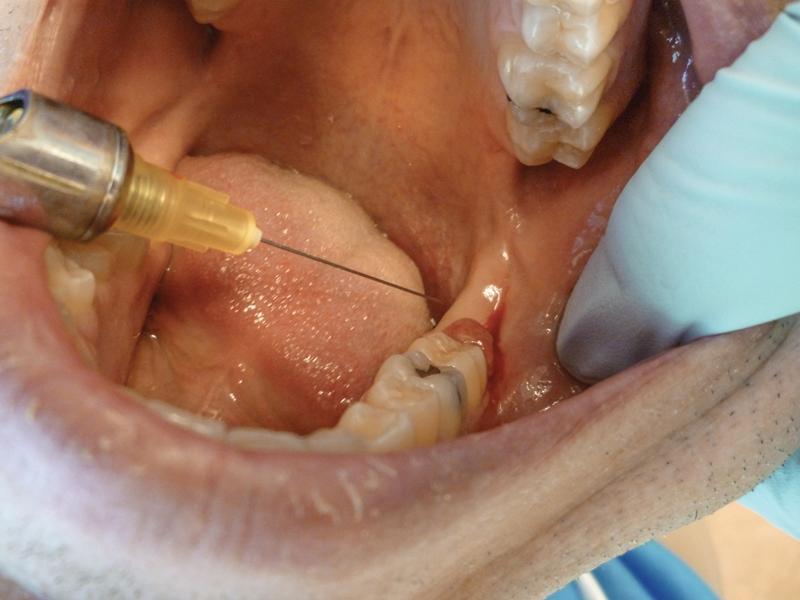
Фото 5. Абляция воспаленной ткани.
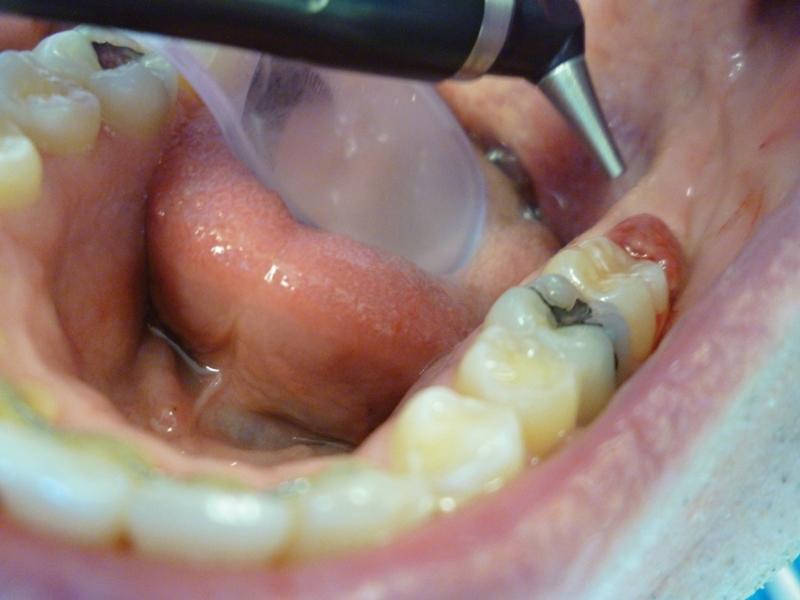
Оператор максимально избегал контакта между лазерным лучом и зубной эмалью (в данном клиническом случае воспаленная ткань находится дистально от проблемного моляра и непосредственный контакт между лазером и поверхностью зуба отсутствовал; однако в случаях, когда оперкулум покрывает лишь часть зуба, между видимой частью зуба и лазерным пучком нужно устанавливать какой-либо инструмент, например, шпатель, чтобы не затронуть поверхность эмали; для неопытных врачей рекомендуется всегда чем-то покрывать зуб во время проведения лазерных процедур с целью профилактики повреждений). После первоначального прохода проблемной области лазерным пучком воспаленная десна начала несколько кровоточить, поэтому хирург расфокусировал лазер путем увеличения расстояния от сопла наконечника к поверхности ткани, и, таким образом, обеспечил гемостатический эффект (фото 6). С помощью гемостаза также удалось добиться отличной визуализации операционного поля. Дополнительный объем тканей в области хирургического вмешательства просто «испарился», а смежные ткани выглядели абсолютно здоровыми (фото 7). После удаления поражения пародонтальную насадку установили на расстоянии около 1 мм от основания кармана с целью дезинфекции области борозды. С помощью горизонтальных движений проводили обработку всего дистального участка десневой борозды. В конце процедуры лазер еще раз расфокусировали путем его перемещения от области хирургического вмешательства для достижения дополнительного гемостатического эффекта. После проведения манипуляций не требовалось какого-либо ушивания образовавшейся раны, так как заживление участка проходит путем вторичного натяжения.
Фото 6. Гемостаз тканей после процедуры абляции.
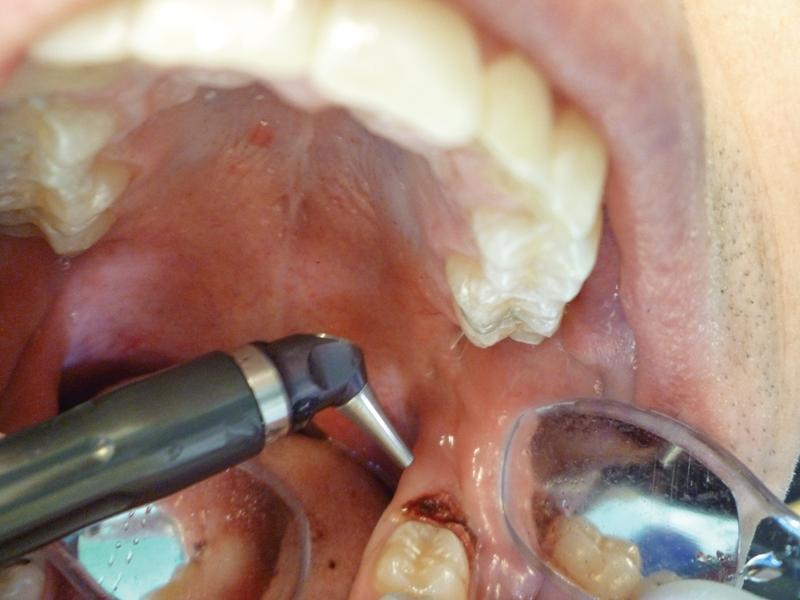
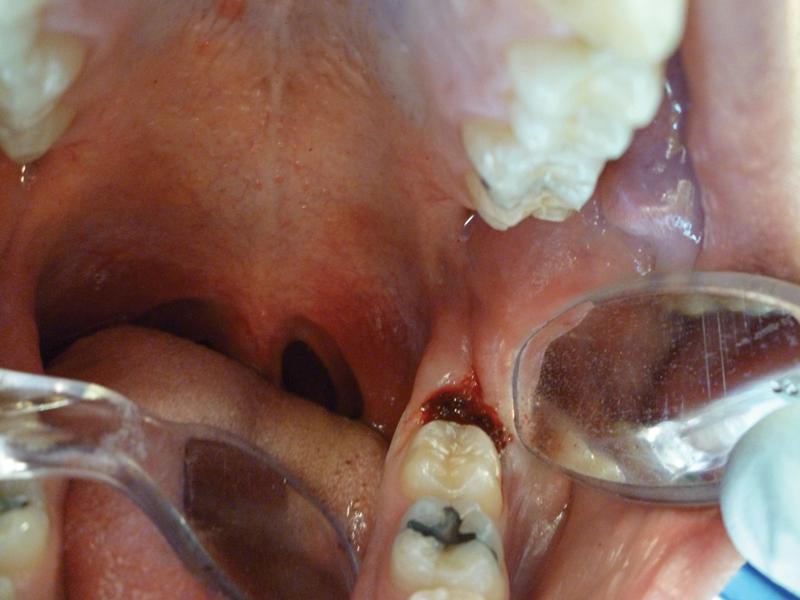
Фото 7. Вид после вмешательства: пораженная ткань удалена путем абляции. При данной манипуляции не требуется наложения швов с учетом достигнутого уровня гемостаза.
Послеоперационные рекомендации
Пациенту были рекомендованы теплые полоскания соленой водой и мягкие стимуляции операционного участка с помощью резиновой насадки два раза в день. Кроме того, были предписаны антибиотики и витамин Е в форме геля для применения непосредственно в области операционного вмешательства. Пациенту также было рекомендовано избегать приема острой и кислой пищи и не пользоваться ротовыми ополаскивателями на основе щелочи. Хотя в данном случае пациенту и был предписан Викодин 7.5, фактически он не нуждался в обезболивающих препаратах и был доволен полученным результатом лечения. По его словам, в первые 24 часа никаких болевых симптомов он не заметил.
Повторный осмотр
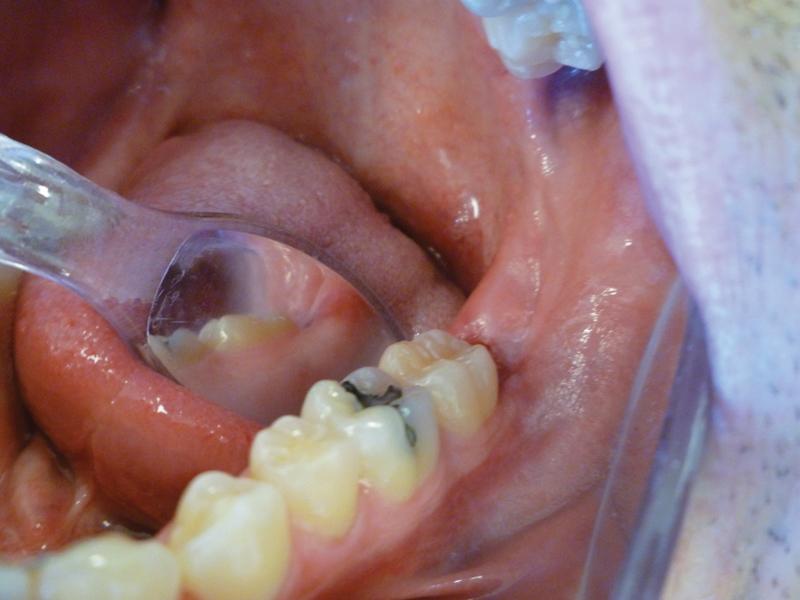
В ходе повторного осмотра через неделю было обнаружено, что заживление раны происходит довольно хорошо (фото 8): признаков отека или воспаления не отмечалось, пациент не предъявлял никаких жалоб в послеоперационном периоде. На повторном осмотре через 5 недель было обнаружено, что область вмешательства полностью зажила без признаков рубцевания (фото 9), повторного разрастания десен не наблюдалось.
Фото 8. Вид через неделю после процедуры: заживление раны происходит без осложнений.
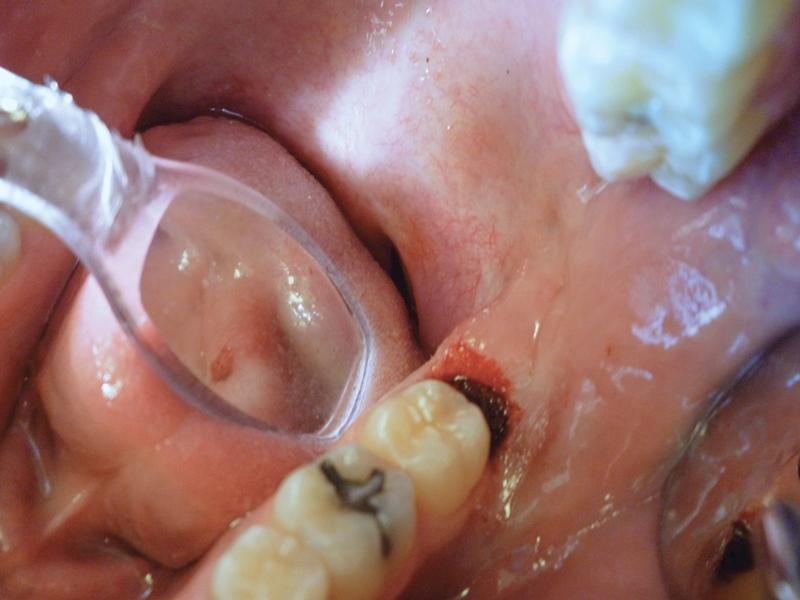
Фото 9. На повторном визите через 5 недель обнаружено адекватно зажившую область вмешательства без признаков рубцевания.
Альтернативные методы проведения оперкулэктомии без применения лазера
Поражения мягких тканей полости рта, в том числе перикорониты, можно лечить посредством и нелазерных методов лечения: классического иссечения с помощью скальпеля, криохирургии, электрохирургии, электрокоагуляции, радиочастотной хирургии, путем диодного иссечения.
Хирургия с помощью скальпеля
Хирургическое иссечение с помощью скальпеля является наиболее широко используемым методом лечения подобных вышеописанных поражений мягких тканей. Среди недостатков данного метода: возможность возникновения операционного и послеоперационного кровотечения, необходимость наложения швов, риск послеоперационного отека и инфицирования. Кроме того, Haytac и Ozcelik, сравнивая состояние пациента после операций френэктомии с помощью СО2-лазера и посредством скальпеля, пришли к выводу, что использование СО2-лазера обеспечивает лучшее состояние пациента с точки зрения отсутствия послеоперационной боли и восстановления функции, по сравнению с классическим хирургическим подходом. Они также предположили, что «хирургия с применением СО2-лазера является безопасной, эффективной, приемлемой и многообещающей альтернативой ятрогенным вмешательствам, выполненным скальпелем».
Криохирургия
Криохирургия является методом разрушения тканей посредством замораживания. Данный подход представляет собой всеобще признанную хирургическую технику лечения различных доброкачественных и злокачественных кожных новообразований, но с не меньшей эффективностью может использоваться и в стоматологии. Хотя данный метод является относительно недорогим и уже доказал свою эффективность, но процедура криодеструкции отнимает много времени и имеет много противопоказаний: например у больных с криоглобулинемией, холодовой крапивницей, агаммаглобулинемией, дисфибриногенемией, болезнью Рейно и другими заболеваниями соединительной ткани и крови. Кроме того, процедура противопоказана людям с нарушенной функцией тромбоцитов, проходящим гемодиализ или иммуносупрессивную терапию. Возможные осложнения криотерапии следующие: болевые симптомы во время замораживания, отек и экссудация, возникновение везикул или булл, риск возникновения псевдоэпителиоматозной гиперплазии, послеоперационного инфицирования, лихорадки, гнойных гранулем. Кроме того, криодеструкция не позволяет контролировать глубину удаления тканей с той же высокой точностью, что и лазерная хирургия.
Электро- и радиочастотная хирургия
Чрезмерное тепло, генерируемое во время проведения электрохирургии, повышает риск для возникновения рубцов. Исследование, в котором сравнивали тепловые повреждения в различных типах мягких тканей при применении различных методов хирургического вмешательства установили, что относительно узкая зона теплового некроза тканей при применении СО2-лазера делает его более эффективным инструментом по сравнению с электроскальпелем. Abt также отметил, что принимая во внимание то, что лазер является бесконтактным инструментом, процедура иссечения проводится во много раз быстрее, чем при применении электроножа, поскольку последний нужно постоянно очищать во время процедуры. Кроме того, использование электрохирургического подхода представляет собой некий риск и является невозможным у пациентов с металлическими ортодонтическими аппаратами. Радиочастотная хирургия является современной формой электрохирургии. В ходе выполнения вмешательства с помощью радиочастотных инструментов наблюдается значительная диффузия тепла в окружающие ткани, поэтому использование данного метода нужно избегать при непосредственной близости костной ткани и у пациентов, имеющих кардиостимуляторы и другие имплантированные или портативные медицинские устройства. Случайный контакт радиочастотного электрода с металлическими предметами (такими как имплантаты, ортодонтические аппараты, стоматологические инструменты) может превратить данные конструкции в своеобразные антенны с высокой радиочастотной мощностью, которые могут становиться собственными мощными радиочастотными источниками энергии (до 100 Вт), небезопасными для жизни и здоровья пациента.
Электрокаустика
Термины электрохирургия и электрокаустика часто вызываю путаницу. Электрокаустика, также известная как тепловая коагуляция, относится к методу, в котором с помощью постоянного или переменного тока, проходящего через металлический электродный проводник, генерируется тепло. Нагретый электрод затем применяется к живой ткани для достижения гемостаза или с целью направленной контролируемой деструкции. При применении электрокаустики, в отличие от электрохирургии, электрический ток не проходит через пациента, поэтому данная методика может безопасно применяться у пациентов с кардиостимуляторами, имплантируемыми кардиовертердефибрилляторами и глубокими стимуляторами мозга. Хотя электрокаутер может быть использован в стоматологии для выполнения оперкулэктомии, согласно литературным данным такое применение является нежелательным из-за риска возникновения чрезмерного теплового некроза и рубцевания.
Хирургия мягких тканей с помощью диода / Тепловая абляция и коагуляция без применения лазера
Лазерный свет около инфракрасного спектра с длиной волны приблизительно 1000 нм, который используется в диодных устройствах, не предоставляет возможностей для удаления или иссечения мягких тканей в полости рта. Вместо этого лазерный луч при таких условиях нагревает дистальный конец фиброоптической насадки до 500-900 ° С (благодаря явлению теплопроводности горячего стекла), а кончик наконечника затем может быть использован для манипуляций с мягкими тканями. Контакт с горячей насадкой вызывает абляцию мягких тканей, в то время как границы операционного поля поддаются процессу коагуляции. В отличие от бесконтактных хирургических лазеров (например, углекислотных или эрбиевых), аблативные диодные устройства работают посредством теплового контакта и не зависят от специфической длины волны устройства.
Выводы
Углекислотный лазер с длиной волны 10,600 нм является высокоэффективным и точным инструментом для проведения фототермической абляции, обеспечивающим, кроме того, также отличную коагуляцию. Последнее обусловлено некоторым соответствием глубины коагуляции и диаметра капилляров мягких тканей ротовой полости. Абляция гиперплазированных мягких тканей ротовой полости при помощи СО2-лазера является минимально инвазивной процедурой, обеспечивающей отличные клинические результаты. Применение лазера исключает необходимость наложения швов, и, как правило, исключает риск возникновения рубцов. Именно благодаря этому лазеротерапия превосходит большинство альтернативных хирургических методов лечения. Предельная точность иссечения, минимальное термическое повреждение прилегающих здоровых тканей, бескровный вид операционного поля и минимальный риск возникновения послеоперационных болевых симптомов аргументируют эффективность применения углекислотного лазера для удаления перикоронарных десневых тканей. Способность СО2-лазера работать в бесконтактном режиме позволяет уменьшить риск осложнений, связанных с обычным амбулаторным лечением.
Авторы:
Robert Levine, DDS
Peter Vitruk, PhD, MInstP, CPhys
Оперкулум – это лоскут десневой ткани, который, как правило, находится дистальнее последнего моляра, и утрудняет процесс его прорезывания. В некоторых случаях, оперкулум является причиной болевых ощущений, возникающих вследствие окллюзионного взаимодействия с моляром верхней челюсти (тогда ткань воспаляется и часто изъязвляется вследствие травмы), или же по причине местного воспаления / инфицирования из-за остатков пищи и накопления зубного налета в пространстве между поверхностью зуба и десневым капюшоном.

Воспаление мягких тканей, окружающих коронку частично прорезавшегося зуба, называется перикоронитом. Данная патология возникает в зубах, которые или слишком медленно прорезываются, или не прорезываются вообще. В случаях, когда фолликул сообщается с полостью рта, бактериальная контаминация фолликулярного пространства провоцирует процессы инфицирования и воспаления. Принято считать, что патофизиологию подобных изменений потенцируют пищевой налет, который скопляется вблизи оперкулума, и травма зубами-антагонистами. Перикоронарит соответственно может быть острым или хроническим. Острая форма заболевания характеризуется сильной иррадиирущей болью, локализованным отеком перикорональных тканей, гноеотделением или серозным экссудатом (отсюда неприятный привкус во рту), тризмом, региональной лимфаденопатией, болезненным глотанием, гипертермией, а иногда и распространением инфекции в область смежных с проблемным участком тканей. Хроническая форма отличается тупой характерной болью, чувством дискомфорта, часто сопровождается плохим привкусом во рту, при этом острые приступы продолжаются несколько дней, а потом возникают ремиссии продолжительностью несколько недель или даже месяцев. Стресс, беременность и усталость часто связаны с повышенной частотой возникновения перикоронитов. Диагностика подобных нарушений осуществляется на основании симптомов и клинических проявлений.
Лечение
Болезненный и/или воспаленный/инфицированный оперкулум может быть удален посредством оперкулэктомии - путем хирургического иссечения или абляции тканей с помощью широкого спектра методов: с использованием скальпеля, едких веществ, методов радиочастотной хирургии, электрохирургическим путем, прижиганием, посредством СО2-лазера или новых подходов диодной хирургии. Оперкулэктомия также является процедурой профилактического характера, которая помогает избежать возникновения перикоронита. В ортодонтии оперкулэктомия выполняется для того, чтобы облегчить прорезывание моляров (даже при отсутствии болевых ощущений) и/или для получения доступа к зубу с целью шинирования или бондинга. Convissar и Chmura установили, что при удалении тканей десны с помощью лазера, процедуры шинирования и бондинга можно проводить непосредственно после хирургического вмешательства, поскольку действие лазера кроме иссечения одновременно обеспечивает кровоостанавливающий эффект.
Одним из потенциальных недостатков оперкулэктомии является частично временный характер процедуры, поскольку оперкулум может заново вырасти, провоцируя возникновение новых последствий. В таких случаях предпочтительно удалять сам проблемный моляр, вызывающий подобные патологические изменения десневой ткани.
Лазерная хирургия мягких тканей
Самим ценным преимуществом лазера в аспекте хирургии мягких тканей является обеспечение точности манипуляции, а также непосредственный гемостатический эффект. Тем не менее, не все лазеры одинаково эффективны для проведения иссечения тканей или коагуляции. Для того, чтобы понять, как именно действие лазера обеспечивает проведение данных процедур, следует рассмотреть вопрос длины волны, от которой зависит характер взаимодействия пучка лазерного света с мягкими тканями (конкретно поглощение и рассеивание света в толще мягких тканей).
Поглощения и рассеивание пучка лазерного света мягкими тканями
Волны различной длины по-разному взаимодействуют с основными хромофорами, или так называемыми центрами поглощения света, находящимися в мягких тканях (фото 1). Так, абсорбция световых волн оксигемоглобином лучше всего происходит при длине волны 808 нм, а для гемоглобина такие показатели варьируют в диапазоне 808-1064 нм, в то время как абсорбция водой может происходить и при длине волны в 2780 нм и даже в 2940 нм. В большинстве стоматологических лазеров используют три основные группы световых волн: около 1000 нм (диодный и неодимовый лазеры); около 3000 нм (эрбиевые лазеры); и около 10000 нм (лазеры на основе диоксида углерода).
Фото 1. Оптический коэффициент поглощения световых волн различного спектра при разных концентрациях гемоглобина (Hb), оксигемоглобина (HbO2) и меланина.

В случае эрбиевых и углекислотных лазеров рассеивание света их волн в мягких тканях является весьма незначительным. В случаях же с диодными и неодимовыми лазерами рассеивание их пучка света в мягких тканях доминирует над эффектом поглощения, поэтому данные лазеры не годятся для выполнения точной абляции, разреза или иссечения.
Абляция мягких тканей с помощью лазера
Абляция мягких тканей с помощью лазера (как, между прочем, разрез и иссечение) представляет собой процесс испарения внутри- и внеклеточной воды, нагретой лазерным светом в конкретном участке мягких тканей. Вода быстро испаряется из интенсивно нагретых лазером мягких тканей, при этом пары воды также захватывают с собой клеточный пепел и другие побочные продукты быстрого кипения и испарения структуры мягких тканей. Поскольку околоинфракрасные спектры диодного и неодимового лазеров имеют длину волн около 1000 нм, то она является недостаточной для подобных манипуляций: в мягких тканях доминирует процесс рассеивания света, поэтому обеспечить точную и аккуратную абляцию практически невозможно. Благодаря очень сильному поглощению света эрбиевого лазера в среднем инфракрасном диапазоне (около 3000 нм) и инфракрасным параметрам углекислотного лазера (около 10000 нм), данные приборы являются куда более эффективными своих предшественников, обеспечивая нужную пространственную точность лазерной абляции.
Гемостаз и коагуляция мягких тканей с помощью лазера
Процесс коагуляции возникает в мягких тканях при денатурации белка в диапазоне температур 60-100 ° C. Данный процесс значительно уменьшает уровень кровотечения и экссудации лимфатической жидкости на границе участка абляции, иссечения или разреза. Поскольку ток крови осуществляется через систему кровеносных сосудов, диаметр последнего является существенным пространственным параметром, который влияет на эффективность процесса коагуляции. Следует отметить, что благодаря исследованиям трупного материала удалось установить, что диаметр кровеносных сосудов десневой соединительной ткани колеблется в диапазоне от 21 до 40 мкм, а среднее значение составляет приблизительно 31 мкм. При действии температурных факторов, коллаген сжимается, что, в свою очередь, приводит к сужению кровеносных и лимфатических стенок сосудов, в результате которого достигается отменный гемостаз операционной раны.
Для коротких лазерных импульсов глубина фототермальной коагуляции во время абляции мягких тканей лазером пропорциональна глубине поглощения светового пучка (или обратно пропорциональна коэффициенту поглощения).
Для эрбиевого лазера с длиной волны около 3000 нм оптическая глубина поглощения света и соответственно коагуляции значительно меньше, чем диаметр кровеносных сосудов десен, поэтому коагуляция эрбиевым лазером происходит на относительно небольшом пространственном участке, и при этом не удается полностью предотвратить кровотечение из кровеносных сосудов, травмированных во время абляции тканей. Глубина коагуляции может быть увеличена путем увеличения ширины импульса и уменьшения мощности/плотности его потока.
Для диодных и неодимовых лазеров с длиной волны около 1000 нм оптическая глубина поглощения и коагуляции является значительно большей, чем диаметр кровеносных сосудов, поэтому коагуляция происходит на значительном объеме тканей, даже вдали от места абляции.
В случае углекислотного лазера с длиной волны около 10000 нм оптическая глубина поглощения и коагуляции имеет те же размеры, что и диаметр кровеносного сосуда, поэтому коагуляция распространяется как раз настолько глубоко, чтобы оптимально остановить кровотечение из травмированного сосуда. Напомним, что глубина коагуляции может быть увеличена за счет увеличения ширины импульса/скорости, и за счет уменьшения мощности импульса/плотности потока.
Оптимальная длина волны для выполнения хирургических манипуляций на мягких тканях
Светловой луч с длиной волны в 10000 нм ровно в 1000 сильнее проводит процедуру абляции, нежели световой пучок с длиной волны в 1000 нм, и в 10 раз глубже проводит коагуляцию и гомеостаз по сравнению с длиной волны в 3000 нм. Длина волны, приближенная к 10000 нм (например, в углекислотном лазере) обеспечивает одновременно как абляцию мягких тканей, так и коагуляцию, чего практически невозможно добиться с диодными (длина волны около 1000 нм) или эрбиевыми (длина волны около 3000 нм) лазерами.
Хирургия мягких тканей углекислотным лазером
Фототермическое действие СО2-лазера обеспечивает его эффективное использование с целью проведения надрезов, абляции и коагуляции мягких тканей ротовой полости. Основная причина такой эффективности СО2-лазера заключается в том, что он может иссекать и коагулировать ткани одновременно. Лечение воспаленных или гиперпластических поражений полости рта, в том числе и перикоронарита с помощью углекислотного лазера обеспечивает ряд преимуществ по сравнению с обычными методами и применением скальпеля: во-первых, метод является бесконтактным (не провоцирует механической травмы тканей), снижается или совсем отсутствует кровотечение, нет необходимости в наложении швов, а также представляются возможности точного и аккуратного иссечения тканей, а факторы послеоперационных боли и отека сводятся к минимуму. Применение СО2-лазера в области мягких тканей полости рта не ограничено какими-либо противопоказаниями и не чревато побочными последствиями. Гемостатический эффект воздействия углекислотного лазера является крайне полезным в челюстно-лицевой хирургии при лечении пациентов с геморрагическими нарушениями или принимающих антикоагулянты.
Лазерная пульсация и время тепловой релаксации
Применение лазерной энергии в течение продолжительного периода времени может привести к возникновению некроза тканей за счет диффузии тепла от облучаемых тканей и спровоцировать обугливание на границах лазерного разреза. Адекватный пульсирующий момент имеет решающее значение для надлежащего применения лазерной энергии во время абляции и коагуляции мягких тканей. Часть тканей, облучаемая лазером, максимально нагревается при условии, что длительность лазерного импульса намного короче, чем время тепловой релаксации (которая является специфичной для лазерных волн разной волны и типа тканей, на которые проводится воздействие). Оптимальное охлаждение достигается при условии, что временной промежуток между импульсами более продолжительный, чем время тепловой релаксации.
Так называемая СуперПульс-настройка параметров СО2-лазера основана именно на концепции времени тепловой релаксации, описанного выше. Режим СуперПульс обеспечивает проведение абляции без прижигания мягких тканей, а разреза и иссечения – на нужную глубину коагуляции/гемостаза на границах разреза.
Режим СуперПульс (фото 2) обеспечивается очередью коротких лазерных импульсов с очень высокой пиковой мощностью, при этом время между импульсами достаточное, чтоб обеспечить охлаждение тканей в этих перерывах между импульсами. СуперПульс минимизирует количество тепла, поступающего из зоны иссечения/абляции в область смежных здоровых тканей.
Фото 2. График СуперПульс: высокая мощность и длительные периоды релаксации обеспечивают эффективность и безопасность удаления мягких тканей без возникновения термического некроза.

Лазерные насадки
С первых дней применения хирургических углекислотных лазеров в 1970-х и 1980-х годах широкое распространение технологии было ограничено использованием цепной системы доставки луча. Изобретение гибких полых волокон для переноса лазерного луча в конце 1980-х изменило целую парадигму использования СО2-лазера в хирургии. Нынешний дизайн гибкого волокна углекислотного лазера обеспечивает его легкость в использовании, сводя размер прибора до шариковой ручки, а также предоставляя возможность автоклавирования, замены или одноразового использования, легкую переключаемость режимов иссечения с фотокоагуляцией, поверхностной абляции с фотокоагуляцией и просто фотокоагуляции. В общем, существует два типа гибких волокон СО2-лазера относительно структуры наконечников: наконечник-фиксатор и наконечник без насадки-волокна. В наконечнике-фиксаторе используются одноразовые полые сфокусированные насадки, сделанные из высокотемпературноустойчивой алюминий-оксидной керамики с размером режущей точки 250 мкм, что позволяет использовать эти приборы даже для проведения интрасулькулярных пародонтологических разрезов. Автоклавируемые наконечники без насадок очень похожи на скальпель, но без необходимости прямого механического контакта инструмента с поверхностью тканей. Для достижения заданного размера режущей точки нужно обеспечить расстояние от 1 мм до 3 мм между дистальным концом наконечника и тканью в области вмешательства.
Плотность лазерного потока
Важным параметром при использовании СО2-лазера является плотность потока (энергии). Аналогию относительно данного параметра можно описать следующим образом: независимо от того, насколько острым является лезвие, взаимодействия между лезвием и тканью невозможно без механического давления на инструмент, которое инициирует взаимодействие между лезвием и тканью. Для СО2-лазера плотность потока сфокусированного лазерного луча эквивалентна механическому давлению, которое применяется к лезвию: чем больше плотность энергии, тем лучше удаляются мягкие ткани.
Размеры точки лазерного луча и влияние данного параметра при выполнении иссечения и коагуляции тканей
Продолжая аналогию со скальпелем, размеры фокальной точки лазерного луча определяет качество лазерного иссечения в той же мере, как острота стального лезвия скальпеля определяет качество и легкость разреза. Как тупое лезвие не может обеспечить получение качественного разреза, так и слишком большая фокальная точка луча ограничивает возможность оптимального иссечения. Чем меньше (или острее) фокусная точка, тем глубже разрез можно получить с ее помощью. Для быстрого переключения с режима иссечения в режим фотокоагуляции, лазерный луч можно просто немного расфокусировать, переместив наконечник дистальнее от тканей на расстояние от 6 мм до 9 мм, и, таким образом, обеспечив оптимальный гемостаз.
Заживление раны
Превосходный кровоостанавливающий эффект СО2-лазера дает возможность врачу работать в условиях улучшенной видимости операционного поля, а это, следовательно, позволяет более точно и аккуратно провести удаление тканей. Благодаря эффективному гемостазу внутриротовые хирургические раны после лазерной терапии не требуют наложения швов или перевязочного материала и заживают путем вторичного натяжения. Значительное уменьшение эффекта сокращения раны, как и образования рубцов, являются одними из самых важных преимуществ лазерной терапии. В области ран, спровоцированных действием углекислотного лазера, процесс заживления характеризуется более заметной фибробластической пролиферацией с активной продукцией коллагена молодыми фибробластами. По сравнению со скальпированной раной, в области ран, созданных лазером, можно найти лишь небольшое количество миофибробластов, которые отвечают именно за контракцию (сокращение) раны. Через 72 ч после операции, над областью раны формируется фиброзно-серозная мембрана, которая замещает поверхностный слой некротических масс, сформировавшихся в процессе лазерной обработки. Эпителиальное покрытие раны начинает формироваться от периферии к центру уже через 2 недели и является более тонким, а также имеет паракератичный характер в отличии от ран, которые возникают после воздействия скальпеля. Вышеизложенные факты объясняют отличные эстетические результаты лечения углекислотным лазером без возникновения признаков фиброза или рубцеваний, в то время как данные процессы более характерны для ран, спровоцированных скальпелем. Еще одним преимуществом лазера является минимальный послеоперационный отек, который возникает из-за интраоперационного закрытия лимфатических сосудов в области хирургического разреза. Лимфатические сосуды регенерируют примерно в период от 8 до 10 дней после пролиферации капиллярных сосудов.
Снижение контракции раны в сочетании с минимальным повреждением смежных тканей, меньшая степень травматизации, возможность более точного управления глубиной иссечения и превосходный эффект гемостаза обосновывают успешность СО2-лазера как одного из наиболее безопасных и эффективных инструментов в челюстно-лицевой хирургии. Strauss и Deppe, сравнивая результаты лазерной хирурги с результатами после криохирургии и электрохирургии, пришли к выводу, что заживление ран после воздействия СО2-лазера происходит более быстро и менее болезненно.
Углекислотный лазер для оперкулэктомии
Основные преимущества СО2-лазера: отличный послеоперационный гемостаз, снижение послеоперационного отека и превосходное заживление раны в сочетании с пониженным риском рубцевания – именно благодаря данным аспектам углекислотный лазер является наиболее эффективным методом хирургического вмешательства для проведения оперкулэктомии. Для того чтобы достичь наиболее надежного результата, врач всегда должен полагаться на основные физические принципы лазерной хирургии, используя правильные параметры лазера (как в случае с СуперПульсом) и адекватный размер фокусной точки (т.е. диаметром 250 мкм) с возможностью быстрой расфокусировки для повышения коагуляции и гемостаза.
Оперкулэктомия посредством лазерной абляции: выводы из клинического случая
Пациент обратился за помощью по поводу приподнятого, воспаленного и болезненного оперкулума дистальнее второго моляра с левой стороны нижней челюсти (фото 3). Область поражения отличалась покраснением, отечностью, а также легко кровоточила. Пародонтальный карман на дистальной стороне второго моляра был глубже 6 мм, но признаков абсцесса обнаружено не было.
Фото 3. Вид воспаленного оперкулума до вмешательства.

Диагностика и план лечения
Изначально вмешательство проводилось с помощью скальпеля. Через 24 часа пациент вернулся в клинику с сильной болью и признаками гранулематозного поражения. Был поставлен диагноз «хронический перикоронарит». Было принято решение удалить воспаленную перикорональную ткань посредством углекислотной лазерной абляции.
Хирургическое лазерное оборудование и настройки
Для вмешательства был использован гибкий волоконный углекислотный лазер с двумя различными автоклавируемыми типами наконечников: угловой наконечник без насадки с диаметром режущей точки 0,25 мм и угловой наконечник с фиксатором со стерильной, одноразовой, конической керамической пародонтальной насадкой с режущей точкой 0,25 мм в диаметре.
Для абляции воспаленной ткани лазер был установлен на 4 Вт в режиме СуперПульс. Повторяющиеся импульсы генерировались каждых 25 миллисекунд с частотой 29 Гц. Наконечник без насадки был использован на расстоянии от 3 до 5 мм от поверхности мягких тканей.
Для обеззараживания борозды лазер был установлен на 2 Вт в режиме СуперПульс с повторением импульса каждые 15 мс и частотой повторения 20 Гц. Наконечник-фиксатор был использован с пародонтальной насадкой, которую удерживали на 1 мм дистальнее и апроксимальнее от основания кармана и параллельно поверхности зуба. Через наконечник под постоянным напором также подавался поток воздуха.
Лазерная хирургия СО2 лазером
Сначала провели инфильтрационную анестезию в области вмешательства с использованием 2% лидокаина (1: 100,000), при этом использовали 30 размер иглы. Угловой наконечник СО2-лазера удерживался перпендикулярно необходимой области обработки (фото 4), и в такой позиции проводили процедуру абляции (фото 5).
Фото 4. Наклон наконечника СО2-лазера удерживался строго перпендикулярно к области вмешательства.

Фото 5. Абляция воспаленной ткани.

Оператор максимально избегал контакта между лазерным лучом и зубной эмалью (в данном клиническом случае воспаленная ткань находится дистально от проблемного моляра и непосредственный контакт между лазером и поверхностью зуба отсутствовал; однако в случаях, когда оперкулум покрывает лишь часть зуба, между видимой частью зуба и лазерным пучком нужно устанавливать какой-либо инструмент, например, шпатель, чтобы не затронуть поверхность эмали; для неопытных врачей рекомендуется всегда чем-то покрывать зуб во время проведения лазерных процедур с целью профилактики повреждений). После первоначального прохода проблемной области лазерным пучком воспаленная десна начала несколько кровоточить, поэтому хирург расфокусировал лазер путем увеличения расстояния от сопла наконечника к поверхности ткани, и, таким образом, обеспечил гемостатический эффект (фото 6). С помощью гемостаза также удалось добиться отличной визуализации операционного поля. Дополнительный объем тканей в области хирургического вмешательства просто «испарился», а смежные ткани выглядели абсолютно здоровыми (фото 7). После удаления поражения пародонтальную насадку установили на расстоянии около 1 мм от основания кармана с целью дезинфекции области борозды. С помощью горизонтальных движений проводили обработку всего дистального участка десневой борозды. В конце процедуры лазер еще раз расфокусировали путем его перемещения от области хирургического вмешательства для достижения дополнительного гемостатического эффекта. После проведения манипуляций не требовалось какого-либо ушивания образовавшейся раны, так как заживление участка проходит путем вторичного натяжения.
Фото 6. Гемостаз тканей после процедуры абляции.

Фото 7. Вид после вмешательства: пораженная ткань удалена путем абляции. При данной манипуляции не требуется наложения швов с учетом достигнутого уровня гемостаза.

Послеоперационные рекомендации
Пациенту были рекомендованы теплые полоскания соленой водой и мягкие стимуляции операционного участка с помощью резиновой насадки два раза в день. Кроме того, были предписаны антибиотики и витамин Е в форме геля для применения непосредственно в области операционного вмешательства. Пациенту также было рекомендовано избегать приема острой и кислой пищи и не пользоваться ротовыми ополаскивателями на основе щелочи. Хотя в данном случае пациенту и был предписан Викодин 7.5, фактически он не нуждался в обезболивающих препаратах и был доволен полученным результатом лечения. По его словам, в первые 24 часа никаких болевых симптомов он не заметил.
Повторный осмотр
В ходе повторного осмотра через неделю было обнаружено, что заживление раны происходит довольно хорошо (фото 8): признаков отека или воспаления не отмечалось, пациент не предъявлял никаких жалоб в послеоперационном периоде. На повторном осмотре через 5 недель было обнаружено, что область вмешательства полностью зажила без признаков рубцевания (фото 9), повторного разрастания десен не наблюдалось.
Фото 8. Вид через неделю после процедуры: заживление раны происходит без осложнений.

Фото 9. На повторном визите через 5 недель обнаружено адекватно зажившую область вмешательства без признаков рубцевания.

Альтернативные методы проведения оперкулэктомии без применения лазера
Поражения мягких тканей полости рта, в том числе перикорониты, можно лечить посредством и нелазерных методов лечения: классического иссечения с помощью скальпеля, криохирургии, электрохирургии, электрокоагуляции, радиочастотной хирургии, путем диодного иссечения.
Хирургия с помощью скальпеля
Хирургическое иссечение с помощью скальпеля является наиболее широко используемым методом лечения подобных вышеописанных поражений мягких тканей. Среди недостатков данного метода: возможность возникновения операционного и послеоперационного кровотечения, необходимость наложения швов, риск послеоперационного отека и инфицирования. Кроме того, Haytac и Ozcelik, сравнивая состояние пациента после операций френэктомии с помощью СО2-лазера и посредством скальпеля, пришли к выводу, что использование СО2-лазера обеспечивает лучшее состояние пациента с точки зрения отсутствия послеоперационной боли и восстановления функции, по сравнению с классическим хирургическим подходом. Они также предположили, что «хирургия с применением СО2-лазера является безопасной, эффективной, приемлемой и многообещающей альтернативой ятрогенным вмешательствам, выполненным скальпелем».
Криохирургия
Криохирургия является методом разрушения тканей посредством замораживания. Данный подход представляет собой всеобще признанную хирургическую технику лечения различных доброкачественных и злокачественных кожных новообразований, но с не меньшей эффективностью может использоваться и в стоматологии. Хотя данный метод является относительно недорогим и уже доказал свою эффективность, но процедура криодеструкции отнимает много времени и имеет много противопоказаний: например у больных с криоглобулинемией, холодовой крапивницей, агаммаглобулинемией, дисфибриногенемией, болезнью Рейно и другими заболеваниями соединительной ткани и крови. Кроме того, процедура противопоказана людям с нарушенной функцией тромбоцитов, проходящим гемодиализ или иммуносупрессивную терапию. Возможные осложнения криотерапии следующие: болевые симптомы во время замораживания, отек и экссудация, возникновение везикул или булл, риск возникновения псевдоэпителиоматозной гиперплазии, послеоперационного инфицирования, лихорадки, гнойных гранулем. Кроме того, криодеструкция не позволяет контролировать глубину удаления тканей с той же высокой точностью, что и лазерная хирургия.
Электро- и радиочастотная хирургия
Чрезмерное тепло, генерируемое во время проведения электрохирургии, повышает риск для возникновения рубцов. Исследование, в котором сравнивали тепловые повреждения в различных типах мягких тканей при применении различных методов хирургического вмешательства установили, что относительно узкая зона теплового некроза тканей при применении СО2-лазера делает его более эффективным инструментом по сравнению с электроскальпелем. Abt также отметил, что принимая во внимание то, что лазер является бесконтактным инструментом, процедура иссечения проводится во много раз быстрее, чем при применении электроножа, поскольку последний нужно постоянно очищать во время процедуры. Кроме того, использование электрохирургического подхода представляет собой некий риск и является невозможным у пациентов с металлическими ортодонтическими аппаратами. Радиочастотная хирургия является современной формой электрохирургии. В ходе выполнения вмешательства с помощью радиочастотных инструментов наблюдается значительная диффузия тепла в окружающие ткани, поэтому использование данного метода нужно избегать при непосредственной близости костной ткани и у пациентов, имеющих кардиостимуляторы и другие имплантированные или портативные медицинские устройства. Случайный контакт радиочастотного электрода с металлическими предметами (такими как имплантаты, ортодонтические аппараты, стоматологические инструменты) может превратить данные конструкции в своеобразные антенны с высокой радиочастотной мощностью, которые могут становиться собственными мощными радиочастотными источниками энергии (до 100 Вт), небезопасными для жизни и здоровья пациента.
Электрокаустика
Термины электрохирургия и электрокаустика часто вызываю путаницу. Электрокаустика, также известная как тепловая коагуляция, относится к методу, в котором с помощью постоянного или переменного тока, проходящего через металлический электродный проводник, генерируется тепло. Нагретый электрод затем применяется к живой ткани для достижения гемостаза или с целью направленной контролируемой деструкции. При применении электрокаустики, в отличие от электрохирургии, электрический ток не проходит через пациента, поэтому данная методика может безопасно применяться у пациентов с кардиостимуляторами, имплантируемыми кардиовертердефибрилляторами и глубокими стимуляторами мозга. Хотя электрокаутер может быть использован в стоматологии для выполнения оперкулэктомии, согласно литературным данным такое применение является нежелательным из-за риска возникновения чрезмерного теплового некроза и рубцевания.
Хирургия мягких тканей с помощью диода / Тепловая абляция и коагуляция без применения лазера
Лазерный свет около инфракрасного спектра с длиной волны приблизительно 1000 нм, который используется в диодных устройствах, не предоставляет возможностей для удаления или иссечения мягких тканей в полости рта. Вместо этого лазерный луч при таких условиях нагревает дистальный конец фиброоптической насадки до 500-900 ° С (благодаря явлению теплопроводности горячего стекла), а кончик наконечника затем может быть использован для манипуляций с мягкими тканями. Контакт с горячей насадкой вызывает абляцию мягких тканей, в то время как границы операционного поля поддаются процессу коагуляции. В отличие от бесконтактных хирургических лазеров (например, углекислотных или эрбиевых), аблативные диодные устройства работают посредством теплового контакта и не зависят от специфической длины волны устройства.
Выводы
Углекислотный лазер с длиной волны 10,600 нм является высокоэффективным и точным инструментом для проведения фототермической абляции, обеспечивающим, кроме того, также отличную коагуляцию. Последнее обусловлено некоторым соответствием глубины коагуляции и диаметра капилляров мягких тканей ротовой полости. Абляция гиперплазированных мягких тканей ротовой полости при помощи СО2-лазера является минимально инвазивной процедурой, обеспечивающей отличные клинические результаты. Применение лазера исключает необходимость наложения швов, и, как правило, исключает риск возникновения рубцов. Именно благодаря этому лазеротерапия превосходит большинство альтернативных хирургических методов лечения. Предельная точность иссечения, минимальное термическое повреждение прилегающих здоровых тканей, бескровный вид операционного поля и минимальный риск возникновения послеоперационных болевых симптомов аргументируют эффективность применения углекислотного лазера для удаления перикоронарных десневых тканей. Способность СО2-лазера работать в бесконтактном режиме позволяет уменьшить риск осложнений, связанных с обычным амбулаторным лечением.
Авторы:
Robert Levine, DDS
Peter Vitruk, PhD, MInstP, CPhys































































































































































0 комментариев