Костные дефекты, возникшие в результате пародонтита или удаления зубов, могут значительно усложнить процедуру последующей имплантации и реконструктивных манипуляций. Увеличение объема кости направлено на возобновление анатомии альвеолярного гребня, что, в свою очередь, значительно улучшает условия для проведения имплантации или протезирования как съемными, так и несъемными конструкциями.
Выбор подходящего материала для реконструкции дефектов огромен: от собственных аллотрансплантантов и аналогов животного происхождения до синтетических костных заменителей. Использование собственной кости целесообразно только в случае небольших дефектов, хотя бы из соображений сохранения объема тканей в области забора материала. При обширных дефектах рекомендуется использовать кость крупного рогатого скота или ксенографты. Структура таких материалов представлена в виде частиц, которые необходимо регидратировать стерильным физиологическим раствором или кровью пациента. Только после процедуры регидратации костный заменитель помещают в участок дефекта.
Недостатком этих материалов является то, что они не поддерживают приданную им форму, особенно в случаях дефектов с сохраненной только одной стенкой.
В последние годы на рынке были представлены пастообразные формы материалов, которые значительно облегчают процесс работы и необходимой установки. Авторы обнаружили, что эти костные заменители застывают при температуре тела, что позволяет им сохранять требуемую форму.
В данной статье авторы будут обсуждать клинический случай с использованием биоматериала NovaBone (NovaBone Products), состоящего из частиц биостекла для восстановления обширного дефекта с потерей щечной и язычной стенок и дефицитом вертикальной составной альвеолярного гребня.
Трансплантационный материал NovaBone
NovaBone представляет собой кальций фосфоросиликатный материал с доказанной способностью активизировать генетические механизмы ускоренного природного прироста кости. Выделение ионов кремния (Si), кальция (Ca) и фосфора (P) из состава NovaBone влияет на стимуляцию генов, которые играют ключевую роль в процессе регенерации костной ткани. Данный процесс детерминируется как остеокондуктивный.
Контролируемое высвобождение ионов в течение длительного времени повышает уровень клеточной сигнализации и остеостимуляции, вызывая каталитическую реакцию, которая ускоряет естественный процесс заживления. Данный механизм в конечном результате является основой регенерации.
Суть прироста кости при использовании NovaBone состоит в следующем. Ионы Ca и P вместе с растворимым кремнеземом образуют силикагель и гидроксикарбонатный апатитовый слой. Это создает идеальные условия для присоединения клеток и поглощения белкового фактора роста. Именно абсорбция данных органических молекул в месте дефекта стимулирует клетки, которые являются предшественниками остеогенеза.
Эти клетки образуют первичную выстилку и обеспечивают процесс пролиферации на поверхности трансплантата. Непрерывное высвобождение ионов Са и Si модулирует процесс дифференциации. Это в свою очередь приводит к созреванию популяции остеобластов и клеток-предшественников с потенциалом для костного формирования.
Такой механизм ускоряет процесс заживления дефекта и формирования костной ткани на поверхности частиц NovaBone с интенсивностью, свойственной аутотрансплантатам. Исследования доказали, что процесс резорбции материала прогрессирует параллельно с процессом ремоделирования костной ткани. Кумулятивный эффект NovaBone обусловлен увеличением числа клеток, способных к делению, формированию новой кости и заживлению ткани. Частицы NovaBone полностью резорбируются в течение 6 месяцев и замещаются родной костью. Гистологические исследования не выявили наличия каких-либо остатков материала в период от 9 месяцев до 1 года. Продукты NovaBone были исследованы на протяжении более чем 20 лет. Трансплантационный материал доступен в форме пасты и порошка, которые могут быть использованы по отдельности или в сочетании друг с другом.
Инкорпорация частиц в структуре пасты позволяет врачу добиться трехмерного моделирования нужной формы с возможностью восстановления формы мягких тканей при необходимости.
Клинический случай
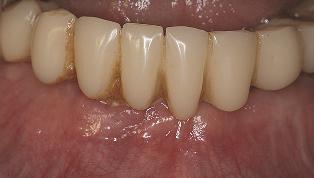
64-летний мужчина обратился за стоматологической помощью с целью протезирования нижней челюсти. На периапикальных рентгенограммах было изучено состояние структур нижней челюсти (фото 1). У пациента наблюдалась следующая клиническая ситуация: присутствуют 20,21,22, 26, 27, 28 зубы, а также несъемный металлокерамический протез с опорой на 22, 26 и 27 зубах.
Фото 1. На периапикальных рентгенограммах визуализируется потеря кости вследствие заболеваний пародонта с образованием костных дефектов во фронтальной области.
План лечения
Отмечена плохая маргинальная адаптация опор мостовидного протеза. В оставшихся зубах нижней челюсти наблюдается умеренный или высокий уровень подвижности. 20 и 21 зубы – стабильны. На рентгенограмме зафиксирована убыль костной массы на 60% около 22 зуба с образованием углового дефекта по направлению к средней линии, 90% около 26 зуба, и 60% около 27 с образованием медиального дефекта, а также 60% около 28 зуба.
Пациент был проинформирован о неприемлемом состоянии зубов нижней челюсти и о возможном алгоритме лечения. Как варианты были предложены частичное съемное протезирование либо несъемное протезирование с опорой на дентальные имплантаты.
Пациент согласился со вторым вариантом лечения.
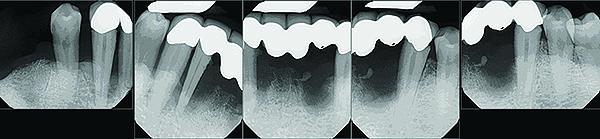
Конусно-лучевая компьютерная томография (CBCT) (Galileos, Sirona) проводилась с целью объективной оценки кости в 3D расширении, а также для планирования будущей имплантации или возможных дополнительных процедур (фото 2).
Фото 2. Панорамный снимок сформирован по результатам конусно-лучевой компьютерной томографии для планирования этапа имплантации.
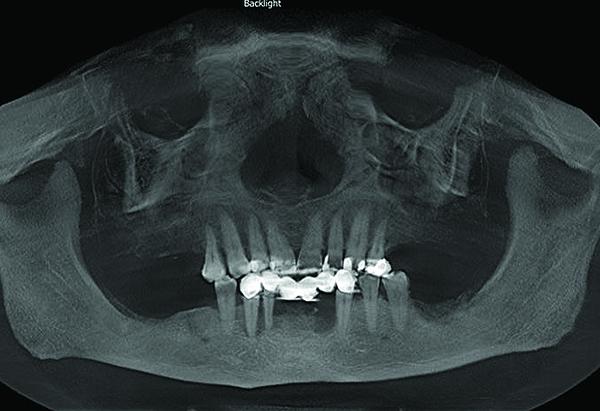
Результаты КЛКТ сканирования подтвердили наличие большого костного дефекта, визуализированного на периапикальных рентгенограммах (фото 3). Дальнейший анализ сагиттального среза определил потерю щечной и язычной стенок, а также снижение высоты альвеолярного гребня почти до уровня апекса соседнего 22 зуба (фото 4). На аксиальном срезе степень дефекта подтвердилась. Этиология дефекта скорее всего связана с заболеваниями пародонта и неполным заживлением лунки после экстракции 23 и 24 зубов (фото 5).
Фото 3. С помощью конусно-лучевой компьютерной томографии подтверждено наличие костного дефекта и нарушений стоматологического статуса.
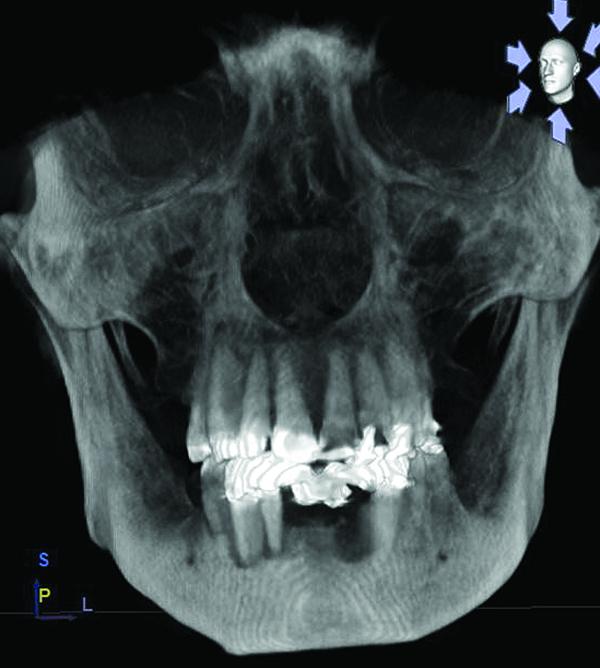
Фото 4. Сагиттальный срез конусно-лучевой компьютерной томографии в области дефекта нижней челюсти: потеря лингвальной и буккальной стенок дефекта, снижение высоты альвеолярного гребня.
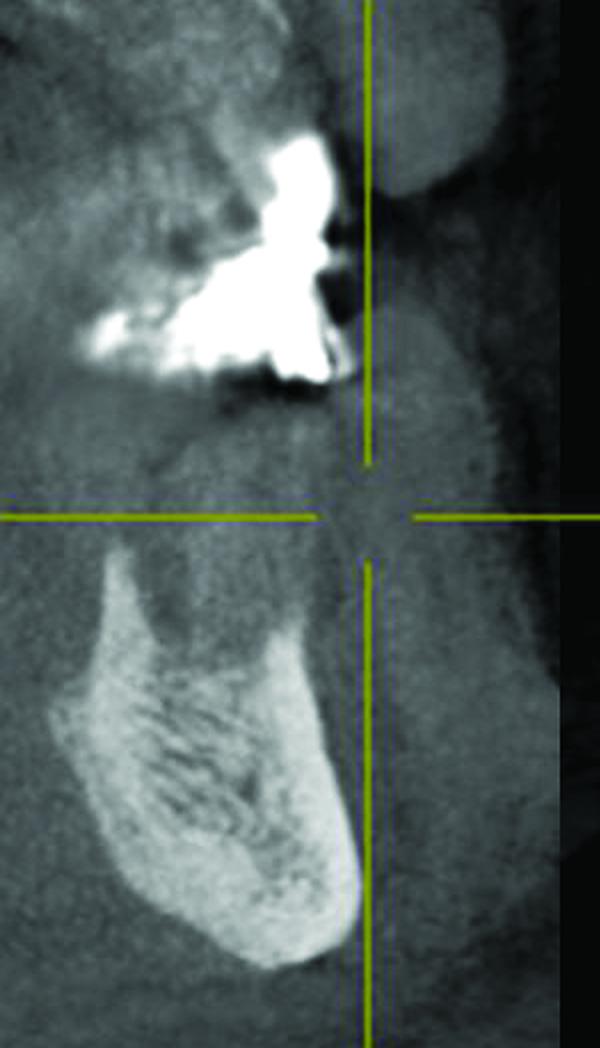
Фото 5. Аксиальный срез конусно-лучевой компьютерной томографии.
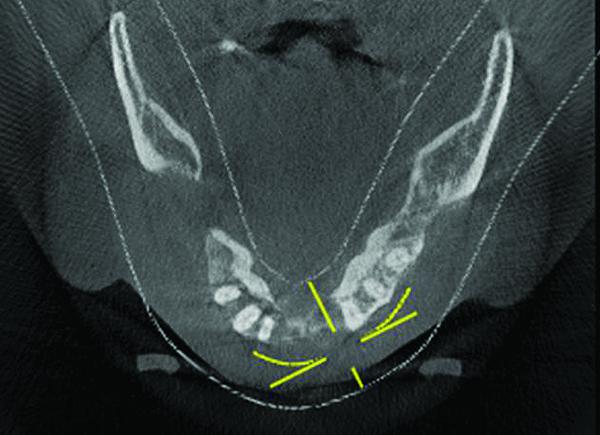
Предполагалось, что после удаления оставшихся зубов нижней челюсти, кюретажа карманов и костных дефектов, имплантаты будут размещены непосредственно в промежутке между 19 и 28 зубами на сохраненных участках кости. Костные дефекты будут заполнены трансплантационным материалом с ушыванием мягких тканей. В условиях нормального торка всех имплантатов возможна немедленная винтовая фиксация провизорного протеза непосредственно после этапа имплантации. Таким образом, имплантаты могли бы полностью интегрироваться, а подсадка костных трансплантатов помогла бы вернуть альвеолярному гребню его анатомическую форму.
Клинический протокол
Оттиски были получены из обеих челюстей для проведения анализа окклюзионных соотношений. Они были направлены в лабораторию для изготовления полного съемного протеза. В качестве ориентира для установки имплантатов с помощью 3/32"спирального сверла в провизорном протезе были сделаны направляющие отверстия в местах, определяемых результатами СВСТ-сканирования. Перед хирургическим вмешательством проведена местная инфильтрационная анестезия. Оставшиеся зубы нижней челюсти были атравматически удалены.
Разрез слизистой альвеолярного гребня был произведен в дистальном направлении от предполагаемого места установки левого имплантата в жевательной зоне и продолжен к дистальной границе предполагаемого места имплантации справа в жевательной зоне.
Полный слизисто-надкостный лоскут был отсепарирован и в области костных дефектов, а также лунок удаленных зубов была проведена процедура кюретажа с целью удаления грануляционной ткани до достижения здоровой кости.
Был установлен временный протез и с помощью 2,0 миллиметрового пилотного сверла началась подготовка костного ложа, путем проведения препарирования в кости через каждое из четырех направляющих отверстий в указанном провизорном протезе.
После данной манипуляции протез удалили, и соответствующие сверла были использованы для дальнейшего препарирования кости в месте установки имплантатов.
Для имплантации были выбраны конические ExHex имплантаты (диаметр 4,0 мм) для установки в переднем левом участке и Co-Axis имплантаты (диаметр 5,0 мм) (Keystone Dental) для передне-задней установки с правой стороны. Выбор имплантатов Co-Axis (12 °) был обусловлен определенной анатомией челюсти, которая позволяла использовать имплантаты большей длины, что впоследствии способно облегчить процесс адаптации наклона имплантов при протезировании.
Выбор конической формы имплантата обусловлен особенностями анатомии данного участка челюсти. После подготовки ложа были установлены имплантаты и формирователи десен.
Паста и порошок NovaBone были смешаны в соотношении 50/50, что обеспечило большую объемность и жесткость материала, а также возможность тампонады мягких тканей над областью дефекта. Дефект в передней области сначала был заполнен смесью трансплантата, а после покрыт резорбируемой коллагеновой мембраной. Лоскут был ушит с помощью нерассасывающейся мононити PTFE с целью закрытия раны путем первичного натяжения.
Формирователи десен были удалены, а вместо них зафиксировали титановые временные цилиндры к каждому имплантату. Полиметилметакрилат замешивали до вязкой консистенции и нагнетали в зазор между цилиндром и временным провизорным протезом. После твердения материала дополнительную порцию акрила снова вводили со стороны тканей челюсти, чтобы надежно зафиксировать временные цилиндры в составе протеза. В дальнейшем фланцы провизорного протеза были удалены акриловым бором для преобразования протеза в винтово-фиксированный несъемный мост. Твердосплавным бором спиливали ту часть временных цилиндров, которая возвышалась над окклюзионной поверхностью провизорного протеза. Протез зафиксировали к имплантатам с помощью винтов, затянутых с силой до 30 Н*см.
Кусок PTFE нити смотали в клубок и поместили в верхней части временного цилиндра, после чего ее залили текучим композитом (Flow-It, Pentron Clinical) и заполимеризировали. Окклюзия была проверена и подкорректирована по мере необходимости.
Пациент явился на контроль на третью неделю после лечения с целью проверки заживления мягких тканей и с целью удаления швов. На периапикальных рентгенограммах были обнаружены остатки трансплантационного материала в некоторых участках. Качество фиксации провизорного протеза на имплантантах было полностью удовлетворительным, промежутков между конструкциями не отмечалось (фото 6-7).
Фото 6. Периапикальный снимок через 3 недели после подсадки костного заменителя: начальная организация материала NovaBone в области дефекта.
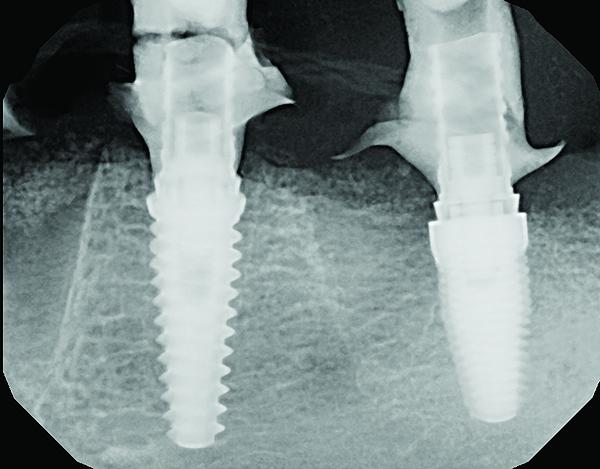
Фото 7. Периапикальный снимок через 3 недели после подсадки костного заменителя: начальная организация материала NovaBone в области дефекта.
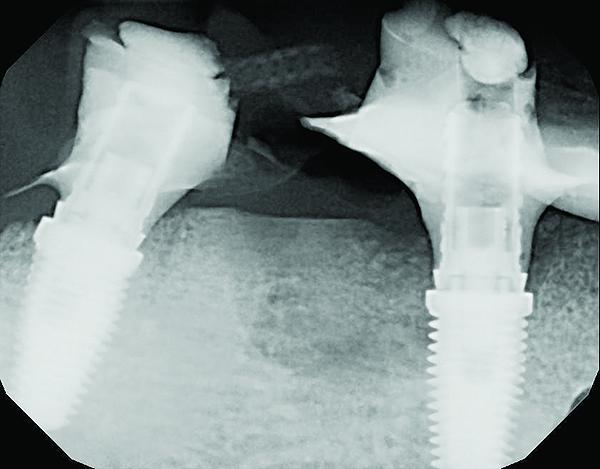
Через шесть месяцев после лечения была проведена оценка интеграции имплантатов и состояния костных дефектов с целью подготовки к финальному этапу восстановительного лечения. На срезах КЛКТ и реконструированной ортопантомограмме отмечено отсутствие дефекта (фото 8). Периапикальная рентгенография показала полное костной заполнение, а также тесный контакт между материалом трансплантата и прилегающей костной тканью (фото 9).
Фото 8. Периапикальный снимок через 6 месяцев после подсадки костного заменителя: полное заполнение дефекта новообразованной костью.
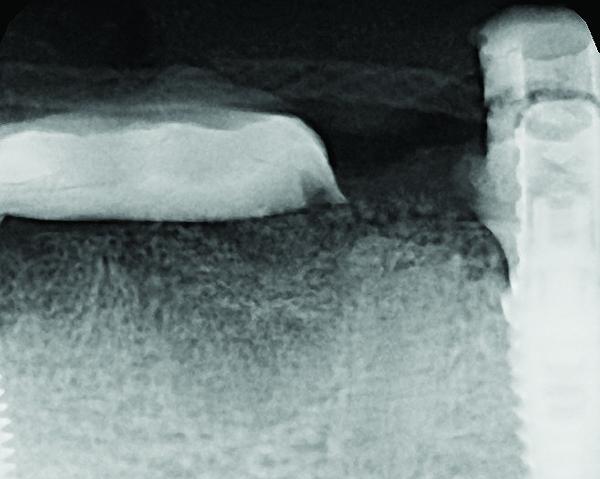
Фото 9. Панорамный снимок сформирован по результатам конусно-лучевой компьютерной томографии через 6 месяцев после подсадки костного заменителя: полное заполнение дефекта новообразованной костью, монолитное сращение NovaBone с родной костью реципиента.
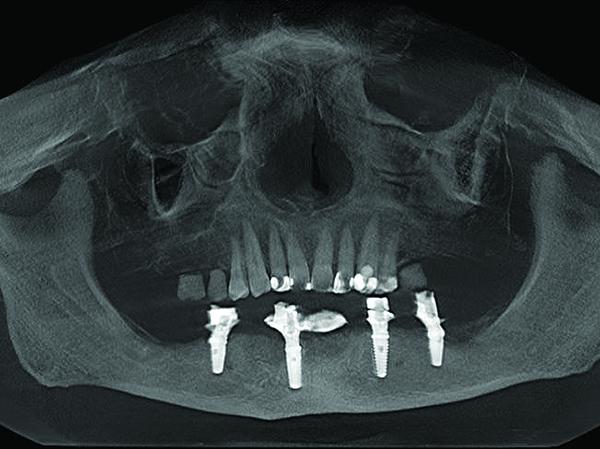
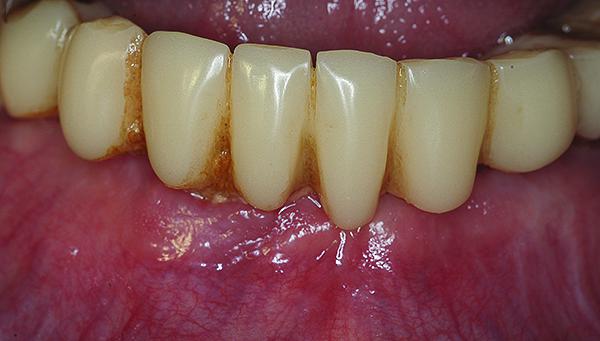
Дополнительные срезы КЛКТ показали, что имплантаты полностью окружены костью, а регион дефекта заполнен материалом трансплантата и прилегающей зоной кости (фото 10-11). На сагиттальном срезе визуализировано замещение переднего дефекта челюсти костной тканью до уровня анатомических показателей высоты и ширины гребня (фото 12). Эти данные были сопоставлены с изображениями до лечения (фото 4). Слева от срединной линии визуализируются нормальные контуры кости, а также здоровые невоспаленные мягкие ткани, покрывающие область аугментации (фото 13).
Фото 10. Дополнительные срезы конусно-лучевой компьютерной томографии через 6 месяцев после лечения: заполнение костного дефекта и интеграция имплантатов.
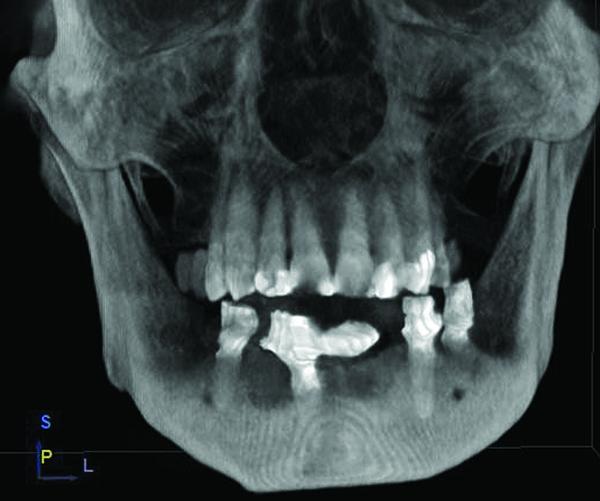
Фото 11. Дополнительные срезы конусно-лучевой компьютерной томографии через 6 месяцев после лечения: заполнение костного дефекта и интеграция имплантатов
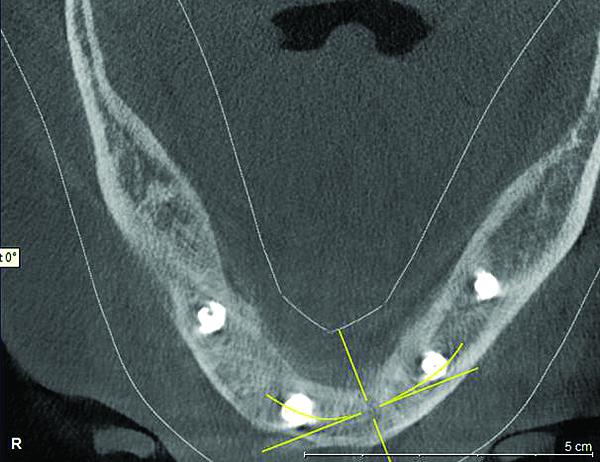
Фото 12. Сагиттальный срез конусно-лучевой компьютерной томографии через 6 месяцев после подсадки костного заменителя: восстановление буккальной и лингвальной стенок, а также высоты костного гребня.
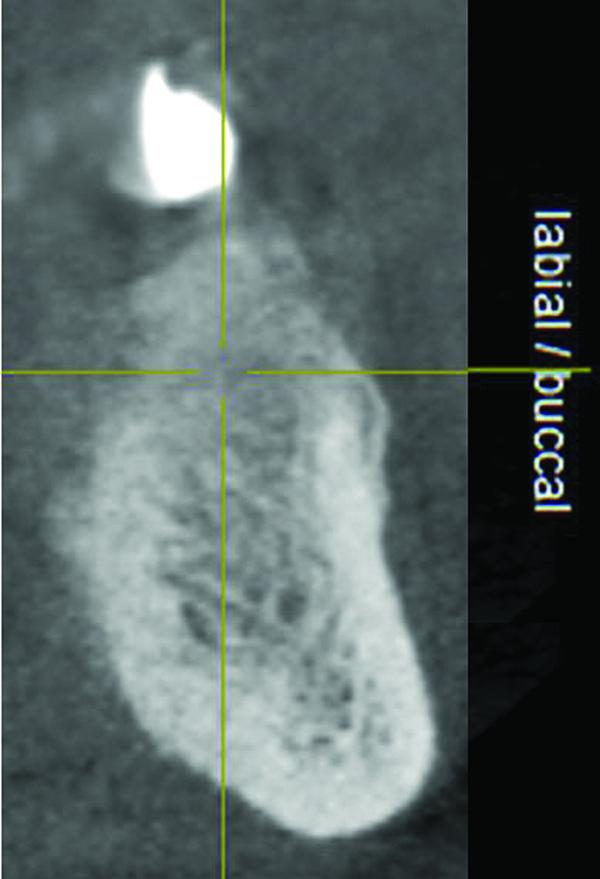
Фото 13. Вид здоровых десен в области зафиксированных провизорных протезов через 6 месяцев после подсадки костного заменителя.
Обсуждение
Выбор необходимого костного заменителя зависит от конкретной клинической ситуации. Гранулированная форма доступных костных трансплантатов усложняет процесс их размещения в области больших дефектов с одной-двумя сохраненными стенками. Трансплантат из этих материалов, как правило, смещается и не сохраняет формы, поэтому создание индивидуальных высоты или ширины гребня является крайне сложной задачей.
В последние годы компании представили на рынке костные заменители в форме пасты, что делает процесс их установки и позиционирования гораздо проще, а также позволяет врачу воссоздать необходимую форму и максимально заполнить дефект.
Деминерализованная кость человека (аллографт) была золотым стандартом аугментации в прошлом. Ксенотрансплантаты из крупного рогатого скота также весьма известны, однако исследования доказали наличие остаточных частиц материала даже после года лечения, что наводит на мысль, что они так никогда и не смогут полностью преобразоваться в форму родной кости. Ранние версии синтетических материалов также известны своей неполной резорбируемостью с течением времени. Но изменения в химическом составе позволили разработать новую форму биостекла, которая полностью рассасывается в течение от 6 до 9 месяцев, и замещается костью реципиента.
Трансплантационный материал играет роль строительного каркаса, который позволяет организму медленно заместить пространство родной костью (остеокондукция), или же стимулирует образование новой костной ткани (остеоиндукция).
NovaBone как представитель группы биоинертного стекла является остеостимулятором и может индуцировать образование костной ткани, а также влияет на скорость замещения дефекта.
Вывод
Замещение дефектов и лунок удаленных зубов костным заменителем может быть трудной для выполнения клинической задачей. Небольшие дефекты, как правило, не нуждаются в подсадке костного заменителя, так как сгустка, который формируется в зоне дефекта после выскабливания, может быть достаточно для образования новой кости. Тем не менее, при наличии крупных дефектов нельзя обойтись без дополнительного заполнения. Без замещения костным трансплантатом они могут прогрессировать с течением времени, что затрудняет процесс лечения. Кроме того, лунки удаленных зубов особенно нуждаются в подсадке трансплантата в случаях, когда планируется последующая имплантация непосредственно в зоне удаления или в смежных с ней областях.
NovaBone в результате 20-летних исследований биостекла, разработали полностью рассасывающийся трансплантационный материал, который обладает остеоиндуктивными и остеостимулирующими свойствами. Материал доступен в форме пасты, форме достаточно простой для проведения манипуляций. Данные свойства позволяют обеспечить трехмерное восстановление утраченной костной ткани гребня обратно к размерам и контурам, характерным для нормальной анатомии челюсти.
Авторы:
Gregori M. Kurtzman, DDS, MAGD, DICOI
Douglas F. Dompkowski, DDS
Lanka Mahesh, BDS
Производители:
Костные дефекты, возникшие в результате пародонтита или удаления зубов, могут значительно усложнить процедуру последующей имплантации и реконструктивных манипуляций. Увеличение объема кости направлено на возобновление анатомии альвеолярного гребня, что, в свою очередь, значительно улучшает условия для проведения имплантации или протезирования как съемными, так и несъемными конструкциями.

Выбор подходящего материала для реконструкции дефектов огромен: от собственных аллотрансплантантов и аналогов животного происхождения до синтетических костных заменителей. Использование собственной кости целесообразно только в случае небольших дефектов, хотя бы из соображений сохранения объема тканей в области забора материала. При обширных дефектах рекомендуется использовать кость крупного рогатого скота или ксенографты. Структура таких материалов представлена в виде частиц, которые необходимо регидратировать стерильным физиологическим раствором или кровью пациента. Только после процедуры регидратации костный заменитель помещают в участок дефекта.
Недостатком этих материалов является то, что они не поддерживают приданную им форму, особенно в случаях дефектов с сохраненной только одной стенкой.
В последние годы на рынке были представлены пастообразные формы материалов, которые значительно облегчают процесс работы и необходимой установки. Авторы обнаружили, что эти костные заменители застывают при температуре тела, что позволяет им сохранять требуемую форму.
В данной статье авторы будут обсуждать клинический случай с использованием биоматериала NovaBone (NovaBone Products), состоящего из частиц биостекла для восстановления обширного дефекта с потерей щечной и язычной стенок и дефицитом вертикальной составной альвеолярного гребня.
Трансплантационный материал NovaBone
NovaBone представляет собой кальций фосфоросиликатный материал с доказанной способностью активизировать генетические механизмы ускоренного природного прироста кости. Выделение ионов кремния (Si), кальция (Ca) и фосфора (P) из состава NovaBone влияет на стимуляцию генов, которые играют ключевую роль в процессе регенерации костной ткани. Данный процесс детерминируется как остеокондуктивный.
Контролируемое высвобождение ионов в течение длительного времени повышает уровень клеточной сигнализации и остеостимуляции, вызывая каталитическую реакцию, которая ускоряет естественный процесс заживления. Данный механизм в конечном результате является основой регенерации.
Суть прироста кости при использовании NovaBone состоит в следующем. Ионы Ca и P вместе с растворимым кремнеземом образуют силикагель и гидроксикарбонатный апатитовый слой. Это создает идеальные условия для присоединения клеток и поглощения белкового фактора роста. Именно абсорбция данных органических молекул в месте дефекта стимулирует клетки, которые являются предшественниками остеогенеза.
Эти клетки образуют первичную выстилку и обеспечивают процесс пролиферации на поверхности трансплантата. Непрерывное высвобождение ионов Са и Si модулирует процесс дифференциации. Это в свою очередь приводит к созреванию популяции остеобластов и клеток-предшественников с потенциалом для костного формирования.
Такой механизм ускоряет процесс заживления дефекта и формирования костной ткани на поверхности частиц NovaBone с интенсивностью, свойственной аутотрансплантатам. Исследования доказали, что процесс резорбции материала прогрессирует параллельно с процессом ремоделирования костной ткани. Кумулятивный эффект NovaBone обусловлен увеличением числа клеток, способных к делению, формированию новой кости и заживлению ткани. Частицы NovaBone полностью резорбируются в течение 6 месяцев и замещаются родной костью. Гистологические исследования не выявили наличия каких-либо остатков материала в период от 9 месяцев до 1 года. Продукты NovaBone были исследованы на протяжении более чем 20 лет. Трансплантационный материал доступен в форме пасты и порошка, которые могут быть использованы по отдельности или в сочетании друг с другом.
Инкорпорация частиц в структуре пасты позволяет врачу добиться трехмерного моделирования нужной формы с возможностью восстановления формы мягких тканей при необходимости.
Клинический случай
64-летний мужчина обратился за стоматологической помощью с целью протезирования нижней челюсти. На периапикальных рентгенограммах было изучено состояние структур нижней челюсти (фото 1). У пациента наблюдалась следующая клиническая ситуация: присутствуют 20,21,22, 26, 27, 28 зубы, а также несъемный металлокерамический протез с опорой на 22, 26 и 27 зубах.
Фото 1. На периапикальных рентгенограммах визуализируется потеря кости вследствие заболеваний пародонта с образованием костных дефектов во фронтальной области.

План лечения
Отмечена плохая маргинальная адаптация опор мостовидного протеза. В оставшихся зубах нижней челюсти наблюдается умеренный или высокий уровень подвижности. 20 и 21 зубы – стабильны. На рентгенограмме зафиксирована убыль костной массы на 60% около 22 зуба с образованием углового дефекта по направлению к средней линии, 90% около 26 зуба, и 60% около 27 с образованием медиального дефекта, а также 60% около 28 зуба.
Пациент был проинформирован о неприемлемом состоянии зубов нижней челюсти и о возможном алгоритме лечения. Как варианты были предложены частичное съемное протезирование либо несъемное протезирование с опорой на дентальные имплантаты.
Пациент согласился со вторым вариантом лечения.
Конусно-лучевая компьютерная томография (CBCT) (Galileos, Sirona) проводилась с целью объективной оценки кости в 3D расширении, а также для планирования будущей имплантации или возможных дополнительных процедур (фото 2).
Фото 2. Панорамный снимок сформирован по результатам конусно-лучевой компьютерной томографии для планирования этапа имплантации.

Результаты КЛКТ сканирования подтвердили наличие большого костного дефекта, визуализированного на периапикальных рентгенограммах (фото 3). Дальнейший анализ сагиттального среза определил потерю щечной и язычной стенок, а также снижение высоты альвеолярного гребня почти до уровня апекса соседнего 22 зуба (фото 4). На аксиальном срезе степень дефекта подтвердилась. Этиология дефекта скорее всего связана с заболеваниями пародонта и неполным заживлением лунки после экстракции 23 и 24 зубов (фото 5).
Фото 3. С помощью конусно-лучевой компьютерной томографии подтверждено наличие костного дефекта и нарушений стоматологического статуса.

Фото 4. Сагиттальный срез конусно-лучевой компьютерной томографии в области дефекта нижней челюсти: потеря лингвальной и буккальной стенок дефекта, снижение высоты альвеолярного гребня.

Фото 5. Аксиальный срез конусно-лучевой компьютерной томографии.

Предполагалось, что после удаления оставшихся зубов нижней челюсти, кюретажа карманов и костных дефектов, имплантаты будут размещены непосредственно в промежутке между 19 и 28 зубами на сохраненных участках кости. Костные дефекты будут заполнены трансплантационным материалом с ушыванием мягких тканей. В условиях нормального торка всех имплантатов возможна немедленная винтовая фиксация провизорного протеза непосредственно после этапа имплантации. Таким образом, имплантаты могли бы полностью интегрироваться, а подсадка костных трансплантатов помогла бы вернуть альвеолярному гребню его анатомическую форму.
Клинический протокол
Оттиски были получены из обеих челюстей для проведения анализа окклюзионных соотношений. Они были направлены в лабораторию для изготовления полного съемного протеза. В качестве ориентира для установки имплантатов с помощью 3/32"спирального сверла в провизорном протезе были сделаны направляющие отверстия в местах, определяемых результатами СВСТ-сканирования. Перед хирургическим вмешательством проведена местная инфильтрационная анестезия. Оставшиеся зубы нижней челюсти были атравматически удалены.
Разрез слизистой альвеолярного гребня был произведен в дистальном направлении от предполагаемого места установки левого имплантата в жевательной зоне и продолжен к дистальной границе предполагаемого места имплантации справа в жевательной зоне.
Полный слизисто-надкостный лоскут был отсепарирован и в области костных дефектов, а также лунок удаленных зубов была проведена процедура кюретажа с целью удаления грануляционной ткани до достижения здоровой кости.
Был установлен временный протез и с помощью 2,0 миллиметрового пилотного сверла началась подготовка костного ложа, путем проведения препарирования в кости через каждое из четырех направляющих отверстий в указанном провизорном протезе.
После данной манипуляции протез удалили, и соответствующие сверла были использованы для дальнейшего препарирования кости в месте установки имплантатов.
Для имплантации были выбраны конические ExHex имплантаты (диаметр 4,0 мм) для установки в переднем левом участке и Co-Axis имплантаты (диаметр 5,0 мм) (Keystone Dental) для передне-задней установки с правой стороны. Выбор имплантатов Co-Axis (12 °) был обусловлен определенной анатомией челюсти, которая позволяла использовать имплантаты большей длины, что впоследствии способно облегчить процесс адаптации наклона имплантов при протезировании.
Выбор конической формы имплантата обусловлен особенностями анатомии данного участка челюсти. После подготовки ложа были установлены имплантаты и формирователи десен.
Паста и порошок NovaBone были смешаны в соотношении 50/50, что обеспечило большую объемность и жесткость материала, а также возможность тампонады мягких тканей над областью дефекта. Дефект в передней области сначала был заполнен смесью трансплантата, а после покрыт резорбируемой коллагеновой мембраной. Лоскут был ушит с помощью нерассасывающейся мононити PTFE с целью закрытия раны путем первичного натяжения.
Формирователи десен были удалены, а вместо них зафиксировали титановые временные цилиндры к каждому имплантату. Полиметилметакрилат замешивали до вязкой консистенции и нагнетали в зазор между цилиндром и временным провизорным протезом. После твердения материала дополнительную порцию акрила снова вводили со стороны тканей челюсти, чтобы надежно зафиксировать временные цилиндры в составе протеза. В дальнейшем фланцы провизорного протеза были удалены акриловым бором для преобразования протеза в винтово-фиксированный несъемный мост. Твердосплавным бором спиливали ту часть временных цилиндров, которая возвышалась над окклюзионной поверхностью провизорного протеза. Протез зафиксировали к имплантатам с помощью винтов, затянутых с силой до 30 Н*см.
Кусок PTFE нити смотали в клубок и поместили в верхней части временного цилиндра, после чего ее залили текучим композитом (Flow-It, Pentron Clinical) и заполимеризировали. Окклюзия была проверена и подкорректирована по мере необходимости.
Пациент явился на контроль на третью неделю после лечения с целью проверки заживления мягких тканей и с целью удаления швов. На периапикальных рентгенограммах были обнаружены остатки трансплантационного материала в некоторых участках. Качество фиксации провизорного протеза на имплантантах было полностью удовлетворительным, промежутков между конструкциями не отмечалось (фото 6-7).
Фото 6. Периапикальный снимок через 3 недели после подсадки костного заменителя: начальная организация материала NovaBone в области дефекта.

Фото 7. Периапикальный снимок через 3 недели после подсадки костного заменителя: начальная организация материала NovaBone в области дефекта.

Через шесть месяцев после лечения была проведена оценка интеграции имплантатов и состояния костных дефектов с целью подготовки к финальному этапу восстановительного лечения. На срезах КЛКТ и реконструированной ортопантомограмме отмечено отсутствие дефекта (фото 8). Периапикальная рентгенография показала полное костной заполнение, а также тесный контакт между материалом трансплантата и прилегающей костной тканью (фото 9).
Фото 8. Периапикальный снимок через 6 месяцев после подсадки костного заменителя: полное заполнение дефекта новообразованной костью.

Фото 9. Панорамный снимок сформирован по результатам конусно-лучевой компьютерной томографии через 6 месяцев после подсадки костного заменителя: полное заполнение дефекта новообразованной костью, монолитное сращение NovaBone с родной костью реципиента.

Дополнительные срезы КЛКТ показали, что имплантаты полностью окружены костью, а регион дефекта заполнен материалом трансплантата и прилегающей зоной кости (фото 10-11). На сагиттальном срезе визуализировано замещение переднего дефекта челюсти костной тканью до уровня анатомических показателей высоты и ширины гребня (фото 12). Эти данные были сопоставлены с изображениями до лечения (фото 4). Слева от срединной линии визуализируются нормальные контуры кости, а также здоровые невоспаленные мягкие ткани, покрывающие область аугментации (фото 13).
Фото 10. Дополнительные срезы конусно-лучевой компьютерной томографии через 6 месяцев после лечения: заполнение костного дефекта и интеграция имплантатов.

Фото 11. Дополнительные срезы конусно-лучевой компьютерной томографии через 6 месяцев после лечения: заполнение костного дефекта и интеграция имплантатов

Фото 12. Сагиттальный срез конусно-лучевой компьютерной томографии через 6 месяцев после подсадки костного заменителя: восстановление буккальной и лингвальной стенок, а также высоты костного гребня.

Фото 13. Вид здоровых десен в области зафиксированных провизорных протезов через 6 месяцев после подсадки костного заменителя.

Обсуждение
Выбор необходимого костного заменителя зависит от конкретной клинической ситуации. Гранулированная форма доступных костных трансплантатов усложняет процесс их размещения в области больших дефектов с одной-двумя сохраненными стенками. Трансплантат из этих материалов, как правило, смещается и не сохраняет формы, поэтому создание индивидуальных высоты или ширины гребня является крайне сложной задачей.
В последние годы компании представили на рынке костные заменители в форме пасты, что делает процесс их установки и позиционирования гораздо проще, а также позволяет врачу воссоздать необходимую форму и максимально заполнить дефект.
Деминерализованная кость человека (аллографт) была золотым стандартом аугментации в прошлом. Ксенотрансплантаты из крупного рогатого скота также весьма известны, однако исследования доказали наличие остаточных частиц материала даже после года лечения, что наводит на мысль, что они так никогда и не смогут полностью преобразоваться в форму родной кости. Ранние версии синтетических материалов также известны своей неполной резорбируемостью с течением времени. Но изменения в химическом составе позволили разработать новую форму биостекла, которая полностью рассасывается в течение от 6 до 9 месяцев, и замещается костью реципиента.
Трансплантационный материал играет роль строительного каркаса, который позволяет организму медленно заместить пространство родной костью (остеокондукция), или же стимулирует образование новой костной ткани (остеоиндукция).
NovaBone как представитель группы биоинертного стекла является остеостимулятором и может индуцировать образование костной ткани, а также влияет на скорость замещения дефекта.
Вывод
Замещение дефектов и лунок удаленных зубов костным заменителем может быть трудной для выполнения клинической задачей. Небольшие дефекты, как правило, не нуждаются в подсадке костного заменителя, так как сгустка, который формируется в зоне дефекта после выскабливания, может быть достаточно для образования новой кости. Тем не менее, при наличии крупных дефектов нельзя обойтись без дополнительного заполнения. Без замещения костным трансплантатом они могут прогрессировать с течением времени, что затрудняет процесс лечения. Кроме того, лунки удаленных зубов особенно нуждаются в подсадке трансплантата в случаях, когда планируется последующая имплантация непосредственно в зоне удаления или в смежных с ней областях.
NovaBone в результате 20-летних исследований биостекла, разработали полностью рассасывающийся трансплантационный материал, который обладает остеоиндуктивными и остеостимулирующими свойствами. Материал доступен в форме пасты, форме достаточно простой для проведения манипуляций. Данные свойства позволяют обеспечить трехмерное восстановление утраченной костной ткани гребня обратно к размерам и контурам, характерным для нормальной анатомии челюсти.
Авторы:
Gregori M. Kurtzman, DDS, MAGD, DICOI
Douglas F. Dompkowski, DDS
Lanka Mahesh, BDS



























































































































































0 комментариев