Начальное ремоделирование костной ткани вокруг дентальных имплантатов в течение первого года функционирования представляет собой сложный полифакторный процесс, составляющие которого все чаще становятся объектами новых исследований. Согласно результатам более ранних научных работ, потеря периимплантатной костной ткани происходит как в горизонтальном, так и в вертикальном направлениях, а величина таковой в течение первого года после имплантации колеблется в диапазоне 0,7-3 мм. С целью минимизации данного эффекта резорбции исследователи упорно работают над видоизменениями формы, поверхности, позиции имплантата, а также всячески модифицируют дизайн абатмента. Исходя из полученных клинических результатов, принцип переключения платформ выглядит наиболее перспективным и многообещающим, а позитивные результаты его использования уже ранее сообщались в отчетах Hürzeler et al. и Vela-Nebot, а также Cochran и Canullo, хотя Becker, в свою очередь, утверждает, что никакой гистологической разницы в структуре кости при использовании обычных имплантатов и таковых с функцией переключения обнаружено не было. Но в любом случае даже переключение платформ не может полностью нивелировать эффект периимплантационной резорбции, следовательно, поиск новых путей решения данной проблемы продолжается. Второй метод, используемый для минимизации эффекта редукции костной ткани, связан с влиянием мягких тканей на уровень низлежащего резидуального гребня. Berglundh и коллеги сумели доказать, что слизистая вокруг имплантатов аналогичная деснам вокруг естественных зубов: биологическая ширина периимплантационных мягких тканей состоит из 2 мм толстого эпителиального слоя и 1 мм надкостной соединительной ткани.
Исходя из вышеупомянутого, современные исследования в имплантологии в огромном своем количестве посвящены именно изучению эффекта аугментации тонкого биотипа мягких тканей с одновременной установкой в области реконструкции дентальных имплантатов. Wiesner сообщил о значительном утолщении десен при проведении аугментации посредством соединительнотканного трансплантата, собранного из области неба. Аугментированные им имплантационные области были в среднем на 1,3 мм толще, чем аналогичные участки в группе контроля, и, кроме того, демонстрировали куда лучшие эстетические параметры, но потеря костной ткани в обеих исследуемых группах практически не отличалась, и составляла 0,8 мм и 0,6 мм соответственно через год после проведения имплантации. Lai и Linkevicius сообщили об успешной вертикальной аугментации мягких тканей посредством бесклеточного дермального матрикса, что помогло уменьшить первоначальную потерю костной ткани до 0,21 мм в группе исследования по сравнению с 1,17 мм в группе контроля через 1 год после установки внутрикостных опор. Наиболее актуальным подходом к минимизации эффекта резорбции костной ткани является применение обогащенного тромбоцитами фибрина (platelet-rich fibrin – PRF). Данный метод был детально описан Choukroun, который предложил использовать в качестве биоматериала фибриновую матрицу, обогащенную цитокинами, циркулирующими клетками-предшественниками, а также факторами роста. Такую смесь можно применять в форме резорбируемых мембран, которые в процессе своего функционирования на протяжении 7-28 дней константно выделяют PDGF (тромбоцитарный фактор роста) или TGF-B (трансформирующий фактор роста). Последние факторы доказательно ускоряют процесс заживления операционного поля. Применение PRF было протестировано в различных областях стоматологии, но результатов использования данного материала для вертикальной аугментации мягких тканей авторами статьи обнаружено не было, следовательно, целью данного рандомизированного контролируемого клинического исследования была оценка эффекта утолщения области периимплантной слизистой посредством PRF на возможность минимизации уровня резорбции костной ткани в периимплантационном участке.
Отбор пациентов
Для исследования отбирались пациенты старше 18 лет, которые нуждались в установке имплантата и последующей ортопедической реабилитации в дистальных участках нижней челюсти.
Критерии исключения из исследования были следующими:
- общие противопоказания к имплантации;
- недостаточная гигиена полости рта или наличие пародонтальной патологии;
- пациенты с тяжелой формой пародонтита в анамнезе;
- пациенты, требующие проведения аугментации резидуального гребня;
- курильщики;
- пациенты, злоупотребляющие алкоголем или наркотиками;
- пациенты с неконтролируемым сахарным диабетом;
- пациенты с тяжелыми сердечно-сосудистыми заболеваниями;
- ранее леченные или проходящие курс лечения посредством внутривенных минобифосфонатов;
- беременные и кормящие.
Исследование было проведено в соответствии со стандартами Хельсинской декларации 1983 года и было одобрено комитетом по этике Freiburger Ethik-Kommission International (Код: 014/1210). Все 40 пациентов были проинформированы о плане и цели исследования, после чего они подписали письменное соглашение. Рандомизация контрольной (п = 20) и испытуемой групп (п = 20) была достигнута посредством метода запечатанных конвертов.
Клиническая процедура
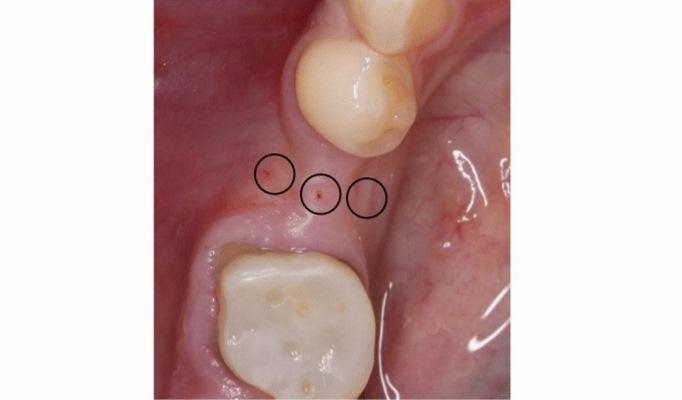
Перед оперативным вмешательством все пациентам проводилась профессиональная гигиена полости рта, а за час до вмешательства им вводили однократную дозу 600 мг клиндамицина с целью профилактики возможных постоперационных осложнений. PRF сгустки получали от каждого пациента из группы исследования и группы контроля, после чего биоматериал проходил через полную процедуру подготовки с помощью центрифуги IntraSpin и пробирок Botiss (Цоссена, Германия). После выполнения анестезии Ultracain DS-форте (Ультракаин + адреналин 1: 100000), при помощи эндодонтического микроспредера (Спредер ISO 30, Dentsply Maillefer) с силиконовым стоппером измеряли толщину мягких тканей с крестальной, язычной и щечной сторон альвеолярного гребня (фото 1). Длина той части инструмента, которая проникала в мягкие ткани, потом измерялась при помощи эндодонтической линейки. Полученные данные были округлены до ближайшей половины миллиметра (мм).
Фото 1. Измерение толщины мягких тканей при помощи эндодонтического инструмента.
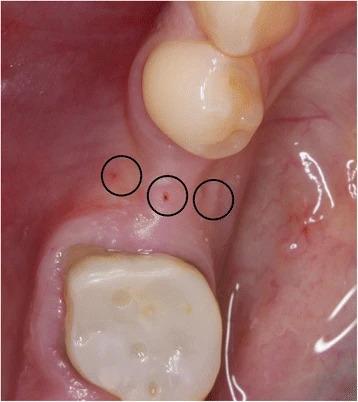
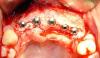
Подготовка расщепленного лоскута проводилась аналогично как в группе контролля, так и в исследуемой группе с использованием набора микрохирургических инструментов. Сначала микрохирургическим лезвием (SM69, Swann MortonLTD, Шеффилд, Англия) проводили крестальный разрез, после чего сепарацию лоскута в области адентии проводили до середины соседних зубов. Аналогично расщепляли область надкостницы для того, чтобы обеспечить адаптацию краев раны без излишнего натяжения (фото 2). Дентальные имплантаты Nobel Speedy Replace (Nobel Biocare, Цюрих, Швейцария) были установлены на уровне кости с достаточной первичной стабильностью. Диаметр конструкций варьировал от 3,5 мм до 4,0 мм, а также 5,0 мм, при длине в 10 мм, 11,5 мм и 13 мм (фото 3, 4 и 5). Для дальнейших процедур пациенты были рандомизированы ассистентом врача посредством метода запечатанных конвертов. В исследуемой группе аугментация мягких тканей проводилась с использованием PRF-мембраны двухслойной техникой, в то время как в контрольной группе имплантологическое лечение было осуществлено без дополнительного утолщения области слизистой (фото 6 и 7). Ушивание раны проводилось с использованием нерезорбируемых поливинилиденфторидных нитей (Seralene, Serag Wiessner, Наиля, Германия) (фото 8).
Фото 2. Крестальный надрез и подготовка расщепленного лоскута.
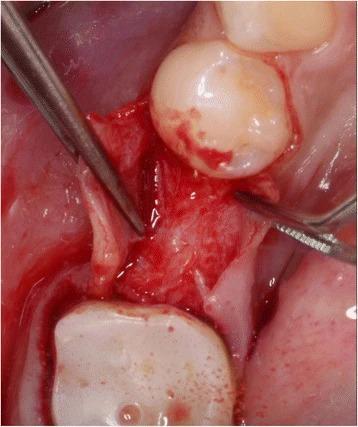
Фото 3. Установка имплантата.
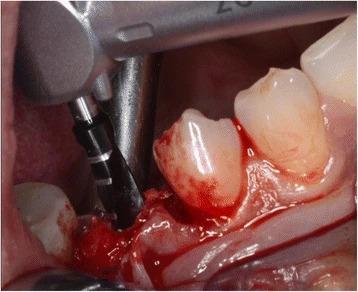
Фото 4. NobelSpeedy Replace

Фото 5. Установка имплантата при использовании техники расщепленного лоскута.
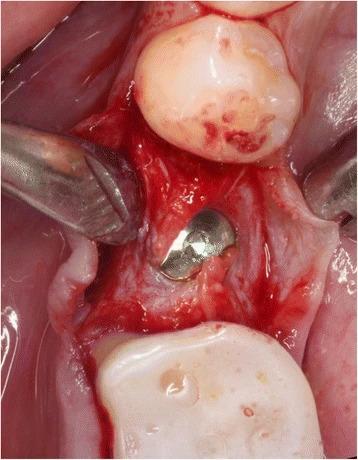
Фото 6. Приготовление PRF-мембран посредством центрифугирования и конденсации кровяного сгустка пациента.
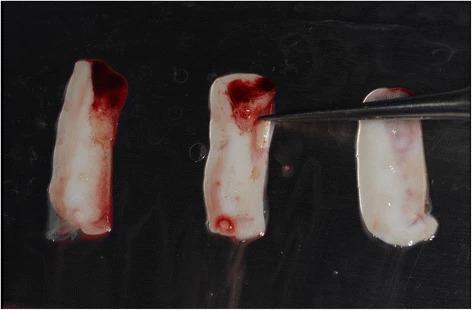
Фото 7. Установка PRF-мембраны двухслойной техникой для утолщения тканей.
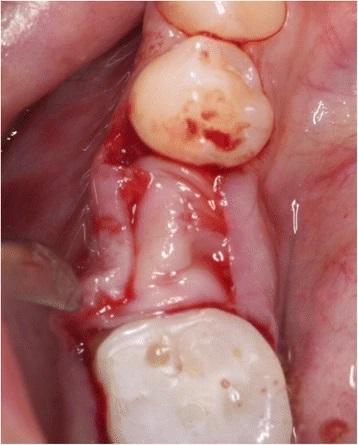
Фото 8. Ушивание области вмешательства при помощи Seralene 6.0.
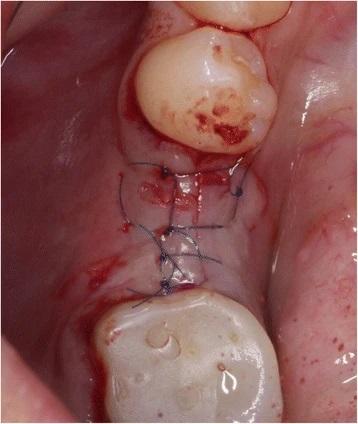
После имплантации были получены стандартизированные цифровые рентгенограммы методом параллельной съемки для регистрации исходного уровня костной ткани (фото 9). Для объективности полученных результатов под каждого пациента был изготовлен индивидуализированный держатель цифровой пленки. В послеоперационном периоде пациентам рекомендовалось избегать приема твердой пищи, а также использовать хлоргексидин в качестве ротового ополаскивателя и проводить чистку зубов мягкой зубной щеткой два раза в день в течение первых 2-х недель. Швы были удалены через 7-10 дней после имплантации.
Фото 9. Рентгенологический контроль непосредственно после процедуры имплантации (а); через 3 месяца после вмешательства (b); через 6 месяцев после вмешательства (с).
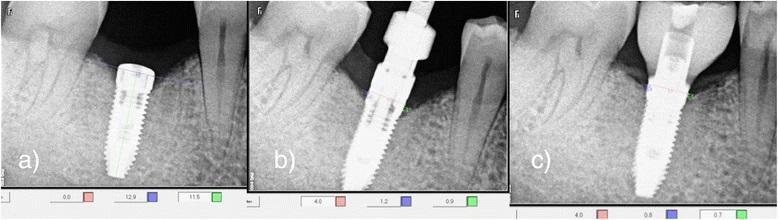
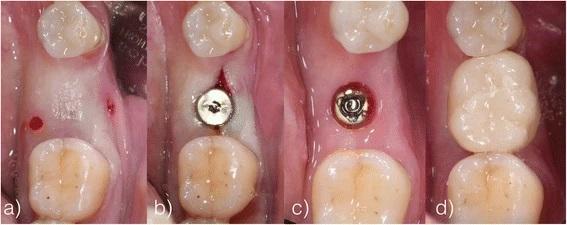
Через три месяца повторно проводили измерение толщины мягких тканей с крестальной, щечной и язычной сторон альвеолярного гребня, а также анализ уровня костной периимплантатной ткани по внутриротовых рентгенограммах. В этот же период заглушки заменили на формирователи десен, а учитывая минимальную инвазивность подхода, потребности в повторном наложении швов попросту не было. На протяжении последующих 2-х недель на дентальные имплантаты в качестве окончательных реставраций с помощью винтов были зафиксированы цельнокерамические коронки (IPS Emax, Ivoclar Vivadent, Шаан, Лихтенштейн; композит: Multilink Implant, Ivoclar Vivadent, Schaan, Liechtenstein) (фото 10). Через полгода пациентов повторно вызывали в клинику для анализа динамики изменений мягких и твердых тканей в области проведенной имплантации.
Фото 10. а-d Повторное измерение толщины тканей, фиксация формирователей, повторны доступ с установкой цельнокерамических коронок.
Рентгенологический контроль
Оценка уровня ремоделирования периимплантатной костной ткани проводилась независимым экспертом, который не принимал участия в хирургических этапах лечения. Анализ редукции костной ткани с медиальной и дистальной сторон каждого имплантата проводился с помощью адаптированого программного обеспечения Kodak dental imaging software, версия 6.13.0, 2013. Калибровка геометрических параметров изображений для минимизации эффекта графических искажений была выполнена на каждой из исследуемых рентгенограмм с учетом эталонных объективных значений длинны и ширины имплантатов.
Статистический анализ
Данные 31 пациента (10 пациентов исследуемой группы и 21 пациента контрольной группы) были проанализированы с помощью программного обеспечения STATISTICA (версия 9.1, StatSoft, Inc., Tulsa, США) и BiAS (версия 10.11, Epsilon, Франкфурт, Германия). Ни один из наборов полученных данных не был исключен в ходе статистического анализа, который состоял из:
- сравнения толщины мягких тканей с крестальной, щечной и язычной сторон альвеолярного гребня в ходе первичного осмотра и через 3 месяца после оперативного вмешательства в исследуемой и контрольной группах;
- сравнение показателя прироста или же убыли тканей между исследуемой и контрольной группами;
- сравнения уровня костной ткани с медиальной и дистальной сторон импланататов в исходной ситуации и через 3 месяца и полгода в исследуемой и контрольной группах;
- сравнения динамики изменений уровня костной ткани в исследуемой и контрольной группах.
Данные выражали в виде «среднее значение ± стандартное отклонение». Сравнения были сделаны с использованием критериев Вилкоксона, Манна-Уитни и показателя множественных сравнений по Schaich-Hamerle (р = 0,05).
Результаты
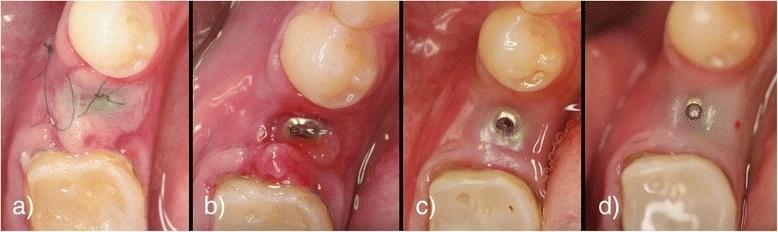
Во время оперативных вмешательств возраст пациентов колебался в диапазоне от 33 до 79 лет (средний возраст 53,8 лет). Алгоритмы имплантации и аугментации проводились в соответствии с описаниями, приведенными выше. Над верхней частью имплантата размещали по два слоя PRF-мембран, и, хотя лоскуты у всех пациентов были ушиты без натяжения, но почти у каждого из них наблюдалось небольшое зияние имплантата в первую неделю после установки конструкций. Это привело почти к полной потере мягких и аугментированных тканей непосредственно над уровнем имплантата, следовательно, открытые участки раны заживали под вторичным натяжением (фото 11). В контрольной группе, где аугментация не проводилась, заживление ран проходило первичным натяжением без каких-либо дигисценций в области оперативного вмешательства.
Фото 11. Вид области вмешательства через 3 дня после имплантации (а), вид через 1 неделю после операции (b), вид через 1 месяц после операции (с), вид через 3 месяца после операции (d).
Из-за этических соображений, количество испытуемых в группе исследования было сокращено к 10 пациентам, все остальные были переведены в группу контроля. Окончательная картина распределения пациентов по группам имела следующий вид: 10 пациентов в группе исследования, 21 пациент в группе контроля, среди которых 16 мужчин и 15 женщин. За последующие полгода никто из участников исследования не выбыл из программы мониторинга, а все установленные имплантаты успешно остеоинтегрировались, демонстрируя отличную стабильность и отсутствие каких-либо признаков бактериальной контаминации.
Оценка толщины слизистой
Толщина слизистой в группе исследования с крестальной стороны гребня уменьшилась от 2,20 мм ± 0,48 мм исходного состояния до 0,90 мм ± 1,02, зарегистрированных на повторных осмотрах, причем данная потеря тканей была статистически значимой. Толщина слизистой со щечной стороны в трехмесячной ретроспективе наоборот возросла от 1,85 мм ± 0,41 мм до 2,15 мм ± 0,78, как и толщина мягких тканей с язычной стороны – от 1,55 мм ± 0,44 до 1,80 мм ± 0,63. Но эти данные, в свою очередь, не являлись статистически значимыми. Учитывая полученные результаты в рамках проведенного исследования, можно утверждать, что использование PRF-мембран в условиях расщепленного лоскута не способствует значительному утолщению слизистой в области проведенной имплантации.
В контрольной группе толщина мягких тканей с крестальной стороны уменьшилась от 2,64 мм ± 0,48 в исходном состоянии до 2,62 мм ± 0,61 мм через три месяца, со щечной – от 2,29 мм ± 0,54 мм до 2,36 мм ± 0,48 мм, с язычной – наоборот увеличилась от 1,62 мм ± 0,55 до 1,86 мм ± 0,53 мм. Отличия всех трех параметров не были статистически значимыми.
Оценка изменений высоты маргинальной костной ткани
В группе контроля глубина мезиальной редукции костной ткани была максимальной через полгода после имплантации и достигала почти 1 мм, в то время как ширина резорбции в данном участке составляла около 1,75 мм. Аналогичная ситуация была замечена и с дистальной стороны имплантатов – глубина дистального дефекта через полгода составляла почти 2,5 мм, в то время как глубина – 2,0 мм. В исследуемой группе величина редукции костной ткани была выше лишь с мезиальной стороны, где глубина резорбции через полгода составляла почти 1,5 мм, в то время как ширина резорбции с мезиальной и дистальной сторон, как и глубина с дистальной стороны, были меньше аналогичных показателей у группы контроля и составляли – 1,2, 1,5 и 1,2 мм соответственно. Следовательно, через полгода в обеих группах была отмечена статистически значимая редукция периимплантатной костной ткани.
Рентгенологическая оценка уровня костной ткани в исследуемой группе
В исходной ситуации глубина мезиального и дистального костных дефектов составляла 0,70 мм ± 0,72 мм и 0,64 мм ± 0,66 мм соответственно. Через 6 месяцев маргинальный уровень костной ткани снизился до 1,47 мм ± 0,65 мм с медиальной стороны и 1,46 мм ± 0,54 мм с дистальной. Ширина дефектов увеличилась от 0,7 мм ± 0,72 мм до 1,22 мм ± 0,57 мм с медиальной стороны, и от 0,65 мм ± 0,64 мм до 1,27 мм ± 0,55 мм с дистальной стороны соответственно.
Рентгенологическая оценка уровня костной ткани в исследуемой группе
В контрольной группе глубина дефектов увеличилась от 0,13 мм ± 0,26 мм до 0,86 мм ± 0,52 мм с медиальной стороны, и от 0,2 мм ± 0,37 мм до 1,02 мм ± 0,62 мм с дистальной стороны соответственно, в то время как ширина таковых увеличилась с 0,09 мм ± 0,17 мм до 0,60 мм ± 0,47 мм, и с 0,24 мм ± 0,42 мм до 0,81 мм ± 0,44 мм с медиальной и дистальной сторон соответственно.
Сравнение параметров потери костной ткани в исследуемой и контрольной группах
В исследуемой группе пациентов средняя потеря костной массы составляла 0,77 мм ± 0,42 мм / 0,57 мм ± 0,44 мм (глубина дефекта / ширина дефекта) с медиальной стороны, и 0,82 мм ± 0,42 мм / 0,62 мм ± 0,36 мм (глубина дефекта / ширина дефекта) с дистальной, в то время как в контрольной группе, данный параметр отвечал 0,72 мм ± 0,61 мм / 0,51 мм ± 0,48 мм (глубина дефекта / ширина дефекта) с медиальной стороны имплантатата, и 0,82 мм ± 0,77 мм / 0,57 мм ± 0,58 мм (глубина дефекта / ширина дефекта) с дистальной стороны соответственно. Тем не менее, сравнение параметров потери костной ткани в исследуемой и контрольной группах не продемонстрировало никакой статистической разницы согласно критерию Манна-Уитни U.
Обсуждение
В ходе данного исследования было обнаружено, что процедура аугментации мягких тканей в области имплантации при помощи PRF и выполнения расщепленного лоскута в 6-месячной перспективе провоцирует редукцию объема слизистой по сравнению с контрольной группой исследования. У всех пациентов группы исследования были обнаружены постоперативные дигисценции в области аугментации сразу же после выполнения операции, которые, очевидно, связаны с утратой мягкотканого объема.
Использование PRF обеспечивает хорошие результаты лечения во многих клинических случаях, так например, Choukron и коллеги отметили позитивное влияние биоматериала на заживление костной ткани после установки титановых инфраконструкций. Согласно данным исследования, естественная структура фибрина защищает имеющиеся в ране факторы роста от процесса протеолиза, таким образом, обеспечивая более длительный период их активного функционирования (до 28 дней). Такой эффект обеспечивает более ускоренную неоваскуляризацию и значительно снижает риск инфицирования раны в послеоперационном периоде. Проведенные раннее исследования свидетельствуют об успешном использовании PRF для аугментации твердых тканей зубочелюстного аппарата в ходе проведения синус-лифта или реконструкции лунки зуба, а также с целью восстановления утраченных структур пародонта, однако, авторами данной статьи не было найдено ни одной публикации, которая свидетельствовала бы об эффективном использовании PRF для восстановления объема именно мягких тканей. Первой проблемой использования PRF является чрезмерное натяжение краев раны по причине увеличения объема в подслизистом пространстве. В данном исследовании подобного побочного эффекта удалось избежать благодаря расширению краев расщепленного лоскута, а также путем использования крайне чувствительного шовного материала для максимально свободной адаптации краев лоскута (фото 8). Также следует детально проанализировать аргументированность использования двухслойной установки PRF-мембраны и формирования расщепленного лоскута. Двухслойное введение PRF обеспечивает улучшенные условия для метаболизма в области имплантации, а также минимизирует риск чрезмерной периимплантационной потери костной ткани или дополнительной травмы периоста. Тем не менее, этот метод является весьма процедурно чувствительным и требует большого опыта для адекватного выполнения. Следует учитывать, что при разделении тонкой слизистой на два отдельных слоя, их толщина должна колебаться в диапазоне не менее 0,8-1,2 мм, поскольку меньшая толщина тканей значительно снижает возможности для адекватного кровоснабжения области ятрогенного вмешательства. Неполное выполнение данной рекомендации может быть причиной того, что у всех 10 пациентов исследуемой группы были обнаружены дигисценции непосредственно над областью имплантата, что значительно ухудшило условия для локального метаболизма в операционных участках и спровоцировало редукцию объема мягких тканей. Что же касается уровня потери маргинальной костной ткани, то между исследуемой и контрольной группами не было замечено никаких значительных статистических отличий, хотя некоторые исследователи утверждают о таковой при использовании других трансплантационных материалов. Hehn и Wiesner смогли добиться значительного утолщения мягких тканей благодаря использованию соединительнотканного трансплантата, полученного из области неба, в свою очередь, Hehn даже доказал позитивный эффект такой аугментации на минимизацию эффекта ремоделирования костной ткани в области имплантации через 12 месяцев после вмешательства. Для достижения аналогичного результата другие исследователи успешно использовали разного рода мембраны. Например, используя бесклеточный дермальный матрикс Lai добился утолщения слизистой до 3,10 +/- 0,64 мм через 12 недель после вмешательства по сравнению с группой контроля, в которой утолщение тканей не превышало 0,30 +/- 0,50 мм. Puisys, получив аналогичные результаты, пришел к выводу, что первоначальное увеличение мягких тканей аллогенной коллагеновой матрицей обеспечивает долгосрочную стабильность результатов аугментации и значительную минимизацию редукции костной ткани. Кроме того, было замечено, что резорбция кости около имплантатов, установленных в области тонкого биотипа тканей, значительно превышает такую в области титановых инфраконструкций, установленных на участках с толстым биотипом слизистой. Потеря костной массы через 1 год после операции вокруг имплантатов с тонкой слизистой оболочкой составляла 1,22 +/- 0,08 мм с медиальной стороны, и 1,14 +/- 0,07 мм с дистальной, в то время как в области толстого биотипа аналогичная потеря составляла 0,24 +/- 0,06 мм и 0,19 +/- 0,06 мм с мезиальной и дистальной сторон соответственно. Попытки увеличить объем тонкого биотипа десен посредством аллогенной мембраны привело к минимизации уровня редукции костной ткани в периимплантатной области до 0,22 +/- 0,06 мм с медиальной стороны, и 0,20 +/- 0,06 мм с дистальной через 1 год после вмешательства. Одним из ограничений данного исследования является также стандартизированная техника рентгенографической оценки периимплантатной костной ткани, которая обеспечивает возможности для анализа кости лишь с медиальной и дистальной сторон имплантата, и не позволяет объективно судить о циркулярной природе резорбции. Тем не менее, данное ограничение было отмечено и в ряде других аналогичных исследований. Кроме того, учитывая небольшую численность выборки группы исследования, результаты данного эксперимента не могут отождествляться с возможным прогнозом использования PRF для более обширного контингента пациентов.
Выводы
Учитывая полученные результаты лечения, аугментация мягких тканей с использованием PRF и техники расщепленного лоскута, не может быть рекомендована для использования в области тонкого биотипа десен, но для более аргументированных выводов требуется проведение дополнительных экспериментальных и клинических исследований, учитывающих и обходящих недостатки предложенной экспериментальной модели.
Авторы: Julia Hehn, Thomas Schwenk, Markus Striegel, Markus Schlee
Начальное ремоделирование костной ткани вокруг дентальных имплантатов в течение первого года функционирования представляет собой сложный полифакторный процесс, составляющие которого все чаще становятся объектами новых исследований. Согласно результатам более ранних научных работ, потеря периимплантатной костной ткани происходит как в горизонтальном, так и в вертикальном направлениях, а величина таковой в течение первого года после имплантации колеблется в диапазоне 0,7-3 мм. С целью минимизации данного эффекта резорбции исследователи упорно работают над видоизменениями формы, поверхности, позиции имплантата, а также всячески модифицируют дизайн абатмента. Исходя из полученных клинических результатов, принцип переключения платформ выглядит наиболее перспективным и многообещающим, а позитивные результаты его использования уже ранее сообщались в отчетах Hürzeler et al. и Vela-Nebot, а также Cochran и Canullo, хотя Becker, в свою очередь, утверждает, что никакой гистологической разницы в структуре кости при использовании обычных имплантатов и таковых с функцией переключения обнаружено не было. Но в любом случае даже переключение платформ не может полностью нивелировать эффект периимплантационной резорбции, следовательно, поиск новых путей решения данной проблемы продолжается. Второй метод, используемый для минимизации эффекта редукции костной ткани, связан с влиянием мягких тканей на уровень низлежащего резидуального гребня. Berglundh и коллеги сумели доказать, что слизистая вокруг имплантатов аналогичная деснам вокруг естественных зубов: биологическая ширина периимплантационных мягких тканей состоит из 2 мм толстого эпителиального слоя и 1 мм надкостной соединительной ткани.

Исходя из вышеупомянутого, современные исследования в имплантологии в огромном своем количестве посвящены именно изучению эффекта аугментации тонкого биотипа мягких тканей с одновременной установкой в области реконструкции дентальных имплантатов. Wiesner сообщил о значительном утолщении десен при проведении аугментации посредством соединительнотканного трансплантата, собранного из области неба. Аугментированные им имплантационные области были в среднем на 1,3 мм толще, чем аналогичные участки в группе контроля, и, кроме того, демонстрировали куда лучшие эстетические параметры, но потеря костной ткани в обеих исследуемых группах практически не отличалась, и составляла 0,8 мм и 0,6 мм соответственно через год после проведения имплантации. Lai и Linkevicius сообщили об успешной вертикальной аугментации мягких тканей посредством бесклеточного дермального матрикса, что помогло уменьшить первоначальную потерю костной ткани до 0,21 мм в группе исследования по сравнению с 1,17 мм в группе контроля через 1 год после установки внутрикостных опор. Наиболее актуальным подходом к минимизации эффекта резорбции костной ткани является применение обогащенного тромбоцитами фибрина (platelet-rich fibrin – PRF). Данный метод был детально описан Choukroun, который предложил использовать в качестве биоматериала фибриновую матрицу, обогащенную цитокинами, циркулирующими клетками-предшественниками, а также факторами роста. Такую смесь можно применять в форме резорбируемых мембран, которые в процессе своего функционирования на протяжении 7-28 дней константно выделяют PDGF (тромбоцитарный фактор роста) или TGF-B (трансформирующий фактор роста). Последние факторы доказательно ускоряют процесс заживления операционного поля. Применение PRF было протестировано в различных областях стоматологии, но результатов использования данного материала для вертикальной аугментации мягких тканей авторами статьи обнаружено не было, следовательно, целью данного рандомизированного контролируемого клинического исследования была оценка эффекта утолщения области периимплантной слизистой посредством PRF на возможность минимизации уровня резорбции костной ткани в периимплантационном участке.
Отбор пациентов
Для исследования отбирались пациенты старше 18 лет, которые нуждались в установке имплантата и последующей ортопедической реабилитации в дистальных участках нижней челюсти.
Критерии исключения из исследования были следующими:
- общие противопоказания к имплантации;
- недостаточная гигиена полости рта или наличие пародонтальной патологии;
- пациенты с тяжелой формой пародонтита в анамнезе;
- пациенты, требующие проведения аугментации резидуального гребня;
- курильщики;
- пациенты, злоупотребляющие алкоголем или наркотиками;
- пациенты с неконтролируемым сахарным диабетом;
- пациенты с тяжелыми сердечно-сосудистыми заболеваниями;
- ранее леченные или проходящие курс лечения посредством внутривенных минобифосфонатов;
- беременные и кормящие.
Исследование было проведено в соответствии со стандартами Хельсинской декларации 1983 года и было одобрено комитетом по этике Freiburger Ethik-Kommission International (Код: 014/1210). Все 40 пациентов были проинформированы о плане и цели исследования, после чего они подписали письменное соглашение. Рандомизация контрольной (п = 20) и испытуемой групп (п = 20) была достигнута посредством метода запечатанных конвертов.
Клиническая процедура
Перед оперативным вмешательством все пациентам проводилась профессиональная гигиена полости рта, а за час до вмешательства им вводили однократную дозу 600 мг клиндамицина с целью профилактики возможных постоперационных осложнений. PRF сгустки получали от каждого пациента из группы исследования и группы контроля, после чего биоматериал проходил через полную процедуру подготовки с помощью центрифуги IntraSpin и пробирок Botiss (Цоссена, Германия). После выполнения анестезии Ultracain DS-форте (Ультракаин + адреналин 1: 100000), при помощи эндодонтического микроспредера (Спредер ISO 30, Dentsply Maillefer) с силиконовым стоппером измеряли толщину мягких тканей с крестальной, язычной и щечной сторон альвеолярного гребня (фото 1). Длина той части инструмента, которая проникала в мягкие ткани, потом измерялась при помощи эндодонтической линейки. Полученные данные были округлены до ближайшей половины миллиметра (мм).
Фото 1. Измерение толщины мягких тканей при помощи эндодонтического инструмента.

Подготовка расщепленного лоскута проводилась аналогично как в группе контролля, так и в исследуемой группе с использованием набора микрохирургических инструментов. Сначала микрохирургическим лезвием (SM69, Swann MortonLTD, Шеффилд, Англия) проводили крестальный разрез, после чего сепарацию лоскута в области адентии проводили до середины соседних зубов. Аналогично расщепляли область надкостницы для того, чтобы обеспечить адаптацию краев раны без излишнего натяжения (фото 2). Дентальные имплантаты Nobel Speedy Replace (Nobel Biocare, Цюрих, Швейцария) были установлены на уровне кости с достаточной первичной стабильностью. Диаметр конструкций варьировал от 3,5 мм до 4,0 мм, а также 5,0 мм, при длине в 10 мм, 11,5 мм и 13 мм (фото 3, 4 и 5). Для дальнейших процедур пациенты были рандомизированы ассистентом врача посредством метода запечатанных конвертов. В исследуемой группе аугментация мягких тканей проводилась с использованием PRF-мембраны двухслойной техникой, в то время как в контрольной группе имплантологическое лечение было осуществлено без дополнительного утолщения области слизистой (фото 6 и 7). Ушивание раны проводилось с использованием нерезорбируемых поливинилиденфторидных нитей (Seralene, Serag Wiessner, Наиля, Германия) (фото 8).
Фото 2. Крестальный надрез и подготовка расщепленного лоскута.

Фото 3. Установка имплантата.

Фото 4. NobelSpeedy Replace

Фото 5. Установка имплантата при использовании техники расщепленного лоскута.

Фото 6. Приготовление PRF-мембран посредством центрифугирования и конденсации кровяного сгустка пациента.

Фото 7. Установка PRF-мембраны двухслойной техникой для утолщения тканей.

Фото 8. Ушивание области вмешательства при помощи Seralene 6.0.

После имплантации были получены стандартизированные цифровые рентгенограммы методом параллельной съемки для регистрации исходного уровня костной ткани (фото 9). Для объективности полученных результатов под каждого пациента был изготовлен индивидуализированный держатель цифровой пленки. В послеоперационном периоде пациентам рекомендовалось избегать приема твердой пищи, а также использовать хлоргексидин в качестве ротового ополаскивателя и проводить чистку зубов мягкой зубной щеткой два раза в день в течение первых 2-х недель. Швы были удалены через 7-10 дней после имплантации.
Фото 9. Рентгенологический контроль непосредственно после процедуры имплантации (а); через 3 месяца после вмешательства (b); через 6 месяцев после вмешательства (с).

Через три месяца повторно проводили измерение толщины мягких тканей с крестальной, щечной и язычной сторон альвеолярного гребня, а также анализ уровня костной периимплантатной ткани по внутриротовых рентгенограммах. В этот же период заглушки заменили на формирователи десен, а учитывая минимальную инвазивность подхода, потребности в повторном наложении швов попросту не было. На протяжении последующих 2-х недель на дентальные имплантаты в качестве окончательных реставраций с помощью винтов были зафиксированы цельнокерамические коронки (IPS Emax, Ivoclar Vivadent, Шаан, Лихтенштейн; композит: Multilink Implant, Ivoclar Vivadent, Schaan, Liechtenstein) (фото 10). Через полгода пациентов повторно вызывали в клинику для анализа динамики изменений мягких и твердых тканей в области проведенной имплантации.
Фото 10. а-d Повторное измерение толщины тканей, фиксация формирователей, повторны доступ с установкой цельнокерамических коронок.

Рентгенологический контроль
Оценка уровня ремоделирования периимплантатной костной ткани проводилась независимым экспертом, который не принимал участия в хирургических этапах лечения. Анализ редукции костной ткани с медиальной и дистальной сторон каждого имплантата проводился с помощью адаптированого программного обеспечения Kodak dental imaging software, версия 6.13.0, 2013. Калибровка геометрических параметров изображений для минимизации эффекта графических искажений была выполнена на каждой из исследуемых рентгенограмм с учетом эталонных объективных значений длинны и ширины имплантатов.
Статистический анализ
Данные 31 пациента (10 пациентов исследуемой группы и 21 пациента контрольной группы) были проанализированы с помощью программного обеспечения STATISTICA (версия 9.1, StatSoft, Inc., Tulsa, США) и BiAS (версия 10.11, Epsilon, Франкфурт, Германия). Ни один из наборов полученных данных не был исключен в ходе статистического анализа, который состоял из:
- сравнения толщины мягких тканей с крестальной, щечной и язычной сторон альвеолярного гребня в ходе первичного осмотра и через 3 месяца после оперативного вмешательства в исследуемой и контрольной группах;
- сравнение показателя прироста или же убыли тканей между исследуемой и контрольной группами;
- сравнения уровня костной ткани с медиальной и дистальной сторон импланататов в исходной ситуации и через 3 месяца и полгода в исследуемой и контрольной группах;
- сравнения динамики изменений уровня костной ткани в исследуемой и контрольной группах.
Данные выражали в виде «среднее значение ± стандартное отклонение». Сравнения были сделаны с использованием критериев Вилкоксона, Манна-Уитни и показателя множественных сравнений по Schaich-Hamerle (р = 0,05).
Результаты
Во время оперативных вмешательств возраст пациентов колебался в диапазоне от 33 до 79 лет (средний возраст 53,8 лет). Алгоритмы имплантации и аугментации проводились в соответствии с описаниями, приведенными выше. Над верхней частью имплантата размещали по два слоя PRF-мембран, и, хотя лоскуты у всех пациентов были ушиты без натяжения, но почти у каждого из них наблюдалось небольшое зияние имплантата в первую неделю после установки конструкций. Это привело почти к полной потере мягких и аугментированных тканей непосредственно над уровнем имплантата, следовательно, открытые участки раны заживали под вторичным натяжением (фото 11). В контрольной группе, где аугментация не проводилась, заживление ран проходило первичным натяжением без каких-либо дигисценций в области оперативного вмешательства.
Фото 11. Вид области вмешательства через 3 дня после имплантации (а), вид через 1 неделю после операции (b), вид через 1 месяц после операции (с), вид через 3 месяца после операции (d).

Из-за этических соображений, количество испытуемых в группе исследования было сокращено к 10 пациентам, все остальные были переведены в группу контроля. Окончательная картина распределения пациентов по группам имела следующий вид: 10 пациентов в группе исследования, 21 пациент в группе контроля, среди которых 16 мужчин и 15 женщин. За последующие полгода никто из участников исследования не выбыл из программы мониторинга, а все установленные имплантаты успешно остеоинтегрировались, демонстрируя отличную стабильность и отсутствие каких-либо признаков бактериальной контаминации.
Оценка толщины слизистой
Толщина слизистой в группе исследования с крестальной стороны гребня уменьшилась от 2,20 мм ± 0,48 мм исходного состояния до 0,90 мм ± 1,02, зарегистрированных на повторных осмотрах, причем данная потеря тканей была статистически значимой. Толщина слизистой со щечной стороны в трехмесячной ретроспективе наоборот возросла от 1,85 мм ± 0,41 мм до 2,15 мм ± 0,78, как и толщина мягких тканей с язычной стороны – от 1,55 мм ± 0,44 до 1,80 мм ± 0,63. Но эти данные, в свою очередь, не являлись статистически значимыми. Учитывая полученные результаты в рамках проведенного исследования, можно утверждать, что использование PRF-мембран в условиях расщепленного лоскута не способствует значительному утолщению слизистой в области проведенной имплантации.
В контрольной группе толщина мягких тканей с крестальной стороны уменьшилась от 2,64 мм ± 0,48 в исходном состоянии до 2,62 мм ± 0,61 мм через три месяца, со щечной – от 2,29 мм ± 0,54 мм до 2,36 мм ± 0,48 мм, с язычной – наоборот увеличилась от 1,62 мм ± 0,55 до 1,86 мм ± 0,53 мм. Отличия всех трех параметров не были статистически значимыми.
Оценка изменений высоты маргинальной костной ткани
В группе контроля глубина мезиальной редукции костной ткани была максимальной через полгода после имплантации и достигала почти 1 мм, в то время как ширина резорбции в данном участке составляла около 1,75 мм. Аналогичная ситуация была замечена и с дистальной стороны имплантатов – глубина дистального дефекта через полгода составляла почти 2,5 мм, в то время как глубина – 2,0 мм. В исследуемой группе величина редукции костной ткани была выше лишь с мезиальной стороны, где глубина резорбции через полгода составляла почти 1,5 мм, в то время как ширина резорбции с мезиальной и дистальной сторон, как и глубина с дистальной стороны, были меньше аналогичных показателей у группы контроля и составляли – 1,2, 1,5 и 1,2 мм соответственно. Следовательно, через полгода в обеих группах была отмечена статистически значимая редукция периимплантатной костной ткани.
Рентгенологическая оценка уровня костной ткани в исследуемой группе
В исходной ситуации глубина мезиального и дистального костных дефектов составляла 0,70 мм ± 0,72 мм и 0,64 мм ± 0,66 мм соответственно. Через 6 месяцев маргинальный уровень костной ткани снизился до 1,47 мм ± 0,65 мм с медиальной стороны и 1,46 мм ± 0,54 мм с дистальной. Ширина дефектов увеличилась от 0,7 мм ± 0,72 мм до 1,22 мм ± 0,57 мм с медиальной стороны, и от 0,65 мм ± 0,64 мм до 1,27 мм ± 0,55 мм с дистальной стороны соответственно.
Рентгенологическая оценка уровня костной ткани в исследуемой группе
В контрольной группе глубина дефектов увеличилась от 0,13 мм ± 0,26 мм до 0,86 мм ± 0,52 мм с медиальной стороны, и от 0,2 мм ± 0,37 мм до 1,02 мм ± 0,62 мм с дистальной стороны соответственно, в то время как ширина таковых увеличилась с 0,09 мм ± 0,17 мм до 0,60 мм ± 0,47 мм, и с 0,24 мм ± 0,42 мм до 0,81 мм ± 0,44 мм с медиальной и дистальной сторон соответственно.
Сравнение параметров потери костной ткани в исследуемой и контрольной группах
В исследуемой группе пациентов средняя потеря костной массы составляла 0,77 мм ± 0,42 мм / 0,57 мм ± 0,44 мм (глубина дефекта / ширина дефекта) с медиальной стороны, и 0,82 мм ± 0,42 мм / 0,62 мм ± 0,36 мм (глубина дефекта / ширина дефекта) с дистальной, в то время как в контрольной группе, данный параметр отвечал 0,72 мм ± 0,61 мм / 0,51 мм ± 0,48 мм (глубина дефекта / ширина дефекта) с медиальной стороны имплантатата, и 0,82 мм ± 0,77 мм / 0,57 мм ± 0,58 мм (глубина дефекта / ширина дефекта) с дистальной стороны соответственно. Тем не менее, сравнение параметров потери костной ткани в исследуемой и контрольной группах не продемонстрировало никакой статистической разницы согласно критерию Манна-Уитни U.
Обсуждение
В ходе данного исследования было обнаружено, что процедура аугментации мягких тканей в области имплантации при помощи PRF и выполнения расщепленного лоскута в 6-месячной перспективе провоцирует редукцию объема слизистой по сравнению с контрольной группой исследования. У всех пациентов группы исследования были обнаружены постоперативные дигисценции в области аугментации сразу же после выполнения операции, которые, очевидно, связаны с утратой мягкотканого объема.
Использование PRF обеспечивает хорошие результаты лечения во многих клинических случаях, так например, Choukron и коллеги отметили позитивное влияние биоматериала на заживление костной ткани после установки титановых инфраконструкций. Согласно данным исследования, естественная структура фибрина защищает имеющиеся в ране факторы роста от процесса протеолиза, таким образом, обеспечивая более длительный период их активного функционирования (до 28 дней). Такой эффект обеспечивает более ускоренную неоваскуляризацию и значительно снижает риск инфицирования раны в послеоперационном периоде. Проведенные раннее исследования свидетельствуют об успешном использовании PRF для аугментации твердых тканей зубочелюстного аппарата в ходе проведения синус-лифта или реконструкции лунки зуба, а также с целью восстановления утраченных структур пародонта, однако, авторами данной статьи не было найдено ни одной публикации, которая свидетельствовала бы об эффективном использовании PRF для восстановления объема именно мягких тканей. Первой проблемой использования PRF является чрезмерное натяжение краев раны по причине увеличения объема в подслизистом пространстве. В данном исследовании подобного побочного эффекта удалось избежать благодаря расширению краев расщепленного лоскута, а также путем использования крайне чувствительного шовного материала для максимально свободной адаптации краев лоскута (фото 8). Также следует детально проанализировать аргументированность использования двухслойной установки PRF-мембраны и формирования расщепленного лоскута. Двухслойное введение PRF обеспечивает улучшенные условия для метаболизма в области имплантации, а также минимизирует риск чрезмерной периимплантационной потери костной ткани или дополнительной травмы периоста. Тем не менее, этот метод является весьма процедурно чувствительным и требует большого опыта для адекватного выполнения. Следует учитывать, что при разделении тонкой слизистой на два отдельных слоя, их толщина должна колебаться в диапазоне не менее 0,8-1,2 мм, поскольку меньшая толщина тканей значительно снижает возможности для адекватного кровоснабжения области ятрогенного вмешательства. Неполное выполнение данной рекомендации может быть причиной того, что у всех 10 пациентов исследуемой группы были обнаружены дигисценции непосредственно над областью имплантата, что значительно ухудшило условия для локального метаболизма в операционных участках и спровоцировало редукцию объема мягких тканей. Что же касается уровня потери маргинальной костной ткани, то между исследуемой и контрольной группами не было замечено никаких значительных статистических отличий, хотя некоторые исследователи утверждают о таковой при использовании других трансплантационных материалов. Hehn и Wiesner смогли добиться значительного утолщения мягких тканей благодаря использованию соединительнотканного трансплантата, полученного из области неба, в свою очередь, Hehn даже доказал позитивный эффект такой аугментации на минимизацию эффекта ремоделирования костной ткани в области имплантации через 12 месяцев после вмешательства. Для достижения аналогичного результата другие исследователи успешно использовали разного рода мембраны. Например, используя бесклеточный дермальный матрикс Lai добился утолщения слизистой до 3,10 +/- 0,64 мм через 12 недель после вмешательства по сравнению с группой контроля, в которой утолщение тканей не превышало 0,30 +/- 0,50 мм. Puisys, получив аналогичные результаты, пришел к выводу, что первоначальное увеличение мягких тканей аллогенной коллагеновой матрицей обеспечивает долгосрочную стабильность результатов аугментации и значительную минимизацию редукции костной ткани. Кроме того, было замечено, что резорбция кости около имплантатов, установленных в области тонкого биотипа тканей, значительно превышает такую в области титановых инфраконструкций, установленных на участках с толстым биотипом слизистой. Потеря костной массы через 1 год после операции вокруг имплантатов с тонкой слизистой оболочкой составляла 1,22 +/- 0,08 мм с медиальной стороны, и 1,14 +/- 0,07 мм с дистальной, в то время как в области толстого биотипа аналогичная потеря составляла 0,24 +/- 0,06 мм и 0,19 +/- 0,06 мм с мезиальной и дистальной сторон соответственно. Попытки увеличить объем тонкого биотипа десен посредством аллогенной мембраны привело к минимизации уровня редукции костной ткани в периимплантатной области до 0,22 +/- 0,06 мм с медиальной стороны, и 0,20 +/- 0,06 мм с дистальной через 1 год после вмешательства. Одним из ограничений данного исследования является также стандартизированная техника рентгенографической оценки периимплантатной костной ткани, которая обеспечивает возможности для анализа кости лишь с медиальной и дистальной сторон имплантата, и не позволяет объективно судить о циркулярной природе резорбции. Тем не менее, данное ограничение было отмечено и в ряде других аналогичных исследований. Кроме того, учитывая небольшую численность выборки группы исследования, результаты данного эксперимента не могут отождествляться с возможным прогнозом использования PRF для более обширного контингента пациентов.
Выводы
Учитывая полученные результаты лечения, аугментация мягких тканей с использованием PRF и техники расщепленного лоскута, не может быть рекомендована для использования в области тонкого биотипа десен, но для более аргументированных выводов требуется проведение дополнительных экспериментальных и клинических исследований, учитывающих и обходящих недостатки предложенной экспериментальной модели.
Авторы: Julia Hehn, Thomas Schwenk, Markus Striegel, Markus Schlee





























































































































































0 комментариев