Пластическая пародонтальная хирургия сегодня является важной частью стоматологической практики. Прогрессирующие рецессии компрометируют общее состояние пародонтологического статуса, и могут провоцировать развитие пульпарно-ассоциированных осложнений. Пластические пародонтальные операции, направленные на восстановление мягкотканного покрытия обнаженной области корня, представляют собой поочередность вмешательств, в ходе которых удается скорректировать имеющиеся мягкотканные деформации травматической или бактериологической этиологии. Последние чаще всего развиваются в результате действия зубного налета. Кроме того, целями мягкотканной аугментации также являются утолщение кератинизированной и прикрепленной слизистой, реставрация эстетического профиля и восстановление функции прикреплённых тканей.
В последнее десятилетие для улучшения процессов заживления мягких и твердых тканей все чаще начали использовать гемогенные производные. Плазма, обогащенная тромбоцитами, или PRP, является первым представителем данной линейки «усилителей» заживления. Но из-за того, что в плазме практически отсутствуют факторы, которые способствуют восстановлению именно твердых тканей, протокол ее корректного приготовления является довольно сложным; кроме того, сами факторы роста высвобождаются довольно быстро, из-за чего использование PRP в практике реконструкции мягких и твердых тканей челюстно-лицевой области считается непрогнозированным. В свою очередь, данные, полученные при применении PRP с целью закрытия рецессии, остаются неоднозначными. В 2013 году Choukroun представил новый продукт – производное крови, называемый расширенной версией фибрина, обогащенной тромбоцитами, или APRF. Он достаточно прост в использовании (одиночный спин без потребности применения антикоагулянтов), содержит в своей структуре костные морфогенетические протеины и обладает гораздо более улучшенными физическими свойствами, способствующими доставке факторов роста в область хирургического вмешательства. Цель данной статьи состоит в том, чтобы обсудить все преимущества и клинические возможности применения APRF при пластических пародонтальных вмешательствах, особенно в случаях закрытия рецессий мягких тканей.
Фундаментальные основы: PRF и APRF
Фибрин, обогащенный тромбоцитами (PRF), представляет собой концентрат тромбоцитов второго поколения, полученный путем однократного центрифугирования без дополнительного использования антикоагулянтов. Полученный сгусток PRF является физиологическим трехмерным матриксом, насыщенным тромбоцитами и лейкоцитами. Альфа-гранулы, секретируемые тромбоцитами и покрытые мембранами, высвобождают факторы роста по мере медленной и естественной резорбции стенок мембран (на протяжении 15 дней). К последним относятся фактор роста тромбоцитов (PDGF), трансформирующий фактор роста-b (TGF-b), фактор роста эндотелия сосудов (VEGF), эпидермальный фактор роста (EGF) и инсулиноподобный фактор роста-1 (IGF-1). Механизм получения APRF основан на том же протоколе; однако вместо пластиковых пробирок используют стеклянные для увеличения эффекта хеляции. Кроме того, для получения APRF параметры центрифугирования уменьшены с 2700 об/мин/12 минут до 13000об/мин/8 минут. Благодаря изменениям параметров спина Choukroun и коллегам удалось увеличить в структуре полученного сгустка концентрацию VEGF (ответственного за быструю неоваскуляризацию), моноцитов (ответственных за высвобождение BMP) и внеклеточного матрикса (фибронектин). Omar и Rocher определили, что моноциты являются важным источником аутогенного костного морфогенетического белка-2 (BMP-2) и костного морфогенетического белка-7 (BMP-7), что выводит APRF на первое место для использования в ходе пластических пародонтологических вмешательств.
Применение PRF / APRF в ходе вмешательств на пародонте
Исследования in vitro
Tsai и коллеги исследовали биологический эффект PRF на фибробласты десен человека, клетки пародонтальной связки, эпителиальные клетки полости рта и остеобласты. В культурах было идентифицировано факт увеличения пролиферации клеток, стимулированный действием PRF (увеличение на 20%), и снижение скорости пролиферации эпителия (из-за использования TGF-b). Исходя из этого, можно предположить, что PRF-мембраны можно эффективно использовать с целью индукции пародонтальной регенерации. Не и коллеги провели исследование по определению эффекта PRF на уровень прикрепления клеток, пролиферацию и фосфолирирование остеобластов человека. Оказалось, что PRF действительно повышает уровень прикрепления остеобластов и их пролиферацию, одновременно модифицируя продукцию коллаген-ассоциированных белков. Последние в свою очередь также способствуют регенерации костной ткани. Данные, полученные Kang и коллегами, подтверждают возможность применения PRF в качестве биокаркаса и резервуара факторов роста, необходимых для регенерации тканей. Экстракт PRF повышает уровни пролиферации, миграции и дифференциации стволовых клеток костного мозга человека. Трансплантация свежего PRF-материала в область свода черепа мышц способствовала восстановлению костного дефекта критического размера, что свидетельствует об огромном потенциале данного гомогенного производного.
В другом исследовании Chang и Zhao было показано, что активация PRF вызывает экспрессию фосфорилированной внеклеточной регулируемой сигнальной протеинкиназы (p-ERK) и остеопротегерина (OPG), которые также принимают участие в регенерации костной ткани. Huang, в свою очередь, продемонстрировал эффект PRF, связанный со стимуляцией пролиферации и дифференциации клеток пульпы путем изменений уровня экспрессии OPG и ALP. По данным совсем новых исследований, экспрессия данных маркеров может быть эффективно использована в процессе формирования условий для обеспечения успешной регенерации тканей пародонта. В ряде исследований PRF непосредственно пытались использовать в качества регенераторного материала для восстановления пародонтальных дефектов. В исследовании Chang и Zhao авторы пришли к выводу, что подобный подход является перспективным, поскольку им удалось добиться уменьшения размера имеющегося дефекта и улучшения показателей уровня пародонтального прикрепления. Sharma и Pradeep установили, что если после хирургической очистки пародонтального 3-стеночного дефекта его дополнительно еще выполнить материалом PRF, то, таким образом, удается достичь более выраженных редукции глубины дефекта, восстановления уровня клинического прикрепления и выполнения дефекта костной тканью по сравнению с результатами, которые были получены только после хирургической очистки дефекта. Аналогичные результаты были получены авторами и при хирургическом лечении фуркационных дефектов 2 степени на нижней челюсти. Необходимо отметить, что в исследовании Pradeep и коллег, авторы не выявили статистической разницы в эффекте применения PRF и PRP в ходе лечения внутрикостных дефектов у пациентов с хроническим периодонтитом по данным клинических и рентгенологических параметров.
Пластические пародонтальные вмешательства
В литературе имеется ограниченное количество данных о применение PRF в ходе пластических операций на пародонте. Aroca и коллеги сравнили результаты лечения 20 пациентов, которым проводили корональное смещение лоскута с и без дополнительного использования PRF. Через 6 месяцев мониторинга в группе дополнительного применения PRF отмечалось увеличение зоны кератинизированных десен, однако несколько меньшее процентное восстановление площади обнажения поверхности корня. Aleksic и Jankovic сравнивали эффект применения трансплантатов соединительной ткани и PRF в качестве материалов для восстановления участков рецессии 1 и 2 класса по Миллеру у 19 пациентов. После 6-месячного мониторинга никакой статистической разницы между группами относительно объема восстановления мягкотканного покрытия и ширины области кератинизации обнаружено не было. Однако зарегистрированный уровень постоперационного комфорта был значительно ниже среди пациентов, в ходе лечения которых применяли PRF, а также у них отмечался сравнительно более низкий уровень последующих осложнений. Tunali и Ozdemir провели проспективное исследование по типу split-mouth с применением PRF и соединительнотканного трансплантата у 20 пациентов с продолжительностью мониторинга в 12 месяцев. В ходе анализа обоих методов вмешательства было отмечено значительное снижение уровня рецессии (на 76% и 77% соответственно) и повышение уровня клинического прикрепления (2,90 мм и 3,04 мм соответственно).
Механизм действия
В литературе чаще всего приводятся данные сравнения PRF / APRF и соединительнотканного трансплантата, которые используются для восстановления участков рецессий. Несмотря на то, что эти два типа материалов характеризуются аналогичными физическими параметрами, механизм их действия в значительной мере отличается. Соединительнотканный трансплантат, собранный из области неба, обеспечивает реализацию процесса кератинизации в реципиентной области за счет переноса механизма генной экспрессии из донорской области. Karring описал данную концепцию на основе исследований животной модели. Таким образом, сама по себе реципиентная область не имеет влияния на параметры качества или количества полученной ткани в конечном счете. Данный механизм именуется фиброгенезом. APRF же работает по-иному. Фибрин должен рассматриваться в качестве биологической матрицы, в то время как APRF за счет повышенного количества факторов роста способствует индукции формирования новой ткани из границ реципиентного участка. Исходя из этого, можно предположить, что исходное качество тканей в реципиентной области непосредственно влияет на успешность хирургической манипуляции по закрытию рецессий. Если у пациента в реципиентном участке отмечается наличие кератинизированных тканей, то в результате применения APRF мы тоже получим кератинизированную ткань. Если же в реципиентной области имеется лишь рыхлая слизистая, то, несмотря на применение APRF, в конечному счете, мы тоже получим прирост лишь рыхлой слизистой. Этот механизм именуется фибропромоцией. Для развития фибропромоции необходимо два фактора: биологическая напряженная целостность и объем. Эти факторы, по сути, являются критическими и при применении любых других биологических модификаторов регенерации.
Биологическая напряженная целостность
Ingber, врач из Гарвардской школы медицины, продемонстрировал, что положительные или отрицательные силы (напряжение и давление), генерируемые на поверхности клетки, передаются через комплекс актомиозиновых нитей через цитоскелет к структуре ядра. Следовательно, существует баланс между внеклеточными силами и внутриклеточной средой, если прилагаемые внешние силы находятся в пределах допустимого диапазона. Принцип биологической напряженной целостности помогает направлять передачу силы и управлять многомолекулярной реакцией на стресс во всех системах органов человека. Если же механические внешние силы, приложенные к поверхности клетки (механорецепторы клеточной поверхности), выходят за рамки допустимой внутриклеточной толерантности, происходит изменение структуры цитоскелета и параметров внутриклеточной биохимии. Все это, соответственно, изменяет и экспрессию генов по сравнению с ее исходными уровнями. Одно из клинических приложений этой концепции состоит в учете принципа биологической напряженной целостности при натяжении лоскута и формировании условий для неоангиогенеза.
Mammoto на исследовательской модели мыши продемонстрировал, что растяжение слизистой оболочки снижает количество продуцируемого VEGF, и, таким образом, наблюдается уменьшение объема сосудистой части лоскута. Pini Prato подтвердили данную гипотезу, проведя рандомизированное контролируемое клиническое исследование для измерения натяжения коронально-смещенного лоскута перед наложением швов и сравнения уменьшения объема рецессии после натяжения лоскута и без такового. Статистический анализ показал, что минимальное натяжение лоскута (от 0,0 г до 0,4 г) способствовало уменьшению рецессии, в то время как более высокое натяжение лоскута (от 4 г до 7 г) было связано с менее эффективным результатом лечения. Marx, в свою очередь, ассоциировал успех вертикальной костной аугментации с пассивным ненапряженным смещением лоскута для сохранения целостности костного состава, окружающего трансплантат.
Объем
Для индукции надлежащей фибропромоции необходимо надлежащее количество тромбоцитов, которые обеспечивают релизинг достаточного количества факторов роста. Последние интегрируются в плотно организованную фибриновую сетку и высвобождаются постепенно на протяжении последующих 12-15 дней (длительной резорбции APRF мембраны). Gahnaati в ходе количественного гистоморфометрического анализа клеточного проникновения определил, что до 68% APRF колонизируется факторами роста, полученными из тромбоцитов. Исходя из этого, автор предложил использовать до 3-4 мембран на пару зубов, нуждающихся в закрытии рецессии, в целях промоции адекватной фибропромоции (фото 2-4).
Фото 1. Пробирка с APRF-сгустком: медленный и короткий спин способствует накоплению большего количества клеток в структуре фибринового сгустка.
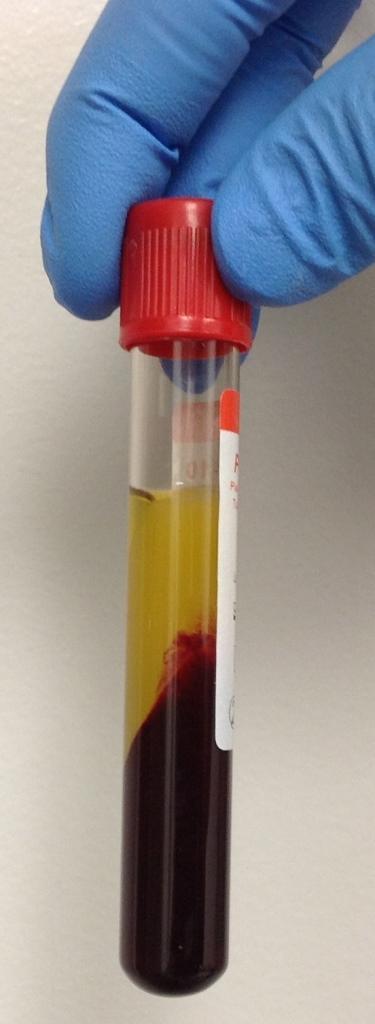
Фото 2. Вид APRF-сгустков перед прессованием. Прессование позволяет сформировать гомогенные мембраны для клинического применения.

Фото 3. Вид APRF-мембран.
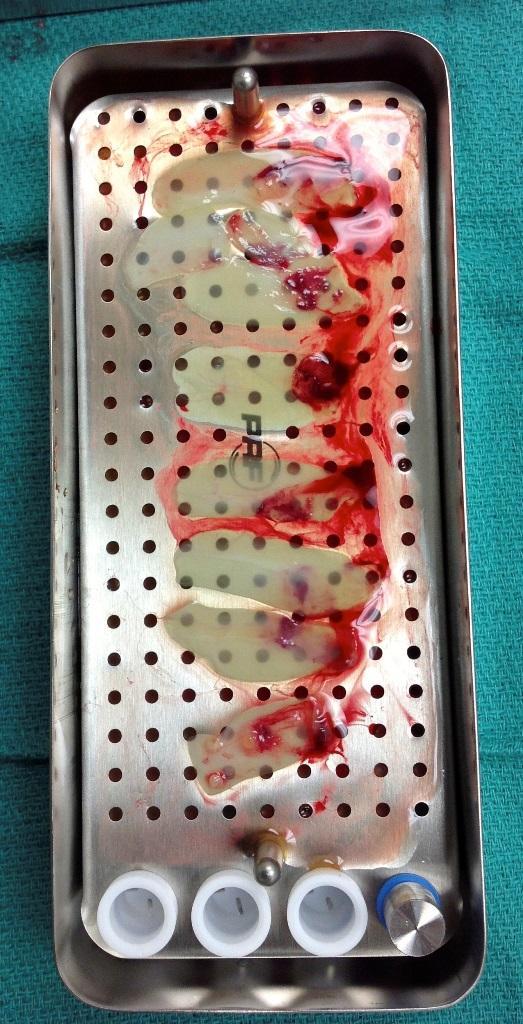
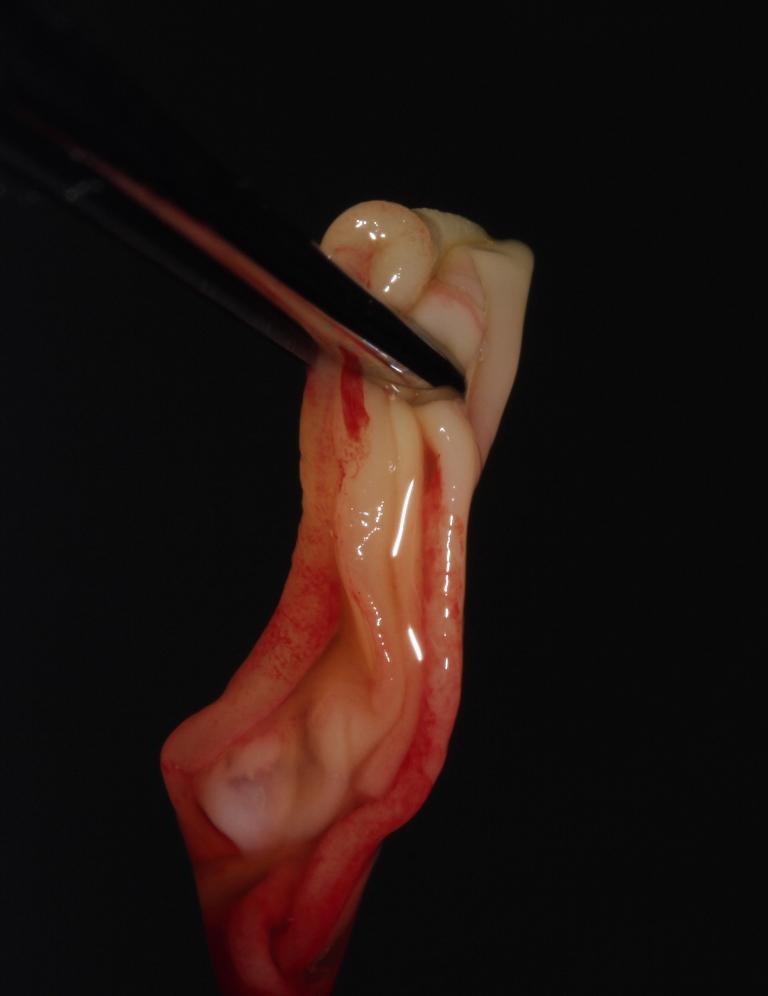
Фото 4. Вид приготовленной APRF-мембраны, которую можно устанавливать под лоскут. Для обеспечения надлежащего объёма и количества клеток на пару зубов необходимо в среднем от 3 до 4 APRF-мембран.
Клиническое применение
Предлагаемая хирургическая техника вмешательства представляет собой упрощенный метод формирования поднадкостничного доступа с проведением вестибулярного разреза и усовершенствованной туннельной техники.
Разрез
Вертикальный разрез слизистой оболочки позволяет провести горизонтальную (мезиодистальную) и апикокорональную сепарацию лоскута на всю толщину тканей, обеспечивая, таким образом, возможности пассивного коронального смещения слизисто-десневого комплекса (фото 5-6).
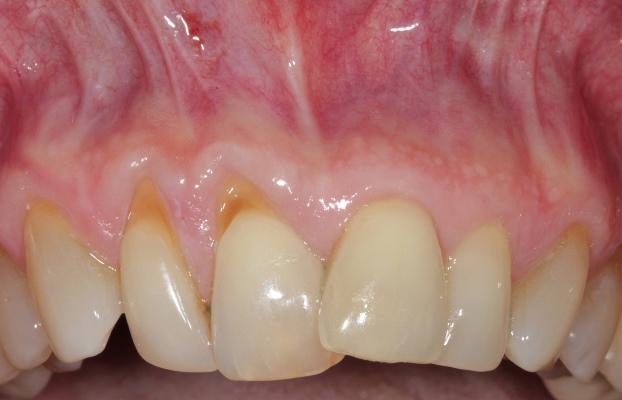
Фото 5. Вид до лечения. Рецессии 2 класса по Миллеру, спровоцированные действием факторов травмы и неправильного положения зубов.
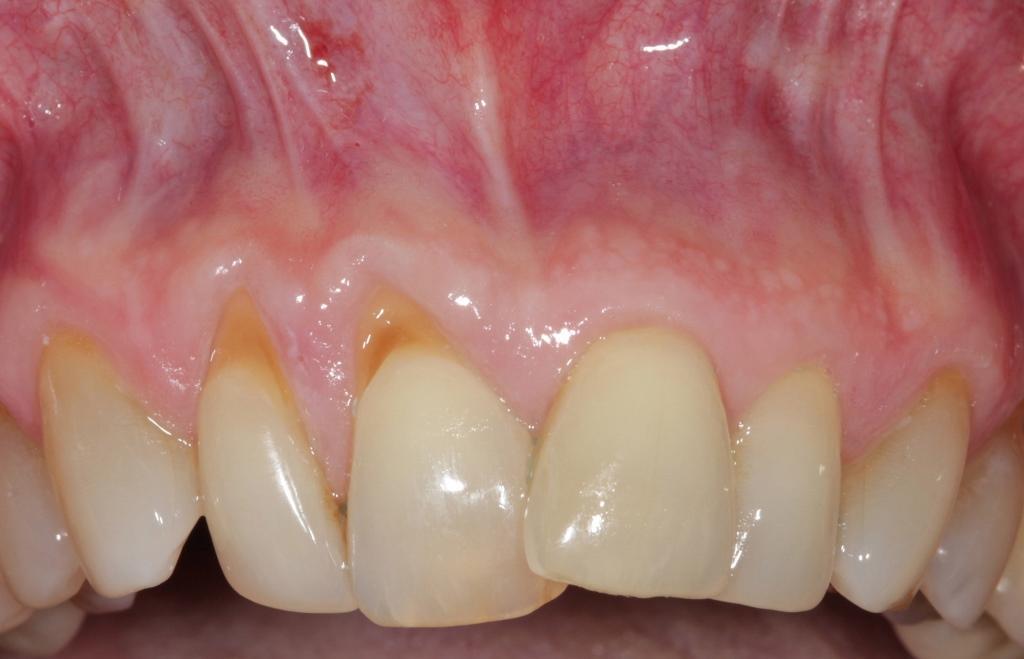
Фото 6. Разрез и послабление лоскута. Техника вестибулярного субпериостального разреза позволяет обеспечить полнотканную горизонтальную диссекцию слизистой и низлежащих структур. Послабление лоскута позволяет избежать формирования излишнего давления и натяжения после упаковки APRF-мембран, а также способствует достижению надлежащей корональной позиции лоскута постоперационно.
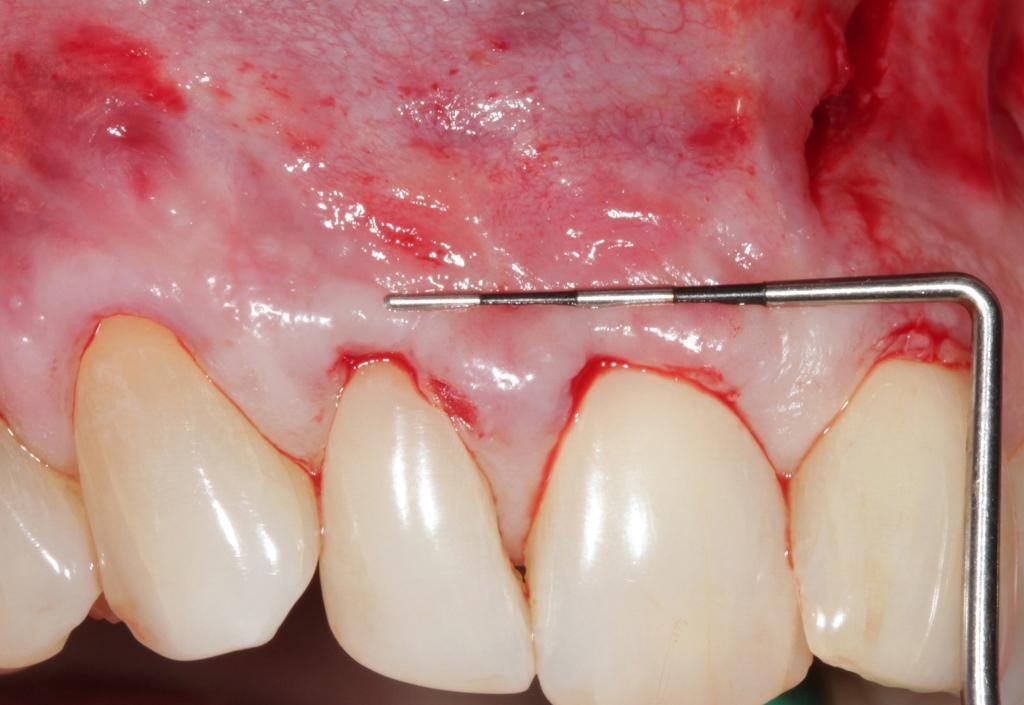
Подготовка корня и деконтаминация его поверхности
Ниже приведены принципы, которые предварительно уже были описаны в качестве рекомендованных при проведении пластических операций на пародонте. Сначала формируют плоскую поверхность корня в области вмешательства для увеличения объема под APRF и снижения натяжения лоскута. Кроме того, плоская поверхность корня замедляет процесс резорбции APRF мембраны за счет принципа биологической напряженной целостности. Деконтаминацию корня проводят 17% этилендиаминтетрауксусной кислотой (ЭДТА) (двойное нанесение в течение 2,5 минут), что позволяет удалить смазанный слой и обеспечивает обнажение коллагеновых волокон в канальцах. Все это способствует улучшению будущего клинического прикрепления.
Объемная упаковка
Для достижения желаемого эффекта необходимо использовать минимум 3–4 APRF-мембраны на пару зубов. Концепция упаковки мембран предполагает их установку от дистального конца к мезиальному, обеспечивая при распределении однородную плотность материала (фото 7). В результате плотной упаковки мембран лоскут физиологически смещается в коронковом направлении без чрезмерного напряжения или растяжения. Данная концепция отсутствия напряжения является ядром клинического применения принципа биологической напряженной целостности.
Фото 7. Упаковка APRF-мембран. На каждую пару зубов упаковывают от 3 до 4 мембран.
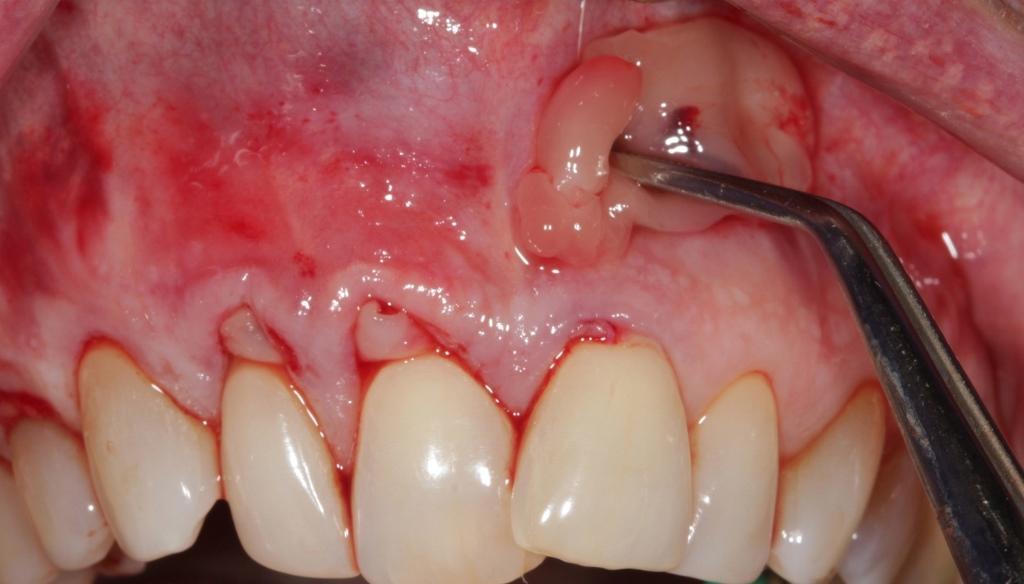
Наложение швов
Ушивание проводят надкостничными матрацными швами, спозиционированными апикально. При ушивании важно избежать натяжения в проекции APRF-мембран, добиться стабилизации их положения в проекции поверхности корня, и избежать смещения в область слизистой оболочки (фото 8). Восстановление мягкотканного покрытия корня связано с увеличением зоны кератинизированных тканей (фото 9-11) и влиянием ряда факторов. Крайне важно, чтобы врач понимал все аспекты механизма действия и биологической природы APRF. Кроме того, корректное выполнение всех этапов хирургического вмешательства также является составляющей залога успеха. Ведь врачу следует одновременно избежать чрезмерного натяжения лоскута, обеспечить плотную упаковку мембран и при этом спозиционировать их положение точно на обнаженной поверхности корня.
Фото 8. Периостальные швы ниже уровня слизисто-десневой границы позволяют сместить лоскут более коронально. Непосредственная близость APRF-мембран к пародонтальной связке способствует медленному высвобождению факторов роста с дальнейшей индукцией процесса кератинизации.
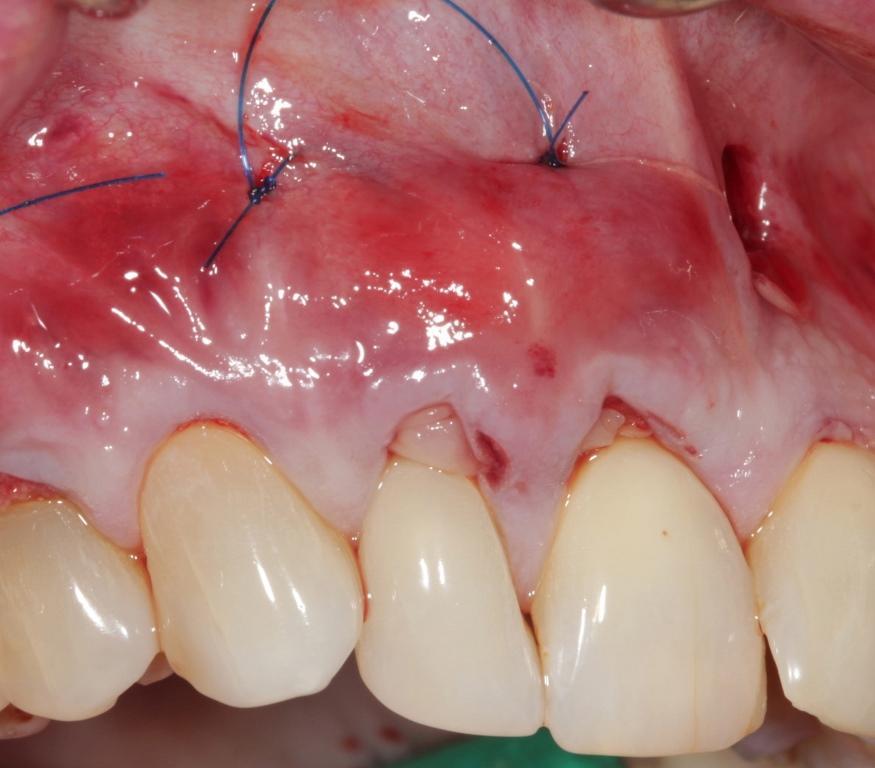
Фото 9. Вид через 2 года после лечения. Полное восстановление мягкотканного покрытия области корня и увеличение зоны прикрепленных и кератинизированных мягких тканей.
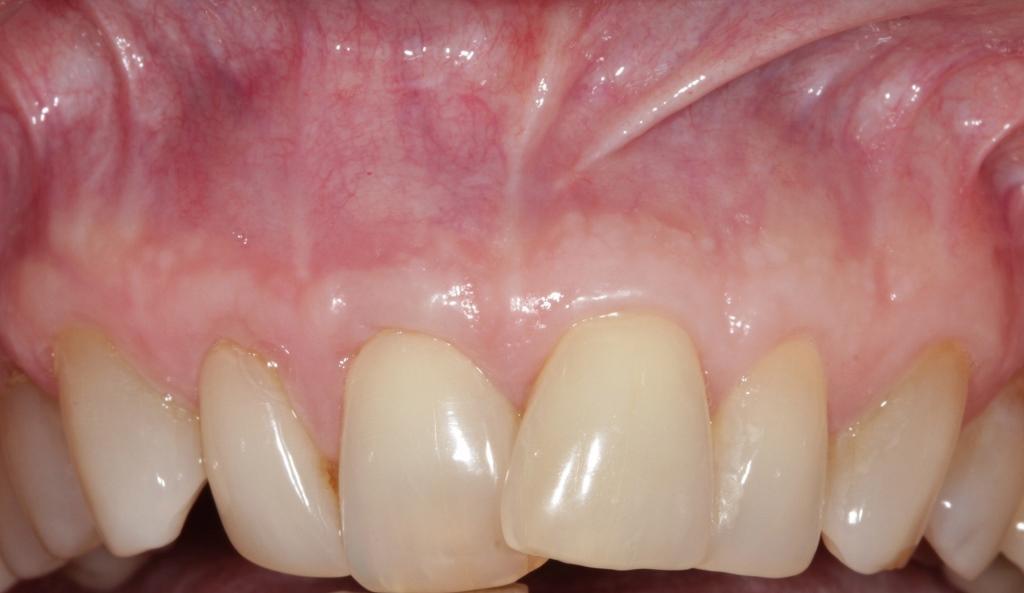
Фото 10. Вид до лечения: дефицит мягкотканного покрытия поверхности корней.
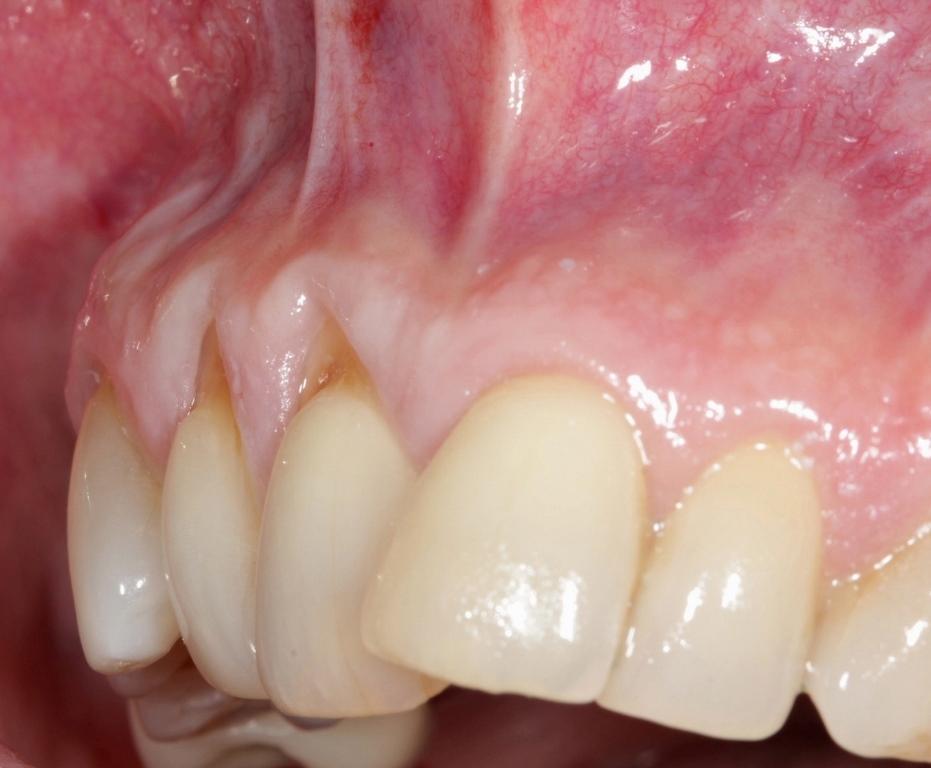
Фото 11. Вид после лечения: восстановления мягкотканного покрытия поверхности корней, трехмерное увеличение зоны кератинизированных и прикреплённых десен, коррекция деформаций ширины и высоты мягких тканей.
Выводы
Концепция фибрин-ассоциированного увеличения объема мягких тканей с целью восстановления мягкотканного покрытия поверхности при помощи APRF является прорывом в пародонтальной практике. Основы реализации данной концепции предусматривают необходимость понимания механизмов лечения и заживления ран в общемедицинской практике. Предложенная инновационная клиническая модель, конечно же, требует проведения дополнительных клинических и гистологических исследований для подтверждения успешности ее практического применения, поскольку на данный момент результаты эффективности ее использования подтверждаются лишь данными, полученными в ходе 2-годичного мониторинга.
Авторы:
Alexandre-Amir Aalam, DDS
Alina Krivitky Aalam, DDS
Joseph Choukroun, MD
Пластическая пародонтальная хирургия сегодня является важной частью стоматологической практики. Прогрессирующие рецессии компрометируют общее состояние пародонтологического статуса, и могут провоцировать развитие пульпарно-ассоциированных осложнений. Пластические пародонтальные операции, направленные на восстановление мягкотканного покрытия обнаженной области корня, представляют собой поочередность вмешательств, в ходе которых удается скорректировать имеющиеся мягкотканные деформации травматической или бактериологической этиологии. Последние чаще всего развиваются в результате действия зубного налета. Кроме того, целями мягкотканной аугментации также являются утолщение кератинизированной и прикрепленной слизистой, реставрация эстетического профиля и восстановление функции прикреплённых тканей.

В последнее десятилетие для улучшения процессов заживления мягких и твердых тканей все чаще начали использовать гемогенные производные. Плазма, обогащенная тромбоцитами, или PRP, является первым представителем данной линейки «усилителей» заживления. Но из-за того, что в плазме практически отсутствуют факторы, которые способствуют восстановлению именно твердых тканей, протокол ее корректного приготовления является довольно сложным; кроме того, сами факторы роста высвобождаются довольно быстро, из-за чего использование PRP в практике реконструкции мягких и твердых тканей челюстно-лицевой области считается непрогнозированным. В свою очередь, данные, полученные при применении PRP с целью закрытия рецессии, остаются неоднозначными. В 2013 году Choukroun представил новый продукт – производное крови, называемый расширенной версией фибрина, обогащенной тромбоцитами, или APRF. Он достаточно прост в использовании (одиночный спин без потребности применения антикоагулянтов), содержит в своей структуре костные морфогенетические протеины и обладает гораздо более улучшенными физическими свойствами, способствующими доставке факторов роста в область хирургического вмешательства. Цель данной статьи состоит в том, чтобы обсудить все преимущества и клинические возможности применения APRF при пластических пародонтальных вмешательствах, особенно в случаях закрытия рецессий мягких тканей.
Фундаментальные основы: PRF и APRF
Фибрин, обогащенный тромбоцитами (PRF), представляет собой концентрат тромбоцитов второго поколения, полученный путем однократного центрифугирования без дополнительного использования антикоагулянтов. Полученный сгусток PRF является физиологическим трехмерным матриксом, насыщенным тромбоцитами и лейкоцитами. Альфа-гранулы, секретируемые тромбоцитами и покрытые мембранами, высвобождают факторы роста по мере медленной и естественной резорбции стенок мембран (на протяжении 15 дней). К последним относятся фактор роста тромбоцитов (PDGF), трансформирующий фактор роста-b (TGF-b), фактор роста эндотелия сосудов (VEGF), эпидермальный фактор роста (EGF) и инсулиноподобный фактор роста-1 (IGF-1). Механизм получения APRF основан на том же протоколе; однако вместо пластиковых пробирок используют стеклянные для увеличения эффекта хеляции. Кроме того, для получения APRF параметры центрифугирования уменьшены с 2700 об/мин/12 минут до 13000об/мин/8 минут. Благодаря изменениям параметров спина Choukroun и коллегам удалось увеличить в структуре полученного сгустка концентрацию VEGF (ответственного за быструю неоваскуляризацию), моноцитов (ответственных за высвобождение BMP) и внеклеточного матрикса (фибронектин). Omar и Rocher определили, что моноциты являются важным источником аутогенного костного морфогенетического белка-2 (BMP-2) и костного морфогенетического белка-7 (BMP-7), что выводит APRF на первое место для использования в ходе пластических пародонтологических вмешательств.
Применение PRF / APRF в ходе вмешательств на пародонте
Исследования in vitro
Tsai и коллеги исследовали биологический эффект PRF на фибробласты десен человека, клетки пародонтальной связки, эпителиальные клетки полости рта и остеобласты. В культурах было идентифицировано факт увеличения пролиферации клеток, стимулированный действием PRF (увеличение на 20%), и снижение скорости пролиферации эпителия (из-за использования TGF-b). Исходя из этого, можно предположить, что PRF-мембраны можно эффективно использовать с целью индукции пародонтальной регенерации. Не и коллеги провели исследование по определению эффекта PRF на уровень прикрепления клеток, пролиферацию и фосфолирирование остеобластов человека. Оказалось, что PRF действительно повышает уровень прикрепления остеобластов и их пролиферацию, одновременно модифицируя продукцию коллаген-ассоциированных белков. Последние в свою очередь также способствуют регенерации костной ткани. Данные, полученные Kang и коллегами, подтверждают возможность применения PRF в качестве биокаркаса и резервуара факторов роста, необходимых для регенерации тканей. Экстракт PRF повышает уровни пролиферации, миграции и дифференциации стволовых клеток костного мозга человека. Трансплантация свежего PRF-материала в область свода черепа мышц способствовала восстановлению костного дефекта критического размера, что свидетельствует об огромном потенциале данного гомогенного производного.
В другом исследовании Chang и Zhao было показано, что активация PRF вызывает экспрессию фосфорилированной внеклеточной регулируемой сигнальной протеинкиназы (p-ERK) и остеопротегерина (OPG), которые также принимают участие в регенерации костной ткани. Huang, в свою очередь, продемонстрировал эффект PRF, связанный со стимуляцией пролиферации и дифференциации клеток пульпы путем изменений уровня экспрессии OPG и ALP. По данным совсем новых исследований, экспрессия данных маркеров может быть эффективно использована в процессе формирования условий для обеспечения успешной регенерации тканей пародонта. В ряде исследований PRF непосредственно пытались использовать в качества регенераторного материала для восстановления пародонтальных дефектов. В исследовании Chang и Zhao авторы пришли к выводу, что подобный подход является перспективным, поскольку им удалось добиться уменьшения размера имеющегося дефекта и улучшения показателей уровня пародонтального прикрепления. Sharma и Pradeep установили, что если после хирургической очистки пародонтального 3-стеночного дефекта его дополнительно еще выполнить материалом PRF, то, таким образом, удается достичь более выраженных редукции глубины дефекта, восстановления уровня клинического прикрепления и выполнения дефекта костной тканью по сравнению с результатами, которые были получены только после хирургической очистки дефекта. Аналогичные результаты были получены авторами и при хирургическом лечении фуркационных дефектов 2 степени на нижней челюсти. Необходимо отметить, что в исследовании Pradeep и коллег, авторы не выявили статистической разницы в эффекте применения PRF и PRP в ходе лечения внутрикостных дефектов у пациентов с хроническим периодонтитом по данным клинических и рентгенологических параметров.
Пластические пародонтальные вмешательства
В литературе имеется ограниченное количество данных о применение PRF в ходе пластических операций на пародонте. Aroca и коллеги сравнили результаты лечения 20 пациентов, которым проводили корональное смещение лоскута с и без дополнительного использования PRF. Через 6 месяцев мониторинга в группе дополнительного применения PRF отмечалось увеличение зоны кератинизированных десен, однако несколько меньшее процентное восстановление площади обнажения поверхности корня. Aleksic и Jankovic сравнивали эффект применения трансплантатов соединительной ткани и PRF в качестве материалов для восстановления участков рецессии 1 и 2 класса по Миллеру у 19 пациентов. После 6-месячного мониторинга никакой статистической разницы между группами относительно объема восстановления мягкотканного покрытия и ширины области кератинизации обнаружено не было. Однако зарегистрированный уровень постоперационного комфорта был значительно ниже среди пациентов, в ходе лечения которых применяли PRF, а также у них отмечался сравнительно более низкий уровень последующих осложнений. Tunali и Ozdemir провели проспективное исследование по типу split-mouth с применением PRF и соединительнотканного трансплантата у 20 пациентов с продолжительностью мониторинга в 12 месяцев. В ходе анализа обоих методов вмешательства было отмечено значительное снижение уровня рецессии (на 76% и 77% соответственно) и повышение уровня клинического прикрепления (2,90 мм и 3,04 мм соответственно).
Механизм действия
В литературе чаще всего приводятся данные сравнения PRF / APRF и соединительнотканного трансплантата, которые используются для восстановления участков рецессий. Несмотря на то, что эти два типа материалов характеризуются аналогичными физическими параметрами, механизм их действия в значительной мере отличается. Соединительнотканный трансплантат, собранный из области неба, обеспечивает реализацию процесса кератинизации в реципиентной области за счет переноса механизма генной экспрессии из донорской области. Karring описал данную концепцию на основе исследований животной модели. Таким образом, сама по себе реципиентная область не имеет влияния на параметры качества или количества полученной ткани в конечном счете. Данный механизм именуется фиброгенезом. APRF же работает по-иному. Фибрин должен рассматриваться в качестве биологической матрицы, в то время как APRF за счет повышенного количества факторов роста способствует индукции формирования новой ткани из границ реципиентного участка. Исходя из этого, можно предположить, что исходное качество тканей в реципиентной области непосредственно влияет на успешность хирургической манипуляции по закрытию рецессий. Если у пациента в реципиентном участке отмечается наличие кератинизированных тканей, то в результате применения APRF мы тоже получим кератинизированную ткань. Если же в реципиентной области имеется лишь рыхлая слизистая, то, несмотря на применение APRF, в конечному счете, мы тоже получим прирост лишь рыхлой слизистой. Этот механизм именуется фибропромоцией. Для развития фибропромоции необходимо два фактора: биологическая напряженная целостность и объем. Эти факторы, по сути, являются критическими и при применении любых других биологических модификаторов регенерации.
Биологическая напряженная целостность
Ingber, врач из Гарвардской школы медицины, продемонстрировал, что положительные или отрицательные силы (напряжение и давление), генерируемые на поверхности клетки, передаются через комплекс актомиозиновых нитей через цитоскелет к структуре ядра. Следовательно, существует баланс между внеклеточными силами и внутриклеточной средой, если прилагаемые внешние силы находятся в пределах допустимого диапазона. Принцип биологической напряженной целостности помогает направлять передачу силы и управлять многомолекулярной реакцией на стресс во всех системах органов человека. Если же механические внешние силы, приложенные к поверхности клетки (механорецепторы клеточной поверхности), выходят за рамки допустимой внутриклеточной толерантности, происходит изменение структуры цитоскелета и параметров внутриклеточной биохимии. Все это, соответственно, изменяет и экспрессию генов по сравнению с ее исходными уровнями. Одно из клинических приложений этой концепции состоит в учете принципа биологической напряженной целостности при натяжении лоскута и формировании условий для неоангиогенеза.
Mammoto на исследовательской модели мыши продемонстрировал, что растяжение слизистой оболочки снижает количество продуцируемого VEGF, и, таким образом, наблюдается уменьшение объема сосудистой части лоскута. Pini Prato подтвердили данную гипотезу, проведя рандомизированное контролируемое клиническое исследование для измерения натяжения коронально-смещенного лоскута перед наложением швов и сравнения уменьшения объема рецессии после натяжения лоскута и без такового. Статистический анализ показал, что минимальное натяжение лоскута (от 0,0 г до 0,4 г) способствовало уменьшению рецессии, в то время как более высокое натяжение лоскута (от 4 г до 7 г) было связано с менее эффективным результатом лечения. Marx, в свою очередь, ассоциировал успех вертикальной костной аугментации с пассивным ненапряженным смещением лоскута для сохранения целостности костного состава, окружающего трансплантат.
Объем
Для индукции надлежащей фибропромоции необходимо надлежащее количество тромбоцитов, которые обеспечивают релизинг достаточного количества факторов роста. Последние интегрируются в плотно организованную фибриновую сетку и высвобождаются постепенно на протяжении последующих 12-15 дней (длительной резорбции APRF мембраны). Gahnaati в ходе количественного гистоморфометрического анализа клеточного проникновения определил, что до 68% APRF колонизируется факторами роста, полученными из тромбоцитов. Исходя из этого, автор предложил использовать до 3-4 мембран на пару зубов, нуждающихся в закрытии рецессии, в целях промоции адекватной фибропромоции (фото 2-4).
Фото 1. Пробирка с APRF-сгустком: медленный и короткий спин способствует накоплению большего количества клеток в структуре фибринового сгустка.

Фото 2. Вид APRF-сгустков перед прессованием. Прессование позволяет сформировать гомогенные мембраны для клинического применения.

Фото 3. Вид APRF-мембран.

Фото 4. Вид приготовленной APRF-мембраны, которую можно устанавливать под лоскут. Для обеспечения надлежащего объёма и количества клеток на пару зубов необходимо в среднем от 3 до 4 APRF-мембран.

Клиническое применение
Предлагаемая хирургическая техника вмешательства представляет собой упрощенный метод формирования поднадкостничного доступа с проведением вестибулярного разреза и усовершенствованной туннельной техники.
Разрез
Вертикальный разрез слизистой оболочки позволяет провести горизонтальную (мезиодистальную) и апикокорональную сепарацию лоскута на всю толщину тканей, обеспечивая, таким образом, возможности пассивного коронального смещения слизисто-десневого комплекса (фото 5-6).
Фото 5. Вид до лечения. Рецессии 2 класса по Миллеру, спровоцированные действием факторов травмы и неправильного положения зубов.

Фото 6. Разрез и послабление лоскута. Техника вестибулярного субпериостального разреза позволяет обеспечить полнотканную горизонтальную диссекцию слизистой и низлежащих структур. Послабление лоскута позволяет избежать формирования излишнего давления и натяжения после упаковки APRF-мембран, а также способствует достижению надлежащей корональной позиции лоскута постоперационно.

Подготовка корня и деконтаминация его поверхности
Ниже приведены принципы, которые предварительно уже были описаны в качестве рекомендованных при проведении пластических операций на пародонте. Сначала формируют плоскую поверхность корня в области вмешательства для увеличения объема под APRF и снижения натяжения лоскута. Кроме того, плоская поверхность корня замедляет процесс резорбции APRF мембраны за счет принципа биологической напряженной целостности. Деконтаминацию корня проводят 17% этилендиаминтетрауксусной кислотой (ЭДТА) (двойное нанесение в течение 2,5 минут), что позволяет удалить смазанный слой и обеспечивает обнажение коллагеновых волокон в канальцах. Все это способствует улучшению будущего клинического прикрепления.
Объемная упаковка
Для достижения желаемого эффекта необходимо использовать минимум 3–4 APRF-мембраны на пару зубов. Концепция упаковки мембран предполагает их установку от дистального конца к мезиальному, обеспечивая при распределении однородную плотность материала (фото 7). В результате плотной упаковки мембран лоскут физиологически смещается в коронковом направлении без чрезмерного напряжения или растяжения. Данная концепция отсутствия напряжения является ядром клинического применения принципа биологической напряженной целостности.
Фото 7. Упаковка APRF-мембран. На каждую пару зубов упаковывают от 3 до 4 мембран.

Наложение швов
Ушивание проводят надкостничными матрацными швами, спозиционированными апикально. При ушивании важно избежать натяжения в проекции APRF-мембран, добиться стабилизации их положения в проекции поверхности корня, и избежать смещения в область слизистой оболочки (фото 8). Восстановление мягкотканного покрытия корня связано с увеличением зоны кератинизированных тканей (фото 9-11) и влиянием ряда факторов. Крайне важно, чтобы врач понимал все аспекты механизма действия и биологической природы APRF. Кроме того, корректное выполнение всех этапов хирургического вмешательства также является составляющей залога успеха. Ведь врачу следует одновременно избежать чрезмерного натяжения лоскута, обеспечить плотную упаковку мембран и при этом спозиционировать их положение точно на обнаженной поверхности корня.
Фото 8. Периостальные швы ниже уровня слизисто-десневой границы позволяют сместить лоскут более коронально. Непосредственная близость APRF-мембран к пародонтальной связке способствует медленному высвобождению факторов роста с дальнейшей индукцией процесса кератинизации.

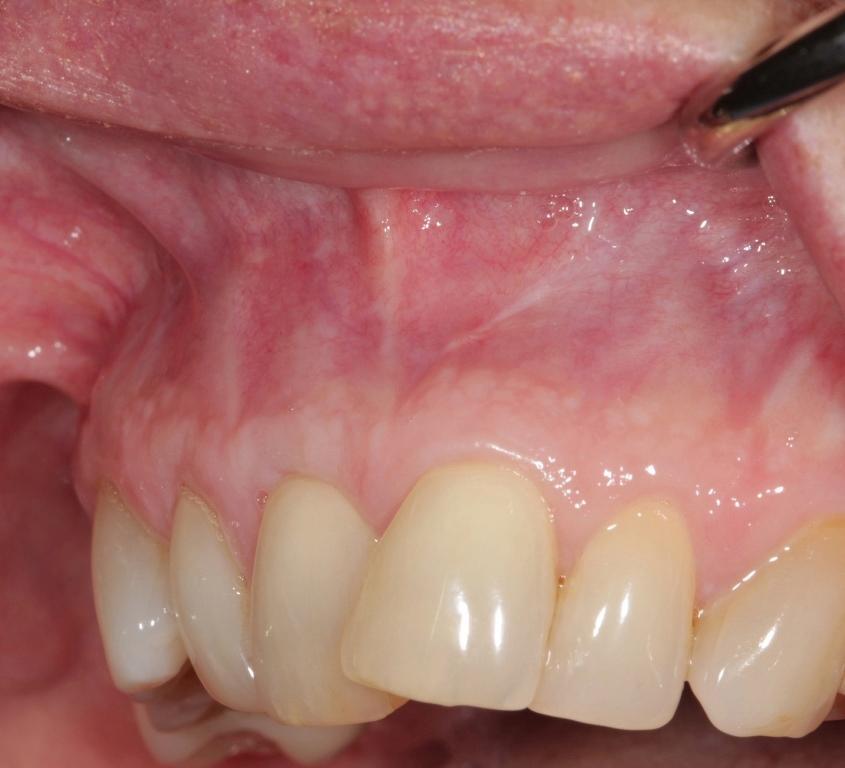
Фото 9. Вид через 2 года после лечения. Полное восстановление мягкотканного покрытия области корня и увеличение зоны прикрепленных и кератинизированных мягких тканей.

Фото 10. Вид до лечения: дефицит мягкотканного покрытия поверхности корней.

Фото 11. Вид после лечения: восстановления мягкотканного покрытия поверхности корней, трехмерное увеличение зоны кератинизированных и прикреплённых десен, коррекция деформаций ширины и высоты мягких тканей.

Выводы
Концепция фибрин-ассоциированного увеличения объема мягких тканей с целью восстановления мягкотканного покрытия поверхности при помощи APRF является прорывом в пародонтальной практике. Основы реализации данной концепции предусматривают необходимость понимания механизмов лечения и заживления ран в общемедицинской практике. Предложенная инновационная клиническая модель, конечно же, требует проведения дополнительных клинических и гистологических исследований для подтверждения успешности ее практического применения, поскольку на данный момент результаты эффективности ее использования подтверждаются лишь данными, полученными в ходе 2-годичного мониторинга.
Авторы:
Alexandre-Amir Aalam, DDS
Alina Krivitky Aalam, DDS
Joseph Choukroun, MD
































































































































































0 комментариев